-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Asymptomatická penetrace žaludečního vředu do slinivky břišní manifestující se jako tumor
Tumor mimicking gastric ulcer penetrating asymptomatically into the pancreas
Gastroduodenal ulcer disease is characterized by ulceration of the stomach or duodenum, with ulcer lesions occurring more frequently in the duodenum. Serious complications of this disease include bleeding, perforation of the ulcer and penetration into surrounding organ. Our report presents the case of an older man who had a gastric ulcer penetrating into the pancreas. This was not diagnosed at the time of the penetration. The patient came to our care for recurrent hematemesis without a proven source of bleeding. During the diagnostic process, the presence of an intramural gastric tumor was suspected. An excision of the suspected lesion was successfully performed at our clinic, followed by histological confirmation of perforated ulcer. The postoperative course was complicated by the development of a pancreatic fistula. However, conservative treatment resulted in complete recovery of the patient.
Keywords:
pancreatic fistula – penetrating peptic ulcer – gastric tumor
Autoři: P. Macan; J. Geiger; J. Rosendorf; V. Třeška
Působiště autorů: Chirurgická klinika, Fakultní nemocnice Plzeň a lékařská fakulta Univerzity Karlovy v Plzni
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 12, s. 612-615.
Kategorie: Kazuistika
doi: https://doi.org/10.33699/PIS.2021.100.12.612–615Souhrn
Gastroduodenální vředová choroba je charakterizována vředovým postižením žaludku či dvanáctníku, přičemž častěji dochází k výskytu vředových lézí v oblasti duodena. Mezi závažné komplikace tohoto onemocnění patří krvácení, perforace vředu či penetrace do okolního orgánu. Naše kazuistika prezentuje případ staršího muže, u něhož došlo k penetraci žaludečního vředu do slinivky břišní. Ta nebyla diagnostikována a pacient se do péče našeho pracoviště dostal pro recidivující hematemézu bez prokázaného zdroje krvácení. V průběhu diagnostického procesu bylo vysloveno podezření na přítomnost intramurálně uloženého tumoru žaludku. Na naší klinice byla úspěšně provedena excize suspektní léze s následným histologickým potvrzením diagnózy penetrujícího vředu. Pooperační průběh byl komplikován rozvojem pankreatické píštěle, avšak konzervativním postupem bylo dosaženo úplného zotavení pacienta.
Klíčová slova:
penetrující peptický vřed − pankreatická píštěl – tumor žaludku
ÚVOD
Gastroduodenální vředová choroba je charakterizována vředovým postižením žaludku či dvanáctníku. I v současné době stále patří mezi nejčastější onemocnění gastrointestinálního traktu. Obvykle dochází k postižení žaludku a proximální části duodena [1]. Podstatou vzniku peptického vředu je narušení rovnováhy mezi ochrannými mechanismy (vrstva mucinu, prostaglandiny, buněčná regenerace, prokrvení) a agresivními faktory (chlorovodíková kyselina, pepsin, žlučové kyseliny, některé léky atd.) [2,3]. V moderní společnosti lze pozorovat mnoho predisponujících faktorů. Hlavními dvěma jsou bakteriální infekce způsobené Helicobacterem pylori a nadměrné užívání nesteroidních protizánětlivých léků [1,4,5]. Dále mají velký vliv na vznik peptického vředu konzumace alkoholu, kouření, stres, nepravidelná strava a další [1,4]. Vzácnějšími příčinami jsou pak Zollinger-Ellisonův syndrom či Crohnova choroba [4,6,7]. Klinické projevy peptického vředu žaludku zahrnují bolesti v oblasti epigastria, které se objevují nebo zhoršují časně po jídle [8,9]. U duodenálního vředu bývá popisována bolest nalačno, několik hodin po jídle nebo v noci. Úleva může následovat po jídle, zvracení či užití antacid [8,9]. Pro potvrzení diagnózy vředové léze hraje dominantní roli ezofagogastroduodenoskopie (EGDS) [10]. V případě perforace vředu ale může být výtěžný i prostý rentgenový snímek břicha vestoje, který zobrazí pneumoperitoneum. Pokud tomu tak není, nebo není možná vertikalizace pacienta a podezření na perforaci trvá, je možné při její dostupnosti využít výpočetní tomografii (CT) [10,11]. V léčbě nekomplikovaného peptického vředu je snaha o maximálně konzervativní postup zahrnující eradikaci H. pylori, neužívání nesteroidních protizánětlivých léků a medikamentózní léčbu. Zde se využívají inhibitory protonové pumpy (omeprazol, pantoprazol) či blokátory H2 receptorů (ranitidin, famotidin) [12]. Díky jejich zařazení do terapie došlo v druhé polovině dvacátého století k poklesu elektivních chirurgických výkonů v případě gastroduodenální vředové choroby [13,14]. Nicméně asi 25 % pacientů má závažné komplikace jako krvácení, perforace vředu či penetrace do jiného orgánu [1]. V těchto případech zaujímá dominantní postavení invazivní terapie v čele s endoskopickými výkony [15].
KAZUISTIKA
55letý muž, kuřák, ethylik v minulosti léčen pro epilepsii na podkladě ethylické encefalopatie, byl vyšetřován pro opakované zvracení krve, s poklesem hemoglobinu (Hb) na 96 g/l. Provedená EGDS neodhalila žádný aktivní zdroj krvácení. Jediným nálezem byla ezofagitida s ojedinělými erozemi. Protože pacient odmítal další péči, nebyla provedena podrobnější diagnostika a muž byl propuštěn s doporučením abstinence alkoholu a užívání antiulcerózní medikace. Pátý den od propuštění byl opět ošetřen na akutní ambulanci a následně hospitalizován na interním oddělení pro hematemézu a bolesti břicha. Vstupním laboratorním nálezem byl pokles Hb na 72 g/l, α-amyláza (AMS) 4,56 μkat/l a elevace zánětlivých parametrů (C-reaktivního proteinu (CRP) 20,9 mg/l a leukocytózy 13,7x109/l). Fyzikální vyšetření odhalilo jen mírnou palpační citlivost ve středním epigastriu. EGDS neodhalila zdroj krvácení. Bylo doplněno CT vyšetření, které zobrazilo lézi v zadní stěně žaludku velikosti 45 mm, imponující jako hematom a okolní lymfadenopatii (Obr. 1). S ohledem na informaci, že pacient zhubl za poslední 3 měsíce 30 kg, byla k bližšímu posouzení povahy léze provedena endosonografie. Na zadní stěně žaludku v místě diskrétní subslizniční prominence zobrazila tumorózní útvar se stěnou silnou několik milimetrů, centrálním rozpadem a známkami vaskularizace stěny. Tenkojehlová biopsie neprokázala přítomnost maligních buněk. I přes benigní výsledky bylo vzhledem k ostatnímu nálezu pomýšleno na gastrointestinální stromální tumor a bylo indikováno operační řešení. Pacient byl operován 2. den od přijetí po nezbytné přípravě. Předoperační hodnota Hb činila 117 g/l. Jako operační přístup byla zvolena rozšířená horní střední laparotomie. V dutině břišní nebyly známky generalizace maligního procesu. Přítomny byly pouze četné peritoneální adheze, přestože pacient v minulosti nebyl operován. V místě předpokládané tumorózní léze se nacházela plošná infiltrace zesílené stěny žaludku adherující k pankreatu. K oddělení obou orgánů muselo být užito ostré preparace. Jejich oddělení ozřejmilo suspektní lézi žaludku, která budila spíše dojem zhojeného peptického vředu penetrujícího do slinivky než nádorového procesu (Obr. 2). Operatér provedl na základě nálezu excizi suspektní léze s dostatečným lemem zdravé tkáně namísto radikálního resekčního výkonu. Stěna žaludku byla uzavřena suturou ve dvou vrstvách a na závěr výkonu byla pacientovi zavedena nazogastrická sonda (NGS). Laboratorní výsledky po výkonu prokázaly pouze mírný pokles Hb na 105 g/l. Druhý pooperační den byla odstraněna NGS a zahájena postupná realimentace, kterou pacient toleroval bez obtíží. Pro přetrvávající sekreci z břišního drénu byla drenážní tekutina 7. pooperační den biochemicky vyšetřena s nálezem AMS >125 μkat/l. Další postup byl konzervativní s ponecháním peroperačně nasazené antibiotické léčby. Jednalo se tedy o pankreatickou píštěl typu B dle International Study Group for Pancreatic Fistula (ISGPF) [16]. Pro naléhání pacienta a jeho celkově dobrý stav byl 8. pooperační den propuštěn z hospitalizace a další léčba pokračovala ambulantně. Odpad z drénu činil v den propuštění 30 ml za 24 hodin. Na první kontrole, která následovala za 3 dny od propuštění, udával pacient odpady 100 ml za 24 hod. Nicméně pro dobrý klinický stav nebyla nutná opětovná hospitalizace. Za další 3 týdny došlo k poklesu denní produkce sekretu na polovinu. Operační rána se zhojila per primam intentionem a docházelo k dalšímu snižování pankreatické sekrece. Břišní drén byl posupně povytahován a definitivně odstraněn 27. den od operačního výkonu. Histologické vyšetření resekované léze potvrdilo benigní diagnózu penetrujícího peptického vředu. Na kontrolním CT vyšetření 70 dní od operace nebyly viditelné patologické změny, ani kolekce tekutiny, ani pankreatická píštěl. Také došlo k regresi velikosti regionálních mízních uzlin. Pacient byl předán do péče gastroenterologa v dobrém celkovém stavu a bez obtíží.
Obr. 1. CT obraz suspektní léze sagitální řez (A) a tansverzální řez (B)
Fig. 1: CT scan of the suspected lesion from the sagittal (A) and transversal view (B)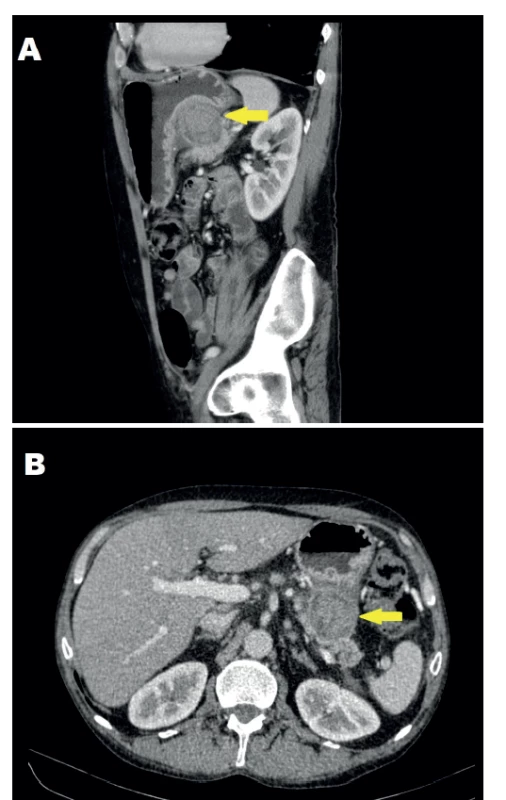
Obr. 2. Peroperační nález
Žaludek oddělený od slinivky břišní s patrnou penetrující vředovou lézí. I – zadní stěna žaludku, II – léze slinivky.
Fig. 2: Intraoperative surgical finding
Stomach separated from the pancreas with a visible penetrating ulcer. I – posterior wall of the stomach; II – lesion of pankreas.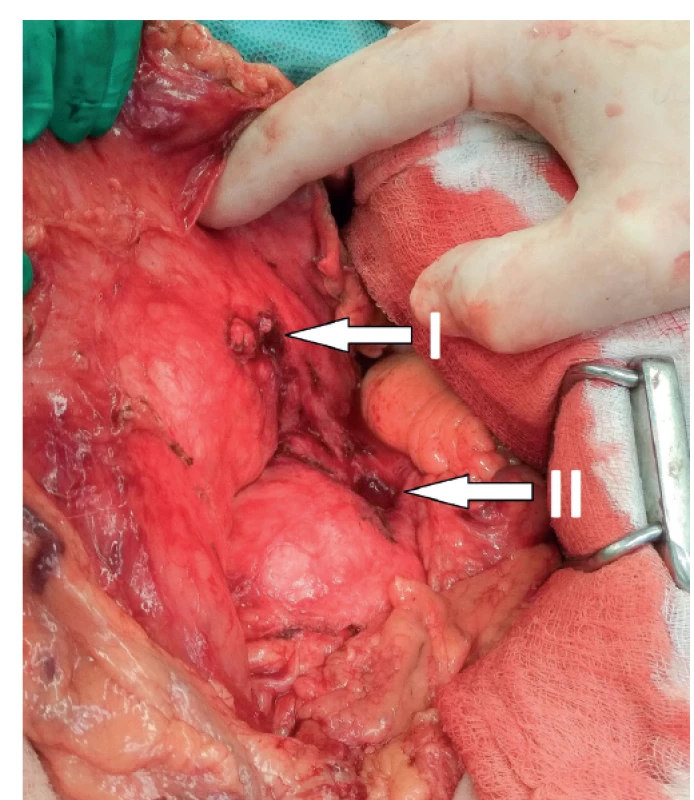
DISKUZE
Téměř polovina krvácení do horní části gastrointestinálního traktu vzniká na podkladě gastroduodenální vředové choroby [17]. V případě našeho pacienta byla příčinou hematemézy pravděpodobně erozivní ezofagitida odhalená endoskopickým vyšetřením. Na vzniku ezofagitidy se jistě podílel pacientův životní styl, neboť je prokázána souvislost mezi konzumací alkoholu a rizikem vzniku erozivní ezofagitidy [18,19]. Nejčastější lokalizací perforace peptického vředu je přední stěna duodena (60 %), dále pak oblast antra (20 %) a malá kurvatura žaludku (20 %) [1]. Tato informace a klíčový fakt, že při endoskopickém vyšetření nebyla v místě suspektní léze nalezena čerstvá ani zhojená ulcerace sliznice, podporovaly diagnózu intramurálně uloženého tumoru. Doplněná zobrazovací vyšetření spíše podpořila hypotézu přítomnosti tumorózního procesu. Indikace na základě dostupných předoperačních nálezů k pokusu o onkologicky radikální výkon byla dle autorů správná. Další možností by bylo sledování pacienta. To však s sebou přináší riziko progrese potenciální malignity.
V terénu chronických změn je obtížné odlišit benigní zánětlivé změny od maligního procesu. V našem případě však peroperační nález z pohledu zkušeného chirurga odpovídal spíše penetrujícímu gastrickému vředu. Operatér tedy volil výkon menšího rozsahu, než by tomu bylo v případě nálezu tumorózního procesu. Tím snížil zátěž pro pacienta a také riziko pooperačních komplikací. Pooperačně došlo k rozvoji pankreatické píštěle typu B dle ISGPF. Terapie pankreatických píštělí je ve většině případů konzervativní, ale řídí se vždy klinickou závažností píštěle [20]. V našem případě léčba spočívala v antibiotické terapii a ponechání břišního drénu. Takto došlo postupně ke snížení sekrece s následnou extrakcí drénu 27. den po operaci. Známým důsledkem penetrace žaludečního vředu do slinivky břišní je rozvoj akutní pankreatitidy [21,22]. Je tedy vysoce pravděpodobné, že pacient nějakou formu akutní pankreatitidy v minulosti prodělal.
ZÁVĚR
Pacient byl vyšetřován pro recidivující hematemézu přibližně 2 měsíce, přičemž opakovaná endoskopická vyšetření neprokázala přítomnost žaludeční vředové léze, pouze ezofagitidu. V rozporu s nálezem z CT a EGDS vedl k definitivní diagnóze penetrujícího vředu až operační výkon, který byl indikován pro podezření na tumor.
V současnosti je klíčovou metodou v diagnostice onemocnění endoskopické vyšetření, které umožňuje odběr biopsie pro diferenciální diagnostiku léze i intervenci v případě krvácení. V případě léčby nekomplikované vředové choroby je snaha o maximálně konzervativní postup – edukace pacienta, úprava životosprávy a medikamentózní terapie. Chirurgická intervence je v současné době vyhrazena pro případy, které nelze zvládnout konzervativní cestou nebo endoskopickým výkonem.
Na naší kazuistice je patrné, že stejně jako u jiných onemocnění je i v případě gastroduodenální vředové choroby důležitá mezioborová spolupráce a že i přes pokročilé farmakologické a endoskopické léčebné modality má chirurgická intervence v managementu léčby komplikované vředové choroby gastroduodenální stále nezastupitelnou roli.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Petr Macan
Chirurgická klinika FN Plzeň
Alej Svobody 80
304 60 Plzeň-Lochotín
e-mail: macanp@fnplzen.cz
Zdroje
1. Ramakrishnan K, Salinas RC. Peptic ulcer disease. Am Fam Physician. 2007 Oct 1;76(7):1005−1012. PMID: 17956071.
2. Scida S, Russo M, Miraglia C, et al. Relationship between Helicobacter pylori infection and GERD. Acta Biomed. 2018 Dec 17;89(8-S):40−43. doi: 10.23750/ abm.v89i8-S.7918. PMID: 30561416; PMCID: PMC6502218.
3. Satinský I. Perforovaný peptický vřed – předoperační rizika, pooperační morbidita a mortalita, profylaxe v intenzivní péči a doporučení. Anesteziologie a intenzivní medicína 2012;(5):259−263.
4. Woolf A, Rose R. Gastric Ulcer. 2020 Jul 13. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan. PMID: 30725813.
5. Kroupa R, Dítě P, Munzová H. Incidence of gastroduodenal ulcer H. pylori positive and negative in years 1996–2000 in region of Czech Republic. Gut 2002;Suppl II: A63.
6. Moriyama T, Matsumoto T. Esophagogastroduodenal mucosal lesions in patients with inflammatory bowel disease [In Japanese]. Nihon Rinsho 2012 Feb;70 Suppl 1 : 249?252. PMID: 23126099.
7. Inuzuka T, Okabe Y, Nishikawa H, et al. A case of Zollinger-Ellison syndrome diagnosed by duodenal ulcer perforation into the gallbladder. Gastrointest Endosc. 2013 Apr;77(4):659−660; discussion 660−601. doi: 10.1016/j.gie.2012.11.044. Epub 2013 Jan 26. PMID: 23357498.
8. Tachecí I, Bureš J. Gastroduodenální vředová choroba u diabetika. Vnitřní lékařství 2011;(57(4):347−350.
9. Spiegelhalter DJ, Crean GP, Holden R, et al. Taking a calculated risk: predictive scoring systems in dyspepsia. Scand J Gastroenterol Supp. 1987;128 : 152–60. doi: 10.3109/00365528709090984.
10. Konečný M. Vředová choroba gastroduodenální. Medicína pro praxi 2017;(14(4):177−179.
11. Charvát D, Leffler J, Hoch J. Chirurgické léčení krvácení z gastroduodenálního vředu. Rozhledy v chirurgii 2007;86(4):166−169.
12. Hoch J, Leffler J. Speciální chirurgie 3., rozš. a přeprac. vyd. Praha, Maxdorf 2011. Jessenius. ISBN 978-80-7345-253-7.
13. Zittel TT, Jehle EC, Becker HD. Surgical management of peptic ulcer disease: indication, technique and outcome. Langenbecks Arch. Surg. 2000;385 : 84–96.
14. Becker HD, Jehle E, Kreis M. Evaluating elective surgical procedures in ulcer surgery [In German]. Der Chirurg; Zeitschrift fur Alle Gebiete der Operativen Medizen 1996 Jan;67(1):14−19.
15. Maceček J, Tůma J, Prucek T, et al. Asymptomatická penetrace duodenálního vředu do jater u antikoagulovaného pacienta. Interní medicína pro praxi 2013;15 : 225−228.
16. Bassi C, Dervenis C, Butturini G, et al. International Study Group on Pancreatic Fistula Definition. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005 Jul;138(1):8−13. doi: 10.1016/j. surg.2005.05.001. PMID: 16003309.
17. Konečný M, Procházka V. Racionální diagnostický a terapeutický postup u akutního krvácení do horní části trávicího traktu. Interní medicína pro praxi 2009;11(10):446−448.
18. Akiyama T, Inamori M, Iida H. Alcohol consumption is associated with an increased risk of erosive esophagitis and Barrett‘ s epithelium in Japanese men. BMC Gastroenterol 2008;118 : 58.
19. Mincis M, Chebli JM, Khouri ST, et al. Ethanol and the gastrointestinal tract. Arq Gastroenterol. 1995;32(3):131–9.
20. Loveček M, Neoral Č, Klos D, et al. Chirurgie karcinomu pankreatu na I. chirurgické klinice FN Olomouc. Rozhl Chir. 2010;89 : 731–739.
21. Mensier A, Bounoua F, Beretvas G, et al. Kissing gastric ulcers causing acute pancreatitis and portal biliopathy: what‘s the link? JOP 2013 Nov10;14(6):646−648. doi: 10.6092/1590-8577/1546. PMID: 24216552.
22. Singh T, Mendelson R. Case report: Confined penetration of a duodenal ulcer causing pancreatitis. J Med Imaging Radiat Oncol. 2010 Feb;54(1):47−49. doi: 10.1111/j.1754-9485.2010.02136.x. Erratum in: J Med Imaging Radiat Oncol. 2010 Apr;54(2):171. PMID: 20377715.
23. Fujihara S, Mori H, Nishiyama N, et al. Giant gastric ulcer penetrating into the pancreas. Arab J Gastroenterol. 2012 Sep;13(3):158−160. doi: 10.1016/j. ajg.2012.06.007. Epub 2012 Jul 19. PMID: 23122461.
24. Shibukawa N, Ouchi S, Wakamatsu S, et al. Rare case of gastric ulcer penetrating the pancreas that was successfully managed by conservative therapy. Intern Med. 2017 Sep 1;56(17):2277−2279. doi: 10.2169/internalmedicine.8188-16. Epub 2017 Aug 10. PMID: 28794357; PMCID: PMC5635298.
25. Bae S, Shim KN, Kim N, et al. Incidence and short-term mortality from perforated peptic ulcer in Korea: a population-based study. J Epidemiol. 2012;22(6):508−516. doi: 10.2188/jea.je20120056. Epub 2012 Sep 1. PMID: 22955110; PMCID: PMC3798562.
26. Lanza FL, Chan FKL, Quigley EMM. Practice parameters Committee of the American College of Gastroenterology. Guidelines for prevention of NSAID-related ulcer complications. Am J Gastroenterol. 2009;104(3):728–738; doi: 10.1038/ ajg.2009.115
27. Kypraios D, Fusaroli P, Artuso S, et al. Gastric ulcer penetration into the liver mimicking malignancy on endoscopic ultrasound. Endosc Ultrasound. 2013;2(2):107−108. doi:10.4103/2303 - 9027.117700.
28. Čečka F, Jon B, Šubrt Z, et al. Pankreatická píštěl − definice, rizikové faktory a možnosti léčby. Rozhl Chir. 2013;92 : 77−84.
29. Röher HD, Imhof M, Goretzki PE, et al. Ulkus 96 – Methodenwahl im Notfall. Chirurg. 1996;67 : 20–25.
30. Pimpl W, Boeckl O, Heinermann, et al. Emergency endoscopy: A basis for therapeutic decisions in the treatment of severe gastroduodenal bleeding. World J Surg. 1989;13 : 592–597.
31. Kujath P, Schwandner O, Bruch HP. Morbidity and mortality of perforated peptic gastroduodenal ulcer following emergency surgery. Langenbecks Arch Surg. 2002 Nov;387(7−8):298−302. doi: 10.1007/s00423-002-0331-9. Epub 2002 Nov 8. PMID: 12447556.
32. Svanes C. Trends in perforated peptic ulcer: incidence, etiology, treatment, and prognosis. World J Surg. 2000 Mar;24(3):277−283. doi: 10.1007/ s002689910045. PMID: 10658061.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Střípky současnosti
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Střípky současnosti
- Retroperitoneální hematom: diagnostika a léčba
- Videoasistované a roboticky asistované torakoskopické plicní lobektomie, naše zkušenosti
- Laparoskopická versus otvorená elektívna pravostranná hemikolektómia pri adenokarcinóme hrubého čreva
- Bílá místa v managementu prevence tromboembolie na chirurgických pracovištích a role klinického farmaceuta
- Transhepatální perforace žlučníku s masivním intraperitoneálním krvácením jako vzácná komplikace akutní cholecystitidy
- Spontánní retroperitoneální krvácení u pacientů s infekcí covid-19 – kazuistika dvou případů
- Asymptomatická penetrace žaludečního vředu do slinivky břišní manifestující se jako tumor
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Retroperitoneální hematom: diagnostika a léčba
- Laparoskopická versus otvorená elektívna pravostranná hemikolektómia pri adenokarcinóme hrubého čreva
- Videoasistované a roboticky asistované torakoskopické plicní lobektomie, naše zkušenosti
- Asymptomatická penetrace žaludečního vředu do slinivky břišní manifestující se jako tumor
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



