-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaInfekčné komplikácie súvisiace s operačnou liečbou degeneratívneho ochorenia driekovej chrbtice
Surgical site infections after degenerative lumbar spine surgery
Degenerative lumbar spine disease is nowadays considered as a serious health condition, because the number of patients requiring a surgical intervention is in last decades rapidly increasing. At the time of surgery indication, it is important to assess the risk of complications incidence, especially surgical ones, because when they occur, they usually lead to reoperation, prolonged hospitalisation and drug use, economic consequences and a compromised postoperative outcome and benefits. Postoperative infectious complications may occur, even after following aseptic and hygienic − epidemiological rules. This article contains an interdisciplinary review of diagnosis, treatment and prevention of postoperative surgical site infections after degenerative lumbar spine surgery.
Key words:
postoperative complications − lumbar spine − surgical treatmens - spondylodiscitis
Autoři: P. Snopko; B. Kolarovszki; R. Opšenák; M. Hanko; R. Richterová
Působiště autorů: Neurochirurgická klinika, Jesseniova lekárska fakulta v Martine, Univerzitná nemocnica Martin, Univerzita Komenského v Bratislave
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 12, s. 539-545.
Kategorie: Souhrnné sdělení
Souhrn
Degeneratívne ochorenie driekovej chrbtice je v súčasnosti považované za závažnú medicínsku problematiku vzhľadom na významný nárast počtu pacientov, ktorých klinický stav vyžaduje realizáciu operačného výkonu. V čase indikácie plánovaného operačného výkonu je dôležité zvážiť riziko výskytu pooperačných komplikácií, pretože ich výskyt môže viesť k reoperácii, predĺženej hospitalizácii, negatívnym ekonomickým následkom a k zníženiu spokojnosti pacientov s operačnou liečbou. Výskyt pooperačných infekčných komplikácií hrozí napriek dôkladnému dodržiavaniu aseptických a hygienicko - epidemiologických zásad. Článok obsahuje medziodborový prehľad súčasných princípov diagnostiky, liečby a prevencie pooperačných infekčných komplikácií v súvislosti s operačnou liečbou degeneratívneho ochorenia driekovej chrbtice.
Kľúčové slová:
pooperačné komplikácie − drieková chrbtica − operačná liečba - spondylodiscitída
ÚVOD
Degeneratívne ochorenie driekovej chrbtice patrí v súčasnosti medzi ochorenie postihujúce významnú časť populácie, obvykle staršiu generáciu. Počet pacientov s nutnosťou podstúpiť operačnú liečbu za posledné desaťročia významne stúpol. Prítomnosť chirurgických infekcií v pooperačnom období po operačnom výkone na driekovej chrbtici patrí k pomerne často sa vyskytujúcim pooperačným komplikáciám, ktoré výrazne ovplyvňujú pooperačnú adaptáciu a skorú rehabilitáciu pacientov. Dôkladná a precízna prevencia, diagnostika a liečba pooperačných infekčných komplikácií má zásadný význam, pretože ich výskyt obvykle vedie k predĺženej hospitalizácii pacientov, zvýšeným finančným nákladom na liečbu a v neposlednom rade výrazne vplýva na spokojnosť pacienta po operačnom výkone [1−4]. Prevencia infekcií závisí hlavne od predoperačnej a pooperačnej antibiotickej profylaxie a dôkladnom dodržiavaní aseptických podmienok a zásad na operačnej sále [5−8]. Výkony realizované na degeneratívne postihnutej driekovej chrbtici sa rozdeľujú na výkony dekompresívne, stabilizačné a výkony dekompresívne-stabilizačné. Podľa realizovaných prospektívnych a retrospektívnych štúdií sa výskyt pooperačných infekcií pohybuje v okolí 3 % po jednoúrovňových dekompresívnych operačných výkonoch. Pri realizácii inštrumentovanej intersomatickej fúzie a zväčšení rozsahu výkonu sa riziko výskytu zvyšuje až na 12 % [9]. Zvýšený výskyt infekcií po inštrumentovanom stabilizačnom operačnom výkone je vysvetlený dlhším časom operácie, väčším operačným prístupom a obvykle vyššími peroperačnými krvnými stratami. Existujú tri najčastejšie cesty infekčnej kontaminácie:
- priama bakteriálna inokulácia počas operačného výkonu,
- kontaminácia v skorom pooperačnom období,
- kontaminácia hematogénnou cestou [10].
Pooperačné chirurgické infekcie po operačnej liečbe driekovej chrbtice sa štandardne klasifikujú ako infekcie povrchové a hlboké, aj keď rozdelenie je skôr teoretické. Povrchové infekcie postihujú kožu a podkožie bez zahrnutia lumbodorzálnej fascie. Hlboké infekcie sa vyskytujú pod lumbodorzálnou fasciou a zahŕňajú postihnutie chrbtice a medzistavcových platničiek, ktoré môže viesť ku spondylodiscitíde, osteomyelitíde a rozvoju epidurálneho abscesu, prípadne meningitídy. Podľa času výskytu sa infekčné komplikácie ďalej rozdeľujú na komplikácie akútne (prejavy do troch týždňovod operačného výkonu) a komplikácie chronické/neskoré (prejavy od troch týždňov od operačného výkonu) [11−15].
Rizikové faktory
Rizikové faktory sa rozdeľujú na faktory súvisiace s operačným výkonom a faktory súvisiace s osobnou charakteristikou pacienta. Vo všeobecnosti platí, že rozsiahlejšie operačné výkony a výkony vyžadujúce dlhší operačný čas, prinášajú so sebou zvýšené riziko pooperačných komplikácií. Riziko výskytu pooperačnej infekcie po jednoúrovňovej mikrodiskektómii pri vyklenutí medzistavcovej platničky sa pohybuje okolo 1 %, v prípade realizovania jednoúrovňovej dekompresie riziko stúpa na 1,5−2 %. U výkonov s nutnosťou inštrumentovanej stabilizácie sa riziko významne zvyšuje na 1−12 % [9]. Výskyt infekcií môže byť ovplyvnený aj typom operačného prístupu. Vedecká štúdia podľa Levieho et al. potvrdila vyššie riziko výskytu infekčnej pooperačnej komplikácie po operáciách realizovaných zadným prístupom v porovnaní s predným prístupom [16]. Medzi ďalšie závažné rizikové faktory zaraďujeme dlhší čas hospitalizácie, nutnosť operačnej revízie, vyšší počet osôb na operačnej sále počas operačného výkonu, peroperačnú incidentálnu léziu durálneho vaku a v neposlednom rade zvýšené peroperačné krvné straty (8). Kato a kol. potvrdili zvýšený výskyt pooperačných infekčných komplikácií u pacientov s nutnosťou podania krvnej transfúzie [17].
Aplikácia subfasciálnych drénov závisí od skúsenosti operatéra a od peroperačného priebehu, pričom ich význam spočíva najmä v znížení rizika vzniku pooperačného hematómu. Drény je vhodné extrahovať do tretieho pooperačného dňa, v prípade dlhšieho ponechania dochádza k zvýšeniu rizika infekčných komplikácií [18].
Medzi najvýznamnejšie rizikové faktory súvisiace s osobnou charakteristikou pacienta patrí obezita, prítomnosť pridružených ochorení (obzvlášť diabetes mellitus I. a II. typu), fajčenie, vyšší vek pacienta, užívanie kortikosteroidov, obezita a malnutrícia [19]. Malnutrícia má vedecky dokázaný negatívny vplyv na výskyt pooperačných hlbokých infekčných komplikácií u pacientov s predoperačne verifikovanou zníženou hladinou sérového prealbumínu. U rizikových pacientov je vhodné zvážiť predoperačnú kontrolu sérového prealbumínu s cieľom identifikácie zvýšeného rizika výskytu pooperačných infekčných komplikácií s následným zvážením odkladu plánovaného operačného výkonu po korekcii nutričného stavu pacienta [20].
Diagnostika
Klinické prejavy
Klinické prejavy sa významne odlišujú v závislosti od typu infekčnej komplikácie. Incipiálne prejavy sú manifestované už prvé dni po operačnom výkone, no v určitých prípadoch sa vyskytujú až niekoľko mesiacov od operácie (v prípade oneskorenej spondylodiscitídy). Začínajúce nešpecifické príznaky zahŕňajú bolestivosť a zvýšenú palpačnú citlivosť v okolí operačnej rany rozvíjajúcu sa medzi druhým pooperačným dňom až troma mesiacmi od operačného výkonu (obvykle tridsať dní od operácie) [21]. Tieto príznaky sú do určitej miery prirodzeným pooperačným javom. Pozornosť si vyžadujú pacienti, u ktorých bolestivosť progreduje a neustupuje. Bolesť je typicky lokalizovaná, neustupujúca a nedostatočne reagujúca na štandardnú analgetickú liečbu. Medzi ďalší prejav patrí prítomnosť subfebrílií/febrílií (40 % prípadov). Za určitých okolností sa môžu vyskytnúť generalizované prejavy ako je triaška, závraty, nauzea a vracanie. Závažným a špecifickým prejavom je dehiscencia operačnej rany, resp. zlyhanie zhojenia operačnej rany „per primam intentionem“. Tento jav sa vyskytuje v 90 % prípadov infekčných chirurgických komplikácií. Rozvoj neurologického deficitu je príznakom skôr neobvyklým, no môže sa objaviť sekundárne v dôsledku útlaku nervových štruktúr. V extrémnych prípadoch môžu hlboké infekcie viesť k sepse a multiorgánovému zlyhaniu [22].
Laboratórne testy
Medzi štandardne využívané a hodnotené laboratórne parametre patrí hladina leukocytov, C-reaktívneho proteínu (CRP) a sedimentácia erytrocytov. Leukocytóza sa vyskytuje u menej ako 50 % pacientov s prítomnou infekciou, preto sa nepovažuje za dostatočne preukázateľný faktor. V pooperačnom období môže byť u pacientov prítomná zvýšená hladina leukocytov napriek neprítomnosti infekcie. Hodnoty CRP a sedimentácia erytrocytov sú preukázateľnejšie, napriek tomu je problematické hodnotenie skorého pooperačného obdobia. V porovnaní s hodnotou sedimentácie je hladina CRP považovaná za viac špecifickú vzhľadom na to, že hladina CRP dosahuje svoje maximum na druhý až tretí pooperačný deň po nekomplikovanom operačnom výkone, postupne klesá a do normálnych hodnôt sa vracia medzi desiatym až štrnástym dňom od operačného výkonu. Hodnoty sedimentácie dosahujú svoje maximálne hodnoty na štrnásty pooperačný deň, fyziologické hodnoty získavajú až šesť týždňov po operačnom výkone. Vďaka rýchlejšej normalizácii hodnôt a vyššej senzitivite oproti sedimentácii erytrocytov (95 %/80 %) je C-reaktívny proteín považovaný za špecifickejší faktor. Pretrvávajúce zvýšené hodnoty CRP po operačnom výkone sú dôležitým indikátorom prítomnosti a rozvoja pooperačnej chirurgickej infekcie. Vzhľadom na uvedené, u rizikových pacientov môže byť kontrola hodnôt CRP predoperačne, tretí a siedmy pooperačný deň považovaná za užitočnú z hľadiska sledovania rozvoja dynamiky eventuálnej infekcie [23].
Sérový amyloid A (SAA), hrajúci významnú rolu pri patogenéze amyloidózy typu A, je v súčasnosti sledovaný pre jeho imunologické aktivity. Štúdia podľaDeguchiho et al. porovnávala hladiny CRP a SAA po operáciách driekovej chrbtice zadným prístupom. Štúdia potvrdila najvyššie hodnoty oboch zápalových parametrov na tretí pooperačný deň, pričom normalizácia hodnôt SAA bola rýchlejšia v porovnaní s CRP. SAA má v porovnaní s CRP kratší polčas rozpadu (50 minút/päť až sedem hodín). Táto štúdia tiež potvrdila, že hladina SAA nie je ovplyvnená užívaním kortikosteroidov v porovnaní s CRP, ktorého hladina v tomto prípade klesá. SAA môžeme považovať za významný faktor v sledovaní výskytu infekčných komplikácií, napriek tomu v praxi nie je štandardne vyžívaným parametrom [24].
Iné zápalové markery, ako prokalcitonín, nie sú považované za dostatočne špecifické. Prospektívna štúdia podľa Mausa et al. porovnávala 17 pacientov so spondylodiscitídou a 18 pacientov s diagnostikovaným vyklenutím medzistavcovej platničky, pričom hodnota prokalcitonínu nebola v žiadnej skupine zvýšená [25].
Mikrobiálna etiológia a prevencia
Identifikácia mikrobiálneho patogénu je základným faktorom adekvátnej liečby infekcie. Výsledok sa získava z kultivačných vyšetrení vzoriek odobratých z operačnej rany a z hemokultivačných vyšetrení. Mikrobiálne kultúry odobraté z povrchu operačných rán sú často kontaminované prirodzenou kožnou flórou a majú veľmi nízku diagnostickú hodnotu. Pri hlbokých infekciách je najviac špecifickou vzorka odobratá počas revízneho operačného výkonu, alebo vzorka z CT − navigovanej biopsie [26].
Najčastejšie sa vyskytujúcim mikroorganizmom spôsobujúcim pooperačné ranové infekcie je Staphylococcus aureus (viac ako 50 %). Medzi ďalšie významné a často sa vyskytujúce patogény patria koaguláza-negatívne stafylokoky, obzvlášť Staphylococcus epidermidis, z gram-negatívnych baktérií sa najčastejšie vyskytuje Escherichia coli, Pseudomonas aeruginosa a Proteus species. Oneskorené hlboké infekcie najčastejšie spôsobujú baktérie, ktoré sú súčasťou prirodzenej kožnej bakteriálnej flóry ako Propionibacterium acnes a koaguláza - negatívny Staphhylococcus [27,28,29].
Medzi základné faktory prevencie infekčných komplikácií patrí dôkladné dodržiavanie aseptických techník a zásad. Dôležitú úlohu v prevencii zohráva antibiotická profylaxia. Štúdia podľa Smitha et al. dokázala zníženie rizika výskytu infekcií po plánovanej spinálnej artrodéze zo 7 % na 3,6 %. Vďaka dodržiavaniu týchto zásad sa v súčasnosti pohybuje výskyt infekčných komplikácií po jednoúrovňovej mikrodiskektómii v okolí 1 % [30]. Najčastejšie profylakticky podávané antibiotiká sú cefalosporíny prvej generácie, obzvlášť cefazolín, vzhľadom na rýchlo dosiahnutú maximálnu hladinu sérovej koncentrácie s relatívne nízkym výskytom vedľajších účinkov. U rizikových pacientov, u pacientov po operačnom výkone dlhšom ako 240–300 minút a pri vysokých peroperačných krvných stratách, je vhodné zvážiť predĺženie pooperačného podávania antibiotickej liečby. Štúdia podľa Sweeta et al. tiež preukázala významne znížený výskyt pooperačných stafylokokových infekčných komplikácií peroperačnou lokálnou aplikáciou vankomycínu do operačnej rany pred jej sutúrou [31]. Ak pacienta považujeme za náchylného ku kolonizácii MRSA (methicilín-rezistentný Staphylococcus aureus), odporúča sa kombinovaná antibiotická profylaxia, obvykle kombinácia vankomycínu s cefazolínom. Za rizikové faktory pre kolonizáciu MRSA je považované užívanie antibiotickej liečby za posledné tri mesiace pred hospitalizáciou, iná nemocničná hospitalizácia v priebehu posledných dvanástich mesiacov, prítomnosť akejkoľvek inej kožnej infekcie a prítomnosť HIV infekcie. Antibiotická profylaxia a odporúčania sa môžu líšiť, resp. môžu a musia byť pravidelne modifikované vzhľadom na pravdepodobnosť vzniku rezistencie na antibiotickú liečbu [32,33].
Znížiť riziko infekčných komplikácií je možné aj v predoperačnom období z hľadiska režimových opatrení:
- hospitalizácia pred operačným výkonom nemá presiahnuť štyri dni,
- obmedzenie nikotinizmu šesť až osem týždňov pred operačným výkonom (z hľadiska zníženia rizika ranových komplikácií),
- korekcia prípadnej obezity a malnutrície [34,35].
Nezastupiteľnú úlohu v prevencii infekčných komplikácií má adekvátna príprava operačného poľa. Jej cieľom je redukcia bakteriálnej flóry prítomnej na koži. V súčasnosti je preferovaná predoperačná dezinfekcia operačného poľa pomocou jódovaného povidónu s pôsobením minimálne po dobu troch minút. Štúdia podľa Yasudu et al. odporúča pôsobenie dezinfekčného prípravku po dobu desať minút pred incíziou kože s cieľom dosiahnuť optimálnu prevenciu chirurgickej infekcie v rane [36].
Vedecká štúdia realizovaná Rehmanom et al. potvrdila signifikatne znížený výskyt pooperačných infekčných komplikácií po operačnom výkone so spinálnou artrodézou pri použití dvojitých rukavíc s výmenou vrchného páru pred inštrumentovanou časťou operácie [37].
Je všeobecne známe, že u pacientov, ktorí podstúpili inštrumentovaný stabilizačný operačný výkon, je vyššie riziko výskytu pooperačných komplikácií. Štúdia podľa Menkesa a kol. sa zamerala na prítomnosť bakteriálnej kontaminácie inštrumentária po jeho otvorení na operačnej sále. U implantátov, ktoré po otvorení neboli zakryté špeciálnou chirurgickou plachtou, bolo signifikantne vyššie riziko bakteriálnej kontaminácie po tridsiatich minútach od ich otvorenia v porovnaní so spinálnymi implantátmi a inštrumentáriom zakrytým po jeho otvorení. Vzhľadom na uvedené je nutná pravidelná edukácia operačných sestier a pomocného personálu na operačnej sále týkajúca sa najnovších aseptických postupov [38].
Zobrazovacie metódy
Röntgenové (RTG) vyšetrenie chrbtice patrí medzi základné vyšetrovacie metódy, ale v prípade infekčných komplikácií neposkytuje dostatočné informácie o ochorení. Napriek tomu, v prípade pooperačnej discitídy, môže byť pozorovaný kolaps medzistavcovej platničky, obvykle medzi štvrtým a šiestym týždňom po operácii. Osifikácia, zmeny v krycích doštičkách a mechanická deteriorácia sa vyskytujú najmenej dva mesiace pooperačne.
Vyšetrenie ultrazvukom je ľahko dostupné, využíva sa obvykle na identifikáciu subkutánnej tekutej kolekcie a pri navigovanej punkcii za účelom odobratia vzorky na kultivačné a biochemické vyšetrenie.
Vyšetrenie počítačovou tomografiou (CT) poskytuje zobrazenie deštrukcie kostného tkaniva, zmeny v krycích doštičkách a obzvlášť prítomnosť tekutých kolekcií. Na základe postkontrastného sýtenia možno odlíšiť pseudo - meningeálne kolekcie od zápalových kolekcií (abscesu) s rozvojom fistuly. Neodmysliteľnou diagnostickou metódou je CT navigovaná biopsia s odberom vzorky z postihnutého tkaniva. PET/CT (pozitrónová emisná tomografia/počítačová tomografia) má diagnostický význam pri chronických infekciách, najmä pri nedostupnosti alebo kontraindikácii vyšetrenia magnetickou rezonanciou. Pri diagnostike hlbokých infekcií po operáciách chrbtice s využitím spinálnych implantátov a pri hodnotení abnormalít v krycích doštičkách má podľa viacerých štúdií vyššiu špecifickosť ako MR.
Zásadné postavenie pri diagnostike a hodnotení hlbokých infekčných komplikácií má magnetická rezonancia (MR), obzvlášť pri spondylodiscitídach a epidurálnom abscese (Obr. 1). Odporúča sa vyšetrenie s použitím kontrastnej látky (gadolínium). Ak je pacient po inštrumentovanom stabilizačnom operačnom výkone, využívajú sa MR sekvencie redukujúce prítomnosť artefaktov (fast spin echo). Niekedy je prínosná technika DWI (diffusion weighted imaging) a STIR (short T1 inversion recovery) s potlačením tuku. Medzi známky rozvíjajúcej sa infekcie v oblasti driekovej chrbtice na MR vyšetrení patria:
T1 vážené sekvencie:
- znížený signál v oblasti medzistavcového priestoru,
- znížený signál v priľahlých krycích doštičkách (edém kostnej drene).
T2 vážené sekvencie:
- zvýšený signál v medzistavcovom priestore,
- zvýšený signál priľahlých krycích doštičkách,
- zvýšený signál v paravertebrálnych mäkkých tkanivách.
T1 vážené sekvencie s kontrastnou látkou:
- periférne postkontrastné sýtenie okolo tekutých kolekcií,
- postkontrastné sýtenie priľahlých krycích doštičiek,
- postkontrastné sýtenie okolo miest s nízkou intenzitou indikuje prítomnosť abscesu.
DWI váženie:
- hyperintenzné zápalové ložiská v akútnom štádiu,
- hypointenzné zápalové ložiská v chronickom štádiu.
Pri rozhodovaní sa medzi CT a MR vyšetrením hrá dôležitú úlohu prítomnosť inštrumentária. U pacientov, ktorí podstúpili operačný výkon bez inštrumentácie, je odporučené prvotne realizovať MR, pri inštrumentovaných výkonoch poskytuje lepšie zobrazenie CT vyšetrenie s kontrastnou látkou. Za určitých okolností môže mať realizácia a porovnanie oboch vyšetrení dôležitý význam pri stratégii liečby [39,40,41].
Obr. 1. Vyšetrenie magnetickou rezonanciou pacientky so spondylodiscitídou po extirpácii medzistavcovej platničky L4/5 pre herniu − T1 váženie/ T2 váženie/ STIR (ako vedľajší nález prítomnosť Tarlovovej cysty v sakrálnej oblasti)
Fig. 1: Patient after discectomy for lumbar herniated disc in level L4/5 − magnetic resonance fi ndings − T1 weight image/ T2 weight image/ STIR (sacral Tarlov cyst as an incidental fi nding)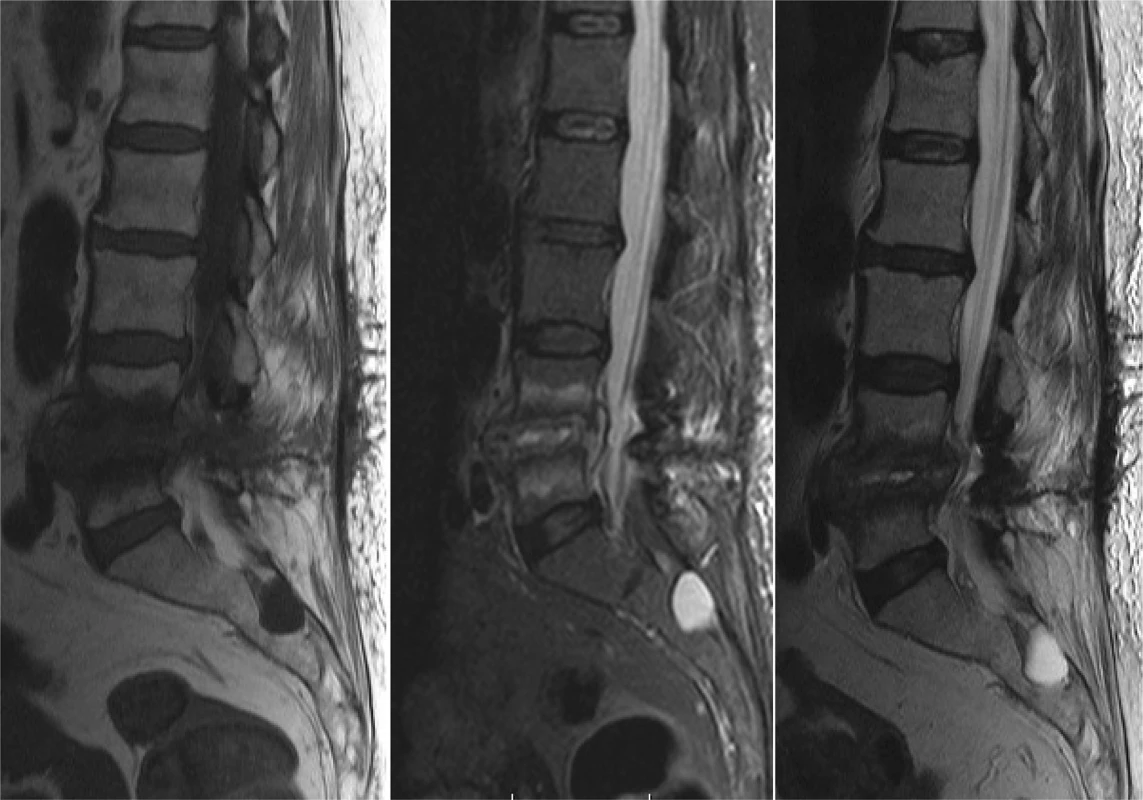
Liečba
V chirurgii stále platí známe pravidlo „ubi pus ibi evacua“. Suprafasciálne infekcie (subkutánne abscesy, flegmóna, celulitída) vyžadujú špecifickú antibiotickú liečbu a malú chirurgickú incíziu s drenážou, obvykle nevyžadujúcu celkovú anestéziu. V prípade zlyhania hojenia operačnej rany „per primam intentionem“ a prítomnosti dehiscencie operačnej rany (aj pri hlbokých infekciách) je realizované oneskorené uzavretie operačnej rany s pravidelným debridementom s odstraňovaním infikovaných a nekrotických tkanív, zvyčajne s využitím prípravkov podporujúcich vlhké hojenie rán. V súčasnosti sa čoraz častejšie uplatňuje VAC systém (vacuum-assisted closure), ktorý vyvoláva podtlak v operačnej rane, čo vedie k redukcii intersticiálneho edému, zlepšeniu krvného zásobenia a stimulácii proliferácie buniek granulačného tkaniva, ktorý umožňuje urýchlenie procesu sekundárneho hojenia operačných rán [42].
Medzi najčastejšie sa vyskytujúcu hlbokú infekciu patrí spondylodiscitída. Liečba spondylodiscitídy môže byť konzervatívna alebo chirurgická. Konzervatívny postup liečby je indikovaný, ak nie sú prítomné absolútne indikácie pre chirurgickú liečbu. Spočíva v dostatočne dlhej imobilizácii postihnutého segmentu chrbtice (šesť až dvanásť týždňov) s adekvátnou antibiotickou liečbou v závislosti od kultivačného vyšetrenia vzorky z CT navigovanej biopsie (Tab. 1). Doba podávania ATB liečby nie je v literatúre presne definovaná. V závislosti od klinického stavu, hodnoty zápalových parametrov a grafických nálezov, je odporúčaná celková doba podávania antibiotickej liečby v rozmedzí šiestich týždňov a troch mesiacov, v ťažkých prípadoch až do šiestich mesiacov. Podľa vedeckých štúdií je priemerná doba parenterálneho podávania antibiotík šesť až osem týždňov, celková doba antibiotickej liečby trvá priemerne šesť až pätnásť týždňov. Chirurgická liečba je indikovaná v prípade graficky verifikovanej progresie infekcie (napriek adekvátnej antibiotickej liečbe), pri rozvoji spinálnej deformity v dôsledku deštrukcie tiel stavcov a pri rozvoji neurologického deficitu v dôsledku šírenia infekcie do spinálneho kanála. Operačný výkon spočíva v explorácii operačnej rany, určenia rozsahu infekcie s agresívnym debridementom nekrotického a infekčného tkaniva s dekompresiou nervových štruktúr. Odstránenie inštrumentácie je dlhodobo diskutovaným problémom bez jednoznačného záveru. Ak sú prítomné známky malfunkcie, resp. uvoľnenia stabilizačného materiálu s rizikom vzniku významnej segmentálnej instability, odporúča sa revízny operačný výkon s restabilizáciou chrbtice. Po odstránení inštrumentária bez následného stabilizačného výkonu, ak ešte neprebehla kostná fúzia, hrozí vznik pseudoartrózy. Vo väčšine prípadov zachovanie alebo odstránenie pôvodného titánového inštrumentária nemá vplyv na eradikáciu/progresiu infekcie [11,16,22,26,43−46]. Vedecky dokázaný pozitívny efekt na liečbu chronických hlbokých infekcií u pacientov s intaktným osteosyntetickým materiálom má hyperbarická komora. Jej efekt spočíva v redukcii hypoxie tkanív so signifikantným zvýšením fagocytárnej aktivity leukocytov. Pobyt v hyperbarickej komore je považovaný za liečbu adjuvantnú [47].
Tab. 1. Antibiotická liečba pri spondylodiscitíde [22,26,43−46,48]
Fig. 1: Spondylodiscitis − specific antibiotic therapy [22,26,43−46,48]![Antibiotická liečba pri spondylodiscitíde [22,26,43−46,48]<br>
Fig. 1: Spondylodiscitis − specific antibiotic therapy [22,26,43−46,48]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9a325ff673193f43c689d6cef47f61ad.jpeg)
Poznámka: Dávkovanie liekov je určené pre dospelé osoby s normálnou renálnou a hepatálnou funkciou. Pri indikácii je nutné brať ohľad na prípadne alergie, špecifické upozornenia a kontraindikácie pre jednotlivé liečivá. Liečba epidurálneho abscesu môže byť konzervatívna,ak je ložisko malé. V prípade rastovej progresie a prítomnosti neurologického deficitu liečba spočíva v urgentnej chirurgickej evakuácii s dôkladným debridementom okolitých tkanív, preplachovej drenáži a antibiotickej liečbe [48].
Výskyt pooperačnej meningitídy je skôr raritný (0,18 %). Liečba závisí od včasnej diagnostiky s nasadením adekvátnej antibiotickej liečby [49].
ZÁVER
Pooperačné infekčné komplikácie významne ovplyvňujú dĺžku hospitalizácie pacienta, finančné náklady spojené s hospitalizáciou a hlavne spokojnosť pacienta po operačnom výkone. Je veľmi dôležité dbať na prevenciu infekcií, predovšetkým antibiotickou profylaxiou,precíznou chirurgickou technikou a disciplínou na ope-račnej sále. Napriek dôkladnému dodržiavaniu pred-operačných, peroperačných a pooperačných aseptických zásad sa infekčné komplikácie vyskytujú. Včasná diagnostika a identifikácia infekčného agensu sú nutné pre zabezpečenie adekvátnej liečby. Liečebná stratégia musí byť pravidelne aktualizovaná vzhľadom na aktuálnu hygienicko - epidemiologickú situáciu a možný rozvoj antibiotickej rezistencie. Úspešné zvládnutie infekčných komplikácií je multidisciplinárny problém, ktorý od ich prevencie, cez diagnostiku po liečbu vyžaduje spoluprácu lekára prvého kontaktu, neurochirurgických (ortopedických), chirurgických a infektologických pracovísk.
Práca bola podporená projektom „Využitie systému PACS vo výskume a vývoji“, ITMS kód Projektu 26210120004, ktorý je spolufinancovaný zo zdrojov EÚ/Európskeho fondu regionálneho rozvoja.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise.
doc. MUDr. Branislav Kolarovszki, Ph.D.
Neurochirurgická klinika JLF UK a UNM
Kollárova 2
03601 Martin
e-mail: kolarovszki@jfmed.uniba.sk
Zdroje
- Kirkland KB, Briggs JP, Trivette SL, et al. The impact of surgical-site infections in the 1990s:attributable mortality, excess length of hospitalisation, and extra costs. Infect Control Hosp Epidemiol 1999;20 : 725−30.
- Smith JS, Shaffrey CI, Sansur CA, et al. Rates of infection after spine surgery based on 108,419 procedures. Spine 2011;36 : 556−63.
- Weinstein MA, McCabe JP, Cammisa FP Jr. Postoperative spinal wound infection: a review of 2,391 consecutive index procedures. J Spinal Disord 2000;13 : 422−6.
- Keller RB, Pappas AM. Infection after spinal fusion using internal fixation instrumentation. OrthopClin North Am 1972;3 : 99−111.
- Bělina F. Současné možnosti ovlivnění infekce v místě operačního výkonu. Rozhl Chir 2017;96 : 189−96.
- Koutsoumbelis S, Hughes AP, Girardi FP, et al. Risk factors for postoperative infection following posterior lumbar instrumented arthrodesis. J Bone Joint Surg Am 2011;93 : 1627−33.
- Cizik A, Lee M, Martin B, et al. Using the spine surgical invasiveness index to identify risk of surgical site infection. J Bone Joint Surg Am 2012;94 : 335−42.
- Gurlich R, Adamkova V, Ulrych J, et al. Infekce kůže a měkkých tkání. Rozhl Chir 2016;95 : 141−6.
- Pull ter Gunne AF, Cohen DB. Incidence, prevalence, and analysis of risk factors for surgical site infection following adult spinal surgery. Spine 2009;34 : 1422−8.
- Collins I, Wilson-MacDonald J, Chami G, et al. The diagnosis and management of infection following instrumented spinal fusion. Eur Spine J 2008;17 : 445−50.
- Bassewitz HL, Fishgurd JS, Herkowitz HN. Postoperative spine infections. Semin Spine Surg 2000;12 : 203−11.
- Valentini LG, Casali C, Chatenoud L, et al. Surgical site infections after elective neurosurgery: a survey of 1747 patients. Neurosurg 2008;62 : 88−96.
- Olsen MA, Nepple JJ, Riew KD, et al. Risk factors for surgical site infection following orthopaedic spinal operations. J Bone Joint Surg Am 2008;90 : 62−9.
- Friedman ND, Sexton DJ, Connelly SM, et al. Risk factors for surgical site infection complicating laminectomy. Infect Control Hosp Epidemiol 2007;28 : 1060−5.
- Blam OG, Vaccaro AR, Vanichkachorn JS, et al. Risk factors for surgical site infection in the patient with spinal injury. Spine 2003;28 : 1475−80.
- Levi AD, Dickman CA, Sonntag VA. Management of postoperative infections after spinal instrumentation. J Neurosurg 1997;86 : 975−80.
- Kato S, Chikuda H, Ohya J, et al. Risk of infectious complications associated with blood transfusion in elective spinal surgery - a propensity score matched analysis. Spine J 2016;16 : 55−60.
- Rao BR, Vasquez G, Harrop J, et al. Risk factors for surical site infections following spinal fusion procedures: a case-control study. Clin Inf Dis 2011;53 : 686−92.
- Olsen MA, Nepple JJ, Riew KD, et al. Risk factors for surgical site infection following orthopaedic spinal operations. J Bone Joint Surg Am 2008;90 : 62−9.
- Salvetti DJ, Tempel ZJ, Gandhoke GS, et al. Preoperative prealbumin level as a risk factor for surgical site infection following elective spine surgery. Surg Neurol Int 2015;6 : 500−3.
- Takahashi J, Ebara S, Kamimura M, et al. Early-phase enhanced inflammatory reaction after spinal instrumentation surgery. Spine 2001;26 : 1698−1704.
- Hadjipavlou AG, Mader JT, Necessary JT, et al. Hematogenous pyogenic spinal infections and their surgical management. Spine 2000;25 : 1668−79.
- Wimmer C, Gluch H, Franzreb B, et al. Predisposing factors for infection in spine surgery: a survey of 850 spinal procedures. J Spinal Disord 1998;11 : 124−8.
- Deguchi M, Shinjo R, Yoshioka Y, et al. The usefulness of serum amyloid A as a postoperative inflammatory marker after posterior lumbar interbody fusion. J Bone Joint Surg Br 2010;92 : 555−9.
- Maus U, Anderega S, Gravius S, et al. Procalcitonin (PTC) as a diagnostic tool for monitoring of spondylodiscitis. Z Orthop Unfall 2009;147 : 59−64.
- Abbey DM, Turner DM, Warson JS, et al. Treatment of postoperative wound infections following spinal fusion and instrumentation. J Spinal Disord 1995;8 : 278−83.
- Sampedro MF, Huddleston PM, Piper KE, et al. A biofilm approach to detect bacteria from removed spinal implants. Spine 2010;35 : 1218−24.
- Nasto LA, Colangelo D, Rossi B, et al. Post-operative spondylodiscitis. Eur Rev Med Pharmacol Sci 2012;16 : 50−7.
- Bemer P, Corvec S, Tariel N, et al. Significance of propionibacterium acnes-positive samples in spinal instrumentation. Spine 2008;33 : 971−6.
- Best NM, Sasso RC. Success and safety in outpatient microlumbar discectomy. J Spinal Disord Tech 2006;19 : 334−7.
- Sweet FA, Roh M, Silva C. Intrawound application of vancomycin for propylaxis in instrumented thoracolumbar fusions: efficiacy, drug levels, and patient outcomes. Spine (Phila Pa 1976) 2011;36 : 2084−8.
- Smith JS, Shaffrey CI, Sansur CA, et al. Rates of infection after spine surgery based on 108,419 procedures. Spine 2011;36 : 556−63.
- Barker FG, II. Efficacy of prophylactic antibiotic therapy in spinal surgery: a meta-analysis. Neurosurgery 2002;51 : 391−401.
- Moller AM, Villebro N, Pedersen T, et al. Effect of preoperative smoking intervention on postoperative complications: a randomised clinical trial. Lancet 2002;359 : 114−7.
- Boer AS, Mintjes-de Groot AJ, Severijnen AJ, et al. Risk assessment for surgical-site infections in orthopedic patients. Infect Control Hosp Epidemiol 1999;20 : 402−7.
- Yasuda T, Hasegawa T, Yamato Y, et al. Optimal timing of preoperative skin preparation with povidone - iodine for spinal surgery: a prospective, randomized controlled study. Asian Spine J 2015;9 : 423−6.
- Rehman A, Rehman AU, Rehman TU, et al. Removing outer gloves as a method to reduce spinal surgery infection. J Spinal Disord Tech 2015;28 : 343−6.
- Menekse G, Kuscu F, Suntur BM, et al. Evaluationof the time-dependent contamination of spinal implants: prospective randomized trial. Spine (Phila Pa 1976) 2015;40 : 1247−51.
- Van Goethem JW, Parizel PM, Jinkins JR. Review article: MR of the postoperative lumbar spine. Neuroradiology 2002;44 : 723−39.
- Ogden AT, Kalser MG. Single-stage debridement and instrumentation for pyogenic spinal infections. Neurosurg Focus 2004;17 : 5.
- Gemmel F, Rijk PC, Collins JMP, et al. Expanding role of 18F-fluoro-d-deoxyglucose PET and PET/CT in spinal infections. Eur Spine J 2010;19 : 540−51.
- Innes MJ, Temple CL, Lacey MS. Vacuum-assisted wound closure: a new approach to spinal wounds with exposed hardware. Spine 2001;26 : 30−3.
- Lazennec JY, Fourniols E, Lenoir T, et al. Infections in the operated spine: update on risk management and therapeutic strategies. Orthop Traumatol Surg Res 2011;97 : 107−16.
- Nasto LA, Colangelo D, Rossi B, et al. Post-operative spondylodiscitis. Eur Rev Med Pharmacol Sci 2012;16 : 50−7.
- Gouliouris T, Aliyu SH, Brown NM. Spondylodiscitis: update on diagnosis and management. J Antimicrob Chemother 2010;65 : 11−24.
- Legrand E, Flipo RM, Guggenbuhl P, et al. Management of nontuberculous infectious discitis. Treatments used in 110 patients admitted to 12 teaching hospitals in France. Joint Bone Spine 2001;68 : 504−9.
- Larsson A, Uusijärvi J, Lind F, et al. Hyperbaric oxygen in the treatment of postoperative infections in paediatric patients with neuromuscular spine deformity. Eur Spine J 2011;20 : 2217–22.
- Abbey DM, Turner DM, Warson JS, et al. Treatment of postoperative wound infections following spinal fusion with instrumentation. J Spinal Disord 1995;8 : 278−3.
- Tunkel AR, Hartman BJ, Kaplan SL, et al. Practice guidelines for the management of bacterial meningitis. Clin Infect Dis 2004;39 : 1267−84.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Zemřel primář Josef Kalný
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2018 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Vzdělávání chirurgů a kompetence
- Konfokální laserová endomikroskopie v diagnostice onemocnění gastrointestinálního traktu − literární přehled a vlastní zkušenosti
- Infekčné komplikácie súvisiace s operačnou liečbou degeneratívneho ochorenia driekovej chrbtice
- Splenektomie u pacientů starších 65 let – evaluace výsledků jednoho pracoviště
- Cílená axilární disekce a sentinelová biopsie u pacientek s karcinomem prsu po neoadjuvantní chemoterapii – retrospektivní studie
- Současné léčebné postupy při střelných poraněních v mírových podmínkách
- Crohnova choroba apendixu – kazuistika
- Zemřel primář Josef Kalný
- Ortotopická transplantace jater redukovaným a rotovaným štěpem dospělému příjemci se situs inversus: kazuistika a přehled publikovaných případů
- Vzpomínka na primáře Vladimíra Černého
- Zápis z jednání schůze Redakční rady časopisu Rozhledy v chirurgii, konané dne 7. 11. 2018
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současné léčebné postupy při střelných poraněních v mírových podmínkách
- Infekčné komplikácie súvisiace s operačnou liečbou degeneratívneho ochorenia driekovej chrbtice
- Cílená axilární disekce a sentinelová biopsie u pacientek s karcinomem prsu po neoadjuvantní chemoterapii – retrospektivní studie
- Crohnova choroba apendixu – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



