-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Primární lymfomy zažívacího traktu z pohledu chirurga
Primary gastrointestinal lymphoma
This article deals with a surgical approach to primary gastrointestinal lymphoma – a rare finding when compared to primary gastric carcinoma. The clinical findings, diagnosis and staging of the disease as well as various treatment methods and prognosis of the condition are discussed. As it is evident from the paper, the opinions of individual authors regarding this diagnosis may often differ considerably. Furthermore, this paper presents two separate case studies of surgical treatment for gastric lymphomas performed at our department in 2016. Case study 1 describes a surgical intervention for acute abdomen, where lymphoma was already diagnosed peroperatively. Case study 2 presents the case of a patient indicated for elective laparoscopic cholecystectomy with an unexpected finding of primary gallbladder lymphoma.
Key words:
primary gastrointestinal lymphoma – chemotherapy – surgical intervention – primary intestinal lymphoma – primary lymphoma of the gallbladder
Autoři: L. Sojka 1; V. Makajevová 1; J. Šimša 1; J. Votrubová 2; R. Matěj 3
Působiště autorů: Chirurgická klinika 1. LF Univerzity Karlovy, Thomayerova nemocnice v Praze, přednosta: doc. MUDr. J. Šimša, Ph. D. 1; RDG – Radiodiagnostické oddělení, primářka: MUDr. J. Votrubová, CSc. 2; Oddělení patologie a národní referenční laboratoř TSE-CJN, primář: doc. MUDr. R. Matěj, Ph. D. 3
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 7, s. 276-283.
Kategorie: Souhrnné sdělení
Souhrn
Náš článek pojednává o přístupu chirurga k primárnímu gastrointestinálnímu lymfomu, který je v porovnání s karcinomem nálezem raritním. Rozebíráme klinický nález, diagnostiku a staging choroby, různé léčebné metody a prognózu onemocnění. Z článku vyplývá, že názory jednotlivých autorů se na danou problematiku liší, mnohdy i výrazně. Dále prezentujeme nález dvou kazuistik operací lymfomů provedených na našem pracovišti v roce 2016. Kazuistika 1 pojednává o operaci pro náhlou příhodu břišní, kdy již peroperačně byla stanovena diagnóza lymfomu. Kazuistika 2 popisuje případ, kdy byl pacient indikován k elektivní laparoskopické cholecystektomii s překvapivým nálezem primárního lymfomu žlučníku.
Klíčová slova:
primární gastrointestinální lymfom – chemoterapie – chirurgická léčba – primární lymfom střeva – primární lymfom žlučníkuÚvod
Lymfomy patří mezi méně časté malignity, se kterými se chirurg setkává. Incidence počtu lymfomů v České republice v roce 2014 byla u mužů 899 na 100 000 obyvatel a u žen 865 na 100 000 obyvatel. Incidence lymfomů stále minimálně narůstá, oproti roku 2013, kdy byla incidence u mužů 869 a u žen 850 na 100 000 obyvatel [1].
Lymfomy gastrointestinálního traktu patří mezi nejčastější extranodální lymfomy a ty konkrétně tvoří 5−20 % ze všech lymfomů [2]. Přesto je primární gastrointestinální lymfom vzácný, tvoří jen asi 1−4 % všech malignit gastrointestinálního traktu [3].
Primární gastrointestinální lymfom je definován dle Lewina z roku 1978 jako onemocnění dominantně ohraničené na zažívací trakt, bez předchozího nálezu periferní lymfadenopatie a nese rysy charakteristické pro onemocnění zažívacího traktu. Z této definice vyplývá, že musejí být přítomny příznaky charakteristické pro zažívací trakt. Postižení zažívacího traktu musí být dominantní, dále musí být tumor histologicky verifikován. Nejčastěji se jedná o extranodální non-Hodgkinův lymfom, který až sekundárně postihuje lymfatické uzliny. Obecně platný koncept pro extranodální lymfom popisuje postižení uzlin menší než 25 % celkového objemu nádoru. Dle Dowsonových kritérií z roku 1961 se jedná o gastrointestinální lymfom v případě, že při projevu choroby není přítomna periferní lymfadenopatie a nejsou zvětšené mediastinální lymfatické uzliny. Musí být přítomen normální krevní obraz v lymfatické řadě a dominantně je postižen střevní trakt pouze se zvětšenými uzlinami v okolí bez postižení jater nebo sleziny [4].
Rizikové faktory
Rizikové faktory pro vznik lymfomu jsou infekce Helicobacter pylori, Campylobacter jejuni, virus Epstein-Barrové, zánětlivá onemocnění střeva a imunosuprese [5].
Klasifikace a staging
Používaná klasifikace vychází z REAL klasifikace z roku 1994, která dělí lymfomy: B-buněčné lymfomy a T-buněčné lymfomy (Tab. 1). REAL klasifikace rozděluje lymfomy podle histologického typu nádoru. Další užívaná klasifikace je Musshoffova klasikace z Ann Arbor (Tab. 2), která dělí lymfomy dle rozsahu postižení. Klasifikace byla několikrát upravována. Dnes je používána modifikace z roku 1993 z Luganu, bývá užívána i jako mezinárodní prognostický index [6]. Tato klasifikace není jednotná a má výrazné nedostatky zejména v pokročilých stadiích onemocnění, z toho důvodu byla vyvinuta nová Pařížská klasifikace (Tab. 3), která rozděluje lymfomy podle rozsahu postižení zasaženého orgánu, lymfatických uzlin a infiltrace kostní dřeně [7,8,9,10].
Tab. 1. REAL klasifikace Tab. 1: REAL classification 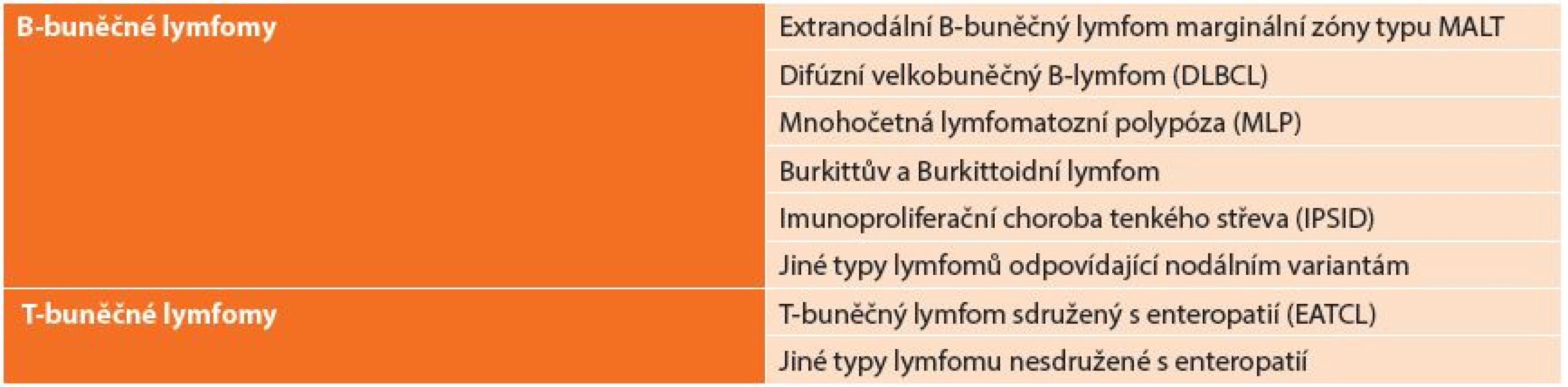
Tab. 2. Musshoffova klasikace z Ann Arbor Tab. 2: The modified Ann Arbor classification 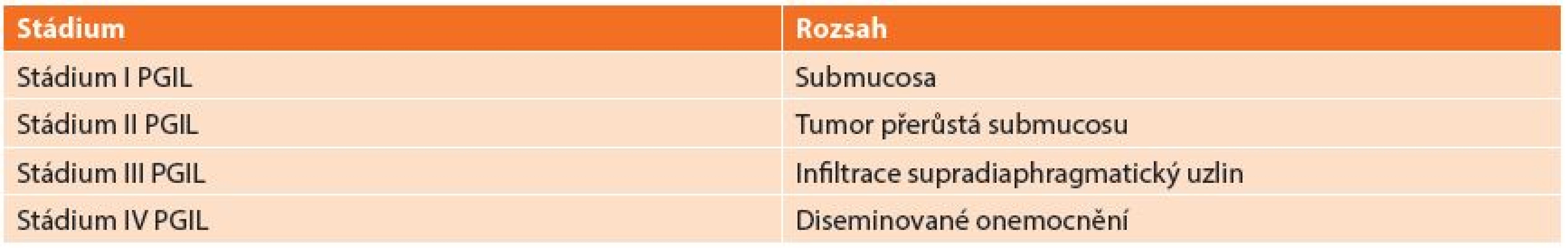
Tab. 3. Pařížská klasifikace Tab. 3: Paris staging system for gastrointestinal lymphoma 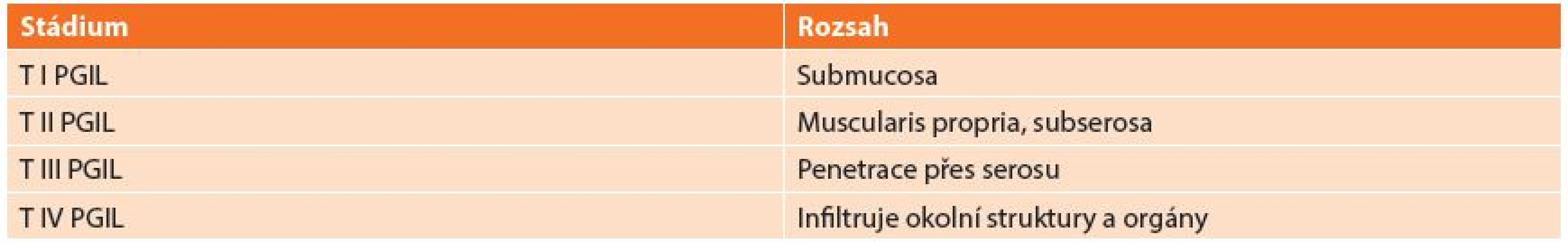
Dle studie z roku 2006 je nejčastější postiženou oblastí zažívacího traktu žaludek, a to až v 70 %, následují tenké střevo, ileocekální přechod a rectum [11].
Dle jiné, starší studie z roku 1997 je nejčastější postiženou etáží tlusté střevo (90 %), dále tenké střevo (88 %), rectum (60 %), žaludek (60 %) a duodenum (52 %). Nejčastěji je diagnostikována velká nádorová masa v ileocekální oblasti až v 40 %. U 90 % nemocných jsou postiženy mezenteriální lymfatické uzliny, u 40 % periferní uzliny. Při podrobném stagingu má až 70 % nemocných pokročilé onemocnění – stadium IV. Kostní dřeň je postižena až u 50 % nemocných, Waldeayerův okruh u 32 % a játra u 27 % [12].
Histologie
Histopatologicky se nejčastěji jedná o non-Hodgkinův B-buněčný lymfom, a to až v 90 %, méně často T-buněčný lymfom nebo Hodgkinův lymfom. Extranodální maligní lymfomy tvoří přibližně 40 % ze všech non-Hodgkinových lymfomů a většina z nich postihuje zažívací trakt, což je cca 40–70 %. Primární gastrointestinální lymfom tvoří tedy 4−20 % z celkového počtu non-Hodgkinových lymfomů. Incidence non-Hodgkinových lymfomů i primárních lymfomů gastrointestinálního traktu pomalu narůstá. Nyní tvoří více než 1 onemocnění na 100 000 obyvatel. Přičemž nárůst extranodálních lymfomů je vyšší než nodálních [13]. Jako sekundární postižení zažívacího traktu je gastrointestinální systém postižen až v 25 % u primárně uzlinových non-Hodgkinových lymfomů [7,14].
Diagnostika
K diagnostice a stagingu choroby se nejčastěji užívají endoskopická sonografie, počítačová tomografie, magnetická rezonance, pozitronová emisní tomografie se značenou glukózou a molekulární markery [15].
Endoskopický nález lymfomu může být různorodý: difuzně granulační tkáň, ulcerace, eroze, ztluštělé řasy nebo uzlinovitá hmota. U lymfomů žaludku jsou nejčastěji postiženy tělo nebo antrum [14].
Endosonografické vyšetření nám pomůže v diagnostice hloubky invaze nádoru a postižení regionálních uzlin [16]. Sonografické vyšetření je vhodné pro iniciální staging choroby a dále pro pravidelné kontroly po absolvované léčbě. Při suspekci je možné pod sonografickou kontrolou odebrat tkáň na biopsii. Pro maligní lymfomy žaludku je charakteristický mnohočetný výskyt lézí na různých částech žaludku. Z toho důvodu je nutné odebrat velké množství vzorků. V dnešní době je preferována extenzivní endoskopická bioptická metoda, kdy se používá takzvané žaludeční mapování a odebírají se vzorky z oblastí makroskopicky nepostižených nádorem. U lymfomu žaludku je kromě bioptického vyšetření provedeno ještě kultivační vyšetření na přítomnost Helicobacter pylori. Celkově se odebírá cca 10 vzorků z různých míst sliznice [6].
Pro diagnostiku a staging choroby jsou v současné době před zahájením terapie dostačující pouze endoskopie, endoskopická sonografie spolu s biopsií a CT vyšetření. U primárních lymfomů zažívacího traktu je častý mnohočetný výskyt lézí v průběhu GIT až 18 %. Z tohoto důvodu některá pracoviště doplňují koloskopické vyšetření a vyšetření Waldayerova mízního okruhu. U pokročilého primárního lymfomu žaludku jsou nejčastěji postiženy kostní dřeň a slezina. Podle typu lymfomu by v rámci stagingu měla být provedena oboustranná trepanobiopsie z lopaty kosti kyčelní. Mezi další doplňující vyšetření patří biopsie jater, lumbální punkce, scintigrafie skeletu, bronchoskopie a CT mozku [12].
Klinický nález
Převážně se manifestují příznaky odpovídající lokálnímu postižení daného orgánu. Systémové příznaky typické pro lymfomy, jako například horečky a noční pocení, se vyskytují pouze u 13 % nemocných. U T-buněčných lymfomů se v krevním obraze může objevit eosinofilie iniciovaná cytokiny [17].
Dle lokalizace dělíme extranodální lymfomy zažívacího traktu na:
- Primární oropharyngeální lymfom tvoří přibližně 10–15 % nádorů postihujících tuto oblast. Vyvíjejí se nejčastěji z Waldeyerova lymfatického okruhu. Rizikovým faktorem je infekce virem Ebstein-Barrové. Nejčastěji postihuje muže nad 50 let. Projevuje se dýchacími obtížemi, dysfagií, bolestí nebo pocitem cizího tělesa v krku. Pacienti si často nahmatají zvětšené tonzily [18]. K léčbě se nejčastěji užívá chemoterapie samotná nebo v kombinaci s radioterapií [19].
- Primární oesophageální lymfom se vyskytuje velice vzácně, tvoří méně než 1 % ze všech gastrointestinálních lymfomů. V literatuře je popisováno jen asi 30 případů. Pro lymfom jícnu neexistuje doporučený způsob léčby. Může být zvolena chirurgická léčba, chemoterapie, radioterapie nebo jejích kombinace [20].
- Primární gastrický lymfom tvoří 2–8 % ze všech malignit žaludku. V posledních letech jeho incidence stoupá až na 10 %. Lymfomy žaludku jsou nejčastější ze všech extranodálních lymfomů, tvoří přibližně 50 % případů [9,21]. Nejčastěji vychází z MALT zóny žaludku a vyskytuje se u pacientů mezi 6. a 7. dekádou života, ale může se vyskytnout v kterémkoliv věku, převážně u mužů. Většina nádorů je zjištěna ve stadiu I a II. Relapsy onemocnění mohou nastat i po mnoha letech. U primárního lymfomu žaludku se vyskytují nespecifické příznaky, podobné jako u jiných malignit žaludku, a to nechutenství, bolest v epigastriu, ztráta hmotnosti, nevolnost, celková slabost, méně často krvácení do GIT a zřídka celkové příznaky [12,14]. Časový interval od prvních příznaků do stanovení diagnózy je průměrně okolo 5 měsíců [7]. Nejčastěji užívaná léčba při pozitivním nálezu Helicobacter pylori je eradikace agens pomocí ATB v kombinaci s inhibitory protonové pumpy [22]. Při negativitě infekce Helicobacter pylori je ve stadiu I a II preferována radioterapie. Chirurgická léčba je doporučována při komplikacích jako perforace, krvácení nebo obstrukce. V pokročilých stadiích nemoci nebo při diseminaci je metodou volby agresivní chemoterapie [23,24].
- Malignity vycházející primárně z tenkého střeva jsou velice vzácné, tvoří asi jen 2 % malignit zažívacího traktu. Primární lymfom tenkého střeva tvoří přibližně 30 % ze všech primárních lymfomů zažívacího traktu a asi 25 % maligních neoplazií tenkého střeva. Nejčastěji postiženou oblastí je ileum [25]. Hlavními příznaky u primárního lymfomu tenkého střeva jsou bolest břicha, střevní obstrukce, ztráta hmotnosti, méně často krvácení do GIT nebo malabsorpce. Tyto příznaky bývají akutní a často vedou k chirurgickému výkonu. Z tohoto důvodu je stanovena diagnóza během několika dní [7].
- Primární lymfom tlustého střeva tvoří asi 10−20 % ze všech nádorů zažívacího traktu, ale pouze 0,5 % z kolorektálních malignit. Častěji je tlusté střevo postiženo sekundárně jako diseminace nodálního lymfomu. Primární lymfom tlustého střeva se stejně jako lymfom tenkého střeva nejčastěji projevuje bolestí břicha, nálezem krve ve stolici, střídá se zácpa s průjmem a méně často ztrátou hmotnosti [17]. Makroskopicky vytváří anulární, ploché léze, aneurizmatické léze, prominující nádorová ložiska nebo mnohočetné polypozní léze. Při diagnostice onemocnění bývají lymfomy střeva obvykle pokročilejšího stadia onemocnění [26]. Histologicky se jedná o velice heterogenní skupinu, kdy se u nádoru tlustého střeva nejčastěji diagnostikuje difuzní velkobuněčný lymfom [17]. S enteropatií sdružený T-buněčný lymfom se vyskytuje u pacientů s celiakíí, kteří mají přibližně 200krát vyšší riziko vzniku maligního lymfomu tenkého střeva [10]. Léčebnou metodou volby u primárních lymfomů tenkého nebo tlustého střeva v lokalizovaných stadiích může být pouze endoskopické snesení nebo resekce postiženého úseku střeva. V pokročilejších stadiích je chirurgická léčba často kombinována s chemoterapií. Radioterapie je metoda pouze paliativní [27].
- Primární lymfom žlučníku se vyskytuje velice zřídka a v literatuře je popsáno asi 40 případů. Tvoří pouze 1−2 % ze všech malignit žlučníku [28]. První případ, který byl v literatuře popsán, je z roku 1982 publikovaný Nguyenem [29]. Z tohoto důvodu diagnostika, léčba a prognóza nejsou jednoznačně stanoveny, nevyplývají žádná doporučení a vedou se pouze diskuze. Klinicky se lymfom žlučníku nejčastěji projevuje jako cholecystitida, obstrukčním ikterem či suspekcí na tumor s nálezem zvětšených lymfatických uzlin v okolí žlučníku [30]. Ze zobrazovacích metod se užívají sonografie, CT tomografie, cholecystografie nebo ERCP [31]. Definitivní diagnóza je často stanovena až zpětně, po operaci a výsledku histologie, jako v našem případě, viz kazuistika. Z literatury vyplývá, že nejčastější léčba je chirurgická obvykle následovaná chemoterapií.
Terapie primárních gastrointestinálních lymfomů
Metodou volby u primárních gastrointestinálních lymfomů je léčba systémová, mezi další patří léčba konzervativní, chirurgická nebo radioterapie. Při rozhodovacím procesu musíme zvážit lokalizaci tumoru, histologický typ a pokročilost onemocnění.
Konzervativní léčba
Specifickou terapii má MALT lymfom nízké malignity, kdy se využívá léčba infekce Helicobracter pylori a s tím spojená regrese lymfomu, která je úspěšná u více než 90 % nemocných [32,33]. Rekurence po úspěšné eradikaci tumoru je udávána přibližně u 10 % nemocných [13]. Endoskopické monitorování je doporučováno v intervalech 4 týdnů až 3 měsíců dle autora, až do kompletní regrese s mnohočetnými odběry biopsie, jak bylo popsáno v úvodu [6,33]. Po úspěšné regresi následují kontroly v 6 měsíčních a následně v ročních rozestupech. Eradikační léčba může být použita také ve stadiu II–IV u lymfomů s nízkým stupněm malignity i u lymfomů s vysokým stupněm malignity, před zahájením onkologické léčby [13].
Chirurgická léčba
Názory na léčbu lymfomu žaludku jsou rozdílné, od základní léčebné metody až po odmítání tohoto způsobu léčby. U lokalizovaného nádoru může být jako metoda volby zvolena totální nebo parciální gastrektomie [21,34,35]. Operační léčba vede k dlouhodobým remisím, přináší nám přesnější staging a redukce masy nádoru a tím snížení komplikací, které mohou provázet chemo nebo radioterapie [12,34]. Je metodou volby u akutních stavů, jako jsou krvácení nebo perforace žaludku [34]. Chirurgická léčba může být zvolena jako jediná, ale častěji je doplněna adjuvantní terapií. Z výzkumu vyplývá, že „debulking“ u agresivních tumorů by neměl být indikován z důvodu, že nezlepšuje prognózu nemocných [12]. Jako samostatná metoda by chirurgický zákrok měl být zvolen pouze ve stadiu I, a to totální nebo subtotální gastrektomie. Samozřejmostí je vyšetření resekčních okrajů a rozsahu resekce do zdravé tkáně. Výkon musí být doplněn o lymfadenektomii a omentektomii často i se splenectomií. V poslední době chirurgická léčba ustupuje do pozadí za chemoterapií. U lymfomu střeva je chirurgická léčba volena častěji z důvodu indikací pro akutní stav, jehož příčinou je obstrukce nebo perforace střeva. Při perioperačním podezření na přítomnost lymfomu by měla být provedena radikální resekce s resekcí mezenteriálních uzlin [35]. Celkové pětileté přežívání u nemocných s PGIL po chirurgické léčbě se pohybuje okolo 65−80 %. Prognóza u lymfomu střeva je o něco horší, a to hlavně díky pokročilosti onemocnění. Nejlepší výsledky mají nemocní mladší 60 let, s lokalizovaným stadiem choroby po radikální operaci s R0 resekcí [21].
Kombinovaná léčba
Adjuvantní chemoterapie je obvykle zahajována s odstupem 3 týdnů po operaci [12]. Indikace k podávání se liší od jednotlivých autorů, někteří podávají adjuvantní terapii po všech resekčních operacích, jiní podávají chemoterapii pouze u PGIL s vysokým stupněm malignity po nekurabilní operaci ve stadiu II a vyšším [33].
Radioterapie kombinovaná s chirurgickou léčbou může být použita před operačním řešením k redukci masy nádoru, ale i pooperačním řešením, kdy je histologicky zjištěn pozitivní okraj resekátu, což zvyšuje procento přežívání nemocných [36,37].
Dle studií vyplývá, že chemoterapie kombinovaná s radioterapií je stejně účinná jako operační řešení bez nutnosti resekce žaludku. Může být použita ve všech stadiích onemocnění různého stupně malignity. Většinou se podává 4−6 cyklů chemoterapie s následnou radioterapií [36].
Multimodální přístup má dle některých autorů lepší výsledky, ale i vyšší toxicitu [36].
Chemoterapie
Chemoterapie jako samostatná léčebná jednotka je v dnešní době nejčastěji užívanou léčenou metodou. Metodou volby je hlavně u agresivních lymfomů [37]. U lymfomů žaludku se užívají různé léčebné protokoly dle histologického typu nádoru, často v kombinaci s monoklonálními protilátkami. V první linii chemoterapie se standardně užívají 3−4 cykly R-CHOP (rituximab, cyclophosphamid, doxorubicin, vincristin a prednison). Kompletní remise se dosahuje až po 6–8 cyklech chemoterapie [23,24]. U primárních lymfomů střeva je chemoterapie jako jediná léčebná jednotka volena u pokročilejších stadií onemocnění. Při indikaci k chemoterapii musí být bráno v úvahu, jestli je pacient následně únosný k autologní transplantaci kostní dřeně. Tito pacienti jsou nejčastěji indikováni k R-CHOP nebo R-HyperCVAD (rituximab, cyclophosphamid, doxorubicin, vincristin a dexamethason). Rituximab samotný nebo jeho purinový analog je užíván u pacientů, kteří nejsou indikováni k transplantaci kostní dřeně [38].
Radioterapie
Radioterapie je jako samostatná léčebná metoda volena některými autory před chirurgickým výkonem z důvodu dobré radiosenzitivity nádorů, nižšímu výskytu komplikací a výsledkům pětiletého přežívání [39].
Prognóza
Prognóza primárního gastrointestinálního lymfomu se odvíjí od toho, jestli se jedná o primární lymfom žaludku, který má příznivější prognózu, dále dle invaze, velikosti a histologického typu nádoru [7,21,34,36].
Pětileté přežívání nemocných s primárním lymfomem žaludku, ať už vysoké nebo nízké agresivity, je průměrně 55 %, u lymfomu střeva je o něco nižší, zhruba 45 % [7]. Pro difuzní velkobuněčný B-lymfom byl vyvinut mezinárodní prognostický index, který je užívaný pro stratifikaci prognózy většiny typů non-Hodgkinsových lymfomů [40].
S diagnózou lymfomů se chirurg nejčastěji setká jako s náhodným nálezem. V našem případě jako náhodný nález při elektivní cholecystektomii a při subtotální kolektomii pro náhlou příhodu břišní.
KAZUISTIKA 1
Pacient, 69 let, byl v jiné nemocnici vyšetřován pro 2 měsíce trvající bolesti v epigastriu. Byla provedena gastroskopie, kde byl nález negativní. Poté byl pacient akutně přijat na naše oddělení pro příměs krve ve stolici a nález subileózního stavu na RTG, viz Obr. 1. Na doplněném CT břicha, viz Obr. 2 a 3, bylo vyjádřeno podezření na tumor v oblasti sigmatu. Při přijetí byl nález na břiše fyziologický pouze s palpační citlivostí v levém hypogastriu. Bylo indikováno akutní koloskopické vyšetření, kde byl verifikován tumor v oblasti sigmatu neznámé etiologie a stenóza obtížně průchodná pro koloskop. Vedlejším nálezem bylo velké množství polypů a velký tumor v oblasti caeca. Pacient byl akutně operován pro rozvoj ileózního stavu. Peroperačně byla nalezena invaginace tenkého střeva cca 40 cm před Bauhinskou chlopní s asi 20 cm dlouhou nekrózou tenkého střeva. Palpačně bylo hmatné velké množství slizničních lézí miskovitého tvaru v oblasti celého ilea, dále tumory v oblasti caeca a sigmatu s lymfadenopatií a prorůstáním na peritoneum. Byla provedena peroperační koloskopie, kde byl nález dalších polypózních útvarů v celém průběhu ilea i jejuna. Vzhledem k rozsahu postižení střeva byla indikována resekce nekrotického úseku tenkého střeva přibližně 80 cm a dále pro stenózu sigmatu subtotální kolektomie s ileo-sigmoideo anastomózou. Resekát tenkého střeva byl odeslán k rychlé histologii s výsledkem lymfomu. Rozsáhlejší resekci vzhledem k nálezu lymfomu a rozsahu postižení jsme neindikovali. Operační výkon i pooperační průběh byly dále bez komplikací. Pacient byl propuštěn do domácího ošetřování 17. den. Dále byl pacient předán do péče onkologické kliniky k dovyšetření a další terapii.
Dle dostupných zpráv pacient nyní podstupuje onkologickou léčbu v jiném nemocničním zařízení, výsledky zatím nejsou známy.
Obr. 1. Nativní RTG snímek břicha: distenze kliček v oblasti jejuna ve středním mesogastriu se širšími hladinami. Obstrukce na přechodu jejuna a ilea, počínající vysoký ileus. Fig. 1: Plain abdominal radiograph: distended, fluid-filled jejunal intestinal loops in the middle mesogastrium. Small bowel obstruction in the jejuno-ileal transition and incipient ileus. 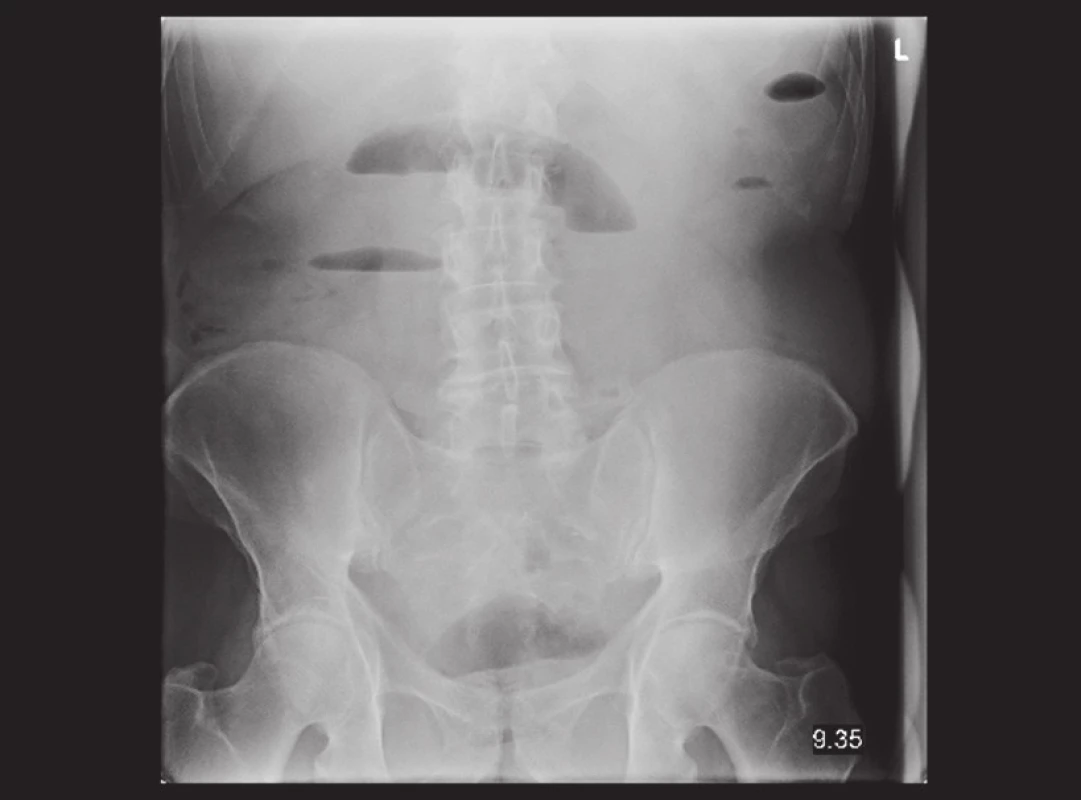
Obr. 2. CT břicha − nativně a postkontrastně: v oblasti malé pánve patrné solidní ložisko velikosti 67x63x58mm− jde s velkou pravděpodobností o TU colon sigmoideum. Divertikulosa orálního sigmoidea. Fig. 2: Nonenhanced and contrast-enhanced abdominal CT scan: a solid mass measuring 67x63x58 mm located in the lesser pelvis – very probably an image of a sigmoid colon tumor. Diverticulosis of the proximal sigmoid colon. 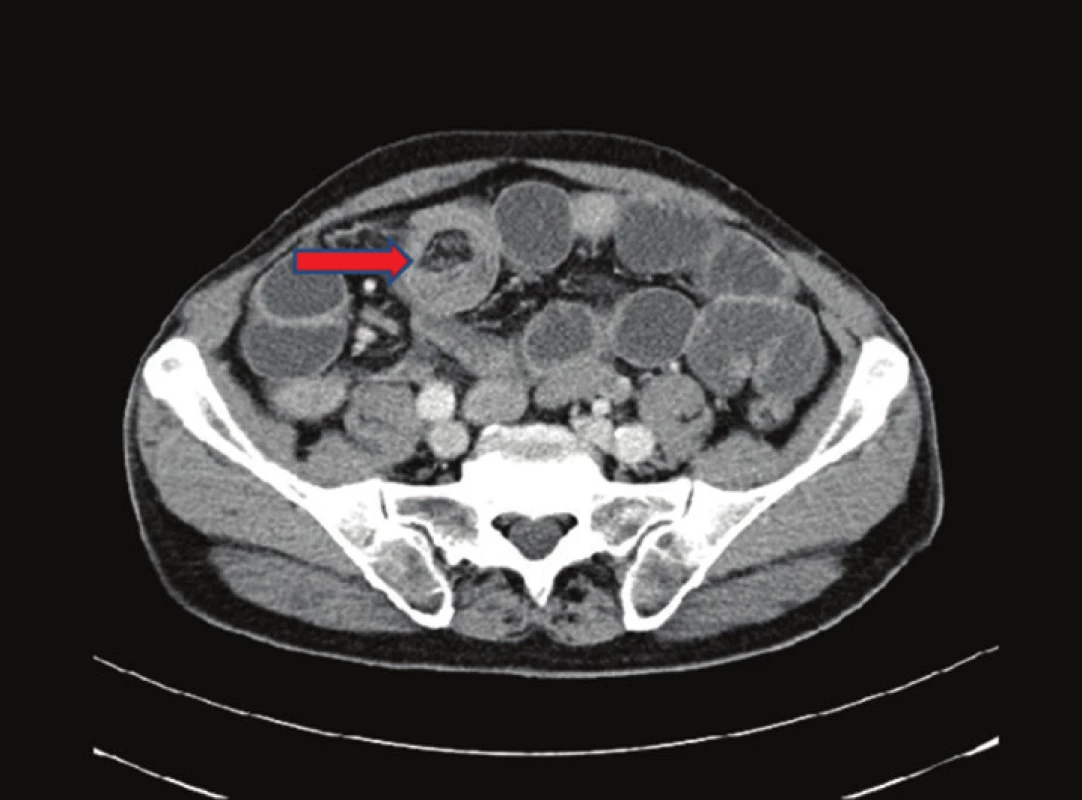
Obr. 3. CT břicha − nativně a postkontrastně: ileocekálně invaginace v délce zhruba 10 cm. Tenké kličky jsou kromě krátkého úseku prvních kliček ilea distendované až na 37 mm, obraz ileu. Fig. 3: Nonenhanced and contrast-enhanced abdominal CT scan: ileocaecal invagination affecting approximately 10 cm of the intestine. The small bowel loops are distended up to 37 mm with the exception of a short segment of the first few loops. Image of acute bowel obstruction. 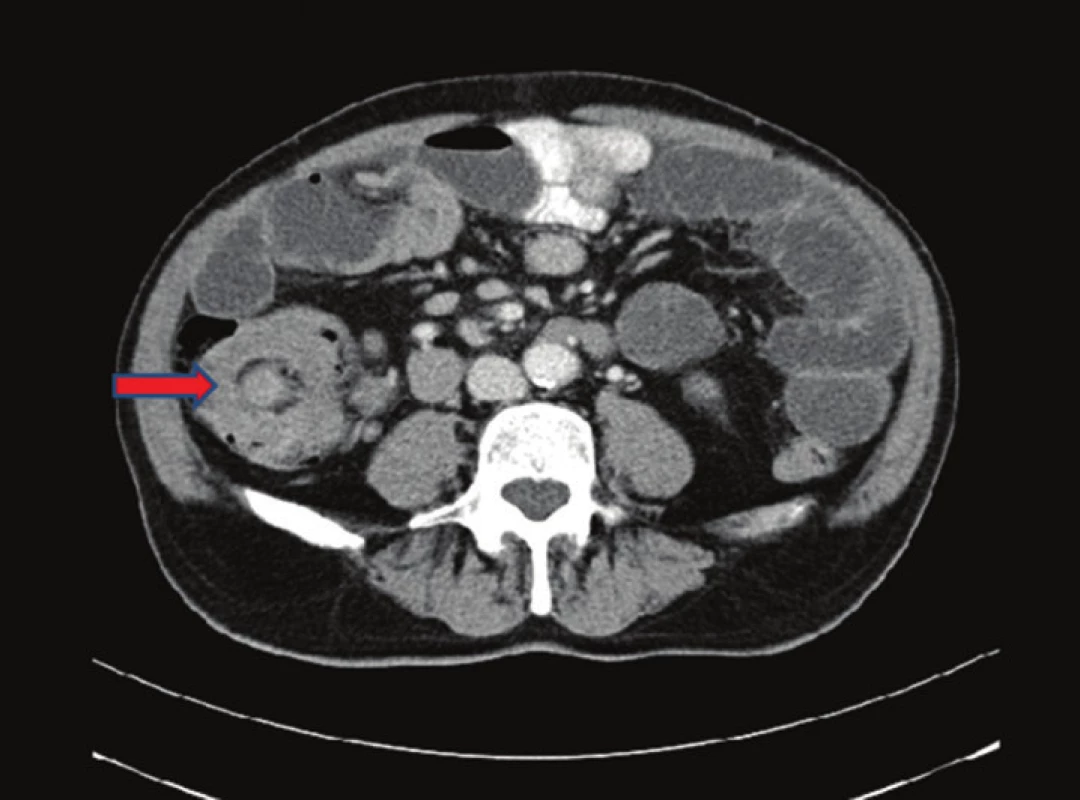
KAZUISTIKA 2
Pacient, 69 let, byl přijat k plánovanému operačnímu výkonu pro těžkou chronickou akalkulózní cholecystitidu. Pacient udával asi 2 měsíce trvající bolesti v epigastriu a pokles hmotnosti o 5 kilogramů za 2 měsíce. V předoperačním období bylo provedeno sonografické vyšetření a CT vyšetření, viz Obr. 4 a, b. Na základě výsledků zobrazovacích metod bylo stanoveno podezření na tumor. Nález na břiše při přijetí pacienta byl zcela klidný, s drobnou pupeční kýlou. Pacient byl indikován k laparoskopické cholecystektomii s případnou konverzí dle peroperačního nálezu. Peroperačně byl nalezen žlučník prosáklý, hydropický s chronickými zánětlivými změnami odpovídající spíše chronické cholecystitidě, viz Obr. 5. Z tohoto důvodu byl operační výkon dokončen laparoskopicky. Operace i další pooperační průběh proběhly bez komplikací a pacient byl druhý den propuštěn do domácího ošetřování. Histologický výsledek překvapivě poukázal na lymfom žlučníku. Z toho důvodu byl pacient předán k další péči do specializovaného hematoonkologického pracoviště, kde byl indikován pouze k dispenzarizaci v onko-chirurgické ambulanci. Pacient je dispenzarizován na našem chirurgickém pracovišti. Od operačního výkonu z roku 2016 je dosud bez komplikací a bez známek relapsu onemocnění.
Obr. 4 a, b: CT břicha a pánve nativně a postkontrastně: difusní zesílení stěny žlučníku bez patologické infiltrace okolních anatomických struktur – chronické zánětlivé změny či tumor žlučníku nelze v CT obraze odlišit. Zvětšená lymfatická uzlina při hilu jater. Fig. 4 a, b: Nonenhanced and contrast-enhanced abdominal CT scan: diffuse thickening of the gallbladder wall without any apparent pathological infiltration of the surrounding anatomical structures – possible chronic inflammatory changes or a gallbladder tumor cannot be reliably differentiated in a CT image. Enlarged lymph node close to the liver hilum. 
Obr. 4. Roztřižený preparát žlučníku Fig. 5: Cut-open specimen of the gallbladder 
ZÁVĚR
Primární gastrointestinální lymfom nepatří mezi častá nádorová onemocnění a v některých oblastech gastrointestinálního traktu je přímo raritní. Z posledních studií vyplývá, že chirurgická léčba ustupuje do pozadí za systémovou terapií. V systémové terapii dominuje chemoterapie, a to hlavně v pokročilých stadiích u agresivních lymfomů. Chirurgická léčba je primárně indikovaná u komplikací projevujících se perforací, obstrukcí nebo krvácením, v případech, kdy nelze získat histologický vzorek ke stanovení definitivní diagnózy, u pacientů s nedostatečnou odpovědí na onkologickou léčbu či při progresi onemocnění během systémové terapie. Dále se chirurg může setkat s lymfomem jako náhodným nálezem při elektivních operacích, kde nebyla primárně stanovena diagnóza lymfomu.
Z našich poznatků vyplývá, že i když systémová terapii převládá v léčbě pacientů s PGI a nezatěžuje pacienty chirurgickým zákrokem či operačními komplikacemi, má chirurgie nezastupitelné místo v léčbě PGI, a to hlavně u komplikací onemocnění. Dále se může zvážit jako jediné řešení i u lokalizovaných stadií onemocnění, viz kazuistika, kdy relativně jednoduchá operace může být dostatečná a pacient naopak není zatížen systémovou léčbou.
Seznam použitých zkratek
PGI – primární gastrointestinální lymfom
REAL klasifikace – Revised European and American Lymphoma Classification
CT – počítačová tomografie
GIT – gastrointestinální trakt
MALT – mucosa-associated lymphoid tissue
ATB – antibiotika
ERCP – endoskopická retrográdní cholangiopankreatikografie
R0 resekce – kompletní chirurgická resekce ve zdravé tkáni
RTG – rentgen
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Ladislav Sojka
Chirurgická klinika 1. LF UK,
Thomayerova nemocnice v Praze
Vídeňská 800
140 59 Praha 4 – Krč
e-mail: ladislav.sojka@centrum.cz
Zdroje
1. Ústav zdravotních informací a statistiky: Novotvary 2014 ČR, Cancer Incidence in the Czech Republic. 2014;160 : 86, available from: http://www.uzis.cz/node/7686.
2. Freeman C, Berg JW, Cutler SJ. Occurrence and prognosis of extranodal lymphomas. Cancer 1972;29 : 252–60.
3. Herrmann R, Panahon AM, Barcos MP, et al. Gastrointestinal involvement in non-Hodgkin lymphoma. Cancer 1980;46 : 215–22.
4. Dawson IM, Cornes JS, Morson BC. Primary malignant lymphoid tumours of the intestinal tract. Report of 37 cases with a study of factors influencing prognosis. Br J Surg 1961;49 : 80–9.
5. Müller AM, Ihorst G, Mertelsmann R, et al. Epidemiology of non-Hodgkin‘s lymphoma (NHL): trends, geographic distribution, and etiology. Ann Hematol 2005;84 : 1–12.
6. Schechter NR, Yahalom J. Low-grade MAL T lymphoma of the stomach: A review of treatment options. Int J Rad Oncol Biol Phys, 2000;46 : 1093−1103.
7. Radaszkiewicz T, Dragosics B, Bauer P. Gastrointestinal malignant lymphomas of the mucosa-associated lymphoid tissue: Factors relevant to prognosis. Gatroenterol 1992;102 : 1628−38.
8. Di Raimondo F, Caruso L, Bonanno G, et al. Is endoscopic ultrasound clinically useful for follow-up of gastric lymphoma? Ann Oncol 2007;18 : 351–6.
9. Harris NL, Jaffe ES, Diebold J, et al. Lymphoma classification − from controversy to consensus: The R.E.A.L. and WHO Classification of lymphoid neoplasms. Ann Oncol 2000, ll(Suppl.l): S3-S10.
10. Zucca E, Roggero E, Bertoni F, et al. Primary extranodal non-Hodgkin‘s lymphomas. Part 1: Gastrointestinal, cutaneous and genitourinary lymphomas. Ann Oncol 1997;8 : 727−37.
11. Papaxoinis G, Papageorgiou S, Rontogianni D, et al. Primary gastrointestinal non-Hodgkin lymphoma: a clinicopathologic study of 128 cases in Greece. A Hellenic Cooperative Oncology Group study (HeCOG) Leuk Lymphoma 2006;47 : 2140–46.
12. Ruskoné-Fourmestraux A, Delmer A, Lavergne, et al. Multiple lymphomatous polyposis of the gastrointestinal tract: Prospective clinicopathologic study of 31 cases. Gastroenterol 1997;112 : 7−16.
13. Morgner A, Bayerdorffer E, Neubauer A, et al. Gastric MAL T lymphoma and its relationship to Helicobacter pylori infection: Management and pathogenesis of the disease. Micr Res Technique 2000;48 : 349−56.
14. Kolve M, Fischbach W, Greiner A, et al. Differences in endoscopic and clinicopathological features of primary and secondary gastric non-Hodgkin‘s lymphoma. Gastroint Endoscopy 1999;49 : 307−15.
15. Ansell SM, Armitage J. Non-Hodgkin lymphoma: diagnosis and treatment. Mayo Clin Proc 2005;80 : 1087–97.
16. Pavlick AC, Gerdes H, Portlock CS. Endoscopic ultrasound in the evaluation of gastric small lymphocytic mucosa-associated lymphoid tumors. J Clin Oncol 1997;15 : 1761−6.
17. Cho MJ, Ha ChS, Allen PK, et al. Primary non-Hodgkin‘s lymphoma of the large bowel. Radiology 1997;205 : 535−9.
18. Kemp S, Gallagher G, Kabani S, et al. Oral non-Hodgkin lymphoma: review of the literature and World Health Organization classification with reference to 40 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008;105 : 194–201.
19. Quiñones-Avila Mdel P, Gonzalez-Longoria AA, Admirand JH, et al. Hodgkin lymphoma involving Waldeyer ring: a clinicopathologic study of 22 cases. Am J Clin Pathol 2005;123 : 651–6.
20. Weeratunge CN, Bolivar HH, Anstead GM, et al. Primary esophageal lymphoma: a diagnostic challenge in acquired immunodeficiency syndrome − two case reports and review. South Med J 2004;97 : 383–7.
21. Ernst M, Stein H, Ludwig D, et al. Surgical therapy of gastrointestinal non-Hodgkin‘s lymphomas. Eur J Surg Oncol 1996;22 : 177−81.
22. Stathis A, Chini C, Bertoni F, et al. Long-term outcome following Helicobacter pylori eradication in a retrospective study of 105 patients with localized gastric marginal zone B-cell lymphoma of MALT type. Ann Oncol 2009;20 : 1086–93.
23. Ferrucci PF, Zucca E. Primary gastric lymphoma pathogenesis and treatment: what has changed over the past 10 years? Br J Haematol 2007;136 : 521–38.
24. Park HS, Kim YJ, Yang WI, et al. Treatment outcome of localized Helicobacter pylori-negative low-grade gastric MALT lymphoma. World J Gastroenterol 2010; 16 : 2158–62.
25. Schottenfeld D, Beebe-Dimmer JL, Vigneau FD. The epidemiology and pathogenesis of neoplasia in the small intestine. Ann Epidemiol 2009;19 : 58–69.
26. Thieblemont C, Bastion Y, Berger F, et al. Mucosa-associated lymphoid tissue gastrointestinal and nongastrointestinal lymphoma behavior: Analysis of 108 patients. J Clin Oncol 1997;15 : 1624−30.
27. Dickson BC, Serra S, Chetty R. Primary gastrointestinal tract lymphoma: diagnosis and management of common neoplasms. Expert Rev Anticancer Ther 2006;6 : 1609–28.
28. Lokich JJ, Kane RA, Harrison DA, et al. Biliary tract obstruction secondary to cancer: management guidelines and selected literature review. J Clin Oncol 1987;5 : 969–81.
29. Nguyen GK. Primary extranodal non-Hodgkin‘s lymphoma of the extrahepatic bile ducts. report of a case. Cancer 1982;50 : 2218–22.
30. Ferluga D, Luzar B, Gadžijev EM. Follicular lymphoma of the gallbladder and extrahepatic bile ducts. 2002 Virchows Arch 2003;442 : 136.
31. Mitropoulos FA, Angelopoulou MK, Siakantaris MP, et al. Primary non-Hodgkin‘s lymphoma of the gall bladder. Leuk Lymphoma 2000;40 : 123−31, available from: https://www.ncbi.nlm.nih.gov/pubmed/11426613
32. Begum S, Sáno T, Endo H, et al. Mucosal change of the stomach with low-grade mucosa-associated lymphoid tissue lymphoma after eradication of Helicobacter pylori: Follow-up study of 48 cases. J Med Invest 2000;47 : 36–46.
33. Nakamura T, Nakamura S, Yonezumi M, et al. Helicobacter pylori and the t(l I;18)(q21;q21) translocation in gastric low-grade B-cell lymphoma of mucosa-associated lymphoid tissue type. Jpn J Cancer Res 2000;91 : 301−9.
34. Kodera Y, Yamamura Y, Nakamura S, et al. The role of radical gastrectomy with systematic lymphadenectomy for the diagnosis and treatment of primary gastric lymphoma. Annals Surg 1998;227 : 45−50.
35. Steinau G, Riesener KP, Schleef J, et al. Primary non-Hodgkin lymphoma of the stomach – role of surgery. Hepatogastroenterology 1997;44 : 1513−18.
36. Amer MH, El-Akkad S. Gastrointestinal lymphoma in adults: Clinical features and management of 300 cases. Gastroenterol 1994;106 : 846−58.
37. Popescu RA, Wotherspoon AC, Cunningham D, et al. Surgery plus chemotherapy or chemotherapy alone for primary intermediate - and high-grade gastric non-Hodgkin‘s lymphoma: the Royal Marsden Hospital Experience. Eur J Cane 1999;35 : 928−34.
38. Ogura M. Current treatment strategy and new agents in mantle cell lymphoma. Int J Hematol 2010;92 : 25–32.
39. Brincker H, D‘Amore F. For the Danish Lymphoma Study Group, Lyfo: A retrospective analysis of treatment outcome in 106 pases of localised gastric non-Hodgkin‘s lymphomas. Leuk Lymph 1995;18 : 281−8.
40. Giné E, Montoto S, Bosch F, et al. The Follicular Lymphoma International Prognostic Index (FLIPI) and the histological subtype are the most important factors to predict histological transformation in follicular lymphoma. Ann Oncol 2006;17 : 1539–45.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Česká lůžková chirurgieČlánek Zemřel profesor KrálíkČlánek Miniinvazivní resekce jaterČlánek Volvulus žlučníku
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Česká lůžková chirurgie
- Primární lymfomy zažívacího traktu z pohledu chirurga
- Zemřel profesor Králík
- Miniinvazivní resekce jater
- Duální transplantace ledvin – zkušenosti jednoho centra
- Jednoduchá technika perkutánního podvazu akcesorních žil hemodialyzačních zkratů
- Invaginace u dospělého jako vzácná příčina náhlé příhody břišní – 2 kazuistiky
- Subclavian-steal recovery carotid fenomén − „ old school“ chirurgické řešení
- Volvulus žlučníku
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Invaginace u dospělého jako vzácná příčina náhlé příhody břišní – 2 kazuistiky
- Miniinvazivní resekce jater
- Volvulus žlučníku
- Subclavian-steal recovery carotid fenomén − „ old school“ chirurgické řešení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



