-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Maligní nádory tenkého střeva
Malignant tumors of the small bowel
Introduction:
Malignant tumors of the small bowel are relatively uncommon neoplasms; their incidence is around 1.5 per 100,000 inhabitants in the Czech Republic.Method:
104 patients underwent a resection of the small bowel because of a primary or secondary tumor over the 10-year period between 2006−2015 at the Masaryk Memorial Cancer Institute. Data from these patients was reviewed retrospectively. Survival rates were analyzed using the Kaplan-Meier method.Results:
We observed 45 primary and 59 secondary tumors. The group of primary malignancies included 12 adenocarcinomas, 14 cases of GIST and 19 cases of NET. Neuroendocrine tumors showed the best prognosis with a 62% probability of five-year survival. Patients with gastrointestinal stromal tumors had a 39% probability of five-year survival and those with adenocarcinomas had a 32% probability of five-year survival. Secondary tumors were caused mostly by metastatic colorectal carcinoma (22 times), malignant melanoma (11 times) and ovarian cancer (10 times). The probability of five-year survival was 15% in the group of secondary tumors.Conclusion:
Malignant tumors of the small intestine are rare, but their incidence has increased in the last decades. The main prognostic factors include advancement of the tumor and radicality of surgical resection.Key words:
small bowel tumors – adenocarcinoma – sarcoma – NET – GIST – lymphoma
Autoři: L. Němec 1; P. Fabian 2; J. Tomášek 3
; Jiří Jarkovský 4
; R. Šefr 1; L. Fiala 1
Působiště autorů: Klinika operační onkologie LF Masarykovy univerzity a Masarykova onkologického ústavu Brno přednosta doc. MUDr. R. Šefr, Ph. D. 1; Oddělení onkologické patologie, Masarykův onkologický ústav Brno primář MUDr. P. Fabian, Ph. D. 2; Klinika komplexní onkologické péče LF Masarykovy univerzity a Masarykova onkologického ústavu Brno přednosta prof. MUDr. R. Vyzula, CSc. 3; Institut biostatistiky a analýz Masarykovy univerzity Brno ředitel doc. RNDr. L. Dušek, Ph. D. 4
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 6, s. 252-259.
Kategorie: Původní práce
Souhrn
Úvod:
Maligní nádory tenkého střeva jsou poměrně vzácné, incidence v ČR se pohybuje okolo 1,5/100 000 obyvatel.Metoda:
V Masarykově onkologickém ústavu jsme v desetiletém období 2006–2015 uskutečnili 104 resekční operace pro diagnózu maligního nádoru tenkého střeva, tento soubor jsme zhodnotili retrospektivně. Odhad pravděpodobnosti přežití byl proveden pomocí Kaplan-Meierovy analýzy.Výsledky:
Z uvedeného počtu bylo 45 nádorů primárních a 59 sekundárních. U primárních nádorů se jednalo ve 12 případech o adenokarcinom, ve 14 o GIST, v 19 případech o NET. Z primárních nádorů tenkého střeva měly nejlepší prognózu neuroendokrinní nádory s pravděpodobností pětiletého přežití 62 %, u gastrointestinálních stromálních tumorů byla pravděpodobnost přežití 39 %, u karcinomů 32 %. Sekundární nádory byly způsobeny nejčastěji metastazováním kolorektálního karcinomu (22x), maligního melanomu (11x) a karcinomu ovaria (10x). Pravděpodobnost pětiletého přežití u pacientů se sekundárním nádorem tenkého střeva byla 15 %.Závěr:
Výskyt zhoubných nádorů tenkého střeva není častý, jejich incidence ale v posledních desetiletích zvolna narůstá. Zásadními prognostickými faktory jsou pokročilost onemocnění a radikalita provedeného chirurgického výkonu.Klíčová slova:
nádory tenkého střeva – adenokarcinom – sarkom – NET – GIST – lymfomÚVOD
Zhoubné nádory tenkého střeva se vyskytují vzácně. Tvoří 0,1 až 0,3 % všech maligních novotvarů a pouze 1,4 % nádorů GIT [1], a to navzdory tomu, že tenké střevo představuje 75 % délky trávicí trubice a 90 % její resorpční plochy. Vysvětlením této skutečnosti se zabývají hypotézy, zohledňující množství tenkostřevního sekretu, jeho pH, rychlost pasáže, bakteriální osídlení a další faktory [2].
Incidence primárních nádorů tenkého střeva je ve vyspělých zemích vyšší než v zemích rozvojových, v západní civilizaci je to 0,5−1/100 000 obyvatel. V České republice se incidence těchto nádorů pohybuje okolo 1,5/100 000 obyvatel, což je podle údajů ÚZIS počet zhruba trojnásobný oproti období před 40 lety. V roce 2013 bylo v ČR hlášeno 180 nových případů zhoubných nádorů tenkého střeva, 75 jedinců na tuto diagnózu zemřelo.
Primární maligní nádory tenkého střeva představují heterogenní patologickou skupinu s rozdílným biologickým chováním. Patří sem adenokarcinomy (40 %), neuroendokrinní nádory – NET (30 %), lymfomy (15 %) a mezenchymální nádory (15 %) – sarkomy a gastrointestinální stromální nádory (GIST) [3]. Tenké střevo je taktéž místem výskytu sekundárních nádorů, metastazuje sem nejčastěji maligní melanom a karcinomy (tlustého střeva, prsu, vaječníků a ledvin).
Klinická symptomatologie nádorů tenkého střeva je nespecifická, přítomny bývají rozličné dyspeptické stesky, křeče břicha, úbytek tělesné hmotnosti, nauzea a zvracení, nádory se mohou projevit i náhlou příhodou břišní – krvácením do GIT, perforací nebo obstrukcí. Ke krvácení mají největší sklon gastrointestinální stromální nádory, k obstrukci neuroendokrinní nádory, k perforaci lymfomy [4]. Specificky se projevují neuroendokrinní nádory v případě své sekreční hormonální aktivity.
Diagnostika nádorů tenkého střeva není snadná, nezřídka bývá předoperačně nejasná. Nejčastěji se diagnóza stanovuje na podkladě zobrazovacích metod – CT, MR, eventuálně PET; bez předoperační histologické klasifikace. Endoluminální vyšetřovací metody, jako jsou dvoubalonková enteroskopie, kapslová endoskopie a enteroklýza, jsou přínosné, ale jejich dostupnost je relativně malá. Biopsie těchto nádorů mnohdy není technicky možná, anebo je riziková (porušení nádorové kapsuly u GIST může vést k peritoneální diseminaci). Slibnými vyšetřovacími metodami jsou CT a MR kolografie. Invazivní, ale suverénní diagnostickou metodou je peroperační enteroskopie.
Základní terapeutickou metodou primárních i sekundárních nádorů tenkého střeva je radikální chirurgická resekce, kterou je nutné sdružit s regionální lymfadenektomií (výjimkou jsou GIST). Systémová léčba je indikovaná u lymfomů a u vybraných případů GIST a adenokarcinomů (dle klinického stadia).
METODA
V Masarykově onkologickém ústavu jsme v desetiletém období 2006−2015 retrospektivně zhodnotili soubor 104 pacientů, u nichž jsme uskutečnili resekční výkon pro diagnózu primárního nebo sekundárního maligního nádoru tenkého střeva. Do souboru jsme nezařadili pacienty, u nichž nebyl vzhledem k pokročilosti onemocnění indikován kurativní ani paliativní resekční výkon. Odhad pravděpodobnosti přežití byl proveden pomocí Kaplan-Meierovy analýzy.
VÝSLEDKY
V hodnoceném souboru pacientů s malignitou tenkého střeva jsme zaznamenali 45 nádorů primárních a 59 nádorů sekundárních. Věkové rozložení a rozložení podle pohlaví jsou znázorněny v tabulkách (Tab. 1, Tab. 2).
Tab. 1. Věkové rozložení Tab. 1: Age distribution 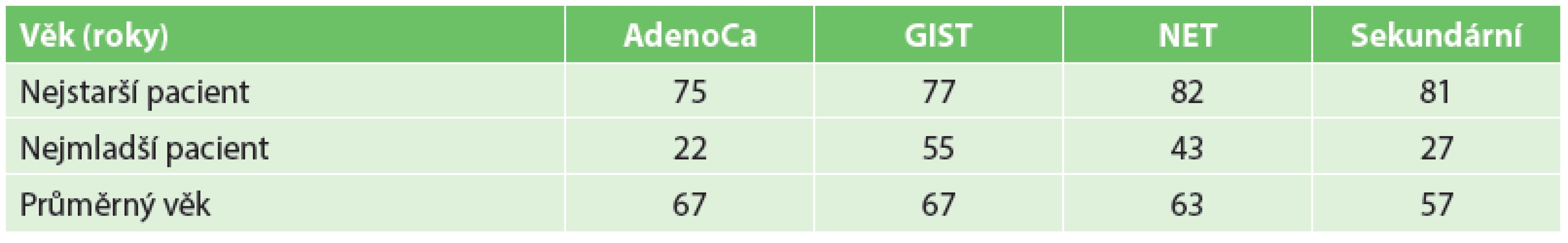
Tab. 2. Rozložení podle pohlaví Tab. 2: Gender distribution 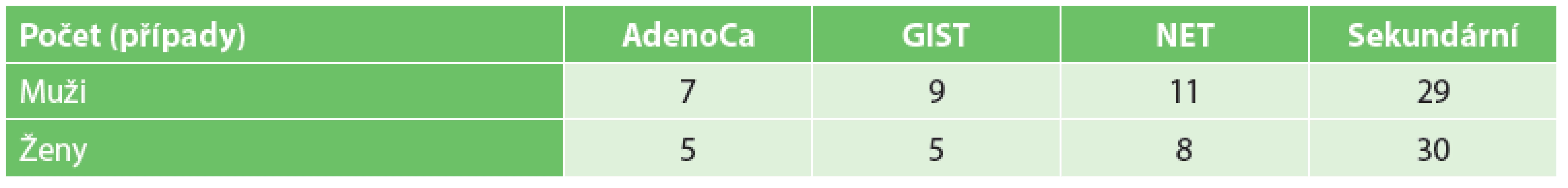
Lokalizace a typy primárních nádorů jsou zobrazeny v tabulce (Tab. 3). Lymfom ani sarkom jsme nezaznamenali žádný.
Tab. 3. Primární maligní nádory tenkého střeva Tab. 3: Primary malignant tumors of the small bowel 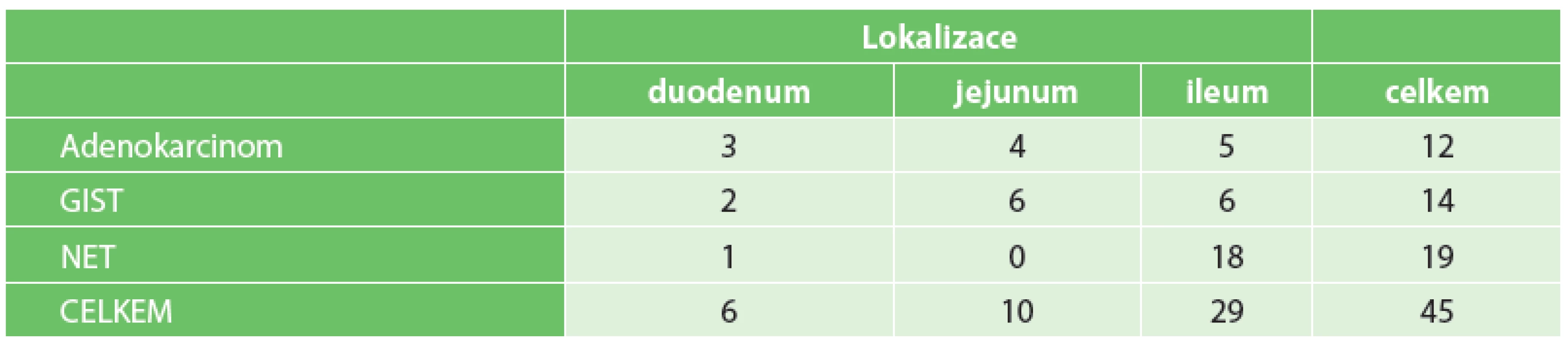
U pacientů s primárním adenokarcinomem tenkého střeva jsme provedli v devíti případech (75 %) resekci v oblasti jejuna a ilea, u duodenálního karcinomu ve dvou případech (17 %) resekci v oblasti D3/D4 a jedenkrát (8 %) hemipankreatoduodenektomii. Pacienti se ve čtyřech případech (33 %) nacházeli v klinickém stadiu II, ve čtyřech případech (33 %) v klinickém stadiu III a ve čtyřech případech (33 %) v klinickém stadiu IV. Adekvátně stadiu onemocnění nemocní podstoupili adjuvantní chemoterapii. Pravděpodobnost pětiletého přežití ve skupině pacientů s primárním adenokarcinomem byla 32 %.
U pacientů s gastrointestinálním stromálním tumorem jsme ve dvanácti případech (85 %) provedli resekci jejuna nebo ilea a dvakrát (15 %) hemipankreatoduodenektomii. Podle histopatologického gradingu se jednalo v sedmi případech (50 %) o GIST s nízkým maligním potenciálem (ve všech sedmi případech klinické stadium II), v sedmi případech (50 %) o GIST s vysokým rizikem agresivního chování (čtyřikrát klinické stadium III tj. 29 %, třikrát klinické stadium IV tj. 21 %). Adjuvantně byl u pacientů s GIST s vysokým maligním potenciálem a u pacientů s metastatickým onemocněním podáván imatinib. Pravděpodobnost pětiletého přežití ve skupině pacientů s primárním GIST tenkého střeva byla 39 %.
U pacientů s neuroendokrinním nádorem jsme v osmnácti případech (95 %) provedli resekci ilea, jedenkrát (5 %) resekci duodena. Třináct pacientů (68 %) mělo dobře diferencovaný NET, šest pacientů (32 %) NET špatně diferencovaný. Osm pacientů (42 %) trpělo karcinoidovým syndromem s nutností podávání somatostatinových analog. Pravděpodobnost pětiletého přežití ve skupině pacientů s primárním NET tenkého střeva byla 62 %.
Lokalizace a typy sekundárních nádorů jsou zobrazeny v tabulce (Tab. 4). Pacienti se sekundárními nádory tenkého střeva měli nejhorší prognózu, s pravděpodobností pětiletého přežití 15 %.
Tab. 4. Sekundární maligní nádory tenkého střeva Tab. 4: Secondary malignant tumors of the small bowel 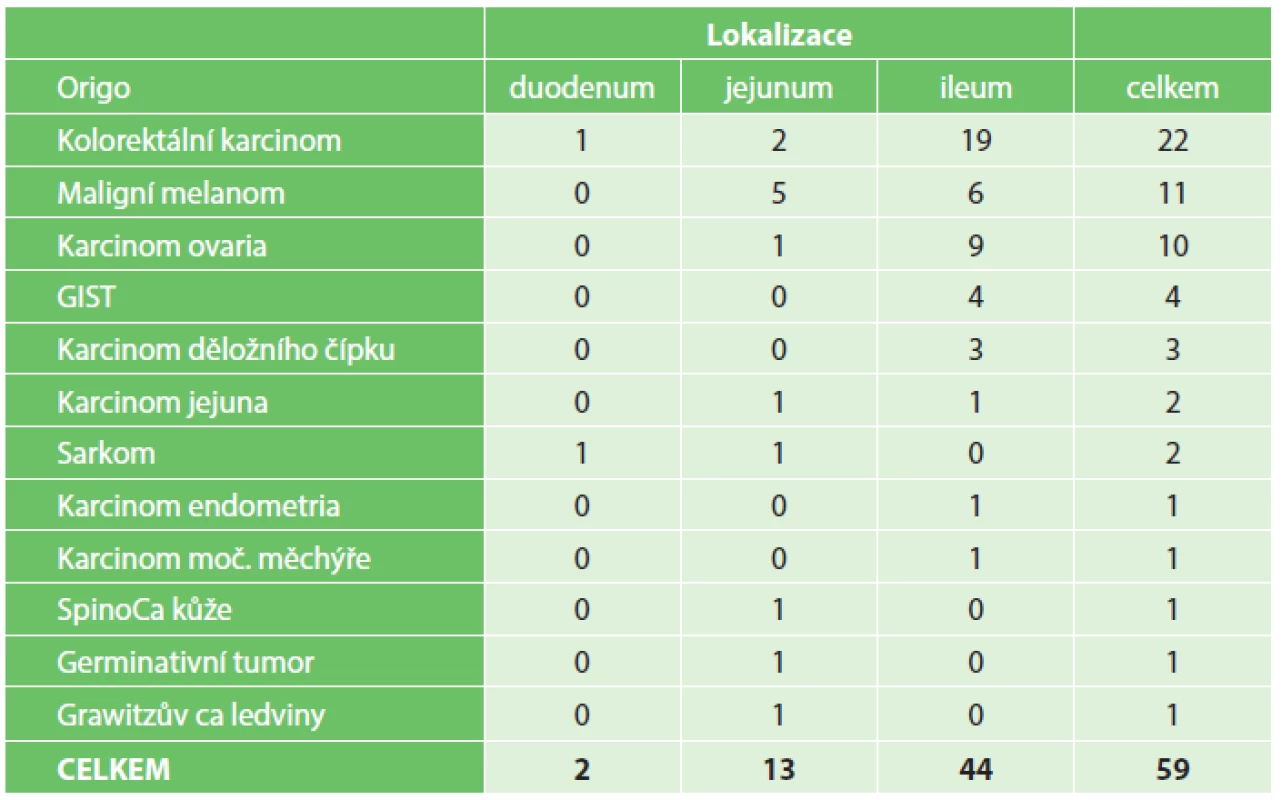
Obrázky (Obr. 1–4) zobrazují fotografie resekátů. Pravděpodobnost přežití podle Kaplan-Meierovy analýzy znázorňují grafy (Graf 1, Graf 2).
Obr. 1. Adenokarcinom duodena Fig. 1: Adenocarcinoma of the duodenum 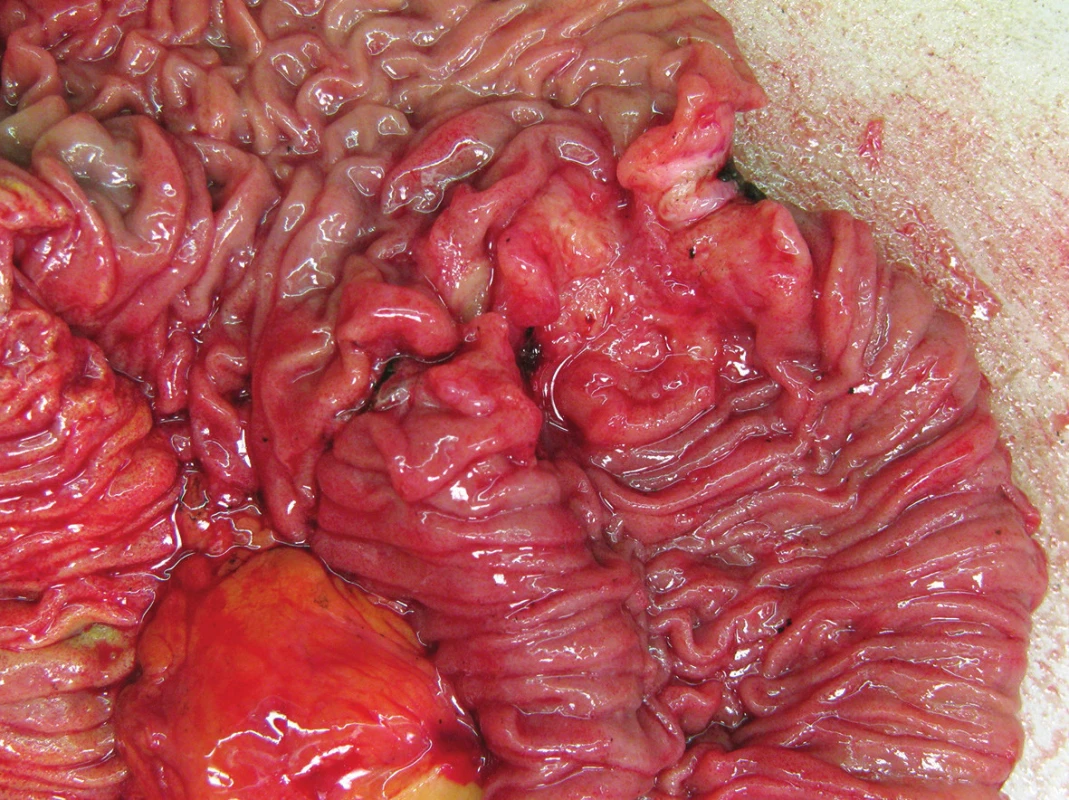
Obr. 2. Neuroendokrinní tumor ilea Fig. 2: Neuroendocrine tumor of the ileum 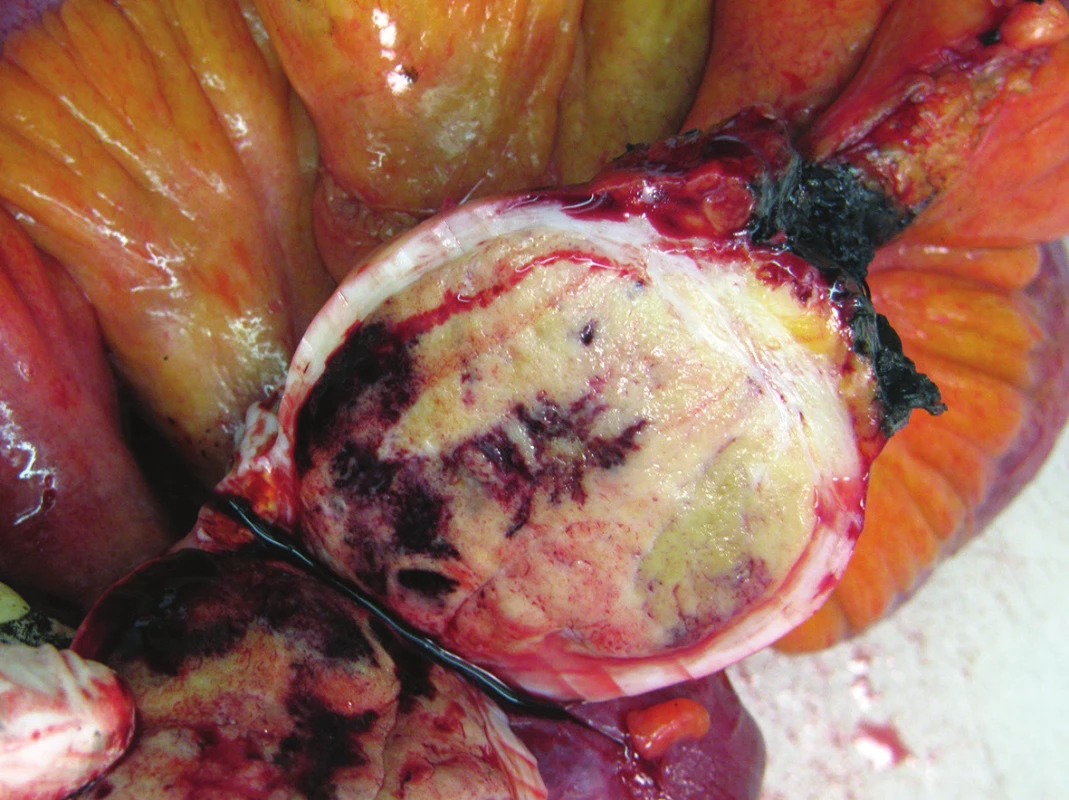
Obr. 3. Gastrointestinální stromální tumor ilea Fig. 3: Gastrointestinal stromal tumor of the ileum 
Obr. 4. Perforovaný T-lymfom jejuna Fig. 4: Perforated T-lymphoma of the jejunum 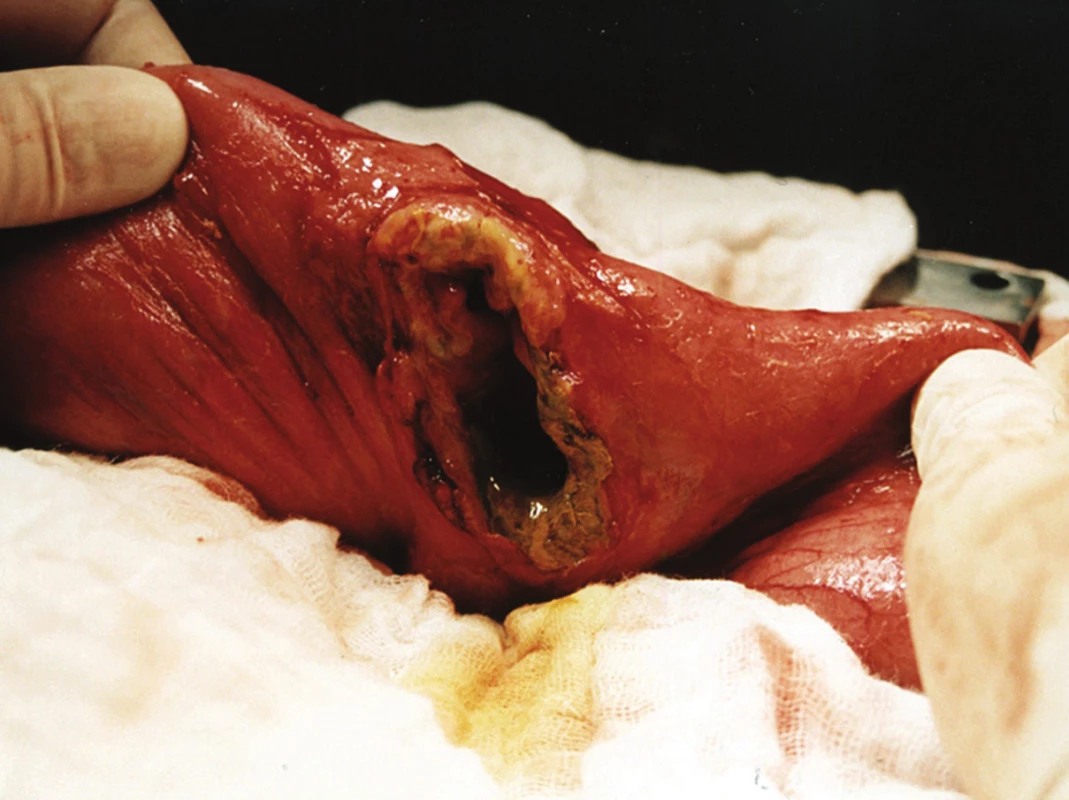
Graf 1. Odhad přežití u primárních a sekundárních nádorů tenkého střeva Graph 1: Survival rates for primary and secondary tumors of the small bowel 
Graf 2. Pravděpodobnost přežití ve skupině primárních nádorů tenkého střeva Graph 2: Probability of survival in the group with primary tumors of the small bowel 
DISKUZE
Adenokarcinomy
Tvoří 40 % všech maligních nádorů tenkého střeva. Přibližně polovina adenokarcinomů vzniká v duodenu, třetina v jejunu a pětina v ileu. Vyvíjejí se často maligním zvratem adenomů, bývají součástí hereditárních polypózních i nepolypózních syndromů (FAP, Lynchův syndrom, Peutz-Jeghersův syndrom), zvýšené riziko mají pacienti s Crohnovou chorobou, s celiakální sprue, s imunosupresivními syndromy a s vývojovými vadami střevními (Meckelův divertikl). Maligní zvrat může nastat i v ileostomii nebo v ileálním pouchi. Z exogenních vlivů se jako rizikový uvádí vyšší příjem živočišných tuků a potravin konzervovaných uzením a solením, dále vliv ionizujícího záření (stavy po radioterapii). Vztah tabáku a alkoholu ke vzniku adenokarcinomu tenkého střeva jednoznačně prokázán nebyl [6,7]. U více než 50 % pacientů je přítomna mutace onkogenu c-K-RAS a u 40 % zvýšená exprese cyklinu D1 (CCND1) [1]. Adenokarcinomy tenkého střeva metastazují nejčastěji do jater a do plic, výjimečně do kostí a do mozku.
Biologické chování karcinomů tenkého střeva je podobné, jako je tomu u kolorektálního karcinomu, podobná je i jejich léčba – základem je radikální chirurgická resekce zahrnující makroskopicky nepostižené střevo 10 cm orálně i aborálně od tumoru [8] spolu s regionální lymfadenektomií. Pokud není možná kurativní resekce, je na místě provedení paliativní limitované resekce s anastomózou nebo stomií, popřípadě operace bypassová. V oblasti duodena lze velmi časné nádory řešit endoskopickými technikami, většinou je ale při postižení D1 a D2 nutná pankreatoduodenektomie.
Vzhledem k nízké incidenci adenokarcinomů tenkého střeva nebyly prováděny větší prospektivní studie protinádorovou farmakoterapií; případná adjuvantní chemoterapie je analogická adjuvantní systémové léčbě kolorektálního karcinomu – na bázi 5-fluorouracilu, oxaliplatiny a irinotekanu (režimy FOLFOX, XELOX, FOLFIRI) [3]. U neresekabilních tenkostřevních nádorů je indikována paliativní chemoterapie. Radioterapie se využívá k iradiaci vzdálených metastáz.
Pětileté přežití u adenokarcinomů se uvádí v rozmezí 30−35 %, u pacientů po radikální resekci se zvyšuje na 40−60 %, nemocní s paliativní systémovou léčbou přežívají 11−13 měsíců [2]. U karcinomů tenkého střeva s peritoneální diseminací je na místě zvážení cytoreduktivní operace spolu s hypertermickou intraperitoneální chemoterapií (HIPEC), s popsaným prodloužením pooperačního přežití z 12 na 40 měsíců [9,10].
Neuroendokrinní nádory − NET
Tvoří třetinu primární maligních nádorů tenkého střeva. Vznikají maligním zvratem neuroendokrinních střevních buněk, které jsou zodpovědné za regulaci střevní peristaltiky a zpětnou resorpci vody [11]. Tyto nádory poprvé popsal v roce 1907 Oberndorfer, označil je termínem „Karzinoid“ [12]. V roce 2010 došlo na doporučení Světové zdravotnické organizace (WHO) ke změně terminologie a výraz „karcinoid“ byl nahrazen označením „neuroendokrinní tumor“, resp. „neuroendokrinní karcinom“ [13].
NET mohou být klinicky řadu let zcela němé. K nespecifickým příznakům, tak jak jsou popisovány u všech nádorů tenkého střeva, se nadto mohou připojit symptomy z hormonální aktivity, pokud ji nádor vykazuje: jako karcinoidový syndrom se označují serotoninem vyvolané záchvaty zarudnutí obličeje a dekoltu (flush) s průjmovitými stolicemi a s dušností z bronchospazmu. Karcinoidový syndrom se vyskytuje ve 20−30 % případů NET [14], převážně postihuje pacienty s metastázami [15]. Dlouhodobá sekrece serotoninu může vést k hemodynamicky závažné fibróze endokardu srdečních chlopní, která se nejčastěji manifestuje trikuspidální insuficiencí. NET metastazují lymfogenně do mízních uzlin, hematogenně do jater, do plic, do kostí a do mozku.
Diagnostika NET se opírá o stanovení přítomnosti metabolitu serotoninu kyseliny 5-hydroxyindoloctové v moči, v rámci stagingových vyšetření je základní vyšetřovací metodou CT doplněné o somatostatinovou receptorovou scintigrafii (octreotidová scintigrafie). Nádorovými markery pro monitoraci dynamiky nemoci jsou chromogranin A (CgA) a neuronspecifická enoláza (NSE) [3].
Radikální resekční výkon doplněný o regionální lymfadenektomii je v léčbě NET jedinou modalitou s kurativním potenciálem. U diseminovaných pacientů mají smysl i cytoredukční výkony, které zmírní sekrečně podmíněnou symptomatologii. U přísně selektovaných případů jaterních metastáz NET lze při vyloučení extrahepatálního postižení zvažovat i transplantaci jater [3]. U neresekabilních jaterních metastáz NET připadají v úvahu metody embolizační (transarteriální embolizace – TAE, transarteriální chemoembolizace – TACE) a termoablační (radiofrekvenční ablace – RFA, mikrovlnná ablace – MWA), popřípadě stereotaktická radioterapie jaterních metastáz (SBRT). Chemoterapie je u NET málo účinná, s nejistým účinkem se zkouší podávání dakarbazinu, temozolomidu nebo kapecitabinu [16]. Příslibem budoucnosti je cílená léčba zaměřená na interferenci farmak se specifickými molekulami, které jsou zapojeny do procesu proliferace, progrese a metastazování (ihibitory tyrozinkináz a m-TOR kinázy) [3]. K terapii inoperabilních nebo metastatických neuroendokrinních nádorů bude možné využít léčbu somatostatinovými analogy s navázaným radionuklidem (yttrium 90Y nebo lutecium 177Lu) – PRRT [17], tato léčba ale není prozatím (jaro 2017) v České republice dostupná. Pro zmírnění karcinoidového syndromu se podávají analoga somatostatinu (octreotid a lantreotid).
NET mají nejlepší prognózu ze všech maligních nádorů tenkého střeva, u klinických stadií I a II se pětileté přežití blíží 100 %, u vyšších klinických stadií se pětileté přežití uvádí v rozmezí 60–83 % [15,18]. Nezávislými prognostickými faktory jsou věk, velikost nádoru, stupeň nádorové diferenciace a radikalita resekčního výkonu [18].
Gastrointestinální stromální tumory (GIST)
Jsou specifické mezenchymální nádory gastrointestinálního traktu s rozmanitým biologickým chováním – od benigního až po vysoce maligní [19,20]. V tenkém střevě je lokalizováno 24–35 % všech gastrointestinálních stromálních nádorů, což představuje 12–15 % primárních maligních nádorů tenkého střeva [21].
Většina těchto nádorů vzniká na podkladě mutace genu transmembránového tyrozinkinázového proteinu (c-KIT, resp. CD117), což je receptor pro růstový faktor, který na svém povrchu exprimují nádorové buňky GIST. Přibližně 5–10 % GIST membránový protein KIT neexprimuje, často je pak zachycena mutace v genu PDGFRA (platelet-derived growth fractor receptor alpha), který kóduje příbuzný tyrozinkinázový receptor. Uvedené charakteristiky umožňují tyto nádory imunohistochemicky velmi dobře detekovat a odlišit např. od leiomyomů nebo leiomysarkomů, kde KIT pozitivita většinou chybí [3].
Ve třetině případů je GIST diagnostikován v metastatickém stadiu. Nádory metastazují převážně hematogenně do jater, implantačně na omentum a peritoneum, výjimečně do kůže a do kostí, zcela raritně do lymfatických uzlin a do plic [19]. Metastazovat může každý GIST, riziko agresivního chování je rozdílné v závislosti na lokalizaci nádoru, jeho velikosti a na mitotickém indexu (počet mitóz na ploše 5 mm2). U více než poloviny případů dochází do pěti let k recidivě onemocnění, toto riziko lze snížit cílenou systémovou léčbou.
Strategie léčby gastrointestinálních stromálních tumorů závisí na stadiu onemocnění. U resekabilních nádorů je indikován primární radikální chirurgický výkon. Ve většině případů je plně dostačující segmentální či klínovitá resekce s mikroskopicky negativními okraji [20,22]. Možný je laparoskopický přístup, zejména u nádorů menší velikosti lokalizovaných v jejunu a ileu. Nádory bývají dobře ohraničené, někdy s tenkou pseudokapsulou, jejich konzistence bývá elastická. Během operace je nezbytné zabránit ruptuře nádoru, resp. jeho kapsuly kvůli riziku peritoneální diseminace [23,24]. Jelikož tyto nádory prakticky nikdy nemetastazují lymfogenně, není v případě jasně stanovené histopatologické diagnózy nutné provedení regionální lymfadenektomie [22].
U neresekabilních nebo diseminovaných gastrointestinálních stromálních nádorů nehraje zásadní roli primární cytoredukce; iniciálně se indikuje léčba systémová a až poté pokus o radikální chirurgický výkon. Prokázalo se totiž, že celkový terapeutický výsledek nepredikuje velikost nádorové hmoty před zahájením systémové léčby, ale až po jejím ukončení [21,25].
V systémové léčbě GIST mají doložený terapeutický efekt inhibitory tyrozinkinázy (imatinib, sunitinib, regorafenib). Ty byly zprvu vyhrazeny pro léčbu metastatického onemocnění, později i pro adjuvantní podání u tumorů s vyšším maligním potenciálem, u kterých snižují riziko recidivy až o 54 % [26]. U histologicky verifikovaných tumorů je v indikovaných případech možné i podávání neoadjuvantní s cílem dosažení následné R0 resekce [21].
Jednoduchá kvantifikace pětiletého přežití GIST je z důvodů heterogenity těchto nádorů obtížná, prognóza je závislá na pokročilosti onemocnění a na radikalitě resekčního výkonu. Zásadní význam má „no touch“ operační technika předcházející intraabdominální ruptuře nádoru. Medián přežití u radikálně resekovaných GIST je 66 měsíců, u neradikálně operovaných pouze 22 měsíců [2]. Prognóza pacientů vyšších klinických stadií se výrazně zlepšila po zavedení inhibitorů tyrozinkinázy do klinické praxe.
Sarkomy
Jsou agresivní mezenchymální nádory, patologicky se jedná téměř beze zbytku o leiomyosarkomy. Charakterizuje je těžká buněčná atypie s četnými mitózami, na rozdíl od GIST vykazují přítomnost aktinu hladké svaloviny a desminu, imunohistochemicky u nich neprokážeme pozitivitu c-KIT (CD117), CD34 a PDGFRA.
Sarkomy jsou nejméně častými maligními nádory tenkého střeva, z nichž představují pouze 1−3 % [27,28], literární zmínky o nich jsou na úrovni kazuistik. Metaanalýza anglicky psané literatury provedená Aggarwalem s kolektivem zaznamenala v období let 2002−2012 pouze 26 publikovaných případů sarkomu tenkého střeva [29]. Leiomyosarkom se objevuje častěji u pacientů s anamnézou retinoblastomu, u dětí s kongenitálním imunodeficitem a u imunokompromitovaných pacientů po transplantacích nebo s HIV infekcí [30]. V době diagnózy jsou u více než třetiny pacientů se sarkomem tenkého střeva přítomny vzdálené metastázy [31]. Leiomyosarkom tenkého střeva metastazuje hematogenně do orgánů GIT, do jater a do plic, častěji než jiné sarkomy též lymfogenně a na peritoneum.
Podobně jako u většiny ostatních nádorů tenkého střeva i u sarkomů je základem léčby radikální chirurgický výkon zahrnující širokou resekci mezenteria. Smysl mají i opakované resekční výkony pro recidivy a taktéž metastazektomie. Možnosti adjuvantní chemoterapie jsou omezené, terapeutická odpověď na doxorubicin, ifosfamid a dakarbazin se uvádí v rozmezí 15−20 % [30], další chemoterapeutika (pazopanib či trabectidin v kombinaci s gemcitabinem) nesplnila v léčbě sarkomu tenkého střeva očekávání [32]. Efekt radioterapie v léčbě sarkomů tenkého střeva prokázán nebyl, resp. není o něm k dispozici dostatečné množství přesvědčivých dat.
Prognóza sarkomů tenkého střeva je neuspokojivá, střední doba přežití se pohybuje okolo 12 měsíců [33], pětileté přežití u tumorů větších než 5 cm a s vysokou mitotickou aktivitou se udává v rozmezí 5–27 % [34,35]. Léčebné výsledky se za posledních dvacet let bohužel příliš nezlepšily [36].
Lymfomy
Primární lymfomy zažívacího traktu (PGIL) jsou nádory lymfatické tkáně vznikající v oblasti GIT. Jde o extranodální non-Hodgkinské lymfomy, které se v pokročilém stadiu mohou šířit do uzlin nebo do dalších extralymfatických orgánů [37]. Jedna třetina PGIL je lokalizována v tenkém střevě a označuje se jako primární intestinální lymfom (PIL). Histopatologicky se jedná o T-lymfomy a B-lymfomy, které jsou v naší populaci častější. Mezi B-lymfomy patří difuzní velkobuněčný B-lymfom DLBCL (diffuse large B-cell lymphoma), B-lymfom marginální zóny MALT (mucosa-associated lymphoid tissue), lymfom z plášťových buněk MCL (mantle cell lymphoma) a folikulární lymfom FL (follicular lymphoma). Pro B-lymfomy je charakteristický výskyt v distálních úsecích tenkého střeva (s výjimkou FL, který se nachází nejčastěji v duodenu) a relativně častá multifokalita [38]. Intestinální T-lymfomy mají vzhledem ke své vysoké biologické agresivitě horší prognózu [39], na rozdíl od B-lymfomů se u nich objevuje i extraabdominální infiltrace. V evropské a americké populaci se vyskytují výjimečně. T-lymfomy asociované s celiakií se označují jako EATL (enteropathy-associated T-cell lymphoma), nejčastěji se nacházejí v jejunu.
Většina PIL se manifestuje až komplikacemi, jako jsou perforace, fistulace či krvácení, které si vyžádají urgentní chirurgickou léčbu. Je-li onemocnění histologicky verifikováno předoperačně, připadá v úvahu primární chemoterapie. S ohledem na riziko perforace lymfomu v průběhu podávání chemoterapie se ale spíše doporučuje iniciální provedení radikálního resekčního výkonu s regionální lymfadenektomií a podání chemoterapie až po operaci [4,40,41]. Výjimkou jsou indolentní asymptomatické folikulární lymfomy, u kterých je na místě sledování („watch and wait“), v případě progrese léčba imunochemoterapií a u vybraných pacientů transplantace krvetvorných buněk [42,43]. Radioterapie je v léčbě PIL pro velké riziko časných i pozdních poradiačních komplikací indikována výjimečně [2].
ZÁVĚR
Zhoubné nádory tenkého střeva jsou vzácné, jejich incidence ale v posledních desetiletích zvolna narůstá. U většiny těchto nádorů patří mezi zásadní prognostické faktory pokročilost onemocnění a radikalita provedeného chirurgického výkonu. Stanovení správné léčebné strategie, podepřené přesnou diagnostikou, by se mělo odehrávat ve specializovaném komplexním onkologickém centru.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Práce byla přednesena dne 21. 4. 2016 v Olomouci v rámci XXVI. Petřivalského-Rapantových dnů.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Libor Němec
Klinika operační onkologie,
Masarykův onkologický ústav,
Žlutý kopec 7
656 53 Brno
e-mail: lnemec@mou.cz
Zdroje
1. Becker HD, Hohenberger W, Junginger T, et al. Chirurgická onkologie, Praha, Grada Publishing 2005.
2. Krška Z, Hoskovec D, Petruželka L, et al. Chirurgická onkologie, Praha, Grada Publishing 2014.
3. Tomášek J. Benigní a maligní nádory tenkého střeva, Postgrad gastroenter hepatol 2016;1 : 2−8.
4. Abbott S, Nikolousis E, Badger I. Intestinal lymphoma—a review of the management of emergency presentations to the general surgeon. Int J Colorectal Dis 2015;30 : 151–7.
5. Howe JR, Karnell LH, Menck HR, et al. Adenocarcinoma of the small bowel. Cancer 1999;12 : 2693–706.
6. Chow WH, Linet MS, McLaughlin JK, et al. Risk factors for small intestine cancer. Cancer Causes Control 1993;4 : 163−9.
7. Bennett CM, Coleman HG, Veal PG, et al. Lifestyle factors and small intestine adenocarcinoma risk: A systematic review and meta-analysis. Cancer Epidemiol 2015;3 : 265−73.
8. Dasari BVM, Keith R, Gardiner KR. Management of adenocarcinoma of the small intestine. Gastrointest Cancer Res 2009;3 : 121−2.
9. Marchettini P, Sugarbaker PH. Mucinous adenocarcinoma of the small bowel with peritoneal seeding. Eur J Surg Oncol 2002;28 : 19–23.
10. Jacks SP, Hundley JC, Shen P, et al. Cytoreductive surgery and intraperitoneal hyperthermic chemotherapy for peritoneal carcinomatosis from small bowel adenocarcinoma. J Surg Oncol 2005;91 : 112–7.
11. Modlin IM, Oberg K, Chung DC, et al. Gastroenteropancreatic neuroendocrine tumours. Lancet Oncol. 2008; 9 : 61−72.
12. Oberndorfer S. Karzinoide Tumoren des Dünndarms. Frankfurt Z Pathol 1907;1 : 426−32.
13. Kloppel G, Perren A, Heitz PU. The gastroenteropancreatic neuroendocrine cell system and its tumors: the WHO classification. Ann N Y Acad Sci 2004;1014 : 13−27.
14. Bajčiová V, Tomášek J, Štěrba J, et al. Nádory adolescentů a mladých dospělých, Praha, Grada Publishing 2011.
15. Shebani KO, Souba WW, Finkelstein DM, et al. Prognosis and survival in patients with gastrointestinal tract carcinoid tumors. Ann Surg 1999;6 : 815.
16. Strosberg J, Goldman J, Costa, et al. The role of chemotherapy in well-differentiated gastroenteropancreatic neuroendocrine tumors. Front Horm Res 2015;44 : 239−47.
17. van Essen M, Krenning EP, De Jong M, et al. Peptide receptor radionuclide therapy with radiolabelled somatostatin analogues in patients with somatostatin receptor positive tumours. Acta Oncol 2007;6 : 723−34.
18. Wu L, Fu J, Wan L, et al. Survival outcomes and surgical intervention of small intestinal neuroendocrine tumors: a population based retrospective study. Oncotarget 2017;3 : 4935−47.
19. Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006;10 : 1466–78.
20. Bednarski BK, Pisters PWT, Hunt KK. The role of surgery in the multidisciplinary management of patients with localized gastrointestinal stromal tumors. Expert Rev Anticancer Ther 2012;12 : 1069–78.
21. Fiala L, Šefr R, Kocáková I, et al. Léčba gastrointestinálních stromálních tumorů – komplexní pohled chirurga, Rozhl Chir 2015;94 : 189–92.
22. Páral J, Lochman P, Kalábová H, et al. GIST: Novodobé poznatky a léčebné modality. Rozhl Chir 2012;4 : 189.
23. Neuhaus SJ, Clark MA, Hayes AJ, et al. Surgery for gastrointestinal stromal tumour in the post-imatinib era. ANZ J Surg 2005;75 : 165−72.
24. Schwameis K, Fochtmann A, Schwameis M, et al. Surgical treatment of GIST − an institutional experience of a high-volume center. Int J Surg 2013;9 : 801−6.
25. Blanke CD, Demetri GD, von Mehren M, et al. Long-term results from a randomized phase II trial of standard-versus higherdose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol 2008;26 : 620–5.
26. Dagher R, Cohen M, Williams G, et al. Approval summary: imatinib mesylate in the treatment of metastatic and/or unresectable malignant gastrointestinal stromal tumors. Clin Cancer Res 2002;10 : 3034−8.
27. Yamamoto H, Handa M, Tobo T, et al. Clinicopathological features of primary leiomyosarcoma of the gastrointestinal tract following recognition of gastrointestinal stromal tumours. Histopathology 2013;63 : 194–207.
28. Weledji EP, Enoworock G, Ngowe MN. Gastric leiomyosarcoma as a rare cause of gastric outlet obstruction and perforation: a case report. BMC Res Notes 2014;7 : 479.
29. Aggarwal G, Sharma S, Zheng M, et al. Primary leiomyosarcomas of the gastrointestinal tract in the postgastrointestinal stromal tumor era. Ann Diagn Pathol 2012;16 : 532–40.
30. Guzel T, Mech K, Mazurkiewicz M, et al. A very rare case of a small bowel leiomyosarcoma leading to ileocaecal intussusception treated with a laparoscopic resection: a case report and a literature review. World J Surg Oncol 2016;14 : 48.
31. Skandalakis JE, Gray SW, Skandalakis LJ. Metastasis of malignant smooth muscle tumors of the gastrointestinal tract: pattern and process. J Med Assoc Ga 1991;80 : 701−9.
32. Kasper B, Reichardt P, Pink D, et al. Combination of trabectedin and gemcitabine for advanced soft tissue sarcomas: results of a phase I dose escalating trial of the German Interdisciplinary Sarcoma Group (GISG). Mar Drugs 2015;13 : 379–88.
33. Chunwei X, Hongyan H, Jingjing W, et al. Diagnosis value of CD117 and PDGFRA, alone or in combination DOG1, as biomarkers for gastrointestinal stromal tumors. Ann Transl Med 2015;20 : 308.
34. Licht JD, Weissmann LB, Antman K. Gastrointestinal sarcomas. Semin Oncol 1988;15 : 181–8.
35. O’Riordan BG, Vilor M, Herrera L. Small bowel tumors: an overview. Dig Dis 1996;14 : 245–57.
36. Adámková-Krákorová D. Systémová léčba sarkomů měkkých tkání, Postgrad med 2014;3 : 243−6.
37. Rossi A, Lister TA. Primary gastric non-Hodgkin´s lymphoma: a therapeutic challenge. Eur J Cancer 1993; 29A:1924–6.
38. Bečvářová Z, Voller J. Primární gastroinestinální lymfomy – chirurgické komplikace. Přehled a kazuistika. Plzeňský lékařský sborník 2016,82 : 129–35.
39. Ghimire P, Wu GY, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol 2011;6 : 697−707.
40. Vaidya R, Habermann TM, Donohue JH, et al. Bowel perforation in intestinal lymphoma: incidence and clinical features. Ann Oncol 2013;9 : 2439–43.
41. Nakamura S, Matsumoto T. Gastrointestinal lymphoma: recent advances in diagnosis and treatment. Digestion 2013;87 : 182–8.
42. Lightner AL, Shannon E, Gibbons MM, et al. Primary gastrointestinal non-Hodgkin’s lymphoma of the small and large intestines: a systematic review. J Gastrointest Surg 2016;4 : 827–39.
43. Janíková A, Michalka J, Šálek D, et al. Folikulární lymfom a další indolentní B-lymfomy. Postgrad med 2011;3 : 269−75.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Pánevní onkochirurgie
- Chirurgická léčba ovariálního karcinomu
- Totální pánevní exenterace – strategie a rozsah operačního výkonu
- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Záchranná pánevní lymfadenektomie po selhání chirurgické léčby karcinomu prostaty – kazuistika
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
- Carneyho trias
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Chirurgická léčba ovariálního karcinomu
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



