-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kompletní miniinvazivní Ivor-Lewisova resekce jícnu
Complete minimally invasive Ivor-Lewis esophageal resection
Introduction:
Minimally invasive esophagectomy is becoming a standard procedure in the treatment of esophageal cancer. We would like to present our experience with Ivor Lewis esophagectomy completed by minimally invasive technique.Methods:
The primary aim of the study was to analyse potential technical difficulties and intraoperative complications of thoracolaparoscopic Ivor Lewis esophagectomy with intrathoracic anastomosis. A secondary aim of the study was to evaluate postoperative complications according to the Clavien-Dindo classification. The inclusion criterion for the study was a history of thoracolaparoscopic esophagectomy. Multidisciplinary approach was employed in the diagnosis, surgery indications and perioperative care of all patients.Results:
Between January 2011 and January 2016, 19 patients underwent completely minimally invasive esophagectomy with intrathoracic anastomosis. There were 13 men and 6 women. Adenocarcinoma was confirmed by histopathological examination in all the patients. The cumulative postoperative morbidity was 68.4%. According to the Clavien-Dindo classification, we recorded grade I complications in 10.5% of the patients, grade II in 15.8%, grade III in 36.8% and grade IV in 5.3% of the patients. Anastomotic leak was the most serious complication; it was initially managed by negative pressure (vacuum) therapy followed by stent implantation. Postoperative mortality was 0%. Mean hospital stay was 12 days and mean stay at intensive care unit was 3.6 days.Conclusions:
The basic oncosurgical principles of radicality need to be respected during minimally invasive procedures. However, functionality, safety, and cost effectiveness have to be preserved as well. In this paper, we present thoracolaparoscopic Ivor Lewis esophagectomy as one of feasible and accessible options of intrathoracic anastomosis. It seems to be safe with respect to technical obstacles, short-term and long-term complications.Key words:
esophagectomy – intrathoracic – anastomosis – laparoscopy – thoracoscopy
Autoři: P. Zonča; M. Peteja
; V. Richter; P. Vávra; P. Ostruszka; D. Worek; J. Stigler
Působiště autorů: Chirurgická klinika, FN LF Ostravské univerzity přednosta: doc. MUDr. P. Zonča, Ph. D., FRCS, MBA
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 3, s. 114-119.
Kategorie: Původní práce
Souhrn
Úvod:
Miniinvazivní resekce jícnu se stávají standardem v léčbě karcinomu jícnu. V naší práci se soustředíme na Ivor-Lewisovu resekci jícnu prováděnou kompletně miniinvazivní technikou.Metoda:
Primárním cílem naší práce je rozbor potenciálních technických úskalí a intraoperačních komplikací laparoskopicko-thorakoskopické resekce jícnu s intrathorakální anastomózou v retrospektivní klinické studii. Sekundárním cílem bylo vyhodnocení pooperačních komplikací dle Clavien-Dindo. Vstupním kritériem do studie byla provedená laparoskopicko-thorakoskopická resekce jícnu. Léčebná strategie a indikace k operaci byla výsledkem konsenzu odborníků v rámci multidisciplinárního týmu.Výsledky:
Od ledna 2011 do ledna 2016 jsme operovali 19 pacientů kompletně miniinvazivně laparoskopicko-thorakoskopicky s intrathorakální anastomózou. Celkem se jednalo o 13 mužů a 6 žen. U všech pacientů byl histologicky potvrzený adenokarcinom. Kumulativní morbidita byla 68,4 %. Následuje přehled komplikací dle klasifikace Clavien-Dindo. Komplikace I se vyskytly v 10,5 %, komplikace II se vyskytly v 15,8 %, komplikace III v 36,8 % a komplikace IV v 5,3 %. Nejzávažnější komplikací byl leak z anastomózy, který se vyřešil iniciálně podtlakovou terapií s následným zavedením stentu. Mortalita v této skupině pacientů byla 0 %. Průměrná délka hospitalizace byla 12 dní. Průměrná délka pobytu na JIP byla 3,6 dne.Závěr:
Jako u ostatních chirurgických výkonů i při uplatnění miniinvazivních technik je nutné respektovat všechny atributy radikality onkologických operací. Zároveň je potřebné zachovat funkčnost, bezpečnost a ekonomickou efektivitu. V této práci prezentujeme jednu z možných technik intrathorakálních anastomóz, kterou považujeme za bezpečnou z hlediska technických intraoperačních úskalí a komplikací a z hlediska morbidity.Klíčová slova:
resekce jícnu – nitrohrudní – anastomóza – laparoskopie – thorakoskopieÚvod
Miniinvazivní techniky za posledních 25 let prošly obrovským rozvojem. U samých počátků miniinvazivní chirurgie si chirurgové kladli otázky týkající se samotné proveditelnosti zákroků. Později se diskutovaly otázky indikací a dostatečné radikality u maligních onemocnění. V současné době je miniinvazivní chirurgie považovaná za standard léčby u řady benigních a maligních onemocnění. Platí to i pro pacienty s nádory jícnu a gastroezofageálního přechodu [1,2,3]. Parciální nebo kompletní mininvazivní přístup u nádorů jícnu je součástí většiny odborných doporučení včetně NCCN a pravděpodobně se velmi brzo stanou zlatým standardem [4]. Implementace miniinvazivního přístupu do guidelines např. chirurgie kolorekta trvalo velmi dlouho. Ve srovnání s tím trvala implementace miniivazivního přístupu do terapie jícnu kratší dobu. Důvodem je zřejmě zásadní benefit pro pacienty v podobě snížení vysoké morbidity u rozsáhlého dvoudutinového zákroku, který patří k nejextenzivnějším operacím v oblasti gastrointestinálního traktu.
Zpočátku se objevovaly práce s provedením laparoskopické transhiatální techniky s konstrukcí krční anastomózy. Později se prováděla kombinovaná laparoskopická a thorakoskopická technika. První intrathorakální anastomóza s cirkulárním staplerem byla popsaná v roce 1996 Jagotem [5]. Tehdy šlo vlastně o hybridní techniku kombinující laparoskopii a torakotomii. Lineární side to side anastomózu popsal Ben-David [6]. Kompletní miniinvazivní Ivor-Lewisova operace na větších skupinách pacientů byla popsána později [7,8,9]. V souvislosti s miniinvazivními operacemi jícnu se často zmiňuje thorakoskopická ezofagektomie v pronační poloze, avšak existují i jiné techniky [10]. V této práci bychom chtěli sdělit naše zkušenosti s laparoskopicko-thorakoskopickou resekcí jícnu s intrathorakální anastomózou s hybridní polohou bez nutnosti změny pozice během břišní a hrudní fáze.
Metoda
Primárním cílem naší práce je rozbor potenciálních technických úskalí a intraoperačních komplikací laparoskopicko-thorakoskopické resekce jícnu s intrathorakální anastomózou v retrospektivní klinické studii. Sekundárním cílem bylo vyhodnocení pooperačních komplikací dle Clavien-Dindo. Vstupním kritériem do studie byla Ivor-Lewisova resekce jícnu provedená kompletně miniinvazivně s indikacemi dle S3 standardů (Standardy Německé onkologické společnosti, AWMF-Registernummer: 021/023OL). Byli indikováni všichni pacienti, u kterých bylo možné provést intratorakální anastomózu v dostatečné vzdálenosti resekční linie od orálního konce tumoru a s přihlédnutím k dalším kritériím. Exkluzivním kritériem byl jiný typ resekce jícnu např. s krční anastomózou nebo konverze k otevřené operaci. Diagnostika, indikace k operaci a perioperační péče jsou úkolem centra s funkční interdisciplinární spoluprací včetně multidisciplinárního onkologického týmu. Data ke studii byla získána z nemocničního informačního systému. Vzhledem k charakteru práce nebyl nutný souhlas etické komise. Před každou operací pacient podepsal standardní informovaný souhlas.
Technika operace
Operační poloha pacienta se vyvíjela. Na počátku byla abdominální fáze zahájena v poloze na zádech v anti-Trendelenburgově poloze se sklonem 30o. Po skončení abdominální fáze byl pacient napolohován do levé laterální pozice. Změna operační polohy vyžadovala kompletní přerouškování pacienta, proto jsme ji později upravili tak, že pacient byl po uložení na vakuovou matraci v poloze na zádech a narotován trupem doleva. Během abdominální fáze je operační stůl situován do anti-Trendelenburgovy polohy o 30o a během hrudní fáze dle potřeby doleva. Výhodou univerzální polohy je zkrácení operačního času a zároveň zachování dobrého přístupu.
Je použita standardizovaná operační technika. V celkové anestezii po biluminální orotracheální intubaci je supraumbilikálně zaveden otevřenou cestou 10mm port pro optiku a založeno kapnoperitoneum (12 mmHg). Následně jsou vloženy pracovní porty: 5mm v epigastriu pro jaterní retraktor, 12mm port v pravém a 12mm port v levém mezogastriu a 5mm port v levém hypochondriu. Standardně se používá 30o optika. Je zaveden jaterní retraktor s cílem elevace levého jaterního laloku. Operatér stojí na pravé straně pacienta a asistent na jeho levé straně. Abdominální fáze je vždy zahájena diagnostickou laparoskopií s revizí supramezokolického a inframezokolického prostoru. Pokud se nevyskytnou žádné kontraindikace miniinvazivního postupu či radikální operace vůbec, je dále pokračováno v operaci.
Začínáme přerušením gastrokolického ligamenta pomocí ultrazvukového skalpelu (Harmonic ACE®, Ethicon). Preparujeme podél velké křiviny žaludku se zachováním gastroepiploické arkády. Přerušujeme gastrolienální ligamentum a preparujeme až do oblasti crus sinister. Hepatogastrické ligamentum podél malé křiviny je přerušeno těsně vedle jater v rozsahu od hepatoduodenálního ligamenta až ke crus dexter. Uvolňujeme eventuální retrogastrické srůsty. Následuje preparace v oblasti truncus coeliacus s identifikací všech tří tepen a lymfadenektomií. K vlastní lymfadenektomii používáme s výhodou elektrokoagulační háček v kombinaci s bipolární koagulací. Následuje přerušení arteria a vena gastrica sinistra mezi klipy. Následuje Kocherův manévr. Je důležité, abychom mohli dislokovat pylorus minimálně do úrovně hiatus oesophagei.
Výkon pokračuje transhiatální preparací distálního jícnu v oblasti distálního mediastina a postupujeme tak kraniálně, nakolik nám to nástroje svou délkou umožní. Problémem mohou být objemnější tumory v oblasti hiatu nebo těsně nad ním. Při velkém objemu tumoru není možná volná manipulace s jícnem pro nedostatek místa i přes parciální protětí crus dexter et sinister po odstranění „diafragmatického cuffu“. Důležitá je lymfadenektomie, kterou provádíme en bloc.
Následuje vytvoření žaludečního tubusu o průměru 3−4 cm. Používáme flexibilní verzi endostapleru délky 60 mm (Echelon FlexTM, Ethicon). Začínáme na malé křivině v oblasti incisura angularis po protětí cévní arkády harmonickým ACE. První stapler je nasazen kolmo k malé křivině. Další staplery jsou umístěny paralelně s velkou křivinou až do oblasti žaludečního fundu. Používáme modré zásobníky. Pokud je to možné, ponecháváme cca 2cm parenchymový můstek mezi jícnem a tubulizovaným žaludkem, abychom později usnadnili dislokaci žaludku do hrudní dutiny. V tomto případě extrahujeme preparát později po protažení hiatem přes stěnu hrudní. V případě distálních tumorů, eventuálně tumorů gastroezofageální junkce přerušujeme jícen orálně od tumoru endostaplerem délky 60 mm (Echelon FlexTM, Ethicon) a 2 prolenovými stehy jej dočasně suturujeme s tubulizovaným žaludkem. V tomto případě extrahujeme preparát z miniincize v epigastriu protažené do pravého podžebří po naložení ochranné fólie. Po výplachu dutiny břišní a naložení kapilárního drénu k hiatu rušíme kapnoperitoneum, extrahujeme porty a suturujeme rány po vrstvách.
Následuje hrudní fáze operace. Operační stůl s pacientem je napolohován 30o doleva. Jsou zavedeny hrudní porty, jeden pro kameru a obvykle 3 pracovní porty. Operatér stojí na pravé straně pacienta a asistent stojící vlevo vede kameru a drží retraktorem kolabovanou plíci u selektovaně ventilujícího pacienta. Jícen v zadním mediastinu je vizualizován v celé délce. Další postup je v souladu s popisem Siewerta [11]. Parietální pleura je z kaudálního konce incidovaná směrem kraniálním až nad úroveň vena azygos. Tato je přerušena 35mm lineárním endocutterem (ETS, Ethicon) s bílým zásobníkem. Jícen je preparován en bloc s mediastinálními uzlinami. Po jeho preparaci v zamýšleném rozsahu je přerušen kraniálně od tumoru endostaplerem délky 60 mm (Echelon FlexTM, Ethicon). Následuje protažení tubulizovaného žaludku z dutiny břišní do pravého hemithoraxu. V případě ponechání parenchymového můstku je tento nyní staplerem přerušen a preparát ponechán volně v dutině pravého hemithoraxu.
Intrathorakální anastomóza
Orální část jícnu a tubulizovaný žaludek jsou přiloženy vedle sebe ve smyslu budoucí anastomózy side to side. Přibližně 5 cm od obou konců nakládáme jeden steh PDS 4/0. Následuje bodová perforace elektrokoagulačním háčkem na obou koncích s dilatací otvoru tak, abychom mohli naložit 60mm endostapler, modrý náboj (Echelon FlexTM, Ethicon). Po vytvoření zadního obvodu anastomózy protahujeme sondu, jejíž konec umisťujeme nad pylorus (Obr. 1). Následuje uzavření předního obvodu anastomózy druhým nábojem 60mm endostapleru (modrý náboj). V místě křížení staplerových svorek anastomózy nakládáme vždy jeden steh PDS 4/0. Nepoužíváme fixační steh k pleuře, který doporučují někteří autoři. Následuje ověření vodotěsnosti anastomózy aplikací roztoku patentní modři. Po kontrole hemostázy zavádíme hrudní drén obvykle Ch 24, který umisťujeme v zadním mediastinu. Nyní dle již výše zmíněné lokalizace tumoru z minithorakotomie po naložení ochranné fólie extrahujeme tumor en bloc nebo část jícnu nad tumorem. Po kontrole rozepnutí pravé plíce po zrušení selektivní ventilace extrahujeme porty a suturujeme rány po jednotlivých vrstvách.
Obr. 1. Intrathorakální anastomóza Fig. 1: Intrathoracic anastomosis 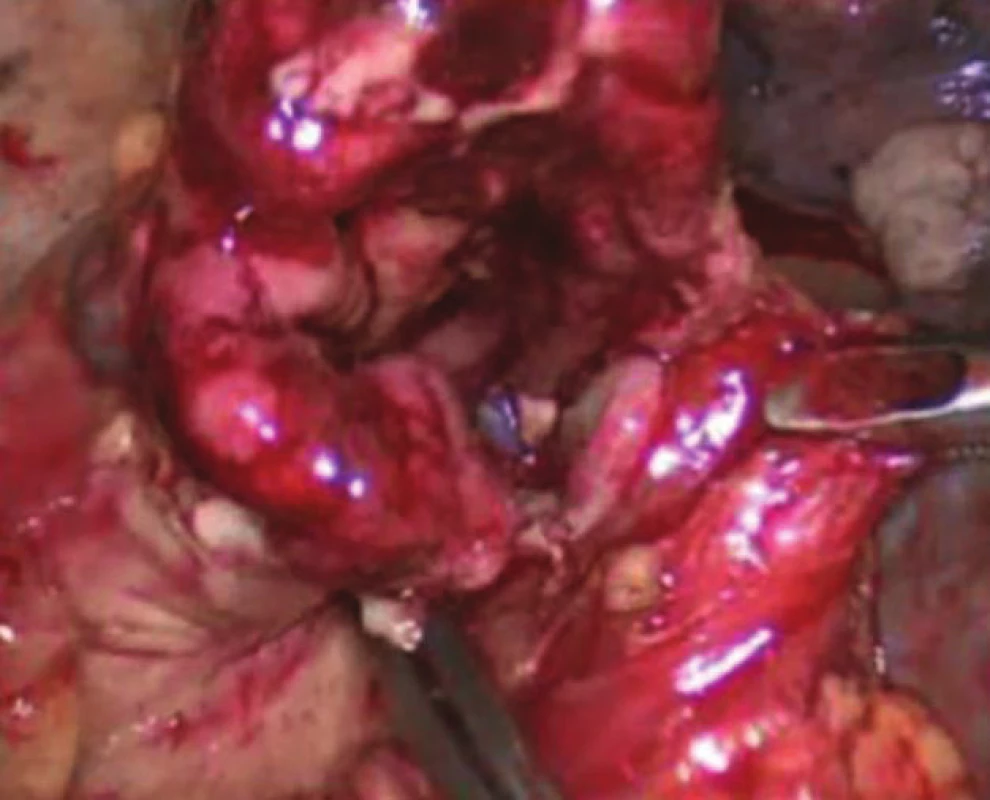
Výsledky
Od ledna 2011 do ledna 2016 jsme operovali 19 pacientů kompletně miniinvazivně laparoskopicko-thorakoskopicky s intrathorakální anastomózou. Celkem se jednalo o 13 mužů a 6 žen. U všech pacientů byl histologicky potvrzený adenokarcinom.
K intraoperačním technickým úskalím patřila u některých pacientů obtížnější intraoperační identifikace gastroepiploické arkády, jejíž zachování je esenciální pro konstrukci žaludečního tubulu. Další úskalí se vyskytla při občasné ventilaci plíce na operované straně i přes selektivní intubaci.
K intraoperačním komplikacím, které se vyskytly, došlo při preparaci objemnějšího tumoru distálního jícnu k oboustrannému poranění pleury s rozvojem ventilačních problémů. Tato komplikace si vyžádala zásadní snížení intraoperačního tlaku kapnoperitonea blížící se hodnotám technické operability.
Kumulativní morbidita byla 68,4 %. Následuje přehled komplikací dle klasifikace Clavien-Dindo. Komplikace I se vyskytly v 10,5 % (2/19), komplikace II se vyskytly v 15,8 % (3/19), komplikace III v 36,8 % (7/19) a komplikace IV v 5,3 % (1/19). Nejzávažnější komplikací byl leak z anastomózy, který se vyřešil podtlakovou terapií. Přehled komplikací skupiny III a IV dle klasifikace Clavien-Dindo je shrnut v Tab. 1. Mortalita v této skupině pacientů byla 0 %. Průměrná délka hospitalizace byla 12 dní (7−31 dní). Průměrná délka pobytu na JIP byla 3,6 dne (1−14 dní). Průměrný počet vyšetřených lymfatických uzlin byl 18,2. Výsledky jsou přehledně shrnuty v Tab. 2.
Tab. 1. Přehled komplikací III a IV dle Clavien-Dindo klasifikace Tab. 1: Grade III and IV complications according to the Clavien-Dindo classification 
Tab. 2. Tab. 2: Přehled pacientů a jednotlivých parametrů Tab. 2: Overview of patients and the individual parameters 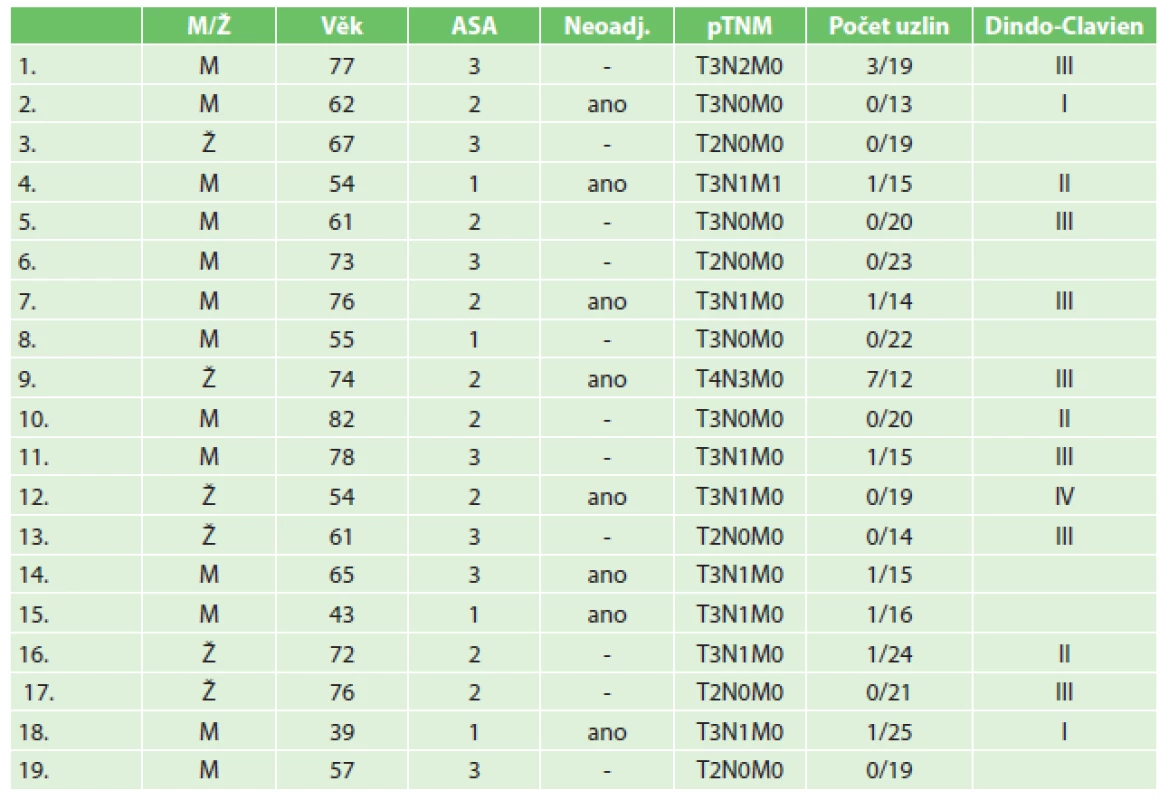
Diskuze
Řada autorů přicházela s inovativními technikami s cílem redukce morbidity a mortality operace jícnu. Kompletní miniinvazivní Ivor-Lewisova operace byla popsaná Watsonem v roce 1999 [12]. V tomto případě se k rekonstrukci používá tubulizovaný žaludek. Tubulizovaný žaludek s sebou přináší řadu výhod. Patří k nim spolehlivé a standardní cévní zásobení, technicky snadná možnost vytvoření tubulu z žaludku s částečným zachováním jeho funkce, dostatečná délka vytvořeného tubulu a jednoduchost operace díky konstrukci pouze jedné anastomózy. K nevýhodám patří reflux a riziko vynucené splenektomie. Riziko vynucené splenektomie je však velmi nízké s přihlédnutím k rozsáhlým zkušenostem chirurgů např. s laparoskopickou sleeve resekcí žaludku v rámci bariatrických operací. Otázka leaku z anastomózy je velmi diskutabilní. Řada autorů udává nižší výskyt leaků při intrathorakální anastomóze, avšak jednoznačným faktem je, že možný leak z intrathorakálně umístěné anastomózy je potenciálně fatální na rozdíl od leaku z krční anastomózy.
Miniinvazivní Ivor-Lewisova operace je vhodným řešením u pacientů s tumory v oblasti distálního jícnu a gastroezophageální junkce. Při rozhodování o typu operace však rozhodují i další faktory kromě vlastní lokalizace tumoru: staging onemocnění, technická proveditelnost R0 resekce, riziko kontaminace při otevření gastrointestinálního traktu, šířka horní hrudní apertury, kardiopulmonální kondice pacienta, zvolený substitut jícnu a zkušenost chirurga s určitou operační technikou.
Jednotlivé intraoperační komplikace, jako jsou krvácení, poranění tracheobronchiálního stromu, event. poranění nervus laryngeus recurrens, kontralaterální pneumotorax, jsou relativně málo frekventní [13]. V našem souboru jsme zaznamenali intraoperační komplikaci ve smyslu respirační insuficience při oboustranném poranění pleury při objemném tumoru u jednoho pacienta. Tato komplikace se vyřešila zásadním snížením hodnoty intraoperačního tlaku kapnoperitonea k hodnotám 6−8 mmHg. Šlo však o hodnoty, které se blížily hodnotám technické operability.
V rámci pooperačních komplikací je nutné zmínit potenciální opožděné krvácení, leak z anastomózy, mediastinitidu, pulmonální komplikace (atelektáza, ARDS, bronchiolitida, pneumonie, aspirace), dysrytmie, infarkt myokardu, tamponádu perikardu, poruchu evakuace žaludečního tubusu, chylothorax a herniaci břišních orgánů do hrudníku [14,15]. Findlay ve své práci shrnující osmileté zkušenosti s miniinvazivními resekcemi jícnu uvádí výskyt anastomotické striktury 22,4 % a potenciální leak 17,9 %, což jsou vyšší hodnoty než u otevřených resekcí. Přes vyšší % udávaného leaku však morbidita u miniinvazivních resekcí byla nižší. Týkalo se to především respiračních komplikací s výskytem 2,9 %. Projevuje se zde vliv thorakoskopie, která jednoznačně ve srovnání s thorakotomií představuje benefit pro pacienty. Právě tak byl nižší výskyt ranných komplikací a chylózního leaku [16]. V našem souboru se u jednoho pacienta (1/19, 5,3 %) vyskytl leak z anastomózy, který jsme v akutní fázi zvládli pomocí podtlakové terapie zavedené endoskopicky a po stabilizaci stavu zavedením stentu. Šlo o komplikaci stupně IV dle Clavien-Dindo. U pěti pacientů byla potřebná jednorázová punkce či zavedení drénu do hemithoraxu vpravo k evakuaci výpotku. U jednoho pacienta jsme evakuovali hematom z rány v epigastriu a u jednoho pacienta bylo nutné endoskopické vyšetření k vyloučení eventuální torze tubulizovaného žaludku. V těchto sedmi případech se jednalo o komplikaci stupně III dle Clavien-Dindo. Počty komplikací v našem souboru korespondují s údaji v literatuře.
Ve vztahu ke strikturám či leaku z anastomózy je nutné zmínit techniku anastomózy. Byla popsaná řada technik konstrukce intrathorakální anastomózy. Nabízí se kompletně ručně šitá, konstrukce cirkulárním staplerem nebo side to side anastomóza konstruovaná kompletně staplery, případně kombinovaná technika s konstrukcí zadní poloviny obvodu pomocí stapleru a ručně šitou přední polovinou obvodu anastomózy. Luketich v roce 2003 prezentoval soubor 222 pacientů s 93% úspěšností anastomózy [17]. Relativní náročnost intrathorakální anastomózy thorakoskopickou cestou vedla opět k příklonu k cervikální anastomóze. Nicméně řada chirurgů nebyla spokojena s výsledky, ať již v podobě vysokého procenta insuficiencí, vysokou incidencí striktur nebo parézy nervus laryngeus recurrens. Luketich z Pittsburghu později uvedl, že intrathorakální anastomóza je beznapěťová, je lépe prokrvená a má nižší výskyt leaků. Příklon k tomuto typu rekonstrukce pravděpodobně rovněž souvisí s efektivnější terapií potenciálních leaků, ať již pomocí potahovaných stentů, nebo v podobě podtlakové terapie [18]. Lee prezentoval techniku konstrukce intrathorakální anastomózy s použitím cirkulárního stapleru. Hlavice stapleru byla zavedena transhiatálně přes ezofagotomii a utažena pomocí Roederovy kličky. Tělo stapleru bylo zavedeno přes tubulizovaný žaludek transabdominálně [19)]. Jinou techniku popsal Nguyen se zavedením hlavice i těla přes minithorakotomii [20]. Dalším krokem konstrukce intrathorakální anastomózy byla technika pomocí OrVilu. Pro pacienta je pravděpodobně výhodou, pokud se vyhneme minithorakotomii a místo ní použijeme k odstranění preparátu minilaparotomii. Někteří autoři preferují manuální asistenci při konstrukci anastomózy. V našem souboru jsme preferovali mechanickou side to side anastomózu včetně uzavření reziduálního defektu staplerem.
V rámci evidence based medicine je relativně málo dat, o která bychom se mohli opřít, pokud srovnáváme miniinvazivní ezophagektomii s otevřenou. V roce 2002 prezentoval Biere holandskou multicentrickou studii, kde srovnal 59 pacientů operovaných miniinvazivní technikou s 56 pacienty operovanými otevřenou cestou [2]. Dále je k dispozici početný soubor pacientů z Pittsburghu prezentovaný Luketichem [21]. Obě tyto studie ukazují na nižší morbiditu při miniinvazivních technikách. Bezesporu by bylo zajímavé srovnání resekcí jícnu s intratorakální anastomózou prováděnou miniinvazivní technikou v našem souboru pacientů s otevřenou či hybridní technikou. V dřívější době jsme však preferovali provedení krční anastomózy otevřenou cestou před aplikací výše uvedené techniky, a tudíž nemáme k dispozici tato čísla.
Dalším faktorem, který je nutné zhodnotit v rámci onkologických operací, je počet vyšetřených uzlin. Na jedné straně tímto parametrem hodnotíme chirurgickou techniku, avšak na druhé straně rovněž kvalitu patologického vyhodnocení. V našem souboru jsme dosáhli průměrného počtu 18,2 vyšetřených uzlin. Ve srovnání s holandskou studií Biera [2] jsme dosáhli identického počtu vyšetřených uzlin. Luketich měl průměrně 21 vyšetřených uzlin [22]. Findlay dosáhl počtu 20 uzlin u miniinvazivních resekcí ve srovnání s 27,5 uzlinou u hybridních technik. Uvedl však, že počet vyšetřených uzlin neměl vliv na rekurenci [16].
V rámci operační techniky může být rovněž diskutována nutnost standardizovaného zavedení jejunostomie. Na našem pracovišti zavádíme jejunostomii frekventněji, nicméně s výhodou rovněž uplatňujeme perioperační ERAS přístup [23]. Jinou otázkou je potřeba pyloroplastiky či aplikace botulotoxinu. Některá pracoviště provádějí pyloroplastiku rutinně, jiná ji neprovádějí. Multidisciplinární přístup považujeme za důležitý jak v léčbě samotného onemocnění, tak i v řešení komplikací [24,25,26,27,28].
Závěr
U karcinomu jícnu zaznamenáváme v poslední době tři trendy. Prvním je zvyšující se incidence nádorů směrem distálním, druhým je neoadjuvantní léčba a třetím trendem je zvyšující se počet miniinvazivních technik. Jako u ostatních chirurgických výkonů i při uplatnění miniinvazivních technik je nutné respektovat všechny atributy radikality onkologických operací. Zároveň je potřebné zachovat funkčnost, bezpečnost a ekonomickou efektivitu. Je potřebné dodržet vysoký technický standard operace a musíme se vyhnout „technickým zkratkám“, které mohou vést k leaku, poškození conduitu a vynechání důležitých technických kroků. V této práci prezentujeme jednu z možných technik intrathorakálních anastomóz, kterou považujeme za bezpečnou z hlediska krátkodobých i dlouhodobých komplikací.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. Pavel Zonča, PhD., FRCS., MBA
Ruskova 681
532 25 Ostrava
e-mail: zonca@centrum-chirurgie.cz
Zdroje
1. Dantoc MM, Cox MR, Eslick GD. Does minimally invasive esophagectomy (MIE) provide for comparable oncologic outcomes to open techniques? A systematic review. J Gastrointest Surg. 2012;16 : 486–94.
2. Biere SS, Cuesta MA, van der Peet DL. Minimally invasive versus open esophagectomy for cancer: a systematic review and meta-analysis. Minerva Chir. 2009;64 : 121–33.
3. Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet 2012;379 : 1887–92.
4. National Comprehensive Cancer Network, Inc., Esophageal and Esophagogastric Junction Cancer 2.2016, accessed December 1st, 2016.
5. Jagot P, Sauvanet A, Berthoux L, et al. Laparoscopic mobilization of the stomach for oesophageal replacement. Br J Surg 1996;83 : 540–2.
6. Ben-David K, Sarosi GA, Cendan JC, et al. Technique of minimally invasive Ivor Lewis esophagogastrectomy with intrathoracic stapled side-to-side anastomosis. J Gastrointest Surg 2010;14 : 1613–8.
7. Nguyen NT, Follette DM, Lemoine PH, et al. Minimally invasive Ivor Lewis esophagectomy. Ann Thorac Surg 2001; 72 : 593 – 6.
8. Luketich JD, Alvelo-Rivera M, Buenaventura PO, et al. Minimally invasive esophagectomy: outcomes in 222 patients. Ann Thorac Surg 2003;238 : 486 –95.
9. Nguyen NT, Roberts P, Follette DM, et al. Thoracoscopic and laparoscopic esophagectomy for benign and malignant disease: lessons learned from 46 consecutive procedures. J Am Coll Surg 2003;197 : 902–13.
10. Jarral OA, Purkayastha S, Athanasiou T, et al. Thoracoscopic esophagectomy in the prone position. Surg Endosc. 2012;26 : 2095–103.
11. Siewert JR, Bartels H, Stein HJ. Abdomino-rechts-thorakale Ösophagusresektion mit intrathorakaler Anastomose bei Barrett-Karzinom. Chirurg 2005;76 : 588–94
12. Watson DI, Davies N, Jamieson GG. Totally endoscopic Ivor Lewis esophagectomy. Surg Endosc 1999;13 : 293−97.
13. Giugliano DN, Berger AC, Rosato EL, et al. Total minimally invasive esophagectomy for esophageal cancer: approaches and outcomes. Langenbecks Arch Surg. 2016;401 : 747−56.
14. Straatman J, van der Wielen N, Nieuwenhuijzen GA, et al. Techniques and short-term outcomes for total minimally invasive Ivor Lewis esophageal resection in distal esophageal and gastroesophageal junction cancers: pooled data from six European centers. Surg Endosc. 2017;31 : 119−26.
15. Zhai C, Liu Y, Li W, et al. A comparison of short-term outcomes between Ivor-Lewis and McKeown minimally invasive esophagectomy. J Thorac Dis 2015;7 : 2352−8.
16. See comment in PubMed Commons below Findlay L, Yao C, Bennett DH, et al. Non-inferiority of minimally invasive oesophagectomy: an 8-year retrospective case series. Surg Endosc 2017; [Epub ahead of print]
17. Luketich JD, Alvelo-Rivera M, Buenaventura PO, et al. Minimally invasive esophagectomy: outcomes in 222 patients. Ann Surg 2003;238 : 486–94.
18. Weidenhagen R, Hartl WH, Gruetzner KU, et al. Anastomotic leakage after esophageal resection: new treatment options by endoluminal vacuum therapy. Ann Thorac Surg 2013;90 : 1674–81.
19. Lee KW, Leung KF, Wong KK, et al. One-stage thoracoscopic oesophagectomy: ligature intrathoracic stapled anastomosis. Aust N Z J Surg 1997;67 : 131–2.
20. Nguyen NT, Follette DM, Lemoine PH, et al. Minimally invasive Ivor Lewis esophagectomy. Ann Thorac Surg 2001;72 : 593–6.
21. Luketich JD, Pennathur A, Awais O, et al. Outcomes after minimally invasive esophagectomy: review of over 1000 patients. Ann Surg 2012;256 : 95–103.
22. Zonca P, Stigler J, Maly T, et al. Do we really apply fast-track surgery? Bratisl Lek Listy 2008;109 : 61−5.
23. Vomackova K, Neoral C, Aujesky R, et al. The benefit of PET/CT in the diagnosis and treatment of esophageal cancer. Rozhl Chir 2015;94 : 8−16.
24. Aujeský R, Neoral Č. [Modern approach to esophageal carcinoma.] Czech, Rozhl Chir. 2012;91 : 568-73.
25. Pazdro A, Harustiak T, Snajdauf M, et al. [Esophageal perforation.] Czech Rozhl Chir 2011;90 : 647−52.
26. Aujesky R, Neoral C, Kral V, et al. [Video-assisted esophageal resection for carcinoma – ten-year experience.] Czech, Rozhl Chir 2010;89 : 746−9.
27. Runkel N, Walz M, Ketelhut M. Abdominothorakale Ösophagusresektion nach Ivor-Lewis mit intrathorakaler Anastomose, Standardisierte total-minimalinvasive Technik Chirurg 2015;86 : 468–75.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Lux et veritas past, present, and future
- Alarminy a chirurgické trauma
- Kompletní miniinvazivní Ivor-Lewisova resekce jícnu
- Laparoskopická protektivní ileostomie v chirurgii karcinomu rekta
- Dodržování publikačních standardů v časopisu Rozhledy v chirurgii
- Rizika retroperitoneoskopické adrenalektomie
- Poranění levé hepatické vény v průběhu laparoskopické fundoplikace pro velkou paraezofageální hiátovou kýlu
- Wilkieho syndrom – vzácná příčina obstrukce duodena u dospělé pacientky
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Wilkieho syndrom – vzácná příčina obstrukce duodena u dospělé pacientky
- Laparoskopická protektivní ileostomie v chirurgii karcinomu rekta
- Kompletní miniinvazivní Ivor-Lewisova resekce jícnu
- Rizika retroperitoneoskopické adrenalektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



