-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stimulace sakrálního nervu v léčbě fekální inkontinence – první zkušenosti v České republice a hodnocení funkčních výsledků
Sacral Nerve Stimulation in the Treatment of Fecal Incontinence – Initial Experience in the Czech Republic and Assessment of Functional Outcomes
Introduction:
During the last decade, sacral nerve stimulation (SNS) has become a new perspective and effective method in the treatment of fecal incontinence. In the Czech Republic, SNSs have been used since 2010.Methods:
From May 2010 to August 2011, sacral nerve stimulation was performed in 15 patients in FN Na Bulovce Surgical Clinic in Prague. All of the subjects were female patients and their mean age was 59 (46–68 years of age). The first phase of the treatment included the following procedures: percutaneous sacral nerve (S2-S4) examination, electrode implantation and subchronic stimulation. Permanent neurostimulator implantation was indicated in 14 out of the 15 subjects and over 50% of them experienced reduction in incontinence episodes. The following neurostimulators were used: Medtronic InterStim 3023 or InterStim II 3058. Stimulation parameters included 15 Hz frequency, pulse width of 210 μs and the stimulation range was between 1–3 V. The patients’ follow up period was 1–15 months after the procedure.Outcomes:
After the first phase of SNS, the morbidy rate was 7%. The morbidity rate after the permanent neurostimulator implantation was 0 %. Permanent neurostimulators were implanted in 14 out of the total of 15 subjects, i.e. the success rate was 93 %. Based on the incontinence recording sheet (diary) data collected from all the 14 subjects, the mean number of incontinence epizodes was 24 epizodes / week (± 13.0) before the stimulation and 4 epizodes/ week (± 3.8) after the stimulation procedure. Cleveland Clinic Incontinence Score was assessed in the first 8 subjects and its mean value was 20 (± 0.7) before the procedure, vs. 7 (± 1.2) after the stimulation procedure. The both values were significantly lower after the stimulation procedure (p < 0.05). No significant differences between the manometric values before the procedure and after the stimulation procedure were detected. SF-36 showed improvement in the quality of life, in particular in the parameters assessing social and mental functions. Nevertheless, there were no significant differences in any of the studied parameters.Conclusion:
The initial experience with SNS in the Czech Republic showed over 50% improvement in continence rates in 93% of the subjects with introduction of stimulation electrodes and subchronic stimulation and over 50% improvement in 100% of the subjects, who underwent permanent neurostimulator implantations, and full continence was achieved in 33% of the subjects.Key words:
sacral nerve stimulation – fecal incontinence – quality of life – functional outcomes
Autoři: P. Šlauf; F. Antoš; P. Dytrych
; J. Marvan; O. Ryska; P. Bartoška
Působiště autorů: Chirurgická klinika 1. LF UK a IPVZ, FN Na Bulovce, Praha, přednosta: doc. MUDr. J. Fanta, DrSc.
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 12, s. 674-681.
Kategorie: Monotematický speciál - Původní práce
Podporováno grantem IGA MZ ČR – NS 10461-3/2009.
Souhrn
Úvod:
Stimulace sakrálního nervu (SNS) se stala v posledním desetiletí novou perspektivní a efektivní metodou v léčbě fekální inkontinence. Od roku 2010 se začala SNS provádět poprvé i v ČR.Metoda:
Na chirurgické klinice FN Na Bulovce v Praze byla od května 2010 do srpna 2011 provedena stimulace sakrálního nervu u 15 pacientů. Vždy šlo o ženy a jejich průměrný věk byl 59 let (rozmezí 46–68). V první fázi provedeno perkutánní vyšetření sakrálního nervu v rozsahu S2-S4,implantace elektrody a subchronická stimulace. Implantace permanentního neurostimulátoru byla indikována u 14 z 15 žen, u nichž došlo k více než 50 % snížení epizod inkontinence. Jako neurostimulátor byl použit Medtronic InterStim 3023 nebo InterStim II 3058. Stimulační parametry byly nastaveny na frekvenci 15 Hz, pulzní šířku 210 μs a stimulační intenzitu v rozmezí 1–3 V. Pacientky byly po operaci sledovány po dobu 1–15 měsíců.Výsledky:
Morbidita po 1. fázi SNS byla 7 %. Morbidita po implantaci permanentního neurostimulátoru byla 0 %. Permanentní neurostimulátor byl implantován u 14 z 15 pacientů tj. úspěšnost byla 93 %. Počet epizod inkontinence stolice podle deníku inkontinence činil v průměru u všech 14 pacientů 24 / týden (± 13,0) před stimulací a 4 / týden (± 3,8) po stimulaci. Cleveland Clinic Incontinence Score bylo hodnoceno u prvních 8 pacientů a bylo před stimulací v průměru 20 (± 0,7) a po stimulaci 7 (± 1,2 ). Obě tyto hodnoty byly signifikantně nižší po stimulaci (p< 0,05). Manometrické hodnoty před stimulací a po stimulaci nevykazovaly signifikantní rozdíly. SF-36 ukázalo zlepšení kvality života především v parametrech hodnotících sociální a psychické funkce. V žádném ze sledovaných parametrů však nebyl rozdíl signifikantní.Závěr:
První zkušenosti se SNS v ČR ukázaly více než 50% zlepšení kontinence u 93 % pacientek po implantaci stimulační elektrody a subchronické stimulaci a více než 50% zlepšení u 100 % pacientek, které podstoupily implantaci permanentního neurostimulátoru, plné kontinence bylo dosaženo v 33 %.Klíčová slova:
stimulace sakrálního nervu – fekální inkontinence – kvalita života – funkční výsledkyÚVOD
Stimulace sakrálního nervu (SNS) původně vyvinutá pro léčbu močové dysfunkce, byla poprvé použita pro fekální inkontinenci (FI) v roce 1995. Cílem SNS bylo posílit residuální funkci kontinentního mechanismu elektrickou stimulací jeho periferního nervového zásobení [1].
Počáteční indikace pro SNS byly vyhrazeny pro inkontinentní pacienty s funkčně insuficientním zevním análním svěračem a s dysfunkcí pánevního dna, ale bez většího strukturálního defektu na ultrasonografii či magnetické rezonanci. V posledním desetiletí se SNS stala novou perspektivní a efektivní metodou v léčbě FI. Krátkodobé výsledky udávají zlepšení kontinence o více než 50 % u 75–100 % pacientů a plné kontinence je dosaženo u 37–75 % [2, 3]. Dlouhodobé výsledky ukazují stabilitu ve zlepšení kontinence o více než 50 % u 74–100 % pacientů [4, 5]. Od roku 2010 se začala SNS provádět poprvé i v České republice.
PACIENTI A METODIKA
Cílem studie, podporované grantem IGA MZ ČR NS 10461 – 3/ 2009, bylo provést stimulaci sakrálního nervu u 15 pacientů s fekální inkontinencí, vybraných na podkladě přísných indikačních kritérií a zahrnující jen pacienty s funkčně insuficientním, ale morfologicky intaktním análním svěračem (Tab. 1). I když se v posledních letech výrazně rozšířily indikace k SNS, v naší studii při získávání prvních zkušeností jsme se striktně drželi v literatuře uváděných kontraindikací (Tab. 2) [2, 6]. Získané první zkušenosti se SNS v České republice a hodnocení funkčních výsledků i kvality života pacientů by se měly stát podkladem pro zavedení metody v ČR i pro postupné rozšíření indikačních kritérií.
Tab. 1. Indikace k provedení SNS Tab. 1. Indications for SNS 
Tab. 2. Kontraindikace SNS (Jarret 2004, Leroi 2009) Tab. 2. Contraindications of SNS (Jarret 2004, Leroi 2009) 
Na chirurgické klinice FN Na Bulovce v Praze byla od května 2010 do srpna 2011 provedena stimulace sakrálního nervu u 15 pacientů. Vždy šlo o ženy a jejich průměrný věk byl 59 let (rozmezí 46–68). Všechny pacientky byly inkontinentní pro formovanou nebo řídkou stolici nejméně jednou týdně a selhala u nich veškerá konzervativní terapie včetně cvičení pomocí biologické zpětné vazby (biofeedback).
Před stimulací všechny pacientky prodělaly kompletní klinické vyšetření, zahrnující podrobnou anamnézu a fyzikální vyšetření, koloskopii, endoanální ultrasonografii, anorektální manometrii, vyšetření terminální motorické latence nervus pudendalis (PNTML) a pacientky po operaci pro kompletní rektální prolaps ještě podstoupily defekografii (Tab. 3).
Tab. 3. Vyšetření nutná před SNS Tab. 3. Examinations required prior to SNS 
Kolonoskopicky byla vyloučena malignita či zánět distálního GIT, endosonograficky byl vyloučen defekt svěračů, manometricky byl vyšetřen maximální klidový a kontrakční anální tlak, první pocit vjemu a práh urgence k defekaci a k manometrii bylo použito stacionární techniky s osmikanálovým perfuzním systémem. PNTML měřená pomocí elektrody sv. Marka vyšší než 2,6 ms unilaterálně nebo bilaterálně byla definována jako pudendální neuropatie. U 13 pacientek byla zjištěna pudendální neuropatie, devětkrát bilaterální a čtyřikrát unilaterální, u zbývajících dvou pacientek nebyla pudendopatie prokázána, ale hodnoty byly hraniční.
U pacientek po operaci rektálního prolapsu byla defekografií vyloučena recidiva prolapsu. Skóre inkontinence bylo stanoveno použitím Cleveland Clinic Incontinence (Wexner) Score (0–20, 20 kompletní inkontinence, 0 perfektní kontinence) (Tab. 4). Pacientky vyplnily dotazník kvality života SF – 36 a deník inkontinence po dobu 14 dní před stimulací. Epizody inkontinence byly klasifikovány jako urgentní (neschopnost zadržet defekaci) nebo pasivní (nekontrolovatelný únik stolice). Všechny pacientky ve studii měly urgentní fekální inkontinenci a čtyři z nich současně i pasivní inkontinenci. Všechny pacientky před stimulací podepsaly informovaný souhlas, schválený etickou komisí nemocnice.
Tab. 4. Použité skóre inkontinence (CCIS – Wexner ) Tab. 4. Used incontinence score (CCIS – Wexner ) 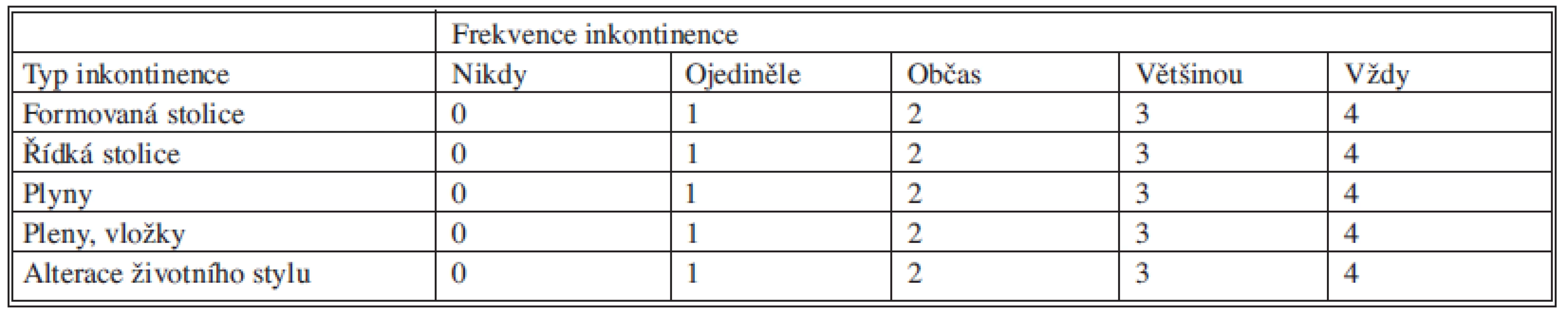
0 = perfektní kontinence, 20 = totální inkontinence nikdy = 0, ojediněle = méně než 1x/m, občas = méně než 1x týdně, více než 1x/m,většinou = méně než 1x denně, více než 1x/t, vždy = 1x či vícekrát denně Etiologie fekální inkontinence byla stanovena jako idiopatická u 10 pacientek, postupně se zhoršující inkontinence po rekonstrukci svěračů bez prokazatelného defektu (total pelvic floor repair) u 2 pacientek a přetrvávající fekální inkontinence po abdominální rektopexi pro kompletní prolaps rekta u 3 pacientek.
V první fázi bylo provedeno perkutánní vyšetření sakrálního nervu speciální spinální stimulační jehlou zaváděnou při poloze pacientky na břiše systematicky do foramina sacralia posteriora v rozsahu S2–S4 bilaterálně (Obr. 1). K elektrické stimulaci dorzálních sakrálních kořenů byl použit přenosný pulzní generátor (Medtronic Interstim, model 3625, Minneapolis, MN, USA) ke zjištění nejlepší motorické odpovědi, hodnocené podle kontrakce svěračů, perinea a palce nohy na stejné straně. U 13 pacientek bylo optimální místo na S3, u 2 pacientek na S2. Do vybraného foramen sacrale posterior byla pomocí speciálního zaváděcího setu miniinvazivní technikou implantována permanentní elektroda s trny tzv. „tined lead elektroda“, (Obr. 2) a to u 13 pacientek (Medtronic model 3093 – 28cm, Minneapolis, MN, USA) a u 2 pacientek (Medtronic model 3889, Minneapolis, MN, USA). Trny elektrody se po implantaci rozevřely, a tak zabraňovaly vycestování či pozdější dislokaci elektrody. Perkutánní vyšetření nervu a implantace elektrody byly provedeny v celkové anestezii bez relaxace u všech 15 pacientů, za ATB profylaxe a délka procedury nepřesáhla 60 minut. Elektroda byla poté protažena podkožním tunelem do incize v lumbální krajině (Obr. 3), kde byla spojena se speciálním drátem pro zevní stimulaci (Obr. 4).
Obr. 1. Perkutánní vyšetření nervu stimulační jehlou Fig. 1. Percutaneous examination of the nerve with a stimulation needle 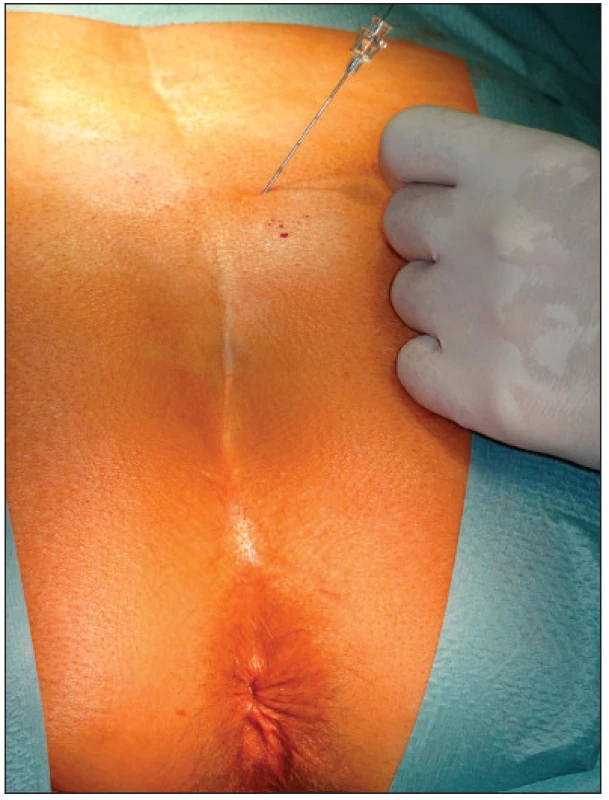
Obr. 2. Permanentní elektroda s trny Fig. 2. Permanent electrod tined lead 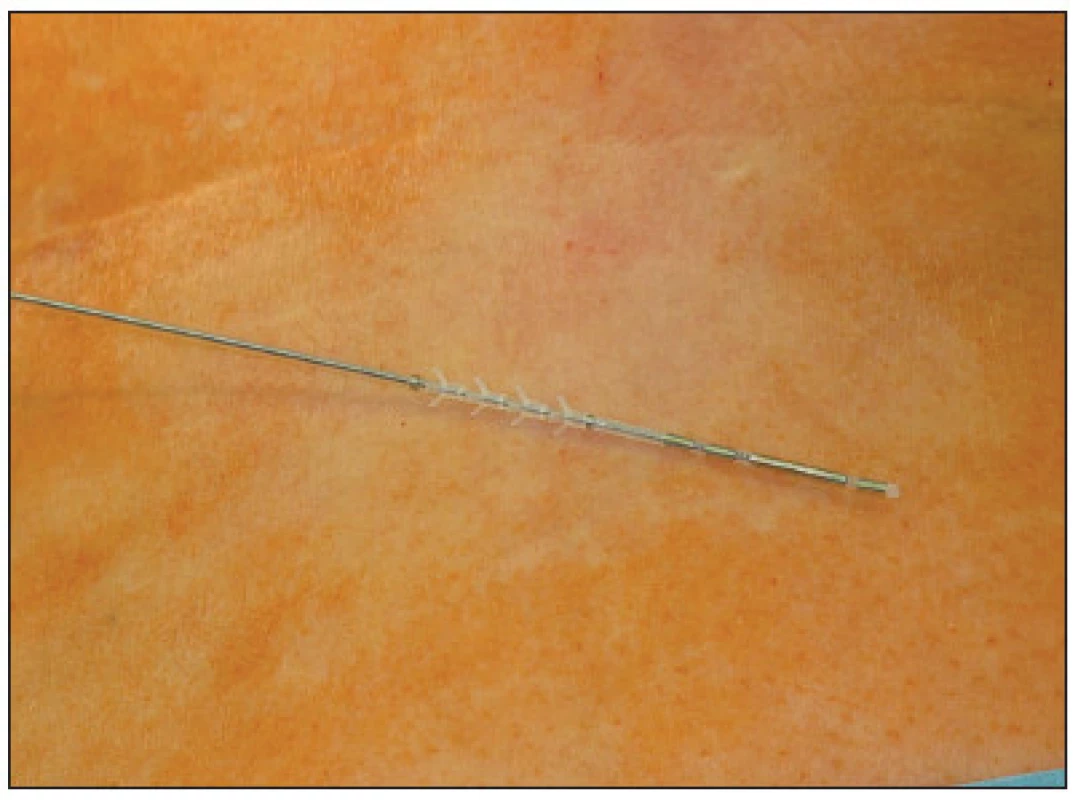
Obr. 3. Protažení elektrody do incize v lumbální krajině Fig. 3. Introduction of the electrode into the lubar region incisioning 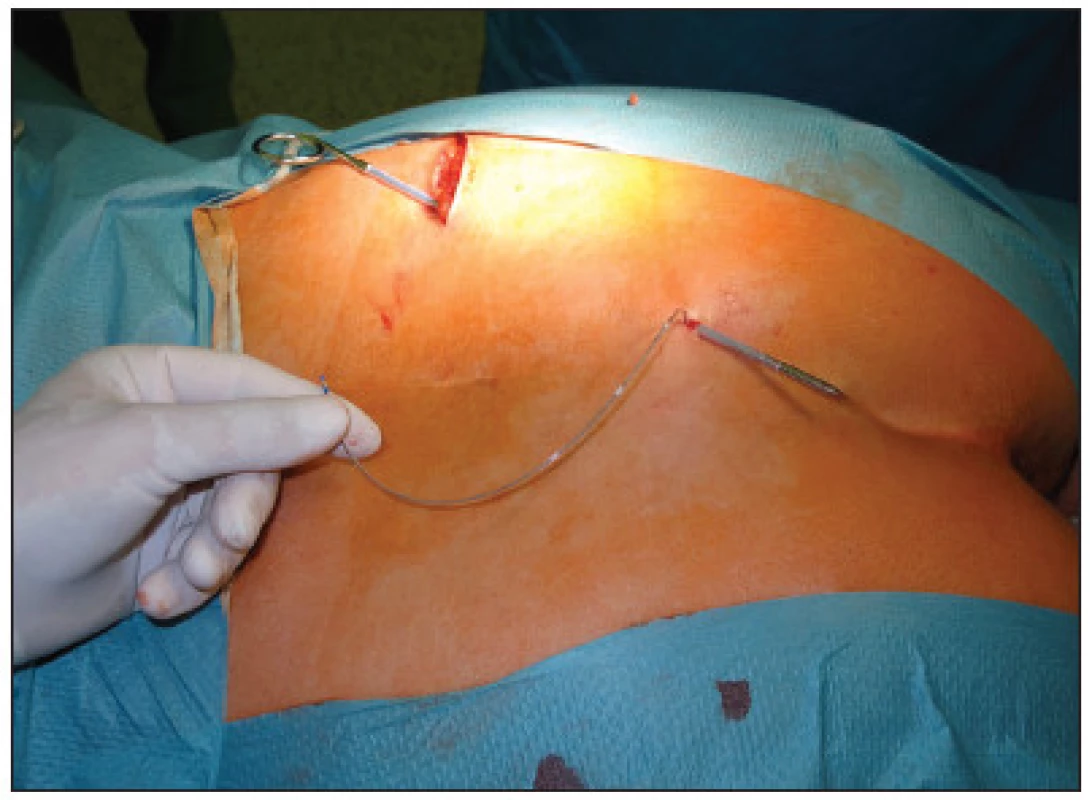
Obr. 4. Připojení elektrody k drátu pro zevní stimulaci Fig. 4. Attachment of the electrode to a wire for external stimulation 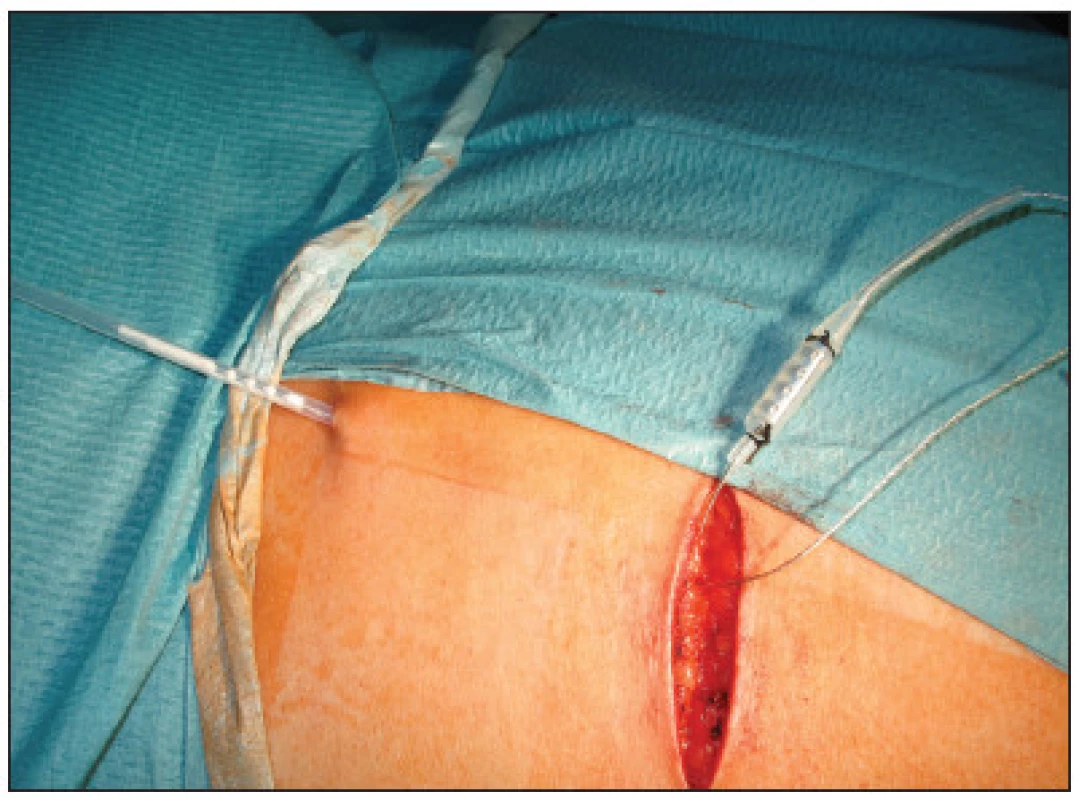
Tento drát byl poté vytažen zevně ze zvláštní kontraincize, fixován ke kůži a napojen na kabel k zevnímu pulznímu generátoru. Poté byla provedena sutura kožních incizí. Po operaci byly pomocí zevního pulzního generátoru nastaveny požadované stimulační hodnoty a pacientky byly ještě před propuštěním poučeny o ovládání zevní stimulace. Délka hospitalizace byla 2–3 dny. Po propuštění si pacientky prováděly samy subchronickou stimulaci doma pomocí přenosného pulzního generátoru (model 3625) jak uvedeno výše, který jim byl zapůjčen. Délka testování – subchronické stimulace byla 14 dní u 12 pacientek, 3 týdny u 2 pacientek a 4 týdny u jedné pacientky, u které ani po prodloužení testování a přeprogramování stimulačních parametrů nebylo dosaženo uspokojivého zlepšení kontinence a elektroda tak musela být explantována.
Implantace permanentního neurostimulátoru byla indikována u 14 z 15 žen, u nichž došlo k více než 50% snížení epizod inkontinence. Implantace byla provedena opět v celkové anestezii bez relaxace za ATB profylaxe. Jako neurostimulátor byl použit Medtronic InterStim (model 3023, Minnesota, MN, USA) a spojovací kabel Medtronic Interstim (model 3095 – 10 cm, Minneapolis, MN, USA) u 5 pacientek a InterStim II (model 3058 Minnneapolis, MN, USA) u 9 pacientek. Po proniknutí původní incizí v lumbální krajině do podkoží a po odpojení drátu pro zevní stimulaci byl neurostimulátor zabalen do Garamycinové pěny a připojen k elektrodě implantované již v 1. fázi SNS (Obr. 5). Neurostimulátor byl pak uložen do vytvořené podkožní kapsy a provedena sutura podkoží a kůže. Délka operace byla 20–30 minut a délka hospitalizace 2 dny. Stimulační parametry byly nastaveny na frekvenci 15 Hz, pulzní šířku 210 μs a stimulační amplitudu průměrně 2,2 V (1,8–2,8) pomocí lékařského programátoru N-Vision Programmer Medtronic. Neurostimulátor byl trvale zapnutý. Nicméně každé pacientce byl po operaci vydán vlastní programátor Interstim i-Con Medtronic, umožňující v případě potřeby přechodné vypnutí stimulátoru či korekci stimulační amplitudy telemetricky prostým přiložením programátoru na místo implantovaného stimulátoru.
Obr. 5. Připojení neurostimulátoru k elektrodě Fig. 5. Connection of the neurostimulator to the electrode 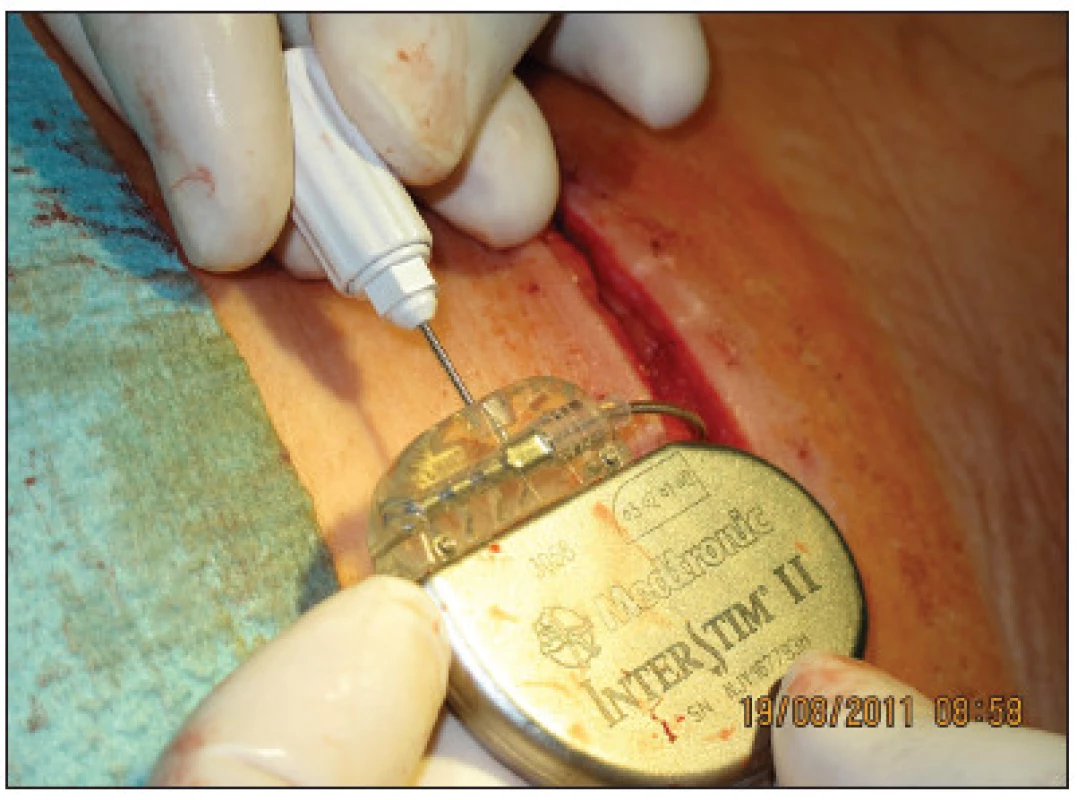
Pacientky byly po operaci sledovány po dobu 1–16 měsíců s kontrolním vyšetřením za 3, 6, 9 a 12 měsíců po zhojení operační rány.
Počty epizod inkontinence, manometrické hodnoty a skóre inkontinence (Cleveland Clinic Incontinence Score) u pacientů před a po zavedení stimulace jsou uváděny v průměrných hodnotách se směrodatnou odchylkou a byly srovnány pomocí neparametrického testu (Wilcoxonův test). Hlavní parametry dotazníku kvality života SF – 36 byly srovnávány Studentovým T-testem. Statistická významnost byla definována jako hodnota P nižší než 0,05. Pro statistickou analýzu byl použit software MedCalc 11.4.4.0.
VÝSLEDKY
Po 1. fázi SNS tj. po perkutánním vyšetření nervu a subchronické stimulaci jsme nepozorovali žádnou dislokaci elektrody, žádnou disrupci zevního drátu, žádnou alergickou reakci, ani žádný infekt operačních ran, kromě malého seromu v podkoží u jedné obézní pacientky, který byl evakuován a nebyl kontraindikací implantace permantního neurostimulátoru. Morbidita po 1. fázi SNS tak byla 7 %. Morbidita po implantaci permanentního neurostimulátoru byla 0 %.
Permanentní neurostimulátor byl implantován u 14 z 15 pacientek tj. úspěšnost byla 93 %.
Před SNS a po stimulaci byl měřen počet epizod inkontinence stolice podle pacientova deníku inkontinence po dobu 14 dní a činil v průměru u všech 14 pacientek 24/týden (± 13,0) před stimulací a 4 / týden (± 3,8) po stimulaci (Graf 1).
Graf 1. Počet epizod FI před SNS a po SNS Graph 1. Number of fecal epizodes pre- and post-SNS 
Cleveland Clinic Incontinence Score (CCIS) bylo hodnoceno zatím u prvních 8 pacientek a činilo před stimulací v průměru 20 (± 0,7) a po stimulaci 7 (± 1,2) (Graf 2). Obě tyto hodnoty byly signifikantně nižší po stimulaci (p < 0,05).
Graf 2. CCIS před SNS a po SNS Graph 2. CCIS pre- and post-SNS 
Maximální klidový tlak a maximální tlak při kontrakci svěrače před stimulací a po ní byly zatím hodnoceny u 8 pacientek (Graf 3, 4). Manometrické hodnoty před stimulací a po stimulaci nevykazovaly signifikantní rozdíly. Všechna data jsou shrnuta v tabulce 5.
Graf 3. Maximální klidový tlak (MRP v mm Hg) před SNS a po SNS Graph 3. Maximum resting pressure (MRP in mm Hg) preand post-SNS 
Graf 4. Maximální kontrakční tlak (MSP v mm Hg) před SNS a po SNS Graph 4. Maximum squeeze pressure (MSP in mm Hg) preand post-SNS 
Tab. 5. Souhrn hodnocení funkčních výsledků před SNS a po SNS (uvedeny jsou průměrné hodnoty se směrodatnou odchylkou). Tab. 5. Assessment summary of functional pre- and post- SNS outcomes (mean values with standard deviations are presented). 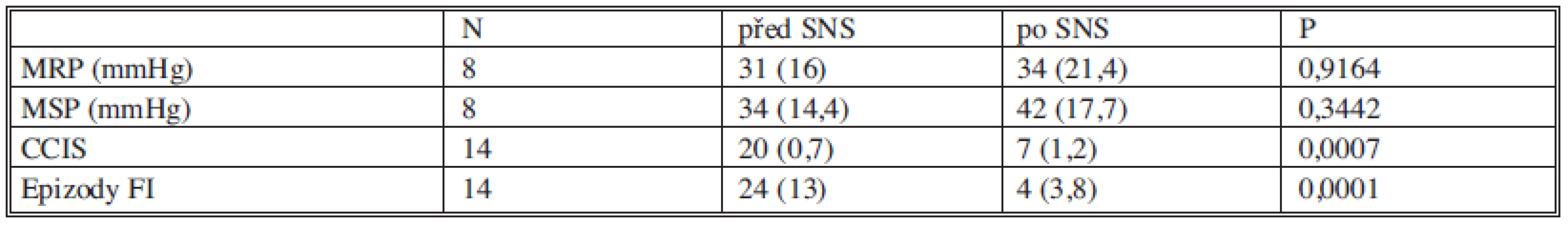
Kvalita života byla měřena pomocí SF-36 a ukázala zlepšení především v parametrech hodnotících sociální a psychické funkce. V žádném ze sledovaných parametrů však nebyl rozdíl signifikantní (Graf 5).
Graf 5. Hodnocení kvality života (SF-36) před SNS a po SNS Graph 5. Quality of life assessment (SF-36) pre- and post-SNS 
DISKUSE
Při SNS je optimálním místem s nejlepší odpovědí foramen sacrale v úrovni S3. Samotný sakrální nervový kořen je smíšený nerv obsahující jak volní somatická, tak i aferentní sensorická a eferentní autonomní motorická vlákna a navíc stimulace S3 může ovlivnit i pánevní část sympatického provazce, který leží na mediální straně tohoto foramina. To vše se může podílet na klinickém efektu SNS [2]. Při SNS tak dochází k stimulaci a neuromodulaci aferentních i eferentních nervových svazků a kromě zvýšení tlaků v průběhu análního kanálu dochází také ke změně rektální senzibility. To vede k modifikaci spinálních reflexů a tím ke zlepšení kontinence [7]. Rovnováha mezi autonomní nervovou aktivitou je klíčem určujícím kolorektální motilitu a funkci vnitřního análního svěrače. Změny této rovnováhy mohou být součástí mechanismu účinku SNS. Měření krevního průtoku sliznice rekta laser Doppler metodou jako nepřímé měření extrinsické autonomní nervové aktivity ukázalo zvýšení krevního průtoku rektální sliznicí až do stimulační amplitudy 1 V při SNS. To odráží zvýšení parasympatické aktivity nebo snížení sympatické aktivity v oblasti anorekta [2]. Michelsen prokázal zvýšení rektální kapacity a compliance i zvýšení klidového análního tlaku 6 měsíců po SNS, zatímco kontrakční anální tlak zůstal nezměněn. Popsáno bylo také ovlivnění motility celého tračníku [9]. Není jasné, zda SNS má i centrální efekt, ale byl popsán příznivý efekt SNS u pacientů s inkompletní míšní lézí [7]. A některé recentní studie ukázaly, že efekt SNS spočívá spíše v neuromodulaci centrálního nervového systému, zatímco efekt přímého působení na anální svěrače a svalstvo pánevního dna je méně signifikantní [4, 10]. U vlastního souboru pacientek jsme po stimulaci zaznamenali většinou jen nevýrazné změny v manometrických hodnotách, které nebyly signifikantní, i když bylo pozorováno signifikantní snížení epizod inkontinence i snížení CCIS. To potvrdilo, že u SNS jde o složitý komplexní účinek a při hodnocení efektu se nelze omezovat jen na manometrické hodnoty.
Vzhledem k tomu, že mechanismus kontinence není závislý jen na zevním análním svěrači, došlo v posledních letech k rozšíření indikací i na pacienty s limitovaným strukturálním defektem análního svěrače. Ukazuje se, že počáteční předpoklad intaktního sfinkteru, jako podmínky úspěchu léčby SNS byl zbytečně omezující. Dosavadní výsledky ukazují, že SNS pro fekální inkontinenci u pacientů s defektem svěrače až do 120° cirkumference je stejně efektivní jako u pacientů bez defektu [4, 11, 12]. Postupně byly popsány i úspěšné případy léčby inkontinence po přední resekci rekta včetně pacientů po radiochemoterapii [13, 14, 15]. V našem souboru jsme se striktně drželi přísnějších indikací k SNS tj. bez defektů svěračů nejen vzhledem k nedostatku zkušeností s touto metodou, ale i na podkladě doporučení dřívějších multicentrických studií.
Navíc postupné testování SNS metodou „pokusů a omylů“ umožnilo další expanzi indikací pro SNS i u pacientů s rozličnými patofyziologickými a patomorfologickými příčinami fekální inkontinence. Podstatné rozšíření indikačních kritérií představovalo zavedení metody SNS pro pacienty s neurogenními příčinami inkontinence [7]. Jedná se o různorodou skupinu příčin, jako jsou postraumatické paraplegie, stavy po operacích pro protruze disků, meningomyelokély, sklerosis multiplex a svalové dystrofie. V těchto jednotlivých podskupinách bylo dosaženo rozličné úspěšnosti či neúspěšnosti metody [16]. V naší skupině pacientek s úspěšně implantovaným neurostimulátorem, byla jedna pacientka původně inkontinentní po operaci pro protruzi disku v úrovni L5-S1, u níž byl neurologicky zjištěn inkompletní syndrom caudae equinae. Efekt SNS byl u ní jednoznačný, když došlo ke snížení epizod inkontinence o více než 60 %.
Velké zastoupení v publikovaných souborech představuje skupina pacientů s insuficiencí pánevního dna, kde po původních obstrukčních defekačních potížích následuje inkontinence obvykle s přítomnými morfologickými znaky, jako jsou pokles pánevního dna, intususcepce rekta, prolaps mukózy, rektokéla či zevní prolaps rekta. Otázkou doposud zůstává, zdali je nutné před SNS operačně korigovat prolaps mukózy či rektální intususcepci [15]. U zevního prolapsu rekta představuje SNS úspěšnou metodu léčby inkontinence po jeho operačním odstranění [17]. To potvrzujeme i z vlastních zkušeností, když SNS byla provedena u tří pacientek s přetrvávající FI po operační korekci kompletního prolapsu rekta. Úspěšné výsledky jsou prezentovány při indikaci SNS k léčbě obstrukčního defekačního syndromu a chronické obstipace a tato metoda zde představuje alternativu k jiným chirurgickým zákrokům, jako jsou mimo jiné i resekční výkony a stomie [2, 18]. Příznivý vliv je zde vysvětlován neuromodulací sakrálních reflexů vedoucích ke snížení prahu vnímání stolice a nucení na stolici, a i změnami v motilitě levé části tračníku [15]. Jarrett presentuje dobré výsledky SNS i u pacientů s idiopatickou slow-transit obstipací [2]. To nemůžeme potvrdit ani vyloučit, neboť jsme k SNS indikovali jen pacientky s fekální inkontinencí. Nicméně u tří pacientek s téměř dokonalým efektem SNS jsme pozorovali spíše sklon k obstipaci, což může potvrzovat mechanismus účinku SNS na motilitu rekta a aborálního tračníku.
Postupným vývojem prošla i technika SNS. V současné době se používají permanentní tzv. „ tined lead elektrody“, což jsou elektrody s trny omezující na minimum možnost dislokace a jsou zaváděné perkutánní technikou. V posledních letech se objevují i informace o léčbě urgentní fekální inkontinence perkutánní stimulací tibiálního nervu. Metoda je velmi dobře tolerována pacienty a předběžné studie ukazují částečné zlepšení kontinence, především snížení počtu epizod inkontinence [18]. SNS se tak stala minimálně invazivní technikou s minimální až nulovou morbiditou [10]. U našich pacientek jsme pozorovali pouze u jediné drobný serom v operační ráně po 1. fázi SNS, ale tato drobná komplikace nebyla kontraindikací implantace permanentního neurostimulátoru.
SNS lze provádět v celkové nebo lokální anestezii. Výhodou celkové anestezie je zjednodušení výkonu pro operujícího chirurga i větší komfort pro pacienta, nevýhodou jsou větší finanční náklady [7]. Hlavní výhodou lokální anestezie je možnost pro pacienta podílet se na přesném umístění elektrody v první fázi SNS a poskytnutí údajů chirurgům o tom, zda je odpověď na stimulaci symetrická. Limitujícím faktorem lokální anestezie může být přítomnost úzkého foramen sacrale posterior, které může činit zavedení stimulační jehly a elektrody velmi obtížné a pro pacienta bolestivé (Hetzer 2007). Všechny naše pacientky byly operovány v první i druhé fázi vždy v celkové anestezii. Výhodu tohoto postupu kromě komfortu pro pacientky jsme ocenili především v situacích, kdy bylo obtížné přesné zavedení stimulační jehly a tento proces tak musel být opakován, stejně jako opakované zavádění elektrody. Důležitým ukazatelem v testovací fázi je výše použité voltáže. Permanentní elektroda by měla být implantována jen tehdy, když odpověď svalstva pánevního dna je pozorována při elektrické stimulaci méně než 4 V, jinak hrozí perineurální fibróza (Hetzer 2007). U našich pacientek byla maximální amplituda 2,8 V.
Selhání metody SNS je v publikovaných souborech popisováno zhruba v rozmezí 0–31 % a je pochopitelně závislé na striktnosti indikačních kritérií [15]. V našem souboru 15 pacientů byla explantována stimulační elektroda u jediné pacientky vzhledem k nedostatečnému efektu během subchronické stimulace i přes prodloužení doby testování na 4 týdny a přeprogramování stimulačních parametrů, a proto nebyla indikována implantace permanentního neurostimulátoru.
Nicméně jako vedlejší efekt SNS jsme u této pacientky pozorovali úplné vymizení chronické sakralgie v průběhu testovací fáze, která pacientku sužovala po mnoho let a byla refrakterní na veškerou léčbu včetně fyzioterapie. Sakralgie se opět objevila po explantaci stimulační elektrody.
Zřídka jsou publikovány závažnější chirurgické komplikace. Kromě chronických parestezií a bolestí byly popsány infekční komplikace vyžadující odstranění stimulátoru [3, 19]. U některých pacientů po SNS, u nichž dochází k neuspokojivým dlouhodobým výsledkům, se uvažuje o možnosti cílené stimulace pudendálního nervu a první zkušenosti jsou nadějné [20].
ZÁVĚR
Naše první zkušenosti se SNS v České republice ukázaly více než 50% zlepšení kontinence u 93 % pacientek, kterým byla implantována stimulační elektroda a podstoupily testovací subchronickou stimulaci, a více než 50% zlepšení kontinence u 100 % pacientek, které podstoupily implantaci permanentního neurostimulátoru, přičemž plné kontinence bylo dosaženo v 33 %. To odpovídá i krátkodobým výsledkům uváděným v literatuře. Stimulace sakrálních nervů je bezpečnou miniinvazivní operací s minimální morbiditou. Nicméně je třeba větší počet pacientů, rozšíření indikačních kritérií i dlouhodobé sledování stejně jako zajištění finančního krytí operace ze zdravotního pojištění pro to, aby se SNS stala jednou z efektivních metod pro léčbu pacientů s fekální inkontinencí i v ČR.
Použité zkratky:
SNS – sacral nerve stimulation (stimulace sakrálního nervu)
FI – fekální inkontinence
CCIS – Cleveland Clinic Incontinence Score
PNTML – Pudendal nerve terminal motor latency
MRP – Maximal resting pressure
MSP – Maximal squeeze pressure
MUDr. Petr Šlauf
Chirurgická klinika IPVZ a 1. LF UK
FN Na Bulovce Praha
Budínova 2
180 81 Praha 8
e-mail: petrslauf@seznam.cz
Zdroje
1. Matzel, K., Stadelmeier, U., Hohenfellner, M., Gall, F. P. Electrical stimulation of sacral spinal nerves for treatment of faecal incontinence. Lancet, 1995, 346, p. 1124–1127.
2. Jarrett, M. E., Mowatt, G., Glazener, C. M., Fraser, C., Nicholls, R. J., Grant, A. M., Kamm, M. A. Systematic review of sacral nerve stimulation for faecal incontinence and constipation. Br. J. Surg., 2004, Dec; 91 (12): 1559–1569.
3. Matzel, K. E., Kamm, M. A., Stösser, M., Baeten, C. G., Christiansen, J., Madoff, R., Mellgren, A., Nicholls, R. J., Rius, J., Rosen, H. Sacral spinal nerve stimulation for faecal incontinence: multicentre study. Lancet, 2004 Apr, 17; 363 (9417): 1270–1276.
4. Matzel, K., Lux, P., Heuer, M., Besendorfer, M., Zhang, W. Sacral nerve stimulation for faecal incontinence: long-term outcome. Colorectal Dis., 2009, vol. 11, issue 6, p. 636–641.
5. Hollingshead, J. R. F., Dudding, T. C., Vaizey, C. J. Sacral nerve stimulation for faecal incontinence: results from a single centre over a 10-year period. Colorectal Dis., 2011, 13, 9, p. 1030–1034.
6. Leroi, A. M., Damon, H., Faucheron, J. L., Lehur, P. A., Siproudhis, L., Slim, K., Barbieux, J. P., Barth, X., Borie, F., Bresler, L., Desfourneaux, V., Goudet, P., Huten, N., Lebreton, G., Mathieu, P., Meurette, G., Mathonnet, M., Mion, F., Orasoni, P., Parc, Y., Portier, G., Rullier, E., Sielezneff, I., Zerbib, F., Michot, F. Sacral nerve stimulation in faecal incontinence : position statement based on a collective experience. Colorectal Dis., 2009, 11, p. 572–583.
7. Rosen, H. R., Urbarz, C., Holzer, B., Novi, G., Schiessel, R. Sacral nerve stimulation as a treatment for fecal incontinence. Gastroenterology, 2001 Sep; 121 (3): 536–541.
8. Dinning, P. G., Fuentealba, S. E., Kennedy, M. L., Lubowski, D. Z., Cook, I. J. Sacral nerve stimulation induces pan-colonic propagating pressure waves and increases defecation frequency in patients with slow-transit constipation. Colorectal Dis., 2007 Feb; 9 (2): 123–132.
9. Michelsen, H. B., Christensen, P., Krogh, K., Rosenkilde, M., Buntzen, S., Theil, J., Laurberg, S. Sacral nerve stimulation for faecal incontinence alters colorectal transport. Br. J. Surg., 2008 Jun; 95 (6): 779–784.
10. Matzel, K. Sacral nerve stimulation for faecal incontinence: its role in the treatment algorithm. Colorectal Dis., 2011, 13, Issue Supplement s2, p. 10–14.
11. Baeten, C., Bartolo, D. C. C., Lehur, P. A., Matzel, K., Pescatori, M., Roche, B., Williams, N. S. Consensus conference on faecal incontinence. Tech. Coloproctol., 2007, 11, p. 225–233.
12. Chan, M. K., Tjandra, J. J. Sacral nerve stimulation for fecal incontinence: external anal sphincter defect vs. intact anal sphincter. Dis. Colon Rectum, 2008 Jul; 51 (7): 1015–1024; discussion 1024–1025. Epub 2008 May 17.
13. Jarrett, M. E., Matzel, K. E., Stösser, M., Christiansen, J., Rosen, H., Kamm, M. A. Sacral nerve stimulation for faecal incontinence following a rectosigmoid resection for colorectal cancer. Int. J. Colorectal. Dis., 2005 Sep; 20(5): 446–451. Epub 2005 Apr 21.
14. Matzel, K. E., Stadelmaier, U., Bittorf, B., Hohenfellner, M., Hohenberger, W. Bilateral sacral spinal nerve stimulation for fecal incontinence after low anterior rectum resection. Int. J. Colorectal Dis., 2002 Nov; 17 (6): 430–434. Epub 2002 Jul 3.
15. Stelzner, S., Köhler, K., Hellmich, G., Witzigmann, H. Indications and results of sacral nerve stimulation in faecal incontinence. Zentralbl. Chir., 2008 Apr; 133 (2): 135–141.
16. Jarrett, M. E., Matzel, K. E., Christiansen, J., Baeten, C. G., Rosen, H., Bittorf, B., Stösser, M., Madoff, R., Kamm, M. A. Sacral nerve stimulation for faecal incontinence in patients with previous partial spinal injury including disc prolapse. Br. J. Surg., 2005 Jun; 92 (6): 734–729.
17. Jarrett, M. E., Matzel, K. E., Stösser, M., Baeten, C. G., Kamm, M. A. Sacral nerve stimulation for fecal incontinence following surgery for rectal prolapse repair: a multicenter study. Dis. Colon Rectum, 2005 Jun; 48 (6): 1243–1248.
18. Boyle, D., Prosser, K., Allison, M., Williams, N., Chan, Ch. Percutaneous tibial nerve stimulation for the treatment of urge faecal incontinence. Dis. Colon Rectum, 2010, 53, 4, p. 432–437.
19. Tan, E., Ngo, N. T., Darzi, A., Shenouda, M., Tekkis, P. P. Meta-analysis: sacral nerve stimulation versus conservative therapy in the treatment of faecal incontinence. Int. J. Colorectal Dis., 2011 Mar; 26 (3): 275–294. Epub 2011 Jan 29.
20. Bock, S., Folie, P., Wolff, K., Marti, L., Engeler, D. S., Hetzer, F. H. First experiences with pudendal nerve stimulation in fecal incontinence: a technical report. Tech. Coloproctol., 2010 Mar; 14 (1): 41–44.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Současná onkochirurgie a kód multidisciplinárního týmu
- Trendy v léčbě jaterních metastáz kolorektálního karcinomu v Japonsku
- Stimulace sakrálního nervu v léčbě fekální inkontinence – první zkušenosti v České republice a hodnocení funkčních výsledků
- Incidence a rizikové faktory vzniku střevní ischemie u pacientů po resekci AAA v našem souboru z let 2005–2009
- IGF1 a nádorové markery ve stadiích nádoru prsu
- Transrektální hybridní NOTES versus laparoskopická cholecystektomie – randomizovaná prospektivní studie na velkém laboratorním zvířeti
- Torzia dystopickej sleziny – možnosti riešenia
- Zpráva z 21. světového kongresu IASGO – International Association of Surgeons, Gastroenterologists and Oncologists
- Karcinom rekta, totální mezorektální excize. Současné trendy v zobrazování a hodnocení kvality. Workshop za účasti prof. R. J. Healda
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Stimulace sakrálního nervu v léčbě fekální inkontinence – první zkušenosti v České republice a hodnocení funkčních výsledků
- Torzia dystopickej sleziny – možnosti riešenia
- IGF1 a nádorové markery ve stadiích nádoru prsu
- Incidence a rizikové faktory vzniku střevní ischemie u pacientů po resekci AAA v našem souboru z let 2005–2009
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



