-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVěk jako rizikový faktor ototoxicity způsobené cisplatinou
Age as a Risk Factor of Cytotoxicity Caused by Cisplatin
Cisplatin is chemotherapy agent, which is used in various types of neoplasia. On of undesirable effects of cisplatin therapy is ototoxicity. The authors followed a group of child patients with the diagnosis of neuroblastoma and osteosarcoma. These two groups differ in diagnosis, mean age of the patients and the cumulative cisplatin dose. All patients were examined by audiology at the beginning and at the end of chemotherapy and a part of the patients also one year after the end of treatment. Age deteriorated during chemotherapy in both groups. The patients with neuroblastoma suffered from a more pronounced deterioration of hearing. Hearing proved to be worse even several years after the end of chemotherapy.
Keywords:
cisplatin, ototoxicity
Autoři: D. Hošnová
Působiště autorů: Klinika dětské otorinolaryngologie LF MU a FN Brno, přednosta prof. MUDr. I. Šlapák, CSc.
Vyšlo v časopise: Otorinolaryngol Foniatr, 64, 2015, No. 1, pp. 3-7.
Kategorie: Původní práce
Souhrn
Cisplatina je chemoterapeutikum, které je léčebně využíváno u řady neoplazií. Jedním z nežádoucích účinků léčby cisplatinou je ototoxicita. Sledovali jsme soubor dětských pacientů s diagnózou neuroblastomu a osteosarkomu. Skupiny se navzájem liší diagnózou, průměrným věkem pacientů a kumulativní dávkou cisplatiny. Všichni pacienti byli audiologicky vyšetřeni na začátku chemoterapie a na jejím konci a část pacientů vždy po jednom roce od ukončení léčby. V obou skupinách došlo ke zhoršení sluchu během chemoterapie. Výraznější zhoršení sluchu bylo u pacientů s neuroblastomem. Sluch u těchto pacientů se horší i několik let po ukončení chemoterapie.
Klíčová slova:
cisplatina, ototoxicitaÚVOD
Ototoxicita je definována jako poškození struktur vnitřního ucha (kochley a/i rovnovážného systému) nebo sluchového nervu působením cizorodé látky (9). Jednou z těchto látek je cisplatina. Cisplatina je chemoterapeutikum s širokým využitím v léčbě maligních tumorů. Cisplatina se váže na purinové báze v DNA kovalentní vazbou, způsobuje vnitrořetězcové i meziřetězcové vazby a zlomy, čímž poškozuje DNA (1). Za příčinu ototoxicity způsobené cipslatinou je oxidativní stres po vyčerpání antioxidativních mechanismů (5).
Na buněčné úrovni způsobuje cisplatina destrukci zevních vláskových buněk – postupuje směrem od báze k apexu, pravděpodobně z důvodu nižší hladiny antioxidantů v zevních vláskových buňkách v oblasti báze, ve srovnání s apexem (15). Rovněž ale dochází k destrukci vnitřních vláskových buněk, podpůrných buněk Cortiho orgánu, buněk spirálního ganglia, k atrofii stria vascularis, kolapsu Reisnerovy membrány. Na molekulární úrovni dochází ke tvorbě volných kyslíkových a kovových radikálů a po vyčerpání antioxidantů ke smrti buňky mechanismem apoptózy. Substance přestupují do endolymfy vnitřního ucha po parenterálním podání (skrze hojně vaskularizované struktury stria vaskularis) (8).
Poškození sluchu je obvykle v počátečních stadiích reverzibilní, později je nevratné, je oboustranné, většinou symetrické. Je charakterizováno přítomností tinitu, který je vysokofrekvenční a odpovídá postižení bazální části kochley. Hypakuse je zpočátku vysokofrekvenční, pacientem není vnímána, je diagnostikovatelná vysokofrekvenční audiometrii 12,16 kHz. Při pokračování léčby se stává pacientem vnímatelnou, postupuje do nižších frekvencí, stává se pankochleární (14). Vestibulární poškození je méně nápadné. Vzhledem k současnému poškození obou labyrintů nevzniká typický vestibulární syndrom charakterizovaný vertigem, nystagmem a vegetativními příznaky, charakteristická je nejistota v chůzi a vestibulární ataxie (18).
Mezi rizikové faktory, které zhoršují poškození sluchu, řadíme věk pacienta, kumulativní dávku ototoxické látky, u cisplatiny je udávána kumulativní dávka, při níž dochází k poškození sluchu, 400 mg/m2 pro dětský věk (v případě běžně měřených frekvencí 125-8000 Hz) a 220 mg/m2 (v případě použití vysokofrekvenční audiometrie 12, 16 kHz (10). Dále je to užívání jiných látek s ototoxickým účinkem, preexistující onemocnění vnitřního ucha, radiace na oblast vnitřního ucha (dnes s použitím moderních radiačních vykrývacích technik je riziko ototoxicity sníženo na minimum), současné poškození jaterních a renálních funkcí, těžký stav pacienta (malnutrice, anemie), rovněž genetická výbava pacienta (variabilita v genech kódující enzymy účastnící se na metabolizaci cisplatiny a odstraňování volných kyslíkových radikálů) (11, 16, 17). V dnešní době přes intenzivní výzkumy neexistuje v humánní medicíně účinná prevence vzniku ototoxicity. Vzhledem k poškození antioxidačního systému zevních vláskových buněk je studována celá řada látek, které snižují oxidativní stres kochley, zatím však s nejasnými výsledky. V současné době se pouze na laboratorní úrovni prokázal otoprotektivní účinek thiosulfátu sodného, D-methioninu, N-acetylsyteinu, esterů glutathionu, vitaminu E. Rovněž v laboratorní fázi zkoumání je transtympanální aplikace kortikoidů u onkologicky nemocných pacientů (2, 4, 6, 7, 12, 13).
U pacientů, kteří jsou léčení ototoxickými preparáty, je nutné pravidelné audiologické sledování, a to nejen v průběhu léčby, ale rovněž po jejím ukončení. Zlatým standardem je použití tónové audiometrie s vysokofrekvenční audiometrií, vyšetření otoakustických emisí vzhledem k postižení zevních vláskových buněk. U malých dětí potom vyšetření kmenových potenciálů, audiometrie hrou, audiometrie s vizuálním posílením. O eventuální indikaci sluchadel potom rozhoduje výsledek slovní audiometrie, eventuálně percepčního testu. Sluch je hodnocen úplným popisem audiometrické křivky a stupňovacím systémem dle Brock. Tento systém byl vyvinut speciálně pro charakteristiku poruch sluchu, které jsou způsobené cisplatnou (3).
METODIKA
Ve studii jsou zařazeni pacienti léčení na Klinice dětské onkologie FN Brno. V první skupině jsou pacienti s diagnózou neuroblastomu, jedná se o malé děti do 5 let věku, druhou skupinu tvoří pacienti s diagnózou osteosarkomu, což jsou typicky adolescenti. Všichni pacienti jsou audiologicky vyšetřováni na počátku chemoterapie. S ohledem na věk, fyzický stav a mentální schopnosti jsou pacienti vyšetřováni pomocí tónové audiometrie, dále se jedná o vyšetření kmenových evokovaných potenciálů BAEP a vyšetření DPOAE s odhadem audiogramu. Stav sluchu byl hodnocen úplným popisem audiogramu a pro onkology systémem dle Brock.
Do studie byli zařazeni pacienti pouze s normálním sluchem na začátku chemoterapie (tj. do 20 dB na všech měřených frekvencích). Dále byli pacienti vyšetřeni na konci chemoterapie a vždy s odstupem jednoho roku od ukončení chemoterapie. Ve skupině pacientů sledovaných delší dobu nejsou zařazeni všichni pacienti, jsou vytvořeny podskupiny (úmrtí pacientů, změna foniatrického pracoviště blíže svému bydlišti). Výsledky jsou hodnoceny částečně retrospektivně, částečně prospektivně.
Pacienti, které jsme zařadili do souboru, jsou léčeni s diagnózou neuroblastomu (19 dětí – 9 chlapců a 10 děvčat) a osteosarkomu (16 dětí – 7 dívek, 9 chlapců). Pro jednotlivé skupiny diagnóz je typický jiný věk pacienta. Zatímco pacienti s neuroblastomem jsou malé děti, průměrný věk v době diagnózy v našem souboru je 41 měsíců, pacienti s osteosarkomy jsou adolescenti, průměrný věk v době diagnózy je 171 měsíců. U pacientů s neuroblastomem je průměrná dávka léčebně podané cisplatiny je 367 mg/m2, u pacientů s osteosarkomem je průměrná dávka podané cisplatiny 480 mg/m2.
VÝSLEDKY
Během sledovaného období bylo vyšetřeno na Klinice dětské ORL v Brně celkem 19 pacientů s neuroblastomem, 9 chlapců a 10 děvčat. Průměrný věk v době diagnózy byl 41 měsíců. Celková dávka cisplatiny byla 367 mg/m2. U části pacientů v této skupině jsme museli použít jako vyšetřovací metodu DPOAE s odhadem audiogramu a BAEP (stimulem tone bursty) pro nespolupráci při tónové audiometrii. Zde bylo možné hodnocení dle Brock. (Tónovou audiometrii bylo možné zařadit u všech sledovaných pacientů až 1 rok po ukončení terapie opakovanými nácviky audiometrického vyšetření.)
Z 19 pacientů s neuroblastomem mělo na konci chemoterapie normacusis bilat pouze 5 pacientů. Z celkové skupiny byla vytvořena podskupina 9 pacientů, kteří byli sledováni více let od ukončení chemoterapie. S dalšími roky sledování se počet normálně slyšících jedinců ještě dále snižoval. Vyšetření vysokofrekvenční audiometrií nepodstoupili všichni zařazení pacienti, proto je zde neuvádíme (tab. 1, tab. 2, graf 1, graf 2).
Tab. 1. Souhrn pacientů s neuroblastomem. 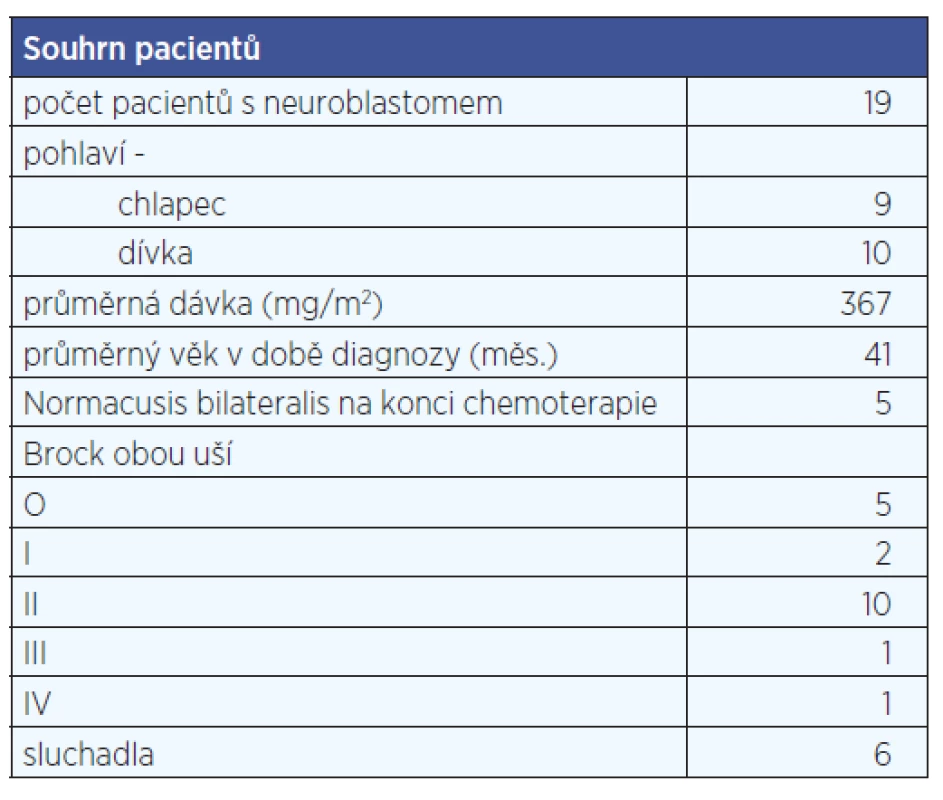
Tab. 2. Skupina pacientů s neuroblastomem, sledovaná 2 roky od ukončení chemoterapie. 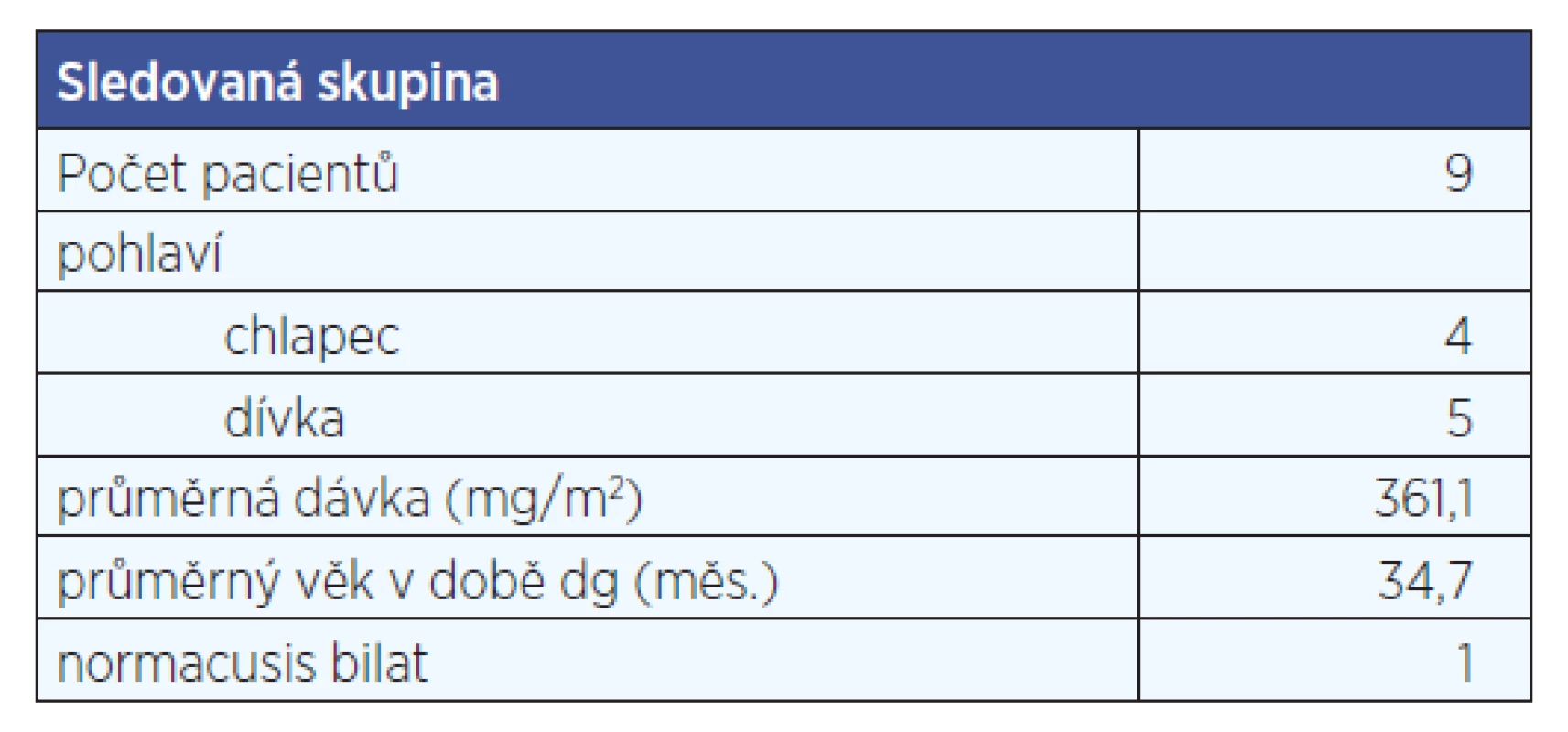
Graf 1. Průměrné audiogramy vytvořené vždy po 1 roce od ukončení chemoterapie (pacienti s neuroblastomem). 
Graf 2. Poruchy sluchu dle Brock u pacientů s neuroblastomem. 
Ve sledovaném období bylo vyšetřeno celkem 16 pacientů s osteosarkomem, jedná se o adolescenty. Průměrná dávka cisplatiny je 480 mg/m2. Byla vytvořena podskupina 7 pacientů, která byla sledována 2 roky od ukončení chemoterapie.
I u pacientů s osteosarkomem dochází na konci chemoterapie ke zhoršení sluchu, pouze 5 pacientů z 16 mělo na konci chemoterapie normacusis bilat, ale poškození sluchu pacientů není tak výrazné jako u pacientů mladších s neuroblastomem a sluch se jim s dalšími roky prakticky nemění, a to i přes vyšší celkovou kumulativní dávku cisplatiny (tab 3, tab. 4, graf 3, graf 4).
Tab. 3. Souhrn pacientů s osteosarkomem. 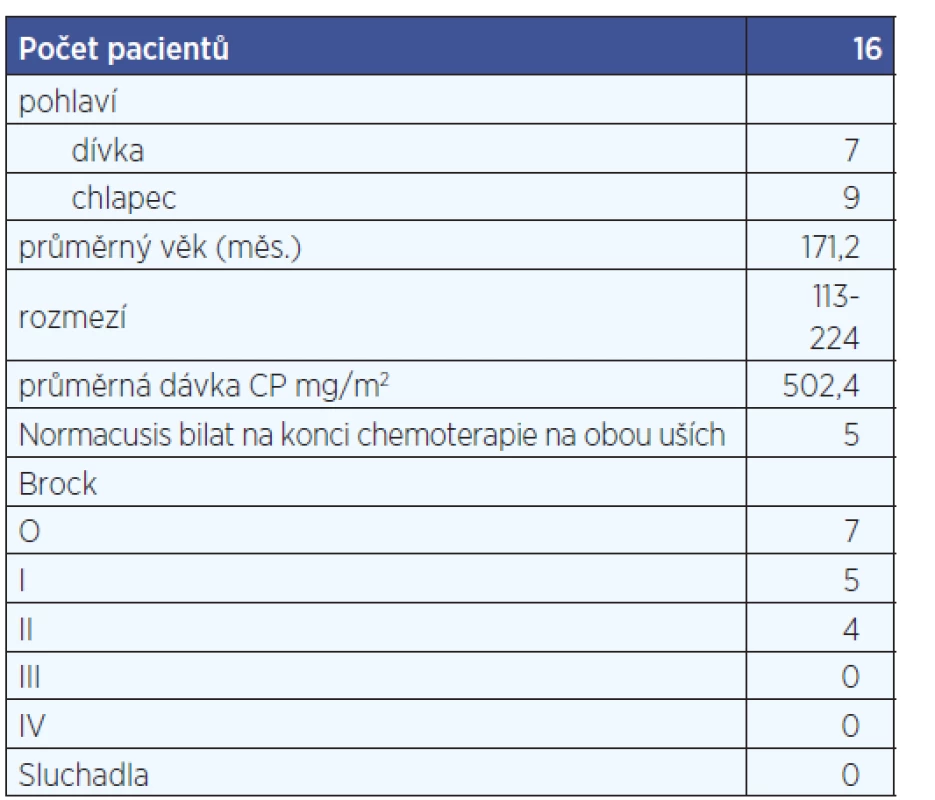
Tab. 4. Skupina pacientů s osteosarkomem, sledovaná 2 roky od ukončení chemoterapie. 
Graf 3. Průměrné audiogramy vytvořené vždy po 1 roce od ukončeni chemoterapie (pacienti s osteosarkomem). 
Graf 4. Poruchy sluchu dle Brock u pacientů s osteosarkomem. 
DISKUSE
Studie zabývající se ototoxickým účinkem cisplatiny si mnohdy odporují, což může být způsobeno malým počtem pacientů v souboru. Množství podané cisplatiny je udáváno v mg podané látky na metr čtvereční plochy těla. U dětských pacientů dochází k poškození řečových frekvencí (500-2000 Hz) při překročení kumulativní dávky cisplatiny 400 mg/m2.Tato dávka je obecně přijímána jako kritická pro dětský věk. Při využití vysokofrekvenční audiometrie je prokázána ztráta sluchu různého stupně již při dávce 220 mg/m2 (10).
Rozdělením pacientů dle diagnóz bylo získáno rozdílné věkové zastoupení v obou skupinách. Zatímco u malých dětí dochází i přes nízkou dávku cisplatiny k výrazné poruše sluchu, u adolescentů je tomu právě naopak. I přes vysokou dávku dochází k menší ztrátě sluchu ve srovnání s malými dětmi. Právě proto je nutné u malých dětí intenzivně sledovat stav sluchu nejen během léčby a eventuálně zavčas změnit léčbu například výměnou za méně toxický preparát, nebo dávku redukovat i na konci chemoterapie, a to i u dětí s normálním sluchem. Guidelines COG verze 3,0 2008 doporučují pravidelné sledování sluchu každý rok po ukončení chemoterapie, pokud jsou známky poškození sluchu na jejím konci. My se přikláníme k pravidelnému vyšetřování sluchu i při normálním sluchu na konci chemoterapie pro možný rozvoj nedoslýchavosti i po jejím ukončení. Doporučujeme sledování vždy minimálně po 1 roce. V našem souboru je nositeli sluchadel 6 pacientů s neuroblastomem, přičemž doba přidělení sluchadla od ukončení chemoterapie je 36 měsíců (1-72 měsíců).
Zlatým standardem při vyšetřování stavu sluchu je použití tónové audiometrie, včetně vyšetření vysokých frekvencí 12, 16 tis. Hz, tyto frekvence jsou postiženy nejdříve. Vzhledem k nízkému věku pacientů a jejich časté nespolupráci jsou využívány i objektivní metody vyšetření sluchu – TEOAE, DPOAE, BAEP. Otoakustické emise odrážejí činnost zevních vláskových buněk, jejich vyšetření je vhodné zejména v počátečních stadiích ototoxické terapie, při subklinickém postižení sluchu. Nevýhodou jejich použití, zvláště v dětském věku, je falešná negativita výsledků při středoušní patologii, která je u dětí častá (OMCHS).
ZÁVĚR
V prezentované práci je prokázáno, že věk je velmi důležitým rizikovým faktorem, naproti tomu i vysoká kumulativní dávka cisplatiny nemusí poškození sluchu způsobit. Audiometrické vyšetření sluchu se u dospělých léčených cisplatinou prakticky neprovádí. Poškození sluchu zhoršuje kvalitu života, u dětí brání správnému rozvoji řeči, zhoršuje sociální integraci, tím více, pokud se jedná navíc o onkologicky nemocného jedince. V dnešní době, díky pokrokům na poli onkologické léčby, je dnes vyléčeno více než 80 % onkologicky nemocných dětí. Pozdní nežádoucí účinky léčby, včetně poruchy sluchu, tedy nabývají na významu, proto je nanejvýše nutné sledovat stav sluchu nejen v průběhu léčby, ale i po jejím ukončení.
Adresa ke korespondenci:
MUDr. Dagmar Hošnová
Klinika dětské ORL LF MU a FN
Černopolní 9
613 00 Brno
e-mail: dagmarp@email.cz
Zdroje
1. Adam, Z., Vorlíček, J., Koptíková, J.: Obecná onkologie a podpůrná léčba, Praha, Grada publishing, a.s, 2003.
2. Berglin, C. E., Pierre, P. V., Bramer, T.: Prevention of cisplatin-induced hearing loss by administration of a thiosulfate-containing gel to the middle ear in a guinea pig model. Cancer Chemotherapy and Pharmacology, 68, 2011, s. 1547-1556.
3. Brock, P. R. a spol.: Cisplatin ototoxicity in children: a practical grading system. . Medical and Pediatric Oncology, 19, 1991, sv. 4, s. 295-300.
4. Daldal, A., Odabasi, O., Serbetcioglu, B.: The protective effect of intratympanic dexamethasone on cisplatin-induced ototoxicity in guinea pigs. Otolaryngology - Head and Neck Surgery, 137, 2007, sv. 5, s. 747-752.
5. De Freitas, M. R., et al.: The role of apoptosis in cisplatin-induced ototoxicity in rats. Brazilian Journal of Otorhinolaryngology, 75, 2009, sv. 5, s. 745-752.
6. Elferink, F. a spol.: Interaction of cisplatin and carboplatin with sodium thiosulfate: reaction rates and protein binding. Clinical Chemistry, 32, 1986, sv. 4, s. 641-645.
7. Feghali, J. G., Liu, W., Van De Water, T. R.: L-N-Acetyl-Cysteine Protection against cisplatin-induced auditory neuronal and hair cell toxicity. The Laryngoscope , 111, 2001, sv. 7, s. 1147-1155.
8. Hill, G. W., Morest, D. K., Parham, K.: Cisplatin-induced ototoxicity: effect of intratympanic dexamethasone injections. Otology and Neurotology. 29, 2008, sv. 7, s 1005-1011.
9. Klozar, J. et al.: Speciální otorinolaryngologie, Praha, Galen, 2005.
10. Knight, K. G., Kraemer, D. F., Neuwelt, E. A.: Ototoxicity in children receiving platinum chemotherapy: Underestimating a commonly occurring toxicity that may influence academic and social development. Journal of clinical Oncology, 23, 2005, sv. 34.
11. Moeller, B. J. a spol.: Low early ototoxicity rates for pediatric medulloblastoma patients treated with proton radiotherapy. Radiation Oncology, 6, 2011, sv. 58.
12. Reiter, R. J., Tan, D. X., Korkmaz, A.: Drug-mediated ototoxicity and tinnitus: alleviation with melatonin. Journal of Physiology and Pharmacology, 62, 2011, sv. 2, s. 151-157.
13. Riga, M. G. a spol.: Transtympanic injections of N-acetyl-cysteine for the prevention of cisplatin-induced ototoxicity: A feasible method with promising efficacy. American Journal of Clinical Oncology, 2011.
14. Rybak, L. P. a spol.: Cisplatin ototoxicity and protection: Clinical and experimental studies. The Tohoku Journal of Experimental Medicíně, 219, 2009 , sv. 3, s. 177-186.
15. Sha, S. H.: Differential vulnerability of basal and apical hair cells is based on intrinsic susceptibility to free radicals. Hearing Research, 155, 2001, sv. 1-2, s.1-8.
16. Šlampa, P. a spol.: Ozáření kraniospinální osy u dětí s meduloblastomy v supinační poloze: dlouhodobé výsledky. Česká a Slovenská Neurologie a Neurochirurgie, 70/103, 2007, sv. 3, s. 308-314.
17. Talach, T. a spol.: Ototoxicita indukovaná cisplatinou - klinické sledování a stanovení individuální senzitivity. Otorinolaryngologie a foniatrie, 59, 2010, sv. 4, s. 175-179.
18. Vrabec, P., Lischkeová, B., Skřivan, J., Černý, R., Truc, M.: Rovnovážný systém II – speciální část. Triton, Praha, 2007.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek Coganův syndromČlánek Difúzny veľkobunkový B-lymfóm ako najčastejší B-bunkový non-Hodgkinov lymfóm oblasti hlavy a krkuČlánek POZVÁNKAČlánek Kurz chirurgie příušní žlázyČlánek 1. česká ORL akademie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2015 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Inosin pranobex v léčbě chřipky a dalších respiračních infekcí virové etiologie
-
Všechny články tohoto čísla
- Stav screeningu sluchu novorozenců v ČR
- Screening sluchu fyziologických a rizikových novorozenců metodami OAE a AABR – zhodnocení výsledků
- Změna ve způsobu měření ztrát do drénů s aktivním sáním umožní jejich dřívější odstranění po operacích hlavy a krku
- První zkušenosti se zobrazením vnitřního ucha magnetickou rezonancí s využitím intratympanické aplikace kontrastní látky
- Věk jako rizikový faktor ototoxicity způsobené cisplatinou
- Podtlaková terapie v otorinolaryngologii
- Coganův syndrom
- Tornwaldtova choroba – endoskopický chirurgický prístup
- Vydechovaný oxid dusnatý jako bioindikátor zánětu horních dýchacích cest – literární přehled
- Difúzny veľkobunkový B-lymfóm ako najčastejší B-bunkový non-Hodgkinov lymfóm oblasti hlavy a krku
- KUTVIRTOVA CENA 2014 – PODMÍNKY SOUTĚŽE
- Stáž na ORL klinice ve Würzburgu
- POZVÁNKA
- Kurz „Základní principy chirurgie kůže hlavy a krku“
- Kurz chirurgie příušní žlázy
- 1. česká ORL akademie
- 27. mezinárodní kurz endoskopické endonazální chirurgie
- Preparační kurz ORL – chirurgie ucha a spánkové kosti
- Podíl Haemophilus influenzae b na akutních zánětech středouší a meningitidách otogenního původu u dětí po zavedení očkování antihemofilovou vakcínou
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vydechovaný oxid dusnatý jako bioindikátor zánětu horních dýchacích cest – literární přehled
- Coganův syndrom
- První zkušenosti se zobrazením vnitřního ucha magnetickou rezonancí s využitím intratympanické aplikace kontrastní látky
- Difúzny veľkobunkový B-lymfóm ako najčastejší B-bunkový non-Hodgkinov lymfóm oblasti hlavy a krku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




