-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv fotodynamické terapie na cytomechaniku nádorové buněčné linie HeLa
Autoři: K. Tománková; P. Kolář; J. Malohlava; H. Kolářová
Působiště autorů: Ústav lékařské biofyziky, Lékařská fakulta, Univerzita Palackého v Olomouci
Vyšlo v časopise: Lékař a technika - Clinician and Technology No. 3, 2012, 42, 32-36
Souhrn
Během posledních desetiletí byla k zobrazování detailních struktur biologických preparátů používána zejména elektronová mikroskopie (EM). Ačkoliv nám EM poskytuje vysoké rozlišení; zobrazovat vzorky bez fixace a barvení není zcela jednoduché a je tímto limitováno. Jak se ale ukazuje, mikroskopie atomárních sil (AFM) se zdá být vhodným nástrojem nejen pro zobrazení biologických struktur, ale i k jejich manipulaci s nimi v nativním stavu a v přirozeném prostředí. Navíc nám poskytuje přesné morfologické a mechanické informace v reálném čase a v nanorozlišení. Moderní AFM přístroj pracuje s pikonewtonovou silovou interakcí s povrchem preparátu, což nám umožňuje provádět detailní studie mofrologických charakterizací biologického vzorku a popisy interakcí hrot-vzorek.
Jako biologický objekt byla vybrána HeLa buněčná linie (nádor děložního hrdla virového původu), která je citlivá vůči fotodynamické terapii za současného využití ftalocyaninového senzitizeru. Pro detekci změn v buněčné kultuře byly použity dva různé mikroskopy atomárních sil: Bioscope Catalyst od firmy Bruker a Ntegra AURA od firmy NT-MDT jako nástroj pro detekci mechanických změn po terapii.
Naše práce má za úkol upozornit na jednu z aplikací mikroskopie atomárních sil - mechanickou charakterizaci buněk před a po poškození fotodynamickou terapií, která může mít výhledově velký přínos v diagnostice různých onemocnění.Keywords:
cytomechanika, mikroskopie atomárních sil, fotodynamická terapieÚvod
Fotodynamická terapie (PDT) je metoda léčby maligních i benigních onemocnění neinvazivním způsobem využívající fotocitlivou látku s vhodným absorpčním maximem, viditelného světla o vhodné vlnové délce a vznikajícího singletního kyslíku jako oxidačního zdroje, který je produkován v místě akumulace sensitizeru po ozáření [1]. Fotodynamická terapie indukuje dramatické změny v buněčné morfologii a v cytoskeletu v závislosti na světelné dávce, koncentraci sensitizeru a době po ozáření. V prvních 10 sekundách může dojít k mírnému smrštění buňky a k počáteční fázi narušení mikrotubulů bez výrazných změn mirkofilament. Na buněčné membráně se mohou objevit malé puchýřky. Po 300 sekundách PDT indukuje zřejmé zmenšení buňky s výraznějším růstem puchýřků na membráně a hlubokým narušením mikrotubulů. Ve dvojnásobném čase od ozáření (600 s) dochází k zintenzivnění předchozích změn. Membrána vznikajících mikrotubulových váčků může být obklopena reorganizovanými mikrofilamenty, zatímco extracelulárně prodloužené mikrotubulové váčky jsou lokalizovány na extracelulární mikrofilamentě. Nejvíce výrazné změny v cytoskeletární struktuře nastávají v 10 minutě po ozáření, kdy dochází k masivnímu růstu membránových bublinek a k narušení celého cytoskeletu [2].
Biopolymerní bílkoviny představují základní prvky cytoskeletu eukaryotických buněk a určují tvar a mechanickou odolnost buněk. Do polymerních bílkovin tvořících tzv. vnitřní lešení buněk spadají obecně tři strukturní komponenty: aktinové mikrofilamenty (F-aktin), střední filamenty (vimentin) a mikrotubuly (tubulin) [3]. Každá z těchto komponent má svou specifickou funkci, ovšem dohromady tvoří celkovou mechanickou deformační charakteristiku. Systém opory buňky se uplatňuje např. při transportu buněčných komponent nebo při buněčném dělení. Bílkoviny v oblastech mezi jednotlivými buňkami tvoří extracelulární matrix (ECM), která k sobě váže buňky a tvoří tak kompletní tkáně. Na povrchu buněk jsou adhezní receptory tzv. integriny, které tvoří klastry známé jako adhezní ohniska (Focal adhesions). Tyto vazebné oblasti jsou zodpovědné za soudržnost buněk a ECM k dalším buňkám [2, 3]. Struktura ECM a celého cytoskeletu může být transformována nádorovým bujením. Pozměněná struktura a mecha-nizmus deformace cytoskeletárních bílkovin může mít vlit na schopnost buněk komunikovat s okolním prostředím a zejména se mění mechanické vlastnosti celé buňky nebo její části. Výsledkem může být změna v motilitě nádorových buněk a může dojít k migraci na různá místa v lidském těle. V takovém případě dochází ke vzniku metastáz. Nádorové buňky si tvoří své vlastní signály k udržení růstu a rozmnožování a pomocí signálního přenosu je transportují mezi další proteiny. Tyto signály probíhají v obousměrné komunikaci mezi ECM a organelami buňky včetně cytoplazmy, jádry a adhezními ohnisky.
Elastické vlastnosti živých buněk mohou být analyzovány použitím velkého množství biofyzikálních metod, ke kterým patří stres-relaxační metody či silově-modulační metody, např. magnetická twist cytometrie, AFM medoty, cytointendace, optické pinzety, aspirace mikropipetou, smykový tok, atd. [4]. Těmito metodami je možné analyzovat povrch buňky v rozsahu sil 10-12–10-6 N s přesunem sondy pod 1 nm. Pomocí AFM je možné vyvolat lokální deformaci povrchu buňky jejím kontaktem s ostrou špičkou, která je umístěná na volném konci nosníku. Síly jsou poté odhadnuty snímáním výchylky nosníku pomocí laserového paprsku dopadajícího z konce odrazivé plochy raménka do fotodiody [5, 6].
Průkopníci těchto studií poukazují na změny mechanických vlastností buněk při různých procesech (buněčný růst, adheze, diferenciace, migrace, karcinogeneze a v neposlední řadě stárnutí či atak viru) [7, 8, 9, 10]. Je známo, že Youngův modul nádorové a normální buňky se liší a to díky rozdílné organizaci cytoskeletu [9]. Např. MCF7 buněčná linie prsního adenokarcinomu se chová jako complex lineárního viskoelastického materiálu v aplikovaných silách 0,5–4 nN. Metastatická buňka je měkčí než zdravá buňka [9, 10]. Nejměkčí část buňky je její jaderná oblast. Například Youngův modul NIH3T3 myšího fibroblastu v oblasti jádra je 4 kPa a oblast mimo jader dosahuje tuhosti až 100 kPa [11].
Koncentrace a molekulární architektura různých složek cytoskeletu určuje celkovou deformovatelnost a mechanickou odezvu buněk spolu s chemome-chanickým prostředím, které zajišťuje interakce buněk s ostatními sousedními buňkami a ECM. Jakékoli změny na buněčné funkce vyvolané biochemickými procesy, které probíhající v lidském těle, jako je např. invaze cizích organismů nebo vývoj chorob, může výrazně ovlivnit mechanické vlastnosti buněk [3]. Tyto změny mohou být využity jako indikátory biologického stavu organizmu a mohou nabídnout cenné informace o patogenním základu nemoci. Defekty ve struktuře cytoskeletu mají vliv na počet onemocnění, včetně různých typů nádorů. Pokud se zaměříme na cytoskelet a upravíme strukturální, mechanické a biochemické funkce poškozených buněk, můžeme otevřít novou cestu pro vývoj léčiv rakoviny a dalších chorob.
Materiál a metody
V našich experimentech jsme jako biologický model použili HeLa buněčnou linii (karcinom děložního hrdla virového původu). Jako materiálu bylo použito růstové medium DMEM (10% fetálního bovinního séra, 2% 200 mM L-glutaminu, 0,4% penicilinu/streptomycinu, Sigma). Sensitizery ClAlPcS2 a TMPyp, dale Poly-L-lysin (PLL, Sigma), PBS. Ozáření bylo prováděno LED diodami s vlnovou délkou 660 nm, FWHM 25 nm. Měření bylo prováděno na AFM Ntegra Aura (NT-MDT) – stanovení elasticity, Bioscope Catalyst (Bruker) – zobrazení na inverzním optickém mikrosko-pu Olympus IX81 s DSU jednotkou (Olympus). Buňky byly kultivovány na sterilních plastových discích Thermanox® (Nunc) vložených do 35 mm Petriho misek (Iwaky) nebo přímo v Petriho miskách.
Příprava buněčné kultury
100 000 HeLa buněk bylo kultivováno ve 2 ml DMEM media v atomosférě 5% CO2 po dobu 24h při 37°C na plastových discích Thermanox® modifikova-ných poly-L-lysinem (0,01% PLL, inkubace 24h při pokojové teplotě, 2× opláchnutých deionizovanou vodou a vysušených). Buňky byly skenovány v čerstvém DMEM (bez fixace).
Fotodynamická terapie
Sensitizer ClAlPcS2 nebo TMPyp byl přidán do DMEM media v koncentraci 0 (kontrola) a 5 µM. Inkubace byla 24 h při 37°C a 5% CO2. Po inkubaci byly buňky opláchnuty PBS a ozářeny dávkou 5 J.cm-2 pomocí LED diod. Po ozáření byly buňky inkubovány dalších 6 h v čerstvém DMEM médiu.
Mikroskopie atomárních sil
Buňky byly zobrazeny se skenovací rychlostí 0,1 Hz. Pro zobrazení buněk byl použit hrot DNP10 (Burker) s rezonanční frekvencí 12-24 kHz a konstantou tuhosti 0,06 N.m-1. Pro mechanické mapování elasticity buněk byl použit hrot CSG10 (NT-MDT) s rezonanční frekvencí 8-39 kHz a konstantou tuhosti 0,01-0,5 N.m-1. Zobrazení buněk probíhalo v módu kontaktního měření nebo v módu Scan, což je poloviční doba potřebná Asyst. Snímky byly zpracovány pomocí SW programu Nova (NT-MDT) a Nanoscope analysis (Bruker). F-d křivky byly analyzovány programem SPIP (Image metrology). Čas měření byl limitován dobou 2 h k projevu teplotních změn na buněčných kulturách. Buňky byly nejprve naskenovány v topografickém módu a poté byl hrot umístěn nad jadernou oblast buňky. Bylo provedeno přibližně 20 měření silových křivek každé skupiny a data následně podrobena statistické analýze.
Výsledky a diskuze
Buňky kontrolní skupiny mají tendenci shlukovat se do kolonií, což částečně znemožňuje zobrazení mechanického rozložení na molekulární úrovni [9]. Naopak fotodynamicky ošetřené buňky rostou a jsou rozloženy nezávisle na okolních buňkách.
Pomocí AFM můžeme morfologicky klasifikovat vliv fotodynamické terapie na nádorovou buňku, jak lze vidět na obrázku 1 a 2. Výška neošetřené buňky byla 3,6 µm, a její velikost v ose x 52 µm a v ose y 33 µm. Rozměr fotodynamicky narušené buňky byl v ose x 25 µm a v ose y 21 µm. Výška byla 4,2 µm. Intaktní buňky jsou nižší díky aktinovým vláknům, které překrývají jádro a tlačí jej směrem k substrátu.
Obr. 1. Buňka HeLa kontrolní skupiny bez terapie. Inkubace 24h při 37 °C a 5% CO<sub>2</sub>. Velikost skenu 53 × 53 µm. Výška neošetřené buňky - 3,6 µm, v ose x 52 µm, v ose y 33 µm. Skenováno v kontaktním módu bez chemické fixace. Skenovací rychlost 0,1 Hz. 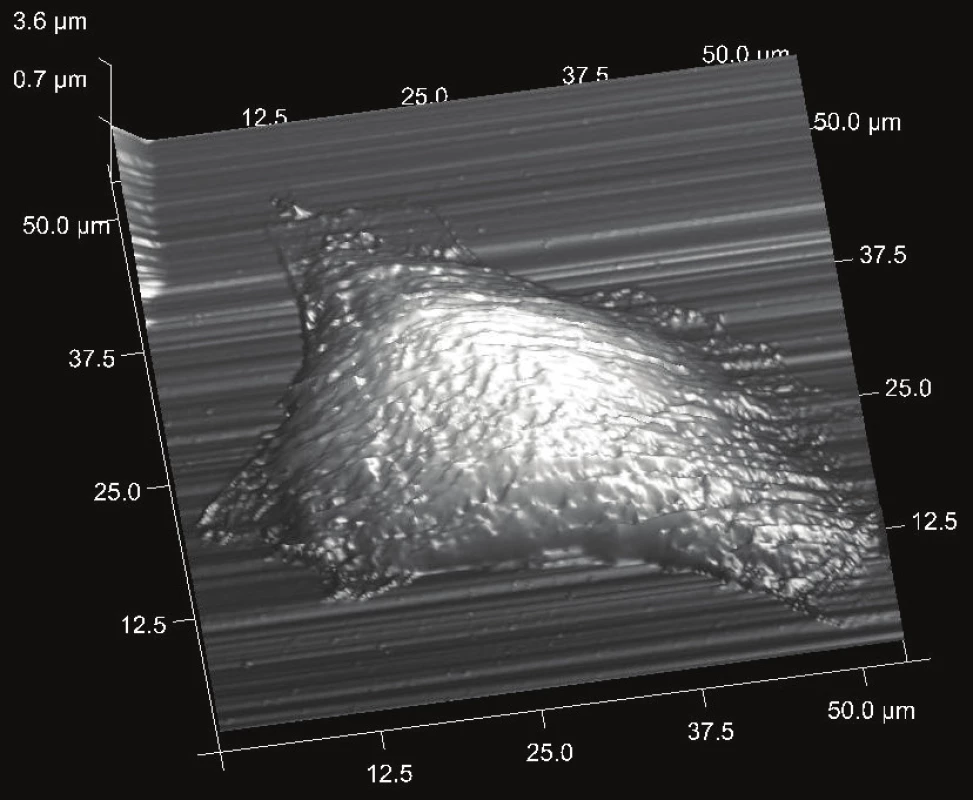
Obr. 2. Buňka HeLa po fotodynamické terapii. Inkubace 6 h od ozaření (5 J.cm<sup>-2</sup>) při 37 °C a 5% CO<sub>2</sub>. Velikost skenu 53 × 53 μm. Výška neošetřené buňky – 4,2 μm, v ose x 25 μm, v ose y 21 μm. Světlá oblast udává největší výšku buněk. Skenováno v módu ScanAsyst bez chemické fixace. Skenovací rychlost 0,1 Hz. 
Taková buňka je celkově větší a svůj objem zaujímá spíše v horizontálním prostoru než buňka po terapii. Skenování povrchu buněk technikou AFM může odhalit heterogenity mechanických vlastností povrchu a podpovrchových vrstev buněk v nanorozlišení. Rozlišení AFM na vzduchu ve svislém směru je 0,1–0,5 nm, v horizontálním směru je 1–5 nm, v závislosti na tuhosti vzorku. Při měření živých buněk ve vodném prostředí, může být horizontální rozlišení posunuto i na několik desítek nanometrů s ohledem na vlastnosti měkké buněčné membrány. Tloušťka buněčné membrány je přibližně 5–10 nm. Citlivost a rozlišení AFM závisí také na hrotu a vlastnostech nosníku (např. poloměru, tvaru, materiálu atd.) [8].
Cytoskelet zahrnuje komplexní síť biopolymerních molekul a především určuje tvar buňky a její mechanickou odolnost. Tři základní biopolymery cytoskeletu mají rozdílnou odezvu vůči mechanickému působení: F-aktin v mikrofilamentech má vysokou odolnost proti deformaci až do určité kritické hodnoty místního působení tlaku a jeho Youngův modul byl určen na 1,3–2,5 GPa. Vysoká koncentrace F-aktinu je např. v buňkách mozkové kůry, kde tvoří jakousi polymerní síť, která je ovšem snadno fluidizována při vysokých smykových napětích, což usnadňuje buněčný pohyb. Vimentin obsažený ve středních filamentech má Youngův modul 1–5 GPa. Tato vlákna odolávají pouze střednětlaké deformaci, ale přitom jsou vysoce odolná vůči smykové deformaci a tím udržují strukturní integritu buňky. Mikrotubuly, a v nich obsažený tubulin, samostatně nemá dostatečnou pevnost a tuhost. Nicméně, působí v souladu s ostatními cytoskeletální-mi biopolymery a přispívá k celkové stabilitě cytoskeletu. Jeho youngův modul byl určen 1,9 GPa [3, 10, 11, 12, 13].
Elastický modulus neporušených (kontrolních) a fotodynamicky narušených buněk (5 µM ClAlPcS2, 5 J.cm-2) je presentováno v grafu č. 1.
Graf 1. Graf 1: Elasticita HeLa buněk kontrolní skupiny (přepočet na 100% kontroly) a skupiny po fotodynamické akci (5 µM ClAlPcS<sub>2</sub>, 5 J.cm<sup>-2</sup>). Youngův modul vykazuje zvýšení o 64% u fotodynamicky narušených buněk oproti kontrolní skupině. 
Změna modulu může charakterizovat změnu mechanických vlastností jako hlavní vlastnost buňky. Buňky kontrolní skupiny vykazují větší elasticitu v jaderné oblasti, než buňky po PDT o celých 64%, jak je možné vidět v grafu č. 1. Čím vyšší je Youngův modul, tím je buňka méně elastická a tvrdší. Po fotodynamickém narušení buněčné struktury je jaderná oblast buňky tužší. Rozsah směrodatné odchylky je určen velkým rozptylem dat a určuje nám, že každá buňka má svou specifickou tuhost i přesto, že se jedná o stejnou buněčnou kulturu.
Je zřejmé, že mechanické parametry buněk závisí na experimentální metodě, na použití teoretického modelu, na typu buněk a experimentálních podmínkách [13]. Měření elasticity není možné, jestliže buňka není nasednutá k substrátu. V současné době již není vyžadována fixace buněk k substrátu během AFM měření, neboť moderní mikroskopy působí na vzorek velice malými silami v řádech pikonewtonů. Navíc, fixační procesy se negativně projevují při měření mechanických vlastností a je jasné, že rigidita buněk se s fixací výrazně zvyšuje. Důvod, proč jsme si vybrali jadernou oblast k určení mechanických vlastností buněk, je velice jednoduchý. V místě jádra je buňka dostatečně vysoká a je eliminován vliv substrátu ve výsledcích mechanické charakterizace. Ve skutečnosti, jádro buňky hraje důležitou roli jako centrální podpora pro udržení těla buňky a také hraje významnou roli v odpovědi buněk vůči mechanickému namáhání [4]. Cytoskelet jádra (tzv. jaderná lamina) především určuje tvar a velikost jádra, stejně tak jeho mechanické vlastnosti a spojuje jadernou vnitřní membránu k chromatinu [13]. Youngův modul buněk v oblasti jader je nejnižší s ohledem na celou stavbu buněčného těla a to až 10× [11].
Změny mechanických vlastností a reorganizace cytoskeletu se zdá být v korelaci s fázemi buněčného cyklu, se stárnutím buňky, s její diferenciací, motilitou, atd. [13]. Např. modul pružnosti srdeční buňky mláděte krysy byl 35,1 ± 0,7 kPa na rozdíl od srdeční buňky staré krysy 42,5 ± 1,0 kPa [8]. Rozložení tuhosti povrchu buněk se zdá být konstantní pro stacionární buňky. Ovšem začnou-li se pohybovat, tuhost v jaderné oblasti se značně sníží. Normální buňky mají Youngův modul asi o jeden řád vyšší než nádorové. Změny v elastických vlastnostech normálních a nádorových buněk může mít příčinu v rozdílné organizaci cytoskeletu buněk, což je pravděpodobně způsobeno zvýšeným síťováním jednotlivých proteinů.
Závěr
AFM skenování buňky je účinným nástrojem pro studium membránových a sub-membránových buněčných struktur. AFM lze efektivně využít při vyšetřování vlastností a dynamiky cytoskeletu, například po poškození fotodynamickou reakcí. Stanovením lokálních elastických vlastností buněk v jejich přirozeném prostředí se otevřela možnost detekce vlivu různých faktorů na mechanické vlastnosti živých buněk a odhad mechanických vlastností buněk pomocí AFM se zdá být perspektivní metodou diagnostiky různých chorob.
Poděkování
Tato práce byla podpořena projekty GAČR 303/09 H048, LF 2012/009 a Institutem Molekulární a Translační Medicíny CZ.1.05/2.1.00/01.0030.
Kateřina Tománková Ing., Ph.D.
Ústav lékařské biofyziky
Lékařská fakulta Univerzita Palackého
Hnevotínská 3, Olomouc 775 15
E-mail: katerina.tomankova@upol.cz
Phone: +420 585 632 103
Zdroje
[1] Kolarova H., Tomankova K., Bajgar R., Kolar P., Kubinek R. 2009. Photodynamic and sonodynamic treatment by phthalocyanine on cancer cell lines. Ultrasound in Medicine and Biology 35, 1397–1404,
[2] Jung SH, Park JY, Yoo JO, Shin I, Kim YM, Ha QS. 2009. Identification and ultrastructural imaging of photodynamic therapy - induced microfilaments by atomic force microscopy. Ultramicroscopy 109, 1428-1434.
[3] Suresh S. Biomechanics and biophysics of cancer cells. 2007. Acta Biomaterialia 3, 413–438.
[4] Sugitate T, Kihara T, Liu XY, Miyake J. 2009. Mechanical role of the nucleus in a cell in terms of elastic modulus. Curr. Appl. Phys. 9, e 291–e293.
[5] Sullivan CJ, Venkataraman S, Retter ST, Allison DP, Doktycz MJ. 2007. Comparison of the identation and elasticity of E. coli and its spheroplasts by AFM. Ultramicroscopy 107, 934-942.
[6] Casuso I, Rico F, Scheuring S. Biological AFM: where we come from – where we are – where we may go. J. Mol. Recognit. 24, 406-413.
[7] Mustata N, Ritchie K, McNally HA. 2010. Neuronal elasticity as measured by atomic force microscopy. J. Neurosci. Meth. 186, 35-41.
[8] Kuznetsova TG, Starodubtseva MN, Yegorenkov NI, Chizhik SA, Zhdanov RI. 2007. Atomic force microscopy probing of cell elasticity. Micron 38, 824-833.
[9] Leporatti S, Vergara D, Zacheo A, Vergaro V, Maruccio G, Cingolani R, Rinaldi R. 2009. Cytomechanical and topological investigation of MCF-7 cells by scanning force microscopy. Nanotechnology 20, 055103.
[10] Li QS, Lee GYH, Ong CN, Lim CT. 2008. AFM indentation study of breast cancer cells Biochem. Biophys. Res. Commun. 374, 609–613.
[11] Haga H, Sasaki S, Kawabata K, Ito E, Ushiki T, Sambongi T. 2000. Elasticity mapping of living fibroblasts by AFM and immunofluorescence observation of the cytoskeleton. Ultramicroscopy 82, 253-258.
[12] Starodubtsteva MN. 2011. Mechanical properties of cell and aging. Ageing Res. Rev. 10, 16-25.
[13] Docheva D, Padula D, Popov C, Mutschler W, Clausen-Schaumann H, Schieker M. 2008. Researching into the cellular shape, volume and elasticity of mesenchymal stem cells, osteoblasts and osteosarcoma cells by atomic force microscopy. J. Cell. Mol. Med. 12, 537-552.
[14] Nikkhah M, Strobl JS, De Vita R, Agah M. 2010. The cytoskeletal organization of breast carcinoma and fibroblast cells imide three dimensional (3-D) isotropic silicon microstructures. Biomaterials 31, 4552-4561.
Štítky
Biomedicína
Článek Editorial
Článek vyšel v časopiseLékař a technika

2012 Číslo 3-
Všechny články tohoto čísla
- ECMO ambulance and advanced emergency medical system
- Measurement of thermal symmetry of the human spine by the use of medical thermography
- Editorial
- Determination of Human Gait Phase by Zero-moment Point
- Stanovení pohybové aktivity na základě výsledků zátěžového vyšetření
- Vliv fotodynamické terapie na cytomechaniku nádorové buněčné linie HeLa
- Inovace praktických úloh ve výuce lékařské biofyziky Lékařské fakulty univerzity palackého
- Leksell gamma knife past, present and future
- Lékař a technika
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Leksell gamma knife past, present and future
- Stanovení pohybové aktivity na základě výsledků zátěžového vyšetření
- Vliv fotodynamické terapie na cytomechaniku nádorové buněčné linie HeLa
- Inovace praktických úloh ve výuce lékařské biofyziky Lékařské fakulty univerzity palackého
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



