-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role exozomů u nádorových onemocnění
Role of exosomes in malignancies
Background: Extracellular vesicles are closed structured surrounded by a lipid membrane that are secreted by almost all types of cells; their function is information delivery during cell-to-cell communication. They are most commonly divided into three categories – exosomes, microvesicles and apoptotic bodies. Exosomes are small vesicles with the size of 30–100 nm, and they are found in almost all body fluids, including peripheral blood, urine, breast milk, saliva and others. They are able to deliver their content to target cells and change their behavior. Cancer cells are able to secrete more exosomes and also contain different proteins and RNA species than the exosomes from healthy cells. Due to their specific composition that is connected to the cell of origin, exosomes could be used as biomarkers of various diseases in the future.
Purpose: The aim of this work is to summarize current knowledge about exosomes and their role in various processes connected to resistance in tumors.
This work was supported by grant of the Ministry of Health of the Czech Republic AZV 17-29343A.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
exozomy – nádory – extracelulární vezikuly – léková rezistence
Autoři: M. Vodičková; J. Gregorová; M. Ždárská; M. Vlachová; S. Ševčíková
Působiště autorů: Babákova myelomová skupina, Ústav patologické fyziologie, LF MU, Brno
Vyšlo v časopise: Klin Onkol 2020; 33(4): 274-279
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2020274Souhrn
Východiska: Extracelulární váčky jsou uzavřené struktury ohraničené lipidovou membránou, které jsou vylučovány téměř všemi druhy buněk, a jejich funkcí je přenos informací při mezibuněčné komunikaci. Nejčastěji se rozdělují do tří kategorií – exozomy, mikrovezikuly a apoptotická tělíska. Exozomy jsou malé váčky o velikost 30–100 nm a nacházejí se téměř ve všech tělních tekutinách, jako je periferní krev, moč, mateřské mléko, sliny a další. Jsou schopny doručovat svůj obsah do cílových buněk, a tím měnit její chování. Nádorové buňky mají větší sklon k sekreci exozomů a obsahují jiné proteiny a druhy RNA než exozomy vylučované z buněk zdravých. Vzhledem k jejich specifickému složení odpovídajícímu buňce původu a jejímu stavu by mohly být v budoucnu použitelné mimo jiné také jako biomarkery různých onemocnění.
Cíl: Cílem práce je shrnout dosavadní poznatky o exozomech a jejich zapojení v nejrůznějších procesech, které jsou spojeny s rezistencí u nádorových onemocnění.
Klíčová slova:
exozomy – nádory – extracelulární vezikuly – léková rezistence
Extracelulární váčky
Extracelulární váčky jsou uzavřené struktury ohraničené lipidovou membránou, které jsou vylučovány téměř všemi typy buněk. Nejčastěji se rozdělují do tří kategorií, které se mezi sebou liší např. hustotou lipidové membrány, obsahem nukleových kyselin, velikostí, anebo biogenezí. Všechny jsou ale svým složením podobné původní buňce a jejich funkcí je přenos informací při mezibuněčné komunikaci [1]. Do prvních dvou kategorií patří exozomy a mikrovezikuly, které jsou secernovány buňkami a které si jsou svým složením navzájem velmi podobné. Třetí kategorii tvoří apoptotická tělíska [2].
Exozomy
Exozomy jsou váčky ohraničené membránou, které jsou produkovány většinou buněk, o velikosti 30–100 nm. Membrána je tvořena lipidovou dvojvrstvou a uvnitř se nacházejí mimo jiné i nukleové kyseliny. Jsou bohaté na cytozolické a membránové proteiny (např. Rab proteiny či tetraspaniny) [3]. Přesné složení každého exozomu závisí na buňce původu [4]. Nacházejí se téměř ve všech tělních tekutinách, jako je periferní krev, moč, mateřské mléko, mozkomíšní mok a sliny. Jsou schopny doručit svůj obsah do cílových buněk, a tím měnit jejich chování [5,6].
Biogeneze exozomů
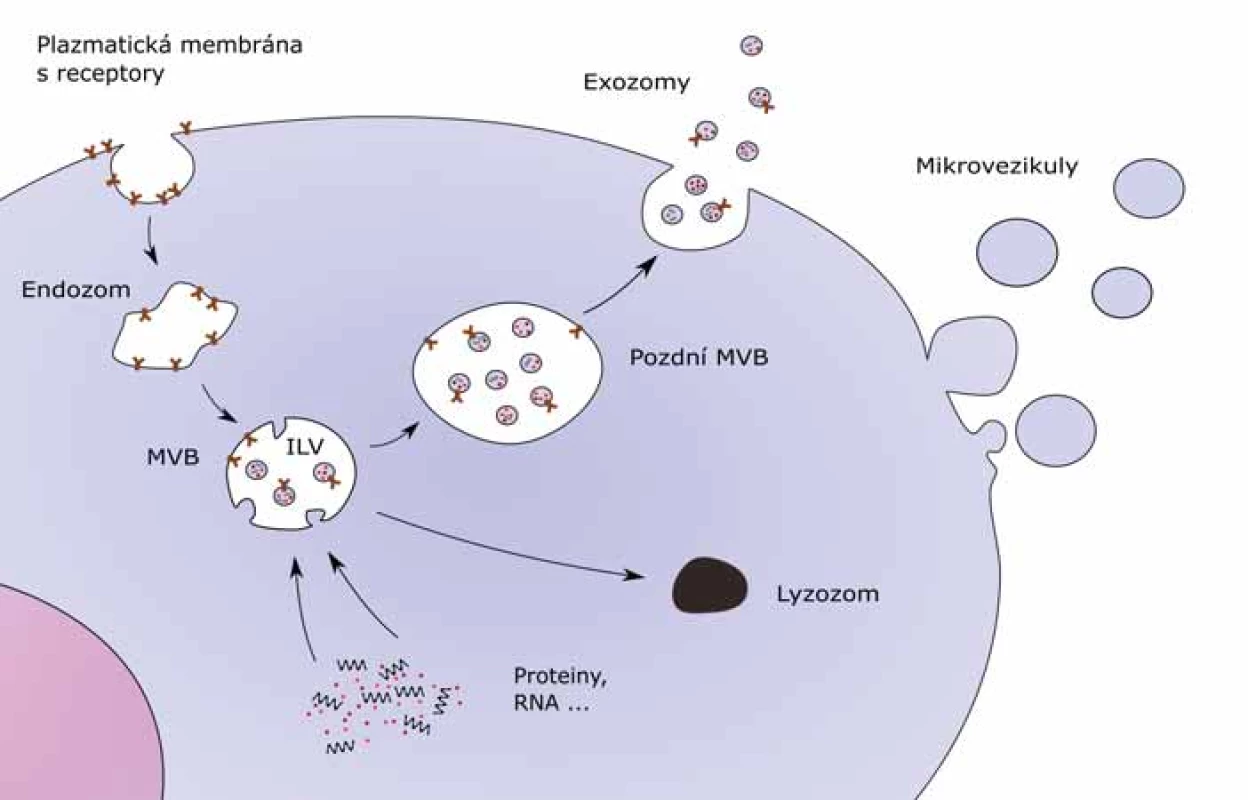
Exozomy vznikají invaginací plazmatické membrány, na rozdíl od ostatních extracelulárních váčků, které vznikají jejím pučením (obr. 1). Formují se v rámci endozomální dráhy, pomocí které buňka přijímá a rozděluje molekuly, které endocytuje. Endocytózou vzniká v buňce časný endozom, který dále dozrává v pozdní endozom, a ten se mění na multivezikulární tělísko (multivesicular body – MVB). Exozomy se tvoří z MVB a formují se tak, že se membrána MVB na několika místech vyboulí a uvolní dovnitř membranózní intraluminální váčky (intraluminal vesicles – ILV). Ty obsahují cytoplazmu, proteiny a RNA i DNA. Váčky se nazývají exozomy až poté, co MVB splyne s plazmatickou membránou buňky a vypustí svůj obsah do extracelulárního prostoru [7–9]. Některé MVB vzniklé v buňce nesplynou s plazmatickou membránou, ale podléhají degradaci pomocí lyzozomů. Molekulární podstata procesu degradace MVB nebo tvorby exozomu není plně objasněna. Oba děje mohou probíhat ve stejné buňce [10,11].
Biogeneze je z velké části zajišťována endozomálním třídicím komplexem (endosomal sorting complexes required for transport – ESCRT). ESCRT má čtyři multiproteinové komplexy – 0, I, II a III – které jsou doplněny dalšími proteiny. Tyto komplexy společně zajišťují vznik MVB, odštěpení ILV a rozdělení proteinů [12].
ESCRT 0 se účastní shromažďování jednotlivých složek exozomu a navázání ubikvitinu na proteinové receptory nacházející se na vnějším povrchu endozomu [13,14]. Membránové proteiny, které jsou ubikvitinované, se účastní formace MVB, zatímco neubikvitinované proteiny jsou vráceny zpět do plazmatické membrány nebo do Golgiho aparátu. ESCRT I, jehož důležitou součástí je protein TSG101, vytváří komplex s ubikvitinovanými proteiny, a tím aktivuje ESCRT II. Vzniklý komplex ESCRT I a ESCRT II je zodpovědný za deformaci membrány, která se vypoulí dovnitř MVB, aby vytvořila prostor pro tvorbu ILV s vybranými proteiny a nukleovými kyselinami. Výsledkem je, že MVB proteiny se oddělí a deubikvitinační enzym poslouží k tomu, aby odstranil ubikvitin z proteinů [15–17]. Nakonec aktivovaný komplex ESCRT II zahájí tvorbu složek ESCRT III, který opustí membránu MVB za pomoci energie dodávané třídicím proteinem s ATPázovou aktivitou Vps4. To umožní uvolnění ILV do lumen MVB [18].
Některé studie prokázaly, že existuje i biogeneze exozomů nezávislá na ESCRT. Jedním z důkazů této ESCRT nezávislé biogeneze je, že i po potlačení všech ESCRT komplexů bylo v buňce pozorováno MVB s ILV uvnitř [19]. Do ESCRT nezávislé dráhy mohou být také začleněny tetraspaniny [20], sfingolipidy [21] nebo proteiny teplotního šoku [22].
Mechanizmus uvolnění exozomů vyžaduje cytoskelet (aktin a mikrotubuly) a asociované molekulární motory kinesin a myozin. Několik studií potvrdilo nutnost přítomnosti Rab proteinů, které patří do skupiny malých GTPáz. Rab proteiny se účastní pučení váčků, jejich přenosu prostřednictvím cytoskeletu a také jejich navázání na povrch cílové buňky [23–25].
Exozomy uvolněné do mimobuněčného prostoru mohou svůj obsah transportovat do jiné buňky, a tím dosáhnout odpovědi a vyvolat fenotypové změny, které ovlivňují fyziologický nebo patologický stav buňky [24]. Přesný mechanizmus přijetí exozomu do buňky není zcela objasněn, protože se pro různé buňky liší [26]. Exozom se na buňku naváže přes molekulární interakci pomocí membránových proteinů, sacharidů nebo lipidů a adhezivních molekul, např. tetraspaninů, na povrchu exozomů. Bylo popsáno několik mechanizmů přijetí exozomu buňkou: fúze s buněčnou membránou [27], receptorem zprostředkovaná endocytóza [28] a makropinocytóza (typ endocytózy, při které dochází k pohlcení větších částic, např. nutrientů, antigenů a dalších rozpustných molekul) [29]. Těmito způsoby může recipientní buňka přijmout exozomy, které se stanou součástí ESCRT, a jednotlivé složky exozomu ji tak mohou ovlivnit. Mezi další možné mechanizmy patři i fagocytóza, pomocí které se exozomy dostávají do fagocytů, kde se stávají součástí lyzozomální degradační dráhy [30].
Složení
Složení exozomů odpovídá složení jejich mateřské buňky, a proto se od sebe mohou jednotlivé exozomy velmi lišit. Existují ale molekuly, které se běžně vyskytují u většiny z nich, jako např. membránové proteiny tetraspaniny (CD9, CD63, CD81), které jsou důležité při transportu exozomů a při jejich adhezi k cílové buňce [31,32]. Dále obsahují proteiny teplotního šoku (HSP70, HSP90), které fungují jako chaperony – zabezpečují skládání proteinů, transport přes membránu a zabraňují jejich agregaci. Rovněž hrají roli v procesu prezentace antigenu pomocí antigen prezentujících buněk [33,34]. Další ze skupiny exozomálních proteinů jsou Rab proteiny, malé GTPázy, které jsou důležité při transportu molekul přes buněčnou membránu, při nitrobuněčném transportu, fúzi a následné sekreci exozomů [35,36].
Zastoupení lipidů v exozomech je podobné lipidovým raftům v plazmatické membráně. Jsou bohaté na sfingomyelin, cholesterol, ceramid a fosfatidylserin. Studie s využitím hmotnostní spektrometrie prokázaly, že v exozomech je podíl těchto lipidů vůči ostatním lipidům několikrát větší než v buňce, ze které pochází [37–39]. Tyto lipidy také mohou hrát roli v biogenezi exozomů [21,40].
Exozomy obsahují také nukleové kyseliny, které mohou být překládány v jiné buňce [41]. Jsou bohaté hlavně na mRNA a mikroRNA (miRNA). Jelikož se zastoupení těchto druhů RNA v exozomech výrazně liší od buňky jejich původu, předpokládá se, že RNA jsou do exozomů vybírány selektivně [42]. Nejrůznější studie naznačují, že rozdělování miRNA do exozomů by mohlo být regulováno posttranskripčními modifikacemi, jako např. adenylací a uridylací [18].
Role exozomů v rezistenci vůči léčbě nádorů
Rezistence k nádorové terapii je zásadní překážkou v efektivní léčbě nádorů. Přirozená (primární) rezistence je geneticky podmíněná rezistence k léku, zatímco získaná (sekundární) rezistence, která se vyskytuje častěji, se vyvine po již proběhnuté léčbě. Obě jsou výsledkem interakcí v rámci mikroprostředí nádoru, které probíhají mimo jiné pomocí exozomů [43].
Mnohočetná léková rezistence
Nádorové buňky se získanou rezistencí k léku si často vytvoří tzv. mnohočetnou lékovou rezistenci, přestože má další léčba jiné složení látek a jiný mechanizmus účinku než léčba původní [44]. Mnohočetná léková rezistence je spojena se zvýšenou expresí přenašečů ze skupiny adenosintrifosfát (ATP) vázajících kazet (ATP-binding cassettes – ABC). Jsou to proteiny využívající energii z hydrolýzy ATP pro aktivní transport přes buněčnou membránu [45]. Jedním z nejdůležitějších ABC přenašečů je transmembránový glykoprotein P (P-gp) kódovaný genem MDR1. Funguje jako pumpa, která za fyziologických podmínek aktivně přenáší toxické látky ven z buňky. Zvýšené množství P-gp bylo detekováno u mnoha nádorových onemocnění, u nichž je častý výskyt rezistence k léčbě, jako např. nádory ledvin, jater, tlustého střeva, ale také u leukemií a lymfomů [43,46].
Několik studií dokazuje, že P-gp a další ABC přenašeče mnohočetné lékové rezistence jsou přenášeny z rezistentních buněk do buněk citlivých k léčivu [47,48]. Studie rezistence k docetaxelu u nádorů prostaty prokázala, že exozomy z rezistentních buněk dokážou navodit rezistenci u buněk citlivých k léčivu. Zvýšená exprese MDR1/P-gp byla pozorována u rezistentních buněk, zatímco u citlivých byla jeho hladina nedetekovatelná, což potvrzuje jeho roli v rezistenci [49]. Podobný fenomén byl zjištěn i při studii buněčné linie nádoru prsu. Buňky citlivé k docetaxelu měly po inkubaci s exozomy z rezistentních buněk rezistentní fenotyp a také zvýšenou expresi MDR1/P-gp. Navíc exprese MDR1/P-gp úměrně rostla spolu s množstvím exozomů, kterým byly buňky vystaveny [50].
Epitelo-mezenchymální tranzice
Exozomy mohou působit při procesu navození epitelo-mezenchymální tranzice (EMT), během kterého dochází ke změně z epiteliálního fenotypu buňky na mezenchymální fenotyp. Tento proces je charakterizován ztrátou E-kadherinu a změnami vlastností buňky. EMT dává za vznik mezenchymálním kmenovým buňkám, které jsou samoobnovitelné a jsou zodpovědné za relaps nádoru a rezistenci [51,52]. Při studiu buněk nádoru prsu bylo zjištěno, že miR-155 přenášená pomocí exozomů z kmenových buněk navozuje EMT, a tím zvyšuje rezistenci cílových buněk k doxorubicinu a paklitaxelu [51]. Buňky nádoru vaječníku rezistentní k platině vylučovaly exozomy, které u citlivých buněk zvyšovaly rezistenci a indukovaly EMT [53]. Studie zabývající se buňkami karcinomu žaludku prokázala, že exozomy vylučované z paklitaxel rezistentních buněk mají vysokou expresi miR-155-5p a po dosažení cílové buňky u ní navozují EMT a zvyšují rezistenci [54].
Antiapoptotické mechanizmy
Exozomy jsou schopné přenášet molekuly, které ovlivňují apoptotické signální dráhy. Cílem protinádorového léčiva je zastavit buněčný cyklus a usmrtit nádorové buňky, proto je jedním z mechanizmů lékové rezistence únik buněčné smrti. Při studii buněk melanomu byly v exozomech z rezistentních buněk identifikovány tři miRNA (miR-34a, miR-100, miR-125b), které zvyšovaly rezistenci citlivých buněk a zabraňovaly apoptóze [55]. Studie nádoru prsu prokázala stejnou funkci dlouhé nekódující RNA lncRNA SNHG14 [56].
Exozomy a nádorové onemocnění
Nádory jsou komplexní multifaktoriální choroby. V roce 2000 byla publikována studie Hallmarks of Cancer, která popisuje šest znaků nádorových onemocnění:
- udržení proliferační signalizace;
- únik růstovým supresorům;
- únik apoptóze;
- neomezený replikační potenciál;
- schopnost angiogeneze;
- schopnost metastazování [57].
V roce 2011 byla tato studie rozšířena o další dva znaky:
- deregulace energie a hospodaření s energií;
- únik imunitnímu systému
a dvě podmínky:
- nestabilita genomu;
- zánět podporující nádor [58].
Mezibuněčná komunikace je důležitou součástí kontrolující a ovlivňující tyto znaky. S dalšími výzkumy znaků nádorových buněk je stále jasnější, že exozomy hrají roli téměř ve všech z nich [59].
Nádorové buňky mají větší sklon k sekreci exozomů a obsahují jiné proteiny a druhy RNA než exozomy vylučované z buněk zdravých [60]. Takto mají schopnost ovlivňovat okolní buňky (vč. buněk imunitního systému) v mikroprostředí nádoru, a tím pomáhat jeho progresi a šíření [11,61]. Mohou interagovat např. s makrofágy, které za fyziologických podmínek zabraňují růstu nádoru a po interakci s nádorovým exozomem se stávají makrofágy asociované s nádorem. Ty následně pomáhají v proliferaci a angiogenezi nádoru [62,63].
Jedním z významných míst jejich uplatnění jsou mechanizmy vrozené i adaptivní imunitní odpovědi, jako je transport a prezentace antigenů, ovlivnění exprese genů zánětu, modulace pomocí miRNA či aktivace signalizačních drah povrchovými ligandy [64]. Co se týče antigenní prezentace, již v roce 1996 Raposo et al popsali, že exozomy uvolňované z B-lymfocytů nesou hlavní histokompatibilní komplex II (MHC II) s navázaným antigenním peptidem, který je společně s kostimulačními molekulami schopen aktivovat příslušné
T-lymfocyty [65]. Exozomy jsou uvolňované také z neuronů a gliových buněk, kde mohou působit protektivně skrze odstraňování špatně složených proteinů nebo naopak napomáhat při rozvoji neurodegenerativních onemocnění [64]. Např. u prionových chorob, které jsou způsobeny šířením špatně složeného prionového proteinu PrPSc v mozku, představují exozomy způsob transportu těchto proteinů mezi buňkami [66]. Exozomy uvolňované z nádorových buněk mohou mít také dvojí roli. Jednak byly popsány exozomy s protinádorovou funkcí, které indukovaly apoptózu nádorových buněk [67] nebo napomáhaly protinádorové imunitní odpovědi [68]. Na druhou stranu uvolňují nádorové buňky exozomy, které mohou různými mechanizmy podporovat progresi onemocnění a tvorbu metastáz. Způsobů, jakými mohou ovlivňovat metastazování, je několik, přičemž jeden z nich je zprostředkování transportu onkogenních molekul z nádorových buněk k cílovému orgánu, kde dochází k přípravě premetastatického prostředí k následnému uchycení metastatických buněk [69]. V průběhu let byly exozomy popsány ve většině tělních tekutin a vzhledem k jejich specifickému složení odpovídajícímu buňce původu a jejímu stavu by mohly být v budoucnu použitelné mimo jiné také jako biomarkery různých onemocnění [6].Závěr
Exozomy jsou uvolňovány z různých typů buněk – od imunitních až po nádorové – a jsou velmi důležité v mezibuněčné komunikaci. Díky jejich malé velikosti a unikátní kompozici jsou schopny interagovat s rozdílnými typy buněk. Exozomy hrají důležitou roli také při rozvoji nádorového onemocnění, jelikož zprostředkovávají jak komunikaci mezi nádorovými buňkami, tak ovlivňují buňky v okolním prostředí. Vzhledem k jejich specifickému složení odpovídajícímu buňce původu a jejímu stavu by mohly být v budoucnu použitelné jako biomarkery různých onemocnění.
Tato práce byla podpořena grantem Ministerstva zdravotnictví ČR AZV 17-29343A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. RNDr. Sabina Ševčíková, Ph.D.
Babákova myelomová skupina
Ústav patologické fyziologie LF MU
Kamenice 753/5
625 00 Brno
e-mail: sevcik@med.muni.cz
Obdrženo/Submitted: 13. 3. 2020
Přijato/Accepted: 15. 4. 2020
Zdroje
1. Chiriacò MS, Bianco M, Nigro A et al. Lab-on-chip for exosomes and microvesicles detection and characterization. Sensors 2018, 18 (10): 3175. doi: 10.3390/s18103175.
2. Osteikoetxea X, Sódar B, Németh A et al. Differential detergent sensitivity of extracellular vesicle subpopulations. Org Biomol Chem 2015; 13 (38): 9775–9782. doi: 10.1039/C5OB01451D.
3. Kowal J, Arras G, Colombo M et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci USA 2016; 113 (8): E968–E977. doi: 0.1073/pnas.1521230113.
4. Chenjie Y, Robbins PD. The roles of tumor-derived exosomes in cancer pathogenesis. [online]. Available from: https: //www.hindawi.com/journals/jir/2011/842849/.
5. Waldenström A, Gennebäck N, Hellman U et al. Cardiomyocyte microvesicles contain DNA/RNA and convey biological messages to target cells. [online]. Available from: https: //journals.plos.org/plosone/article?id=10.1371/journal.pone.0034653.
6. Zhang Y, Liu Y, Liu H et al. Exosomes: biogenesis, biologic function and clinical potential. Cell Biosci 2019; 9 (1): 19. doi: 0.1186/s13578-019-0282-2.
7. Brinton LT, Sloane HS, Kester M et al. Formation and role of exosomes in cancer. Cel Mol Life Sci 2015; 72 (4): 659–671. doi: 10.1007/s00018-014-1764-3.
8. Kahlert C, Melo SA, Protopopov A et al. Identification of double-stranded genomic DNA spanning all chromosomes with mutated KRAS and p53 DNA in the serum exosomes of patients with pancreatic cancer. J Biol Chem 2014; 289 (7): 3869–3875. doi: 0.1074/jbc.C113.532267.
9. Minciacchi VR, Freeman MR, di Vizio D. Extracellular vesicles in cancer: exosomes, microvesicles and the emerging role of large oncosomes. Semin Cell Dev Biol 2015; 40 : 41–51. doi: 0.1016/j.semcdb.2015.02.010.
10. Hessvik NP, LLorente A. Current knowledge on exosome biogenesis and release. Cel Mol Life Sci 2018; 75 (2): 193–208. doi: 0.1007/s00018-017-2595-9.
11. Jella KK, Tahseen HN, Li Z et al. Exosomes, their biogenesis and role in inter-cellular communication, tumor microenvironment and cancer immunotherapy. Vaccines 2018; 6 (4): 69. doi: 0.3390/vaccines6040069.
12. Henne WM, Buchkovich NJ, Emr SD. The ESCRT Pathway. Developmental Cell 2011, 21 (1), 77–91. doi: 0.1016/j.devcel.2011.05.015.
13. KatzmanN DJ, Odorizzi G, Emr SD. Receptor downregulation and multivesicular-body sorting. Nat Rev Mol Cell Biol 2002; 3 (12): 893–905. doi: 0.1038/nrm973.
14. Katzmann DJ, Stefan CJ, Babst M et al. Vps27 recruits ESCRT machinery to endosomes during MVB sorting. J Cell Biol 2003; 162 (3): 413–423. doi: 0.1083/jcb.200302136.
15. Gross JC, Chaudhary V, Bartscherer K et al. Active Wnt proteins are secreted on exosomes. Nat Cell Biol 2012; 14 (10): 1036–1045. doi: 0.1038/ncb2574.
16. Hoshino D, Kirkbride KC, Costello K et al. Exosome secretion is enhanced by invadopodia and drives invasive behavior. Cell Rep 2013; 5 (5): 1159–1168. doi: 0.1016/j.celrep.2013.10.050.
17. Tamai K, Tanaka N, Nakano T et al. Exosome secretion of dendritic cells is regulated by Hrs, an ESCRT-0 protein. Biochemical and Biophysical Research Communications 2010; 399 (3): 384–390. doi: 0.1016/j.bbrc.2010.07.
083.18. Barile L,Vassalli G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Therap 2017; 174 : 63–78. doi: 0.1016/j.pharmthera.2017.02.020.
19. Stuffers S, Wegner CS, Stenmark H et al. Multivesicular endosome biogenesis in the absence of ESCRTs. Traffic 2009; 10 (7): 925–937. doi: 0.1111/j.1600-0854.2009.00920.x.
20. Van Niel G, Charrin S, Simoes S et al. The tetraspanin CD63 regulates ESCRT-independent and -dependent endosomal sorting during melanogenesis. Develop Cell 2011; 21 (4): 708–721. doi: 0.1016/j.devcel.2011.08.019.
21. Trajkovic K, Hsu C, Chiantia S et al. Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science 2008; 319 (5867): 1244–1247. doi: 0.1126/science.1153124.
22. Kowal J, Tkach M, Théry C. Biogenesis and secretion of exosomes. Curr Opin Cell Biol 2014; 29 : 116–125. doi: 0.1016/j.ceb.2014.05.004.
23. Blanc L, Vidal M. New insights into the function of Rab GTPases in the context of exosomal secretion. Small GTPases 2018; 9 (1–2): 95–106. doi: 0.1080/21541248.2016.1264352.
24. Raposo G, Stoorvogel W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology 2013; 200 (4): 373–383. doi: 0.1083/jcb.201211138.
25. Ostrowski M, Carmo NB, Krumeich S et al. Rab27a and Rab27b control different steps of the exosome secretion pathway. Nat Cell Biol 2010; 12 (1): 19–30. doi: 0.1038/ncb2000.
26. Fitzner D, Schnaars M, van Rossum D et al. Selective transfer of exosomes from oligodendrocytes to microglia by macropinocytosis. J Cell Sci 2011; 124 (3): 447–458. doi: 0.1242/jcs.074088.
27. Parolini I, Federici C, Raggi C et al. Microenvironmental pH is a key factor for exosome traffic in tumor cells. J Biol Chem 2009, 284 (49), 34211–34222. doi: 0.1074/jbc.M109.041152.
28. Gonda A, Kabagwira J, Senthil GN et al. Internalization of exosomes through receptor-mediated endocytosis. [online]. Available from: https: //mcr.aacrjournals.org/content/molcanres/17/2/337.full.pdf.
29. Tian T, Zhu ZL, Yue-Yuan Z et al. Exosome uptake through clathrin-mediated endocytosis and macropinocytosis and mediating miR-21 delivery. J Biol Chem 2014; 289 (32): 22258–22267. doi: 0.1074/jbc.M114.588046.
30. Feng D, Zhao WL, Ye YY et al. Cellular internalization of exosomes occurs through phagocytosis. Traffic 2010; 11 (5): 675–687. doi: 0.1111/j.1600-0854.2010.01041.x.
31. Lu J, Li J, Liu S et al. Exosomal tetraspanins mediate cancer metastasis by altering host microenvironment. Oncotarget 2017; 8 (37): 62803–62815. doi: 0.18632/oncotarget.19119.
32. Rana S, Yue S, Stadel D et al. Toward tailored exosomes: The exosomal tetraspanin web contributes to target cell selection. International J Biochem Cell Biol 2012; 44 (9): 1574–1584. doi: 0.1016/j.biocel.2012.06.018.
33. Shevtsov M, Multhoff G. Heat shock protein–peptide and HSP-based immunotherapies for the treatment of cancer. Front Immunol 2016; 7 : 171. doi: 0.3389/fimmu.2016.00171.
34. Murshid A, Gong J, Calderwood SK. The role of heat shock proteins in antigen cross presentation. Front Immunol 2012; 3 : 63. doi: 0.3389/fimmu.2012.00063.
35. Le NQK, Ho QT, Ou YY. Classifying the molecular functions of Rab GTPases in membrane trafficking using deep convolutional neural networks. Anal Biochem 2018; 555 : 33–41. doi: 0.1016/j.ab.2018.06.011.
36. Subra C, Grand D, Laulagnier K et al. Exosomes account for vesicle-mediated transcellular transport of activatable phospholipases and prostaglandins. J Lipid Res 2010; 51 (8): 2105–2120. doi: 0.1194/jlr.M003657.
37. Durcin M, Fleury A, Taillebois E et al. Characterisation of adipocyte-derived extracellular vesicle subtypes identifies distinct protein and lipid signatures for large and small extracellular vesicles. [online]. Available from: https: //www.tandfonline.com/doi/full/10.1080/20013078.2017.1305677.
38. Chapuy-Regaud S, Dubois M, Plisson-Chastang C et al. Characterization of the lipid envelope of exosome encapsulated HEV particles protected from the immune response. Biochimie 2017; 141 : 70–79. doi: 0.1016/j.biochi.2017.05.003.
39. Llorente A, Skotland T, Sylvänne S et al. Molecular lipidomics of exosomes released by PC-3 prostate cancer cells. Biochimica et Biophysica Acta 2013; 1831 (7): 1302–1309. doi: 0.1016/j.bbalip.2013.04.011.
40. Llorente A, van Deurs B, Sandvig K. Cholesterol regulates prostasome release from secretory lysosomes in PC-3 human prostate cancer cells. Eur J Cell Biol 2007; 86 (7): 405–415.doi: 0.1016/j.ejcb.2007.05.001.
41. Valadi Hadi, Ekström K, Bossios A et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007; 9 (6): 654–659. doi: 0.1038/ncb1596.
42. Villarroya-Beltri C, Gutiérrez-Vázque C, Sánchez-Cabo F et al. Sumoylated hnRNPA2B1 controls the sorting of miRNAs into exosomes through binding to specific motifs. Nat Commun 2013; 4 (1): 1–10. doi: 0.1038/ncomms3980.
43. Holohan C, van Schaeybroeck S, Longley DB et al. Cancer drug resistance: an Evolving paradigm. Nat Rev Cancer 2013; 13 (10): 714–726. doi: 0.1038/nrc3599.
44. Ullah MF. Cancer multidrug resistance (MDR): a major impediment to effective chemotherapy. Asian Pac J Cancer Prev 2008; 9 (1): 1–6.
45. Leonard GD, Fojo T, Bates SE. The role of ABC transporters in clinical practice. Oncologist 2003; 8 (5): 411–424. doi: 0.1634/theoncologist.8-5-411.
46. Nanayakkara AK, Follit CA, Chen G et al. Targeted inhibitors of P-glycoprotein increase chemotherapeutic-induced mortality of multidrug resistant tumor cells. Sci Rep 2018; 8 (1): 1–18. doi: 0.1038/s41598-018-19325-x.
47. Bebawy M, Combes V, Lee E et al. Membrane microparticles mediate transfer of P-glycoprotein to drug sensitive cancer cells. Leukemia 2009; 23 (9): 1643–1649. doi: 0.1038/leu.2009.76.
48. Levchenko A, Mehta BM, Niu X et al. Intercellular transfer of P-glycoprotein mediates acquired multidrug resistance in tumor cells. Proc Natl Acad Sci USA 2005; 102 (6): 1933–1938. doi: 0.1073/pnas.0401851102.
49. Corcoran C, Rani S, O’brien K et al. Docetaxel-Resistance in Prostate Cancer: Evaluating Associated Phenotypic Changes and potential for resistance transfer via exosomes. PLoS ONE 2012; 7 (12): doi: 0.1371/journal.pone.0050999.
50. Lv M, Zhu X, Chen W et al. Exosomes mediate drug resistance transfer in MCF-7 breast cancer cells and a probable mechanism is delivery of P-glycoprotein. Tumor Biol 2014; 35 (11): 10773–10779. doi: 0.1007/s13277-014-2377-z.
51. Santos JC, Lima NS, Sarian LO et al. Exosome-mediated breast cancer chemoresistance via miR-155 transfer. Sci Rep 2018; 8 (1): 1–11. doi: 0.1038/s41598-018-19339-5.
52. Lee G, Hall RR, Ahmed AU. Cancer stem cells: cellular plasticity, niche, and its clinical relevance. J Stem Cell Res Ther 2016; 6 (10): doi: 0.4172/2157-7633.1000
363.53. Crow J, Atay S, Banskota S et al. Exosomes as mediators of platinum resistance in ovarian cancer. Oncotarget 2017; 8 (7): 11917–11936. doi: 0.18632/oncotarget.
14440.54. Wang M, Qiu R, Yu S et al. Paclitaxel‑resistant gastric cancer MGC‑803 cells promote epithelial‑to‑mesenchymal transition and chemoresistance in paclitaxel‑sensitive cells via exosomal delivery of miR‑155‑5p. Int J Oncol 2019; 54 (1): 326–338. doi: 0.3892/ijo.2018.4601.
55. Vergani E, di Guardo L, Dugo M et al. Overcoming melanoma resistance to vemurafenib by targeting CCL2-induced miR-34a, miR-100 and miR-125b. Oncotarget 2015; 7 (4): 4428–4441. doi: 0.18632/oncotarget.6599.
56. Dong H, Wang W, Chen R et al. Exosome-mediated transfer of lncRNA‑SNHG14 promotes trastuzumab chemoresistance in breast cancer. Int J Oncol 2018; 53 (3): 1013–1026. doi: 0.3892/ijo.2018.4467.
57. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100 (1): 57–70. doi: 0.1016/S0092-8674 (00) 81683-9.
58. Hanahan D, Weinberg RA. Hallmarks of Ccancer: The next generation. Cell 2011; 144 (5): 646–674. doi: 0.1016/j.cell.2011.02.013.
59. Fouad YA, Aanei C. Revisiting the hallmarks of cancer. Am J Cancer Res 2017; 7 (5): 1016–1036.
60. Riches A, Campbell E, Borger E et al. Regulation of exosome release from mammary epithelial and breast cancer cells – a new regulatory pathway. Eur J Cancer 2014; 50 (5): 1025–1034. doi: 0.1016/j.ejca.2013.12.019.
61. Rackov G, Garcia-Romero N, Esteban-Rubio S et al. Vesicle-mediated control of cell function: The role of extracellular matrix and microenvironment. Front Physiol 2018; 9 : 651. doi: 0.3389/fphys.2018.00
651.62. Chen Z, Yang L, Cui Y et al. Cytoskeleton-centric protein transportation by exosomes transforms tumor-favorable macrophages. Oncotarget 2016; 7 (41): 67387–67402. doi: 0.18632/oncotarget.11794.
63. Steidl C, Lee T, Shah SP et al. Tumor-associated macrophages and survival in classic Hodgkin’s lymphoma. New Engl J Med 2010; 362 (10): 875–885. doi: 0.1056/NEJMoa0905680
64. Kalluri R, Lebleu VS. The biology, function, and biomedical applications of exosomes. [online]. Available from: https: //science.sciencemag.org/content/367/6478/eaau6977.
65. Raposo G, Nijman HW, Stoorvogel W et al. B lymphocytes secrete antigen-presenting vesicles. J Exp Med 1996; 183 (3): 1161–1172. doi: 0.1084/jem.183.3.1161.
66. Guo BB, Bellingham SA, Hill AF. Stimulating the release of exosomes increases the intercellular transfer of prions. J Biol Chem 2016; 291 (10): 5128–5137. doi: 0.1074/jbc.M115.684258.
67. Ristorcelli E, Beraud E, Verrando P et al. Human tumor nanoparticles induce apoptosis of pancreatic cancer cells. FASEB J 2008; 22 (9): 3358–3369. doi: 0.1096/fj.07-102855.
68. Zhang Y, Luo CL, He BC et al. Exosomes derived from IL-12-anchored renal cancer cells increase induction of specific antitumor response in vitro: A novel vaccine for renal cell carcinoma. Int J Oncol 2010; 36 (1): 133–140. doi: 0.3892/ijo_00000484.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Úloha CDK12 v rozvoji nádorů
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Karcinom děložního hrdla v graviditě
- Integrovaná diagnostika difúzních gliomů
- Úloha CDK12 v rozvoji nádorů
- Zhubné nádory krčka maternice v gravidite
- Role exozomů u nádorových onemocnění
- Nemoc těžkých řetězců imunoglobulinu gama
- Hematologická toxicita u IMRT/VMAT v kurativní léčbě análního karcinomu
- Efektivita blokády pektorálneho nervu typu II oproti torakálnej paravertebrálnej blokáde v analgézii po operácii tumoru prsníka
- Atypický průběh typického karcinoidu plic
- Akademická studie XR-TEMinDREC – kombinace konkomitantní neoadjuvantní chemoradioterapie následované lokální excizí operačním rektoskopem a akcelerovanou dispenzarizací u pacientů s mírně pokročilými stadii nízce sedícího adenokarcinomu konečníku a její průběh v MOÚ
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zhubné nádory krčka maternice v gravidite
- Integrovaná diagnostika difúzních gliomů
- Atypický průběh typického karcinoidu plic
- Nemoc těžkých řetězců imunoglobulinu gama
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání