-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAkademická studie XR-TEMinDREC – kombinace konkomitantní neoadjuvantní chemoradioterapie následované lokální excizí operačním rektoskopem a akcelerovanou dispenzarizací u pacientů s mírně pokročilými stadii nízce sedícího adenokarcinomu konečníku a její průběh v MOÚ
Academic Study XR-TEMinDREC – Combination of the Concomitant Neoadjuvant Chemoradiotherapy Followed by Local Excision Using Rectoscope and Accelerated Dispensarisation and Further Treatment of the Patients with Slightly Advanced Stages of Distant Localized Rectal Adenocarcinoma in MOÚ
Background: Miniinvasive approaches are a long-term trend in surgery. Maximum possible quality of life after treatment of rectal cancer is a long-term goal. Adequate radicality of surgery is a long-term necessity. It is sometimes very difficult to fulfill all the above-mentioned requirements in low-level rectal cancer. By applying a multidisciplinary approach in the treatment of mildly advanced stages of low-seated malignant rectal tumor, a treatment procedure resulting in continence preserving can be offered to a selected group of patients meeting the strict indication criteria. We document our results with respect to a small number of patients in several interesting case reports.
Cases: We are following up one patient after ideal treatment course achieving downstaging after neoadjuvant treatment, with uncomplicated operation and after operation period and with a long-term complete remission. One patient achieved dehiscence of the rectum suture. After secondary healing we observed a long-term remission. In one patient a rectovaginal fits developed outside the operation site. We were forced to abdominoperineal amputation. The pathological investigation of the specimen proved radically of the local excision and lack of lymphangioinvasion; nevertheless, a positive perirectal lymph node was found. The last case report shows the limits of imaging diagnostics. The liver lesions described as benign were in fact liver metastases of the early rectal cancer.
Conclusion: According to the worldwide data available, the combination of neoadjuvant chemoradiotherapy and local excision by means of an operative rectoscope is a safe alternative to a resection surgery with total mesorectal excision in T2N0 rectal cancer. However, there is a need of other studies with more patients included, optimally randomized and prospective ones, which will support these claims.
Supported by MH CR – DRO (MOÚ, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
rectal cancer – TEM – neoadjuvant treatment – stoma
Autoři: M. Ondrák 1,2; L. Fiala 1; P. Pospíšil 3
; I. Kocáková 4; M. Pacal 5
Působiště autorů: Klinika operační onkologie MOÚ Brno 1; Klinika operační onkologie LF MU Brno 2; Klinika radiační onkologie LF MU a MOÚ Brno 3; Klinika komplexní onkologické péče LF MU a MOÚ Brno 4; Oddělení radiologie, MOÚ Brno 5
Vyšlo v časopise: Klin Onkol 2020; 33(4): 309-317
Kategorie: Kazuistika
doi: https://doi.org/10.14735/amko2020309Souhrn
Východiska: Miniinvazivní přístupy jsou v chirurgii dlouhodobým trendem. Dlouhodobým cílem je maximální možné zachování kvality života po léčbě zhoubného nádoru konečníku. Adekvátní radikalita operačního výkonu je dlouhodobá nutnost. U nízce uloženého zhoubného nádoru konečníku je někdy velmi těžké naplnit všechny výše jmenované požadavky. Aplikací multioborového přístupu v léčbě mírně pokročilých stadií nízce sedícího zhoubného nádoru konečníku je možné vybrané skupině pacientů splňující přísná indikační kritéria nabídnout léčebný postup, jehož výsledkem je zachování přirozené pasáže. Naše výsledky dokumentujeme vzhledem k malému počtu pacientů na několika zajímavých kazuistických případech.
Případy: Dispenzarizujeme pacienta s ideálním průběhem léčby, downstagingem po neoadjuvantní léčbě, nekomplikovanou operací a pooperačním průběhem a dlouhodobou remisí; dále pacienta s pooperační dehiscencí sutury rekta sekundárně zhojenou a s následnou dlouhodobou remisí onemocnění. Pacientka, u které došlo v pooperačním období k vytvoření rektovaginální píštěle mimo operovanou oblast byla následně operována, provedli jsme abdominoperineální amputaci rekta a v definitivním histologickém nálezu byla prokázána radikalita lokální excize a vyloučena lymfangioinvaze, přesto však detekována pozitivní perirektální uzlina. Limity v diagnostice zobrazovacími metodami dokazuje poslední kazuistika. Jaterní ložiska, která byla v rámci stagingu popsaná jako benigní, byla ve skutečnosti jaterními metastázami časného karcinomu rekta.
Závěr: Kombinace neoadjuvantní chemoradioterapie a lokální excize pomocí operačního rektoskopu u T2 N0 karcinomu rekta se dle dostupných celosvětových dat jeví jako bezpečná alternativa k resekčnímu výkonu s totální mezorektální excizí. Je ale třeba dalších studií s větším počtem zařazených pacientů, optimálně randomizovaných a prospektivních, které by tato tvrzení podpořily.
Klíčová slova:
karcinom rekta – TEM – neoadjuvantní léčba – stomie
Úvod
Miniinvazivita a multioborový přístup jsou standardní trendy onkochirurgické léčby pacientů. V léčbě maligních nádorů rekta jsou uplatňovány již dlouhá léta. S časem a nabývanými novými poznatky se však mění indikace k jednotlivým léčebným modalitám vzhledem k různým stadiím onemocnění, preferencím pacienta a individualizaci léčby. Obecně lze pozorovat trend redukce podávání neoadjuvantní léčby v časnějších stadiích zhoubného onemocnění. Vyplývá to z dat, která neprokázala delší přežití bez nemoci ani celkové přežití [1,2].
Naproti tomu můžeme zaznamenat využití neoadjuvantních léčebných modalit u pacientů, u kterých vzhledem ke stadiu onemocnění dříve indikovány nebyly. Cílem je umožnit minimálně invazivní výkon v rozsahu, který má na kvalitu života pacienta pokud možno co nejmenší dopady [3].
Typickým příkladem jsou nízce sedící zhoubné nádory konečníku stadia cT2 N0 M0 nebo cT1 N1 M0 neinfiltrující anální svěrače. Podle současných doporučení je u těchto pacientů indikováno radikální operační řešení s totální mezorektální excizí. Vzhledem k lokalizaci nádoru v aborální části konečníku to však v důsledku znamená abdominoperineální amputaci s konstrukcí trvalého tlustostřevního vývodu.
Několik pracovišť začalo v rámci klinických studií na půdorysu multioborové spolupráce uplatňovat léčebnou strategii, která by měla pacientům s lokálně nepokročilým, ale nízko sedícím karcinomem umožnit vyhnout se abdominoperineální amputaci rekta. Publikované výsledky zatím potvrzují, že u selektované skupiny nepokročilých karcinomů rekta nemá radikální operační výkon z hlediska lokální recidivy ani dlouhodobého přežívání lepší výsledky než kombinovaná metoda předoperační chemoradioterapie následovaná minimálně invazivním lokálním zákrokem pomocí operačního rektoskopu. Akcelerovaná follow-up umožňuje navíc časný záchyt případné lokální recidivy a včasné indikování salvage radikalizujícího chirurgického výkonu [4–6].
Masarykův onkologický ústav nabízí komplexní péči o pacienty s kolorektálním karcinomem vč. všech dostupných modalit chirurgické léčby zahrnující laparotomické, laparoskopické, robotické i transanální operační přístupy. Proto jsme se rozhodli v rámci akademické studie nabídnout vybraným pacientům splňujícím přísná indikační kritéria i tuto variantu léčby zhoubného nádoru
rekta.Vstup do studie nabízíme pacientům se zhoubným nádorem rekta, u kterých by radikální operační výkon s totální mezorektální excizí znamenal abdominoperineální amputaci rekta s konstrukcí trvalého tlustostřevního vývodu. Dále musejí splňovat kritérium iniciálního stadia cT2-3N0-1M0 a zároveň ycT2-3N0 M0 po absolvování neoadjuvantní léčby stadia. Rozhodující pro indikaci k vstupu do studie je samozřejmě informovaný souhlas pacienta s léčbou a následnou akcelerovanou dispenzarizací.
Iniciální vyšetření před indikací vstupu do studie zahrnuje kolonoskopické vyšetření, rektoskopické vyšetření, histologickou verifikaci zhoubného nádoru, transanální ultrazvuk, magnetickou rezonanci pánve, vyšetření hrudníku a břicha výpočetní tomografií a odběr nádorových markerů. Operující chirurg posoudí, zda je technicky možný lokální zákrok. Následuje neoadjuvantní chemoradioterapie s kapecitabinem (dávka 825 mg/m2 2× denně) a ozáření (5 dní v týdnu při denní dávce 1,8 Gy) po dobu 5 týdnů až do dávky 45 Gy, následované boostem 5,4 Gy do celkové dávky 54 Gy.
Za 8–10 týdnů od ukončení radioterapie následuje operace. Před samotným operačním výkonem pacient podstoupí přešetření a potvrzení indikace lokálního endoskopického výkonu. Samotný operační výkon probíhá transanální endoskopickou mikrochirurgickou technikou (TEM) za pomoci operačního rektoskopu. Resekuje se nádor s bezpečnostním lemem makroskopicky zdravé tkáně v rozsahu celé stěny rekta s následnou suturou stěny v jedné vrstvě.
Po zhodnocení histologického závěru pacienty zařazujeme buď do skupiny akcelerované follow-up, nebo k radikalizujícímu operačnímu výkonu. Sledujeme pacienty, u kterých nebylo histopatologem popsáno pokročilejší stadium než pT2 s vyloučením lymfangioinvaze, angioinvaze a perineurálního šíření.
Sledování probíhá v prvních 2 letech každé 3 měsíce, v dalších 3 letech každý půlrok a v následujících 5 letech každý rok. Součástí klinické kontroly je vždy rektoskopie, případně kolonoskopie, odběr nádorových markerů a magnetická rezonance pánve. K vyloučení případné diseminace onemocnění provádíme v prvních 3 letech CT vyšetření hrudníku a břicha každý rok; tato metoda bude v dalších 7 letech sledování nahrazena rentgenovým vyšetřením hrudníku a ultrazvukem břicha.
Prvním pacientům jsme vstup do studie nabídli v druhé polovině roku 2016. Vzhledem k přísným indikačním kritériím jsme touto kombinovanou metodou léčili zatím 6 pacientů. Na statistické vyhodnocení je to soubor velmi malý, nicméně je pestrý z hlediska odlišných průběhů léčby a zajímavý z hlediska publikace jednotlivých kazuistických případů.
Kazuistika 1
Prvním pacientem zařazeným do studie byl 52letý muž bez interkurencí, s negativní rodinnou anamnézou stran kolorektálního karcinomu a verifikovaným G1 adenokarcinomem rekta těsně za svěrači, stadium cT2 N0 M0. Pacient striktně odmítal konstrukci střevního vývodu. Po nekomplikovaném průběhu neoadjuvantní chemoradioterapie a přešetření pacient absolvoval operační výkon, po týdnu byl propuštěn do domácí péče (obr. 1 a 2). Definitivní histologické zhodnocení potvrdilo stadium ypT1 N0 M0, L0 R0 V0 s výraznou regresí po neoadjuvantní léčbě. V tříměsíčním intervalu pacient podstoupil přešetření vždy se závěrem trvající kompletní remise a nyní je již v režimu půlročního sledování se stále trvající kompletní remisí. Takovýto průběh léčby bychom přáli všem našim pacientům, bohužel ne vždy je takto optimální, což dokazují následující případy.
Obr. 1. Detekce nádoru na T2 axiálním řezu před neoadjuvatní CHT/RT (vlevo) a následně po ní (vpravo). CHT – chemoterapie, RT – radioterapie 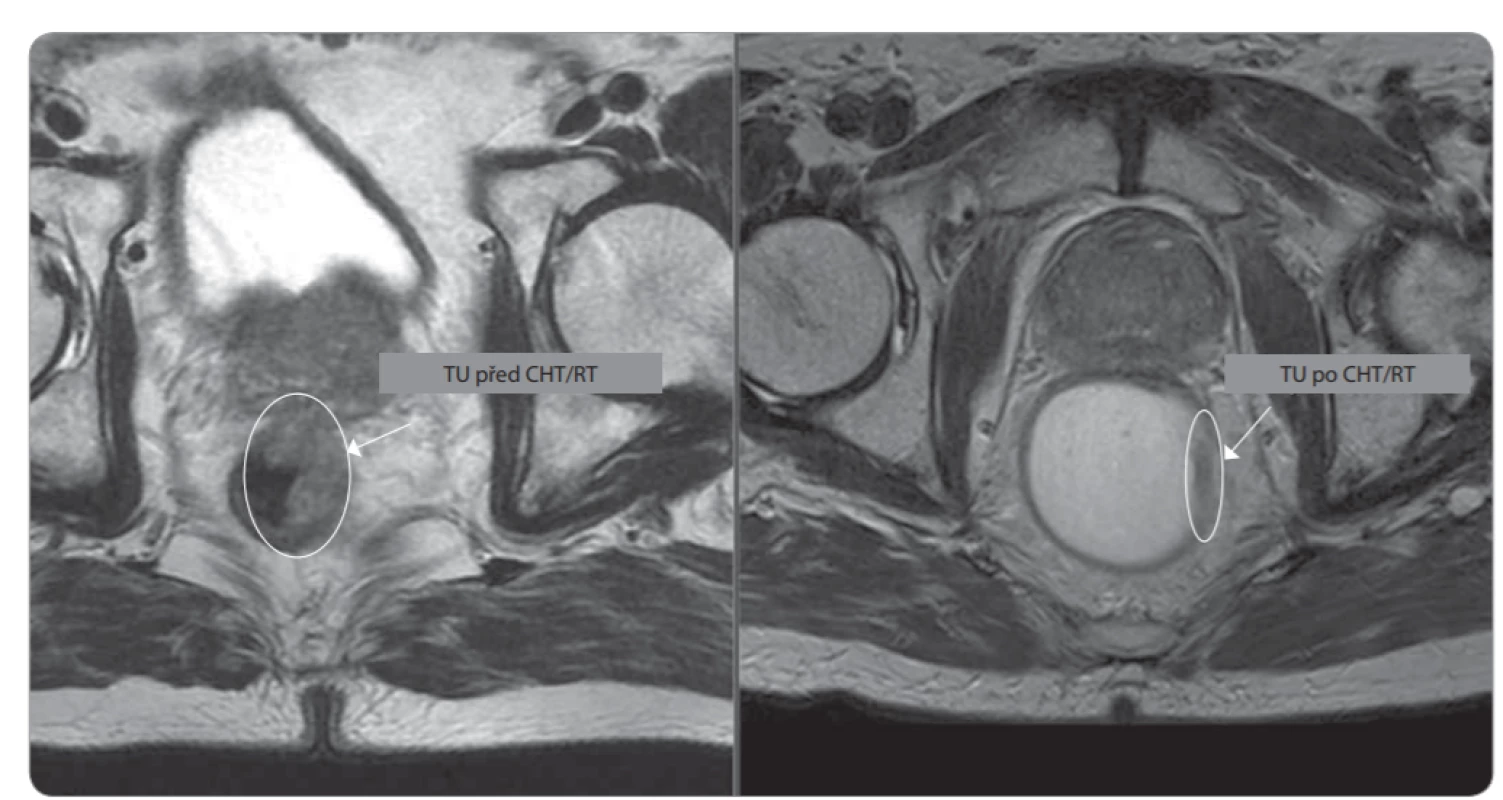
Obr. 2. 2. Endoskopický obraz nádoru před léčbou (vlevo) a půl roku po operaci (vpravo). 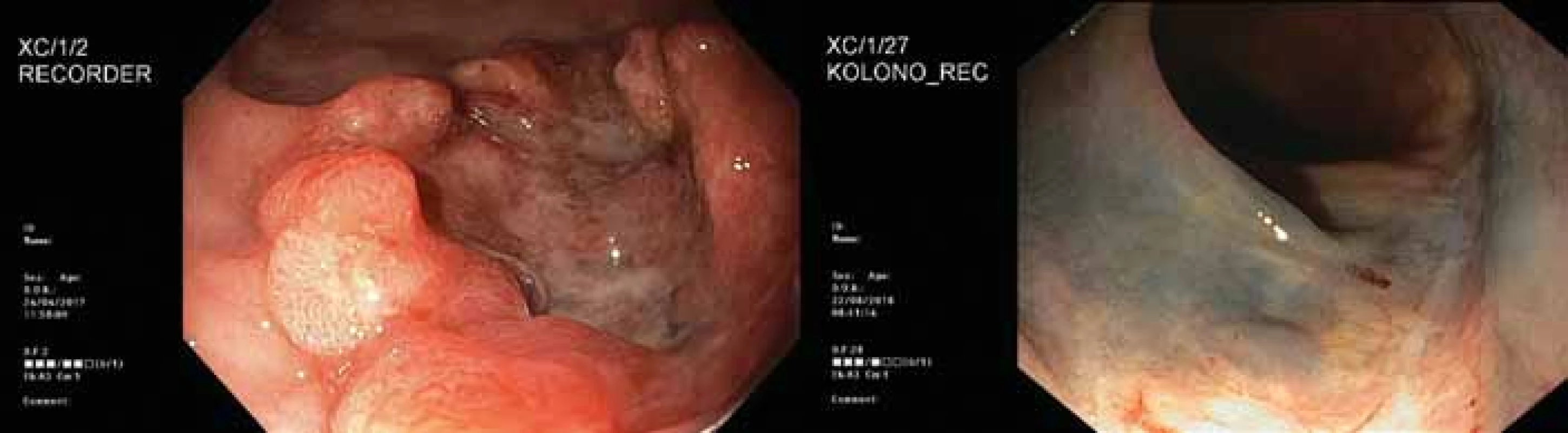
Kazuistika 2
Druhým pacientem byl 67letý muž s hypertenzí a nádorovým onemocněním v rodinné anamnéze. Histologicky středně diferencovaný adenokarcinom rekta stadium cT2 N0 M0. Po prodělané neoadjuvantní chemoradioterapii následovala s odstupem 8 týdnů operace metodou TEM. Již při operaci byla zhoršená kvalita stěny rekta. Sliznice byla po ozáření křehká a lehce edematózní. Operace samotná však proběhla zcela standardně, bez jakýchkoliv komplikací. Ani bezprostřední pooperační průběh nebyl nijak komplikován. Definitivní histologický závěr byl ypT2 N0, L0 V0 R0. Již po měsíci však pacient přichází pro inkontinenci řídké stolice. Při došetření byla identifikována dehiscence sutury, pacient však radikální řešení odmítl a dohodli jsme se na ponechání defektu a pokus o jeho vyhojení granulacemi. Do standardního akcelerovaného follow-up režimu byly zařazeny pravidelné odběry na histologii a PET/CT vyšetření. Žádnou metodou nebyla prokázána lokální recidiva a defekt se zcela vyhojil hladkou jizvou po osmnácti měsících. Pacient je stále v režimu tříměsíčních kontrol s trvající celkovou remisí.
Kazuistika 3
Snad nejzajímavější průběh diagnostiky a léčby jsme zaznamenali u 43leté pacientky s nízce sedícím polypoidním tumorem konečníku. Extramurální vyšetření pozitronovou emisní tomografii s magnetickou rezonancí (PET/MRI) a transrektální snografií (TRUS) byla v zásadním rozporu. PET/MRI diagnostikovala onemocnění jako stadium cT3-4 cN0 cM0, zatímco TRUS popsal stadium cT2 cN0; bioptický závěr zněl maximálně carcinoma in situ. Dle přešetření v Masarykově onkologickém ústavu jsme dospěli k jednoznačné diagnóze adenokarcinomu rekta grade 2, klinického stadia cT2 N0 M0 (obr. 3–5). Pacientka byla již při první návštěvě v ambulanci přesvědčena, že chce radikální operaci a trvalý vývod. Nicméně jí byla nabídnuta varianta neoadjuvantní chemoradioterapie s následnou lokální excizí nádoru operačním rektoskopem. S tímto postupem nakonec souhlasila, především díky vlivu manžela. Bez komplikací absolvovala neoadjuvantní léčbu. Po přešetření jsme uzavřeli stadium onemocnění jako ycT1-2 N0 M0. Pacientka podstoupila nekomplikovanou transmurální resekci tumoru lokalizovaného na zadní stěně rekta se standardním bezprostředním pooperačním průběhem. Dle definitivní histologie bylo stadium popsáno jako ypT2 N0 M0, L0 V0 R0. Měsíc od operace přichází neplánovaně k ambulantní kontrole, pozoruje odchod větrů a stolice pochvou. Endoskopicky prokázána rektovaginální píštěl, která lokalizačně nesouvisí s jizvou po resekci tumoru zadní stěny rekta. U pacientky jsme indikovali abdominoperineální amputaci rekta dle Milese.
Obr. 3. Uzlina při TRUS vyšetření. Žádný znak ani velikost nesvědčí pro patologickou uzlinu. TRUS – transrektální sonografi e 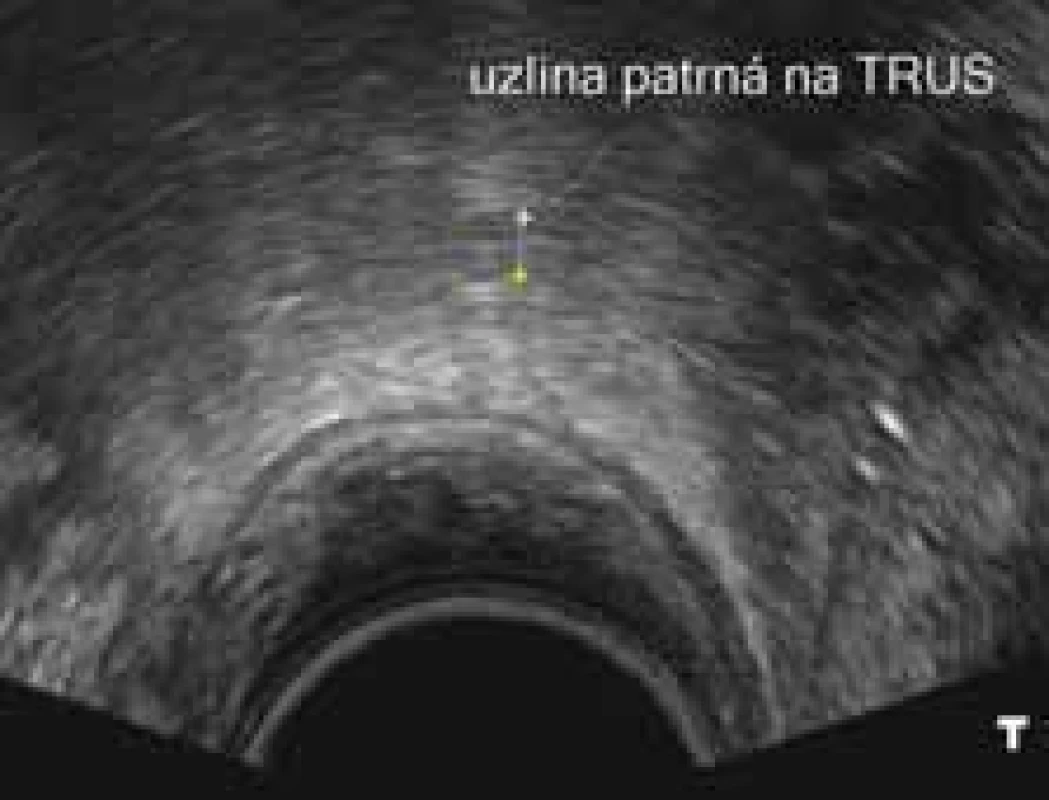
Obr. 4. Detekce uzlin při MR vyšetření na DWI sekvenci. Všechny zachycené uzliny (cca 5–6 v perirektálním prostoru) neměly ani v T1w a T2w ani v DWI znaky patologických uzlin v okolí nádoru (malá velikost do 5 mm, tvar spíše oválný, k okrajům se vzhledem k velikosti nelze exaktně vyjádřit). DWI – difuzí vážený obraz, MR – magnetická rezonance, T1w – T1 vážený obraz, T2w – T2 vážený obraz 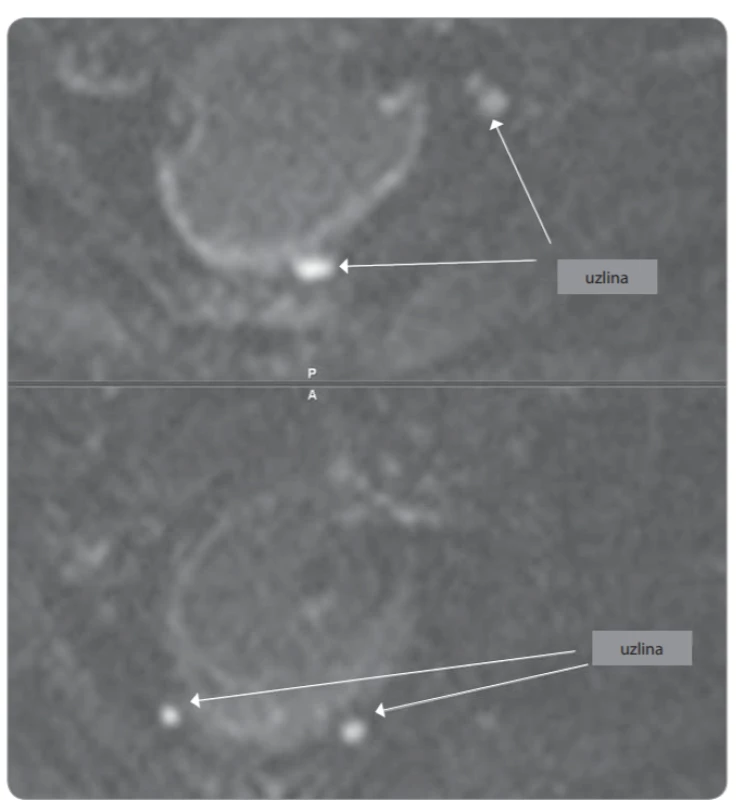
Obr. 5. Endoskopický obraz nádoru zadní stěny konečníku před léčbou (vlevo) a endoskopický obraz rektovaginální píštěle na přední stěně konečníku po operaci (vpravo). 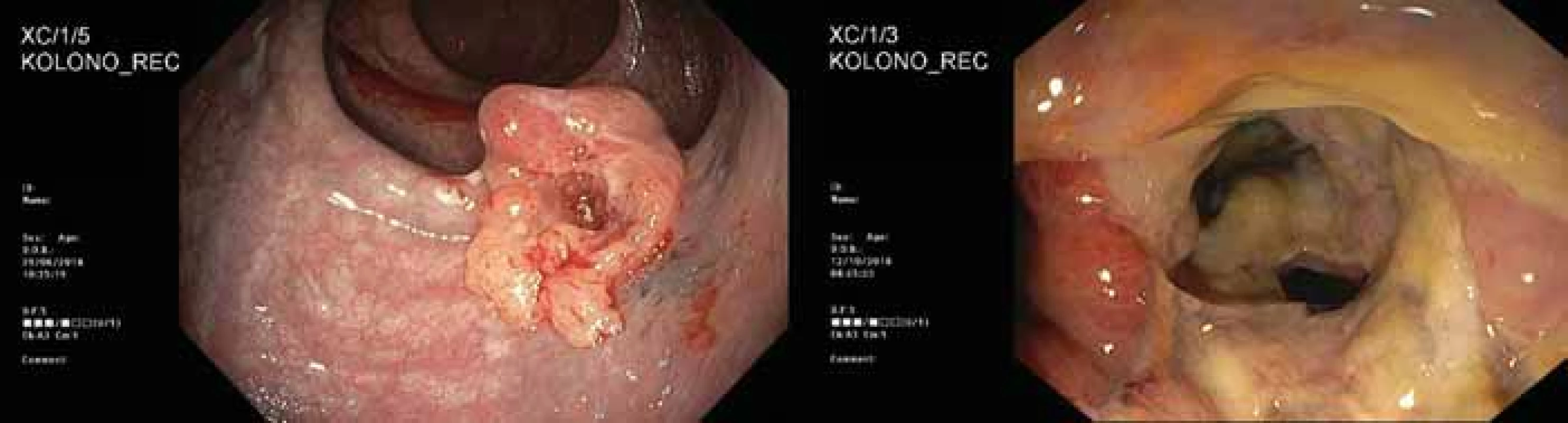
Po absolvování komplikované multioborové léčby s cílem zachovat normální pasáž nakonec stejně pacientka dospěla k výkonu, který si přála již na začátku léčby – tedy k radikálnímu operačnímu výkonu s konstrukcí trvalého vývodu. Byla provedena abdominoperineální amputace rekta, bez komplikací v pooperačním období. Překvapením byl histologický závěr. Ten prokázal radikalitu lokální excize bez nálezu rezidua nádorových buněk ve stěně rekta, ale popsal metastázu v jedné z deseti lymfatických uzlin. U pacientky byla indikována adjuvantní chemoterapie, kterou nyní podstupuje. Byla samozřejmě vyřazena ze sledování podle protokolu studie.
Kazuistika 4
Posledním pacientem se zajímavým průběhem diagnostiky a léčby byl 57letý muž došetřovaný pro pozitivní test na okultní krvácení. Byl mu diagnostikován nízce sedící tumor rekta histologicky verifikovaný jako středně diferencovaný adenokarcinom. V rámci došetřování případné diseminace bylo vysloveno podezření na plicní metastázy, které byly následně cíleným CT vyšetřením vyloučeny, dále byl u pacienta popsán nejednoznačný nález na játrech, který byl nakonec uzavřen jako cysty jaterní k dalšímu sledování. Před zařazením do studie bylo tedy u pacienta popsáno stadium cT2 N0 M0 (obr. 6-9). Pacient podstoupil neoadjuvantní chemoradioterapii s nekomplikovaným průběhem. Po ukončení byl přešetřen a bylo potvrzeno stadium onemocnění ycT2-3a N0 M0. U pacienta jsme indikovali dle studiového protokolu transmurální resekci operačním rektoskopem s eventuální následnou radikalizací při nepříznivém histologickém výsledku z definitivního histologického zhodnocení preparátu. Následovala tedy nekomplikovaná operace metodou transanální endoskopické mikrochirurgické techniky se standardním pooperačním průběhem. Definitivní histologický závěr zněl ypT2 N0 M0. Výsledek splňoval kritéria studie a pacient byl tedy zařazen do akcelerovaného sledování. Nadále byla sledována jaterní ložiska. Po půl roce kontrolní CT břicha ukázalo stacionární jaterní ložiska benigního vzhledu. Pro nárůst hodnoty nádorového markeru CEA proběhlo kontrolní CT již po dalších 2 měsících. Zde již byla ložiska v játrech popsána jako suspektní metastázy ve velikostní progresi. Vzhledem k velikosti nebyla možná radionavigovaná biopsie, a proto pacient podstoupil laparoskopický operační výkon s cílenou biopsií jaterního ložiska. Histologické vyšetření prokázalo metastázu adenokarcinomu rekta. Pacient byl tedy ze studie vyřazen a nyní absolvuje systémovou léčbu diseminovaného onemocnění.
Obr. 6. Velikostní vývoj na CT vyšetření u největšího z 3 jaterních ložisek v kopuli jater v rozmezí 25. 4. 2018–4. 1. 2019. Etiologii prokázala až diagnostická laparoskopie s histologií. CT – výpočetní tomografi e 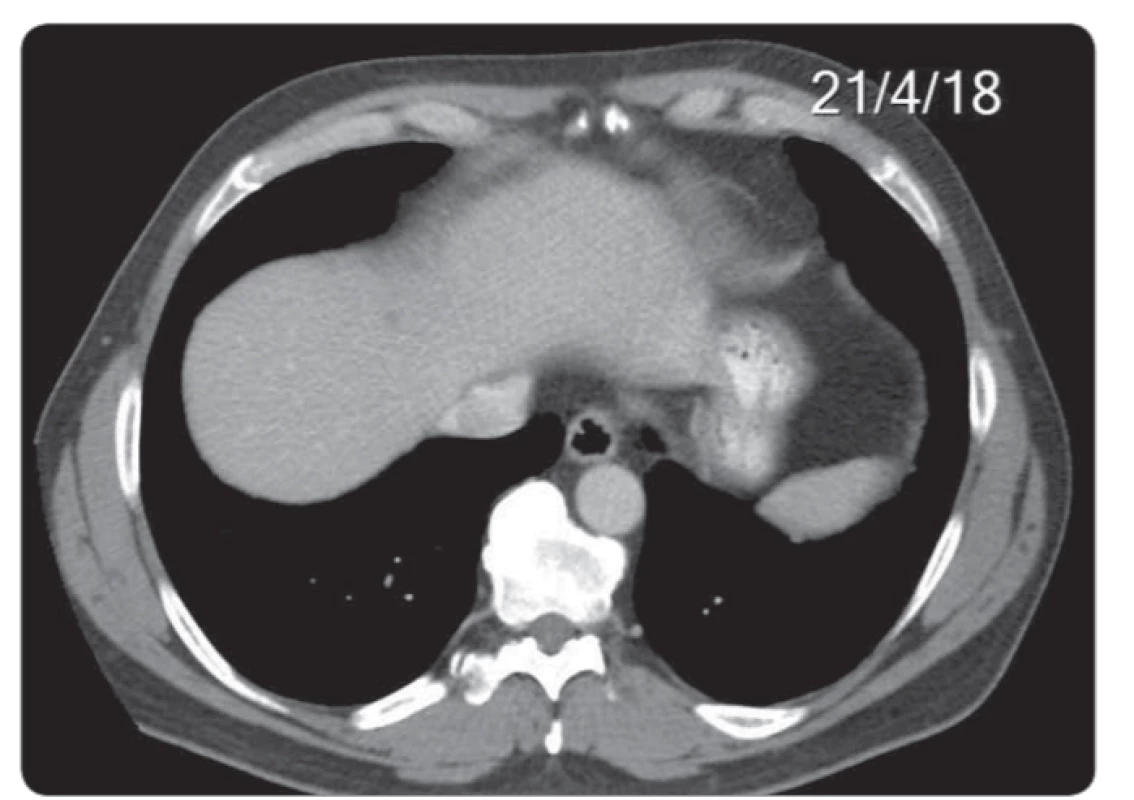
Obr. 7. Velikostní vývoj na CT vyšetření u největšího z 3 jaterních ložisek v kopuli jater v rozmezí 25. 4. 2018–4. 1. 2019. Etiologii prokázala až diagnostická laparoskopie s histologií. CT – výpočetní tomografi e 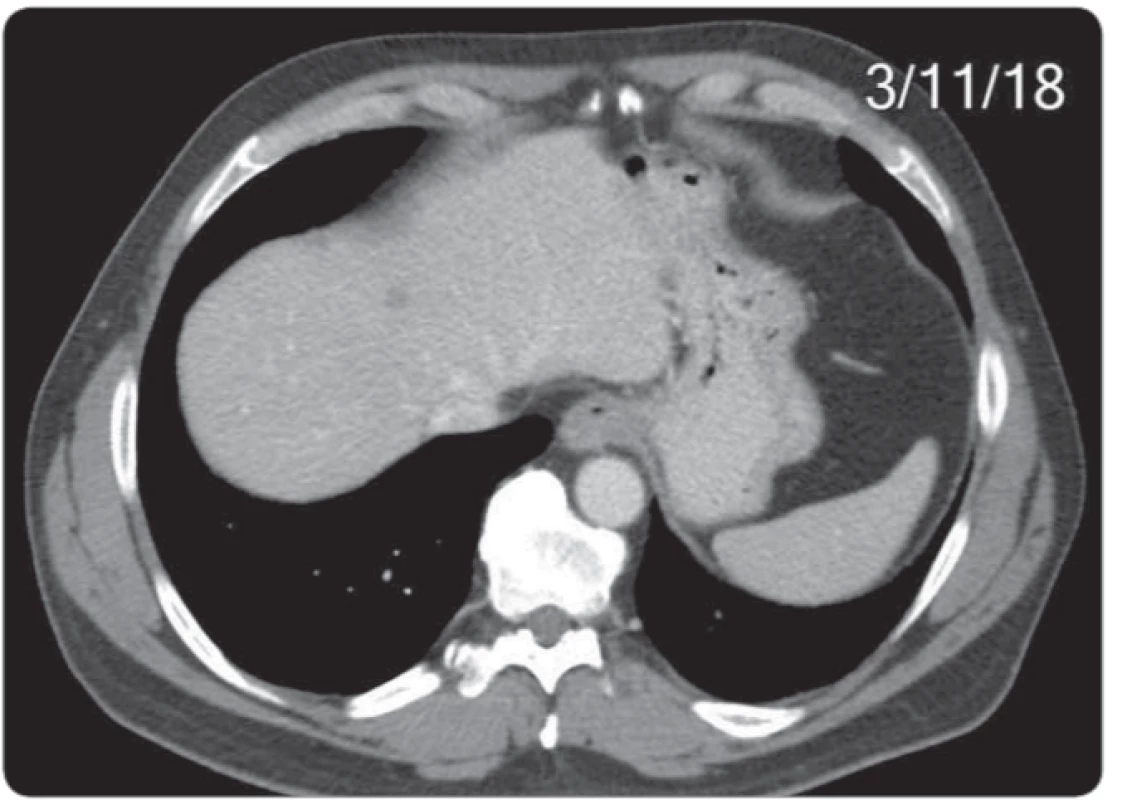
Obr. 8. Velikostní vývoj na CT vyšetření u největšího z 3 jaterních ložisek v kopuli jater v rozmezí 25. 4. 2018–4. 1. 2019. Etiologii prokázala až diagnostická laparoskopie s histologií. CT – výpočetní tomografie 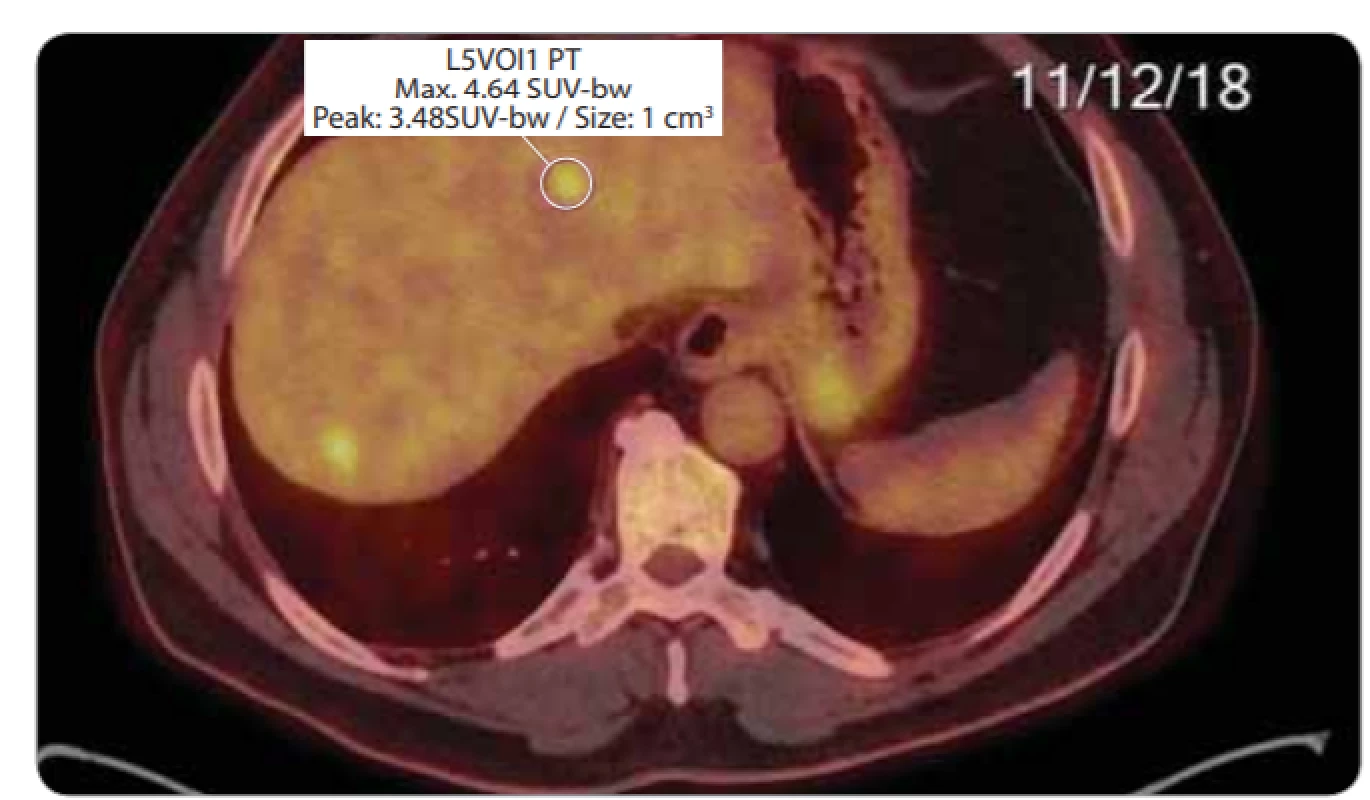
Obr. 9. Velikostní vývoj na CT vyšetření u největšího z 3 jaterních ložisek v kopuli jater v rozmezí 25. 4. 2018–4. 1. 2019. Etiologii prokázala až diagnostická laparoskopie s histologií. CT – výpočetní tomografie 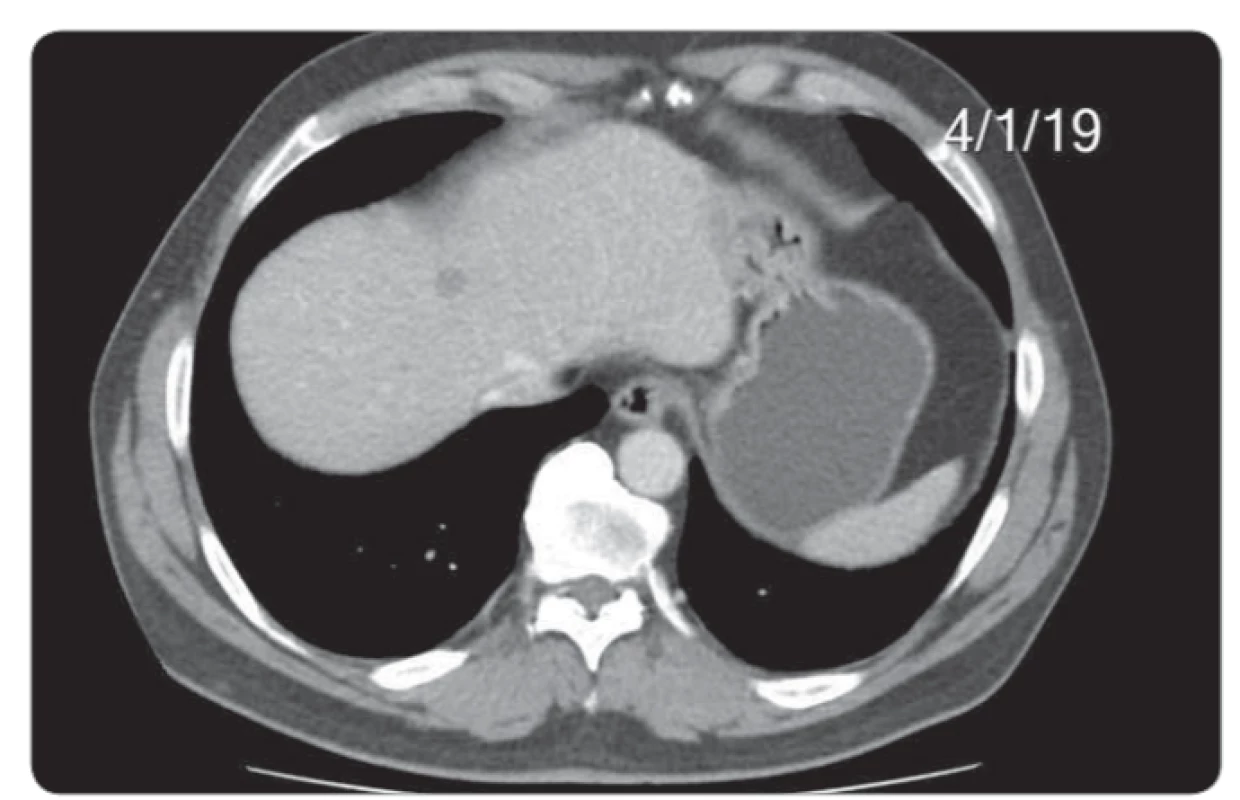
Pro úplnost zmiňujeme i poslední dva pacienty, kteří byli zařazení do studie.
První z nich – 54letý muž – absolvoval předoperační léčbu, přešetření a následně operaci. Po 3 měsících se dostavil k plánované kontrole, která prokázala remisi onemocnění. K dalším kontrolám se pacient již nedostavil. Podle údajů zdravotní pojišťovny zemřel 14. 5. 2017. Příčinu úmrtí se nepodařilo dohledat.
Posledním pacientem je 70letý muž, který podstoupil předoperační léčbu, operační výkon a je v režimu akcelerované follow-up bez komplikací v celkové remisi.
Diskuze
V léčbě maligních nádorů rekta je již dlouhá léta s úspěchem uplatňován multioborový přístup. Vedle chirurgické léčby je to v rámci neoadjuvantní a adjuvantní léčby radioterapie a chemoterapie.
Standardem v chirurgické léčbě karcinomu konečníku je již mnoho let totální mezorektální excize (TME), jejímž hlavním smyslem je odstranění postižených nebo potenciálně postižených pararektálních mízních uzlin. Díky této operační technice se dnes četnost lokálních rekurencí pohybuje pod 5 % [7]. TME ale znamená nízkou přední resekci (s anastomózou nebo bez) nebo abdominoperineální amputaci rekta. Jde o výkony s nezanedbatelnou pooperační morbiditou a reálným rizikem konstrukce dočasné nebo trvalé stomie. Průměrně ¼ pacientů po těchto operačních výkonech udává určitý stupeň urologických a sexuálních dysfunkcí [2,8–11].
U časných stadií karcinomu rekta a nezhoubných rektálních adenomů je nicméně riziko uzlinového postižení nízké, resp. nulové, a provedení TME tak není nutné. Z těchto důvodů se v 80. letech minulého století k chirurgické léčbě lokálně nepokročilých nádorů rekta začala používat technika TEM využívající operační rektoskop a transanální přístup [12]. Četnost lokálních rekurencí (LR) ani 5leté přežití se u vhodně zvolených T1 karcinomů rekta řešených operačním rektoskopem neliší od případů, kdy proběhla TME. Současně navíc transanální endoskopická mikrochirurgie má prokazatelně lepší funkční výsledky a nižší pooperační morbiditu [13,14].
Pro dosažení dobrých krátkodobých, ale zejména dlouhodobých výsledků je zásadní výběr vhodných pacientů. Jednak je třeba počítat s technickými limity metody (vzdálenost léze od anodermální linie, anatomické poměry v pánvi, velikost vlastní patologie), jednak je třeba důsledně posoudit stadium karcinomu. Podstatné je zejména důkladné posouzení hloubky invaze do stěny rekta a stavu pararektálních lymfatických uzlin. S hloubkou invaze (tedy s rostoucím T stadiem) přímo úměrně narůstá i pravděpodobnost uzlinového postižení a současně i riziko lokální recidivy po lokální excizi karcinomu rekta.
U stadia T1 se riziko uzlinového postižení uvádí 0–12 % (některé práce ale uvádějí až 23 %!) [13–15]. Obecně ale platí, že riziko uzlinového postižení u T1 karcinomů je nízké, a proto jsou dlouhodobé výsledky po lokální excizi dobré. Resekce operačním rektoskopem je současně spojena s výbornými funkčními výsledky, a proto je u vybraných případů T1 karcinomů obecně přijatou a doporučovanou metodou [1].
Přesto byly publikovány práce, ve kterých se pohybovalo procento lokálních recidiv po resekci T1 karcinomu operačním rektoskopem v rozmezí 20–30 % [16–18]. Důvodem je zřejmě skutečnost, že i v rámci T1 karcinomů existují ty s horší a lepší prognózou, což je dáno kombinací několika faktorů. Mezi ně patří přítomnost perineurálního, lymfatického a krevního šíření nebo nedostatečné resekční okraje po lokální resekci (< 1 mm). Nejzásadnější se zdá být ale hloubka submukózní invaze předmětného karcinomu, která nejsilněji predikuje míru rizika uzlinového postižení [8,19]. Z tohoto důvodu vzniklo několik klasifikací popisujících hloubku submukózní invaze. V současné době je nejpoužívanější Haggitova klasifikace pro polypoidní léze a Kikuchiho klasifikace pro nepolypoidní léze (tab. 1, 2) [20,21]. Lze tedy říci, že pokud se jedná o T1 karcinom s příznivými histopatologickými a chirurgickými faktory, je jeho odstranění pomocí operačního rektoskopu bezpečnou a doporučovanou metodou, u které procento lokálních recidiv nepřesahuje 5 %. Pokud jsou ale přítomny rizikové faktory (zejména vysoký stupeň submukózní infiltrace), pravděpodobnost lokální rekurence stoupá, dle některých autorů až k 20 % [8].
Tab. 2. . Kikuchiho klasifikace 
m.m. – muscularis mucosae V případě T2 karcinomu je pravděpodobnost výskytu uzlinových metastáz udávána v rozmezí 12–28 % [14,15]. Proto je i v situaci bez zjevného uzlinového postižení (stadium cT2 N0) standardním chirurgickým výkonem TME. Je-li i patologická TNM klasifikace po resekci stejná (pT2 N0), není indikována žádná adjuvantní léčba. Ve světovém písemnictví lze nicméně dohledat práce, které referují o pokusech řešit stadium T2 lokální excizí bez TME. Nutno ale podotknout, že se jedná o jednotlivá sdělení malých souborů pacientů a že chybí silnější data postavená na prospektivní randomizované studii.
Byla-li provedena u T2 stadia pouze lokální excize (byť transmurální pomocí operačního rektoskopu) bez jakékoliv zajišťovací nechirurgické léčby, výskyt lokálních rekurencí osciloval mezi 22 % a 35 %. Vzhledem k těmto výsledkům není použití pouze TEM s kurativním záměrem u stadia T2 přijatelné a lze ho akceptovat pouze jako paliativní metodu [4,8].
Případná adjuvantní (pooperační) chemoradioterapie po lokální excizi T2 karcinomu dle literárních review sice může nepatrně snížit pravděpodobnost lokálního relapsu, ale celkově zůstává toto riziko stále nepřijatelně vysoké v porovnání s TME, a tedy ani tento postup nelze doporučit [22].
Pokud pacient s cT2 N0 karcinomem nejprve podstoupí chemoradioterapii (standardní neoadjuvantní režim používaný u vyšších stadií nebo v případě karcinomů s uzlinovým postižením) a následuje lokální excize, jsou výsledky mnohem příznivější. Je-li dosaženo kompletní patologické remise (ypT0), je riziko LR 0 % a systémový relaps onemocnění do 4 %.
V případě ypT1 se LR pohybuje kolem 2 % a vzdálená diseminace kolem 7 %. Pokud není zjištěna žádná odpověď na neoadjuvantní léčbu (ypT2), je riziko lokální i systémové rekurence přibližně stejné, a to 7 %.
Nejhorší je situace u stadia ypT3, kdy riziko lokální recidivy přesahuje 20 % a riziko systémového postižení 12 % [5]. Nejlepší výsledky u pacientů s T2 karcinomem, kteří podstoupili neoadjuvantní léčbu a následně lokální excizi, jsou tedy patrné v souboru, kde bylo dosaženo kompletní patologické remise. Zároveň bylo prokázáno, že kompletní patologická remise je spojena častěji s dlouhým režimem (tzn. 50,4 Gy po dobu 5 týdnů konkomitantně s kapecitabinem nebo 5-fluorouracilem) [6]. Neméně významnou roli hraje pochopitelně i kvalita chirurgické resekce. Horší výsledky z pohledu lokální recidivy byly pozorovány, pokud nebyla resekce „en block“ a pokud definitivní resekční okraje byly < 1 mm.
Nezanedbatelným přínosem tohoto kombinovaného postupu, který by měl být v rozhodovacím procesu rovněž zvážen, je již dříve zmíněná signifikantně nižší pooperační morbidita po TEM resekci ve srovnání s TME, lepší kvalita života s nižším procentem urologických a sexuálních dysfunkcí a možnost operačního výkonu bez rizika konstrukce střevního vývodu. Na druhou stranu je ale třeba vzít v úvahu akutní toxicitu neoadjuvantní léčby. Během chemoradioterapie se asi u 30 % pacientů vyskytnou gastrointestinální nežádoucí účinky stupně 3 a asi 15 % má hematologické nežádoucí účinky stupně 3–4 [23]. Podstatné je zmínit i pozdní, zpravidla trvalý vedlejší efekt radioterapie – genitourinární toxicitu. Jako hlavní důvod erektilních dysfunkcí u karcinomu rekta bývá uváděn chirurgický výkon a radioterapie k tomu určitou měrou přispívá. V literatuře však lze najít i práce, kde pravděpodobnost vzniku erektilních dysfunkcí u ozařovaných pacientů byla výrazně vyšší proti pacientům bez radioterapie (OR 7,3; p < 0,001). V této práci bylo také popsáno, že pacienti, kteří podstoupili radioterapii, měli také signifikantně nižší hladiny testosteronu [24]. Radioterapie pánve může mít za následek přechodnou nebo trvalou azoospermii, u fertilních žen může vést ke sterilitě.
Co se toxicity týká, zatím jsou závěry studií s lokální excizí po neoadjuvantní léčbě rozporuplné. Výsledky některých studií vyzněly příznivě, udávají např. jen minimální negativní dopad na anorektální funkce. Avšak závěr jiné studie je, že anorektální funkce mohou být horší, než se předpokládalo, a že není zásadní rozdíl ve srovnání s nízkou přední resekcí [25]. Definitivně na tuto otázku odpoví až randomizované klinické studie.
Souhrnně lze konstatovat, že vhodným pacientem, který z kombinace neoadjuvantní chemoradioterapie a lokální excize pomocí operačního rektoskopu dle dostupných výsledků bude nejvíce profitovat, je pacient s cT2 N0 M0 karcinomem nízkého gradu, přiměřené velikosti (do cca 4 cm), nízce uloženým (kde by v případě provedení TME hrozilo vysoké riziko konstrukce stomie), a pokud došlo po neadjuvantní terapii ke kompletní nebo alespoň částečné remisi [8].
Závěr
Kombinace neoadjuvantní chemoradioterapie a lokální excize pomocí operačního rektoskopu u T2 N0 karcinomu rekta se dle dostupných celosvětových dat jeví jako bezpečná alternativa ke standardnímu postupu, kterým je resekční výkon s totální mezorektální excizí. Hlavní výhody lze spatřovat ve výrazně nižší pooperační morbiditě, v možnosti lepších funkčních výsledků po TEM ve srovnání s výkony s TME a dále v nižším riziku konstrukce střevního vývodu (dočasného nebo trvalého). Zároveň je třeba připomenout, že TEM u T2 karcinomu bez neoadjuvantní léčby je spojen s dramaticky horšími onkologickými výsledky a nelze tento postup akceptovat. Je ale třeba dalších studií – optimálně randomizovaných a prospektivních – s větším počtem zařazených pacientů, které by tato tvrzení podpořily. Zatím tedy tuto strategii není možno rutinně doporučovat, s výjimkou klinických studií a s výjimkou starších, křehkých pacientů s vysokým rizikem komplikací při provedení většího operačního výkonu. Studie na toto téma právě probíhá v MOÚ a tento příspěvek je sdělením našich prvních osobních zkušeností.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Ondrák, Ph.D.
Klinika operační onkologie
MOÚ Brno
Žlutý kopec
656 53 Brno
e-mail: ondrak@mou.cz
Obdrženo/Submitted: 11. 1. 2020
Přijato/Accepted: 9. 2. 2020
Zdroje
1. Clinical practice guidelines in oncology: Cancer Network; version 1, 2018. [online]. Available from: http: //www.nccn.org.
2. Ondrák M, Šefr R, Eber Z. Transanální endoskopická mikrochirurgie a její postavení v chirurgii rekta – review. Rozhl Chir 2011; 90 (8): 450–456.
3. Lezoche G, Paganini AM, Campagnacci R et al. Treatment of rectal cancer by transanal endoscopic microsurgery: review of the literature. Minerva Chir 2013; 68 : 1–9.
4. Borschitz T, Heintz A, Junginger T. Transanal endoscopic microsurgical excision of pT2 rectal cancer: results and possible indications. Dis Colon Rectum 2007; 50 : 292–301. doi: 10.1007/s10350-006-0816-7.
5. Borschitz T, Wachtlin D, Möhler M et al. Neoadjuvant chemoradiation and local excision for T2-3 rectal cancer. Ann Surg Oncol 2008; 15 : 712–720.
6. Garcia-Aguilar J, Shi Q, Thomas CR et al. A phase II trial of neoadjuvant chemoradiation and local excision for T2N0 rectal cancer: preliminary results of the ACOSOG Z6041 trial. Ann Surg Oncol 2012; 19 : 384–391. doi: 10.1245/s10434-007-9732-x.
7. Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986; 1 : 1479–1482. doi: 10.1016/s0140-6736 (86) 91510-2.
8. Serra-Aracil X, Mora-Lopez L, Alcantara-Moral M et al. Transanal endoscopic surgery in rectal cancer. World J Gastroenterol 2014; 20 (33): 11538–11545. doi: 10.3748/wjg.v20.i33.11538.
9. Kneist W, Junginger T. Residual urine volume after total mesorectal excision: an indicator of pelvic autonomic nerve preservation? Results of a case-control study. Colorectal Dis 2004; 6 : 432–437. doi: 10.1111/j.1463-1318.2004.00711.x.
10. Paun BC, Cassie S, MacLean AR, Dixon E, Buie WD. Postoperative complications following surgery for rectal cancer. Ann Surg 2010; 251 : 807–818. doi: 10.1097/SLA.0b013e3181dae4ed.
11. Lange MM, van de Velde CJ. Urinary and sexual dysfunction after rectal cancer treatment. NatRev Urol 2011; 8 : 51–57. doi: 10.1038/nrurol.2010.206.
12. Buess G, Theiss R, Hutterer F et al. Transanal endoscopic surgery of the rectum-testing a new method in animal experiments. Leber Magen Darm. 1983; 13 : 73–77.
13. Varma MG, Rogers SJ, Schrock TR et al. Local excision of rectal carcinoma. Arch Surg 1999; 134 : 863–867.
14. Palma P, Freudenberg S, Samel S et al. Transanal endoscopic microsurgery: indications and results after 100 cases. Colorectal Dis 2004; 6 : 350–355. doi: 10.1111/j.1463-1318.2004.00671.x.
15. Mellgren A, Sirivongs P, Rothenberger DA et al. Is local excision adequate therapy for early rectal cancer? Dis Colon Rectum 2000; 43 : 1064–1074. doi: 10.1007/BF02236551.
16. Madbouly KM, Remzi FH, Erkek BA et al. Recurrence after transanal excision of T1 rectal cancer: should we be concerned? Dis Colon Rectum 2005; 48 : 711–719. doi: 10.1007/s10350-004-0666-0.
17. Doornebosch PG, Ferenschild FT, de Wilt JH et al. Treatment of recurrence after transanal endoscopic microsurgery (TEM) for T1 rectal cancer. Dis Colon Rectum 2010; 53 : 1234–1239. doi: 10.1007/DCR.0b013e3181e73f33.
18. Tovar J, Jimenez-Miramon J, Valle A et al. Endoscopic Resection as Unique Treatment for Early Colorectal Cancer. Rev Esp Enferm Dig 2010; 102 (7): 435–441. doi: 10.4321/s1130-01082010000700006.
19. Kitajima K, Fujimori T, Fujii S et al. Correlations between lymph node metastasis and depth of submucosal invasion in submucosal invasive colorectal carcinoma: a Japanese collaborative study. J Gastroenterol 2004; 39 : 534–543. doi: 10.1007/s00535-004-1339-4
20. Kikuchi R, Takano M, Takagi K et al. Management of early invasive colorectal cancer. Risk of recurrence and clinical guidelines. Dis Colon Rectum 1995; 38 : 1286–1295. doi: 10.1007/BF02049154.
21. Haggitt RC, Glotzbach RE, Soffer EE et al. Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology 1985; 89 : 328–336. doi: 10.1016/0016-5085 (85) 90333-6.
22. Baxter NN, Garcia-Aguilar J. Organ preservation for rectal cancer. J Clin Oncol 2007; 25 : 1014–1020.
23. Garcia-Aguilar J, Renfro LA, Chow OS et al. Organ preservation for clinical T2N0 distal rectal cancer using neoadjuvant chemoradiotherapy and local excision (ACOSOG Z6041): results of an open-label, single-arm, multi-institutional, phase 2 trial. Lancet Oncol 2015; 16 (15): 1537–1546. doi: 10.1016/S1470-2045 (15) 00215-6.
24. Bruheim K, Guren MG, Dahl A et al. Sexual function in males after radiotherapy for rectal cancer. Int J Radiat Oncol Biol Phys 2010; 76 (4) : 1012–1017. doi 10.1016/ j.ijrobp.2009.03.075
25. Gornicki P, Richter W, Polkowski M et al. Anorectal and sexual functions after preoperative radiotherapy and full-thickness local excision of rectal cancer. Eur J Surg Oncol 2014; 40 (6) : 723–730. doi: 10.1016/ j.ejso.2013.11.010.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Úloha CDK12 v rozvoji nádorů
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Karcinom děložního hrdla v graviditě
- Integrovaná diagnostika difúzních gliomů
- Úloha CDK12 v rozvoji nádorů
- Zhubné nádory krčka maternice v gravidite
- Role exozomů u nádorových onemocnění
- Nemoc těžkých řetězců imunoglobulinu gama
- Hematologická toxicita u IMRT/VMAT v kurativní léčbě análního karcinomu
- Efektivita blokády pektorálneho nervu typu II oproti torakálnej paravertebrálnej blokáde v analgézii po operácii tumoru prsníka
- Atypický průběh typického karcinoidu plic
- Akademická studie XR-TEMinDREC – kombinace konkomitantní neoadjuvantní chemoradioterapie následované lokální excizí operačním rektoskopem a akcelerovanou dispenzarizací u pacientů s mírně pokročilými stadii nízce sedícího adenokarcinomu konečníku a její průběh v MOÚ
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zhubné nádory krčka maternice v gravidite
- Integrovaná diagnostika difúzních gliomů
- Atypický průběh typického karcinoidu plic
- Nemoc těžkých řetězců imunoglobulinu gama
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




