-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodnocení klinického benefitu protinádorových léků limitovaných na komplexní onkologická centra podle metodiky ESMO-MCBS
Evaluation of Anti-cancer Therapies with Reimbursement Limited to Comprehensive Cancer Centres Using the European Society for Medical Oncology Magnitude of Clinical Benefit Scale
Background:
The costs of oncology treatments are increasing, due to the rising prevalence of malignant diseases and the introduction of expensive novel anti-cancer agents. The new European Society for Clinical Oncology (ESMO) has recently developed a new parametric system to evaluate the clinical benefit of drugs. The Magnitude of Clinical Benefit Scale (ESMO-MCBS) compares the contribution of a novel drug based on overall and progression-free survival and quality of life with those of current treatment options.Material and Methods:
An expert group of the Czech Oncological Society conducted an assessment based on published data and an ESMO-MCBS methodology for antineoplastic agents used for the treatment of solid tumors with limited reimbursement to Comprehensive Cancer Centers. We evaluated drugs categorized as “S” that were eligible for public health insurance as of January 1, 2017.Results and Conclusion:
The ESMO-MCBS score is a promising new parameter for the evaluation of new anticancer drugs. The ESMO-MCBS method for assessing the clinical benefit of drugs is simple, robust, and reproducible. The advantage of the assessment is that it is not based on a single index but rather combines several dimensions of drug performance. This parameter will be gradually added to Czech cancer guidelines. Scores obtained in the majority of cases correspond to the observed benefit of a drug in routine clinical practice.Key words:
tumors – farmacotherapy – assesment study as a subject – survival – protocols of anti-cancer therapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
3. 5. 2017Accepted:
20. 6. 2017
Autoři: T. Büchler 1; B. Melichar 2; D. Vrána 2; R. Lemstrová 2; J. Fínek 3; L. Dušek 4,5; K. Petrakova 6; J. Prausová 7
Působiště autorů: Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 1; Onkologická klinika LF UP a FN Olomouc 2; Onkologická a radioterapeutická klinika LF UK a FN Plzeň 3; Ústav zdravotnických informací a statistiky, Praha 4; Institut biostatistiky a analýz, LF a PřF MU, Brno 5; Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno 6; Onkologická klinika 2. LF UK a FN Motol, Praha 7
Vyšlo v časopise: Klin Onkol 2017; 30(5): 349-360
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2017349Souhrn
Východiska:
Náklady na onkologickou léčbu neustále stoupají, přičemž dominantní podíl na tomto nárůstu má kromě zvyšující se epidemiologické zátěže právě zavádění nových léků. Expertní tým Evropské společnosti pro klinickou onkologii (European Society for Medical Oncology – ESMO) v posledních letech vypracoval nový parametrický systém k hodnocení klinického benefitu léků. V systému Magnitude of Clinical Benefit Scale (ESMO-MCBS) je přínos nového léku hodnocen podle zlepšení celkového přežití, přežití do progrese a kvality života/toxicity ve srovnání se stávajícími možnostmi léčby.Materiál a metody:
Expertní skupina České onkologické společnosti ČLS JEP provedla na základě publikovaných dat a metodiky ESMO-MCBS hodnocení přínosu léků indikovaných v léčbě solidních nádorů, jejichž použití je limitováno na komplexní onkologická centra. Hodnotili jsme léky kategorie S, které měly k 1. 1. 2017 úhradu z veřejného zdravotního pojištění.Výsledky a závěr:
Metoda ESMO-MCBS pro hodnocení klinického benefitu léků je jednoduchá, robustní a reprodukovatelná. Získané skóre ve většině případů odpovídá intuitivně hodnocenému přínosu léků v klinické praxi. Skóre ESMO-MCBS se může stát dalším doplňkovým parametrem při hodnocení nových protinádorových léků. Skóre podle ESMO-MCBS by se mělo stát dalším hodnoceným parametrem při posuzování úhrady léku z veřejného zdravotního pojištění. Výhoda tohoto hodnocení je rovněž v tom, že není postaveno na jednom podílovém indexu, ale kombinuje více dimenzí hodnoceného problému. Doporučení České onkologické společnosti ČLS JEP budou postupně doplňována o tento parametr.Klíčová slova:
nádory – farmakoterapie – hodnotící studie jako téma – přežití – protokoly protinádorové léčbyÚvod
Masivní zavádění nových protinádorových léků do praxe, které je výsledkem explozivního rozvoje poznatků o patogenezi zhoubných novotvarů, je velkou výzvou pro odbornou veřejnost i plátce zdravotní péče. Náklady na onkologickou léčbu neustále stoupají, přičemž dominantní podíl na tomto nárůstu má kromě zvyšující se epidemiologické zátěže právě zavádění nových léků. Je jasné, že přínos nových protinádorových léků pro pacienty není ve všech případech stejný a bude záležet na jejich účinnosti a toxicitě ve srovnání se stávajícími možnostmi léčby.
Expertní tým Evropské společnosti pro klinickou onkologii (European Society for Medical Oncology – ESMO) v posledních letech vypracoval a posléze publikoval nový parametrický systém k hodnocení klinického přínosu léků [1,2]. Podle metodiky Magnitude of Clinical Benefit Scale (ESMO-MCBS) se hodnotí přínos nového léku na základě zlepšení celkového přežití (overall survival – OS), přežití do progrese (progression-free survival – PFS) a kvality života (quality of life – QoL) /toxicity ve srovnání se stávajícími možnostmi léčby. Podkladem pro parametrické hodnocení přínosu léku jsou výsledky srovnávacích klinických studií. Léky jsou hodnoceny v kontextu prognózy pacientů v té fázi onemocnění, ve které jsou indikovány. Léky dosahující skóre A nebo B u kurativních indikací (vč. adjuvance) a 4 nebo 5 při hodnocení nekurativních režimů jsou považovány za esenciální (tab. 1).
Tab. 1. Stupně hodnocení dle ESMO-MCBS a jejich intepretace. 
ESMO-MCBS – European Society for Medical Oncology V publikaci autorů Cherny et al jsou uvedené výsledky hodnocení pro většinu nových protinádorových léků registrovaných v Evropě na základě srovnávacích klinických studií [1]. Hodnocení dalších léčebných režimů přinesla publikace autorů z vídeňské univerzitní nemocnice [3].
Expertní tým České onkologické společnosti (ČOS) ČLS JEP hodnotil léky používané v léčbě solidních nádorů, které měly k 1. 1. 2017 úhradu z veřejného zdravotního pojištění a jsou kategorizovány jako S, tj. lze je podávat jen v komplexních onkologických centrech. Klinický benefit léku byl hodnocen podle metodologie ESMO-MCBS v indikacích, v nichž je daný lék u nás hrazen.
Materiál a metody
Hodnocení ESMO-MCBS
Metoda hodnocení klinického benefitu protinádorových léků ESMO-MCBS byla publikována v roce 2015 [2]. Je založena na skórování účinnosti daného léku ve srovnání s komparátorem v parametrech OS, PFS, případně jiných výsledků, jako procento klinických odpovědí (response rate – RR). Hodnocen je poměr rizik (hazard ratio – HR), rozdíl v mediánu OS a procentuální rozdíl v OS po definované době sledování. Daný lék může dále být penalizován, pokud je hodnocen podle parametru PFS a zhoršuje QoL nebo je jeho podávání spojeno se závažnou toxicitou, nebo naopak zvýhodněn, pokud QoL zlepšuje (v tomto případě může být hodnocen podle PFS nebo OS). V našem hodnocení bylo zohledněno erratum k původnímu článku publikované v roce 2016 [4].
Formuláře pro hodnocení léků jsou volně dostupné ke stažení na www.esmo.org. Současný systém ESMO-MCBS obsahuje čtyři typy formulářů: 1 – pro hodnocení kurativní léčby (vč. adjuvance), 2a – pro hodnocení nekurativních léků na základě parametru OS, 2b – pro hodnocení nekurativních léků na základě parametru PFS, 3 – pro hodnocení nekurativních léků na základě jiných parametrů nebo pro ekvivalenční studie.
Jako příklad uvádíme v tab. 2 překlad formuláře 2a (pro OS na komparátoru ≤ 1 rok). Tento formulář byl v hodnocení použit nejčastěji.
Pokud byly publikovány zralé výsledky studií, hodnocení proběhlo na základě parametru OS. V případě, že studie byla primárně cílená na prokázání rozdílu v PFS a výsledek OS by mohl být významně zkreslen následující léčbou nebo zkřížením ramen, byl použit parametr PFS (tab. 2).
Tab. 2. Příklad hodnocení nekurativní onkologické léčby na základě parametru OS, přičemž medián OS na komparátoru je ≤ 1 rok (formulář 2a). Maximální skóre je 5. 
*tento parametr nezahrnuje nežádoucí účinky jako jsou alopecie nebo myelosuprese, ale toxicity jak např. chronická nauzea, průjem, únava apod QoL – kvalita života, OS – celkové přežití Získávání údajů pro hodnocení
Údaje pro hodnocení byly získávány z registračních klinických studií pro danou indikaci nebo z klinické studie, která odpovídá obvyklému použití léku v ČR. Pokud to bylo možné, použili jsme stejnou studii, kterou hodnotila také expertní skupina ESMO. U léků, jejichž použití významně zhoršilo QoL podle definovaných parametrů a které byly hodnoceny dle parametru PFS, došlo k penalizaci – snížení skóre o 1 bod. U léků, u nichž se neprokázalo zhoršení QoL, jsme na rozdíl od původní metodiky ESMO-MCBS penalizaci neaplikovali.
Výsledky
Kolorektální karcinom
Některé starší studie s monoklonálními protilátkami proti receptoru epidermálního růstového faktoru (epidermal growth factor receptor – EGFR) zařazovaly nemocné s vyšetřením mutací v kodonech 12. a 13. genu KRAS, nikoli však v dalších kodonech KRAS a v genu NRAS. V tab. 3 uvádíme u anti-EGFR léčby indikaci jen u nemocných s wild-type RAS, což je v souladu se současným úhradovým omezením, i když to nemusí vždy odpovídat registrační studii.
Tab. 3. Kolorektální karcinom. 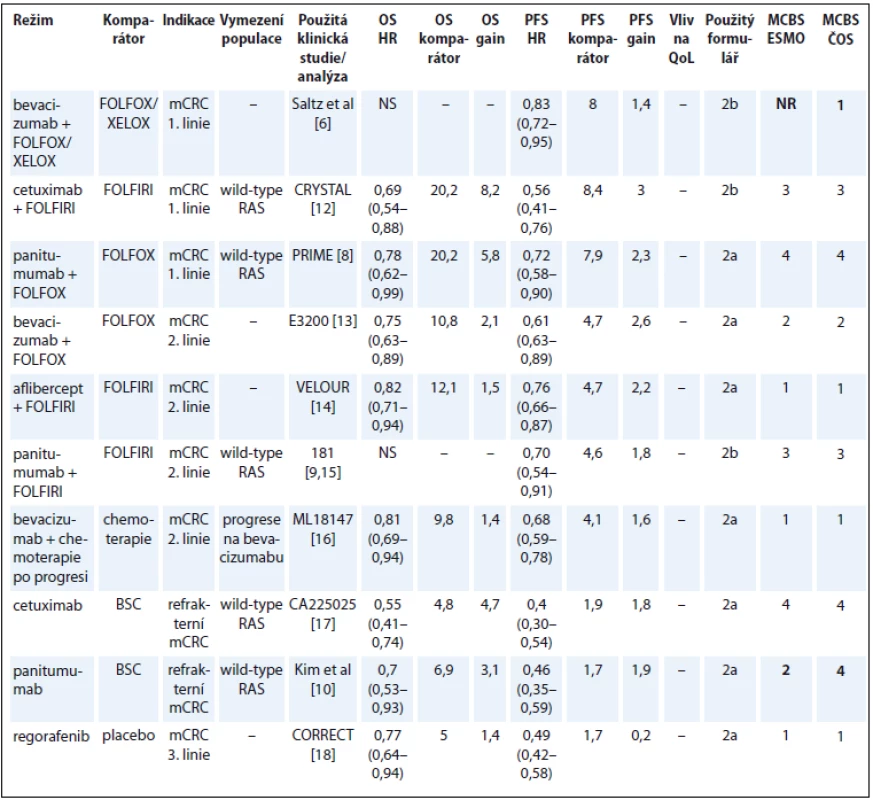
OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, mCRC – metastatický kolorektální karcinom, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno, BSC – nejlepší podpůrná léčba Bevacizumab byl u metastatického kolorektálního karcinomu (metastatic colorectal cancer – mCRC) registrován na základě studie autorů Hurwitz et al s režimem IFL (irinotekan, bolus 5-fluorouracil a leukovorin) [5]. Protože se tento režim v ČR nepoužívá, přínos byl tedy hodnocen na základě studie Saltz et al [6], což odpovídá klinické praxi u nás. Podle údajů v registru CORECT je bevacizumab podáván především s režimy FOLFOX (41,6 %), XELOX (27,5 %) a FOLFIRI (11,7 %) [7].
V hodnocení léčby CRC jsou v současném materiálu oproti publikaci expertního týmu ESMO tři rozdíly. Přínos panitumumabu v léčbě 1. linie u pacientů s wild-type RAS jsme hodnotili podle OS, protože již byly publikované zralé výsledky OS. Podle aktualizovaných výsledků publikovaných Douillardem et al došlo ke zlepšení 3letého OS o 9 % [8]. V léčbě 2. linie jsme přínos léku hodnotili podle prezentovaných dat na subpopulaci pacientů s wild-type RAS [9]. Přínos monoterapie panitumumabem jsme hodnotili podle nové práce autorů Kim et al, kde jsou uvedeny parametry umožňující hodnocení podle přínosu k OS pacientů s wild-type RAS [10]. V době práce na původní publikaci ESMO-MCBS nebyly tyto výsledky ještě zveřejněny a byla použita data dle práce autorů Amado et al [11]. Přehled CRC je uveden v tab. 3 [6,8–10,12–18].
Karcinom prsu
Publikace Cherny et al [1] nehodnotí trastuzumab u HER2+ metastatického karcinomu prsu (metastatic breast carcinoma – mBC), pravděpodobně proto, že novější strategie (pertuzumab/trastuzumab) a trastuzumab emtansin dosáhly ve srovnání s trastuzumabem lepších výsledků. Vzhledem k běžné klinické praxi v ČR jsme hodnotili i trastuzumab v kombinaci s chemoterapií a hormonální léčbou. Do hodnocení nejsou zahrnuty studie, kde byl trastuzumab podáván s různými režimy chemoterapie, protože ty byly zaměřené na chemoterapii a není možné podle nich hodnotit přínos trastuzumabu.
Pro adjuvantní léčbu trastuzumabem byly vypracovány metaanalýzy randomizovaných studií [19]. Vzhledem k rozdílu v 2–3letém přežití mezi nemocnými léčenými trastuzumabem a historickými kontrolami zde není pochyb o klinickém benefitu v kategorii A, ať již se použije metaanalýza, nebo kterákoli z randomizovaných studií. Svědčí to o robustnosti systému ESMO-MCBS i o jasném přínosu trastuzumabu v této indikaci.
U karcinomu prsu je mezi naším hodnocením a hodnocením ESMO diskrepance v přínosu bevacizumabu a everolimu [1]. Příčinou je penalizace o 1 bod aplikovaná autory ESMO u léků, jejichž použití nezlepšilo QoL. Jak je vysvětleno v diskuzi, v naší analýze jsme tuto penalizaci uplatňovali jen tehdy, pokud se QoL zhoršila v některém ze signifikantních parametrů, což v těchto případech neplatí (tab. 4) [19–27].
Tab. 4. Karcinom prsu. 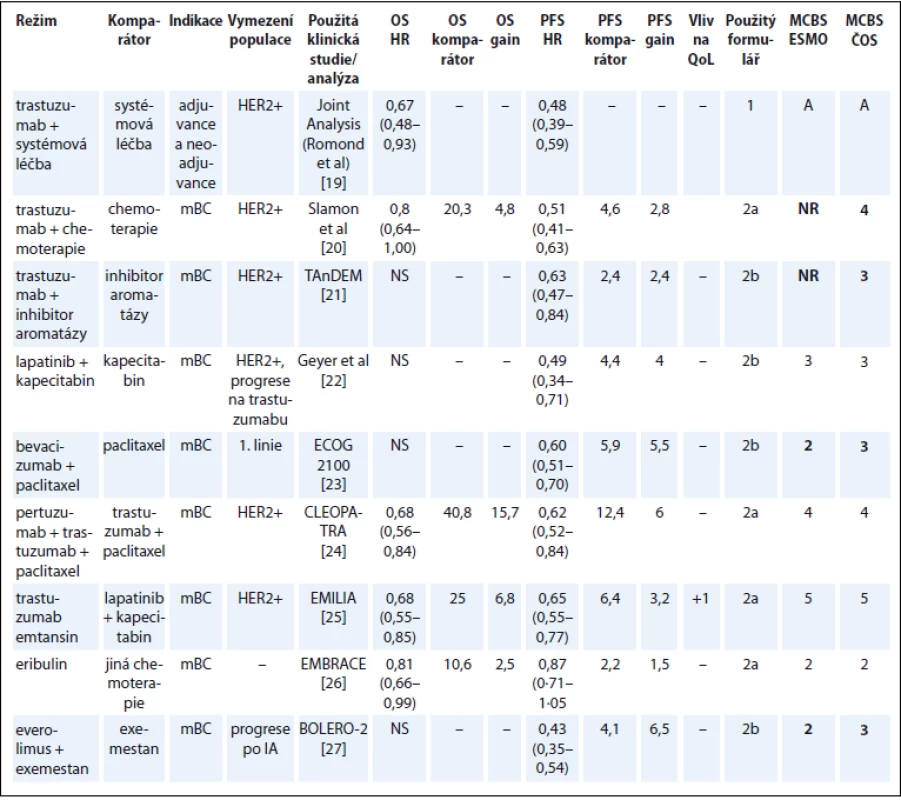
OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, mBC – metastatický karcinom prsu, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno Karcinom plic
U nemalobuněčného karcinomu plic se výrazným způsobem prosadila cílená léčba na základě molekulárních prediktivních markerů. V konkrétních podskupinách nemocných dosahují tyto léky významného klinického benefitu za nízké toxicity ve srovnání s necílenou klasickou chemoterapií, která byla použita v kontrolních ramenech studií. Hodnocení expertní skupiny ČOS ČLS JEP se ve všech případech shodovalo s hodnocením ESMO (tab. 5) [28–34].
Tab. 5. Karcinom plic. 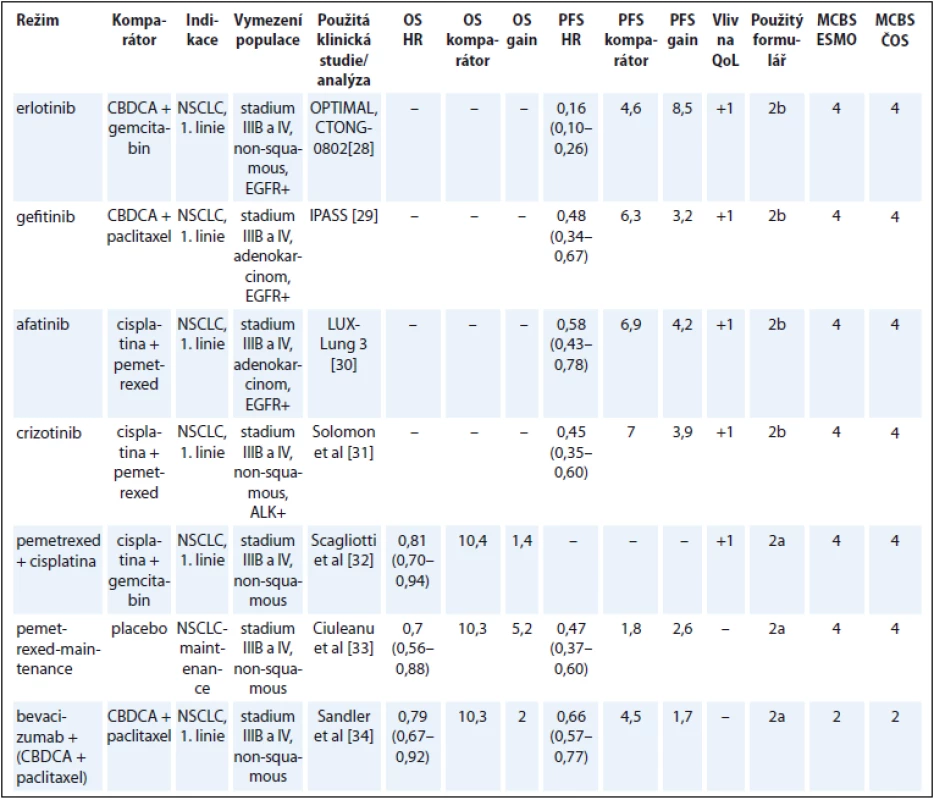
OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, NSCLC – nemalobuněčný karcinom plic, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno, EGFR – epidermal grow factor receptor, CBDCA – carboplatin Karcinom ledviny
V řadě registračních studií u metastatického renálního karcinomu (metastatic renal cell cancer – mRCC) je hodnocení OS nemožné v důsledku překřížení ramen. Navzdory tomu, že data o OS nemocných ve většině studií jsou již zralá, bylo použito hodnocení na základě PFS. Do některých studií byli zařazováni nemocní po selhání jedné nebo dvou předchozích léčebných linií. Výsledky klinické studie použité v hodnocení se tudíž vztahují na celý soubor pacientů, ale úhradové podmínky umožňují podání jen v jedné konkrétní linii terapie.
V ČR je často volena sekvence pazopanib-sunitinib, pro kterou neexistují údaje z randomizované studie. Hodnocení přínosu sunitinibu podle zásad MCBS ve 2. linii léčby tudíž nebylo možné.
Dalším problémem klinických studií u této indikace je, že komparátorem může být lék bez prokázané účinnosti pro danou léčebnou linii, např. sorafenib ve 2. linii po selhání jiného anti-VEGF léku ve studii AXIS (tab. 6) [35–41].
Tab. 6. Karcinom ledviny. 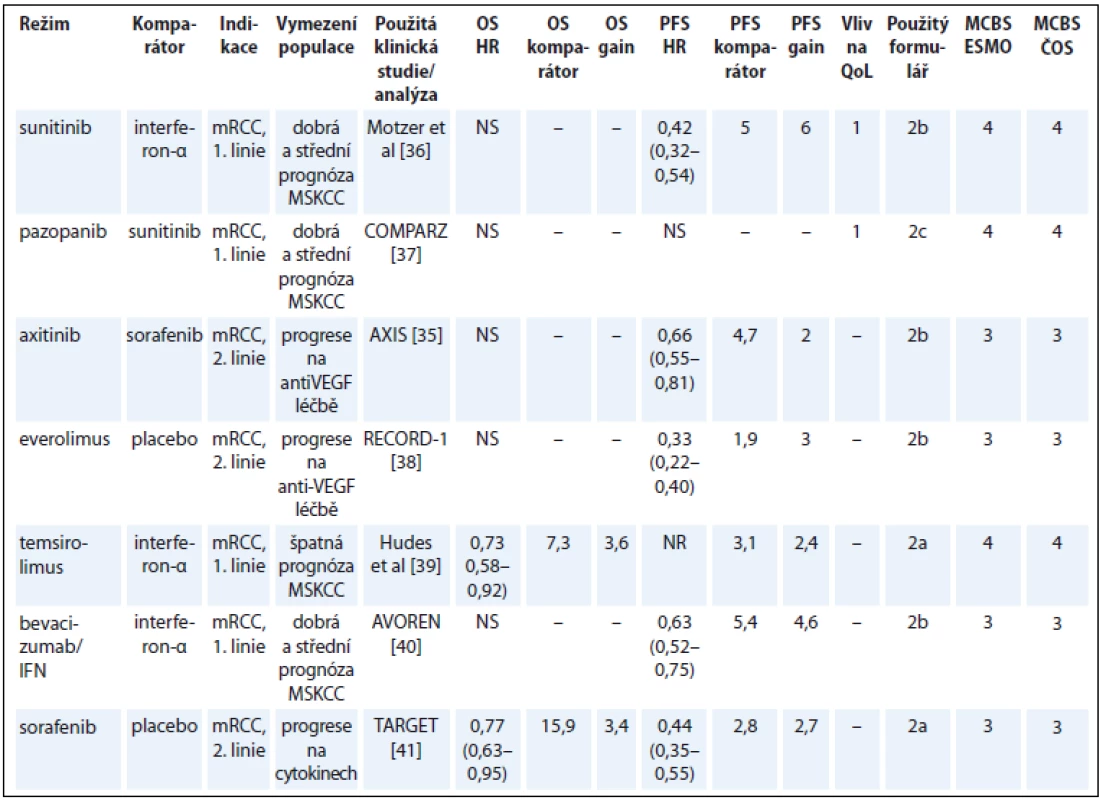
OS – celkové přežití, PFS – přežití bez progrese, QoL – kvalita života, NS – statisticky nesignifikantní rozdíl v parametru, mRCC – metastatický renální karcinom, VEGF – vaskulární endoteliální růstový faktor, NR – neuvedeno, MSKCC – Memorial Sloan-Kettering Cancer Centre kritéria, IFN – infernon-alfa Melanom
V hodnocení přínosu léků na melanom došlo k diskrepanci oproti hodnocení týmem ESMO ve dvou případech. U kombinace dabrafenib/trametinib jsme použili parametr OS, i když primárním hodnoceným parametrem studie COMBI-d bylo PFS [42]. Výsledky OS, a dokonce i výsledky 3letého OS jsou již dostupné. Po zohlednění nejnovějších výsledků studie COMBI-d a také COMBI-v [43,44] jsme pro kombinaci dabrafenib/trametinib dospěli ke skóre 5 vs. 4 uváděnému ESMO.
V našem hodnocení získal nejvyšší skóre 5 také nivolumab na základě zásadního prodloužení OS a zlepšení QoL oproti terapii dacarbazinem v populaci nemocných bez mutace BRAF (tab. 7) [42–49].
Tab. 7. Melanom. 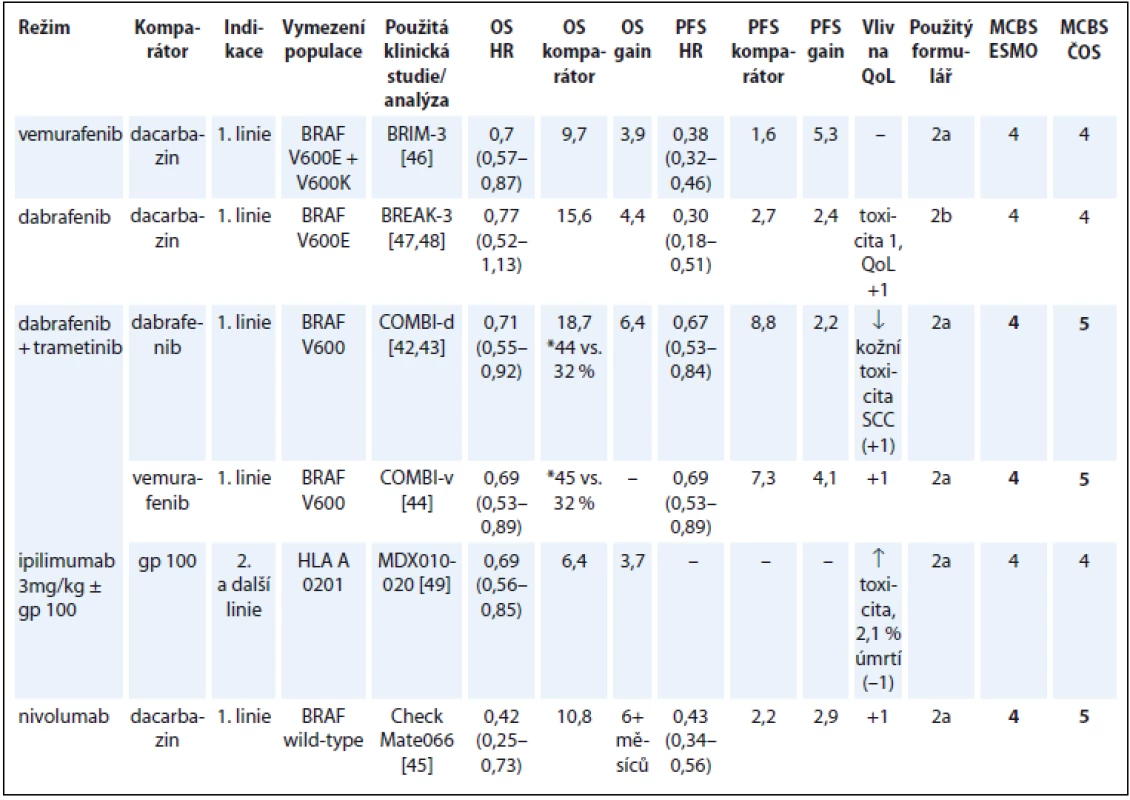
*3leté přežití OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, NSCLC – nemalobuněčný karcinom plic, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno, SCC – skvamózní karcinom Karcinom prostaty
Jak uvádí i experti ESMO, u metastatického kastračně rezistentního karcinomu prostaty (metastatic castration-resistant prostate cancer – mCRPC) použila většina studií nové hormonální léky (androgen receptor-targeted agents – ARTA) v kontrolním rameni placebo nebo prednison. Problematické je proto provádět nepřímé srovnání hormonálních léků s chemoterapií podle dosaženého skóre, jelikož ve studiích s cytostatiky bylo v kontrolním rameni obvykle použito jiné cytostatikum s nezanedbatelnou účinností u mCRPC.
Terapie enzalutamidem v pre-chemo indikaci, ač podpořena výsledky randomizované studie [50], zatím u nás není hrazena z veřejného zdravotního pojištění, proto ji zde neuvádíme (tab. 8) [51–55].
Tab. 8. Kastračně refrakterní karcinom prostaty. 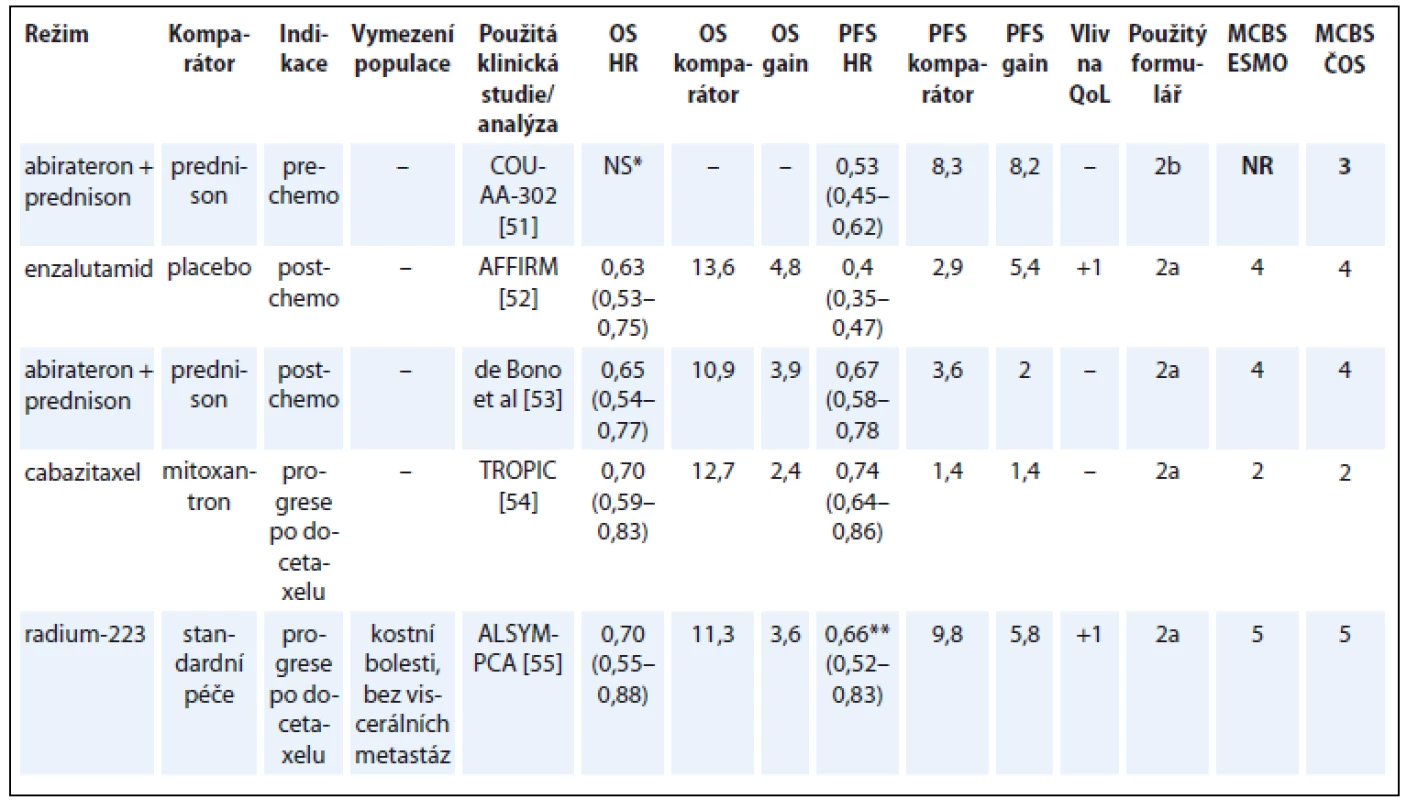
*rozdíl v OS není signifikantní na prespecifikované hladině statistické signifikance **sledovaným parametrem byla doba do symptomatické kostní příhody OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno Hepatocelulární karcinom
Indikace sorafenibu u hepatocelulárního karcinomu (hepatocellular carcinoma – HCC) je založená na randomizované studii SHARP, jejímž primárním cílem bylo hodnocení PFS a doby do zhoršení QoL. Překřížení ramen nebylo v této studii povoleno před finální analýzou OS [56]. I když je sorafenib jediným cíleným lékem v současnosti dostupným v této indikaci, na základě hodnocení MCBS je jeho přínos relativně nízký. U některých nemocných se nicméně daří dosáhnout dlouhodobé odpovědi na léčbu sorafenibem [57]. Na tomto příkladu je vidět problém s hodnocením léku podle metodiky ESMO-MCBS, pokud se jedná o jedinou léčebnou možnost pro danou malignitu (tab. 9) [56].
Tab. 9. Hepatocelulární karcinom (údaje přežití jsou uvedeny v týdnech). 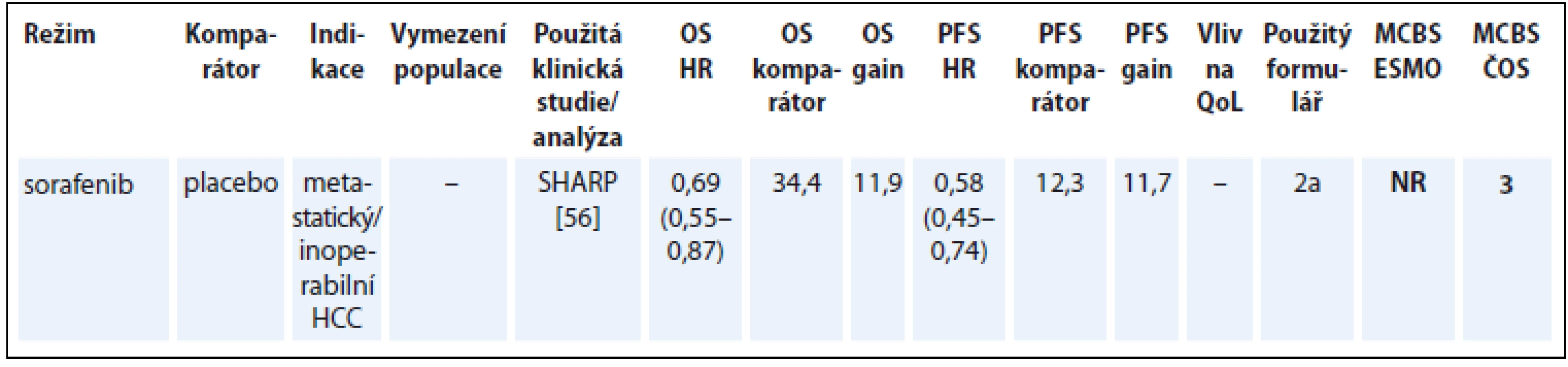
OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, HCC – hepatocelulární karcinom, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno Karcinom žaludku a gastroezofageální junkce
Podobně jako u HCC je v této indikaci hrazen jediný cílený lék, trastuzumab, v podskupině nemocných s HER2+ nádorem. Navzdory léčbě cílené na konkrétní receptor a absenci významné přidané toxicity je přínos léku hodnoceného podle systému ESMO-MCBS vyjádřen jen hodnotou 3. V klinickém kontextu je ovšem nutné zohlednit také to, že se jedná o prognosticky mimořádně nepříznivý typ nádoru s omezenými možnostmi systémové léčby (tab. 10) [58].
Tab. 10. Karcinom žaludku a gastroezofageální junkce. 
OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, mGC – metastatický karcinom žaludku, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno Ovariální karcinom
Přínos bevacizumabu v kombinaci s chemoterapií byl hodnocen v podskupině nemocných s vysokým rizikem, což je v souladu s úhradovým omezením bevacizumabu na základě analýzy podskupin ve studii ICON7 [59]. Pro takto vymezenou indikaci bylo v hodnocení dle ESMO-MCBS dosaženo vysoké skóre (tab. 11) [59].
Tab. 11. Ovariální karcinom. 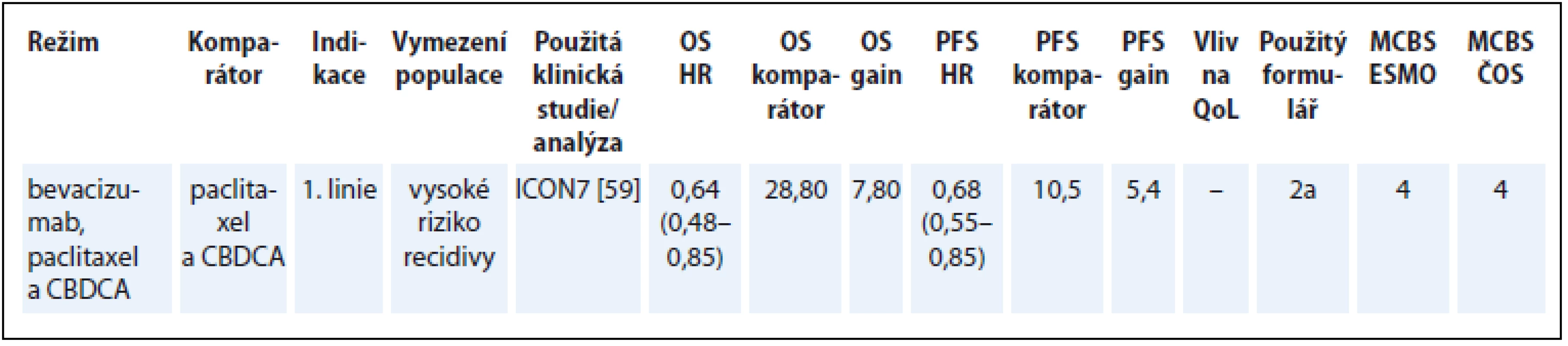
OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, CBDCA – carboplatin, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno Karcinom močového měchýře
Vinflunin jako terapie 2. linie pro nemocné s metastatickým karcinomem močového měchýře je jedinou v současnosti hrazenou terapií, pro kterou je v této indikaci dostupná klinická studie prokazující prodloužení přežití [60]. Tento lék publikace ESMO nehodnotila (tab. 12) [60].
Tab. 12. Karcinom močového měchýře. 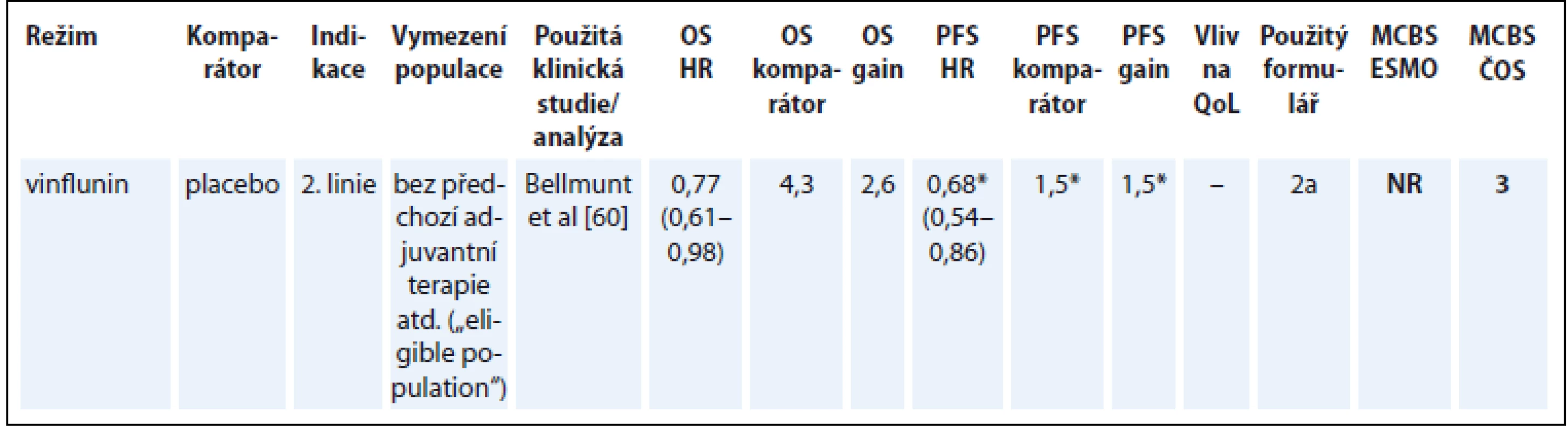
*parametry související s PFS platí pro „intention-to-treat“ populaci OS – celkové přežití, PFS – přežití do progrese, QoL – kvalita života, NS – statisticky nesignifikantní rozdíl v parametru, NR – neuvedeno Diskuze
Metoda ESMO-MCBS pro hodnocení klinického benefitu léků je jednoduchá, robustní a reprodukovatelná. Její výsledky se ve velké většině případů shodují s expertním názorem na klinický přínos daného léku. Expertní tým ČOS ČLS JEP se domnívá, že skóre podle ESMO-MCBS by se mělo stát dalším hodnoceným parametrem při posuzování úhrady léku z veřejného zdravotního pojištění. Robustnost metody rovněž odpovídá požadavkům metodik HTA (Health Technology Assessment), a to zejména v tom, že není postavena na jednom podílovém indexu, ale kombinuje více dimenzí hodnoceného problému. Doporučení ČOS ČLS JEP budou postupně doplňována o tento parametr.
Metoda dosud neumožňuje hodnocení léků v některých klíčových indikacích, např. neoadjuvanci, kde často hlavním hodnoceným parametrem je pCR, a u studií s jedním ramenem, na jejichž základě občas dochází k registraci nových léků pro méně časté diagnózy. Proto nebylo možné hodnotit léky imatinib v indikaci gastrointestinální stromální tumor, vismodegib v indikaci kožní basaliom nebo pazopanib v indikaci sarkomy měkkých tkání. Přitom např. v případě imatinibu u nemocných s metastatickým gastrointestinálním stromálním nádorem je zřejmé, že oproti dřívějšímu standardu, kterým byla většinou chemoterapie, imatinib prodlužuje medián OS v řádu několika let. Limitací metody ESMO-MCBS je tedy mimo jiné i to, že nemůže hodnotit ty léky, kde byl výrazný efekt zaznamenán již ve studiích časné fáze, a kde by tudíž provedení randomizované studie nebylo etické. Není možné ani hodnocení metaanalýz, které obvykle neuvádějí absolutní rozdíly v přežití, nýbrž jen HR. V současnosti expertní skupina ESMO pracuje na systému MCBS 1.1, který by měl umožnit i hodnocení ve výše uvedených situacích a případně modifikovat některé parametry hodnocení léků.
V hodnocení expertní skupina ČOS ČLS JEP mírně modifikovala metodiku ESMO-MCBS v hodnocení QoL. Podle ESMO se při zlepšení QoL díky hodnocené léčbě vůči komparátoru přidává k bodovému hodnocení 1 bod, pokud není QoL zlepšena a hodnocení je provedeno podle parametru PFS, ubere se 1 bod. V našem hodnocení jsme ubírali 1 bod jen v případě, že došlo k prokazatelnému zhoršení QoL vůči komparátoru. Důvodem této modifikace bylo, že u většiny použitých studií nejsou údaje o QoL dostupné a došlo by k znevýhodnění léků ve studiích, kde QoL hodnocena byla a rozdíl se neprokázal. QoL je u onkologických pacientů podmíněna hlavně základním onkologickým onemocněním a oddálení progrese v klinické praxi převáží jistý stupeň dyskomfortu způsobený léčbou. Tato modifikace nicméně způsobila změnu jen u dvou léků (bevacizumab a everolimus v indikaci karcinom prsu), kde je naše hodnocení o 1 bod vyšší než v publikaci Cherny et al [1].
Hodnocení přínosu léků v indikacích s mimořádně nepříznivou prognózou, jako je HCC, HER2+ karcinom žaludku a gastroezofageální junkce, a také vyšší linie terapie dalších malignit může být podle algoritmu ESMO-MCBS podhodnoceno. Existují totiž nemocní, kteří budou na léčbu dobře a dlouhodobě odpovídat. Problémem je, že v současnosti není možné tyto nemocné předem identifikovat.
Závěr
Hodnocení léků podle systému ESMO-MCBS je jednoduché, reprodukovatelné a robustní. Získané skóre ve většině případů odpovídá intuitivně hodnocenému přínosu léků v klinické praxi zkušenými onkology. Skóre ESMO-MCBS se může stát dalším doplňkovým parametrem při hodnocení nových onkologických léků za účelem jejich úhrady z veřejného zdravotního pojištění.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Tomáš Büchler, Ph.D.
Onkologická klinika 1. LF UK a Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: tomas.buchler@ftn.cz
Obdrženo: 3. 5. 2017
Přijato: 20. 6. 2017
Zdroje
1. Cherny NI, Sullivan R, Dafni U et al. A standardised, generic, validated approach to stratify the magnitude of clinical benefit that can be anticipated from anti-cancer therapies: the European Society for Medical Oncology Magnitude of Clinical Benefit Scale (ESMO-MCBS). Ann Oncol 2015; 26 (8): 1547–1573. doi: 10.1093/annonc/mdv249.
2. Cherny NI, Sullivan R, Dafni U et al. ESMO – Magnitude of Clinical Benefit Scale V.1.0 questions and answers. ESMO Open 2016; 1 (5): e000100. doi: 10.1136/esmoopen-2016-000100.
3. Kiesewetter B, Raderer M, Steger GG et al. The European Society for Medical Oncology Magnitude of Clinical Benefit Scale in daily practice: a single institution, real-life experience at the Medical University of Vienna. ESMO Open 2016; 1 (4): e000066. doi: 10.1136/esmoopen-2016-000066.
4. Cherny NI, Sullivan R, Dafni U et al. A standardised, generic, validated approach to stratify the magnitude of clinical benefit that can be anticipated from anti-cancer therapies: the European Society for Medical Oncology Magnitude of Clinical Benefit Scale (ESMO-MCBS). Ann Oncol 2016; pii: mdw258. doi: 10.1093/annonc/mdw258.
5. Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350 (23): 2335–2342. doi: 10.1056/NEJMoa032691.
6. Saltz LB, Clarke S, Díaz-Rubio E et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008; 26 (12): 2013–2019. doi: 10.1200/JCO.2007.14.9930.
7. Linkos. Klinický registr CORECT. [online]. Institut biostatistiky a analýz Masarykovy univerzity, Brno. [citováno 1. ledna 2017]. Dostupné z: http: //www.linkos.cz/prehled-registru/klinicky-registr-corect/.
8. Douillard JY, Tabernero J, Salvatore S et al. The PRIME study: survival outcomes in patients with KRAS/NRAS wild-type metastatic colorectal cancer and non-liver-limited disease. Ann Oncol 2014; 25 (Suppl 2): abstr. 0004. doi: 10.1093/annonc/mdu164.4.
9. Peeters M, Oliner KS, Price TJ et al. Analysis of KRAS/NRAS Mutations in a Phase III Study of Panitumumab with FOLFIRI Compared with FOLFIRI Alone as Second-line Treatment for Metastatic Colorectal Cancer. Clin Cancer Res 2015; 21 (24): 5469–5479. doi: 10.1158/1078-0432.CCR-15-0526.
10. Kim TW, Elme A, Kusic Z et al. A phase 3 trial evaluating panitumumab plus best supportive care vs best supportive care in chemorefractory wild-type KRAS or RAS metastatic colorectal cancer. Br J Cancer 2016; 115 (10): 1206–1214. doi: 10.1038/bjc.2016.309.
11. Amado RG, Wolf M, Peeters M et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26 (10): 1626–1634. doi: 10.1200/JCO.2007.14.7116.
12. Van Cutsem E, Lenz HJ, Köhne CH et al. Fluorouracil, leucovorin, andirinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol 2015; 33 (7): 692–700. doi: 10.1200/JCO.2014.59.4812.
13. Giantonio BJ, Catalano PJ, Meropol NJ et al. Bevacizumab in combination withoxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treatedmetastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007; 25 (12): 1539–1544. doi: 10.1200/JCO.2006.09.6305.
14. Van Cutsem E, Tabernero J, Lakomy R et al. Addition of aflibercept tofluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012; 30 (28): 3499–3506. doi: 10.1200/JCO.2012.42.8201.
15. Peeters M, Price TJ, Cervantes A et al. Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 2010; 28 (31): 4706–4713. doi: 10.1200/JCO.2009.27.6055.
16. Bennouna J, Sastre J, Arnold D et al. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol 2013; 14 (1): 29–37. doi: 10.1016/S1470-2045 (12) 70477-1.
17. Jonker DJ, O’Callaghan CJ, Karapetis CS et al. Cetuximab for the treatment of colorectal cancer. N Engl J Med 2007; 357 (20): 2040–2048. doi: 10.1056/NEJMoa071834.
18. Grothey A, Cutsem EV, Sobrero A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381 (9863): 303–312. doi: 10.1016/S0140-6736 (12) 61900-X.
19. Romond EH, Perez EA, Bryant J et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005; 353 (16): 1673–1684. doi: 10.1056/NEJMoa052122.
20. Slamon DJ, Leyland-Jones B, Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344 (11): 783–792. doi: 10.1056/NEJM200103153441101.
21. Kaufman B, Mackey JR, Clemens MR et al. Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2-positive, hormone receptor-positive metastatic breast cancer: results from the randomized phase III TAnDEM study. J Clin Oncol 2009; 27 (33): 5529–5537. doi: 10.1200/JCO.2008.20.6847.
22. Geyer CE, Forster J, Lindquist D et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006; 355 (26): 2733–2743. doi: 10.1056/NEJMoa064320.
23. Miller K, Wang M, Gralow J et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med 2007; 357 (26): 2666–2676. doi: 10.1056/NEJMoa072113.
24. Swain SM, Baselga J, Kim SB et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015; 372 (8): 724–734. doi: 10.1056/NEJMoa1413513.
25. Verma S, Miles D, Gianni L et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012; 367 (19): 1783–1791. doi: 10.1056/NEJMoa1209124.
26. Cortes J, O’Shaughnessy J, Loesch D et al. Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. Lancet 2011; 377 (9769): 914–923. doi: 10.1016/S0140-6736 (11) 60070-6.
27. Baselga J, Campone M, Piccart M et al. Everolimus in postmenopausal hormone receptor-positive advanced breast cancer. N Engl J Med 2012; 366 (6): 520–529. doi: 10.1056/NEJMoa1109653.
28. Zhou C, Wu YL, Chen G et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non small cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12 (8): 735–742. doi: 10.1016/S1470-2045 (11) 70184-X.
29. Fukuoka M, Wu Y-L, Thongprasert S et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J Clin Oncol 2011; 29 (21): 2866–2874. doi: 10.1200/JCO.2010.33.4235.
30. Sequist LV, Yang JC, Yamamoto N et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31 (21): 3327–3334. doi: 10.1200/JCO.2012.44.2806.
31. Solomon BJ, Mok T, Kim DW et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014; 371 (23): 2167–2177. doi: 10.1056/NEJMoa1408440.
32. Scagliotti GV, Parikh P, von Pawel J et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008; 26 (21): 3543–3551. doi: 10.1200/JCO.2007.15.0375.
33. Ciuleanu T, Brodowicz T, Zielinski C et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet 2009; 374 (9699): 1432–1440. doi: 10.1016/S0140-6736 (09) 61497-5.
34. Sandler A, Gray R, Perry MC et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med 2006; 355 (24): 2542–2550. doi: 10.1056/NEJMoa061884.
35. Rini B, Escudier B, Tomczak P et al. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet 2011; 378 (9807): 1931–1939. doi: 10.1016/S0140-6736 (11) 61613-9.
36. Motzer RJ, Hutson TE, Tomczak P et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009; 27 (22): 3584–3590. doi: 10.1200/JCO.2008.20.1293.
37. Motzer RJ, Hutson TE, Cella D et al. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 2013; 369 (8): 722–731. doi: 10.1056/NEJMoa1303989.
38. Motzer RJ, Escudier B, Oudard S et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 2008; 372 (9637): 449–456. doi: 10.1016/S0140-6736 (08) 61039-9.
39. Hudes G, Carducci M, Tomczak P et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356 (22): 2271–2281. doi: 10.1056/NEJMoa066838.
40. Escudier B, Pluzanska A, Koralewski P et al. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet 2008; 370 (9605): 2103–2111. doi: 10.1016/S0140-6736 (07) 61904-7.
41. Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356 (2): 125–134. doi: 10.1056/NEJMoa060655.
42. Long GV, Stroyakovskiy D, Gogas H et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet 2015; 386 (9992): 444–451. doi: 10.1016/S0140-6736 (15) 60898-4.
43. Flaherty K, Davies MA, Grob JJ et al. Genomic analysis and 3-y efficacy and safety update of COMBI-d: A phase 3 study of dabrafenib (D) + trametinib (T) vs D monotherapy in patients (pts) with unresectable or metastatic BRAF V600E/K-mutant cutaneous melanoma. J Clin Oncol 2016; 34: abstr. 9502.
44. Robert C, Karaszewska B, Schachter J et al. Three-year estimate of overall survival in COMBI-v, a randomized phase 3 study evaluating first-line dabrafenib (D) + trametinib (T) in patients (pts) with unresectable or metastatic BRAF V600E/K–mutant cutaneous melanoma. Ann Oncol 2016; 27 (Suppl 6): LBA40. doi: 10.1093/annonc/mdw435.37.
45. Robert C, Long GV, Brady B et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372 (4): 320–330. doi: 10.1056/NEJMoa1412082.
46. McArthur GA, Chapman PB, Robert C et al. Safety and efficacy of vemurafenib in BRAF (V600E) and BRAF (V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol 2014; 15 (3): 323–332. doi: 10.1016/S1470-2045 (14) 70012-9.
47. Hauschild A, Grob JJ, Demidov LV et al. Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012; 380 (9839): 358–365. doi: 10.1016/S0140-6736 (12) 60868-X.
48. Hauschild J, Grobb L, Demidov LV et al. An update on overall survival (OS) and follow-on therapies in BREAK-3. Ann Oncol 2014; 25 (Suppl 4): iv374–iv393. abstract 1092PD.
49. Hodi FS, O’Day SJ, McDermott DF et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363 (8): 711–723. doi: 10.1056/NEJMoa1003466.
50. Beer TM, Armstrong AJ, Rathkopf DE et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371 (5): 424–433. doi: 10.1056/NEJMoa1405095.
51. Ryan CJ, Smith MR, de Bono JS et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368 (2): 138–148. doi: 10.1056/NEJMoa1209096.
52. Scher HI, Fizazi K, Saad F et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367 (13): 1187–1197. doi: 10.1056/NEJMoa1207506.
53. de Bono JS, Logothetis CJ, Molina A et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364 (21): 1995–2005. doi: 1056/NEJMoa1014618.
54. de Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376 (9747): 1147–1154. doi: 10.1016/S0140-6736 (10) 61389-X.
55. Parker C, Nilsson S, Heinrich D et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 2013; 369 (3): 213–223. doi: 10.1056/NEJMoa1213755.
56. Llovet JM, Ricci S, Mazzaferro V et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359 (4): 378–390. doi: 10.1056/NEJMoa0708857.
57. Lu LC, Shao YY, Chan SY el al. Clinical characteristics of advanced hepatocellular carcinoma patients with prolonged survival in the era of anti-angiogenic targeted-therapy. Anticancer Res 2014; 34 (2): 1047–1052.
58. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376 (9742): 687–697. doi: 10.1016/S0140-6736 (10) 61121-X.
59. Perren TJ, Swart AM, Pfisterer J et al. A phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med 2011; 365 (26): 2484–2496. doi: 10.1056/NEJMoa1103799.
60. Bellmunt J, Théodore C, Demkov T et al. Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol 2009; 27 (27): 4454–4461. doi: 10.1200/JCO.2008.20.5534.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Soutěž o nejlepší práciČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Odmítnutí léčby v dětské onkologii
- Soutěž o nejlepší práci
- Potenciál vitamínu D v adjuvantnej liečbe malígneho melanómu kože
- Kontroverze v pooperační léčbě low-grade gliomů
- Postavení chemoterapie v pooperační léčbě low-grade gliomů
- Hodnocení klinického benefitu protinádorových léků limitovaných na komplexní onkologická centra podle metodiky ESMO-MCBS
- Mutace isocitrátdehydrogenázy jsou lepší prognostický marker než metylace promotoru O6-metylguanin-DNA-metyltransferázy u glioblastomů – retrospektivní molekulárně genetická studie gliomů z jednoho centra
- Anti-apoptotický mechanizmus metforminu proti apoptóze indukované ionizujícím zářením v mononukleárních buňkách lidské periferní krve
- Odmietnutie liečby v detskej onkológii
- Informace z České onkologické společnosti
- Aktuality z odborného tisku
- Vznik postradiační reakce a její preventivní ošetřování během radioterapie
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vznik postradiační reakce a její preventivní ošetřování během radioterapie
- Kontroverze v pooperační léčbě low-grade gliomů
- Postavení chemoterapie v pooperační léčbě low-grade gliomů
- Odmietnutie liečby v detskej onkológii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



