-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Reaktivní lymfoidní hyperplazie jater
Reactive Lymphoid Hyperplasia of the Liver
Case:
Here, we present the case of a 50-year-old woman diagnosed with stage I hormone-dependent breast cancer. The patient underwent partial mastectomy followed by adjuvant radiotherapy and hormone treatment with tamoxifen. Three years later, she presented with a solitary liver lesion on MRI, which was highly suspicious of malignancy. However, several fine needle biopsies were performed, and histopathological examination revealed no signs of neoplasia. As a result of these alarming discrepancies, the multidisciplinary board recommended a diag-nostic laparotomy, which yielded a finding consistent with reactive lymphoid hyperplasia, a pseudolymphoma of the liver, on a background of incipient steatohepatitis. This rare condition is characterized by proliferation of non-neoplastic lymphocytes in extranodular sites, and is usually an incidental finding on imaging modalities in clinically asymptomatic patients, predominantly women. Lesions share some radiologic features with primary malignant liver diseases such as hepatocellular carcinoma or cholangiocarcinoma. Although the etiology remains unclear, reactive lymphoid hyperplasia is believed to be associated with some malignancies, including breast cancer, or inflammatory and autoimmune disorders. Reactive lymphoid hyperplasia usually progresses slowly, with some cases of spontaneous regression described in the literature. To the best of our knowledge, only 50 cases of hepatic reactive lymphoid hyperplasia have been reported so far.Key words:
pseudolymphoma – hyperplasia – liver – lymphatic tissue
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
20. 3. 2017Accepted:
10. 4. 2017
Autoři: B. Dobiašová; M. Zvaríková; K. Petrakova
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2017; 30(4): 294-298
Kategorie: Kazuistika
doi: https://doi.org/10.14735/amko2017294Souhrn
Případ:
Předkládáme kazuistiku 50leté pacientky léčené pro hormonálně dependentní karcinom prsu I. klinického stadia. V rámci primární léčby pacientka absolvovala chirurgický výkon (parciální mastektomie) a radioterapii, standardně byla indikována adjuvantní hormonoterapie tamoxifenem. Po 3 letech od zahájení bylo na MRI diagnostikováno ložiskové jaterní postižení charakteru metastatické infiltrace. Tento ložiskový proces byl následně potvrzen i dalšími zobrazovacími metodami. Histologicky ani po opakovaných jaterních rebiopsiích nádorové změny zachyceny nebyly. Vzhledem k přetrvávajícímu rozporu bylo doporučeno provedení diagnostické laparotomie. Ze získaného materiálu byl následně histologicky potvrzen obraz kompatibilní s reaktivní lymfoidní hyperplazií, pseudolymfom jaterní tkáně v terénu steatózy až steatohepatitidy. Jedná se o velice vzácné onemocnění, které je charakterizováno nenádorovou proliferací lymfatické tkáně v extranodálních lokalitách. Nález na zobrazovacích metodách je často náhodný u klinicky asymptomatických pacientů, více v ženské populaci. Ložiska mohou připomínat primární maligní jaterní postižení jako hepatocelulární karcinom nebo cholangiokarcinom. Přesná etiologie této léze není známa, často však bývá asociována s předcházejícími malignitami, vč. karcinomu prsu nebo zánětlivými a autoimunitními procesy. Onemocnění je většinou pomalu progredující, zaznamenány jsou i případy spontánní regrese. Doposud bylo v literatuře popsáno pouze kolem 50 případů.Klíčová slova:
pseudolymfom – hyperplazie – játra – lymfatická tkáňÚvod
Reaktivní lymfoidní hyperplazie jater (RLH, pseudolymfom) je vzácné onemocnění. První případ byl ve světě popsán v roce 1981 (Snover et al) [1] a doposud je známých 51 případů [2–5]. Toto onemocnění častěji postihuje ženy (1 : 7), a to nejvíce ve středním věku [6]. Vyskytuje se v různých orgánech jako orbita [7], plíce [8], kůže [9,10], štítnice [11], gastrointestinální trakt vč. pankreatu a jater [12–14]. Patogeneze onemocnění není známa, dává se do souvislosti s imunologickými abnormalitami, zejména autoimunitní tyreoiditidou [15], Sjögrenovým syndromem [16], primárním imunodeficitem [1] i primární biliární cirhózou [17,18]. Známá je také korelace s maligním onemocněním (kolorektální karcinom, renální karcinom, karcinom prsu) [19] a zánětlivými procesy typu hepatitidy (HBV, HCV) jako projev stimulace samotným virem nebo důsledkem léčby hepatitidy IFN-α [20,21].
Jedná se o benigní nodulární lézi, která je histopatologicky charakterizována jako výrazná nonneoplastická proliferace polyklonálních lymfocytů formujících folikuly s aktivním germinálním centrem (Takuro Machida et al) [6]. Podle Saltzsteina et al jde o propagaci lymfoidních folikulů tvořených lymfoidními buňkami bez cytologické atypie, vyznačující se nápadnými reaktivními germinálními centry [22]. Obdobně je onemocnění definováno jako lokalizovaná, dobře ohraničená léze charakterizovaná přítomností hyperplastických lymfoidních folikulů s polymorfními a polyklonálními populacemi buněk tvořenými malými zralými lymfocyty, zralými plazmatickými buňkami, makrofágy a stromální fibrózou [23,24].
Pacienti postižení nemocí jsou obvykle asymptomatičtí, nebo mají pouze nespecifické symptomy v podobě abdominálního dyskomfortu [25]. Laboratorní parametry (krevní obraz i biochemie vč. transamináz a bilirubinu) jsou v referenčních mezích, stejně tak hodnoty tumor markerů. Na zobrazovacích metodách mnohdy nacházíme obraz malignity nejčastěji připomínající hepatocelulární karcinom nebo cholangiokarcinom. V USG obrazu jsou popisovány hypoechogenní masy s hyperechogenním lemem, na CT hypodenzní léze a dle MRI hypointenzivní ložiska v T1 a hyperintenzivní v T2, na AG dominující hypervaskularita lézy [6,26].
Makroskopicky nacházíme bílé, šedé a bílo-žluté dobře ohraničené léze nepravidelného tvaru, většinou neopouzdřené, v průměru 1,5 cm [17,23]. V nodule mohou být drobné okrsky hemoragie, nekrózy i kalcifikace [26]. Játra jsou hladkého povrchu, normálního vzhledu s typickou tkání, kromě patologické léze [17,23]. Mikroskopicky bývá popisována masivní infiltrace lymfoidními buňkami, různě velké a různě tvarované hyperplastické folikuly s aktivními germinálními centry, rozptýlené plazmatické buňky, histiocyty a stromální fibróza a v portálním traktu a kolem biliárních duktulů v okolí léze nalezeny chronické zánětlivé infiltráty [6,26,27].
Imunohistochemicky jsou v terminálních centrech přítomné folikuly CD20 lymfocytů, Bcl-2 je negativní. Tento je zas interfolikulárně pozitivní, stejně jako CD3 lymfocyty. Plazmatické buňky v podobě kappa a lambda lehkých řetězců jsou ve stejné frekvenci [6,26,27].
Právě polyklonalitou lymfocytů a plazmatických buněk a negativitou Bcl-2 v germinálních centrech se odlišuje toto onemocnění od maligního lymfomu. Na potvrzení diagnózy je vždy potřebné doplnění genové analýzy, kdy v PCR nenacházíme klonální přestavby těžkých řetězců IgH [6,27].
Terapeuticky se uplatňují chirurgické postupy, a tedy resekce postižené tkáně, která se ale ve většině případů provádí primárně s diagnostickým záměrem. Uváděnou transplantaci jater podstoupili pacienti pro asociované hepatální onemocnění [17,28]. V literatuře se léčebně uvádí i použití perkutánní etanolové injekce bez známého efektu [27,29]. U sledovaných pacientů bylo pozorováno pomalu progredující onemocnění [15,18], ale i spontánní regrese postižení [27,29].
Reaktivní lymfoidní hyperplazie je benigní onemocnění, byla však popsána i jeho transformace na maligní lymfom [30] v oblasti plíce [31], žaludku [32] a kůže [33]. Jediný známý popsaný případ transformace pseudolymfomu jater na nízkostupňový lymfom byl u 55leté pacientky s primární biliární cirhózou a Sjögrenovým syndromem [30].
Kazuistika
Polymorbidní pacientka, 50 let, zdravotní sestra, polyvalentní alergička, léčená pro diabetes mellitus 2. typu, autoimunitní tyreopatii a depresivní syndrom, po infekční hepatitidě typu B v minulosti, s anamnézou steatózy jater, po gynekologické operaci pro myomatózní uterus a dalších opakovaných chirurgických zákrocích. Pacientka s onkologicky pozitivní rodinnou anamnézou ze strany matky, abstinentka, exkuřačka. V říjnu 2010 u ní byl diagnostikován karcinom pravého prsu. Pacientka podstoupila parciální mastektomii s disekcí axily, rozsahem se jednalo o pT1b pN0 M0 tumor, kraniálně byl zachycen 2mm kritický okraj, bez angioinvaze, SNB byla negativní. Histologicky to byl invazivní duktální karcinom G2, s pozitivními steroidními receptory (ER 43 %, PR 65 %), proliferace Ki-67 17 %, bez Her-2 amplifikace. Onemocnění bylo I. klinického stadia, s nízkým rizikem relapsu. Pacientka byla v době stanovení diagnózy postmenopauzální. Standardně absolvovala pooperační radioterapii na oblast pravého prsu v dávce 50 Gy a cíleně na lůžko tumoru v dávce 10 Gy v kombinaci s adjuvantní hormonoterapií tamoxifenem celkem po dobu 5 let. Vzhledem k hraničnímu věku v čase vzniku diagnózy byla pacientka geneticky vyšetřena, známé mutace BRCA1 a BRCA2 prokázány nebyly.
Pro elevaci jaterních testů v květnu 2014 byla pacientka došetřována. Na MRI se objevila dvě nejasná ložiska na játrech v S6 a S8 charakteru metastáz (obr. 1). Histologie z jaterní biopsie provedená pod bezkontrastní CT kontrolou pro anamnézu alergie malignitu neprokázala.
Dle doplněného PET vyšetření byla nadále vyslovena suspekce z jaterního metastatického postižení (obr. 2). Nakolik tyto nálezy nebyly v korelaci s fenotypem ani stadiem onemocnění (nízké riziko relapsu), přistoupilo se k jaterní rebiopsii (6/2014). Histologicky byl popsán pouze suspektní obraz chronické hepatitidy, opět bez nádorových změn, proto gastroenterologická komise indikovala otevřenou laparotomii s odběrem materiálu k histologické verifikaci.
Obr. 1. Obraz jaterního postižení charakteru metastáz dle MRI. 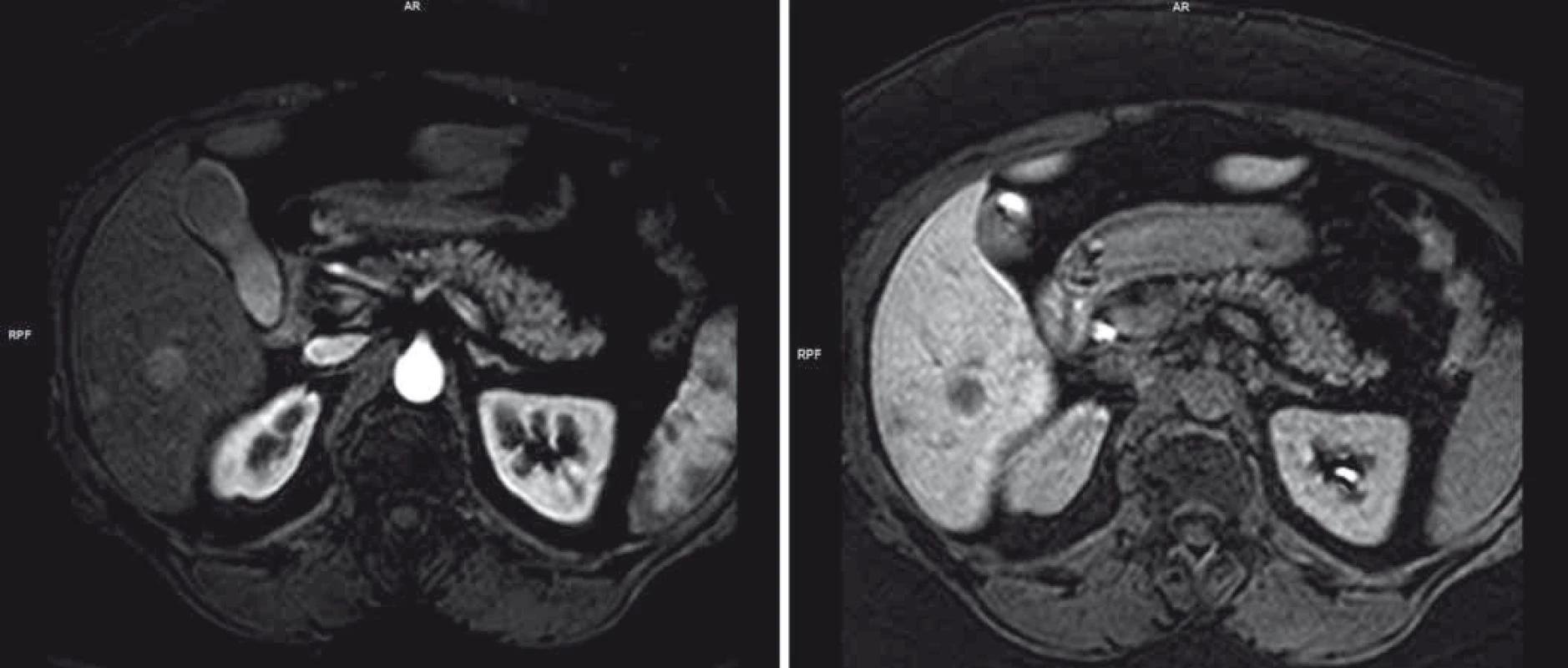
Obr. 2. Suspekce z jaterního metastatického postižení dle PET. 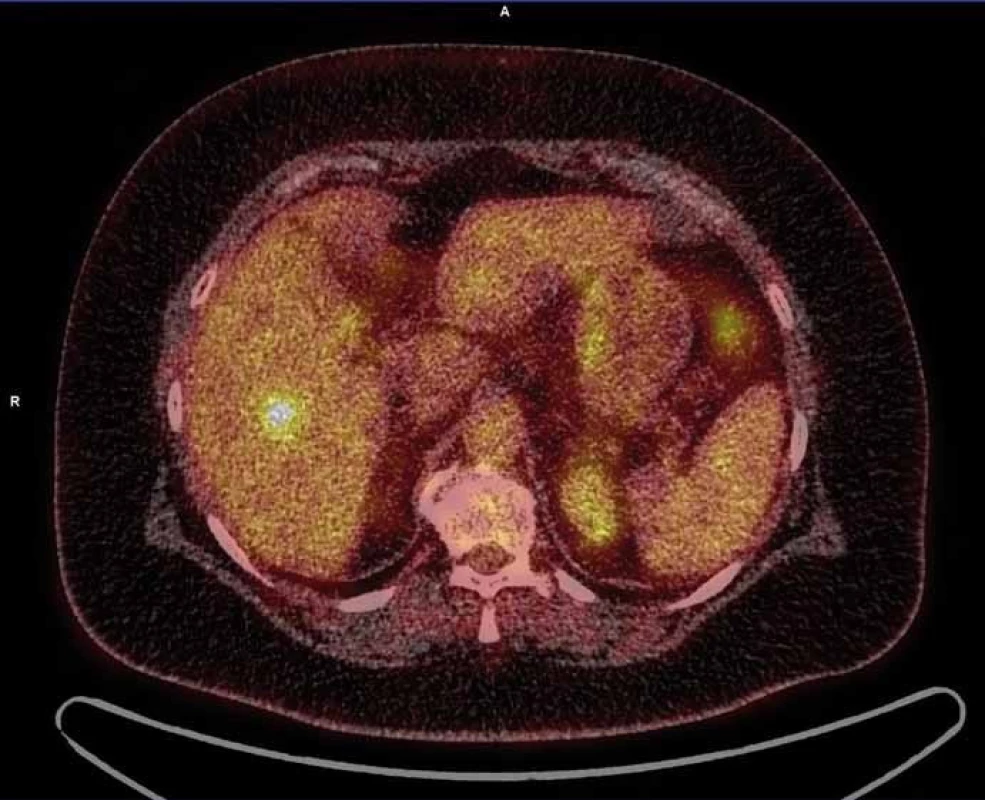
Peroperačně bylo popsáno ovoidní ložisko v pravém laloku v S6 s mírnou prominencí o průměru cca 3 cm. Excize na kryohistologii nepotvrdila očekávaný maligní nález, opět pouze zánětlivé ložisko přestavby, které může být PET pozitivní vzhledem k vysokému počtu histiocytů. Resekce pro tento benigní nález po konzultaci s ošetřujícím onkologem nebyla provedena. Dle podrobné definitivní histologie z další excize byl popsán obraz aktivní inflamatorní léze s predominantně výraznou novostavbou lymfatických folikulů, místy až abortivně granulomatózní s následnými reaktivními změnami s výraznou duktulární hyperplazií s nepravidelnými edematózními duktulárními formacemi v rámci sekundární obstrukce. Léze jsou místy centrované na reziduální portální pole s dukty. V reziduálních okrscích hepatocytů je přítomná makrovezikulární steatóza se světlými jádry hepatocytů, možnost NASH (nonalcoholic steatohepatitis) nelze vyloučit. Lymfatické folikuly jsou místy mírně nepravidelné s CD20+ germinálními centry a přítomností CD68 histiocytů, minoritní je CD3+ populace T lymfocytů interfolikulárně. Hemopoetická neoplazie s monoklonální proliferací byla vyloučena i v předchozích biopsiích (bez restrikce kappa či lambda řetězců). Aktuální imunohistochemické vyšetření Bcl-2 odpovídá reaktivním folikulům. Lymfoepitelová léze zcela jednoznačně zachycena nebyla. Jedná se tedy o obraz kompatibilní s reaktivní lymfoidní hyperplazií jaterní tkáně v inkompletní excizi. Přítomny jsou známky perilezionální sekundární biliární obstrukce, nelze ale vyloučit ani fokální ischemické změny v terénu steatózy až těžké suspektní steatohepatitidy.
Pacientka byla s tímto nálezem sledována v hepatologické ambulanci, po celou dobu byla klinicky asymptomatická, laboratorně bez vývoje, pouze s minimální elevací transamináz. Až v lednu 2016 došlo k další elevaci jaterního souboru a dle USG břicha byl popsán ložiskový proces jater, ve srovnání s vyšetřením z dubna 2015 v progresi velikosti ložisek, s difuzní lézí jaterního parenchymu charakteru těžké steatózy jater. Dle doplněné MRI jsou játra hraniční velikosti, prostoupena četnými ložisky (T1 hyposignální, T2 hypersignální). Ve srovnání s vyšetřením z května 2014 ve velikostní i početní progresi nálezu, stejného chování, tedy obraz metastatického postižení, resp. diferenciálně diagnosticky RLH ve světle již předchozích poznatků (obr. 3).
Onkologická indikační komise doporučila rebiopsii a histologicky byl potvrzen obraz RLH s progredující fibrózou, a tedy rizikem hepatální insuficience. S těmito závěry byla pacientka konzultována na transplantační chirurgii.
Obr. 3. Velikostní a početní progrese jaterního postižení dle MRI. 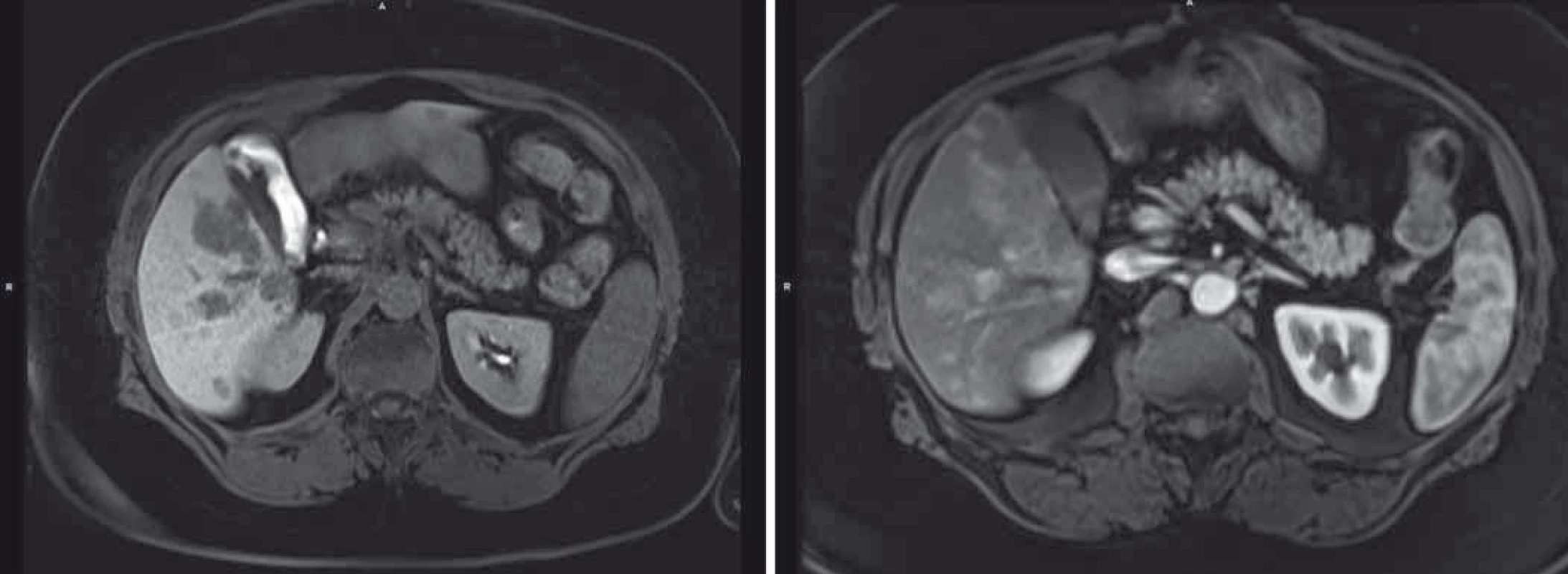
Závěr
EBM (evidence-based medicine) kritéria pro takové případy nejsou jednoznačně stanovena a samotná diagnóza RLH není na indikační listině transplantace jater. Existují ale výjimky z platných indikačních kritérií, a to v případě, že onemocnění nelze řešit jinými konvenčními metodami, lze očekávat podobný efekt jako u nemocných s ESLD (end stage liver disease) indikovaných k transplantaci jater a situace na waiting listu umožňuje nemocného zařadit. Čekací doba na transplantaci v ČR je průměrně 3,3 měsíce. Pacientka s onkologickou diagnózou po úspěšné léčbě v minimálním odstupu 5 let není kontraindikována k transplantačnímu výkonu. Dle imunologického došetření, které neshledalo žádnou patologii, a doplněného PET vyšetření, které potvrdilo remisi onkologické nemoci, není námitek na zařazení pacientky na čekací listinu. Transplantace jater z podobné indikace u nás dosud provedena nebyla.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Barbora Dobiašová
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: barbora.dobiasova@mou.cz
Obdrženo: 20. 3. 2017
Přijato: 10. 4. 2017
Zdroje
1. Snover DC, Filipovich AH, Dehner LP et al. ‚Pseudolymphoma‘. A case associated with primary immunodeficiency disease and polyglandular failure syndrome. Arch Pathol Lab Med 1981; 105 (1): 46–49.
2. Yang CT, Liu KL, Lin MC et al. Pseudolymphoma of the liver: report of a case and review of the literature. Asian J Surg 2017; 40 (1): 74–80. doi: 10.1016/j.asjsur.2013.07. 013.
3. Song KD, Jeong WK. Benign nodules mimicking hepatocellular carcinoma on gadoxetic acid-enhanced liver MRI. Clin Mol Hepatol 2015; 21 (2): 187–191. doi: 10.3350/cmh.2015.21.2.187.
4. Lv A, Liu W, Qian HG et al. Reactive lymphoid hyperplasia of the liver mimicking hepatocellular carcinoma: incidental finding of two cases. Int J Clin Exp Pathol 2015; 8 (5): 5863–5869.
5. Sonomura T, Anami S, Takeuchi T et al. Reactive lymphoid hyperplasia of the liver: Perinodular enhancement on contrast-enhanced computed tomography and magnetic resonance imaging. World J Gastroenterol 2015; 21 (21): 6759–6763. doi: 10.3748/wjg.v21.i21.6759.
6. Machida T, Takahashi T, Itoh T et al. Reactive lymphoid hyperplasia of the liver: a case report and review of literature. World J Gastroenterol 2007; 13 (40): 5403–5407.
7. Knowles DM, Jakobiec FA, McNally L et al. Lymphoid hyperplasia and malignant lymphoma occurring in the ocular adnexa (orbit, conjunctiva, and eyelids): a prospective multiparametric analysis of 108 cases during 1977 to 1987. Hum Pathol 1990; 21 (9): 959–973.
8. Abbondanzo SL, Rush W, Bijwaard KE et al. Nodular lymphoid hyperplasia of the lung: a clinicopathologic study of 14 cases. Am J Surg Pathol 2000; 24 (4): 587–597.
9. Caro WA, Helwig HB. Cutaneous lymphoid hyperplasia. Cancer 1969; 24 (3): 487–502.
10. Baldassano MF, Bailey EM, Ferry JA et al. Cutaneous lymphoid hyperplasia and cutaneous marginal zone lymphoma: comparison of morphologic and immunophenotypic features. Am J Surg Pathol 1999; 23 (1): 88–96.
11. Mizukami Y, Ikuta N, Hashimoto T et al. Pseudolymphoma of the thyroid. Acta Pathol Jpn 1988; 38 (10): 1329–1336.
12. Tokunaga O, Watanabe T, Morimatsu M. Pseudolymphoma of the stomach. A clinicopathologic study of 15 cases. Cancer 1987; 59 (7): 1320–1327.
13. Abbondanzo SL, Sobin LH. Gastric „pseudolymphoma“: a retrospective morphologic and immunophenotypic study of 97 cases. Cancer 1997; 79 (9): 1656–1663.
14. Kojima M, Itoh H, Motegi A et al. Localized lymphoid hyperplasia of the rectum resembling polypoid mucosa-associated lymphoid tissue lymphoma: a report of three cases. Pathol Res Pract 2005; 201 (11): 757–761.
15. Nagano K, Fukuda Y, Nakano I et al. Reactive lymphoid hyperplasia of liver coexisting with chronic thyroiditis: radiographical characteristics of the disorder. J Gastroenterol Hepatol 1999; 14 (2): 163–167.
16. Okubo H, Maekawa H, Ogawa K et al. Pseudolymphoma of the liver associated with Sjögren‘s syndrome. Scand J Rheumatol 2001; 30 (2): 117–119.
17. Sharifi S, Murphy M, Loda M et al. Nodular lymphoid lesion of the liver: an immune-mediated disorder mimicking low-grade malignant lymphoma. Am J Surg Pathol 1999; 23 (3): 302–308.
18. Okada T, Mibayashi H, Hasatani K et al. Pseudolymphoma of the liver associated with primary biliary cirrhosis: a case report and review of literature. World J Gastroenterol 2009; 15 (36): 4587–4592.
19. Takahashi H, Sawai H, Matsuo Y et al. Reactive Lymphoid Hyperplasia of the liver in a patient with colon cancer: report of two cases. BMC Gastroenterol 2006; 6 : 25.
20. Ohtsu T, Sasaki Y, Tanizaki H et al. Development of pseudolymphoma of liver following interferon-alpha therapy for chronic hepatitis B. Intern Med 1994; 33 (1): 18–22.
21. Kim SR, Hayashi Y, Kang KB et al. A case of pseudolymphoma of the liver with chronic hepatitis C. J Hepatol 1997; 26 (1): 209–214.
22. Saltzstein SL. Pulmonary malignant lymphomas and pseudolymphomas: Classification, therapy, and prognosis. Cancer 1963; 16 : 928–955.
23. Katayanagi K, Terada T, Nakanuma Y et al. A case of pseudolymphoma of the liver. Pathol Int 1994; 44 (9): 704–711.
24. Tanizawa T, Eishi Y, Kamiyama R et al. Reactive lymphoid hyperplasia of the liver characterized by an angiofollicular pattern mimicking Castleman‘s disease. Pathol Int 1996; 46 (10): 782–786.
25. Amer A, Mafeld S, Saeed D et al. Reactive lymphoid hyperplasia of the liver and pancreas. A report of two cases and a comprehensive review of the literature. Clin Res Hepatol Gastroenterol 2012; 36 (4): e71–e80. doi: 10.1016/j.clinre.2011.12.004.
26. Yuan L, Zhang Y, Wang Y et al. Reactive lymphoid hyperplasia of the liver: a clinicopathological study of 7 cases. HPB Surg 2012; 2012 : 357694. doi: 10.1155/2012/357694.
27. Zen Y, Fujii T, Nakanuma Y. Hepatic pseudolymphoma: a clinicopathological study of five cases and review of the literature. Mod Pathol 2010; 23 (2): 244–250. doi: 10.1038/modpathol.2009.
28. Domínguez-Pérez AD, Castell-Monsalve J. Pseudolymphoma of the liver. Contribution of double-contrast magnetic resonance imaging. Gastroenterol Hepatol 2010; 33 (7): 512–516. doi: 10.1016/j.gastrohep.2010.04. 005.
29. Ota H, Isoda N, Sunada F et al. A case of hepatic pseudolymphoma observed without surgical intervention. Hepat Res 2006; 35 (4): 296–301.
30. Sato SI, Masuda T, Oikawa H et al. Primary hepatic lymphoma associated with primary biliary cirrhosis. Am J Gastroenterol 1999; 94 (6): 1669–1673.
31. Koss MN, Hochholzer L, Nichols PW et al. Primary non-Hodgkin‘s lymphoma and pseudolymphoma of lung: a study of 161 patients. Hum Pathol 1983; 14 (12): 1024–1038.
32. Brooks JJ, Enterline HT. Gastric pseudolymphoma. Its three subtypes and relation to lymphoma. Cancer 1983; 51 (3): 476–486.
33. Kulow BF, Cualing H, Steele P et al. Progression of cutaneous B-cell pseudolymphoma to cutaneous B-cell lymphoma. J Cutan Med Surg 2002; 6 (6): 519–528.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Zasedání Organizace evropských onkologických ústavů v Brně
- Soutěž o nejlepší práci
- Nové poznatky o patogenezi folikulárního lymfomu a koncepty cílené léčby
- Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
- Metastatické postižení hypofýzy
- Informace z České onkologické společnosti
- Hyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
- Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
- Reaktivní lymfoidní hyperplazie jater
- Nádor hrudnej steny ako zriedkavý klinický prejav metastázy hepatocelulárneho karcinómu
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Exprese antigenu CD20 na povrchu buňky maligního B lymfomu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metastatické postižení hypofýzy
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



