-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ovariální ablace u pacientek s karcinomem prsu a možnosti ovlivnění vedlejších účinků léčby
Ovarian Ablation in Breast Cancer Patients and the Possibility of Influencing Treatment Side Effects
Ovarian suppression or ovarian ablation used in treatment of breast carcinoma results in temporary or permanent menopause and associated menopausal symptoms – most frequently vasomotoric symptoms (hot flashes, sweats), vaginal atrophy, sleep disturbances. Patients can also experience frequent decrease in bone density (osteopenia, osteoporosis), mood swings or depression, less frequently cardiac toxicity. Managements of these symptoms is complex. As hormonal replacement therapy (estrogens or combined estrogen/gestagen therapy) is contraindicated in women with breast carcinoma, other available options include non-hormonal pharmacological or non-pharmacological methods or their combinations. Women should be advised about cooling techniques and how to avoid known triggers; these measures should be combined with other non-pharmacological and pharmacological intervention. Non-pharmacological methods include the use of acupuncture or cognitive behavioral therapy. Some tips to help stay cool and decrease hot flashes – avoid hot beverages, spicy food, limit coffee or alcohol intake, dress in layers of clothing that can be removed if necessary. Pharmacological options include most frequently antidepressants – SSRI (selective serotonin reuptake inhibitor), SNRI (serotonin norepinephrin reuptake inhibitor), or alternatively gabapentin or pregabali. A very promising drug is paroxetine with a lot of clinical trials. Only this drug has FDA approval for the indication of hot flashes. Paroxetine can lead to disproportional changes in plasma levels of drug in CYP2D6 metabolism and thus it is not suitable for combination of paroxetine with tamoxifen. Several studies demonstrated the effectiveness of the newer generation of SSRI – citalopram, escitalopram, sertralin and duloxetin in ameliorating hot flashes. Venlafaxine in dose 75 or 150 mg has been associated with a 61% reduction in hot flashes frequency if compared to 27% reduction with placebo. Medroxyprogesterone acetate and megestrol acetate were investigated especially in patients with breast cancer history and both drugs demonstrate an effect in hot flashes treatment. Management of vaginal atrophy is challenging. Vaginal dryness/atrophy can be relieved with use of topical lubricants/gels or possibly in highly symptomatic patients with short term use of topical estrogens. As these symptoms require highly complex management, multidisciplinary approach is recommended.
Key words:
breast cancer – postmenopause – ovarian suppression – postmenopausal osteoporosis – therapy
This work was supported by grant of the Czech Ministry of Health – RVO (MOÚ, 00209805).
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
20. 7. 2016Accepted:
10. 8. 2016
Autoři: M. Palacova
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2016; 29(Supplementum 3): 29-38
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20163S29Souhrn
V důsledku ovariální suprese nebo ablace dochází k výskytu menopauzálních symptomů. Nejčastěji se vyskytují vazomotorické symptomy, vaginální atrofie, poruchy spánku. Dále dochází ke změně kostní denzity, ke změně nálad až výskytu depresí, objevuje se i kardiální toxicita. Jejich management by měl být komplexní. U žen s karcinomem prsu není možno použít hormonální substituční terapii – tzn. estrogeny, popř. kombinaci estrogenů s gestageny. Je nutno volit alternativy nefarmakologické nebo farmakologické, event. jejich kombinaci. Vhodné je zavést známá režimová opatření – snažit se omezit teplé nápoje, kořeněná jídla, konzumaci kávy, alkoholických nápojů a oblékat se ve více vrstvách, které mohou být postupně odstraněny. Dále je možné je doplnit o další nefarmakologické či farmakologické metody. Z nefarmakologických metod je možno využít akupunktury, kognitivní behaviorální terapie, z farmakologických skupin jsou využívány nejčastěji léky ze skupiny antidepresiv – SSRI (selektivní serotonin reuptake inhibitor), SNRI (serotonin norepinefrine reuptake inhibitor), dále gabapentin nebo pregabalin. Ze skupiny SSRI má nejvíce dat k dispozici paroxetin, ale možno je využít i dalších preparátů – citalopramu, escitalopramu nebo sertralinu. Paroxetin není vhodné použít u pacientek léčených tamoxifenem vzhledem k metabolizaci obou preparátů na cytochromu CYP2D6. Ze skupiny SNRI je k dispozici venlafaxin. Progestační látky byly testovány především na pacientkách s karcinomem prsu a podání obou látek – medroxyprogesteron acetátu nebo megestrol acetátu prokázalo benefit v řešení návalů horka. Vaginální atrofii lze řešit lokálním podáním lubrikačních gelů, popř. krátkodobou lokální aplikací estrogenů. Vzhledem k polymorfním symptomům je při jejich řešení vhodná multioborová spolupráce.
Klíčová slova:
karcinom prsu – postmenopauza – ovariální suprese – postmenopauzální osteoporóza – terapieÚvod
Terapie karcinomu prsu s sebou přináší množství vedlejších účinků. Nežádoucí účinky chemoterapie jsou většinou intenzivní, ale krátkodobé, na rozdíl od vedlejších účinků hormonální terapie, které přetrvávají dlouhodobě. U pacientek léčených chemoterapií může také dojít ke vzniku arteficiální menopauzy přechodné nebo trvalé. Menopauzální symptomy se projevují také u pacientek léčených hormonální léčbou, ať už při medikaci s tamoxifenem, nebo se mohou zvýraznit při terapii inhibitorem aromatáz. Součástí hormonální terapie je u premenopauzálních pacientek ovariální suprese (ovarian function suppression – OFS), kdy dochází taktéž ke vzniku menopauzy. Symptomy menopauzy se vyskytují u žen s karcinomem prsu až v 65–80 % pacientek. Klinickými symptomy menopauzy jsou nejčastěji vazomotorické symptomy (hot flashes, noční pocení), ale poměrně frekventní jsou i následující symptomy – projevy atrofické (vaginální suchost, pálení rodidel, dyspareunie), psychologické (změny nálad, podrážděnost, deprese), kognitivní (poruchy spánku, únava, potíže s koncentrací) a v neposlední řadě potíže somatické (palpitace, bolesti především kloubů) [1,2]. Nejefektivnější terapií menopauzálních symptomů je hormonální substituční léčba estrogeny, popř. kombinací estrogenů a gestagenů, která není bohužel u pacientek s anamnézou karcinomu prsu možná. Existují ale alternativy k hormonální substituční terapii (hormone replacement therapy – HRT). Menopauzální symptomy lze ovlivnit nefarmakologicky nebo pomocí farmakoterapie. Nefarmakologicky lze dosáhnout redukce symptomů, obzvláště návalů horka, několika způsoby – pomocí režimových opatření, akupunktury, hypnózy, jógy a relaxační terapie. Z farmakologických prostředků lze k ovlivnění hot flashes dle dat z literatury použít magnezium, vitamin E, klonidin, progestační látky, léky ze skupiny antidepresiv – SSRI (selektivní serotonin reuptake inhibitory) a SNRI (serotonin norepinefrine reuptake inhibitory), gabapentin a pregabalin.
Hot flashes
Hot flashes – návaly horka jsou nejčastějším projevem výpadové symptomatologie u žen vstupujících do přechodu. U žen s karcinomem prsu se vyskytují až v 65–80 %. Návaly horka jsou vnímány jako pocit intenzivního tepla spojený s pocením, zarudnutím a třesavkou. Pocení se projevuje především v oblasti obličeje, krku a hrudníku. Návaly horka trvají obvykle 1–5 min, zcela výjimečně i déle. V případě fyziologické menopauzy je medián trvání návalů horka kolem 4 let. Za příčinu je považován pokles estrogenů, nicméně přesná role estrogenů v mechanizmu vzniku návalů horka není jasná. Existuje hypotéza, která tvrdí, že ke vzniku návalů horka je nutné odstranění estrogenů a ne pouhý pokles hladin. Tuto teorii podporuje i vznik přirozené menopauzy, kdy je výskyt návalů horka nejvýraznější v úvodu menopauzy, ale obvykle netrvá po celé období existence menopauzy, kdy jsou hladiny cirkulujících estrogenů nízké [3]. Vazodilatace a pocení spojené s návaly horka jsou kontrolovány termoregulačním jádrem, které je lokalizováno do neoptické arey hypotalamu. Úkolem termoregulačního jádra je regulace tělesné teploty a udržení teploty v mezích termoregulační zóny. Návaly horka jsou vyvolány vzestupem tělesné teploty nebo snížením prahové hranice pocení [4]. Ženy, u kterých se hot flashes objevují, mají užší termoregulační zónu a tak malý vzestup tělesné teploty může vyvolat nával horka [5]. Norepinefrin a serotonin mohou být součástí komplexu endokrinologické cesty, která kontroluje termoregulační zónu. Nabízí se teorie, že zvýšená hladina norepinefrinu v mozku zúží termoregulační zónu. Aktivace specifických serotoninových receptorů může být příčinou hypo - nebo hypertermie [6]. Odstranění estrogenu je spojeno s poklesem hladiny serotoninu a s nárůstem serotoninových receptorů v mozku [7]. Měření návalů horka je subjektivní a posuzuje se při něm frekvence, závažnost, intenzita a interference s denními aktivitami. Využívá se několika testů, některé z nich jsou i validované – Hot Flash Composite Score (nejčastěji využíváno v uvedených klinických studiích), Weekly Hot Flash Severity Score, Greene Climacteric Scale (validovaný) a Patients Global Impression of Improvement (validovaný). Nejvíce dat zkoumajících menopauzální symptomy i v kontextu s ženami s karcinomem prsu je věnováno návalům horka, a proto je jim i v tomto článku věnována největší pozornost. Dalším důvodem je i jejich velmi častý výskyt. Největší pozornost je věnována lékovým skupinám, které jsou v praxi nejčastěji využívány.
Nefarmakologické metody
Režimová opatření
Vazomotorické symptomy lze ovlivnit také pomocí režimových opatření. Následující rady nejsou podloženy výsledky klinického výzkumu, ale v praxi alespoň v určitém procentu fungují. Vhodné je snažit se zjistit, co vyvolává návaly horka. Nejčastějšími příčinami jsou teplé nápoje, kořeněná jídla. Dále je vhodné omezit konzumaci kávy a alkoholických nápojů. Oblékat se ve více vrstvách, které mohou být postupně odstraněny. Spát v chladné místnosti, na bavlněném prostěradle a používat bavlněné nebo rychle schnoucí oblečení na spaní. Nosit s sebou přenosný větrák (např. vějíř) (tab. 1) [8].
Tab. 1. Alternativy k hormonální substituční terapii (HRT). 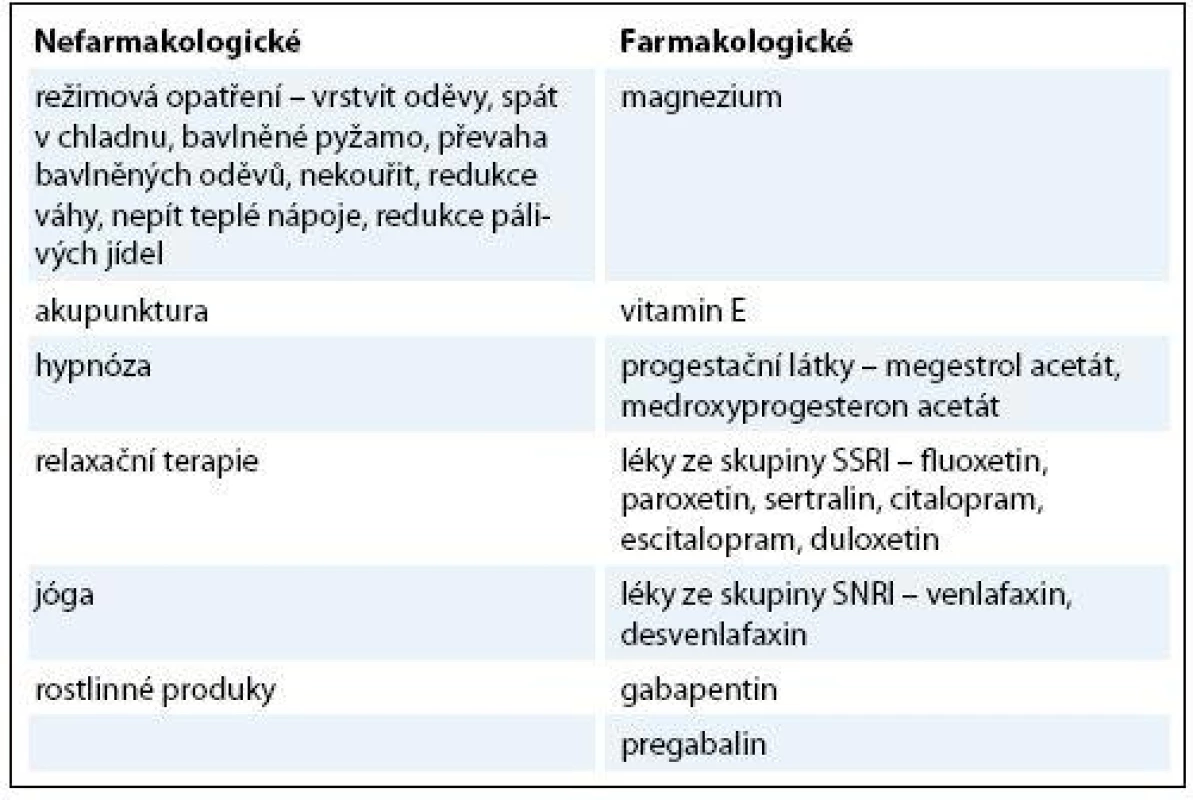
SSRI – selektivní serotonin reuptake inhibitory, SNRI – serotonin norepinefrine reuptake inhibitory Akupunktura
Několik klinických studií prokázalo vliv akupunktury u žen s karcinomem prsu na redukci návalů horka. Limitujícími faktory je malý počet účastníků ve studiích, který nepřesahuje 75 žen, a krátké sledování s max. dobou šest měsíců. V roce 2013 byl publikován přehled 41 klinických studií s akupunkturou, kde nemohl být benefit stanoven vzhledem k množství problémů ve studiích [9]. V systematickém přehledu 16 studií, kde byla srovnávána akupunktura s „falešnou“ akupunkturou, nebyl nalezen dostatek dat, která by podporovala použití akupunktury jako efektivní metody v terapii návalů horka [10]. Akupunktura byla stejně efektivní jako venlafaxin v redukci počtu a intenzity hot flashes [11].
Ostatní nefarmakologické metody zkoumající jógu, cvičení, relaxační terapii, redukci váhy a hypnózu prokazují určitý efekt v ovlivnění návalů horka, ale výzkumy jsou velmi omezené.
Farmakologické metody
Vitamin E
Používání vitaminu E je v běžné klinické praxi časté, ale doklady o efektu nejsou. Výsledkem randomizované klinické studie bylo dosažení redukce hot flashes o jeden den. Signifikantní efekt nebyl nalezen [12].
Magnezium
V roce 2011 byla publikována malá observační studie, která zkoumala efekt magnezia na hot flashes. Zařazeno bylo 25 pacientek s karcinomem prsu, které užívaly magnezium v dávce 400 mg denně po dobu čtyř týdnů, následně byla zvýšena na 800 mg v případě, že dávka 400 mg nebyla efektivní. Došlo k redukci hot flashes skóre o 25 % [13].
Progestační látky
Alternativu k substituční terapii estrogeny mohou poskytnout progestační látky – megestrol acetát (MA) a medroxyprogesteron acetát. Tyto látky lze právě s velkou výhodou využít u pacientek s anamnézou karcinomu prsu. Efektivita MA byla prokázána v randomizované, dvojitě zaslepené, placebem kontrolované klinické studii, která zahrnovala 97 žen s karcinomem prsu a 66 mužů s karcinomem prostaty léčených androgenní deprivací. U pacientů, kteří byli léčeni 40 mg MA, došlo k 85% redukci hot flashes ve srovnání s 21% redukcí pacientů léčených placebem [14]. Určité procento pacientů bylo léčeno MA po dobu až tří let a efektivita terapie byla monitorována průběžně po celou dobu [15]. Ve studii publikované v roce 2008 bylo léčeno 288 žen s karcinomem prsu, 85 % z nich užívalo tamoxifen. Randomizovány byly do tří ramen – placebo, MA v dávce 20 a 40 mg. Byl prokázán statisticky signifikantní rozdíl mezi placebem a rameny s MA. Byla prokázána stejná efektivita MA v dávce 20 mg ve srovnání s vyšším dávkováním [16]. Další látkou, která je efektivní v terapii vazomotorických symptomů, je medroxyprogesteron acetát (MPA), u kterého byl prokázán efekt v obou formách – perorální i intramuskulární. V 70. a 80. letech 20. století byly publikovány výsledky klinických studií, které prokazovaly benefit depomedroxyprogesteron acetátu (DMPA) v redukci hot flashes. V roce 2002 byly k dispozici výsledky randomizované klinické studie srovnávající MA s DMPA u postmenopauzálních pacientek s historií karcinomu prsu. V obou ramenech byl prokázán srovnatelný efekt – redukce hot flashes o 86 % [17].
SNRI – serotonin norepinefrine reuptake inhibitory
Venlafaxin
Venlafaxin je preparát, který je relativně často využíván v terapii hot flashes. Jeho efektivita byla prokázána ve více studiích [18]. Při výzkumu možné efektivity venlafaxinu v terapii návalů horka probíhaly studie srovnávající venlafaxin s placebem, klonidinem, akupunkturou a gabapentinem. Boekhout srovnával v trojramenné studii venlafaxin s placebem a klonidinem. U čtyř z pěti klinických studií s venlafaxinem byly navýšeny dávky z původních 37,5 na 75 mg. Při této dávce došlo ke zlepšení tolerance, redukci vedlejších účinků a zlepšení kompliance. Medián věku byl mezi 50 a 56 roky a sledování probíhalo od 4 do 52 týdnů [19–21]. U tří klinických studií byl proveden crossover. Pacientky ve všech studiích byly ženy, které byly léčeny radioterapií, chemoterapií nebo hormonální léčbou. Efektivita jednotlivých preparátů byla posuzována podle hot flash skóre v úvodu a v závěru studiové terapie v experimentálním a kontrolním rameni – jako standardizovaný průměr rozdílu (standardized mean difference – SMD) na základě stanoveného výpočtu. Při srovnávání efektivity jednotlivých látek byl v metaanalýze efektivnější klonidin vs. venlafaxin (SMD –0,49), stejně tak větší efekt klonidinu byl prokázán i ve studii Buijse (SMD –0,11). U akupunktury byl prokázán nižší efekt ve srovnání s venlafaxinem (SMD 1,83). Stejně tak nižší efekt byl prokázán i ve studii, která srovnávala venlafaxin s gabapentinem (SMD 0,89). V uváděné metaanalýze šesti randomizovaných klinických studií s 525 pacientkami byl prokázán efekt venlafaxinu při srovnání s placebem nebo jinou nehormonální léčbou.
Venlafaxin v dávce 75 mg je efektivní v terapii pacientek s karcinomem prsu a lze ho k ovlivnění hot flashes zvažovat. Efekt byl prokázán ve studiích srovnávajících venlafaxin s placebem. U akupunktury byl prokázán srovnatelný efekt v redukci intenzity a frekvence výskytu hot flashes. Nicméně akupunktura není široce dostupnou metodou, kterou lze běžně pacientkám nabízet. Při výběru preparátu je vždy nutno zvažovat také jeho vedlejší účinky. Nejčastěji se vyskytující možné nežádoucí účinky venlafaxinu jsou nevolnost, deprese, sexuální dysfunkce, obstipace, pokles apetitu a suchost dutiny ústní. Venlafaxin je slabý inhibitor cytochromu CYP2D6, a proto ho lze s výhodou nabízet pacientkám užívajícím tamoxifen (tab. 2).
Tab. 2. Srovnání efektivity a dávky venlafaxinu. 
Desvenlafaxin
Největším aktivním metabolitem venlafaxinu je desvenlafaxin, a proto byl také součástí klinických studií zkoumajících redukci výskytu frekvence a intenzity hot flashes. Doposud byly publikovány výsledky čtyř klinických studií. Dávka desvenlafaxinu byla od 50 do 200 mg/den, počty pacientek ve studiích od 458 do 707, léčba probíhala ve všech studiích 12 týdnů. Zařazovací kritéria pro všechny čtyři studie byla podobná – jednalo se o postmenopauzální zdravé ženy s BMI pod 40 kg/m2 (pouze ve studii Boucharda et al byl BMI pod 34 kg/m2). Podmínkou byl střední až závažný výskyt hot flashes (sedm návalů na den nebo 50 za týden). Pacientky s karcinomem prsu nejsou v těchto studiích zmiňovány. Primárním cílem všech čtyř klinických studií byla změna v denním výskytu frekvencí hot flashes a změna v jejich závažnosti. V obou studiích Archera et al byl prokázán benefit desvenlafaxinu v dávce 100 a 150 mg na den ve srovnání s placebem v redukci počtu středně závažných nebo závažných návalů ve 4. a ve 12. týdnu. Došlo k redukci frekvence návalů horka o 60–66 %. I ve studii Speroffa et al došlo k redukci frekvence hot flashes v rameni s desvenlafaxinem o 60–64 %. Pouze ve studii Boucharda et al nebyl prokázán benefit podávání desvenlafaxinu ve srovnání s placebem. Z nejčastěji se vyskytujících vedlejších účinků byla uváděna nevolnost. Faktorem, který ovlivnil výskyt nevolnosti, byla titrace dávky, která byla uváděna u jedné ze studií Archera – od 50 do 150 mg během jednoho týdne [22–25].
Duloxetin
Duloxetin je posledním ze skupiny SNRI, který byl zkoumán v terapii návalů horka. Data jsou v současné době stále limitovaná a k dispozici je zatím výsledek pouze jedné studie o 20 pacientkách. Primárním cílem bylo ovlivnění deprese, teprve až sekundárním cílem bylo ovlivnění hot flashes. V úvodu byly pacientky dva týdny léčeny placebem a ty, u kterých nebyl prokázán efekt placeba, pokračovaly v terapii duloxetinem osm týdnů. Duloxetin prokázal benefit nejenom v ovlivnění depresí, ale signifikantně došlo i ke zlepšení hot flashes a spánku [26].
SSRI – selektivní serotonin reuptake inhibitory
Látky, u kterých byl zkoumán efekt na hot flashes, jsou paroxetin, fluoxetin, sertralin, citalopram a escitalopram. Volba léků ze skupiny SSRI pro terapii hot flashes byla podpořena úlohou serotoninu a norepinefrinu v termoregulaci. Ačkoliv přesný mechanizmus efektivity těchto látek není znám, u mnohých z nich byl prokázán efekt v redukci hot flashes a výskytu nočního pocení.
Paroxetin
Efekt paroxetinu na hot flashes byl zkoumán v šesti kontrolovaných klinických studiích a ve dvou otevřených studiích. Byl používán paroxetin v dávkách 7,5–25 mg po dobu 4–24 týdnů s cílem zjištění redukce frekvence a intenzity hot flashes. Zařazovány byly postmenopauzální pacientky s výskytem více než sedmi středních nebo závažných hot flashes za týden. Středně závažné návaly byly definovány jako pocit horka a zpocení, ale se schopností dále pokračovat v aktivitě, nebo jako závažné hot flashes se zpocením, kdy pacientky nebyly schopny pokračovat v aktivitě. Proběhly dvě randomizované, dvojitě zaslepené, placebem kontrolované studie o počtu 534 a 614 pacientek, které byly léčeny paroxetinem v dávce 7,5 mg denně vs. placebo po dobu 12 a 24 týdnů. V obou studiích byla prokázána efektivita v redukci hot flashes po 4 i 12 týdnech terapie. Intenzita hot flashes byla redukována v obou studiích po 4 týdnech terapie, ale pouze u jedné po 12 týdnech ve srovnání s placebem [27]. V dalších dvou klinických studiích byl zkoumán efekt paroxetinu v dávkách 12,5–25 mg podávaných šest týdnů ve srovnání s placebem. V obou studiích i přes rozdílné dávkování byl prokázán benefit paroxetinu ve srovnání s placebem v počtu hot flashes/týden, ve skupině léčené dávkou 25 mg na den byl efekt terapie větší. V dalších symptomech, které byly sledovány, např. nálada, nebyl nalezen rozdíl mezi skupinou léčenou paroxetinem a skupinou s placebem [28–29]. V následujících třech studiích byly zařazeny i pacientky s historií karcinomu prsu, které mohly být léčeny tamoxifenem. Dvě studie z nich byly pilotní studie z jednoho pracoviště, otevřené, pouze třetí z nich byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná. Ve všech těchto třech studiích byl paroxetin podáván v dávce 10 nebo 20 mg. Ve dvou nerandomizovaných studiích došlo k výrazné redukci výskytu hot flashes – o 67 % a k 69% redukci počtu návalů [30,31]. Třetí studií byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie se 151 pacientkami, kde byl srovnáván efekt paroxetinu v dávce 10 a 20 mg s placebem po dobu devíti týdnů. Až 68 % pacientek užívalo tamoxifen. Došlo k redukci počtu návalů v obou ramenech s paroxetinem a nebyl pozorován rozdíl mezi dávkou 10 a 20 mg [32]. Nejčastějšími nežádoucími účinky paroxetinu v uvedených studiích byly váhový přírůstek, obstipace, somnolence, nespavost, bolesti hlavy, pokles libida, nevolnost, event. zvracení. Paroxetin je metabolizován přes cytochrom P450 izoenzym 2D6, a proto může negativně ovlivnit antiestrogenní aktivitu tamoxifenu snížením konverze na aktivní metabolit endoxifen. Byl prokázán pokles hladiny endoxifenu až u 56 % žen s wild-type CYP2D6 alelou [33]. Paroxetin jako jediný ze skupiny SSRI získal FDA povolení pro terapii v indikaci středně těžkých a závažných hot flashes. Není vhodné ho podávat v kombinaci s tamoxifenem vzhledem k jeho silné inhibici cytochromu P450 CYP2D6 enzymu, který konvertuje tamoxifen na aktivní metabolit endoxifen.
Sertralin
Sertralin je dalším lékem ze skupiny SSRI, u kterého byla zkoumána aktivita v terapii hot flashes. Publikováno bylo pět klinických studií, ve kterých byl podáván sertralin v dávce 50 nebo 100 mg a jeho efekt byl srovnáván s placebem. Ve třech studiích byly zařazeny postmenopauzální pacientky, bez anamnézy karcinomu prsu. Počty pacientek byly nízké (33–97), sertralin byl srovnáván s placebem, ve dvou studiích v dávce 50 mg/den, ve třetí studii v dávce 100 mg/den. V jedné studii nebyl efekt sertralinu ve srovnání s placebem prokázán (dávka 100 mg/den) [34]. V dalších dvou byla prokázána redukce nejenom frekvence výskytu hot flashes, ale i redukce jejich intenzity [35–36]. Do dalších dvou studií byly zařazovány pacientky s anamnézou karcinomu prsu, které byly léčeny tamoxifenem. Obě studie byly randomizované, dvojitě zaslepené, placebem kontrolované; sertralin byl podáván ve studii Kimmicka et al v dávce 50 mg/den, ve studii Wu et al v titrovací dávce od 25 mg do maximální dávky 100 mg/den. Efekt byl také rozdílný. Ve studii vedené Wu et al nebyl prokázán benefit sertralinu ve srovnání s placebem. Ve studii vedené Kimmickem et al po šesti týdnech terapie došlo k poklesu frekvence hot flashes o 50 % v rameni se sertralinem a pouze o 27 % v rameni s placebem. V crossover analýze byl sertralin také signifikantně efektivnější ve srovnání s placebem. U žen, které přešly z placeba na sertralin, došlo k poklesu (–0,9 a –1,7) frekvencí hot flashes a skóre, zatímco u žen, které přešly ze sertralinu na placebo, došlo k nárůstu (1,5 a 3,4) jak frekvence, tak i intenzity návalů (p = 0,03 a 0,03) [37,38].
Fluoxetin
Ačkoli je fluoxetin nejstarší ze skupiny SSRI, dat, která by prokazovala benefit v ovlivnění hot flashes, není mnoho. V roce 2002 byla publikována randomizovaná, dvojitě zaslepená crossover studie zahrnující 81 pacientek. Tyto pacientky byly léčeny 20 mg fluoxetinu denně vs. placebo a po čtyřech týdnech došlo ke změně ramen. V první léčebné periodě došlo k 50% redukci hot flashes skóre ve skupině žen léčených fluoxetinem oproti 36% redukci ve skupině léčené placebem. Následující crossover prokázal větší redukci hot flashes skóre. Nebyl nalezen statisticky signifikantní rozdíl v toxicitě [39]. Další studie byla publikována v roce 2005. Jednalo se také o randomizovanou, placebem kontrolovanou studii srovnávající efekt fluoxetinu a citalopramu v terapii návalů. Léčeno bylo 150 žen, které byly randomizovány do tří léčebných ramen – fluoxetin, citalopram a placebo. Fluoxetin a citalopram byly podávány v úvodu v dávce 10 mg, následně po měsíci byla dávka zdvojnásobena a po šesti měsících byly léky podávány v dávce 30 mg denně. Nebyl nalezen statisticky signifikantní rozdíl mezi jednotlivými rameny. Autorům se jevilo problematické, že jako baseline byl zvolen první den terapie [40]. U fluoxetinu stejně jako u paroxetinu je problémem jeho silná inhibice cytochromu P450 CYP2D6, která může snižovat efektivitu terapie tamoxifenu.
Citalopram a escitalopram
Citalopram byl v terapii hot flashes poprvé testován v roce 2003 v pilotní studii, která zahrnovala 26 pacientek s karcinomem prsu. Po čtyřech týdnech medikace 10 mg denně byla dávka citalopramu zvýšena na 20 mg a došlo k redukci výskytu frekvence hot flashes o 58 % [41]. V jiné pilotní studii byla u 22 pacientek léčených čtyři týdny citalopramem prokázána redukce hot flashes skóre o 58 % [42]. Tato slibná data vedla k dalším výzkumům a v roce 2007 byly publikovány výsledky již randomizované, placebem kontrolované klinické studie. Sto žen bylo randomizováno do čtyř léčebných ramen – citalopram, placebo, kombinace citalopramu a HRT nebo placebo v kombinaci s HRT. Došlo k následující redukci průměru hot flashes skóre v jednotlivých ramenech: o 37, 13, 50 a 14 %. Byl prokázán benefit citalopramu, který může být zvýšen ještě při podání HRT. Pacientky s karcinomem prsu nebyly do studie zařazovány [43]. Jedna z větších randomizovaných, placebem kontrolovaných klinických studií fáze III se 254 pacientkami byla publikována v roce 2010. V této čtyřramenné studii byly srovnávány jednotlivé dávky citalopramu – 10, 20 a 30 mg a v jednom rameni bylo pacientkám podáváno placebo. V jednotlivých léčebných ramenech došlo k poklesu frekvence hot flashes o 46, 43, 50 a 20 %. Signifikantně došlo k redukci hot flashes v ramenech s citalopramem ve srovnání s placebem, ale nebyl nalezen rozdíl v léčebné odpovědi mezi jednotlivými dávkami citalopramu. Citalopram byl velmi dobře tolerován [44].
Escitalopram byl zkoumán ve dvou klinických studiích publikovaných v roce 2011. V první z nich bylo léčeno 205 menopauzálních žen, pacientky léčené hormonální terapií vč. tamoxifenu a inhibitorů aromatáz byly vyloučeny. Byly léčeny osm týdnů dávkou 10 mg denně a pouze u těch, u kterých nedošlo po čtyřech týdnech k 50% redukci frekvence hot flashes, popř. tam, kde nedošlo k poklesu jejich intenzity, byla dávka zvýšena na 20 mg [45]. Druhá studie publikovaná Freedmanem et al zahrnovala pouze 42 pacientek léčených escitalopramem, z nich bylo 16 léčeno escitalopramem v dávce 10 mg a 26 žen bylo léčeno dávkou 20 mg denně. V této studii nebyl prokázán benefit escitalopramu v terapii hot flashes [46].
Gabapentin
Efektivita gabapentinu v terapii hot flashes byla studována v několika klinických studiích. Gabapentin je strukturální analog kyseliny gama-aminobutyrové, která je neurotransmiterem. Původně byl podáván pouze v terapii epilepsie, ale postupně byly jeho indikace rozšířeny na terapii diabetické neuropatie, profylaxe migrén, esenciální tremor a v neposlední řadě k ovlivnění spánku. Pilotní studie s 20 pacientkami, které byly léčeny gabapentinem čtyři týdny v rostoucí dávce od 300 do 900 mg, byla publikována v roce 2002. U pacientek, které užívaly gabapentin, byla zaznamenána redukce frekvence hot flashes o 66 % [47]. Od tohoto okamžiku několik klinických randomizovaných studií prokázalo benefit gabapentinu v terapii hot flashes. První klinická randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie zahrnovala 59 postmenopauzálních žen, které byly léčeny gabapentinem v denní dávce 900 mg nebo placebem. Po 12 týdnech terapie došlo ve skupině žen léčených gabapentinem k redukci frekvence návalů horka o 45 % ve srovnání s 29% redukcí u žen léčených placebem. Po 12 týdnech terapie ve fázi otevřené studie došlo k navýšení dávky na 2 700 mg gabapentinu na den. Tato vyšší dávka byla spojena s 54% redukcí frekvence návalů horka a nebyl zaznamenán vyšší výskyt vedlejších účinků [48]. V jiné velké randomizované, dvojitě zaslepené, placebem kontrolované studii bylo 420 pacientek s karcinomem prsu randomizováno do tří léčebných ramen – placebo, gabapentin v dávce 300 nebo 900 mg denně. Po čtyřech týdnech terapie došlo k poklesu intenzity hot flashes skóre o 21, 33 a 49 %. Gabapentin v dávce 900 mg prokázal větší efekt ve srovnání s dávkou 300 mg denně [49]. V další randomizované klinické studii byla srovnávána efektivita gabapentinu s estrogenem a placebem. Šedesát pacientek bylo randomizováno do tří ramen – placebo, konjugovaný estrogen a gabapentin v dávce 2 400 mg/den. Po 12 týdnech terapie došlo k redukci hot flashes skóre o 72 % ve skupině pacientek léčených estrogenem, o 71 % u žen léčených gabapentinem a u 54 % žen léčených placebem. V současné době zůstává doporučovanou dávkou pro terapii hot flashes gabapentin v dávce 900 mg/den [50]. Další z velkých randomizovaných, dvojitě zaslepených klinických studií byla publikována Buttem et al v roce 2008. Celkem 197 pacientek bylo randomizováno do ramen s gabapentinem v dávce 900 mg/den vs. placebo. Po čtyřech týdnech terapie došlo ke statisticky signifikantní redukci hot flashes skóre o 51 % ve skupině pacientek léčených gabapentinem ve srovnání s 26% redukcí ve skupině s placebem [51]. Pouze ve třech uvedených studiích byly léčeny pacientky s karcinomem prsu. V metaanalýze týkající se efektu gabapentinu v indikaci hot flashes byl prokázán benefit redukce o 20–30 % v obou parametrech – ve frekvenci výskytu návalů horka a také v hot flashes skóre. Problematická je heterogenita uváděných klinických studií a nelze také opominout výskyt nežádoucích účinků, z nich především závratě, nejistotu při chůzi, somnolenci a únavu.
Pregabalin
Pregabalin je novou generací léků s mechanizmem účinku podobným gabapentinu. Odtud hypotéza, že by mohl být, stejně jako gabapentin, účinný v terapii návalů horka. Data týkající se pregabalinu jsou limitovaná. Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie byla publikována v roce 2010. Zařazeno bylo 163 pacientek a ty byly randomizovány do tří ramen – pregabalin v denní dávce 75 mg, 150 mg a placebo. Po šesti týdnech terapie došlo k poklesu hot flashes skóre o 65, 71 a 50 %. Toxicita – především váhový přírůstek, ospalost, závratě – provázely především vyšší léčebnou dávku [52].
Vaginální atrofie
Vaginální suchost, vulvovaginální iritace – svědění a dyspareunie se vyskytují u 10–40 % postmenopauzálních žen a nejméně 25 % z nich potřebuje lékařskou péči. Na rozdíl od vazomotorických symptomů se vaginální atrofie postupem času zhoršuje a není pravděpodobné, že by došlo ke spontánní úpravě. Inflamace vaginálního epitelu může přispět ke vzniku urinárních symptomů, jako jsou urgence, vzestup frekvence močení, dysurie, inkontinence a recidivující močové infekce. Dále změny vaginálního pH a vaginální flóry mohou predisponovat postmenopauzální ženy ke vzniku močových infekcí a ke vzniku mykóz [53]. V terapii jsou popisovány jako efektivní následující metody – pravidelná sexuální aktivita (zvyšuje prokrvení pánevních orgánů), použití lubrikantů, zvlhčujících prostředků aplikovaných do vaginy a lokálně podávaných estrogenů. Jako lubrikantů zlepšujících vaginální suchost lze využít lokálně nebo systémově i vitamin E v denní dávce 100–600 IU. Také u vitaminu D a jeho analog je popisován efekt na růst a diferenciaci skvamózního epitelu vaginy a tím jejich příznivý vliv na vaginální atrofii [54]. Při výskytu vaginální bolesti lze lokálně aplikovat lidokain. U lokálních estrogenů je potřeba opatrnosti především u pacientek s karcinomem prsu, které používají inhibitory aromatáz. Publikovány byly výsledky malé studie se sedmi pacientkami, kterým byl podáván Vagifem (vaginální tablety estradiolu) a došlo ke zvýšení sérové hladiny estradiolu > 19 pmol/l oproti bazální hladině estradiolu postmenopauzálních žen [55]. Proto není vhodné jejich použití právě u pacientek léčených inhibitory aromatáz. U žen léčených tamoxifenem by mírně vyšší hladina estrogenu při známém mechanizmu účinku tamoxifenu neměla být problém.
Sexuální dysfunkce
Onkologická terapie, zejména hormonální léčba, velmi často negativně ovlivňuje sexuální funkce. K sexuálním problémům mohou dále přispívat i deprese a obavy onkologických nemocných. Sexuální dysfunkce může zhoršovat úzkost a tím signifikantně negativně ovlivnit kvalitu života žen s karcinomem prsu [56–57]. U těchto pacientek je nutno provést screening pro přítomnost možných symptomů a psychosociálních problémů – úzkost, deprese, partnerské vztahy, užívání alkoholu. Dále je potřeba cíleně pátrat po medikaci, která může potencovat sexuální dysfunkci, jako jsou SSRI a SNRI. Nelze opominout i další tradiční rizikové faktory sexuální dysfunkce jako kardiovaskulární onemocnění, diabetes mellitus, obezitu, kouření a konzumaci alkoholu. K detekci a stanovení intenzity potíží lze využít především Female sexual function index (FSFI), který je validován přímo pro pacientky s nádorovým onemocněním [58]. Vzhledem k multifaktoriální příčině sexuální dysfunkce vyžaduje i terapie multidimenzionální přístup, kdy je vhodné pokusit se ovlivnit všechny příčiny, které k sexuální dysfunkci vedou. Při řešení sexuální dysfunkce je vhodné využít spolupráce gynekologa, sexuologa a psychologa.
Poruchy spánku
Dalším častým symptomem spojeným s poklesem hladiny estrogenů je porucha spánku. Ženy v menopauze spí méně, častěji trpí nespavostí. Poruchy spánku mohou být ovlivněny i dalšími symptomy – především stresem, depresí, chronickou bolestí, nočním močením, negativní náladou. Rozhodnutí o tom, zda a jak léčit, závisí na závažnosti poruchy spánku, na dalších faktorech, které negativně spánek ovlivňují a na následujících denních aktivitách. Terapii poruch spánku je proto potřeba řešit komplexně, v případě izolované insomnie hypnotiky. Poruchy spánku jsou často spojeny s výskytem hot flashes a nočního pocení. Z nefarmakologických prostředků byly zkoumány akupunktura, kognitivní behaviorální terapie a chladicí polštáře. Akupunktura byla zkoumána v malé randomizované klinické studii, kde její použití signifikantně redukovalo výskyt návalů horka a poruchy spánku [59]. V další studii s akupunkturou byl prokázán ekvivalentní efekt s venlafaxinem – kromě redukce hot flashes došlo i ke zlepšení dalších symptomů, ale není zřejmé, zda k nim patřila i porucha spánku [60]. Využití kognitivní behaviorální terapie bylo popsáno ve studiích Carpentera a Huntera, kde byl kromě hot flashes zkoumán i vliv na poruchy spánku. V obou těchto studiích byl prokázán benefit použití této metody [61–62]. Nezvyklým prostředkem k ovlivnění poruch spánku v souvislosti s výskytem návalů horka jsou chladicí polštáře. Letos byly publikovány výsledky randomizované klinické studie, která prokázala benefit jejich použití v terapii nejenom poruch spánku, ale i v ovlivnění hot flashes [63]. Přestože jsou poruchy spánku uváděny jako jeden z vedlejších účinků terapie escitalopramem, je uváděno také jeho pozitivní ovlivnění spánku. V několika klinických studiích, které primárně řešily hot flashes, byla systematicky shromažďována i data týkající se efektu ovlivnění spánku – v jedné byl nalezen benefit [64], ve studii s paroxetinem byl popsán smíšený efekt [32] a v jiné studii s paroxetinem efekt nalezen nebyl [65]. Ve studii s escitalopramem, která byla publikována v roce 2012, byl prokázán benefit podávání escitalopramu nejenom v ovlivnění hot flashes, ale také v ovlivnění poruchy spánku. Nejčastěji byly k monitoraci efektu využívány následující dotazníky: Insomnia Severity Index (ISI) a Pittsburg Sleep Quality Index (PSQI), který posuzuje subjektivní kvalitu spánku [66].
Kognitivní funkce
Změny kognitivních funkcí – především zhoršení paměti a koncentrace – jsou stále často uváděny v souvislosti s postmenopauzálními symptomy. Ale v současnosti se předpokládá, že spíše souvisejí s procesem stárnutí, poruchami nálady, popř. se stresem. Ve studii ZIPP, jejíž součástí bylo samohodnocení paměti a koncentrace, nebyl nalezen zásadní rozdíl u pacientek, které byly léčeny chemoterapií s nebo bez podání goserelinu, kombinací goserelin a tamoxifen nebo samotným tamoxifenem [67]. Stejně tak i data ze studie SOFT zkoumající kognitivní funkce neprokázala zhoršení u žen léčených kombinací tamoxifen a OFS vs. monoterapie tamoxifenem [68].
Změny nálady
Dalším z postmenopauzálních symptomů, které se objevují často, jsou změny nálady – pocity rozčilení, ztráta kontroly, podráždění, únava a dysforie. Může se objevit i deprese, na které se spolupodílí především následující faktory – stresové situace, sexuální dysfunkce, fyzická inaktivita, výskyt vazomotorických symptomů. Nejvýraznějším faktorem pro vznik deprese v souvislosti s poklesem hladiny estrogenů je výskyt klinické deprese v anamnéze. Ve studii SOFT nebyl nalezen statisticky signifikantní rozdíl ve skupině žen s ovariální ablací léčených kombinací tamoxifenu a ve skupině žen léčených pouze tamoxifenem. Depresivní symptomy byly popisovány u 51,9 a u 46,6 % pacientek. U terapie s inhibitory aromatáz nebyl popsán vyšší výskyt depresí ve srovnání s tamoxifenem [69]. V terapii je vhodné využít relaxace, technik redukujících stres, antidepresiv, psychoterapie. Zásadní je včasná konzultace psychiatra.
Kostní denzita
Osteoporóza je prokazatelně spojena s menopauzálním statutem. Ženy v menopauze ztrácejí zhruba 2 % kostní hmoty. Pokles hladin estrogenů se podílí na poklesu kostní hmoty v 5–7 letech menopauzy až ze dvou třetin. U premenopauzálních pacientek, které se stanou v důsledku onkologické terapie postmenopauzální, je popisována ztráta kostní hmoty až 7,7 %. Tamoxifen zvyšuje kostní denzitu u postmenopauzálních pacientek, u premenopauzálních žen působí ztrátu kostní hmoty. Je to dáno jeho smíšeným agonisto/antagonistickým efektem na estrogenní receptor. Nedávná studie u pacientek, které byly v době diagnózy premenopauzální a neměly prokázanou osteoporózu, odhalila 12% riziko fraktury při mediánu sledování 3,1 roku za 5–6 let po ukončení onkologické terapie. U postmenopauzálních žen bylo riziko fraktury až 15 %. U premenopauzálních pacientek vznikaly častěji fraktury prstů, u postmenopauzálních žen byly častější fraktury krčku femuru [70]. Ve společné analýze studií TEXT a SOFT byl popisován výskyt osteoporózy grade 3–4 0,4 % a 0,3 % a fraktur grade 3–4 1,3 % a 0,8 % v rameni exemestan s OFS vs. tamoxifen s OFS [69]. U pacientek léčených pro karcinom prsu je také prokázán vyšší výskyt fraktur, ačkoliv se na vzniku fraktur budou podílet i jiné příčiny, jako jsou věk, terapie kortikoidy delší než tři měsíce, výskyt fraktury krčku femuru v anamnéze, nízký BMI, konzumace alkoholu, kouření a sekundární příčiny osteoporózy. V publikovaných studiích při použití bisfosfonátů při terapii pacientek s karcinomem prsu byla prokázána redukce poklesu kostní denzity, ale nebyla prokázána redukce vzniku fraktur. Součástí onkologické terapie by měla být edukace pacientek o režimových opatřeních, která prokazatelně snižují výskyt fraktur – správná strava s obsahem mléčných výrobků, pravidelná fyzická aktivita, prevence pádů, redukce konzumace alkoholu a zákaz kouření. Efektivita režimových opatření s cílem redukce výskytu fraktur je větší ve srovnání s podáváním bisfosfonátů.
Kardiovaskulární toxicita
Kardiovaskulární toxicita se u mladých pacientek vyskytuje vzácně, ale je potřeba na ni myslet a cíleně po ní pátrat. Hypertenze se vyskytla u pacientek ve studii SOFT ve 23,3 % ve skupině léčené kombinací tamoxifen s OFS a u 17,2 % žen léčených pouze tamoxifenem [70]. Ve společné analýze studií SOFT a TEXT při srovnání kombinačních ramen exemestan s OFS a tamoxifen s OFS byl výskyt hypertenze grade 3–4 srovnatelný – 6,5 vs. 7,3 % [69]. Trombóza nebo plicní embolie se objevily u 2,2 % pacientek léčených kombinací tamoxifen a OFS a u 1 % žen, které byly léčeny kombinací exemestan a OFS [69].
Závěr
Ženám s vazomotorickými symptomy lze nabídnout alternativu k hormonální substituční terapii. U pacientek s karcinomem prsu se vazomotorické symptomy projevují v 65–80 %. Příčinou je nejenom fyziologicky vzniklá menopauza, ale často menopauza vzniklá předčasně v důsledku podání chemoterapie. Postmenopauzální vazomotorické projevy mohou být často potencovány hormonální terapií – tamoxifenem nebo inhibitory aromatáz. Vhodné je použít kromě farmakologických látek i nefarmakologická, především režimová opatření. Z farmakologických látek lze pacientkám doporučit především léky ze skupiny SSRI, SNRI a gabapentin. Jediným lékem ze skupiny SSRI, který má schválení FDA na indikaci vazomotorických symptomů, je paroxetin. U pacientek léčených tamoxifenem je ale nezbytné si uvědomit, že léky ze skupiny SSRI a SNRI jsou inhibitory CYP2D6 a mohou ovlivnit metabolizmus tamoxifenu. Proto se nedoporučuje kombinovat tamoxifen s fluoxetinem a paroxetinem, ale používat slabé inhibitory CYP2D6, kterými jsou venlafaxin, sertralin, citalopram a escitalopram. U pacientek léčených tamoxifenem je proto výhodné ze skupiny SSRI dávat přednost sertralinu, citalopramu nebo escitalopramu. Při použití venlafaxinu je vhodné zvolit dávku max. 75 mg, která prokazuje vyšší efekt ve srovnání s 37,5 mg. Není vhodné použít dávku vyšší, neboť její efektivita v redukci hot flashes byla srovnatelná s dávkou 75 mg, ale byl signifikantně vyšší výskyt nežádoucích účinků. Další možnou alternativou je gabapentin, u kterého bylo taktéž prokázáno signifikantní ovlivnění návalů horka. Nejvhodnější je při srovnání benefit vs. nežádoucí účinky dávka 900 mg denně. Využít lze ještě progestačních látek, kde byl také prokázán efekt v ovlivnění návalů horka. Tyto látky ale není výhodné kombinovat s tamoxifenem vzhledem k možné kumulaci jednoho z vedlejších účinků – rizika tromboembolické nemoci. Kterou látku z výše uvedených zvolit? Při výběru je výhodou zvažovat i základní indikace jednotlivých preparátů. Zásadní je cíleně po přítomnosti vazomotorických i jiných symptomů menopauzy pátrat a následně je aktivně řešit, neboť častý výskyt návalů horka může narušit nejenom denní aktivity pacientek, ale může vést při poruše spánku k narůstající únavě a podrážděnosti.
Práce byla podpořena grantem MZ ČR – RVO (MOÚ, 00209805).
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Markéta Palácová
Klinika komplexní onkologické péče Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: palacova@mou.cz
Obdrženo: 20. 7. 2016
Přijato: 10. 8. 2016
Zdroje
1. Elavsky S, McAuley E. Physical activity, symptoms, esteem, and life satisfaction during menopause. Maturitius 2005; 52 (3–4): 374–385.
2. Santoro N. Symptoms of menopause: hot flashes. Clin Obstet Gynecol 2008; 51 (3): 539–548. doi: 10.1097/GRF. 0b013e31818093f6.
3. Sturdee DW. The menopausal hot flash – anything new? Maturitas 2008; 60 (1): 42–49. doi: 10.1016/j.maturitas.2008.02.006.
4. Freedman RR. Physiology of hot flashes. Am J Hum Biol 2001; 13 (4): 453–464.
5. Freedman RR, Krell W. Reduced thermoregulatory null zone in postmenopausal women with hot flashes. Am J Obstet Gynecol 1999; 181 (1): 66–70.
6. Berendsen HH. The role of serotonin in hot flashes. Maturitas 2000; 36 (3): 155–164.
7. Shanafelt TD, Barton DL, Adjei AA et al. Pathophysiology and treatment of hot flashes. Mayo Clin Proc 2002; 77 (11): 1207–1218.
8. Kaplan M, Mahon S. Hot flashes management: update of the evidence for patients with cancer. Clin J Oncol Nurs 2014; 18 (6): 59–67. doi: 10.1188/14.CJON.S3.59-67.
9. Garcia MK, McQuade J, Haddad R et al. Systematic review of acupuncture in cancer care: a synthesis of the evidence. J Clin Oncol 2013; 31 (7): 952–960. doi: 10.1200/JCO.2012.43.5818.
10. Dodin S, Blanchet C, Marc I et al. Acupuncture for menopausal hot flashes. Cochrane Database Syst Rev 2013; 7: CD007410. doi: 10.1002/14651858.CD007410.pub2.
11. Walker EM, Rodriguez AI, Kohn B et al. Acupuncture versus venlafaxine for the management of vasomotor symptoms in patients with hormone receptor-positive breast cancer: a randomized controlled trial. J Clin Oncol 2010; 28 (4): 634–664. doi: 10.1200/JCO.2009.23.5150.
12. Barton DL, Loprinzi CL, Quella SK et al. J Clin Oncol 1998; 16 (2): 495–500.
13. Park H, Parker GL, Boardman CH et al. A pilot phase II trial of magnesium supplements to reduce menopausal hot flashes in breast cancer patients. Support Care Cancer 2011; 19 (6): 859–863. doi: 10.1007/s00520-011-1099-7.
14. Loprinzi CL, Michalak JC, Quella SK et al. Megestrol acetate for the prevention of hot flashes. N Engl J Med 1994; 331 (6): 347–352.
15. Quella SK, Loprinzi CL, Sloan JA et al. Long term use of megestrol acetate by cancer survivors for the treatment of hot flashes. Cancer 1998; 82 (9): 1784–1788.
16. Goodwin JW, Green SJ, Moinpour CM et al. Phase III randomized placebo-controlled trial of two doses of megestrol acetate as treatment for menopausal symptoms in women with breast cancer: SWOG Study 9626. J Clin Oncol 2008; 26 (10): 1650–1656. doi: 10.1200/JCO.2006.10.6179.
17. Bertelli GB, Venturini M, Del Mastro M et al. Intramuscular depot medoxyprogesterone versus oral megestrol for the control of postmenopausal hot flashes in breast cancer patients: a randomized study. Ann Oncol 2002; 13 (6): 883–888.
18. Loprinzi CL, Kugler JW, Sloan JA et al. Venlafaxine in management of hot flashes in survivors of breast cancer: a randomised controlled trial. Lancet 2000; 356 (9247): 2059–2063.
19. Carpenter JS, Storniolo AM, Johns S et al. Randomized, double-blind, placebo controlled crossover trial sof venlafaxine for hot flashes after breast cancer. Oncologist 2007; 12 (1): 124–135.
20. Buijs C, Mom CH, Willemse PH et al. Venlafaxine versus clonidine for the treatment of hot flashes in breast cancer patients: a double-blind, randomized cross-over study. Breast Cancer Res Treat 2009; 115 (3): 573–580. doi: 10.1007/s10549-008-0138-7.
21. Bordeleau L, Pritchard KI, Loprinzi CL et al. Multicenter, randomized, cross-over clinical trial of venlafaxine versus gabapentin for the management of hot flashes in breast cancer survivors. J Clin Oncol 2010; 28 (35): 5147–5152. doi: 10.1200/JCO.2010.29.9230.
22. Speroff L, Gass M, Constantine G et al. Efficacy and tolerability of desvenlafaxin succinate treatment for menopausal vasomotor symptoms: a randomized controlled trial. Obstet Gynecol 2008; 111 (1): 77–87. doi: 10.1097/01.AOG.0000297371.89129.b3.
23. Archer DF, Dupont CM, Comstantine GD et al. Desvenlafaxine for the treatment of vasomotor symtpoms associated with menopause: a double-blind, randomized, placebo-controlled trial of efficacy and safety. Am J Obstet Gynecol 2009; 200 (3): 238. doi: 10.1016/j.ajog.2008.10. 057.
24. Archer DF, Seidman L, Constantine GD et al. A double-blind, randomly assigned, placebo-controlled study of desvenlafaxine efficacy and safety for the treatment of vasomotor symptoms associated with menopause. Am J Obstet Gynecol 2009; 200 (2): 172. doi: 10.1016/j.ajog.2008.09.877.
25. Bouchard P, Panay N, de Villiers TJ et al. Randomized placebo - and active-controlled study of desvenlafaxine for menopausal vasomotor symptoms. Climacteric 2012; 15 (1): 12–20. doi: 10.3109/13697137.2011.586445.
26. Freeman MP, Hirchsberg AM, Wang B et al. Duloxetin for major depressive disorders and daytime and nighttime hot flashes associated with me noapusal transition. Maturitas 2013; 75 (2): 170–174. doi: 10.1016/j.maturitas.2013.03.007.
27. Simon JA, Portman DJ, Kaunitz AM et al. Low-dose paroxetine 7,5 mg for menopausal vasomotor symptoms: two randomized controlled trials. Menopause 2013; 20 (10): 1027–1035. doi: 10.1097/GME.0b013e3182a66aa7.
28. Soares CB, Joffe H, Viguera AC et al. Paroxetine versus placebo for women in midlife after hormone discontinuation. Am J Med 2008; 121 (2): 159–162. doi: 10.1016/j.amjmed.2007.10.007.
29. Stearns V, Beebe KL, Iyengar M et al. Paroxetine controlled repase in the treatment of menopausal hot flashes: a randomized controlled trial. JAMA 2003; 289 (21): 2827–2834.
30. Stearns V, Isaacs C, Rowland J et al. A pilot trial assessing the efficacy of paroxetine hydrochloride in controlling hot flashes in breast cancer survivors. Ann Oncol 2000; 11 (1): 17–22.
31. Weitzner M, Moncello J, Jacobsen PB et al. A pilot trial of paroxetine for the treatment of hot flashes and associated symptoms in women with breast cancer. J Pain Symtpom Manage 2002; 23 (4): 337–345.
32. Stearns V, Slack R, Greep N et al. Paroxetine is an effective treatment for hot flashes: results from a prospective randomized clinical trial. J Clin Oncol 2005; 23 (28): 6919–6930.
33. Stearns V, Johnson MD, Rae JM et al. Active tamoxifen metabolite plasma concentrations after coadministration of tamoxifen and the selective serotonin reuptake inhibitor paroxetine. J Natl Cancer Inst 2003; 95 (23): 1758–1764.
34. Grady D, Cohen B, Tice J et al. Ineffectiveness of sertraline for treatment of menopausal hot flashes: a randomized controlled trial. Obstet Gynecol 2007; 109 (4): 823–830.
35. Gordon PR, Kerwin JP, Boesen KG et al. Sertraline to treat hot flashes: a randomized controlled, double blind, crossover trial in a general population. Menopause 2006; 13 (4): 568–575.
36. Aedo S, Cavada G, Campodonico I et al. Sertraline improves static and psychological symptoms of the climacteric syndrome. Climacteric 2011; 14 (5): 590–595. doi: 10.3109/13697137.2011.568645.
37. Kimmick GG, Lovato J, McQuellon R et al. Randomized, double-blind, placebo-controlled, crossover study of sertraline for the treatment of hot flashes in women with early stage breast cancer taking tamoxifen. Breast J 2006; 12 (2): 114–122.
38. Wu MF, Hilsenbeck SG, Tham YL et al. The efficacy of sertraline for controlling hot flashes in women with or at high risk of developing breast cancer. Breast Cancer Res Treat 2009; 118 (2): 369–375.
39. Loprinzi CL, Sloan JA, Perez EA et al. Phase III evaluation of fluoxetine for treatment of hot flashes. J Clin Oncol 2002; 20 (6): 1578–1583.
40. Suvanto-Luukkonen E, Koivunen R, Sundström H et al. Citalopram and fluoxetine in the treatment of postmenopausal symptoms: a prospective, randomized, 9-month, placebo-controlled, double-blind study. Menopause 2005; 12 (1): 18–26.
41. Barton DL, Atherton PJ, Bauer BA et al. Pilot evaluation of citalopram for the reliéf of hot flashes. J Support Oncol 2003; 1 (1): 37–51.
42. Loprinzi CL, Flynn PJ, Carpenter LA et al. Pilot evaluation of citalopram for the treatment of hot flashes in women with inadequate benefit from venlafaxine. J Palliat Med 2005; 8 (5): 924–930.
43. Kalay AE, Demir B, Haberal A et al. Efficacy of citalopram on climacteric symptoms. Menopause 2007; 14 (2): 223–229.
44. Barton DL, LaVasseur BI, Sloan JA et al. Phase III, placebo-controlled trial o free doses of citalopram for the treatment of hot flashes: NCCTG trial N05C9. J Clin Oncol 2008; 26 (20): 953.
45. Freeman EW, Guthrie KA, Caan B et al. Efficacy of escitalopram for hot flashes in healthy menopausal women: a randomized controlled trial. JAMA 2011; 305 (3): 267–274. doi: 10.1001/jama.2010.2016.
46. Freedman RR, Kruger ML, Tancer ME et al. Escitalopram treatment of menopausal hot flashes. Menopausa 2011; 18 (8): 893–896. doi: 10.1097/gme.0b013e31820ccae9.
47. Loprinzi CL. Pilot evaluation of gabapentin for treating hot flashes. Mayo Clin Proc 2002; 77 (11): 1159–1163.
48. Guttuso T Jr, Kurlan R, McDermott MP et al. Gabapentin’s effect on hot flashes in postmenoapusal women: a randomized controlled trial. Obstet Gynecol 2003; 101 (2): 337–345.
49. Pandya KJ, Morrow GR, Roscoe JA et al. Gabapentin for hot flashes in 420 women with breast cancer: a randomized double-blind placebo-controlled trial. Lancet 2005; 366 (9488): 818–824.
50. Reddy SY, Warner Hm, Guttuso T Jr et al. Gabapentin, estrogen and placebo for treating hot flashes: a randomized controlled trial. Obstet Gynecol 2006; 108 (1): 41–48.
51. Butt DA, Lock M, Lewis JE et al. Gabapentin for the treatment of menopausal hot falshes: a randomized controlled trial. Menopause 2008; 15 (2): 310–318.
52. Loprinzi CL, Qin R, Balcueva EP et al. Phase III, randomized, double-blind, placebo-controlled evaluation of pregabalin for alleviating hot flashes, N07C1. J Clin Oncol 2010; 28 (4): 641–647. doi: 10.1200/JCO.2009.24.5647.
53. Castelo-Branco C, Cancelo MJ, Villero J et al. Management of post-menopausal vaginal atrophy and atrophic vaginitis. Matutitas 2005; 52 (Suppl 1): S46–S52.
54. Derzko C, Elliott S, Lam W. Management of sexual dysfunction in postmenopausal breast cancer pacients taking adjuvant aromatase inhibitor therapy. Curr Oncol 2007; 14 (Suppl 1): S20–S40.
55. Kendall A, Dowsett M, Folkerd E et al. Caution: vaginal estradiol appears to be contraindicated in postmenopausal women on adjuvant aromatase inhibitors. Ann Oncol 2006; 17 (4): 584–587.
56. Gilbert E, Ussher JM, Perz J. Sexuality after breast cancer: a review. Maturitas 2010; 66 (4): 397–407. doi: 10.1016/j.maturitas.2010.03.027.
57. Ganz PA, Desmond KA, Belin TR et al. Predcitors of sexual health in women after a breast cancer diagnosis. J Clin Oncol 1999; 17 (8): 2371–2380.
58. Rosen R, Brown C, Heiman J et al. The female sexual function index (FSFI): a multidimensional self-report instrument for the assessment of female sexual function. J Sex Marital Ther 2000; 26 (2): 191–208.
59. Bokmand S, Flyger H. Acupuncture relieves menopausal discomfort in breast cancer patients: a prospective, double-blind, randomized study. Breast 2013; 22 (3): 320–323. doi: 10.1016/j.breast.2012.07.015.
60. Walker EM, Rodriguez AI, Kohn B et al. Acupuncture versus venlafaxine for the management of vasomotor symptoms in patients with hormone receptor-positive breast cancer: a randomized controlled trial. J Clin Oncol 2010; 28 (4): 634–640. doi: 10.1200/JCO.2009.23.5150.
61. Carpenter JS, Neal JG, Payne J et al. Cognitive-behavioral intervention for hot flashes. Oncol Nurs Forum 2007; 34 (1): 37.
62. Hunter MS, Coverntry S, Hamed H et al. Evaluation of a group cognitive behavioral intervention for women suffering from menopausal symptoms following breast cancer treatment. Psychooncology 2009; 18 (5): 560–563. doi: 10.1002/pon.1414.
63. Marshall-McKenna R, Morrison A, Stirling L et al. A randomized trial of the cool pad pillow topper versus standard care for sleep disturbance and hot flashes in women on endocrine therapy for breast cancer. Support Care Cancer 2016; 24 (4): 1821–1829. doi: 10.1007/s00520-015-2967-3.
64. Suvanto-Luukonen E, Koivunen R, Sundstrom H et al. Citalopram and fluoxetine in the treatment of postmenopausal symptoms: a prospective, randomized, 9-month, placebo-controlled, double-blind study. Menopause 2005; 12 (1): 18–26.
65. Stearns V, Beebe KL, Iyengar M et al. Paroxetine controlled release in the treatment of menopausal hot flashes: a randomized controlled trial. JAMA 2003; 289 (21): 2827–2834.
66. Ensrud KE, Hadine J, Guthrie K et al. Effect of escitalopram on insomnia symptoms and subjective sleep quality in healthy menopausal women with hot flashes: a randomized controlled trial. Menopause 2012; 19 (8): 848–855.
67. Nystedt M, Berglund G, Bolund C et al. Side effects of adjuvant endocrine treatment in premenopausal breast cancer patients: a prospective randomized study. J Clin Oncol 2003; 21 (9): 1836–1844.
68. Phillips KA, Feng Y, Ribi K et al. Co-SOFT: the cognitive function sub-study of the suppression of ovarian function trial (SOFT). SABCS December 2014; San Antonio, TX.
69. Pagani O, Regan MM, Walley BA et al. Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N Engl J Med 2014; 371 (2): 107–118. doi: 10.1056/NEJMoa1404037.
70. Koopal C, Janssen-Heijnen ML, van de Wouw AJ et al. Fracture incidence in pre - and postmenopausal women undergoing adjuvant chemotherapy for early-stage breast cancer. J Clin Oncol 2008; 26 : 4739–4745.
71. Francis PA, Regan MM, Fleming GF et al. Adjuvant ovarian suppression in premenopausal breast cancer. N Engl J Med 2015; 372 (5): 436–446. doi: 10.1056/NEJMoa1412379.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- S těhotenstvím spojený karcinom prsu
- Těhotenství po léčbě karcinomu prsu
- Ovariální ablace u pacientek s karcinomem prsu a možnosti ovlivnění vedlejších účinků léčby
- Editorial
- Léčba inhibitory aromatázy u postmenopauzálních pacientek s karcinomem prsu a možnosti ovlivnění nežádoucích účinků
- Sledování cirkulujících hladin estradiolu u pacientek s karcinomem prsu léčených inhibitory aromatázy – přínos v klinické praxi
- Karcinom prsu – specifika gynekologické péče a poradenství
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba inhibitory aromatázy u postmenopauzálních pacientek s karcinomem prsu a možnosti ovlivnění nežádoucích účinků
- Karcinom prsu – specifika gynekologické péče a poradenství
- Sledování cirkulujících hladin estradiolu u pacientek s karcinomem prsu léčených inhibitory aromatázy – přínos v klinické praxi
- Těhotenství po léčbě karcinomu prsu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



