Sarkómy maternice – prehľad
Uterine Sarcomas – a Review
Uterine sarcomas are a heterogeneous group, which constitutes about 8% of malignant uterine tumors. This heterogeneousness and rare occurrence were the main cause of non-uniform therapeutical management. In previously published papers, there were mainly retrospective assessments of the experience of individual centres. The basis of relevant conclusions of the studies, beside their prospectiveness, is the use of unified classification criteria. Currently, a completely new classification of uterine sarcomas is being used, which consists of leiomyosarcoma, endometrial stromal sarcomas and adenosarcomas. For classification of carcinosarcomas, there are valid new criteria of endometrial cancer classification. The basic therapeutic approach of leiomyosarcoma and endometrial stromal sarcomas is a surgical intervention. The gold standard is hysterectomy and salpingooophorectomy. Justifiability of lymphadenectomy is being discussed. For carcinosarcomas, the same recommendations as for the surgical treatment of prognostically unfavourable endometrial carcinoma are valid – hysterectomy, salpingooophorectomy, pelvic and paraaortal lymph node dissection and omentectomy. It is necessary to implement the new classification into clinical practice, to publish and evaluate existing papers, which take into account their basic thesis. Only then it will be possible to create unified therapies. They should be aimed to improve patients’ survival.
Key words:
sarcoma – uterus – epidemiology – classification – terminology – treatment
Submitted:
4. 4. 2012
Accepted:
21. 5. 2012
Autoři:
M. Klačko 1; P. Babala 1; P. Mikloš 1; P. Zuzák 2; M. Chorvath 3; M. Ondrušová 4; D. Ondruš 5
Působiště autorů:
Klinika gynekologickej onkológie, OUSA a SZU Bratislava, Slovenská republika
1; Interná onkologická klinika, OUSA a TU Bratislava, Slovenská republika
2; Klinika stereotaktickej rádiochirurgie, OUSA a VŠZaSP sv. Alžbety Bratislava, Slovenská republika
3; II. onkologická klinika, LF UK a NOÚ Bratislava, Slovenská republika
4; I. onkologická klinika, LF UK a OUSA Bratislava, Slovenská republika
5
Vyšlo v časopise:
Klin Onkol 2012; 25(5): 340-345
Kategorie:
Přehledy
Souhrn
Sarkómy maternice sú heterogénnou skupinou, ktorá tvorí okolo 8 % zhubných nádorov maternice. Táto rôznorodosť a zriedkavý výskyt boli hlavnou príčinou doteraz nejednotného terapeutického manažmentu. V minulosti publikované práce boli väčšinou retrospektívnym zhodnotením skúseností jednotlivých pracovísk. Základom relevantných záverov štúdií a prác, je popri ich prospektívnosti, používanie jednotných klasifikačných kritérií. K dispozícii je aktuálna klasifikácia sarkómov maternice (leiomyosarkómov, endometriálnych stromálnych sarkómov a adenosarkómov). Pre klasifikáciu karcinosarkómov platia nové kritériá klasifikácie karcinómov endometria. Základom liečby leiomyosarkómov a endometriálnych stromálnych sarkómov maternice je chirurgická intervencia. Zlatým štandardom je hysterektómia, salpingoooforektómia. Diskutuje sa o opodstatnenosti lymfadenektómie. Pre karcinosarkómy platia rovnaké odporúčania ako pri chirurgickej liečbe prognosticky nepriaznivých karcinómov endometria – hysterektómia, salpingoooforektómia, pelvická a paraaortálna lymfadenektómia a omentektómia. Je nevyhnutné implementovať novú klasifikáciu do klinickej praxe, publikovať a zhodnotiť doterajšie práce, ktoré zohľadňujú jej základné tézy. Následne bude možné kreovať jednotné liečebné postupy. Ich cieľom má byť zlepšenie prežívania pacientok s týmto závažným ochorením.
Kľúčové slová:
sarkómy – maternica – epidemiológia – klasifikácia – terminológia – liečba
Úvod
Sarkómy maternice (SM) zahŕňajú podľa najnovšej TNM klasifikácie [1] výskyt leiomyosarkómov, endometriálnych stromálnych sarkómov a adenosarkómov (nie však zmiešaných epitelových a mezenchýmových nádorov, tzn. karcinosarkómov) fundu (C54.3), krčku (C53) a istmu (C54.0) maternice, a tvoria skupinu zriedkavých a heterogénnych nádorov so zlou liečebnou odpoveďou a horším celkovým prežívaním.
Mezenchýmové nádory tvoria globálne podskupinu cca 2–5 % z celkového počtu všetkých ZN maternice [2]. V rokoch 1999–2003 sa v SR diagnostikovalo 145 prípadov SM maternice, čo predstavovalo kumulatívnu incidenciu 1,1/100 000 a zastúpenie 2,4 % zo všetkých histologicky potvrdených ZN maternice. Z tohto počtu sa 14 sarkómov (kumulatívna incidencia 0,08/100 000, zastúpenie 0,5 % z histologicky verifikovaných nálezov) vyskytlo v krčku maternice a 131 prípadov v tele maternice (kumulatívna incidencia 1/100 000, zastúpenie 3,8 % z histologicky verifikovaných nálezov), pričom incidencia bola v jednotlivých rokoch (1999–2003) stabilizovaná. Typický vek žien v čase diagnózy SM predstavoval na Slovensku 47 rokov (25% kvantil) – 66 rokov (75% kvantil), priemerný vek bol 57 rokov [3,4].
Napriek zlým prognostickým charakteristikám SM a popisovanému vzostupnému trendu ich výskytu v niektorých prácach aj nad 8 % z celkového počtu ZN maternice a 1 % zo všetkých gynekologických ZN [5,6] sa v odbornej literatúre doposiaľ venovala ich diagnostike a liečbe len malá pozornosť. Nedostatok informácií môže byť zapríčinený nejednotnosťou v klasifikácii, rozdelení a terminológii mezenchýmových nádorov maternice vplyvom malých súborov analyzovaných pacientok a retrospektívnym spôsobom hodnotenia analýz. Tieto faktory, spolu s neuspokojivými liečebnými výsledkami, sú pravdepodobne hlavným dôvodom absencie jednotných liečebných postupov a záväzných odporúčaní.
Delenie a klasifikácia sarkómov maternice
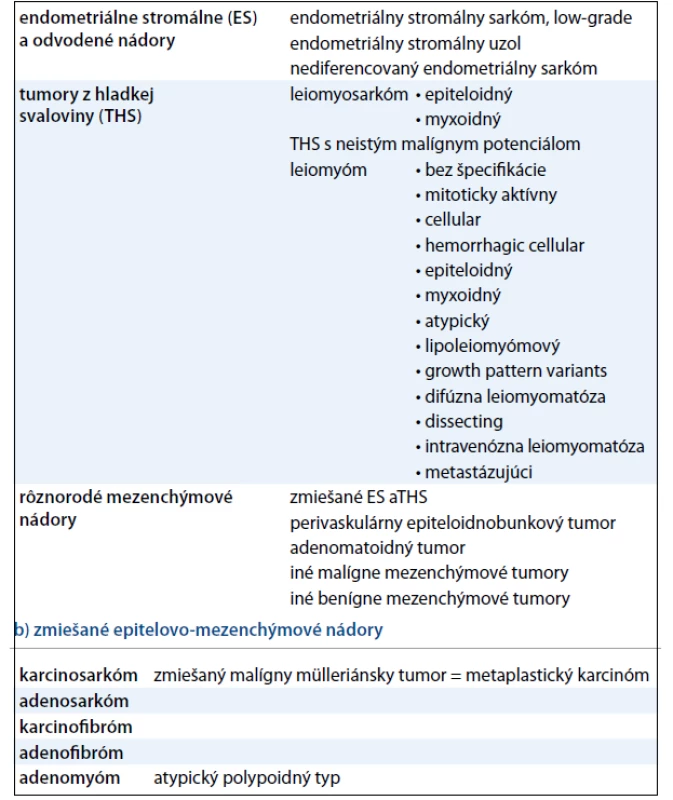
Označenie – sarkómy maternice (SM) – je historicky zaužívané pre ZN maternice so sarkómovým komponentom. Je to skupina nádorov, ktorá má spoločný mezodermový (mezenchýmový) pôvod. Podľa typu tkaniva, ktoré obsahujú, sa rozoznávajú homológne a heterológne sarkómy. Homológne sarkómy sú tvorené tkanivami štandardne prítomnými v maternici – hladká svalovina, endometriálna stróma, steny krvných a lymfatických ciev. Naproti tomu, v heterológnych typoch sa nachádza priečne pruhovaná svalovina, tuk, chrupka i kosť. Podľa prítomnosti len mezodermovej zložky alebo kombinácie epitelovej s mezodermovou zložkou možno hovoriť o tzv. čistých a zmiešaných sarkómoch (tab. 1) [7].
Z aktuálne platnej histologickej klasifikácie WHO (tab. 2) je zrejmé, že samotné SM tvoria malígnu skupinu mezenchýmových a zmiešaných epitelovo-mezenchýmových nádorov maternice [6].
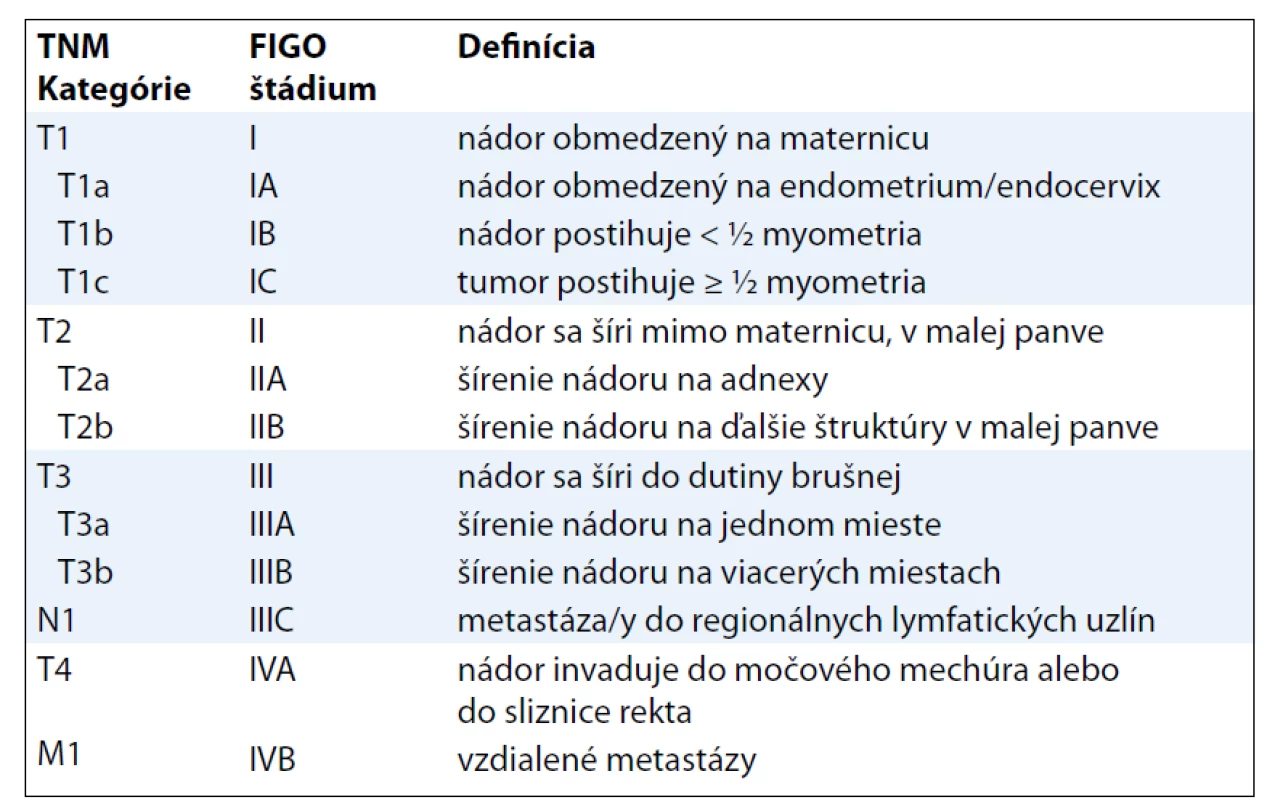
Z hľadiska prognózy sa SM delia na dve kategórie. Medzi prognosticky nepriaznivé SM (high-grade) patrí leiomyosarkóm (LMS), nediferencovaný endometriálny sarkóm (NES) a karcinosarkóm (KS). Skupinu SM s priaznivejšou prognózou (low-grade) tvorí endometriálny stromálny sarkóm (ESS) a adenosarkóm (AS) [8].
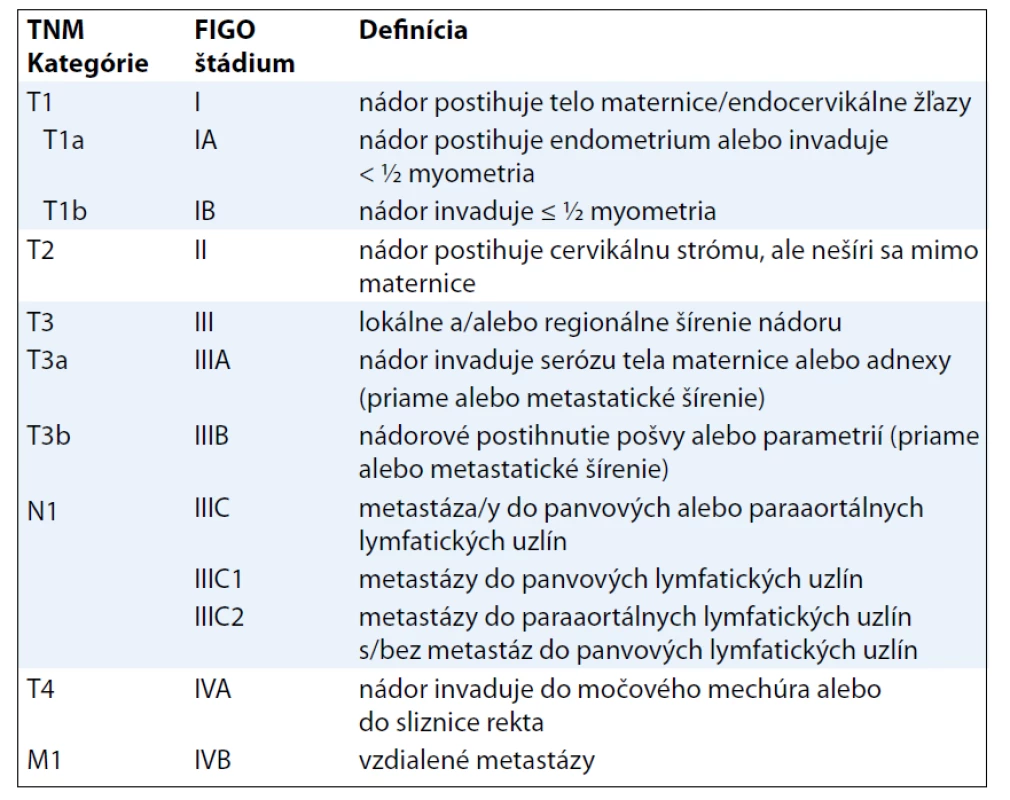
Od roku 2010 platí nová TNM klasifikácia ZN (7. vydanie). Významnou zmenou oproti predchádzajúcej klasifikácii (6. vydanie) v oblasti gynekologických ZN je pridanie samostatnej klasifikácie SM [1,9] – MKCH-O 53, 54 (okrem 54.1) (tab. 3, 4).
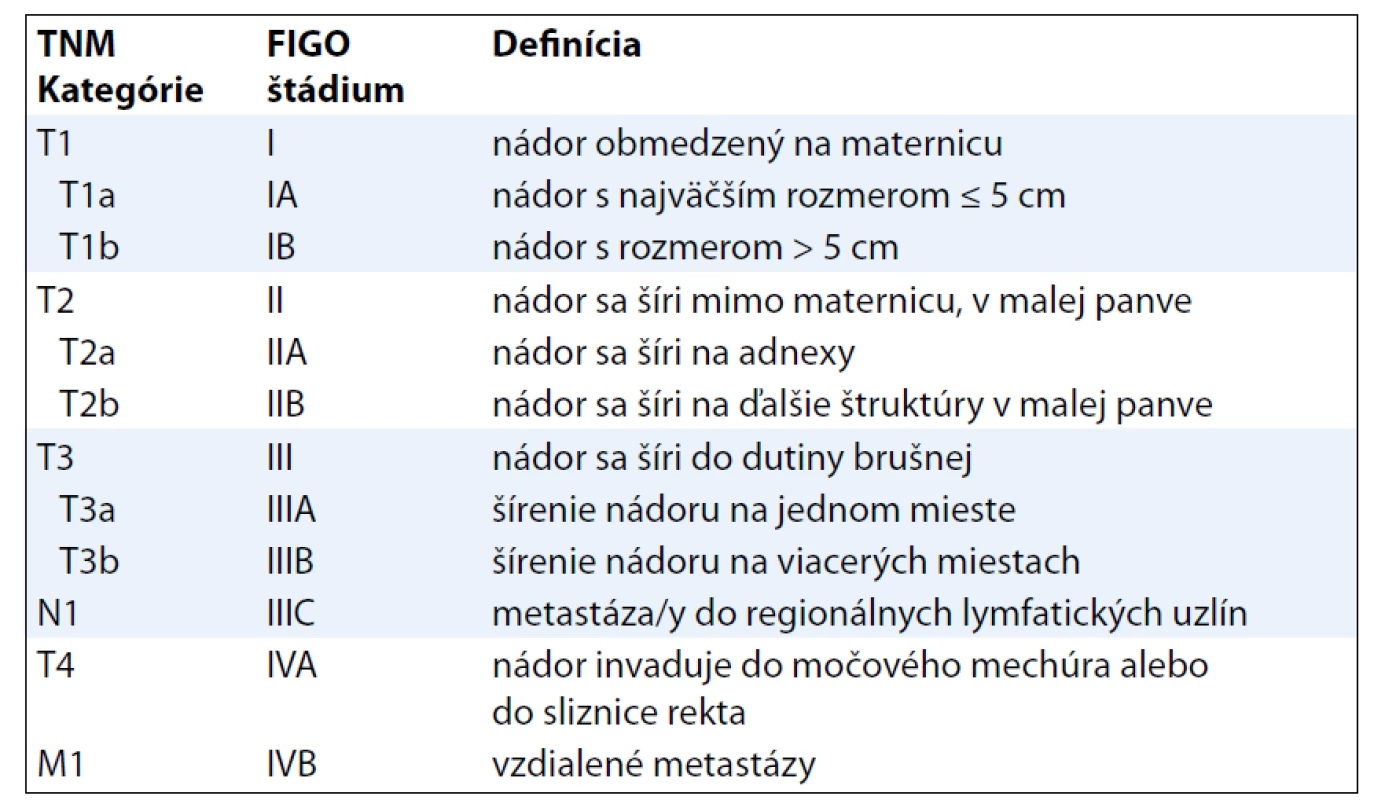
TNM kategórie a FIGO štádiá LMS určujú významný prognostický faktor pri tomto type sarkómov, ktorým je veľkosť tumoru [10]. Klasifikácia AS pri určení T1 kategórie (resp. FIGO štádia I) vychádza z predtým platných kritérií (klasifikácie TNM 6. vydanie) [11], t. j. infiltráciu do myometria delí na tri stupne. Pre klasifikáciu KS pritom platia „nové“ kritériá v rámci klasifikácie karcinómu endometria (tab. 5).
Terminológia záverov vyšetrovacích vyšetrení
Hodnotenie jednotlivých typov SM je možné výlučne pomocou histopatologického vyšetrenia vrátane molekulovej genetiky. Najvýznamnejšími parametrami v rámci diferenciálnej diagnostiky z tohto hľadiska sú koagulačná nekróza, vysoký mitotický stupeň, signifikantná cytologická atypia [12–16]. Bližšia špecifikácia je možná po imunohistochemickej analýze (p16, p53, Ki-67, MIB1, KIT proteín), stanovení estrogénových a progesterónových receptorov [17–23].
Nie sú známe také morfologické znaky (dynamika rastu v časovom horizonte, ohraničenie, echogénna homogénnosť), ktoré by v rámci zobrazovacích vyšetrení (USG, CT, NMR) umožnili s dostatočnou špecificitou a senzitivitou diferencovať benígne nádory od ZN, resp. iných patologických zmien maternice.
V tomto kontexte je odvážne robiť na základe zobrazovacích vyšetrení (USG, CT, NMR) závery typu „leiomyóm”, teda fakticky stanoviť histologickú diagnózu. Neexistuje žiadna zobrazovacia vyšetrovacia metóda, ktorá by s istotou dokázala potvrdiť „nezhubnosť“ štrukturálnych zmien maternice. Podstatné je, aby štrukturálne abnormality (myómy-uzly) opísané v náleze zo zobrazovacích vyšetrovacích metód, boli chápané v zmysle, že v síce malom, no reálnom percente, môžu predstavovať malígne ochorenie. Stanovenie záveru zobrazovacieho vyšetrenia, ktorý obsahuje histopatologické charakteristiky alebo zvádza pacienta domievať sa, že má jednoznačne nezhubné ochorenie, je z forenzného hľadiska chybou.
Chirurgická liečba SM
Chirurgická liečba SM je primárnou liečebnou modalitou. Štandardom je totálna abdominálna hysterektómia a bilaterálna adnexektómia (salpingoooforektómia) [24–27]. U premenopauzálnych pacientok s LMS v skorých štádiách možno ováriá ponechať, nakoľko nemajú negatívny vplyv na priebeh onkologického ochorenia [11,28,29]. Len nízke percento (3,5 %) pacientok s klinicky lokalizovaným LMS má metastázy v lymfatických uzlinách [30]. Pozitívne lymfatické uzliny boli identifikované pri šírení sa nádoru mimo uterus [31–33]. Väčšina autorov sa zhoduje na tom, že lymfadenektómia nemá vplyv na klinický priebeh onkologického ochorenia [27,34]. Lymfadenektómia sa diskutuje aj v súvislosti s manažmentom ESS, nakoľko sa ukazuje, že šírenie sa do lymfatických uzlín pri tomto type SM je väčšie ako sa v minulosti predpokladalo [35–38]. Z väčšiny novších literárnych zdrojov vyplýva, že lymfadenektómia nie je štandardným výkonom, opodstatnené je však odstránenie peroperačne identifikovaných zväčšených lymfatických uzlín [24,26,39].
Adnexektómia je vzhľadom na expresiu hormonálnych receptorov takisto diskutovaným výkonom. Popisuje sa zvýšené riziko rekurencie u pacientok s ponechaním adnex v rámci chirurgickej liečby ESS [40]. Iné práce adnexektómii význam neprikladajú, nakoľko podľa ich záverov adnexektómia na prognózu pacientok nemá vplyv [41]. Analogická stratégia sa uplatňuje pri manažmente AS a nediferencovaných stromálnych sarkómov [24,39,42,43].
Pri stratégii liečby „high-risk“ karcinómov endometria sa vychádza z predpokladu, že pri týchto typoch zohráva významnú úlohu metastázovanie lymfatickými cestami. Analogicky je tento fakt významný pri KS [44], u ktorých sa indikuje štádiová operácia, ktorej súčasťou je okrem totálnej hysterektómie a adnexektómie pelvická a paraaortálna lymfadenektómia, omentektómia, excízie z peritonea, výplach dutiny brušnej, debulkizácia tumoru a sekundárnych ložísk. Optimálna debulkizácia je pritom hlavným faktorom ovplyvňujúcim prežívanie pacientok [26,28,37,39].
Vzhľadom na zriedkavosť ochorenia neexistujú jednotné odporúčania v rámci „Evidence-Based Medicine“ (EBM) pre liečebný manažment SM vyrastajúcich z krčka maternice (C53). V súvislosti so skutočnosťou, že vo väčšine prípadov je prítomná aj epitelová zložka, považujú sa radikálna operácia (radikálna hysterektómia s pelvickou a paraaortálnou lymfadenektómiou, suspenziou ovárií, modifikovaná radikálna hysterektómia) a chemo-rádioterapia za účinné liečebné modality u pacientok s lokalizovaným ochorením [45,46].
Systémová liečba SM
Chemoterapia patrí medzi hlavné liečebné modality SM. LMS uteru má aj vo FIGO štádiu I vysoké riziko rekurencie vo forme vzdialených metastáz. Adjuvantná chemoterapia pre FIGO štádium I kompletne zresekovaných SM však v súčasnosti nemá jednoznačne dokázaný benefit [47]. Omura et al [48] randomizovali 156 pacientok s SM vo FIGO štádiu I a II na observáciu verzus adjuvantné podávanie doxorubicínu, nedokázal sa však štatisticky signifikantný rozdiel vo výskyte recidív, ani v intervale bez progresie či v celkovom prežívaní.
V liečbe pokročilého a metastatického ochorenia sa ako najefektívnejší v monoterapii ukázal doxorubicín s 25 % objektívnych odpovedí [49]. Medzi ďalšie možnosti systémovej liečby patrí podanie ifosfamidu, dakarbazínu, taxánov, lipozomálneho doxorubicínu, epirubicínu a gemcitabínu [50–53]. Spomedzi kombinovaných režimov vykazuje protinádorovú aktivitu a dobrú toleranciu kombinácia gemcitabín s docetaxelom [54] alebo trojkombinácia hydroxyurea, dakarbazín a etopozid [55]. Nedávne dáta poukazujú na aktivitu trabektedínu s mediánom celkového prežívania na úrovni 13,9 mesiaca u pacientok, u ktorých došlo k progresii po chemoterapii obsahujúcej doxorubicín a ifosfamid [56]. Z novších dát sú známe výsledky klinických štúdií s použitím inhibítora angiogenézy thalidomidu [57] a tyrozínkinázového inhibítora sunitinibu [58], pričom vyššie spomínané lieky nepreukázali dostatočnú protinádorovú aktivitu.
K systémovej liečbe ESS nie je dostatok dát z klinických štúdií. ESS, low--grade tumory (menej ako 10 mitóz//HPF) exprimujú hormonálne receptory, čo predikuje možnosť použitia hormonálnej liečby [59], a to pooperačne v adjuvantnej intencii v II. a III. štádiu, podobne však pri inoperabilnom, resp. recidivujúcom ochorení [60]. Z hormonálnych preparátov sa najčastejšie používajú progestíny (megestrol acetát a medroxyprogesterón). V literatúre sa uvádzajú aj skúsenosti s inhibítormi aromatáz (letrozol, anastrozol). NES (v niektorých zdrojoch uvádzané ako high--grade), ktoré sa správajú agresívnejšie, sa zvyčajne liečia chemoterapiou na báze ifosfamidu [61].
KS (malígne zmiešané mülleriánske tumory) sú kombináciou karcinómu a sarkómu a podľa novej klasifikácie [6] sa nezaraďujú medzi SM, keďže z patologického hľadiska sa pokladajú za dediferencované metaplastické karcinómy [60]. Vzhľadom na výraznú agresivitu sa adjuvantná chemoterapia zvažuje aj v prípade kompletne zresekovaného FIGO štádia I a II, hoci neexistujú jednoznačné dáta potvrdzujúce favorizujúci vplyv adjuvantnej liečby na prežívanie bez choroby a celkové prežívanie [62]. Na rozdiel od LMS uteru, má v prípade KS v monoterapii najväčšiu efektivitu ifosfamid. Z kombinovaných režimov majú podobnú aktivitu režimy ifosfamid s paklitaxelom a ifosfamid s cisplatinou, pričom prvý menovaný má nižšiu toxicitu [62,63]. Z ďalších kombinácií sa skúšal režim paklitaxel s karboplatinou, pri čom sa potvrdila jeho protinádorová aktivita a tolerovateľnou toxicitou [64]. Z novších liečebných preparátov sa skúšal thalidomid a imatinib mesylát, avšak bez potvrdenia protinádorovej aktivity [65,66].
Rádioterapia SM
Rádioterapia SM je tiež súčasťou multimodálnej liečby. Radiačná liečba sa aplikuje v adjuvancii pri ESS, kde znižuje percento lokálnych rekurencií s obmedzeným vplyvom na prežívanie. Úloha rádioterapie u LMS a NES u nemetastatických pacientok je kontroverzná. Väčšinou sa aplikuje na základe zhodnotenia rizikových faktorov ako veľkosť tumoru a invázia do myometria.
Rádioterapia sa aplikuje pomocou X lúčov lineárneho úrýchľovača na oblasť malej panvy vrátane panvových lymfatických uzlín najčastejšie formou troj-dimenzionálnej konformnej rádioterapie (3D-CRT). Celková dávka (TD) sa pohybuje v rozmedzí 46,0–50,0 Gy, dávka na frakciu je 1,8–2,0 Gy. Hranice ožarovaných polí sú nasledovné: horná hranica L5-S1, zahŕňa spoločné iliacké lymfatické uzliny, spodná hranica zahŕňa hornú polovicu vagíny. Laterálne hranice sú dané skeletom panvového kruhu, majú prechádzať 1–2 cm za jeho vnútorné hranice. Pri liečbe rekurencií je možná rádioterapia formou (3D-CRT), intenzitou modulovanej rádioterapie (IMRT), zriedkavo brachyterapie [67–69].
Záver
Cieľom prehľadovej práce o SM je poukázať na aktuálny stav týkajúci sa ich klasifikácie. Pre LMS a ESS, AS platí úplne nová klasifikácia, KS sa klasifikuje podľa nových kritérií, ktoré platia pre karcinómy endometria. Stanovenie jednotlivých typov a ich štádií reflektuje heterogénnosť tejto skupiny nádorov. Pri klasifikácii LMS, ESS absentuje v hodnotiacich kritériách infiltrácia myometria, ktorá je naopak dôležitým stagingovým parametrom pri KS. Nejednotné je hodnotenie infiltrácie myometria. Na jednej strane je nevyhnutné pamätať na heterogénnosť tejto skupiny nádorov, etablovať v praxi novú TNM klasifikáciu, no z hľadiska porovnávania jednotlivých typov bude žiaduce a prehľadnejšie hodnotiť SM podľa štádií FIGO. Rýchla implementácia týchto pravidiel do povedomia patológov, gynekológov, onkológov by v konečnom dôsledku mohla prispieť k lepšej prehľadnosti publikovaných prác. Nedostatočná, nepresná definícia histologickej nomenklatúry, štádií ochorenia boli doteraz faktorom, ktorý limitoval výpovednú hodnotu publikovaného, a tým bol prekážkou prijatia konsenzuálnych terapeutických štandardov. Ich dodržiavanie je základným krokom k zlepšeniu prognózy pacientok so SM.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Miroslav Klačko
Klinika gynekologickej onkológie
OUSA a SZU
Heydukova 10
812 50 Bratislava
Slovenská republika
e-mail: mklacko@ousa.sk
Obdrženo: 4. 4. 2012
Přijato: 21. 5. 2012
Zdroje
1. Sobin LH, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours. 7th ed. Oxford: Wiley-Blackwell 2009.
2. Freitag P. Sarkomy dělohy. Česk Gynek 1997; 62(6): 362–365.
3. Ondrušová M, Pleško I, Safaei-Diba C et al. Komplexná analýza výskytu a úmrtnosti na zhubné nádory v Slovenskej republike (online). Bratislava: Národný onkologický register SR NCZI 2007. Dostupné na: http: www.nor-sk.org.
4. Ondrušová M. Epidemiológia nádorov (prednáška). Kurz špecializačného štúdia v špecializačnom odbore ošetrovateľská starostlivosť v onkológii. Bratislava: SZU 20. 10. 2006.
5. Ueda SM, Cheung MK, Osann K et al. Factors responsible for the increase in death rate of women diagnosed with uterine corpus cancer. In: Proceedings of the Society of Gynecologic Oncologists 38th annual meeting. San Diego CA, USA 2007. Abstract 644.
6. Tavassoli FA, Devilee P. Pathology and genetics of tumours of the breast and female genital organs. WHO classification of tumours. Lyon: IARC Press 2003.
7. Hacker NF. Uterine Cancer. Budapest: European School of Oncology 1966.
8. Dafapoulos A, Tsikouras P, Dimitraki M et al. The role of lymphadenectomy in uterine leiomyosarcoma: review of the literature and recommendations for the standard surgical procedure. Arch Gynecol Obstet 2010; 282(3): 292–300.
9. Prat J. FIGO staging for uterine sarcomas. Int J Gynaecol Obstet 2009; 104(3): 177–178.
10. Giuntoli RL 2nd, Metzinger DS, DiMarco CS et al. Retrospective review of 208 patients with leiomyosarcoma of the uterus: prognostic indicators, surgical management, and adjuvant therapy. Gynecol Oncol 2003; 89(3): 460–469.
11. Sobin L, Wittekind C. TNM classification of malignant tumours. 6th ed. New York: Wiley-Liss 2002.
12. Mittal K, Joutovsky A. Areas with benign morphologic and immunohistochemical features are associated with some uterine leiomyosarcomas. Gynecol Oncol 2007; 104(2): 362–365.
13. Bell SW, Kempson RL, Hendrickson MR. Problematic uterine smooth muscle neoplasms. A clinicopathologic study of 213 cases. Am J Surg Pathol 1994; 18(6): 535–558.
14. Wang WL, Soslow RA, Zannoni GF et al. The utility of tumor cell necrosis in the diagnosis of primary leiomyosarcoma of the uterus: an analysis of 77 cases. Mod Pathol 2006; 19 (Suppl 1): 201A.
15. Perrone T, Dehner LP. Prognostically favorable „mitotically active“ smooth-muscle tumors of the uterus. A clinicopathologic study of ten cases. Am J Surg Pathol 1988; 12(1): 1–8.
16. O’Connor DM, Norris HJ. Mitotically active leiomyomas of the uterus. Hum Pathol 1990; 21(2): 223–227.
17. Zhang P, Zhang C, Hao J et al. Use of X-chromosome inactivation pattern to determine clonal origins of uterine leiomyoma and leiomyosarcoma. Hum Pathol 2006; 37(10): 1350–1356.
18. Atkins KA, Arronte N, Darus CJ et. Al. The Use of p16 in enhancing the histologic classification of uterine smooth muscle tumors. Am J Surg Pathol 2008; 32(1): 98–102.
19. Bodner-Adler B, Bodner K, Czerwenka K et al. Expression of p16 protein in patients with uterine smooth muscle tumors: an immunohistochemical analysis. Gynecol Oncol 2005; 96(1): 62–66.
20. Chen L, Yang B. Immunohistochemical analysis of p16, p53, and Ki-67 expression in uterine smooth muscle tumors. Int J Gynecol Pathol 2008; 27(3): 326–332.
21. O’Neill CJ, McBride HA, Connolly LE et al. Uterine leiomyosarcomas are characterized by high p16, p53 and MIB1 expression in comparison with usual leiomyomas, leiomyoma variants and smooth muscle tumours of uncertain malignant potential. Histopathology 2007; 50(7): 851–858.
22. Akhan SE, Yavuz E, Tecer A et al. The expression of Ki-67, p53, estrogen and progesterone receptors affecting survival in uterine leiomyosarcomas. A clinocopathologic study. Gynecol Oncol 2005; 99(1): 36–42.
23. Raspollini MR, Pinzani P, Simi L et al. Uterine leiomyosarcomas express KIT protein but lack mutation(s) in exon 9 of c-KIT. Gynecol Oncol 2005; 98(2): 334–335.
24. Amant F, Coosemans A, Debiec-Rychter M et al. Clinical management of uterine sarcomas. Lancet Oncol 2009; 10(12): 1188–1198.
25. Benoit L, Arnould L, Cheynel M et al. The role of surgery and treatment trends in uterine sarcoma. Eur J Surg Oncol 2005; 31(4): 434–442.
26. Morice P, Rodriques A, Pautier P et al. Surgery for uterine sarcoma: review of the literature and recommendations for the standard surgical procedure. Gynecol Obstet Fertil 2003; 31(2): 147–150.
27. Gaducci A, Landoni F, Sartori E et al. Uterine leiomyosarcoma: analysis of treatment failures and survival. Gynecol Oncol 1996; 62(1): 25–32.
28. Günthert AR. Sarcomas and mixed mesodermal tumors ot he uterus. Ther Umsch 2011; 68(10): 559–564.
29. Giuntoli RL 2nd, Bristow RE. Uterine leiomyosarcoma: present management. Curr Opin Oncol 2004; 16(4): 324–327.
30. Major FJ, Blessing JA, Silverberg SG et al. Prognostic factors in early-stage uterine sarcoma. A Gynecologic Oncology Group study. Cancer 1993; 71 (Suppl 4): 1702–1709.
31. Goff BA, Rice LW, Fleischhacker D et al. Uterine leiomyosarcoma and endometrial stromal sarcoma: lymph node metastases and sites of recurrence. Gynecol Oncol 1993; 50(1): 105–109.
32. Leibsohn S, d’Ablaing G, Mishell DR Jr et al. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. Am J Obstet Gynecol 1990; 162(4): 968–974.
33. Gard GB, Mulvany NJ, Quinn MA. Management of uterine leiomyosarcoma in Australia. Aust N Z J Obstet Gynaecol 1999; 39(1): 93–98.
34. Kapp DS, Shin JY, Chan JK. Prognostic factors and survival in 1,396 patients with uterine leiomyosarcomas: emphasis on impact of lymphadenectomy and oophorectomy. Cancer 2008; 112(4): 820–830.
35. Riopel J, Plante M, Renaud MC et al. Lymph node metastases in low-grade endometrial stromal sarcoma. Gynecol Oncol 2005; 96(2): 402–406.
36. Reich O, Winter R, Regauer S. Should lymphadenectomy be performed in patients with endometrial stromal sarcoma? Gynecol Oncol 2005; 97(3): 982–983.
37. Ramondetta L, Bodurka D, Deavers M et al. Uterine Sarcomas. In: Eifel PJ, Gershenson DM, Kavanagh JJ et al (eds). MD. Anderson Cancer Care Series, Gynecologic Cancer. New York: Springer 2006: 125–147.
38. Gadducci A, Cosio S, Romanini A et al. The management of patients with uterine sarcoma: a debated clinical challenge. Crit Rev Oncol Hematol 2008; 65(2): 129–142.
39. D’Angelo E, Prat J. Uterine sarcomas: a review. Gynecol Oncol 2010; 116(1): 131–139.
40. Spano JP, Soria JC, Kambouchner M et al. Long-term survival of patients given hormonal therapy for metastatic endometrial stromal sarcoma. Med Oncol 2003; 20(1): 87–93.
41. Shah JP, Bryant CS, Kumar S et al. Lymphadenectomy and ovarian preservation on low-grade endometrial stromal sarcoma. Obstet Gynecol 2008; 112(5): 1102–1108.
42. Kohler GH, Evert M. Handbuch und Bildatlas der uterinen Sarkome und Misch tumoren. Belin: De-Gruyter 2009.
43. Zagouri F, Dimopoulos AM, Fotiou S. Treatment of early uterine sarcomas: disentangling adjuvant modalities. World J Surg Oncol 2009; 7: 38.
44. Silverberg SG, Major FJ, Blessing JA et al. Carcinosarcoma (malignant mixed mesodermal tumor) of the uterus. A Gynecologic Oncology Group pathologic study of 203 cases. Int J Gynecol Pathol 1990; 9(1): 1–19.
45. Sharma NK, Sorosky JI, Bender D et al. Malignant mixed müllerian tumor (MMMT) of the cervix. Gynecol Oncol 2005; 97(2): 442–445.
46. Wright JD, Rosenblum K, Huettner PC et al. Cervical sarcomas: an analysis of incidence and outcome. Gynecol Oncol 2005; 99(2): 348-351.
47. Abeloff MD, Armitage JO, Niederhuber JE et al. Abeloff’s Clinical Oncology. 4th ed. Philadelphia: Churchill Livingstone Elsevier 2008.
48. Omura GA, Blessing JA, Major F et al. A randomized clinical trial of adjuvant adriamycin in uterine sarcomas: a Gynecologic Oncology Group study. J Clin Oncol 1985; 3(9): 1240–1245.
49. Omura GA, Major FJ, Blessing JA et al. A randomized study of adriamycin with and without dimethyl triazenoimidazole carboxamide in advanced uterine sarcomas. Cancer 1983; 52(4): 626–632.
50. Look KY, Sandler A, Blessing JA et al. Phase II trial of gemcitabine as second-line chemotherapy of uterine leiomyosarcoma: a Gynecologic Oncology Group (GOG) Study. Gynecol Oncol 2004; 92(2): 644–647.
51. Judson I, Radford JA, Harris M et al. Randomised phase II trial of pegylated liposomal doxorubicin (DOXIL/CAELYX) versus doxorubicin in the treatment of advanced or metastatic soft tissue sarcoma: a study by the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer 2001; 37(7): 870–877.
52. Sutton G, Blessing J, Hanjani P et al. Phase II evaluation of liposomal doxorubicin (Doxil) in recurrent or advanced leiomyosarcoma of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 2005; 96(3): 749–752.
53. Gallup DG, Blessing JA, Andersen W et al. Evaluation of paclitaxel in previously treated leiomyosarcoma of the uterus: a gynecologic oncology group study. Gynecol Oncol 2003; 89(1): 48–51.
54. Hensley ML, Maki R, Venkatraman E et al. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: results of a phase II trial. J Clin Oncol 2002; 20(12): 2824–2831.
55. Currie J, Blessing JA, Muss HB et al. Combination chemotherapy with hydroxyurea, dacarbazine (DTIC), and etoposide in the treatment of uterine leiomyosarcoma: a Gynecologic Oncology Group study. Gynecol Oncol 1996; 61(1): 27–30.
56. Demetri GD, Chawla SP, von Mehren M et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. J Clin Oncol 2009; 27(25): 4188–4196.
57. McMeekin DS, Sill MW, Darcy KM et al. A phase II trial of thalidomide in patients with refractory leiomyosarcoma of the uterus and correlation with biomarkers of angiogenesis: a Gynecologic Oncology Group study. Gynecol Oncol 2007; 106(3): 596–603.
58. Hensley ML, Sill MW, Scribner DR Jr et al. Sunitinib malate in the treatment of recurrent or persistent uterine leiomyosarcoma: a Gynecologic Oncology Group phase II study. Gynecol Oncol 2009; 115(3): 460–465.
59. DeVita VT. Principles of Medical Oncology, In: DeVita VT, Lawrence TS, Rosenberg SA (eds). DeVita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. 8th ed. Philadelphia: Lippincott Williams & Wilkins 2008.
60. NCCN Guidelines, Version 2.2012, Uterine neoplasms.
61. Sutton G, Blessing JA, Park R et al. Ifosfamide treatment of recurrent or metastatic endometrial stromal sarcomas previously unexposed to chemotherapy: a study of the Gynecologic Oncology Group. Obstet Gynecol 1996; 87 (5 Pt 1): 747–750.
62. Sutton G, Kauderer J, Carson LF et al. Adjuvant ifosfamide and cisplatin in patients with completely resected stage I or II carcinosarcomas (mixed mesodermal tumors) of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 2005; 96(3): 630–634.
63. Homesley HD, Filiaci V, Markman M et al. Phase III trial of ifosfamide with or without paclitaxel in advanced uterine carcinosarcoma: a Gynecologic Oncology Group study. J Clin Oncol 2007; 25(5): 526–531.
64. Powell MA, Filiaci VL, Rose PG et al. Phase II evaluation of paclitaxel and carboplatin in the treatment of carcinosarcoma of the uterus: a Gynecologic Oncology Group study. J Clin Oncol 2010; 28(16): 2727–2731.
65. Huh WK, Sill MW, Darcy KM et al. Efficacy and safety of imatinib mesylate (Gleevec) and immunohistochemical expression of c-Kit and PDGFR-beta in a Gynecologic Oncology Group Phase II Trial in women with recurrent or persistent carcinosarcomas of the uterus. Gynecol Oncol 2010; 117(2): 248–254.
66. Yi-Shin Kuo D, Timmins P, Blank SV et al. Phase II trial of thalidomide for advanced and recurrent gynecologic sarcoma: a brief communication from the New York Phase II consortium. Gynecol Oncol 2006; 100(1): 160–165.
67. Bermudez RS, Huang K, Hsu IC. Endometrial Cancer. In: Hansen EK, Roach M (eds). Handbook of evidence-based radiation oncology. 2nd ed. New York: Springer Science + Business Media 2010: 513–526.
68. Schick U, Bolukbasi Y, Thariat J et al. Outcome and prognostic factors in endometrial stromal tumors: a rare cancer network study. Int J Radiat Oncol Biol Phys 2012; 82(5): e757–e763.
69. Reed NS, Mangioni C, Malstrom H et al. Phase III randomised study to evaluate role of adjuvant pelvic radiotherapy in the treatment of uterine sarcomas stages I and II: an EORTC Gynaecological Group Study (protocol 55874). Eur J Cancer 2008, 44(6): 808–818.
Štítky
Dětská onkologie Chirurgie všeobecná OnkologieČlánek vyšel v časopise
Klinická onkologie

2012 Číslo 5
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- MUDr. Lenka Klimešová: Multioborová vizita může být klíčem k efektivnější perioperační léčbě chronické bolesti
- Realita léčby bolesti v paliativní péči v Německu
Nejčtenější v tomto čísle
- Sarkómy maternice – prehľad
- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Mutace BRAF: nový přístup k cílené léčbě melanomu