-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodnocení neoadjuvantní chemoradioterapie u lokálně pokročilého karcinomu rekta srovnáním objemu tumoru před léčbou a po léčbě
Evaluation of Neoadjuvant Chemo - Radiotherapy with Locally Advanced Rectal Cancer by Comparing Tumour Volume before and after Treatment
Backgrounds:
Neoadjuvant chemotherapy is a standard preoperative therapeutical procedure with locally advanced rectal adenocarcinoma. The aim of the study was to compare the tumour volume reduction before and after the oncological therapy in relation to the change in the CEA value and to the outcome of the histopathological evaluation of response to the treatment.Patients and Methods:
In the years 2004 – 2008, 274 rectal cancer patients were evaluated, of which 64 underwent neoadjuvant CRT with subsequent surgery and had also completed other inclusion criteria. The tumour volume before and after the CRT, percentage reduction in the tumour volume and the relation to the change in the CAE value and the histopathological evaluation were evaluated.Results:
The distance between the anus and the tumour was from 3 to 15 centimetres, the average value being 8.1 centimetres. In 5 cases the tumour was not histologically found in the resected specimen. Average value of the CEA value before the CRT was 18.12 ng/ ml, range 0.7 – 98.1 ng/ ml, after the CRT the average value was 7.00 ng/ ml, range 0.5 – 18.7 ng/ ml. The average tumour volume before CRT was 32.48, range 10.3 – 88.5, after the CRT the average volume was 20.13, range 4.7 – 55.1.Conclusion:
A relation between the change in the T value and the volume reduction before and after the CRT of statistical significance has been proven in this group of patients. This relation however has not been proved in the N value change. Only in one – third of the evaluated patients was there a positive change in both T and N classification. No relation between the CEA value and the tumour volume change has been proven.Key words:
rectal cancer – tumor volume – tumor staging – neoadjuvant therapy – radiotherapy – chemotherapy
Autoři: P. Diviš 1; P. Vlček 1; I. Čapov 1; K. Divišová 2; J. Katolická 2; J. Vaníček 3; E. Kotulánová 3
Působiště autorů: I. chirurgická klinika, Fakultní nemocnice u sv. Anny v Brně 1; Oddělení chirurgické onkologie, Fakultní nemocnice u sv. Anny v Brně 2; Klinika zobrazovacích metod, Fakultní nemocnice u sv. Anny v Brně 3
Vyšlo v časopise: Klin Onkol 2010; 23(6): 421-427
Kategorie: Původní práce
Souhrn
Východiska:
Neoadjuvantní chemoradioterapie je standardním léčebným postupem u lokálně pokročilých adenokarcinomů rekta před vlastní chirurgickou léčbou. Cílem naší práce bylo srovnání redukce objemu nádoru před zahájením onkologické léčby a po jejím ukončení v souvislosti se změnou hodnoty CEA a výsledkem histopatologického hodnocení odpovědi na léčbu.Soubor pacientů a metody:
V průběhu let 2004 – 2008 bylo zhodnoceno 274 pacientů s adenokarcinomem rekta, z nichž 64 pacientů prodělalo neoadjuvantní CRT s následným chirurgickým zákrokem a splnilo i další kritéria pro vstup do studie. Byl hodnocen objem tumoru před CRT a po něm, procentuální snížení objemu tumoru a vztah ke změně CEA a histopatologického hodnocení.Výsledky:
Vzdálenost tumoru od anu byla od 3 do 15 cm, průměrně 8,1 cm. V 5 případech nebyl tumor v resekátu histologicky nalezen. Průměrná hodnota CEA před CRT byla 18,12 ng/ ml, rozmezí 0,7 – 98,1 ng/ ml, po proběhlé CRT byla 7,00, rozmezí 0,5 – 18,7 ng/ ml. Průměrná hodnota objemu před CRT byla 32,48, rozmezí 10,3 – 88,5, po CRT byl průměrný objem 20,13, rozmezí 4,7 – 55,1.Závěry:
V hodnoceném souboru byla prokázána statistická souvislost mezi změnou hodnocení T a poklesem objemu tumoru před a po CRT. Tato souvislost však nebyla prokázána v oblasti hodnocení změny N. Pouze u 1/ 3 hodnocených pacientů nastala současně pozitivní změna T i N klasifikace. V hodnocení nebyla prokázána souvislost hodnoty CEA se změnou objemu tumoru.Klíčová slova:
nádory rekta – objem nádoru – staging – neoadjuvantní léčba – radioterapie – chemoterapieÚvod
Standardním postupem u pokročilého karcinomu rekta je konkomitantní chemoradioterapie (CRT). Po proběhlé léčbě je možné zaznamenat celou škálu odpovědí, od kompletní remise přes stacionární obraz po progresi onemocnění. Není jednoduché zhodnotit účinnost neoadjuvantní CRT. Možných pohledů je celá škála. Pro onkologa může být hodnoticím faktorem disease free survival, pro chirurga vyšší procento kurativních resekcí a sfinkter šetřicích výkonů. Studie prokázaly po proběhlé CRT více než 80% resekabilitu a kompletní patologickou remisi v 10 – 20 % případů [1–3]. K hodnocení odpovědi na CRT je možné použít mnoho klinicko patologických faktorů, včetně velikosti tumoru, tvaru, buněčné diferenciace, biologického charakteru. Další možností je změna histopatologického hodnocení – downstaging. Ideálním a jednoznačným výsledkem onkologické léčby je kompletní remise nádoru, i když neoadjuvantní léčba není pojata jako radikální, ve všech ostatních případech je však zhodnocení účinnosti léčby velice problematické a popsané faktory nejsou schopny určit pouze podíl jednotlivých částí komplexní léčby CRC. Všechny uvedené a dosud používané metody nejsou v rámci hodnocení jednoznačně objektivní. Je proto důvod k hledání metody hodnocení účinnosti onkologické léčby. Dosažení ideálního postupu v léčbě CRC je cílem lékařů, pro pacienta znamená určení optimální léčby šanci na kurativní postup.
V rámci hodnocení účinnosti neoadjuvantní CRT jsme použili aplikaci volumometrie u CT vyšetření tumoru před ukončením a po ukončení CRT. Provedli jsme srovnání se změnou hodnoty CEA a změnou histopatologického hodnocení tumoru. Cílem studie je objasnit vztah mezi redukcí objemu tumoru, histopatologickým hodnocením a hodnotou CEA, a tak prokázat klinický význam redukce objemu tumoru po proběhlé CRT.
Souhrn pacientů a metody
Ve výběru pacientů jsme stanovili základní kritéria:
- pacient s karcinomem rekta stadia T3,
- pacient s CT vyšetřením oblasti malé pánve, které proběhlo nejpozději 1 týden před zahájením chemoradioterapie,
- pacient s odběrem CEA, odběry proběhly nejpozději týden před zahájením chemoradioterapie,
- pacient, který prodělal neoadjuvantní chemoradioterapii v režimu standardní radioterapie na oblast malé pánve à 1,8 Gy do 45,0 Gy, poté 3krát 1,8 Gy boost na oblast tumoru; konkomitantně byla podávána Xeloda p.o.,
- pacient s CT vyšetřením oblasti malé pánve, které následovalo 4 – 6 týdnů po ukončení chemoradioterapie,
- pacient s odběrem CEA, odběry proběhly 4 – 6 týdnů po ukončení chemoradioterapie,
- u pacienta následoval operační zákrok na I. chirurgické klinice FN u sv. Anny v Brně 6 – 8 týdnů po ukončení CRT.
Pacienti zařazení do studie byli prospektivně vyhodnocováni. Všichni pacienti měli v rámci stagingu provedeny RTG nebo CT plic, CT malé pánve nebo břicha, ultrazvukové vyšetření břicha a TRUS. Někteří pacienti absolvovali i MRI vyšetření, jelikož ale nešlo o všechny pacienty, bylo volumometrické vyšetření hodnoceno z CT scanů. Hodnocení RTG či CT plic a ultrasonografie nebo CT břicha proběhlo v rámci vyloučení diseminace CRC. Zařazeni byli pouze pacienti bez nálezu vzdálených metastáz.
Pacienti prodělali předoperační radioterapii 45 Gy/ 25 frakcí na oblast malé pánve, následoval boost na primární tumor v dávce 5,4 Gy/ 3 frakce. Použit byl lineární urychlovač s energií 10 MV. Chemoterapie byla podávána po dobu trvání radioterapie, byl použit preparát capecitabine. Pro plánování radioterapie byla použita 3D technika.
CT volumometrie byla provedena zakreslením obrysů tumoru v jednotlivých scanech a vyhodnocením v programu TomoCon. Vyhodnocení bylo prováděno ve spolupráci s lékařem KZM.
Chirurgická léčba proběhla 4 – 6 týdnů po ukončení CRT a zahrnovala resekční zákroky „otevřené“ i laparoskopické. Vždy byl kladen důraz na onkologickou radikalitu, tedy na provedení totální mezorektální excize (obr. 1,2) a sfinkter šetřící výkony. V několika případech proběhla explorace dutiny břišní s derivačním zákrokem při lokálně neresekabilním nálezu. Pokud nebylo možno provést kontinentní výkon, byla provedena Milesova amputace rekta. V sestavě byly i případy pacientů, u kterých neoadjuvantní léčba umožnila provést lokální transanální výkon (TEM).
Obr. 1. Schematické znázornění linie totální mesorektální excize. 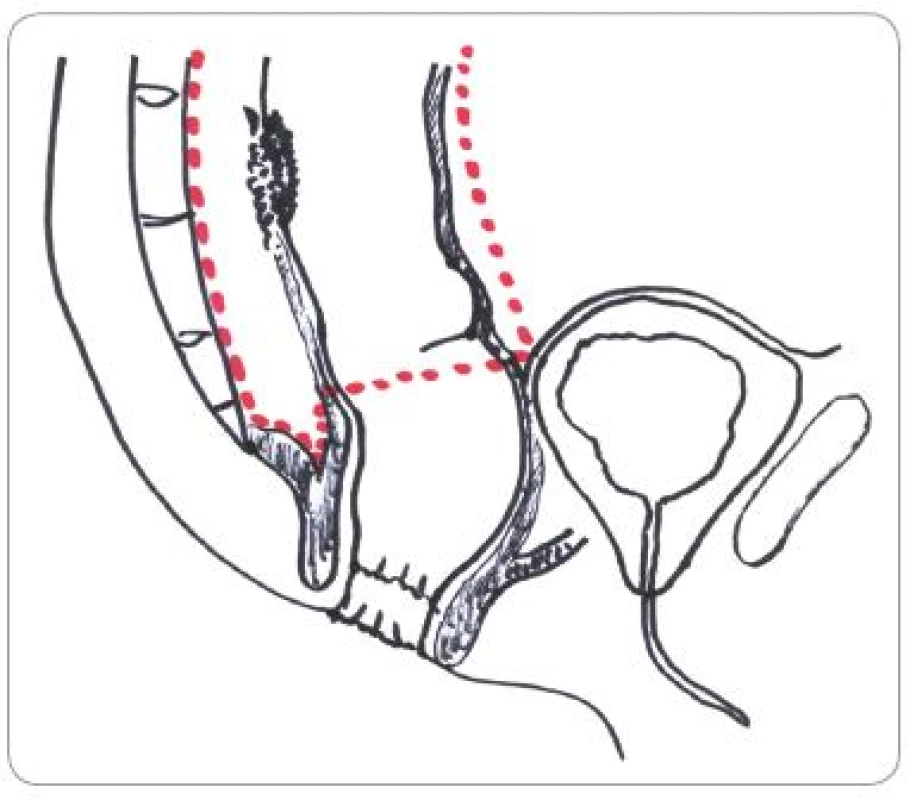
Obr. 2. Schematické znázornění totální mezorektální excize při laparoskopické resekci. 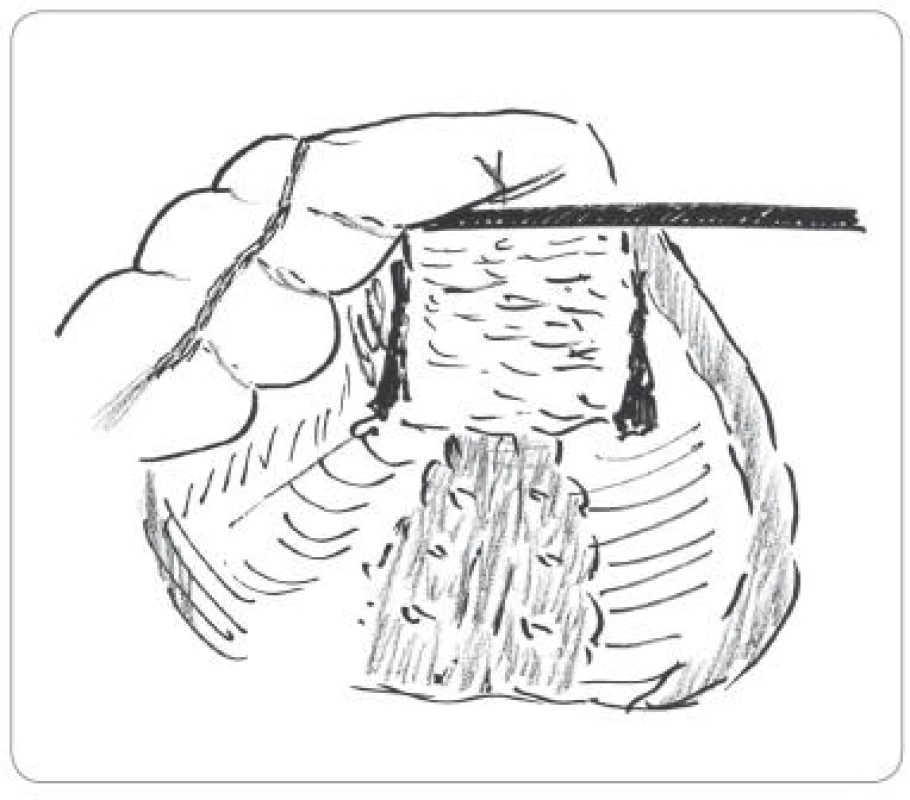
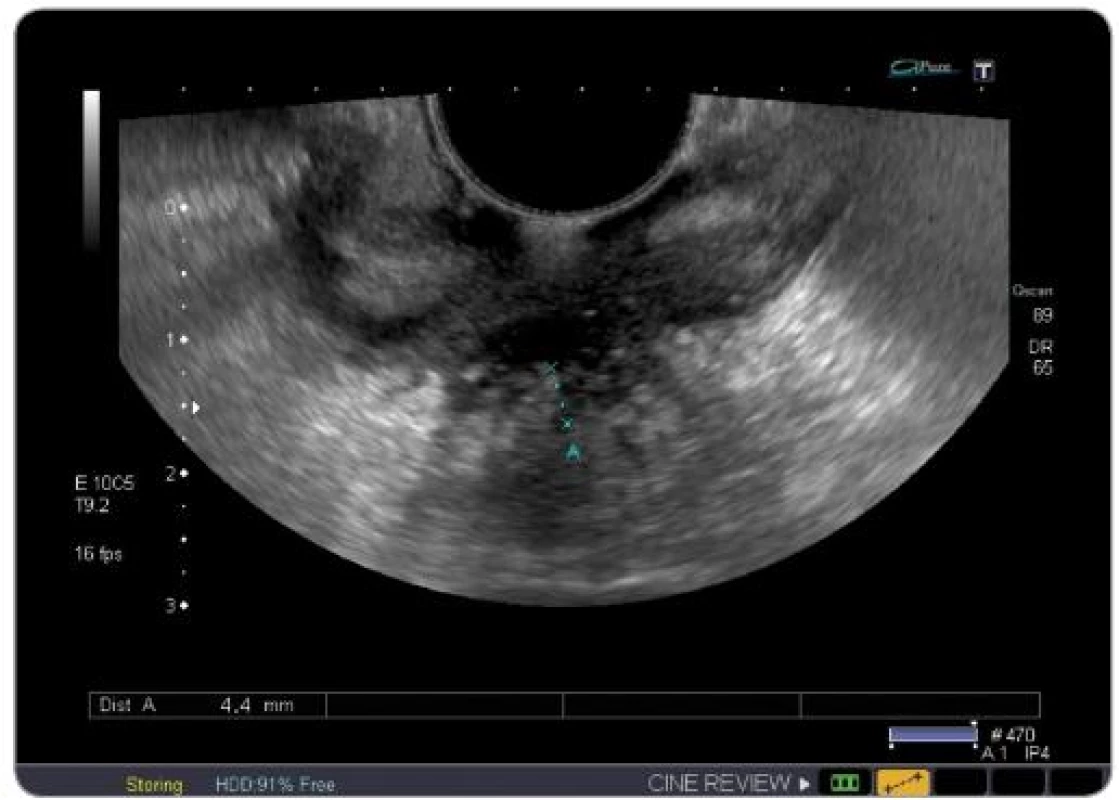
TNM klasifikace byla vyhodnocena TRUS vyšetřením se zhodnocením mezorektálních uzlin (obr. 3 – 6). U části pacientů byla TNM klasifikace hodnocena i z MRI vyšetření. Jelikož se ale nejednalo o všechny pacienty v sestavě, byla hodnoticím vyšetřením TRUS. Za pozitivní výsledek bylo považováno snížení hodnoty T a N při srovnání hodnoty před a po CRT.
Obr. 3. TRUS obraz tumoru rekta T2. 
Obr. 5. TRUS obraz stenózujícího tumoru. 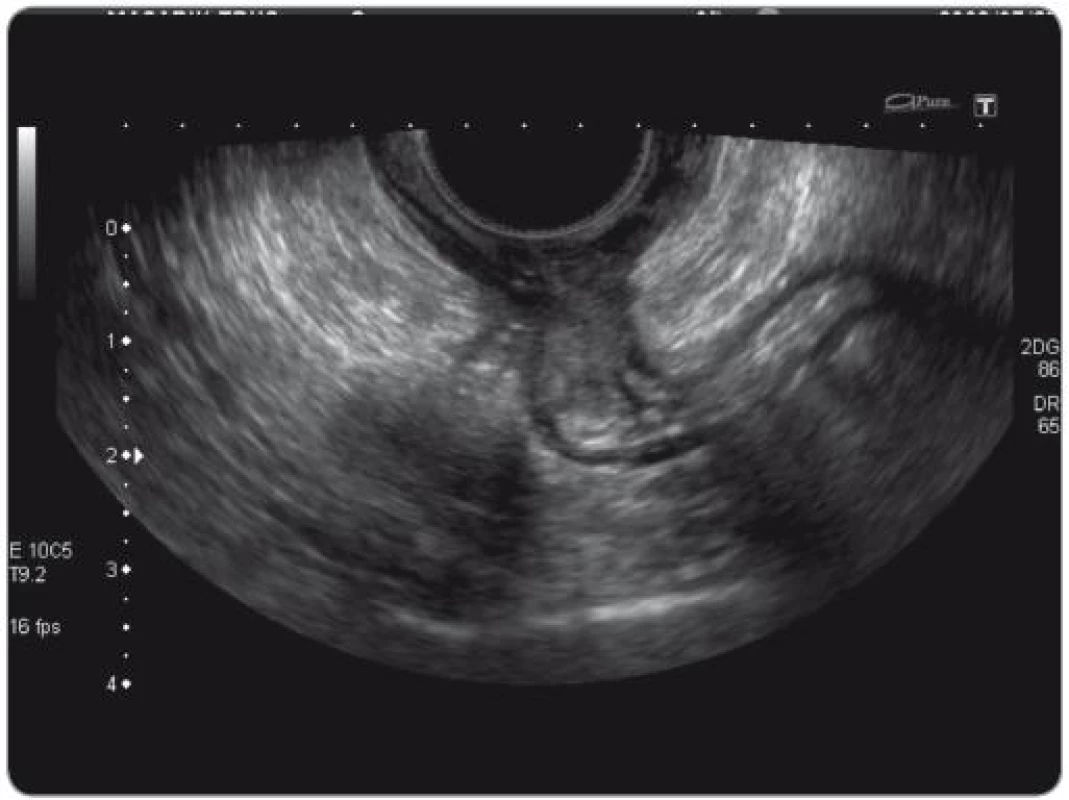
Obr. 6. TRUS 3D obraz tumoru rekta T3. 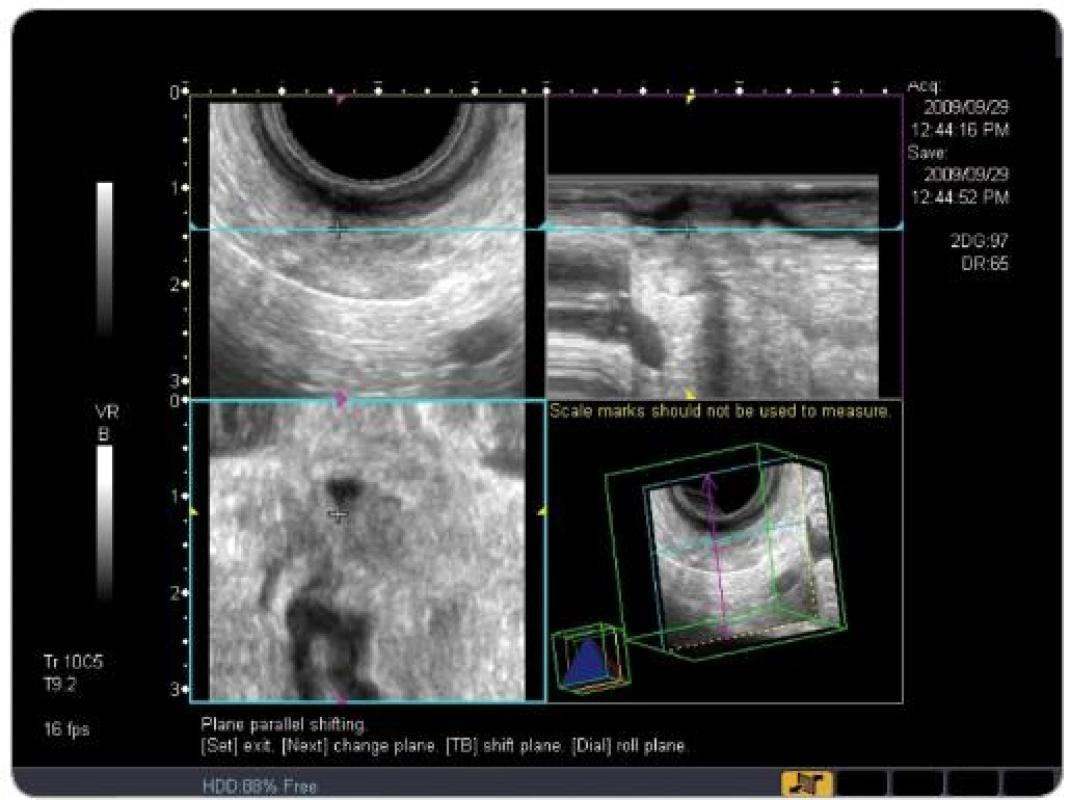
Hodnocení objemu tumoru bylo prováděno před a po CRT a bylo uváděno v %. K výpočtu redukce byl použit vzorec: objem před CRT – objem po CRT/ objem před CRT × 100. Byly srovnávány výsledky objemu před a po CRT, % redukce objemu u pacientů vykazujících downstaging T N klasifikace s pacienty, u kterých k dané změně nedošlo nebo u nichž byla zaznamenána progrese onemocnění.
Výsledky
Mezi pacienty zařazenými do studie bylo 44 mužů a 20 žen. Průměrný věk mužů byl 64 let (40 – 82 let), průměrný věk žen byl 62 let (49 – 77 let) (tab. 1). Vzdálenost tumoru od anu byla od 3 do 15 cm, v průměru 8,1 cm (graf 1). U 55 pacientů byl proveden resekční výkon (12krát laparoskopická resekce), u 6 pacientů byla provedena amputace rekta dle Milese, 6krát downstaging umožnil lokální výkon TEM (transanal endoscopic microsurgery). Ve třech případech proběhla pouze explorace s vyšitím axiální sigmoideostomie (tab. 2). Průměrná hodnota CEA před CRT byla 18,12 ng/ ml, rozmezí 0,7 – 98,1 ng/ ml, po proběhlé CRT byla 7,00, rozmezí 0,5 – 18,7 ng/ ml (graf 2). Průměrná hodnota objemu před CRT byla 32,48, rozmezí 10,3 – 88,5, po CRT byl průměrný objem 20,13, rozmezí 4,7 – 55,1 (graf 3).
Graf 1. Vzdálenost tumoru od anu. 
Graf 2. Hodnota CEA před a po CRT. 
Graf 3. Objem tumoru před a po CRT. 
Statistika: Hodnoty CEA a objemů jsou vyjádřeny jako medián, dolní a horní kvartil.
Tab. 1. Počet pacientů, průměrný věk, hodnota CEA a objem před a po CRT. 
Významnost rozdílu byla testována pomocí Wilcoxon Matched Pairs Test u proměnných před léčbou a po léčbě, při hodnocení rozdílu mezi skupinami (podle T a N) byl použit Mann Whitney U Test. Za statisticky významný rozdíl byla považována hodnota p < 0,05.
Ke statistickému zpracování dat byl použit sofware StatSoft, Inc. (2009), STATISTICA (data analysis software system), version 9.0 – viz www.statsoft.com.
Objem před CRT byl (medián, rozpětí kvartilů) 30,4 (22,3 – 40,6) l, po CRT byl objem 19,5 (12,9 – 23,6) l, objem poklesl o 39 % (18 % – 48 %), p < 0,001.
Tab. 3. Hodnoty objemu a CEA před a po CRT. 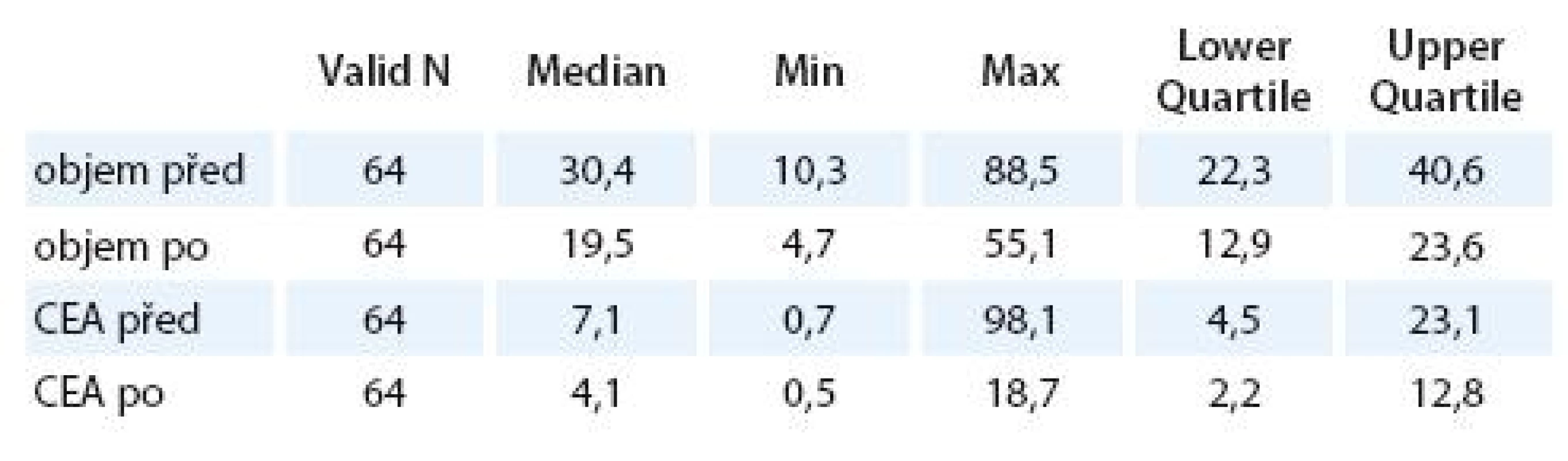
Hodnota CEA před CRT byla (medián, rozpětí kvartilů) 7,1 (4,5 – 23,1) ng/ l a po proběhlé CRT 4,1 (2,2 – 12,8) ng/ l, p < 0,001 (tab. 3). V relativním vyjádření CEA pokleslo o 41 % (22 % – 73 %) (graf 4).
Graf 4. Relativní pokles objemu. 
Kompletní patologická remise byla zaznamenána u 5 pacientů, pozitivní odpověď při hodnocení T nastala u 42 pacientů, beze změny bylo T u 21 pacientů, v jednom případě došlo k progresi onemocnění. Změna N proběhla v pozitivním smyslu v 38 případech, beze změny byla hodnota u 26 pacientů, nebyla zaznamenána negativní změna N (graf 5).
Graf 5. Grafické znázornění četnosti změny TN. 
Ve 22 případech došlo k pozitivní odpovědi u obou ukazatelů. V těchto případech byl medián snížení objemu tumoru o 42 (26 – 52) %, bez pozitivní odpovědi v obou ukazatelích 38 (8 – 46) %, p = 0,14. U pozitivní změny T a N kleslo CEA o 26 (16 – 59) % proti 43 (28 – 75) % v případě nepřítomnosti změny obou ukazatelů (p = 0,13).
Při pozitivní odpovědi v rámci pouze T hodnocení (42 pacientů) bylo průměrné snížení objemu 45 (32 – 55) %, při negativní odpovědi 17 ( – 4 – 39) %, p < 0,001. V jednom případě došlo ke zvýšení objemu o 97 % přes pozitivní posun v T hodnocení (T3 – T2). CEA kleslo o 38 (18 – 71) % u pacientů s pozitivním T hodnocením proti 48 (24 – 77) % při negativní odpovědi T (p = 0,40).
V případech pozitivní odpovědi pouze u N hodnocení (38 pacientů) byl medián snížení objemu 38 (9 – 48) %, v případech negativní odpovědi u N 43 (26 – 53) %, p = 0,2. U pozitivní změny N kleslo CEA o 35 (18 – 67) % proti 48 (28 – 75) % u změny negativní (p = 0,38) (tab. 4).
Tab. 4. Počet pacientů s kompletní remisí, počet a změna TN. 
Diskuze
V současné době je neoadjuvantní léčba lokálně pokročilého CRC standardním postupem. Léčba předcházející chirurgický výkon představuje pro pacienta jednoznačný benefit, který zahrnuje vyšší procento radikálních resekcí, sfinkter šetřících zákroků a delší přežití. Po proběhlé předoperační léčbě je možné sledovat celou řadu změn vlastního tumoru. Tyto zahrnují histopatologický downstaging, redukci nádorové hmoty, TRG a s tím související ozářením vzniklou fibrózu [4]. Data studie fáze III srovnávající pre a postoperační chemoradioterapii pro CRC, která proběhla v Německu a zahrnovala údaje více než 800 pacientů, potvrdila jednoznačně zvýšenou lokální kontrolu, sfinkter šetřící postup a lepší toleranci léčby ve prospěch předoperační chemoradioterapie [5]. I další studie se zabývaly stanovením optimálního postupu v léčbě CRC, např. srovnáním předoperační radioterapie s chemoterapií nebo bez ní a s adjuvantní chemoterapií nebo bez adjuvantní chemoterapie. Takto proběhla studie EORTC zahrnující 22 921 pacientů [6]. Závěry prokázaly signifikantní zvýšení odpovědi v části s chemoterapií. Stejně tak studie prokázala nižší procento lokální recidivy onemocnění v části s chemoterapií než u samostatné radioterapie (8 – 10 % s chemoterapií vs 17 % pouze s radioterapií).
Největším problémem tedy zůstává, jak se zachovat v případě lokální kompletní remise onemocnění. Není možné z algoritmu léčby vynechat chirurgii, protože „klinická“ kompletní remise není totéž, co „patologická“ kompletní remise. V současné době nemáme metodu, která by byla schopna jednoznačně potvrdit „patologickou“ kompletní remisi. Navíc lokální remise neříká nic o situaci v uzlinách. Proto vynechání chirurgické léčby nebo lokální výkony zůstávají stále jako rozporuplné postupy [7,3].
Co se týče vlastního hodnocení neoadjuvantní léčby, i ta je velmi problematická. Není totiž jednoduché hodnotit jednotlivé části jinak komplexní léčby CRC. Jako jeden z parametrů hodnocení by mohl sloužit podíl sfinkter záchovných operací. Tento parametr je však velmi závislý na počtu různě „vysoko“ uložených tumorů. Navíc závisí nejenom na zkušenostech operatérů na daném pracovišti, ale i na zvyklostech pracoviště. K dalším rozdílům může dojít v závislosti na technických možnostech, především na možnosti použití roboticky asistovaných výkonů [8]. Je to tedy parametr značně individuální, a proto k hodnocení samotné neoadjuvantní léčby nevhodný. Snížení frekvence relapsů či prodloužené přežívání jsou také značně závislé na skladbě pacientů a zkušenostech pracoviště podobně jako předešlý faktor [9]. I další parametry, jako disease free survival, jsou stěží použitelné, protože neprokazují pouze podíl neoadjuvantní léčby. Jsou hodnoceny po proběhlé komplexní léčbě s více léčebnými modalitami, i když v literatuře jsou jako hodnocení neoadjuvantní léčby používány [10].
Ideálními parametry proto zůstává downstaging, tedy snížení T při srovnání před neoadjuvantní CRT a po ní, downsizing – v našem případě snížení objemu a TRG [11,12].
Závěr
V rámci hodnocení byli vybráni pacienti s tumorem rekta T3, kteří prodělali neoadjuvantní CRT ve standardním režimu s použitím preparátu Xeloda. Podmínkou bylo provedení CT vyšetření před proběhlou léčbou a po ní. Byla provedena volumometrie tumoru a srovnávána se změnou TN klasifikace a hodnotou CEA.
V hodnoceném souboru byla prokázána statistická souvislost mezi změnou hodnocení T a poklesem objemu tumoru před proběhlou CRT a po ní. Tato souvislost však nebyla prokázána v oblasti hodnocení změny N.
Pouze u 1/ 3 hodnocených pacientů došlo současně k pozitivní změně T i N kla-sifikace. V hodnocení nebyla prokázána souvislost hodnoty CEA se změnou objemu tumoru.
Volumometrie jako hodnoticí faktor je tedy použitelná v rámci hodnocení účinnosti onkologické léčby s vědomím, že poskytuje informace o prostém úbytku hmoty tumoru („debulking“). Neposkytuje však zřejmě žádné další informace o biologické aktivitě nádorového procesu. Na tuto skutečnost ukazuje souvislost s hodnocením T klasifikace, která se týká přímo samotného tumoru. Naopak v oblasti N klasifikace a hodnoty onkomarkeru CEA, které lze považovat za faktory spíše prognostické, se statistická souvislost neprokázala.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Petr Diviš
I. chirurgická klinika
Fakultní nemocnice u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: petr.divis@fnusa.cz
Zdroje
1. Janjan NA, Khoo VS, Abbruzzese J et al. Tumor downstaging and sphincter preservation with preoperative chemoradiation in locally advanced rectal cancer: the M. D. Anderson Cancer Center experience. Int J Radiat Oncol Biol Phys 1999; 44(5): 1027 – 1038.
2. Valentini V, Coco C, Cellini N et al. Preoperative chemoradiation for extraperitoneal T3 rectal cancer: acute toxicity, tumor response and sphincter preservation. Int J Radiat Oncol Biol Phys 1998; 40(5): 1067 – 1075.
3. Benzoni E, Terrosu G, Bresadola V et al. Prognostic value of tumour regression grading and depth of neoplastic infiltration within the perirectal fat after combined neoadjuvant chemoradiotherapy and surgery for rectal cancer. J Clin Pathol 2006; 59 : 505 – 512.
4. Kim NK, Baik SH, Min BS et al. A comparative study of volumometric analysis, histopatologic downstaging and tumor regression grade in evaluating tumor response in locally advanced rectal cancer following preoparative chemoradiation. Int J Radiation Oncology Biol Phys 2007; 67(1): 204 – 210.
5. Sauer R, Becker H, Hohenberger W et al. for the German Rectal Cancer Group. Preoparative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351(17): 1731 – 1740.
6. Bosset JF, Collette L, Calais G et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006; 355(11): 1114 – 1123.
7. Baxter NN, Garcia - Aguilar J. Organ preservation for rectal cancer. J Clin Oncol 2007; 25(8): 1014 – 1120.
8. Vlček P, Čapov I, Chalupník Š et al. Robot - Assisted Colorectal Surgery. A Two Years Single Center Experience. Colorectal Disease 2008; 10 (Suppl 2). Wiley - Blackwell: 9.
9. Sauer R, Becker H, Hohenberger W et al. Preoperative vers. postoperative Chemoradiotherapy for retal cancer. N Engl J Med 2004; 351 : 1731 – 1740.
10. Glynne - Jones R, Mawdsley S, Pearce T et al. Alternative clinical endpoints in Rectal cancer – are we getting closer? Ann Oncol 2006; 17(8): 1239 – 1248.
11. Thomas K. Weber. Preoperative chemoradiation for Rectal Cancer: „Apples and Pears, Tables and Chairs …“, Annals of Surgical Oncology 2002; 9 : 532 – 534.
12. Rödel C, Martus P, Papadopulos T et al. Prognostic Significance of Tumor Regression After Preoperative Chemoradiotherapy for Rectal Cancer. J Clini Oncol 2005; 23(34): 8688 – 8696.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2010 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Nové možnosti léčby glioblastoma multiforme
- Genetické testování a prevence hereditárních nádorů v MOÚ – více než desetiletá zkušenost
- Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
- Aktuálne problémy štruktúry a orientácie komplexných národných programov boja proti zhubným nádorom
- Problematika originálních léčiv, generických přípravků a biosimilars – záměny léků dnes a zítra s hlavním zacílením na rizika spojená s biotechnologiemi
- Hodnocení neoadjuvantní chemoradioterapie u lokálně pokročilého karcinomu rekta srovnáním objemu tumoru před léčbou a po léčbě
- Hormonálna antikoncepcia a jej vzťah k rakovine prsníka
- Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
- Analýza nákladů na cílenou biologickou léčbu pacientů s metastatickým karcinomem ledviny
- Maligní forma cystosarcoma phyllodes s metastázami do mozku
- Inflamatórne kožné metastázy ako prvý prejav progresie karcinómu pľúc – kazuistika
- Variabilita dávek melfalanu vztažených na kilogram tělesné hmotnosti a následky
- Zápis ze schůze výboru České onkologické společnosti dne 26. 10. 2010 ve FN Bulovka Praha
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové možnosti léčby glioblastoma multiforme
- Hormonálna antikoncepcia a jej vzťah k rakovine prsníka
- Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
- Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání