-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
18F ‑ FDG PET/ CT and 99mTc ‑ MIBI Scintigraphy in Evaluation of Patients with Multiple Myeloma and Monoclonal Gammopathy of Unknown Significance: Comparison of Methods
Backgrounds:
Newer imaging modalities, such as 18F ‑ FDG PET/ CT and 99mTc ‑ MIBI scintigraphy, have been recently introduced to assess the activity and extent of disease in patients with multiple myeloma (MM) and gammopathy of undetermined significance (MGUS). The aim of our study was to compare the impact of these imaging modalities in the evaluation of MM and MGUS patients.Materials and Methods:
A total of 101 patients with MM (81 patients) and MGUS (20 patients) were enrolled in the study (21 newly diagnosed and 44 relapsed patients with symptomatic MM, 16 with asymptomatic MM and 20 with MGUS). All patients were without therapy and underwent 18F ‑ FDG PET/ CT and 99mTc ‑ MIBI scintigraphy within a maximum interval of 14 days. The scans were classified as normal (N), diffuse (D), and focal or combined (F ‑ FD) pattern.Results:
There was no significant difference in the detection of newly diagnosed MM and relapsed patients between the compared methods. 18F ‑ FDG PET/ CT performed better than 99mTc ‑ MIBI scintigraphy in the detection of focal lesions (p < 0.039), whereas 99mTc ‑ MIBI scintigraphy was superior in the visualization of diffuse disease (p = 0.042). 18F ‑ FDG PET/ CT visualised significantly more focal lesions than 99mTc ‑ MIBI scintigraphy (p = 0.002), both generally in the cohort and when comparing the number of focal lesions per patient. Both the imaging modalities singly or in combination influenced the subsequent clinical management in 17% of patients. In our study, 18F ‑ FDG PET/ CT predicted asymptomatic MM and MGUS transformation into more aggressive forms with the necessity to start therapy more often than 99mTc ‑ MIBI scintigraphy.Conclusion:
18F ‑ FDG PET/ CT appeared to be a better imaging technique than 99mTc ‑ MIBI scintigraphy in the detection of focal lesions in patients with symptomatic MM. 99mTc ‑ MIBI was superior in the visualization of diffuse disease. On the other hand, despite its limited capacity in detecting focal lesions, 99mTc ‑ MIBI scintigraphy still remains the most rapid and inexpensive technique for whole ‑ body evaluation and may be an alternative option when a PET/ CT facility is not available.Key words:
multiple myeloma – monoclonal gammopathy of undetermined significance – Tc ‑ MIBI – scintigraphy – PET scan – CT scan – 18F ‑ FDG
Autoři: M. Mysliveček 2; J. Bačovský 1; V. Ščudla 1; P. Koranda 2; J. Minařík 1; E. Buriánková 2; R. Formánek 2; J. Zapletalová 3
Působiště autorů: III. interní klinika, FN a LF UP Olomouc 1; Klinika nukleární medicíny, FN a LF UP Olomouc 2; Ústav lékařské biofyziky, LF UP Olomouc 3
Vyšlo v časopise: Klin Onkol 2010; 23(5): 325-331
Kategorie: Původní práce
Souhrn
Východiska:
V nedávné době byly zavedeny ke zhodnocení aktivity a rozsahu onemocnění u pacientů s mnohočetným myelomem (MM) a monoklonální gamapatií nejistého významu (MGNV) novější zobrazovací modality: 18F ‑ FDG PET/ CT a 99mTc ‑ MIBI scintigrafie. Cílem naší práce bylo zhodnotit a srovnat přínos těchto metod v diagnostice MM a MGNV.Materiál a metody:
Do studie bylo zařazeno celkem 101 pacientů – 81 s MM a 20 s MGNV. Nemocní s MM byli rozděleni na skupiny s asymptomatickým (16) a symptomatickým (65) myelomem vyžadujícím léčbu. Ze skupiny pacientů se symptomatickým MM bylo 21 nově diagnostikovaných a 44 s podezřením na relaps. Všem pacientům byly provedeny 99mTc ‑ MIBI scintigrafie a 18F ‑ FDG PET/ CT. Časový odstup mezi oběma vyšetřeními nepřesahoval dva týdny. Výsledky obou vyšetření byly hodnoceny jako N (normální), D (difuzní) a F ‑ FD (ložiskové nebo kombinované ložiskové a difuzní).Výsledky:
Mezi oběma srovnávanými metodami nebyl v detekci nově diagnostikovaného MM a relapsu zaznamenán signifikantní rozdíl. 18F ‑ FDG PET/ CT detekovala s vyšší frekvencí než 99mTc ‑ MIBI scintigrafie F ‑ FD typ nálezu (p < 0,039), naopak 99mTc ‑ MIBI scintigrafie detekovala přesněji D typ nálezu (p = 0,042). 18F ‑ FDG PET/ CT vizualizovala signifikantně více fokálních lézí než 99mTc ‑ MIBI scintigrafie (p = 0,002), a to jak celkově v souboru, tak při srovnání počtu fokálních lézí na pacienta. Obě srovnávané metody samotné nebo v kombinaci ovlivnily terapeutický postup u 17 % pacientů. 18F ‑ FDG PET/ CT detekovala u více pacientů než 99mTc ‑ MIBI scintigrafie u asymptomatických MM a u pacientů s MGNV častěji přechod do agresivnějších forem choroby s nutností terapie.Závěr:
18F ‑ FDG PET/ CT vyšetření je díky kombinaci poskytovaných morfologických a funkčních informací a celotělovému charakteru vyšetření velmi cennou metodou v detekci fokálních lézí MM a jeví se jako vhodná metoda v primárním stážování choroby. 99mTc ‑ MIBI scintigrafie zůstává přes své limitace vedoucí k podhodnocování stadia MM nejdostupnější a relativně levnou celotělovou vyšetřovací metodou a je alternativní volbou zejména v případech, kdy 18F ‑ FDG PET/ CT vyšetření není k dispozici.Klíčová slova:
mnohočetný myelom – monoklonální gamapatie nejistého významu – Tc ‑ MIBI – scintigrafie – PET vyšetření – CT vyšetření – 18F ‑ FDGÚvod
Mnohočetný myelom (MM) je maligní hematologické onemocnění charakterizované proliferací klonálních plazmatických buněk a nadprodukcí monoklonálních imunoglobulinů [1,2]. Diagnóza a stážování MM jsou založeny na standardních kritériích zahrnujících mj. zhodnocení infiltrace kostní dřeně (KD) plazmatickými buňkami, detekci osteolytických lézí (OL) a detekci monoklonální komponenty v séru a moči [3,4].
V současné době je ke stážování nejčastěji používán Durie Salmon systém, který byl zaveden již v roce 1975 [3]. Podle tohoto systému jsou myelomové kostní léze detekovány celotělovým přehledným RTG vyšetřením. Je známo, že toto vyšetření může signifikantně podhodnocovat rozsah kostního postižení a postižení KD, a to zejména v časných fázích onemocnění [5]. Ke zlepšení neinvazivní diagnostiky, terapie a sledování pacientů s MM byly nedávno zavedeny novější zobrazovací modality zahrnující celotělovou 99mTc MIBI scintigrafii, hybridní pozitronovou emisní tomografii s použitím analogu glukózy značeného izotopem fluoru – 2 - [fluorin 18] fluoro 2-deoxy D glukózy kombinovanou s výpočetní tomografií (18F FDG PET/ CT) a magnetickou rezonanci (MR) [6,7]. Lipofilní kationt 99mTc MIBI je v diagnostice MM využíván zejména v hodnocení aktivity a rozsahu onemocnění jak při diagnostice, tak při sledování pacientů [8 – 21]. 18F FDG PET/ CT je celotělová zobrazovací modalita poskytující funkční i morfologické informace, která je v současnosti rutinně používána v diagnostice mnoha nádorů. Její význam v detekci kostních i mimokostních myelomových lézí potvrdila řada autorů [22 – 25]. MR umožňuje vysoce kontrastní a senzitivní vizualizaci kostní dřeně a jejích komponent a stala se metodou volby v zobrazování kostní dřeně [26,27].
V nedávné době byl navržen nový systém ke stážování MM nazvaný „Durie and Salmon PLUS“, který je založen na tradičním Durie Salmon systému, do kterého jsou integrovány 18F FDG PET/ CT a MR [6]. Tento systém přikládá oběma modalitám v detekci myelomového postižení páteře stejnou důležitost. Jejich relativní přínos, preference některé z nich ve specifickém klinickém kontextu a eventuální potřeba využití obou však nebyly autory blíže specifikovány [25]. 99mTc MIBI scintigrafie vykazovala v detekci aktivity a rozsahu MM v řadě studií vysokou senzitivitu a specificitu [28].
Cílem naší práce bylo zhodnotit přínos 18F FDG PET/ CT vyšetření v diagnostice pacientů s MM a monoklonální gamapatií nejistého významu (MGNV), srovnat výsledky této modality s celotělovou 99mTc MIBI scintigrafií a posoudit, zda přes opakovaně prokázanou užitečnost obou metod by mohla být 99mTc MIBI scintigrafie plně nahrazena 18F FDG PET/ CT vyšetřením.
Materiál a metodika
Do studie bylo zařazeno 101 pacientů, 81 s diagnózou MM a 20 s diagnózou MGNV.
Z 81 pacientů s MM vykazovalo 65 symptomatické onemocnění ve stadiu I, II a III a 16 pacientů bylo asymptomatických (stadium I). Ze skupiny 65 pacientů se symptomatickým MM bylo 21 nově diagnostikovaných (10 mužů, 11 žen, průměrný věk 63 let, rozmezí 34 – 77 let, 9 ve stadiu II a 12 ve stadiu III) a 44 pacientů s laboratorním a klinickým podezřením na relaps onemocnění (26 mužů, 18 žen, průměrný věk 63 let, rozmezí 43 – 80 let, 22 ve stadiu II a 22 ve stadiu III). Z 16 asymptomatických pacientů byli všichni ve stadiu I (7 mužů, 9 žen, průměrný věk 64 let, rozmezí 36 – 81 let).
Z 20 pacientů s diagnózou MGNV bylo 10 mužů a 10 žen, průměrný věk 61 let, rozmezí 39 – 76 let.
Žádný z pacientů nebyl v době vyšetření léčen. Diagnóza a stadium onemocnění byly stanoveny na základě standardních kritérií [4]. Všichni nemocní podstoupili přehledné RTG vyšetření skeletu, biopsii kostní dřeně se stanovením procenta plazmatické infiltrace (PB), indexu apoptózy PC AI/ CD138, proliferační aktivity plazmocytů PC PI/ CD138, dále byl stanoven paraprotein (MIG) v séru a v moči, C reaktivní protein (CRP), beta 2 - mikroglobulin v séru (B2M), tymidinkináza v séru (sTK), LDH, hemoglobin (HB), kalcium v séru (Ca), marker kostní resorpce (1CTP) a kostní novotvorby (P1CP).
Všichni pacienti byli vyšetřeni pomocí celotělového 18F FDG PET/ CT vyšetření a celotělové 99mTc MIBI scintigrafie doplněné celotělovou jednofotonovou emisní výpočetní tomografií (SPECT).
Pacienti se k celotělovému 18F FDG PET/ CT vyšetření dostavili lační (nejméně 6 hod) a byla jim změřena hladina krevní glukózy. Pokud glykemie nepřesahovala 8 mmol/ l, bylo pacientům nitrožilně podáno 400 MBq 18F FDG na 70 kg hmotnosti pacienta s přepočtem aplikované aktivity na hmotnost aktuální. 60 min po aplikaci radiofarmaka, perorálním podání roztoku kontrastní látky a těsně po vyprázdnění močového měchýře pacientem bylo zahájeno PET/ CT vyšetření na skeneru Biograph 16 HI REZ firmy Siemens. CT bylo prováděno po nitrožilní aplikaci neionické kontrastní látky. Snímání 18F FDG PET/ CT bylo prováděno typicky v rozsahu od vertexu lebky do poloviny bérců s připaženými horními končetinami. Data z PET vyšetření byla zpracována za použití iterativní rekonstrukce, transmisní korekce na zeslabení záření gama byla prováděna pomocí CT.
Celotělová 99mTc MIBI scintigrafie v přední a zadní projekci byla prováděna 10 min po i.v. aplikaci 800 MBq 99mTc MIBI na scintilační kameře E CAM, Siemens, se dvěma detektory vybavenými nízkoenergetickými paralelními kolimátory s vysokým rozlišením. Rychlost posunu vyšetřovacího lůžka byla 12 cm/ min, bylo použito matice 256 × 1 024, u všech pacientů byla dále provedena celotělová jednofotonová emisní tomografie (SPECT) s použitím iterativní rekonstrukce (8 subsetsů, 8 iterací, Gaussův filtr 5 mm FWHM).
18F FDG PET/ CT a 99mTc MIBI nálezybyly hodnoceny jako typy N, D a F FD. Jako typ N byly hodnoceny nálezy s fyziologickou distribucí 18F FDG a 99mTc MIBI, typ D vykazoval difuzní akumulaci radiofarmaka v kostní dřeni. Jako typ F byly hodnoceny nálezy v případě přítomnosti fokální akumulace 18F FDG a 99mTc MIBI v kostní dřeni nebo extramedulárně (F FD při kombinace obou předchozích typů).
Časový odstup 18F FDG PET/ CT a 99mTc MIBI scintigrafie nepřesahoval 2 týdny.
Nemocní podepsali informovaný souhlas s vyšetřením a s anonymním zpracováním dat o svém onemocnění.
Ke statistickému hodnocení byl pro srovnání typu nálezů obou prováděných vyšetření použit Fischerův exaktní test a pro srovnání počtu fokálních lézí neparametrický párový Wilcoxonův test. Za signifikantní byly považovány hodnoty p < 0,05.
Výsledky
Ve skupině 65 pacientů se symptomatickým MM nebyl v detekci MM a jeho relapsu prokázán statisticky významný rozdíl – N typ nálezu byl detekován u 14 pacientů (21,5 %) při 18F FDG PET/ CT vyšetření a u 19 pacientů (29,2 %) při 99mTc MIBI scintigrafii (p = 0,267). Statisticky významné rozdíly mezi oběma metodami však byly zaznamenány v detekci D a F FD nálezů. Zatímco 18F FDG PET/ CT detekovala F FD typ nálezu u 50 pacientů (76,9 %), 99mTc MIBI scintigrafie pouze u 34 pacientů (52,3 %, p = 0,039). D typ distribuce radiofarmaka v kostní dřeni byl při 18F FDG PET/ CT vyšetření nalezen pouze u jednoho pacienta (1,5 %), při 99mTc MIBI scintigrafii u 12 pacientů (18,5 %, p = 0,042, tab. 1).
Tab. 1. Srovnání typu nálezů <sup>18</sup>F-FDG PET/CT a <sup>99m</sup>Tc-MIBI scintigrafie ve skupině symptomatických MM pacientů (N = 65). 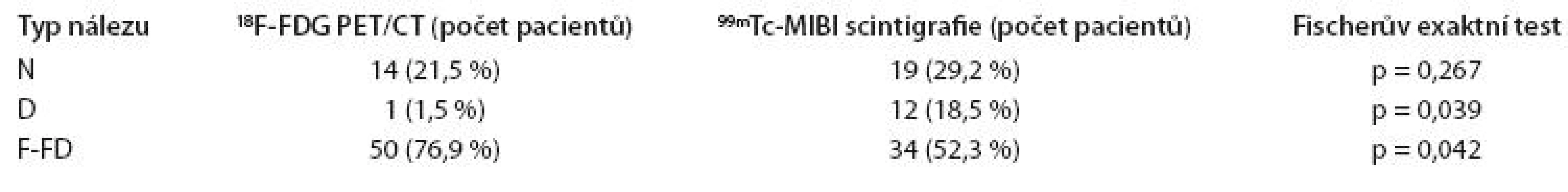
Při srovnání obou zobrazovacích modalit v detekci celkového počtu fokálních lézí ve skupině 65 symptomatických pacientů jich 18F FDG PET/ CT vizualizovala 614 včetně 46 s extramedulární lokalizací v měkkých tkáních, 99mTc MIBI scintigrafie pouze 285, z toho 10 lokalizovaných extramedulárně. Rozdíl mezi oběma metodami je statisticky významný (p = 0,002, tab. 2 a 3, obr. 1 – 5).
Tab. 2. Srovnání celkového počtu fokálních lézí detekovaných pomocí <sup>18</sup>F-FDG PET/CT a <sup>99m</sup>Tc-MIBI scintigrafie ve skupině symptomatických pacientů (N = 65). 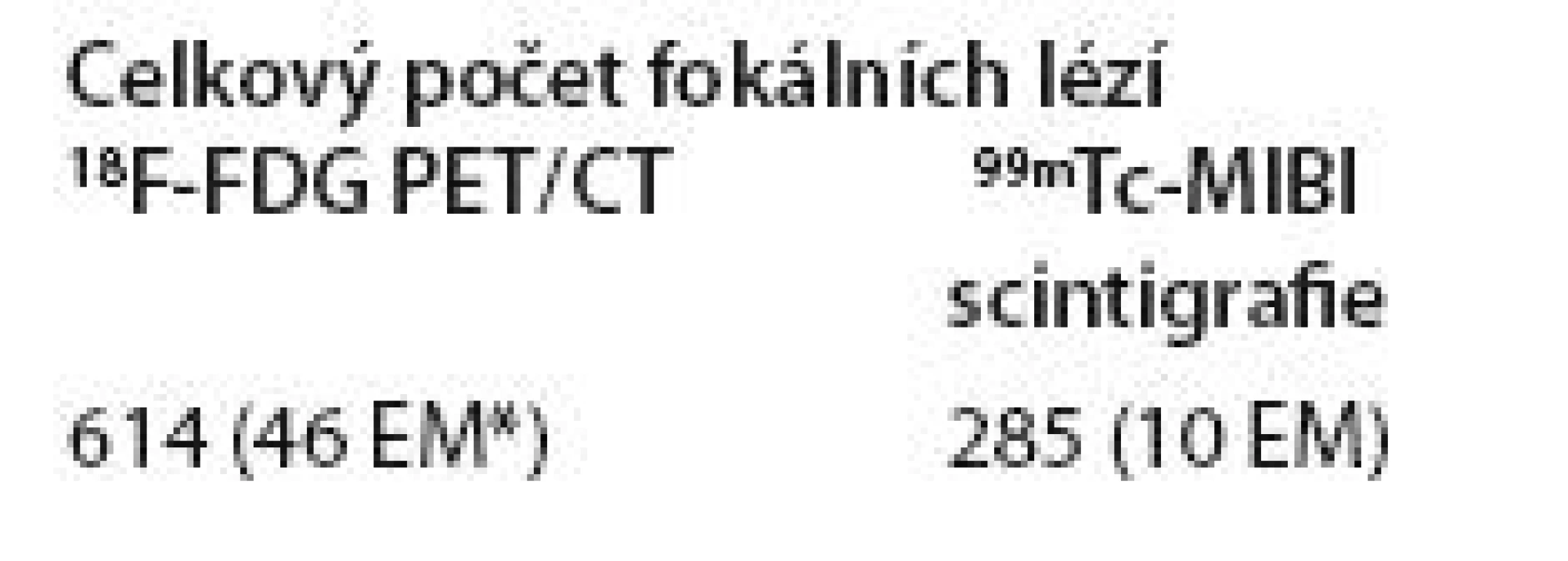
Tab. 3. Srovnání počtu fokálních lézí na pacienta detekovaných pomocí <sup>18</sup>F-FDG PET/CT a <sup>99m</sup>Tc-MIBI scintigrafie ve skupině symptomatických pacientů (N = 65). 
18F FDG PET/ CT a 99mTc MIBI scintigrafie ovlivnily v této skupině pacientů hodnocení stadia („upstage“) a terapeutický postup v 11 (17 %) případech a rozhodly o indikaci radioterapie a chemoterapie; 18F FDG PET/ CT vyšetření samotné nebo v kombinaci s 99mTc MIBI scintigrafií u 10 pacientů, 99mTc MIBI scintigrafie samotná u jednoho pacienta.
Obr. 1. Nově diagnostikovaný mnohočetný myelom ve stadiu III. <sup>18</sup>F-FDG PET/CT vyšetření – MIP obraz – „maximum intenzity projection“ (a) a celotělová <sup>99m</sup>Tc-MIBI scintigrafie (b). Na obrazu MIP lze diferencovat vícečetná ložiska hypermetabolizmu glukózy v oblasti hrudníku, páteře a pánve, při <sup>99m</sup>Tc-MIBI scintigrafii je počet fokálních lézí evidentně nižší. 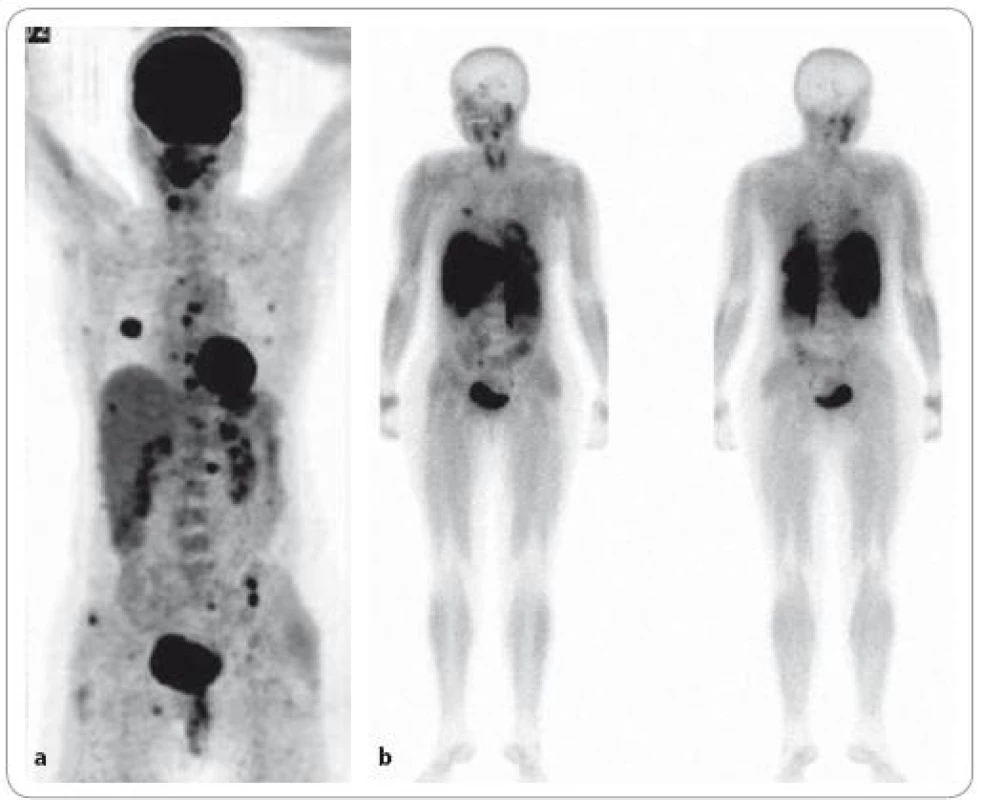
Obr. 2. Mnohočetný myelom ve stadiu III, suspektní relaps. Na celotělových <sup>99m</sup>Tc-MIBI scintigramech neprokazána patologická akumulace radiofarmaka v kostní dřeni ani extramedulárně. Relaps neprokázán. 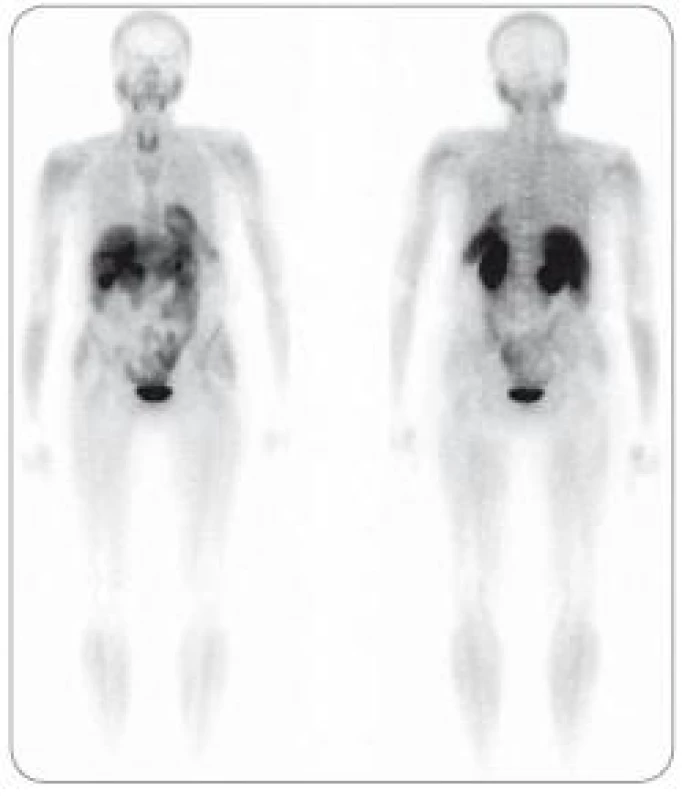
Obr. 3. Mnohočetný myelom ve stadiu III, suspektní relaps – stejný pacient jako na obr. 2. Při <sup>18</sup>F-FDG PET/CT je patrné ložisko zvýšené konzumpce glukózy v lopatě levé kosti kyčelní, na CT osteoporóza. Další ložisko je lokalizováno v 11. žebru paravertebrálně vpravo, kde je na CT fraktura. Zvýšená akumulace FDG ve frakturách bývá obvyklým nálezem, a nádorovou tkáň zde tedy nelze vyloučit ani potvrdit. Nález v levé kyčelní kosti však byl hodnocen jako ložisko viabilní nádorové tkáně a byla zahájena chemoterapie. 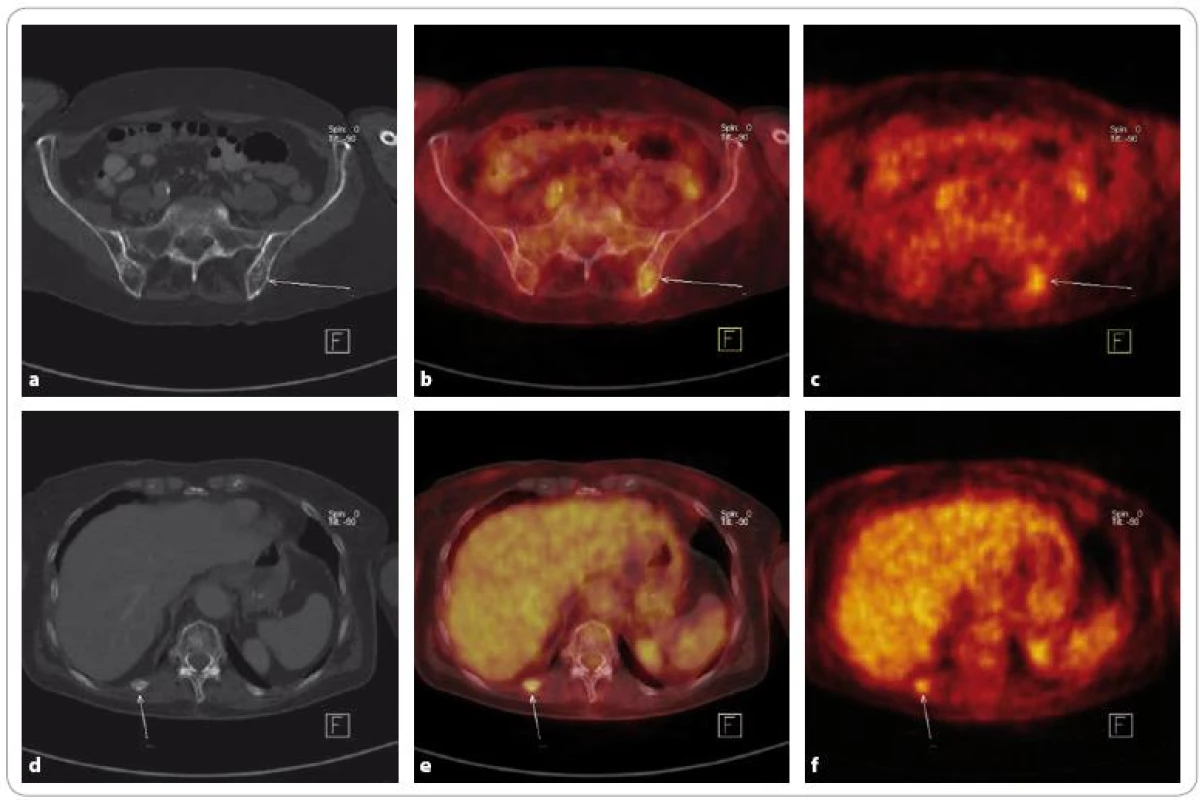
Obr. 4. Celotělová <sup>99m</sup>Tc-MIBI scintigrafie u pacienta se solitárním plazmocytomem levého femuru s osteolýzou, progrese do mnohočetného myelomu. Patologická akumulace radiofarmaka ložiskového typu je patrná v oblasti apexu levé plíce. K bližší anatomické lokalizaci a ke vztahu léze k okolním strukturám se nelze při tomto funkčním vyšetření vyjádřit. 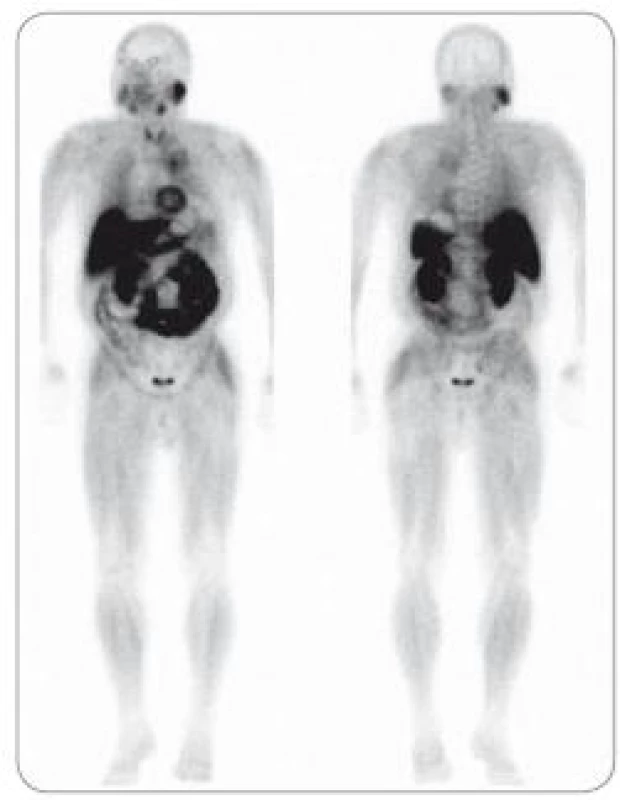
Obr. 5. <sup>18</sup>F-FDG PET/CT u stejného nemocného jako na obr. 4. Lze diferencovat objemnou měkkotkáňovou masu v apexu levé plíce se supraklavikulárním zásahem vykazující zvýšenou akumulaci FDG a centrální fotopenii odpovídající patrně nekróze. Dále osteolýza ventrálního konce 1. žebra vlevo. Laterálně je patrná zvýšená konzumpce glukózy v axilární lymfatické uzlině. Ve srovnání s <sup>99m</sup>Tc-MIBI scintigrafií (obr. 4) bylo <sup>18</sup>F-FDG PET/CT vyšetření přínosnější. 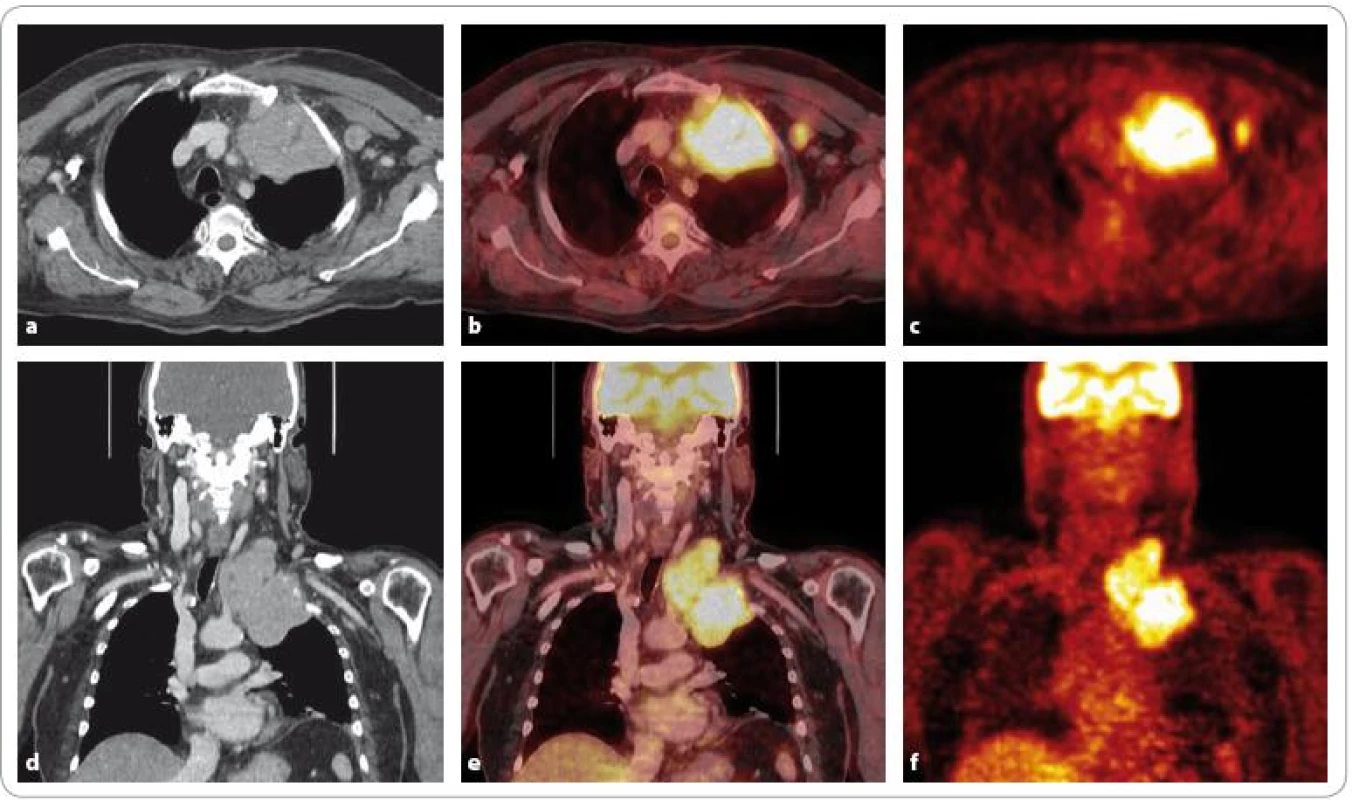
Při srovnání výsledků obou zobrazovacích modalit ve skupině 16 pacientů s asymptomatickým MM (stadium I) bez nutnosti terapie (tab. 4) byl detekován N typ nálezu při 18F FDG PET/ CT vyšetření u 13 a při 99mTc MIBI scintigrafii u 15 pacientů. 18F FDG PET/ CT zaznamenala přechod do agresivnější formy MM s nutností zahájit léčbu u 3 pacientů (u jednoho D typ a u dvou F FD typ nálezu), zatímco 99mTc MIBI scintigrafie totéž zaznamenala u jednoho pacienta (D typ scintigramu).
Tab. 4. Srovnání výsledků <sup>18</sup>F-FDG PET/CT a <sup>99m</sup>Tc-MIBI scintigrafie ve skupině asymptomatických pacientů s MM (st. I) bez nutnosti léčby (n = 16). 
Ve skupině 20 pacientů s MGNV (tab. 5) jsme našli podobný nález jako u předchozí skupiny asymptomatických myelomů – 18F FDG PET/ CT vyšetření zjistilo přechod MGNV do MM s nutností léčby u 3 pacientů (F FD typ nálezu), 99mTc MIBI scintigrafie tuto transformaci detekovala u jednoho pacienta (D typ scintigramu).
Tab. 5. Srovnání výsledků <sup>18</sup>F-FDG PET/CT a <sup>99m</sup>Tc-MIBI scintigrafie ve skupině pacientů s MGNV (n = 20). 
Diskuze
Tak jako v ostatních podobných studiích, ani v tomto hodnocení nebyly všechny patologické nálezy při 18F FDG PET/ CT a 99mTc MIBI scintigrafii potvrzovány cytologickým či histologickým vyšetřením, protože takový postup by nebyl z etického ani medicínského hlediska přijatelný ani technicky možný. Naše nálezy získané při těchto vyšetřeních byly interpretovány ve vztahu ke klinickému a laboratornímu kontextu a analyzovány zejména z hlediska simultánního srovnání dvou zobrazovacích modalit. Předchozí studie navíc ukázaly, že přehledné RTG vyšetření skeletu, které je zahrnuto do systému stážování podle Durie Salmona k detekci osteolytických ložisek, může signifikantně podhodnocovat postižení kostí a kostní dřeně, zejména u nově diagnostikovaných pacientů [5]. Proto u tohoto onemocnění nelze výsledky zobrazovacích modalit srovnávat s jednoznačným „zlatým standardem“.
Z výsledků naší práce je zřejmé, že při srovnání 18F FDG PET/ CT a 99mTc MIBI scintigrafie nebyl zjištěn statisticky významný rozdíl v četnosti nově diagnostikovaných MM ani v průkazu jejich relapsu.
18F FDG PET/ CT však detekovala ve skupině symptomatických MM s významně vyšší přesností ložiskové léze. Tato skutečnost může souviset s mechanizmem 18F FDG akumulace, který reflektuje zvýšenou glykolýzu obvyklou v nádorových buňkách, jejich rychlý růst a invazivní charakter [10,25,29]. S nádorovou proliferací bývají také často spojeny zánětlivé změny, které mohou rovněž přispívat ke zvýšené akumulaci glukózy. Hybridní systém navíc umožňuje fúzi obrazů získaných při PET a CT a dovoluje detekci malých nebo jen lehce aktivních ložisek, která by byla jen stěží rozpoznatelná od okolní normální tkáně na základě PET vyšetření samotného [30]. Hybridní systém také umožňuje preciznější anatomickou lokalizaci hypermetabolických lézí a z toho plynoucí lepší diferenciaci kostních a měkkotkáňových ložisek [22,24]. V naší práci detekovala 18F FDG PET/ CT 46 měkkotkáňových extramedulárních ložisek, 99mTc MIBI scintigrafie pouze 10 z nich, a to i přes použití SPECT, která zlepšuje prostorové rozlišení. Rozlišovací schopnost použitého PET skeneru se při klinických vyšetřeních pohybuje okolo 7 mm, 99mTc MIBI scintigrafie je schopna detekovat většinou pouze ložiska přesahující velikost 10 mm. K horší detekci fokálních lézí při 99mTc MIBI scintigrafii přispívá rovněž fakt, že v oblasti páteře (zejména v dolním Th, L a S úsecích) a pánve je vysoká akumulace 99mTc MIBI, způsobená fyziologickou exkrecí tohoto radiofarmaka žlučovými cestami do střeva, která může patologická ložiska ve zmíněných úsecích skeletu překrývat [15,25]. Naopak v detekci aktivních osteolytických lézí kalvy > 10 mm může být přesnější metodou 99mTc MIBI scintigrafie. Vysoká fyziologická akumulace 18F FDG v mozku totiž může v některých případech jejich vizualizaci zhoršit (obr. 6a, b).
Obr. 6. Na <sup>99m</sup>Tc-MIBI scintigramu hlavy (a) lze dobře diferencovat ložisko patologické akumulace radiofarmaka v kalvě frontálně. Při <sup>18</sup>F-FDG PET vyšetření téhož pacienta (b) není ložisko dobře patrné kvůli vysoké fyziologické akumulaci FDG v mozkové tkáni. Při FDG-PET vyšetření by mohlo toto ložisko uniknout detekci. 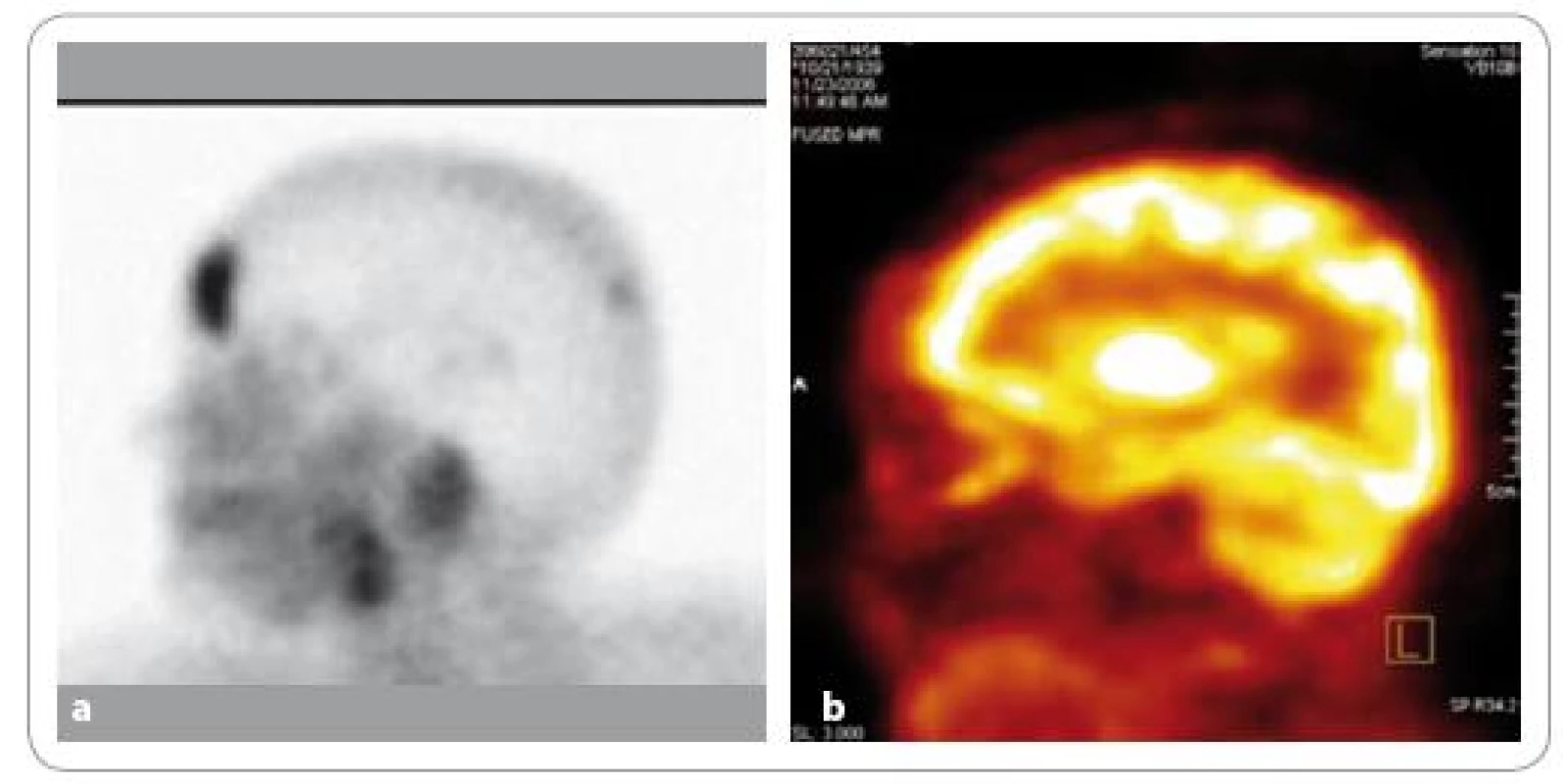
99mTc MIBI scintigrafie byla v našem souboru statisticky významně přesnější než 18F FDG PET/ CT vyšetření v detekci difuzního myelomového postižení kostní dřeně. Význam difuzní akumulace 18F FDG v kostní dřeni není v současné době zcela jasný, protože mírná difuzní akumulace 18F FDG v této lokalizaci bývá nacházena u mladých nebo anemických pacientů bez přítomnosti MM. K objasnění této otázky je potřeba dalších studií [28,29]. Předchozí práce již prokázaly, že difuzní akumulace 99mTc MIBI v kostní dřeni koreluje s procentem její infiltrace plazmatickými buňkami a množstvím monoklonální komponenty [13,15]. Navíc bylo prokázáno, že akumulace 99mTc MIBI v kostní dřeni identifikuje aktivní MM a že rozsah a stupeň této akumulace koreluje s klinickým stavem a stadiem onemocnění [13]. Akumulace tohoto radiofarmaka nízkého stupně se však může vyskytovat i u pacientů s přítomností jiné patologie než MM a v určité míře i fyziologicky [31]. Pokud byl stupeň difuzní akumulace 99mTc MIBI analyzován podle kritérií navržených autory Pace et al [10], specificita tohoto nálezu se signifikantně zvýšila [17].
18F FDG PET/ CT a 99mTc MIBI scintigrafie ovlivnily ve skupině se symptomatickým MM u 11 (17 %) pacientů hodnocení stadia („upstage“) a vedly ke změně terapeutického postupu (indikace radioterapie a chemoterapie): 18F FDG PET/ CT vyšetření samotné nebo v kombinaci s 99mTc MIBI scintigrafií u 10 pacientů, 99mTc MIBI scintigrafie samotná u 1 pacienta. Fonti et al [25] ve své studii zaznamenali tuto skutečnost u 18 % pacientů.
18F FDG PET/ CT přispěla k časné detekci transformace asymptomatických forem choroby (MGNV, MM stadium I) ve formy agresivnější s nutností terapie u více pacientů než 99mTc MIBI scintigrafie. Vzhledem k jen malému počtu pacientů však nelze z těchto výsledků činit jednoznačné závěry. U většiny pacientů této skupiny nevykazovaly obě srovnávané modality patologické nálezy. V několika studiích [8,28,32] však autoři dospěli k odlišným závěrům – možnost predikce transformace MGNV do aktivního myelomu pomocí 99mTc MIBI scintigrafie neprokázali a nepovažují tuto modalitu, zejména pak u MGNV, za užitečnou.
18F FDG PET/ CT a 99mTc MIBI scintigrafie jsou užitečné diagnostické zobrazovací modality v detekci MM. Nedávná rozsáhlá studie NOPR (National Oncologic PET Registry) [33] zaměřená na relativní přínos 18F FDG PET vyšetření pro pacienty s 18 různými typy známých karcinomů v iniciálním stážování, restážování a při podezření na relaps zjistila, že pokud byla zamýšlená rozhodování lékařů klasifikována, zda zahájit terapii, nebo ponechat pacienty bez terapie, byl na základě použití 18F FDG PET vyšetření záměr změněn u MM téměř ve 49 %.
Z výsledků naší práce je zřejmé, že 18F FDG PET/ CT se jeví jako vhodná metoda v primárním stážování (Durie and Salmon PLUS) i v detekci relapsu onemocnění. 99mTc MIBI scintigrafie zůstává přes limitace vedoucí v detekci medulárních i extramedulárních fokálních lézí k podhodnocování stadia MM nejdostupnější a relativně levnou celotělovou vyšetřovací metodou a představuje i nadále alternativní volbu zejména v případech, kdy 18F FDG PET/ CT vyšetření není dostupné.
Závěry
V naší práci jsme hodnotili a srovnávali přínos dvou novějších zobrazovacích modalit – 18F FDG PET/ CT a 99mTc MIBI scintigrafie – v diagnostice pacientů s MM a monoklonální gamapatií nejistého významu (MGNV).
18F FDG PET/ CT vyšetření je díky kombinaci poskytovaných morfologických a funkčních informací a celotělovému charakteru velmi cennou metodou v detekci medulárních a extramedulárních lézí, aktivity a určení rozsahu MM a jeví se jako vhodná metoda v primárním stážování choroby (Durie and Salmon PLUS).
99mTc MIBI scintigrafie zůstává přes své limitace vedoucí k podhodnocování stadia MM nejdostupnější a relativně levnou celotělovou vyšetřovací metodou a představuje i nadále alternativní volbu zejména v případech, kdy 18F FDG PET/ CT vyšetření není k dispozici.
Podpořeno grantem IGA MZ ČR č. NR 9489-3.
This work was supported by the grant No. IGA MZ ČR č. NR 9489-3.Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.doc. MUDr. Miroslav Mysliveček, Ph.D.
Klinika nukleární medicíny
FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: miroslav.myslivecek@fnol.cz
Zdroje
1. Hallek M, Bergsagel PL, Anderson KC et al. Multiple myeloma: increasing evidence for a multistep transformation process. Blood 1998; 91(1): 3 – 21.
2. Klein B, Bataille R. Cytokine network in human multiple myeloma. Hematol Oncol Clin North Am 1992; 6(2): 273 – 284.
3. Angtuaco EJ, Fassas AB, Walker R et al. Multiple myeloma: clinical review and diagnostic imaging. Radiology 2004; 231(1): 11 – 23.
4. Durie BG, Salmon SE. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment and survival. Cancer 1975; 36(3): 842 – 854.
5. Durie BG, Waxman AD, D’Agnolo A et al. Whole ‑ body 18F ‑ FDG PET identifies high‑risk myeloma. J Nucl Med 2002; 43(11): 1457 – 1463.
6. Durie BG. The role of anatomic and functional staging in myeloma: description of Durie/ Salmon plus staging system. Eur J Cancer 2006; 42(11): 1539 – 1543.
7. D’Sa S, Abildgaard N, Tighe J et al. Guidelines for the use of imaging in the management of myeloma. Br J Haematol 2007; 137(1): 49 – 63.
8. Tirovola EB, Biassoni L, Britton KE et al. The use of 99mTc ‑ MIBI scanning in multiple myeloma. Br J Cancer 1996; 74(11): 1815 – 1820.
9. el ‑ Shirbiny AM, Yeung H, Imbriaco M et al. Technetium ‑ 99m ‑ MIBI versus fluorine ‑ 18 - FDG in diffuse multiple myeloma. J Nucl Med 1997; 38(8): 1208 – 1210.
10. Pace L, Catalano L, Pinto A et al. Different patterns of technetium ‑ 99m sestamibi uptake in multiple myeloma. Eur J Nucl Med 1998; 25(7): 714 – 720.
11. Catalano L, Pace L, Califano C et al. Detection of focal myeloma lesions by technetium‑99m ‑ sestamibi scintigraphy. Haematologica 1999; 84(2): 119 – 124.
12. Fonti R, Del Vecchio S, Zannetti et al. Bone marrow uptake of 99mTc ‑ MIBI in patients with multiple myeloma. Eur J Nucl Med 2001; 28(2): 214 – 220.
13. Mileshkin L, Blum R, Seymour JF et al. A comparison of fluorine‑18fluoro‑deoxyglucose PET and technetium ‑ 99m sestamibi in assessing patients with multiple myeloma. Eur J Haematol 2004; 72(1): 32 – 37.
14. Pace L, Catalano L, Del Vecchio S et al. Washout of (99mTc) sestamibi in predicting response to chemotherapy in patients with multiple myeloma. Q J Nucl Med Mol Imaging 2005; 49(3): 281 – 285.
15. Hung GU, Tsai CC, Tsai SC et al. Comparison of Tc ‑ 99m sestamibi and F ‑ 18 FDG PET in the assessment of multiple myeloma. Anticancer Res 2005; 25(6C): 4737 – 4741.
16. Martín MG, Romero Colás MS, Dourdil Sahún MV et al. Baseline Tc ‑ 99 - MIBI scanning predicts survival in multiple myeloma and helps to differentiate this disease from monoclonal gammopathy of unknown significance. Haematologica 2005; 90(8): 1141 – 1143.
17. Nandurkar D, Kalff V, Turlakow A et al. Focal MIBI uptake is better indicator of active myeloma than diffuse uptake. Eur J Haematol 2006; 76(2): 141 – 146.
18. Mele A, Offidani M, Visani G et al. Technetium ‑ 99m sestamibi scintigraphy is sensitive and specific for the staging and the follow‑up of patients with multiple myeloma: a multicentre study on 397 scans. Br J Haematol 2007; 136(5): 729 – 735.
19. Erten N, Saka B, Berberoglu K et al. Technetium ‑ 99m 2-methoxy ‑ isobutyl ‑ isonitrile uptake scintigraphy in detection of bone marrow infiltration in multiple myeloma: correlation with MRI and other prognostic factors. Ann Haematol 2007; 86(11): 805 – 813.
20. Mysliveček M, Bačovský J, Kamínek M et al. Scintigrafie pomocí 99mTc ‑ MIBI v diagnostice mnohočetného myelomu: senzitivní ukazatel biologické aktivity choroby. Klin Onkol 2004; 17(1): 13 – 17.
21. Mysliveček M, Bačovský J, Kamínek M et al. Prediktivní cena 99mTc ‑ MIBI scintigrafie u nemocných s mnohočetným myelomem a potenciální úloha metody při jejich sledování po terapii. Klin Onkol 2005; 18(2): 46 – 50.
22. Zamagni E, Nanni C, Patriarca F et al. A prospective comparison of 18F ‑ fluorodeoxyglucose positron emission tomography – computed tomography, magnetic resonance imaging and whole-body planar radiographs in assessment of bone disease in newly diagnosed multiple myeloma. Haematologica 2007; 92(1): 50 – 55.
23. Mulligan ME, Badros AZ. PET/ CT and MR imaging in myeloma. Skeletal Radiol 2007; 36(1): 5 – 16.
24. Breyer RJ 3rd, Mulligan ME, Smith SE et al. Comparison of imaging with FDG PET/ CT with other imaging modalities in myeloma. Skeletal Radiol 2006; 35(9): 632 – 640.
25. Fonti R, Salvatore B, Quarantelli M et al. 18F ‑ FDG PET/ CT, 99mTc ‑ MIBI, and MRI in evaluation of patients with multiple myeloma. J Nucl Med 2008; 49(2): 195 – 200.
26. Schmidt GP, Schoenberg SO, Reiser MF et al. Whole ‑ body MR imaging of bone marrow. Eur J Radiol 2005; 55(1): 33 – 40.
27. Lucignani G. Bone and marrow imaging: do we know what we see and do we see what we want to know? Eur J Nucl Med Mol Imaging 2007; 34(7): 1123 – 1126.
28. Villa G, Balleari E, Carletto M et al. Staging and therapy monitoring of multiple myeloma by 99mTc ‑ MIBI scintigraphy: a five year single center experience. J Exp Clin Cancer Res 2005; 24(3): 355 – 361.
29. Bredella MA, Steinbach L, Caputo G et al. Value of FDG PET in the assessment of patients with multiple myeloma. AJR Am J Roentgenol 2005; 184(4): 1199 – 1204.
30. Nanni C, Zamagni E, Farsad M et al. Role of 18F ‑ FDG PET/ CT in the assessment of bone involvement in newly diagnosed multiple myeloma: preliminary results. Eur J Nucl Med Mol Imaging 2006; 33(5): 525 – 531.
31. Wakasugi S, Noguti A, Katuda T et al. Potential of (99m)Tc - MIBI for detecting bone marrow metastases. J Nucl Med 2002; 43(5): 596 – 602.
32. Giovanella L, Taborelli M, Ceriani L et al. 99mTc ‑ sestamibi imaging and bone marrow karyotyping in the assessment of multiple myeloma and MGUS. Nucl Med Commun 2008; 29(6): 535 – 541.
33. Hillner BE, Siegel AF, Liu D et al. Relationship between cancer type and impact of PET and PET/ CT on intended management: findings of the National Oncologic PET Registry. J Nucl Med 2008; 49(12): 1928 – 1935.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2010 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Detekcia hypermetylácie DNA ako potenciálny biomarker pre karcinóm prostaty
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Role membránových transportérů v chemorezistenci karcinomu pankreatu při terapii gemcitabinem
- Incidence a mortalita nádorových onemocnění v České republice
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
- Léčebné výsledky pacientů léčených v letech 1980– 2004 na jediném pracovišti pro nefroblastom
- České programy screeningu zhoubných nádorů v roce 2010
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- Kazuistika pacientky s triple negativním karcinomem prsu, která při léčbě paklitaxelem a bevacizumabem dosáhla kompletní remise plicního, uzlinového a kostního metastatického postižení
- Klinický registr TARCEVA
- Gefitinib v monoterapii u nemocných s pokročilým NSCLC nesoucím aktivující mutaci EGFR zlepšuje významně léčebné výsledky oproti standardní chemoterapii – aktualita z klinické praxe
- Profesor Koutecký osmdesátiletý
- Zápis ze schůze výboru České onkologické společnosti dne 21. 9. 2010 v Liberci
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



