-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Evropský kongres chronického srdečního selhání a Světový kongres akutního srdečního selhání – Atény 2019
Autoři: Špinar J. 1; Špinarová L. 2; Vítovec J. 2
Působiště autorů: Lékařská fakulta MU Brno 1; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2019, 21(2): 90-94
Ve dnech 25.–28. 5. 2019 se v Aténách uskutečnil Evropský kongres chronického srdečního selhání a Světový kongres akutního srdečního selhání. Při zahájení prezident Evropské asociace srdečního selhání prof. Petar M. Seferovič oznámil, že k zahájení sjezdu bylo registrováno 5 400 účastníků, v průběhu sjezdu pak počet účastníků dosáhl k 6 000.
Velmi dobrá byla i aktivní účast českých kardiologů. Z více než padesátky českých lékařů měly výrazné zastoupení IKEM Praha (8 prezentací), FN u sv. Anny v Brně (5 účastníků, z toho 1 přednáška), FN Hradec Králové (2, vč. 1 přednášky), Nemocnice na Homolce (2), FN Brno (2), 1. LF UK Praha (1), FN Olomouc (1). Celkem 21 prezentací.
Současně s kongresem se na webových stránkách ESC objevil článek Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management: An expert consensus meeting report of The HFA of the ESC, tedy dá se říci inovace Evropských doporučení pro diagnostiku a léčbu srdečního selhání (SS), o kterém přinášíme samostatnou informaci a zkrácená verze jak v angličtině, tak češtině bude publikována v Cor et Vasa.
Nosná témata kongresu lze rozdělit do několika oblastí:
- sacubitril valsartan,
- SGLT2 a nová perorální antidiabetika,
- nové léky na srdeční selhání,
- neurohumorální aktivace,
- HFpEF a HFmrEF, tedy srdeční selhání se zachovanou a tzv. mid range ejekční frakcí.
Sacubitril valsartan
Přednášky o sacubitril valsartanu samozřejmě vždy začínaly informací o studii PARADIGM-HF, která byla publikována již v roce 2014. Duální antagonista receptorů AT1 pro angiotenzin II (ARB) a neprilysinu s generickým názvem sacubitril valsartan (dříve LCZ 696 nebo také angiotenzin receptor blocker and neprilysin inhibitor – ARNI) byl klinicky ověřován pro léčbu hypertenze a srdečního selhání. Mechanizmus účinku je v blokádě receptorů AT1 valsartanem v kombinaci s blokádou rozpadů vazodilatačních natriuretických peptidů, a tím intenzifikované vazodilatace. Klinická studie PARADIGM-HF u nemocných se sníženou ejekční frakcí a vysokými hodnotami natriuretických peptidů byla předčasně ukončena pro příznivý vliv LCZ 696 ve srovnání s enalaprilem jak na mortalitu, tak na hospitalizace. Kardiovaskulární (KV) mortalita byla snížena o 20 %, první hospitalizace pro srdeční selhání o 21 %.
Další nosnou informací byly studie u akutního SS. Studie TRANSITION byla prospektivní, multicentrická, randomizovaná, open-label, parallel-group studie, porovnávající nasazení sacubitril valsartanu u pacientů hospitalizovaných pro akutní dekompenzaci SS se sníženou ejekční frakcí (heart failure with reduced ejection fraction – HFrEF) po hemodynamické stabilizaci ještě za hospitalizace nebo krátce po propuštění. Celkem bylo randomizováno 893 pacientů, kteří byli starší, s těžšími příznaky a více komorbiditami oproti pacientům ve studii PARADIGM-HF. U 29 % pacientů se jednalo o prvozáchyt SS, 24 % neužívalo při vstupu do studie ACEI/ ARB. Pacienti nesměli dostávat i.v. inotropika a vazodilatancia s výjimkou nitrátu. Před zahájením sacubitril valsartanu museli být alespoň 24 hod bez i.v. diuretik, posledních 6 hod se systolickým krevním tlakem ≥ 110 mm Hg. Mezi oběma větvemi (nasazení sacubitril valsartanu za hospitalizace nebo do 14 dní po propuštění) nebyl významný rozdíl ve sledovaných cílech (podíl pacientů s dosaženou cílovou dávkou sacubitril valsartanu v 10. týdnu, podíl pacientů s dosažením a udržením střední a maximální, resp. jakékoli dávky mezi 8.–10. týdnem). Nebyl rozdíl ani v četnosti vysazení pro nežádoucí účinky. Při analýze biomarkerů došlo v obou větvích po nasazení sacubitril valsartanu k významnému poklesu NT-proBNP i hs-TnT. Studie TRANSITION ukázala, že u pacientů s chronickým HFrEF hospitalizovaných pro akutní dekompenzaci, je zahájení léčby sacubitril valsartanem po hemodynamické stabilizaci ještě za hospitalizace či bezprostředně po propuštění, vč. následné titrace dávky, možné a dobře tolerované. Studie PIONEER-HF byla 12týdenní, prospektivní, multicentrická, randomizovaná, dvojitě zaslepená, aktivně kontrolovaná studie, jejímž cílem bylo zhodnotit účinnost a bezpečnost sacubitril valsartanu ve srovnání s enalaprilem u 881 dospělých pacientů, hospitalizovaných pro akutní dekompenzaci HFrEF. Celkem 52 % pacientů před vstupem do studie neužívalo ACEI/ ARB. Ke studijní léčbě byli pacienti randomizováni ještě za hospitalizace (medián 68 hod od přijetí) po vstupní hemodynamické stabilizaci (TKs ≥ 100 mm Hg bez symptomatické hypotenze v posledních 6 hod, bez i.v. inotropik v posledních 24 hod, bez i.v. vazodilatační léčby a bez navýšení dávky i.v. diuretik v posledních 6 hod). Primární endpoint, pokles hladiny NT-proBNP oproti vstupní hodnotě, byl statisticky významně lepší u sacubitril valsartanu (p < 0,001). V bezpečnostních parametrech (zhoršení renálních funkcí, hypotenze, hyperkalemie, angioedém) nebyl mezi léčebnými větvemi významný rozdíl. K explorativním cílům patřil složený cíl (úmrtí, rehospitalizace pro SS, implantace levostranné oběhové podpory, zařazení na waiting-list k transplantaci srdce), který byl významně redukován u sacubitril valsartanu (46 %; p = 0,001), a to převážně díky poklesu počtu rehospitalizací pro SS a úmrtí. Po 8 týdnech dvojitě zaslepené léčby následovaly další 4 týdny, kdy všichni pacienti užívali open-label sacubitril valsartan. Došlo k poklesu NT-proBNP v původně enalaprilové větvi, rozdíl v klinicky významném explorativním endpointu mezi oběma větvemi zůstal nadále významný. Studie PIONEER-HF prokázala, že zahájení léčby sacubitril valsartanem u pacientů hemodynamicky stabilizovaných po akutní dekompenzaci SS ještě za hospitalizace je bezpečné a vede ke snížení rehospitalizací.
Probíhá studie PARAGON-HF u SS se zachovanou ejekční frakcí (heart failure with preserved ejection fraction – HFpEF). Výsledky této studie se očekávají na kongresu Evropské kardiologické společnosti (ESC) v Paříži na konci srpna letošního roku. Studie probíhala i v ČR a národním koordinátorem byl prof. MU Dr. Jiří Widimský, CSc. Pokud se splní předpoklady (a zatím neoficiální informace tomu odpovídají), tak bychom mohli mít první lék s prokázanou účinností na morbiditu a mortalitu u nemocných se HFpEF.
SGLT2 a nová perorální antidiabetika
Již v roce 2008 Americký úřad pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) vyhlásil, že KV bezpečnost po perorálních antidabeticích je významnější cíl než snížení glykemie, což byl začátek pro rozsáhlý program klinických studií s perorálními antidiabetiky a KV cíly. V roce 2016 pak doporučení pro KV prevenci a pro SS zdůrazňují především pozitivní KV účinky SGLT2 inhibitorů, které mají indikaci IIa. V roce 2018 byly prezentovány dva významné dokumenty ESC, tzv. position statement, o nových antidiabeticích a KV onemocněních obecně a speciálně o ovlivnění SS. V listopadu 2018 byla prezentována studie DECLARE, která potvrzuje významné postavení SGLT2 u nemocných se SS. V průběhu sjezdu byl na internetu zveřejněn další position statement ESC Clinical practice update on heart failure 2019.
V popředí jsou především tři lékové skupiny – GLP-1 agonisté, DPP4 inhibitory a především SGLT2 inhibitory, které mají první pozitivní data u nemocných s diabetes mellitus 2. typu (DM2) v primární i sekundární prevenci. Nezastupitelným stále zůstává metformin.
Pacienti s DM2 a post ischemickým srdečním onemocněním (ICHS) mají vysokou pravděpodobnost recidiv KV příhod. Ve srovnání s ICHS bez diabetu je riziko 1,7× vyšší. Udává se, že DM2 je dokonce významnější rizikový faktor, než vlastní nález na koronarografii. Proto je základem léčby DM2 právě snížení rizika KV příhod. ESC doporučuje snížení glykovaného hemoglobinu < 7 % (70 mmol/ mol) u všech nemocných s prokázanou ICHS. Doporučení České diabetologické společnosti vycházejí ze závěrů několika rozsáhlých klinických studií a jsou poměrně přísná. Podle nich by hladina glykovaného hemoglobinu neměla přesahovat 45 mmol/ mol u pacientů bez vážnějších přidružených komplikací. Ze studií totiž vyplývá, že jen při takto dobře léčeném diabetu je jen malé riziko rozvoje mikro - a makrovaskulárních komplikací. Vzhledem k riziku hypoglykemií, které u starších a více nemocných osob mohou být nebezpečné, je ale v praxi vhodné z takto přísných požadavků do určité míry slevit. Zejména u osob staršího věku a pacientů s významným KV onemocněním proto vyhovují hodnoty do 60 mmol/ mol.
Autoři evropských doporučení rozdělují klinické studie s perorálními antidiabetiky u SS na negativní, neutrální a pozitivní. Většina doporučení pro léčbu DM2 na prvním místě u nemocných se SS zdůrazňují metformin, naopak sulfonylurea je na ústupu. DPP4 a GLP-1 mají neutrální, někdy dokonce mírně negativní účinek na SS, proto se názory na tyto lékové skupiny různí. Thiazolidindiony nejsou u nemocných se SS doporučeny, naopak SGLT2 získávají stále nová data o prospěšnosti u nemocných se SS, o snížení hospitalizací i mortality, renoprotektivitě atd. (tab. 1 a 2).
Tab. 1. Antidiabetika a riziko srdečního selhání. 
SS – srdeční selhání; DPP4 – enzym dipeptidyl-peptidázy 4; GLP-1 – analoga glukagon-like peptidu-1; SGLT2 – společný transportér pro sodík a glukózu typu 2 Tab. 2. Antidiabetika a hospitalizace pro SS. 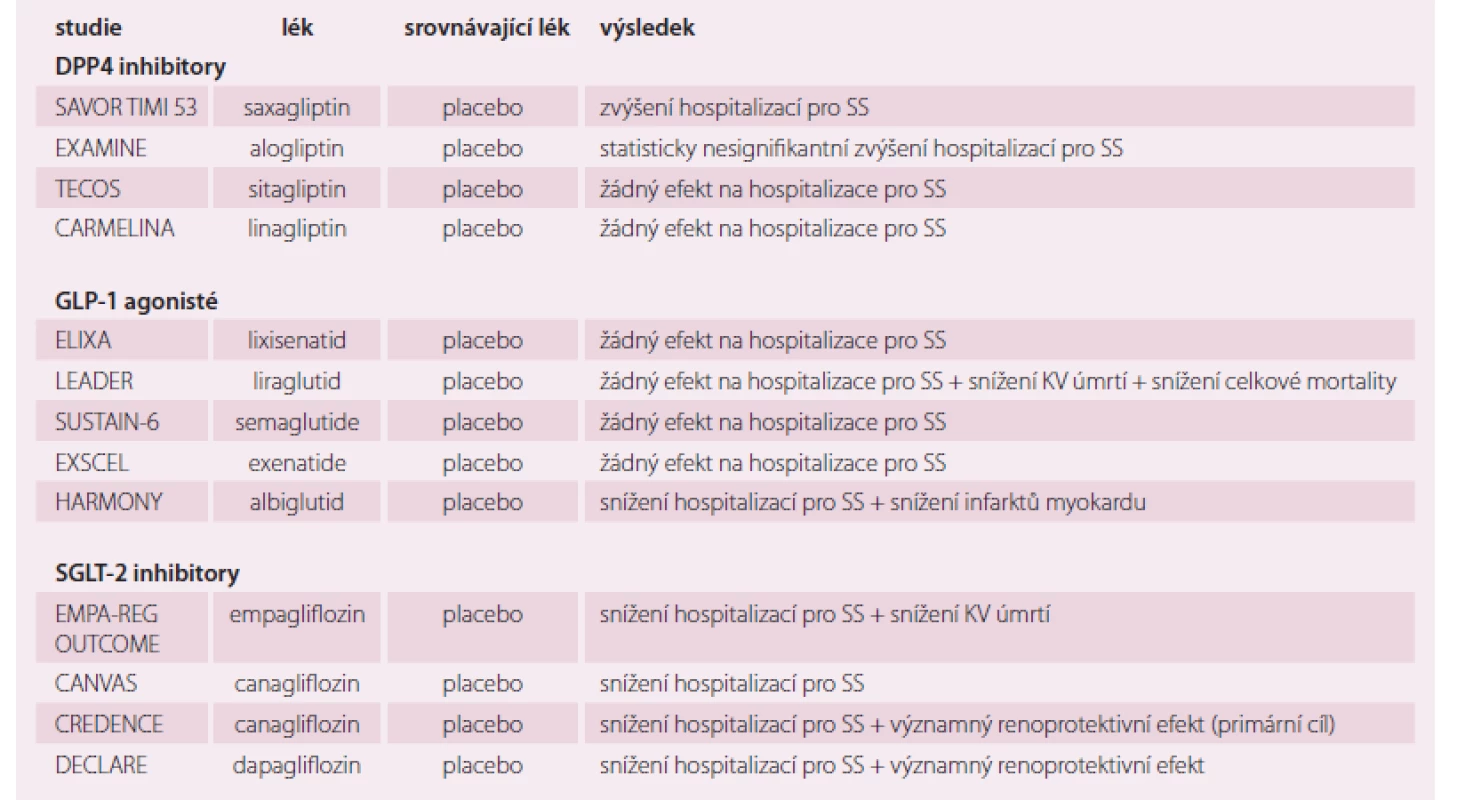
KV – kardiovaskulární; SS – srdeční selhání Evropská léková asociace (European Medical Association – EMA) uvádí, že snížení KV příhod je hlavní cíl léčby DM2, a proto upřednostňuje SGLT2 inhibitory empagliflozin, canagliflozin a dapagliflozin a GLP-1 agonisty liraglutid, semaglutid, exenatide a albiglutide, protože mají tento efekt prokázán. U canagliflozinu je ovšem limitující možný výskyt amputací dolních končetin a u semaglutidu není dosud postavení zcela jasné. Již v roce 2016 Evropská doporučení pro KV prevenci i Evropská doporučení pro SS upřednostňují SGLT2 inhibitory, ke snížení KV mortality – indikace IIa, B. Není doporučena kombinace GLP-1 agonistů a DPP4 inhibitorů. V současné době je nejvíce probíhající klinických studií věnováno SGLT2 inhibitorům, protože se zdají být nejperspektivnější. I zde je ještě mnoho nezodpovězených otázek. Stručně můžeme shrnout, že jsou to perorální antidiabetika, ale současně i antihypertenziva a léky na SS. Otázkou je, jak bude ovlivněn jejich účinek u nemocných bez DM2, tedy bez hyperglykemie, a zda jejich diuretický (glykosurický) efekt zůstane zachován. Přehled probíhajících studií s SGLT2 uvádí tab. 3.
Tab. 3. Osmnáct probíhajích studií s SGLT2 inhibitory u nemocných se SS. 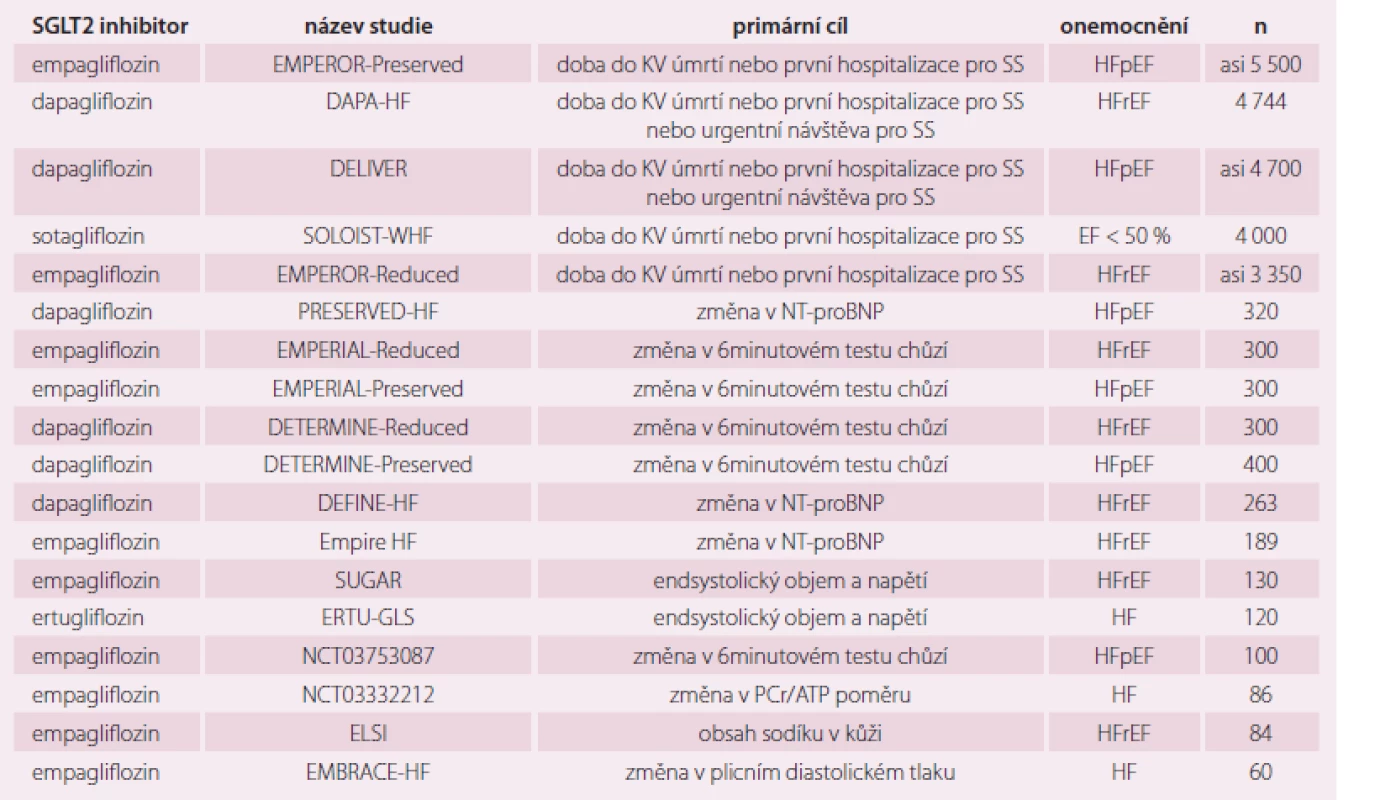
KV – kardiovaskulární; SS – srdeční selhání; HFpEF – srdeční selhání se zachovanou ejekční frakcí; HFrEF – srdeční selhání se sníženou ejekční frakcí; NT-proBNP – mozkový natriuretický peptid Nové léky na srdeční selhání
Cílem léčby SS je snížení mortality i snížení morbidity, především zlepšení kvality života a snížení hospitalizací. Základem léčby jsou ACEI, ke kterým přidáváme blokátory mineralokortikoidních receptorů (MRA). V případě intolerance ACEI jsou indikovány sartany – blokátory receptoru AT1 pro angiotenzin II (ARB).
K blokátorům renin angiotenzinového systému přidáváme betablokátory opět v maximálně tolerované dávce. K odstranění symptomů – otoků či dušnosti – jsou doporučena diuretika. U vybraných nemocných je vhodné přidat digoxin.
Objevují se dvě nové lékové skupiny se slibnou budoucností:
- Na základě výsledků studie PARADIGM-HF mohou být ACEI u symptomatických nemocných nahrazeny ARNI, genericky sacubitril valsartan.
- U diabetes mellitus jsou současně vhodnými léky na SS skupina inhibitorů receptorů pro SGLT2.
O obou se zmiňujeme v úvodu článku.
Na kongresu v Aténách se objevily první zkušenosti s istaroximemem u akutního SS. Istaroxim je luso-inotropní látka působící dvěma mechanizmy cestou ovlivnění vápníku, a to jednak inhibicí sarkolematické Na+/ K+ ATPázy a současně aktivací SERCA 2. Studie CVT-CV 02 byly klinickou studií 2. fáze se dvěma dávkami istaroximu (0,5 a 1,0 µg/ kg/ min) oproti placebu. Sledován byl klinický stav, především dušnost, echoparamatery, biomarkery, renální funkce, krevní tlak a tepová frekvence, vč. 24 hod Holterova monitorování. Infuze trvala 24 hod a doba sledování byla 30 dní. Zařazeni byli nemocní s akutním SS, ale klinicky stabilní s TKs 90–125 mm Hg, ejekční frakcí < 40 % a NT-proBNP > 1 400 pg/ ml. Mezi vylučovací kritéria patřila např. renální insuficience nebo infarkt myokardu či cévní mozková příhoda (CMP) v posledních 3 měsících. Randomizováno bylo 60 nemocných v první větvi (41 na istaroxim 0,5 µg/ kg/ min a 19 na placebo) a 62 nemocných v druhé větvi (42 na istaroxim 1,0 µg/ kg/ min a 22 na placebo). Istaroxim zlepšil poměr E/ e, zvýšil tepový objem, snížil tepovou frekvenci, zvýšil krevní tlak a neovlivnil natriuretické peptidy ani renální funkce. Na Holterově monitorování významně snížil výskyt arytmií. Autoři uzavírají, že istaroxim byl bezpečný a významně zlepšil systolickou i diastolickou funkci levé komory srdeční.
Neurohumorální aktivace
Velmi důležitá je neurohumorální aktivace, z prognostického i diagnostického hlediska je zcela zásadní mozkový natriuretický peptid (Brain Natriuretic Peptide – BNP), resp. jeho prekurzor NT-proBNP secernovaný v srdečních komorách, který se stal i základním kamenem pro diagnostiku, a jeho snížené odbourávání je součástí moderní léčby. Neurohumorální působení je zpočátku lokání a efektivní, z dlouhodobého hlediska však značně vyčerpává srdeční funkční rezervy, efekt se generalizuje a má negativní dopad jak na srdce, tak i na celý organizmus. Nejdříve dochází při vzniku systolické dysfunkce k lokální aktivaci sympatiku v srdci, projevující se zvýšenou hladinou noradrenalinu. Časně se též aktivuje atriální natriuretický faktor. Postupně však vůči němu vzniká rezistence, která koreluje s aktivací renin-angiotenzin-aldosteronového systému (RAAS). Stimulace sympatického nervového systému – sympatická nervová odpověď je univerzální odezva organizmu na stresovou situaci. Vede k uvolňování noradrenalinu a k vazokonstrikci tepen i žil, tedy zvýšení preloadu i afterloadu. Negativním dopadem je jeho toxický vliv na buňky myokardu ve smyslu fibrotických změn myokardu a stimulace apoptózy. V periferních cévách jeho působením dochází ke zvýšení hladiny endotelinu a k hypertrofii cévní stěny arteriol. V ledvinách vede k aktivaci RAAS. RAAS je aktivován u SS velmi časně. Je aktivován poklesem perfuzního tlaku a průtoku krve ledvin. Vede ke zvyšování hladiny angiotenzinu s následnou vazokonstrikcí. Aktivace koreluje se zvýšenou sekrecí aldosteronu, který způsobuje zadržení natria a vody v těle. Výsledkem je snížení glomerulární filtrace a pokles průtoku krve ledvinami. Mezi jeho negativní systémové účinky patří celkové zvýšení obsahu tekutin v těle, zvýšení extravazálního i plazmatického objemu. Množství tekutin vede k volumovému přetížení a ke zhoršování hemodynamiky. Klinicky je působení patrné na vzniku hyponatremie a otoků. V srdci indukuje hypertrofii buněk v cévách a stimuluje proliferaci myocytů. V poslední době je zkoumáno několik dalších neurohumorálních parametrů, velmi pěkně jejich postavení shrnul prof. Di Somma z Říma a Alan Maisel ze San Diega, kteří uvedli, že biomarkery jsou ukazatelem závažnosti onemocnění, ale i nežádoucích reakcí, ale že na druhé straně mohou být rizikovým faktorem sami o sobě. Di Somma ve své přednášce ukazoval klinické studie, které opakovaně prokázaly, že především natriuretické peptidy BNP i NT-proBNP jsou důležitým diagnostickým markerem a že stále ještě neumíme dostatečně využívat natriuretickými peptidy řízenou (guided) léčbu. Dále upozornil na význam anémie, která se vyskytuje u 55–62 % nemocných se SS a že snížený hemoglobin (pod 120 g/ l u žen a pod 130 g/ l u mužů) je spojen se špatnou prognózou. Objevují se ale i další biomarkery, jako mid-regionální pro-adrenomedulin a prokalcitonin, které mohou být cenné při diferenciální diagnostice dušnosti, ale jejich význam je mnohem menší než natriuretických peptidů. Upozornil třeba na studii BACH (Biomarkers in ACute Heart failure) či na studii IMPACT-EU trial s prokalcitoninem. Neopomenul ani význam troponinu, především pro stanovení akutní ischemie. Z dalších markerů zmínil galactin a studie COACH či TRIUMPH či na nový marker sST2 (soluble suppression of tumourigenicity 2), o kterém byl na kongresu i velký stánek. Relativně nový biomarker sST2 je zřejmě ukazatelem stresu myokardiálního svalu a aktivace fibrózy. Zvýšené sST2 hodnoty u akutního SS mají předpovědní význam jak pro morbiditu, tak pro mortalitu. Podobně je tomu i u chronického SS, kde mohou ukazovat i na selhávání léčby. Na druhé straně je ale asi hodně nemocných, kteří i přes jasné SS nemají elevovaný sST2, což limituje jeho diagnostický
význam.Samozřejmě se věnoval i renálním funkcím, kde opět ukázal, že nejcennější parametr je kreatinin a že výpovědní hodnota mnohem dražšího NGALu nepřináší žádné další podstatné informace. Prezentaci pak uzavřel tím, že stanovení NGALu pro diagnostiku akutního renálního selhání nemůžeme v dnešní době doporučit. Dalším renálním biomarkerem je proenkephalin (PENK), který ve studii GREAT AHF byl silným prediktorem zhoršení renálních funkcí a hospitalizační mortality u nemocných s akutním SS. Nedostatkem je, že studie měla jen 264 pacientů, avšak podle výsledků studie byl PENK lepším prediktorem zhoršení renálních funkcí než kreatinin. Za nejvýznamnější biomarker vaskulární funkce označil bio-adrenomedullin, jehož zvýšení je především spojeno s kongescí, a mohl by tedy být ukazatelem úspěšnosti léčby dekongesce.
Kardiovaskulární biomarkery mají asi zásadní roli v diagnostice a v rizikové stratifikaci nemocných se srdečním onemocněním, především se SS. Jejich přesnost a přínosnost je ale velmi silně ovlivněna komorbiditami, což značně limituje jejich užití.
HFpEF a HFmrEF
Prevalence SS v dospělé populaci průmyslově rozvinutých zemí je přibližně 1–2 %; u osob ve věku > 70 let se zvyšuje na hodnotu ≥ 10 %. Podíl pacientů s HFpEF se pohybuje v rozmezí 22–73 %. Zdá se, že HFpEF a HFrEF mají různé epidemiologické a etiologické profily. Ve srovnání s HFrEF jsou nemocní s HFpEF starší, častěji se jedná o ženy a častěji mají v anamnéze hypertenzi a fibrilací síní, zatímco infarkt myokardu se v jejich anamnéze objevuje méně často. Srdeční selhání je považováno za hemodynamickou poruchu, jejíž patofyziologický základ vychází z parametrů určujících srdeční výdej, tj. ze srdeční stažlivosti, náplně komory na konci diastoly, napětí stěny komory během systoly a srdeční frekvence. V roce 2016 se k tomuto rozdělení přidala ještě HFmrEF, SS s mid range ejekční frakcí. HFrEF je tedy ejekční frakce < 40 %, HFpEF je ejekční frakce > 50 % a HFmrEF je ejekční frakce 40–49 %. Podstatné je, že u HFpEF nemáme žádné pozitivní klinické studie a léčba je tedy vždy na úrovni znalostí C – tedy domníváme se, že je prospěšná a používáme léky vyzkoušené u HFrEF. Důležité je u těchto pacientů léčení komorbidit, které k tomuto typu SS přispívají. Pacienti s HFmrEF byli sice do některých studií zavzati, velká mortalitní studie ale taktéž chybí. Hodně se diskutovalo, zda je toto dělení praktické a zda zůstane i v příštích doporučeních, nakonec převládl názor, že zůstane. Prof. Muller z Genevy však tento stav parodoval slovy, že HFmrEF neexistuje, že buď jde o zhoršenou HFpEF, nebo o zlepšenou HFrEF.
prof. MU Dr. Jindřich Špinar, CSc., FESC
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2019 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Kouření – ovlivnitelný rizikový faktor nemocí srdce a cév
- Vzpomínka na prof. Miloše Štejfu (28. 5. 1929–20. 5. 2015)
- Tak s čím jste, pánové, přišli? aneb prof. Štejfa u kolébky Kardiologické revue
- Kardiologická revue v době Matrixu
- Novinky o familiární hypercholesterolemii pro kardiology
- Update role Lp (a) při určení kardiovaskulárního rizika a možnosti jeho ovlivnění
- Variabilita lipidov
- Management dyslipidemií u žen
- Minimum o mechanických podporách srdca – klasifikácia, indikácie, princípy, klinické skúsenosti
- Betablokátory u kardiovaskulárních onemocnění – pro a proti
- Evropský kongres chronického srdečního selhání a Světový kongres akutního srdečního selhání – Atény 2019
- Účinnosť a bezpečnosť nových antikoagulancií v reálnej klinickej praxi
- Tvorba a ověření ošetřovatelského standardu edukace pacientů po infarktu myokardu
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Betablokátory u kardiovaskulárních onemocnění – pro a proti
- Update role Lp (a) při určení kardiovaskulárního rizika a možnosti jeho ovlivnění
- Minimum o mechanických podporách srdca – klasifikácia, indikácie, princípy, klinické skúsenosti
- Novinky o familiární hypercholesterolemii pro kardiology
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



