-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Srdeční selhání ve stáří
Heart failure in old age
Chronic heart failure (HF) occurs in 0.4% of the European population with a significant increase in older age groups (0.2% < 50 years, 2 – 5% 50 – 80 years, > 10% over 80 years); the percentage of female patients is rising with increasing age. Therefore it is a disease of older age. The average age of patients is around 75 years. Heart failure is the most common cause of hospitalizations in patients over 65 years of age. Heart failure affects a wide range of patients, from those with normal ejection fraction (EF), typically defined ≥ 50% (HF with preserved EF – HFpEF) to those with reduced left ventricular EF (LV EF), typically defined as < 40% (HF with reduced EF – HFrEF). Patients with LV EF in the 40–49% range are now newly defined as patients with heart failure with mid-range EF , abbreviated as HFmrEF. The determination of plasma concentrations of natriuretic peptides can be used as a basic diagnostic examination. The negative predictive values are very high and unified for all patients, regardless of age. Neurohumoral antagonists (ACEI, MRA, and beta-blockers) have been shown to prolong the survival of HFrEF patients and are therefore recommended for the treatment of all patients, unless they are contraindicated or intolerant. Unfortunately, the studies conducted with these drugs at the end of the 20th century and the beginning of the 21st century included only very few senior citizens, and the average age of patients in these studies is 10 to 15 years lower than the average age of the real population with heart failure. For the same reason, the representation of women is also very low. An integral part of heart failure in senior patients is comorbidity, especially hypertension, diabetes mellitus, or atrial fibrillation.
Key words:
heart failure – senior – ejection fraction – natriuretic peptide
Autoři: J. Špinar 1; L. Špinarová 2
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno 1; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2018, 20(1): 11-15
Souhrn
Chronické srdeční selhání (SS) se v evropských zemích vyskytuje u 0,4 – 2 % populace s výrazným nárůstem ve vyšších věkových skupinách (< 50 let 0,2 %, 50 – 80 let 2 – 5 %, nad 80 let > 10 %), se stoupajícím věkem roste i procento pacientů ženského pohlaví. Jde tedy o onemocnění především vyššího věku. Průměrný věk pacientů se pohybuje kolem 75 let. Srdeční selhání je nejčastější příčinou hospitalizací u nemocných nad 65 let, postihuje širokou škálu pacientů od osob s normální ejekční frakcí (EF), běžně definovanou hodnotou ≥ 50 %, až po osoby se sníženou EF levé komory typicky definovanou hodnotou < 40 %. Pacienti s EF levé komory v rozmezí 40 – 49 % jsou nyní nově definováni jako pacienti se SS s EF ve středním pásmu. Jako základní diagnostické vyšetření lze použít stanovení plazmatických koncentrací natriuretických peptidů. Negativní předpovědní hodnoty jsou velmi vysoké a jsou jednotné pro všechny nemocné, bez rozdílu věku. Je prokázáno, že neurohumorální antagonisté (ACEI, MRA a betablokátory) prodlužují přežití pacientů se SS se sníženou EF, a jsou proto doporučovány pro léčbu každého pacienta, pokud nejsou kontraindikovány nebo netolerovány. Bohužel studie s těmito léky na konci 20. století a začátku 21. století zavzaly velmi málo seniorů a průměrný věk v těchto studií je o 10 – 15 let nižší než průměrný věk reálné populace se SS. Ze stejného důvodu je taktéž zastoupení žen minimální. Nedílnou součástí SS seniorů jsou komorbidity, především hypertenze, diabetes mellitus či fibrilace síní.
Klíčová slova:
srdeční selhání – senior – ejekční frakce – natriuretické peptidy
Srdeční selhání (SS) je klinický syndrom, charakterizovaný typickými symptomy (např. dušností, otoky kotníků a únavou), jež mohou být doprovázeny známkami (např. zvýšeným tlakem v krčních žilách, chrůpky na plicích a otoky končetin), vyvolanými strukturálními a/ nebo funkčními srdečními abnormalitami vedoucími ke sníženému srdečnímu výdeji a/ nebo ke zvýšeným nitrosrdečním tlakům v klidu nebo při zátěži [1].
Chronické srdeční selhání (CHSS) se v evropských zemích vyskytuje u 0,4 – 2 % populace s výrazným nárůstem ve vyšších věkových skupinách (< 50 let 0,2 %, 50 – 80 let 2 – 5 %, nad 80 let > 10 %), se stoupajícím věkem stoupá i procento pacientů ženského pohlaví.
Jde tedy o onemocnění především vyššího věku. Průměrný věk pacientů se pohybuje kolem 75 let. Srdeční selhání je nejčastější příčinou hospitalizací u nemocných nad 65 let [2]. Roční mortalita se pohybuje kolem 10 %, některé průzkumy udávají až 20 % [3]. U mužů je výskyt SS vyšší než u žen. Ženy po stanovení diagnózy přežívají déle [4]. Rizikové faktory jsou podobné jako u ischemické choroby srdeční (ICHS), zejména kouření, vysoký krevní tlak (TK), zvýšení hladiny krevního cholesterolu, cukrovka, ale také nadměrné požívání alkoholu, prodělané srdeční záněty (revmatická horečka, infekční endokarditida), syndrom spánkové apnoe a další. Podle velké Framinghamské studie umírá do 5 let od diagnózy SS 60 % nemocných, do 1 roku 17 % [5,6].
Hlavní terminologie používaná k popisu SS vychází z měření ejekční frakce levé komory (EF LK). Srdeční selhání postihuje širokou škálu pacientů, od osob s normální EF, běžně definovanou hodnotou ≥ 50 % (heart failure with preserved EF – HFpEF), až po osoby se sníženou EF LK, typicky definovanou hodnotou < 40 % (heart failure with reduced EF – HFrEF). Pacienti s EF LK v rozmezí 40 – 49 % jsou nyní nově definováni jako pacienti se SS s EF ve středním pásmu (mid-range EF – HFmrEF) (tab. 1) [1,7]. Vždy by měly být přítomny symptomy a nebo známka SS (tab. 2).
Tab. 1. Klasifikace srdečního selhání podle ejekční frakce. 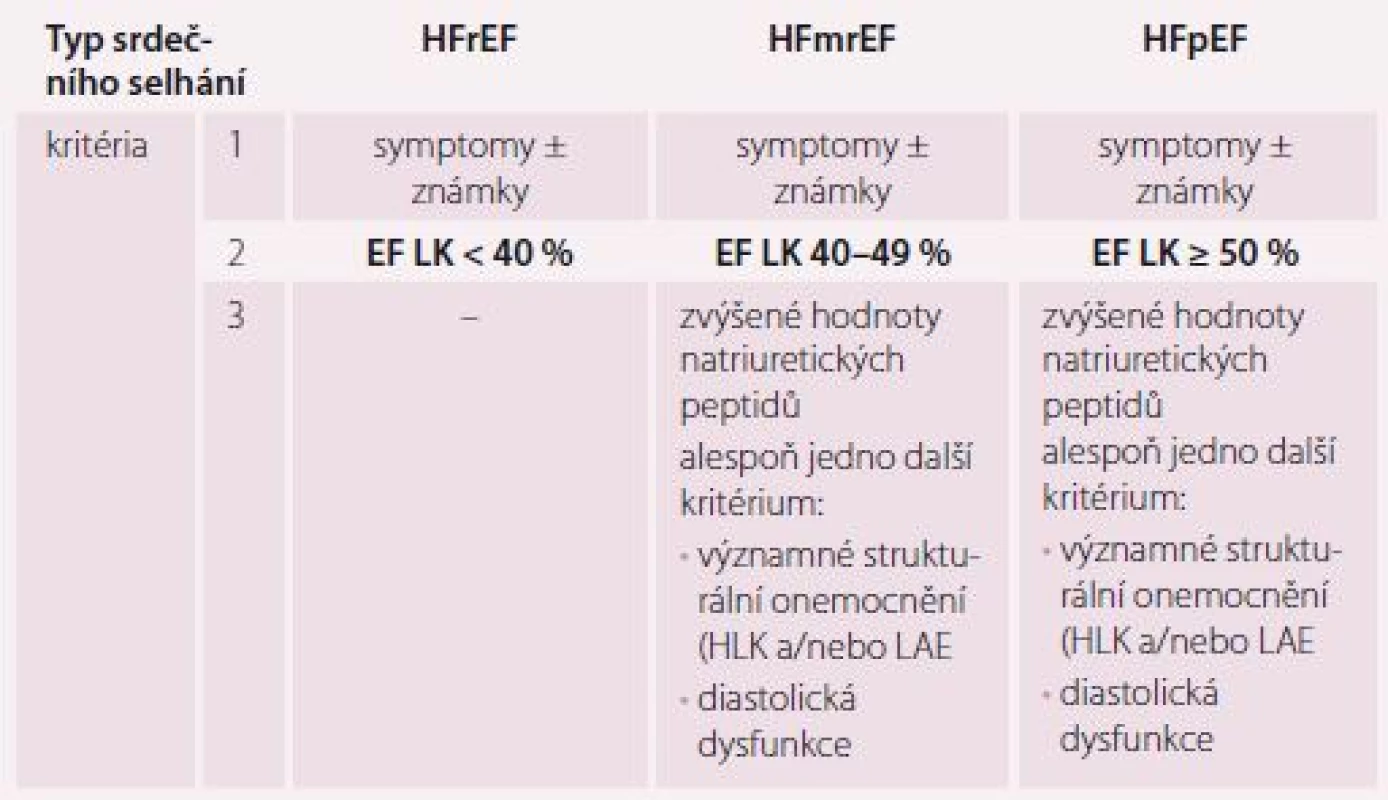
EF LK – ejekční frakce levé komory, HFrEF – srdeční selhání se sníženou ejekční frakcí, HFmrEF – srdeční selhání s ejekční frakcí ve středním pásmu, HFpEF – srdeční selhání se zachovanou ejekční frakcí, HLK – hypertrofie levé komory, LAE – zvětšení levé síně Tab. 2. Symptomy a známka srdečního selhání. 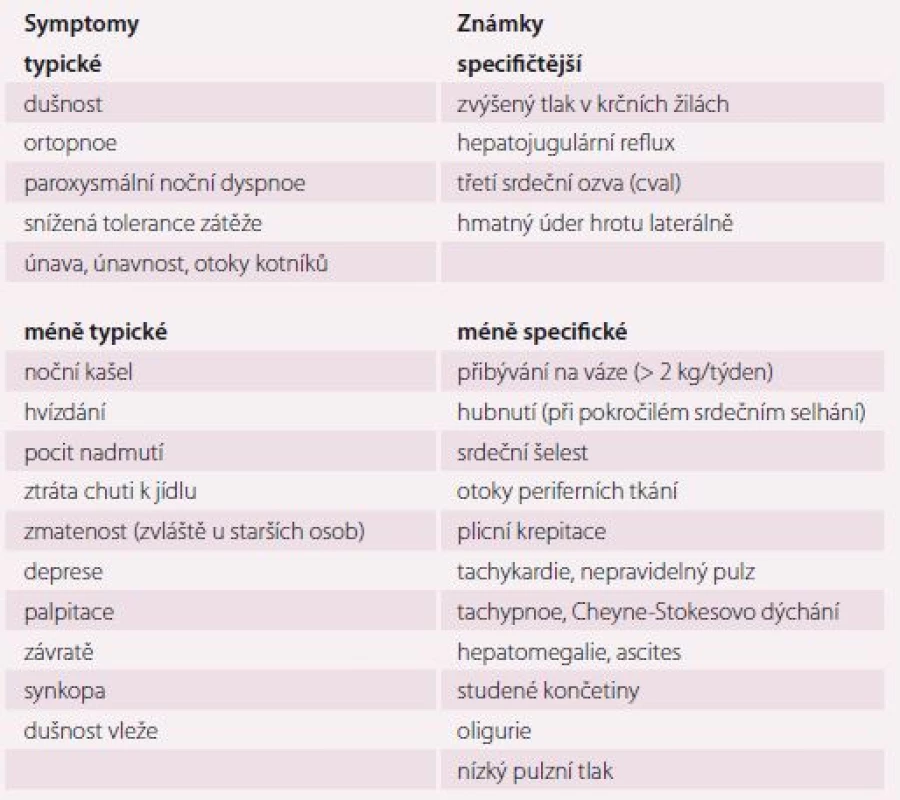
V mladších věkových kategoriích se vyskytuje prakticky jen systolická dysfunkce a diastolická dysfunkce je velmi vzácná, resp. pokud je, tak doprovází dysfunkci systolickou. Ve věku 60 let se izolovaná diastolická dysfunkce již podílí na celkovém výskytu SS v 1/ 3 a ve věku 75 let je zastoupení systolické a diastolické dysfunkce 50 : 50. Ve vyšším věku taktéž stoupá procento žen, můžeme tedy říct, že typickým pacientem se SS nad 75 let je žena s diastolickou dysfunkcí.
Pacienti, kteří trpí SS po určitou dobu, jsou označováni jako pacienti s „chronickým SS“. Pokud se chronické stabilní SS zhoršuje, může být pacient označován za „dekompenzovaného“, tento stav může nastat náhle nebo se rozvíjet pozvolna a často vede k příjmu do nemocnice. Nově vzniklé SS (de novo) se rovněž může projevit akutně, například jako důsledek akutního infarktu myokardu (IM), nebo v subakutní podobě, např. u pacientů s dilatační kardiomyopatií (DKM). K popisu závažnosti symptomů a nesnášenlivosti zátěže se používá funkční klasifikace americké New York Heart Association (NYHA). Mezi závažností symptomů a délkou přežití existuje jednoznačná souvislost.
Zdá se, že HFpEF a HFrEF mají různé epidemiologické a etiologické profily. Ve srovnání s HFrEF jsou nemocní s HFpEF starší, častěji se jedná o ženy a častěji mají v anamnéze hypertenzi a fibrilací síní (FS), zatímco IM se v jejich anamnéze objevuje méně často. Charakteristiky pacientů s HFmrEF jsou někde mezi charakteristikami jedinců s HFrEF a HFpEF; přesnější popis této populace si však vyžádá další studie.
V posledních 30 letech vedlo zdokonalování léčebných postupů a jejich uvádění do praxe k prodloužení přežití a snížilo počty hospitalizací pacientů s HFrEF. U pacientů se SS dochází ve většině případů k úmrtí z kardiovaskulárních (KV) příčin, hlavně v důsledku náhlé srdeční smrti a zhoršování SS. Celková mortalita je u HFrEF obecně vyšší než u HFpEF. K hospitalizacím často dochází z nekardiovaskulárních příčin, zvláště u pacientů s HFpEF.
Jako základní diagnostické vyšetření lze použít stanovení plazmatických koncentrací natriuretických peptidů (NP). U pacientů s normálními plazmatickými koncentracemi NP není pravděpodobné, že by trpěli SS. V neakutních případech je horní hranice normálních hodnot NP typu B (B-type natriuretic peptide – BNP) 35 pg/ ml a aminoterminálního fragmentu natriuretického propeptidu typu B (N-terminal prohormone brain natriuretic peptide – NT-proBNP) 125 pg/ ml; v akutních případech je třeba použít vyšší hodnoty (BNP < 100 pg/ ml, NT-proBNP < 300 pg/ ml). Negativní předpovědní hodnoty jsou velmi podobné a vysoké (0,94 – 0,98), a to jak v neakutních, tak v akutních případech, ale pozitivní predikční hodnoty jsou nižší jak v neakutních (0,44 – 0,57), tak v akutních případech (0,66 – 0,67). Proto se doporučuje NP používat pro vyloučení SS, ne však pro stanovení diagnózy [1,7]. Dřívější doporučení navrhovala pro seniory vyšší cut-off hodnoty NP, guidelines z roku 2016 však mají jednotné hodnoty pro všechny nemocné, bez rozdílu věku.
Abnormální křivka elektrokardiogramu (EKG) pravděpodobnost diagnózy SS zvyšuje. Některé abnormální EKG nálezy poskytují informace o etiologii (např. IM) a nálezy na EKG by mohly poskytnout jistý návod k léčbě, např. antikoagulace u FS, kardiostimulace u bradykardie, srdeční resynchronizační léčba (cardiac resynchronization therapy – CRT) při rozšířeném komorovém komplexu (QRS). U pacientů s úplně normálním EKG je přítomnost SS nepravděpodobná (senzitivita 89 %).
Echokardiografické (ECHO) vyšetření je velmi užitečné a široce dostupné ke stanovení diagnózy u pacientů s podezřením na SS. Poskytuje okamžité informace o objemech srdečních oddílů, funkci komor v systole i v diastole, tloušťce stěn, funkci chlopní i o plicní hypertenzi. Tyto informace jsou pro stanovení diagnózy a vhodné léčby naprosto nezbytné.
Cílem léčby pacientů se SS je zlepšit jejich klinický stav, funkční kapacitu i kvalitu života, zabránit jejich hospitalizaci a snížit mortalitu.
Je prokázáno, že neurohumorální antagonisté (inhibitory ACE (ACEI), mineralokortikoidní receptory (MRA) a betablokátory) prodlužují přežití pacientů s HFrEF, a jsou proto doporučovány pro léčbu každého pacienta, pokud nejsou kontraindikovány nebo netolerovány. Bohužel ale studie s těmito léky na konci 20. století a začátku 21. století zavzaly velmi málo seniorů a průměrný věk v těchto studií je o 10 – 15 let mladší než průměrný věk reálné populace se SS. Ze stejného důvodu je taktéž zastoupení žen minimální, a proto můžeme říct, že pro ženy nad 75 let nemáme žádnou evidence based medicínu, a stejně tak pro seniory s diastolickým SS, což je právě žena nad 75 let (tab. 3) [8].
Tab. 3. Průměrný věk, zastoupení seniorů a žen v klinických studiích. 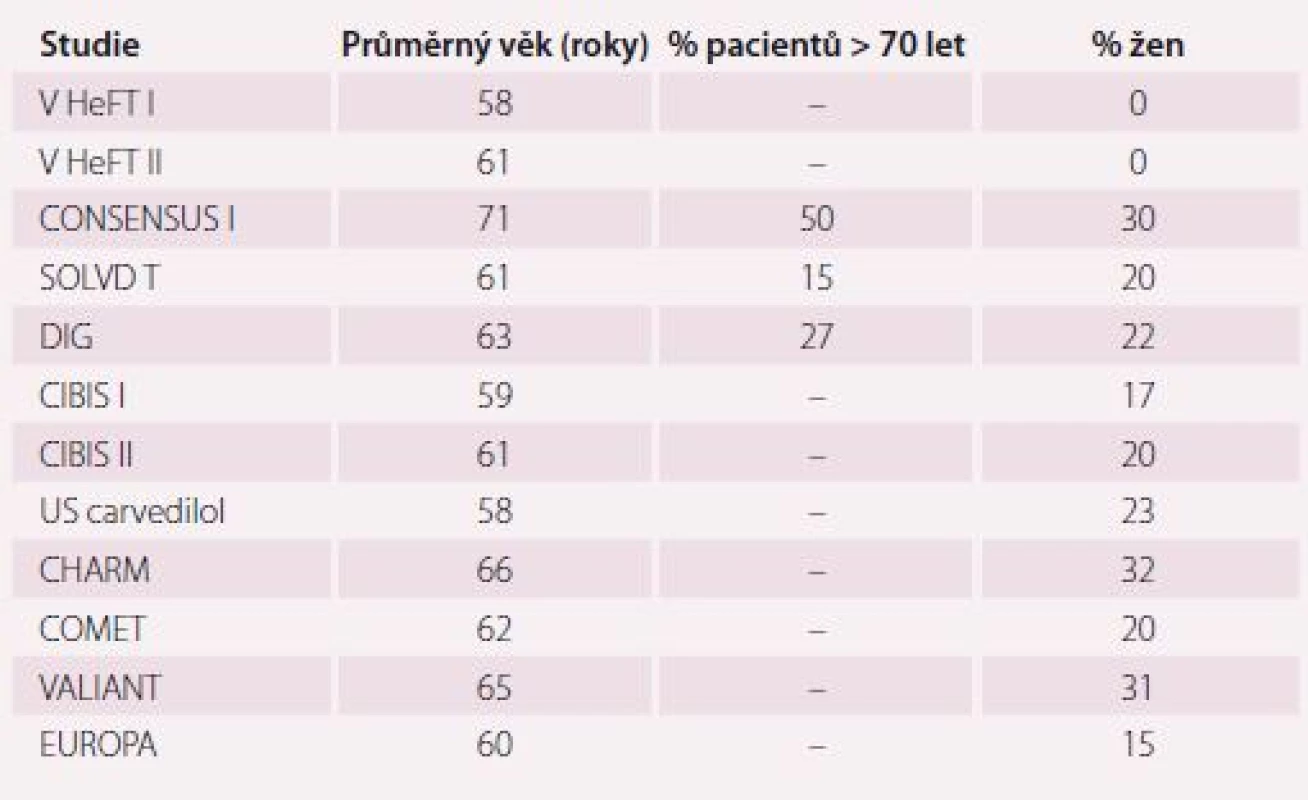
Ve dvou velkých průzkumech v Evropě – IPROVEMENT-HF a Euro Heart Survey, které probíhaly na přelomu století, byl průměrný věk nemocných 70, resp. 71 let a procento žen 45, resp. 48 % [9,10]. První průzkum zahrnul 11 062 nemocných u 1 363 praktických lékařů ve 14 zemích EU, druhý 11 016 nemocných ze 116 nemocnic a 24 zemí EU. Je tedy vidět, že i v těchto průzkumech je průměrný věk asi o 10 let vyšší než ve studiích a že poměr muži : ženy je téměř 50 : 50. V letech 2015 – 2016 jsme provedli registr FAR NHL na třech specializovaných pracovištích pro SS – FN Brno, FN u sv. Anny v Brně a Nemocnice Na Homolce. Průměrný věk zde byl 65 let a ženy tvořily 20 %, což opět potvrzuje, že se nejedná o všeobecnou populaci se SS, ale o specializovaná pracoviště, zabývající se mimo jiné i transplantací srdce, implantací kardioverter defibrilátorů (ICD) atd. [11].
V poslední době se zjistilo, že nová látka (LCZ696) slučující v sobě vlastnosti AT1 blokátoru (valsartan) a inhibitoru neprilysinu (NEP) (sacubitril) snižuje riziko úmrtí a hospitalizace pro SS účinněji než ACEI (enalapril). Proto se kombinace sacubitril-valsartan doporučuje jako náhrada ACEI u ambulantních pacientů s HFrEF, kteří splňují kritéria studie a u nichž i přes optimální léčbu symptomy přetrvávají. Je ale třeba opět zdůraznit, že průměrný věk nemocných v této studii byl 64 let a ženy tvořily 21 %, takže se opět jedná o vysoce selektovanou populaci [5,12,13]. Zatím nebylo prokázáno, že by AT1 blokátory snižovaly mortalitu pacientů s HFrEF, a proto by se jejich podávání mělo omezit na pacienty nesnášející ACEI nebo ty, kteří užívají ACEI, ale nesnášejí MRA. Ivabradin snižuje zvýšenou srdeční frekvenci, s níž se lze často setkat u HFrEF; rovněž bylo prokázáno, že zlepšuje výsledek léčby, a jeho použití je tedy třeba ve vhodných případech zvážit. Je jen velmi málo studií cílených na starší populaci, nejznámější jsou SENIORS s nebivololem a PEP-CHF s perindoprilem [14,15]. Studie IMPROVEMENT proběhla již před 17 lety, na přelomu století, ukázala však velmi smutný fakt, a to že v reálném životě je procento nemocných léčených blokátory systému renin-angiotenzin-aldosteron (RAAS) a betablokátory mnohem menší než v klinických studiích a dávky mnohem nižší, než jsou dávky doporučené (tab. 4 a 5). V tab. 4 je zajímavé i to, že seniorům předepisujeme častěji digoxin a kličková diuretika a tento registr je i jasnou ukázkou, že AT II blokátory teprve začínaly, proto byla jejich preskripce téměř nulová, zatímco dnes tvoří 10 – 15 %, především u nemocných netolerujících ACEI pro suchý kašel [9,10].
Tab. 4. Zastoupení jednotlivých léků ve registru IMPROVEMENT-HF. 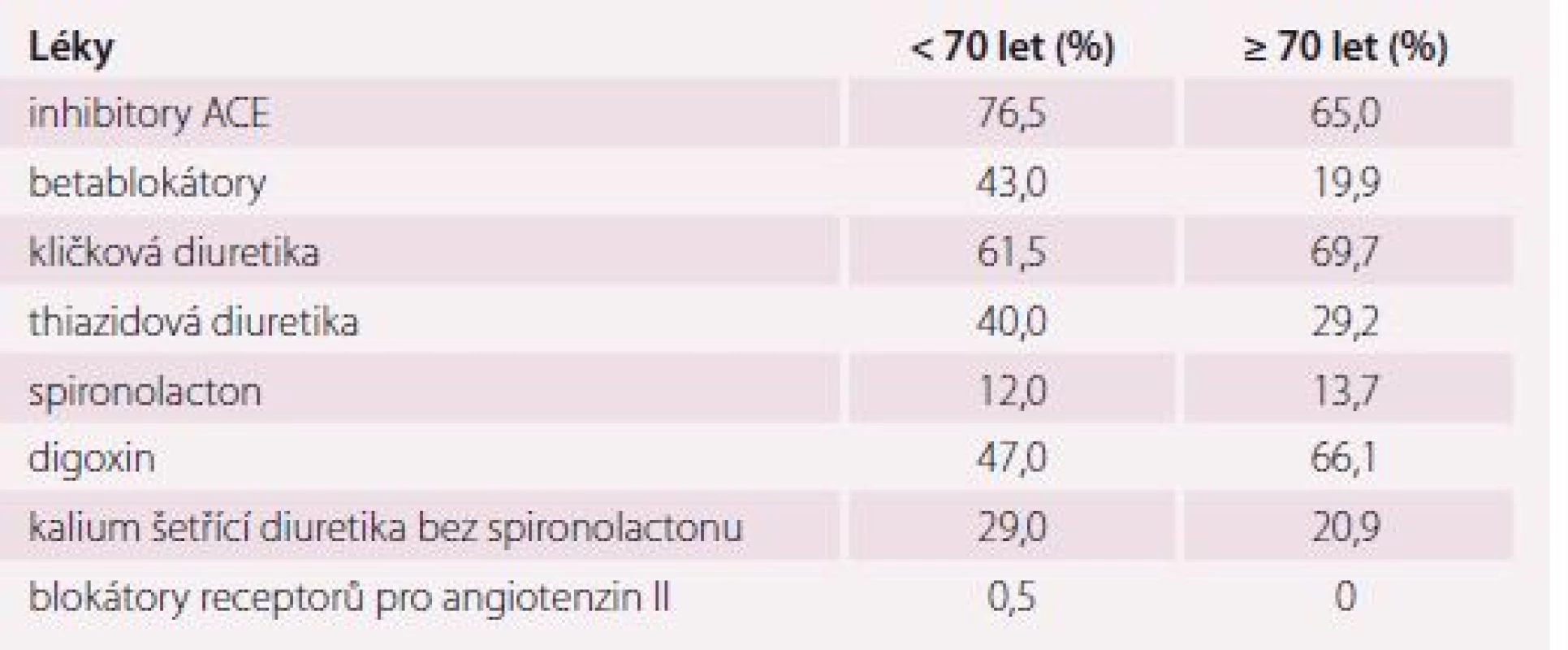
Tab. 5. Doporučené dávky blokátorů RAAS a betablokátorů. 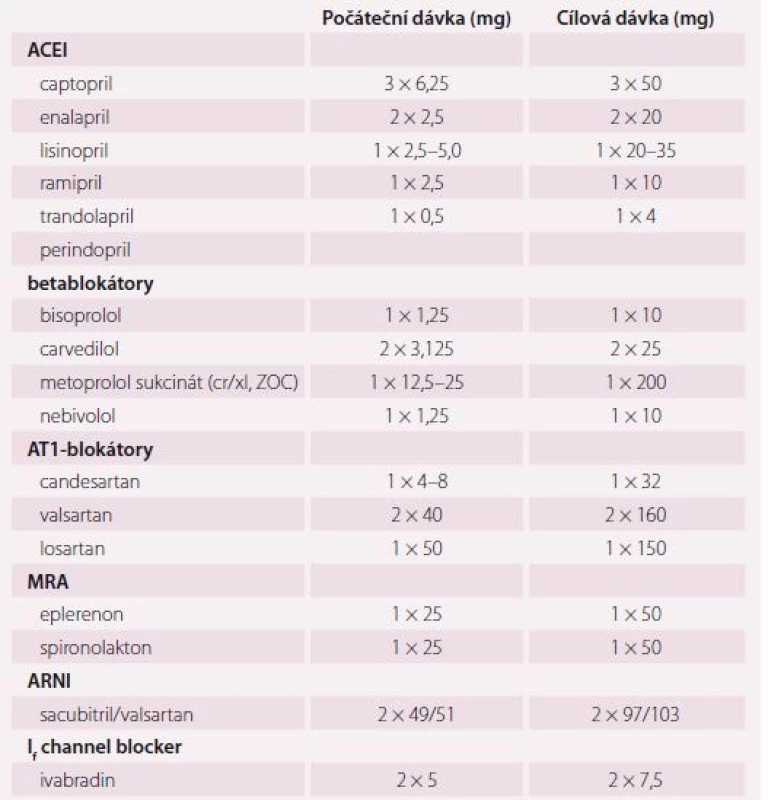
RAAS – renin-angiotenzin-aldosteronový systém, ACEI – inhibitory ACE, MRA – antagonistů receptorů pro mineralokortikoidy, ARNI – inhibitor receptorů pro angiotenzin Výše uvedené léky je u pacientů se symptomy a/ nebo se známkami městnání nutno užívat spolu s diuretiky. Podávání diuretik je nutno upravit podle klinického stavu pacienta.
Použití digoxinu lze zvážit u pacientů se sinusovým rytmem a symptomatickým HFrEF s cílem snížit riziko hospitalizací. Účinky digoxinu u pacientů s HFrEF a FS jsou sporné. U pacientů se symptomatickým SS a FS se digoxin osvědčil při zpomalování rychlé komorové frekvence. U pacientů s FS se doporučuje klidová komorová frekvence v rozmezí 70 – 90 tepů/min, u pacientů se sinusovým rytmem 50–70 za min.
Ke stanovení diagnózy HFpEF je nutná hodnota EF LK ≥ 50 %, zatímco pacienti s EF LK mezi 40 a 49 % jsou označováni jako s HFmrEF. V klinické praxi a v klinických studiích se zdá, že ve srovnání s pacienty s HFrEF užívá diuretika, betablokátory, MRA, ACEI nebo AT1 blokátory pouze o něco méně pacientů s HFpEF a HFmrEF. U pacientů s HFpEF nebo HFmrEF však dosud přesvědčivě žádná studie neprokázala snížení morbidity ani mortality.
Komorbidity hrají při SS velkou úlohu a mohou ovlivnit použití různých medikací pro léčbu SS. Látky použité pro léčbu komorbidit mohou vést ke zhoršení SS. Léčba komorbidit představuje hlavní součást komplexní péče o pacienty se SS. Řadu komorbidit aktivně léčí specialisté v této oblasti a tito lékaři se budou řídit vlastními speciálními doporučenými postupy. Srdeční selhání u seniorů je asi v 90 % doprovázeno hypertenzí, asi v 50 % diabetes mellitus a asi v 45 % FS.
Hypertenze je spojena se zvýšeným rizikem rozvoje SS; antihypertenzní léčba incidenci SS výrazně snižuje (s výjimkou α-adrenoceptorových blokátorů, které brání rozvoji SS méně účinně než jiná antihypertenziva). Většina antihypertenziv – blokátory RAAS, betablokátory, diuretika – je i nedílnou součástí léčby SS.
Negativně inotropní blokátory kalciových kanálů (tzn. diltiazem a verapamil) se nesmí podávat pacientům s HFrEF (předpokládá se však, že u HFpEF jsou bezpečné); podávání moxonidinu je třeba se u pacientů s HFrEF vyvarovat. Pokud nestačí k úpravě TK ACEI (nebo AT1 blokátor), betablokátor, MRA a diuretikum, jsou dalšími antihypertenzivy hydralazin a amlodipin/ felodipin, u nichž byla při léčbě systolického SS prokázána bezpečnost. U pacientů s akutním SS se ke snížení TK doporučují i.v. nitráty (nebo nitroprusid sodný).
Hodnota optimální klidové komorové frekvence u pacientů s FS a SS není známa, může se však pohybovat v rozmezí 70 – 90 tepů/ min. K úpravě komorové frekvence lze použít betablokátory, digoxin a jejich kombinace. Ve vzácných případech nelze komorovou frekvenci snížit pod hodnotu 100 – 110 tepů/ min pouze farmakologicky, a tak zvažujeme nutnost ablace AV uzlu se stimulací komor; v takové situaci je u pacientů s HFrEF třeba zvážit CRT spíše než klasickou stimulaci pravé komory. Je-li pacient indikován k implantabilnímu ICD, může být vhodnějším postupem ablace AV uzlu s implantací CRT-D, zvláště pokud jsou přítomny středně závažné až závažné symptomy.
U diabetiků se SS je nutno glykemii korigovat postupně a uvážlivě, přičemž je třeba dávat přednost látkám, u nichž byla prokázána jejich bezpečnost a účinnost. Bývá doporučován metformin, který je ale kontraindikován u těžkého poškození ledvin nebo jater. Deriváty sulfonylurey byly rovněž spojeny s rizikem zhoršení SS, a je proto nutno velmi zvažovat jejich podání.
Thiazolidindiony (glitazony) vedou k zadržování sodíku a vody a ke zvyšování rizika zhoršení SS a hospitalizace, a proto se u pacientů se SS nedoporučují.
Inhibitory dipeptidylpeptidázy-4 (DPP4i; gliptiny), které zvyšují sekreci inkretinů, a agonisté receptoru pro glukagon-like peptid 1 (GLP-1) s dlouhodobým účinkem, které sice působí jako mimetika inkretinů, nesnižují, a dokonce mohou zvýšit riziko KV příhod a zhoršit SS.
V nedávné době bylo popsáno, že inhibitor sodíko-glukózového kotransportéru SGLT2 empagliflozin snížil počet hospitalizací pro SS a mortalitu, ne však incidenci IM a cévních mozkových příhod (CMP) u diabetiků s vysokým KV rizikem [16]. Empagliflozin je jako lék volby u diabetika se SS uveden jako lék volby i v ESC doporučeních 2016 [1,7].
Pacientům s diabetem 1. typu je nutno podávat inzulin a inzulinem je třeba léčit také symptomatickou hyperglykemii u pacientů s diabetem 2. typu a vyčerpáním β buněk pankreatických ostrůvků. Inzulin je však vysoce účinný hormon zadržující sodík a v kombinaci se snížením glykosurie může zhoršit retenci tekutin, a SS tak ještě zhoršit.
U pacientů se SS dochází ve vysokém procentu případů k úmrtí náhle a nečekaně, zvláště u těch s mírnějšími symptomy. V mnoha případech se jedná o důsledek poruch vedení elektrických impulzů. ICD (CRT) účinně zabraňují bradykardii a korigují vznik potenciálně letálních komorových arytmií. I když by snad některá antiarytmika mohla snižovat incidenci tachyarytmií a náhlé smrti, celkovou mortalitu nesnižují a mohou ji zvyšovat.
Specifická léčba podle příčiny může zahrnovat např.:
- angioplastiku či srdeční bypass u ischemické choroby srdeční,
- plastiku či náhradu chlopně u chlopenních vad,
- léčbu poruch štítné žlázy (thyreotoxikózy, hypothyreózy).
U vhodně vybraných pacientů zlepšuje CRT srdeční funkci a zmírňuje symptomy, zlepšuje i pocit pohody při současném snížení morbidity a mortality. Šířka komplexu QRS předpovídá odpověď na CRT a ve všech randomizovaných studiích byla kritériem pro zařazení. S příznivou odpovědí na CRT však souvisela i morfologie komplexu QRS. Několik studií prokázalo, že u pacientů s morfologií tvaru blokády levého raménka Tawarova existuje vyšší pravděpodobnost odpovědi na CRT.
Pokud je pacient indikován k implantaci ICD, má sinusový rytmus a šířku komplexu QRS ≥ 130 ms, je nutno zvážit použití přístroje CRT-D. Věk není kontraindikací přístrojové léčby, kontraindikací však je pravděpodobná délka života méně než 1 rok.
Závěr
Srdeční selhání u seniorů je velmi časté, je nejčastější příčinou hospitalizací seniorů a jeho léčba je komplexní. Na rozdíl od mladých pacientů jsou častější komorbidity, a proto je třeba pečlivých kontrol jak klinického stavu, tak i laboratorních výsledků. I když jsou nedostatečná data z randomizovaných studií, lze očekávat, že evidence based léky jsou prospěšné i u této části populace a doporučení pro farmakologickou i nefarmakologickou léčbu seniorů se neliší od obecných doporučení pro celou populaci.
Léčba starších nemocných, zvláště ve věku nad 75 let, vyžaduje velmi individuální přístup. Musíme zhodnotit celkový stav nemocného a tomu přizpůsobit výběr léčby jak farmakologické s optimálním dávkováním a přihlédnutím k nežádoucím účinkům, tak nefarmakologické, zvláště pečlivou indikaci CRT a hlavně ICD a v budoucnosti i destinační léčbu pomocí mechanických srdečních podpor. U terminálních stavů pak vždy zvažujeme paliativní péči, tak aby nemocný se SS netrpěl jak fyzicky, tak duševně, a my mu dopřáli důstojné umírání [17].
Doručeno do redakce: 27. 12. 2017
Přijato po recenzi: 18. 1. 2018
prof. MU Dr. Jindřich Špinar, CSc., FESC
www.fnbrno.cz
Zdroje
1. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur Heart J 2016; 37(27): 2129 – 2220. doi: 10.1093/ eurheartj/ ehw128.
2. Krumholz HM, Chen YT, Wang Y et al. Predictors of readmission among elderly survivors of admission with heart failure. Am Heart J 2000; 139 (1 Pt 1): 72 – 77.
3. Neubauer S. The failing heart – an engine out of fuel. N Engl J Med 2007; 356(11): 1140 – 1151.
4. Strömberg A, Mårtensson J. Gender differences in patients with heart failure. Eur J Cardiovasc Nurs 2003; 2(1): 7 – 18. doi: 10.1016/ S1474-5151(03)00002-1.
5. Špinarová L, Špinar J, Vítovec J. Co nám přináší studie PARADIGM‑HF. Kardiol Rev Int Med 2014; 16(5): 395 – 397.
6. Špinarová L, Špinar J, Vítovec J. Léčba srdečního selhání ve starším věku. Interní Med 2008; 10(5): 212 – 215.
7. Špinar J, Hradec J, Špinarová L et al. Summary of the 2016 ESC Guidelines on the diagnosis and treatment of acute and chronic heart failure. Prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58: e530 – e568.
8. Špinar J, Vítovec J. Srdeční selhání ve starším věku. Česká geriatrická revue 2004; 2 : 24 – 30.
9. Widimský J, Špinar J. Nedostatky léčby srdečního selhání v Evropě. Zaostává klinická praxe za evropskými směrnicemi? Zaostává Česká republika za Evropou? Cor Vasa 2003; 45(10): 481 – 485.
10. Widimský J, Lánská V, Magulová D et al. Průzkum stavu aktuální praxe diagnostiky a léčby srdečního selhání v ordinacích všeobecných lékařů v České a Slovenské republice v roce 1999. 2. část programu IMPROVEMENT of HF. Cor Vasa 2001; 43 : 345 – 352.
11. Lábr K, Špinar J, Pařenica J et al. Betablokátory v registru chronického srdečního selhání FAR NHL. Kardiol Rev Int Med 2017; 19(1): 68 – 72.
12. McMurray JJ, Packer M, Desai AS et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Eng J Med 2014; 371(11): 993 – 1004. doi: 10.1056/ NEJMoa1409077.
13. Špinar J, Špinarová L, Vítovec J. Studie PARADIGM-HF možná změní léčbu srdečního selhání. Hypertenze a kardiovaskulární prevence 2014; 2(3): 25 – 26.
14. Cleland JF, Tendera M, Adamus J et al. On behalf of PEP-CHF investigators. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27(19): 2338 – 2345. doi: 10.1093/ eurheartj/ ehl250.
15. Goncalvesová E et al. Zlyhávanie srdca. Bratislava: ProLitera 2016.
16. Zinman B, Wanner C, Lachin JM et al. The EMPA-REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Eng J Med 2015; 373(22): 2117 – 2128. doi: 10.1056/ NEJMoa1504720.
17. Gřiva M, Loučka M, Štastný J. Palliative care in cardiology. Cor Vasa 2015; 57: e39 – e44.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2018 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Srdeční selhání ve stáří
- Léčba arteriální hypertenze u starších osob
- Polyfarmakoterapie ve stáří – lékové interakce nejčastěji předepisovaných lékových skupin v kardiologii
- Chronické srdeční selhání a paliativní péče
- Tyreopatie ve stáří a kardiovaskulární postižení
- Přínosy a rizika profylaxe tromboembolické nemoci u geriatrického pacienta
- Imunosenescence a infekční komplikace vyššího věku
- Závratě a pády jako častá symptomatologie kardiovaskulárního postižení ve vyšším věku
- Duální inhibice AT1 receptoru pro angiotenzin II a neprilysinu nebo inhibice angiotenzin konvertujícího enzymu?
-
Stručný komentář k novým doporučením pro léčbu hypertenze v USA
2017 ACC/ AHA High Blood Pressure Guideline - Specifika diagnostiky a léčby ve stáří
- Dapagliflozin a studie DECLARE – vstupní charakteristika
- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
- Zvýšená hladina NP u stabilních pacientů 3 měsíce po STEMI je jednoduchý nástroj k predikci dlouhodobé nepříznivé prognózy
- Klinická kardiologie (3. vyd.)
- Zpráva z akce – ACC 2018 v Orlandu
- Zemřel prof. MUDr. Roman Čerbák, CSc., FESC *19. 10. 1933 – †4. 3. 2018
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
- Specifika diagnostiky a léčby ve stáří
- Srdeční selhání ve stáří
- Tyreopatie ve stáří a kardiovaskulární postižení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



