-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aplikace molekulární diagnostiky kardiomyopatií v pediatrické praxi
Application of molecular diagnostics of cardiomyopathies in paediatric practice
Inherited cardiomyopathies are one of the most common cardiovascular diseases. Recently, genetic examination has become part of the diagnostics of these conditions. More than 80 genes are known to be associated with cardiomyopathies and according to the latest research, their pathogenesis overlaps with channelopathies. The range of examined genes has been expanded using modern molecular genetic methods. Nowadays, there are 97 genes associated with cardiomyopathies analysed simultaneously in our laboratory. New sequencing methods extended the possibilities of molecular diagnostics of patients with cardiomyopathy as well as identification of pre-symptomatic individuals in families. Regular cardiologic check-ups are scheduled for both children with inherited suspicious variants and relatives of subjects without clear genetic foundation.
Keywords:
cardiomyopathy – molecular diagnostics – genetics – paediatrics
Autoři: L. Skutková 1; D. Humlová 1,2; J. Kadlecová 3
Působiště autorů: Pediatrická klinika LF MU a FN Brno 1; Centrum kardiovaskulární a transplantační chirurgie, Brno 2; Cytogenetická laboratoř Brno, s. r. o. 3
Vyšlo v časopise: Kardiol Rev Int Med 2016, 18(4): 268-271
Souhrn
Dědičné typy kardiomyopatií patří k nejčastějším dědičným vadám kardiovaskulárního systému. V posledních letech se genetické vyšetření stává součástí diagnostiky těchto onemocnění. Je známo více než 80 genů, které jsou se vznikem kardiomyopatií asociovány, a dle nejnovějších poznatků se jejich patofyziologický podklad překrývá s podstatou kanalopatií. Pomocí moderních molekulárně-genetických metod se rozšířilo spektrum vyšetřovaných genů a v naší laboratoři je v současné době vyšetřováno zároveň 97 genů zavzatých do patogeneze těchto onemocnění. Na základě molekulárně genetické diagnostiky je možné upřesnit diagnózu u pacientů s kardiomyopatií a především identifikovat presymptomatické jedince v rodině. Děti, které zdědily suspektní variantu, jsou pravidelně kardiologicky sledovány stejně tak jako příbuzní probandů, u kterých nebyla genetická podstata onemocnění objasněna.
Klíčová slova:
kardiomyopatie – molekulární diagnostika – genetika – pediatrieÚvod
Kardiomyopatie jsou charakterizované poruchou funkce nebo struktury srdečního svalu. Jedná se o heterogenní skupinu onemocnění s různými klinickými příznaky, které se často vyvíjí pomalu a v konečném stadiu mohou vést k srdečnímu selhání (SS). Jsou také známým rizikovým faktorem pro náhlou srdeční smrt, typicky u mladých sportovců. Onemocněním jsou častěji postiženi dospělí, může se však projevit v jakémkoli věku. V pediatrické populaci je maximum výskytu ve skupině dětí do jednoho roku věku a poté v pubertě.
Podle etiologie lze kardiomyopatie rozdělit na primární a sekundární. U sekundárních typů je postižení srdce důsledkem jiného onemocnění nebo působením toxických látek. V dětském věku jsou to často kardiomyopatie spojené s infekcí, vrozenými srdečními vadami, chemoterapií, svalovými dystrofiemi nebo endokrinními poruchami. Vyskytují se také u vzácných metabolických poruch, např. u některých střádavých onemocnění a mitochondriálních vad, nebo jako součást genetických syndromů, např. Noonanův, Carvajalův či Barthův syndrom.
U primárních forem je příčina nejasná a často se jedná o dědičná onemocnění. V tomto článku budou popsány současné možnosti genetického vyšetření dědičných typů kardiomyopatií a na vybrané kazuistice bude ukázán příklad interpretace výsledků molekulárně-genetické analýzy.
Genetika dědičných kardiomyopatií
Dědičné typy kardiomyopatií patří k nejčastějším dědičným vadám kardiovaskulárního (KV) systému. Jejich výskyt je často familiární, kdy se onemocnění projevuje v několika generacích postižené rodiny, existují však i sporadické formy s de novo mutací u probanda. Familiární kardiomyopatie jsou většinou monogenní, autozomálně dominantně dědičná onemocnění. Jsou ale známy i formy autozomálně recesivní, X-vázané a typy s maternální dědičností [1].
Tato skupina onemocnění je známá vysokou fenotypovou a genetickou variabilitou. To znamená, že stejný fenotyp může být podmíněn velkým počtem různých mutací a na druhou stranu mutace ve stejném genu mohou vést k různým projevům onemocnění srdečního svalu i k různým typům kardiomyopatií. Stejná genová mutace u jednoho pacienta může být maligní s vysokým rizikem náhlé srdeční smrti, u jiného pacienta se nemusí projevit vůbec. To ukazuje na multifaktoriální příčinu vzniku tohoto onemocnění, vč. vlivu prostředí [2]. Svou roli na penetranci hraje i věk nemocného. Konkrétní kauzální mutace jsou v populaci většinou velmi vzácné a jsou privátní pro danou rodinu. Proto není užitečný screening známých mutací, ale je nutné se zaměřit na celé geny.
V poslední době se ukazuje, že genetický a patofyziologický podklad dědičných kardiomyopatií se ve značné míře překrývá s podstatou dědičných forem srdečních arytmií – kanalopatií, jako např. syndrom short QT, syndrom long QT, Brugada syndrom, syndrom časné repolarizace, katecholaminergní polymorfní ventrikulární tachykardie a některé případy syndromu náhlého úmrtí kojence [3,4].
Současné možnosti molekulární diagnostiky kardiomyopatií
S dědičným typem kardiomyopatií je asociováno více než 80 různých genů s vysokou variabilitou a různou penetrancí. Vzhledem k této značné genetické heterogenitě byla do nedávné doby diagnostika kardiomyopatií na molekulární úrovni velice omezená. S příchodem technologie masivního paralelního sekvenování se otevřela možnost analyzovat současně velký počet genů za krátkou dobu a ve srovnání s klasickým sekvenováním za relativně nízkou cenu a s dobrým diagnostickým přínosem.
Od počátku roku 2016 byla molekulárně-genetická diagnostika kardiomyopatií a kanalopatií v Cytogenetické laboratoři Brno, s. r. o., sloučena a u pacientů s těmito diagnózami je analyzováno 97 vybraných genů, které jsou v souvislosti s rozvojem těchto onemocnění nejčastěji popisovány. K vyšetření jsou indikováni pacienti s prokázanou kardiomyopatií nebo s pozitivní rodinnou anamnézou. Všichni podstoupí vyšetření klinickým genetikem a je sestaven rodokmen probanda. Po poučení o vyšetření a po podepsání informovaného souhlasu ke genetickému testování je proveden odběr periferní krve a izolace DNA z lymfocytů k molekulárně-genetickému vyšetření. Následně je cíleně sekvenováno 97 genů zapojených do patogeneze kardiomyopatií a kanalopatií metodou sekvenování nové generace (next generation sequencing – NGS). Klinický význam nalezených variant je hodnocen na základě jejich četnosti v populaci, vlivu varianty na výsledný protein, výstupů z predikčních programů a informací z mezinárodních databází a vědeckých publikací. Podle klinického významu jsou nalezené varianty DNA rozděleny na základě směrnic The American College of Medical Genetics and Genomics (ACMG) do pěti tříd: patogenní, potenciálně patogenní, varianty nejasného významu (variant of unknown significance – VOUS), potenciálně benigní a benigní [5].
Suspektní mutace se ověřují klasickým Sangerovým sekvenováním z nezávislého odběru vzorku z bukálního stěru. V případě zjištění pravděpodobné kauzální mutace u probanda se provádí segregace mutace v rodině.
Kazuistika chlapce s familiární formou dilatační kardiomyopatie
Tato kazuistika pojednává o 15letém chlapci s pozitivní rodinnou anamnézou na dilatační kardiomyopatii (DCM). Jeho matka má projevy DCM od 31 let, matka matky zemřela v důsledku DCM ve 29 letech, bratr matky zemřel na DCM v 33 letech, sestra matky zemřela na DCM ve 42 letech, její syn podstoupil v 33 letech transplantaci srdce. Pacient má dva bratry, starší je po transplantaci srdce ve 14 letech, druhý byl na vyšetření ve 20 letech asymptomatický. Otec a příbuzenstvo z jeho strany jsou bez srdečních potíží. Chlapec chodil do deváté třídy základní školy, měl průměrný prospěch, hrál florbal a stolní tenis. Byl pravidelně preventivně sledován na kardiologii. Ve 14 letech byl zjištěn pokles ejekční frakce (EF) o 20 % a současně byly přítomny známky dekompenzovaného pravostranného srdečního selhávání (dyspepsie, malý pleurální a perikardiální výpotek). Byla zahájena léčba chronického SS. Jeho stav rychle progredoval, za dva měsíce byla EF levé komory 20 %, na ultrazvuku srdce byla patrná těžká systolická i diastolická dysfunkce levé i pravé komory, středně významná mitrální regurgitace, významná trikuspidální regurgitace a plicní hypertenze. Pacient byl zařazen na urgentní waiting list k transplantaci srdce. Krátce nato mu byl z důvodu běhu nesetrvalých komorových tachykardií implantován kardioverter-defibrilátor (ICD). Postupně byla nutná intermitentní a poté i kontinuální intravenózní podpora inotropiky a diuretiky. Za pět měsíců od prvních klinických příznaků DCM podstoupil chlapec transplantaci srdce.
Vzhledem k pozitivní rodinné anamnéze a jisté familiární formě DCM bylo indikováno genetické vyšetření, sestaven rodokmen (obr. 1) a byla provedena mutační analýza 46 genů asociovaných s kardiomyopatií pomocí NGS. Byla aplikována metodika s využitím kytu TruSightCardiomyopathy. V analyzovaném vzorku bylo detekováno celkem 68 variant, které vyhovovaly filtru pokrytí (coverage) minimálně 20× a frekvenci varianty min. 20 %. Podle předpokládaného klinického významu byly varianty rozděleny na jednu potenciálně patogenní variantu, devět variant nejasného významu, dvě potenciálně benigní a 56 benigních variant.
Obr. 1. Rodokmen rodiny s výskytem dilatační kardiomyopatie (DCM). Červeně označení jedinci s klinickými projevy DCM, modře nositelé patogenní varianty v <i>LMNA</i> genu a zeleně jedinci po ortotopní transplantaci srdce. 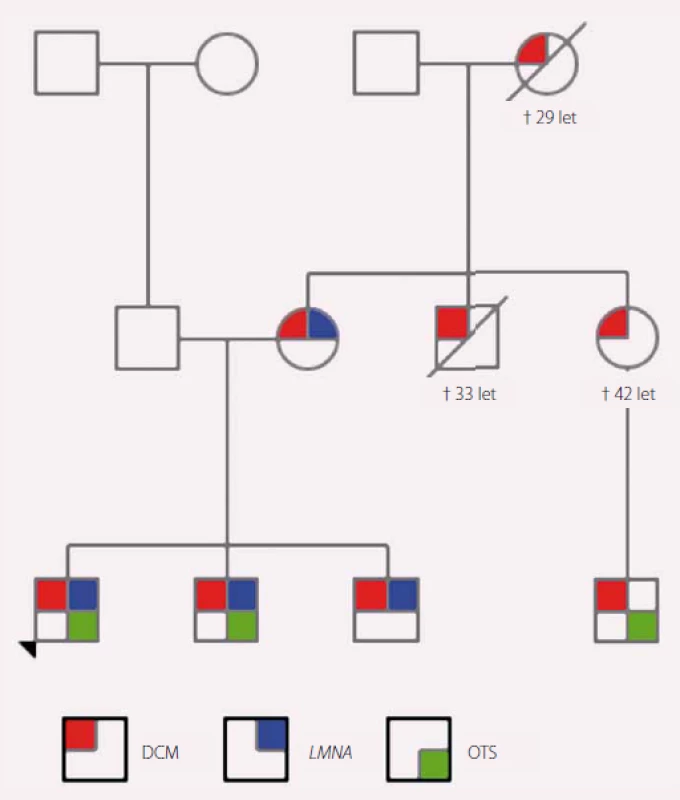
Jako potenciálně patogenní byla klasifikována varianta v genu LMNA, (chromozom 1): NM_170707.3:c.1621C>T, NP_733821.1:p.Arg541Cys, genotyp c.[1621C>T]+[=], typ mutace missense. Podle výsledku predikčních programů SIFT a PolyPhen je tato varianta v heterozygotním stavu klasifikována jako potenciálně patogenní (deleterious(0):SIFT/ probably damaging(1):PolyPhen). V literatuře již byla tato změna popsána jako varianta asociovaná se segmentální akinezou/ dyskinezou svaloviny levé komory [6] a elektrokardiografickými abnormalitami (neurčená intraventrikulární blokáda, patologický Q kmit, ventrikulární arytmie) [7]. Patogenita byla potvrzena transfekcí u experimentálních myoblastů [7].
Výsledek z NGS u našeho pacienta byl verifikován Sangerovým sekvenováním (obr. 2) a bylo doporučeno testování i přímých příbuzných. Postupně byli vyšetřeni oba bratři a matka. U všech byla nalezena stejná sekvenční změna. Mladší bratr byl v době vyšetření probanda bez echokardiografických známek DCM, na kontrole za 12 měsíců již byla zjištěna snížená EF levé komory. Vzhledem k rodinné anamnéze, pozitivitě molekulárně-genetického vyšetření a dostupných informací o této variantě lze předpokládat progresivní průběh DCM i u tohoto pacienta.
Obr. 2. Výstup z analýzy varianty c.1621 > T v genu <i>LMNA</i> Sangerovým sekvenováním (šipkou je vyznačena daná varianta u pacienta – horní obrázek, na spodním obrázku je sekvence bez této varianty (wild type). 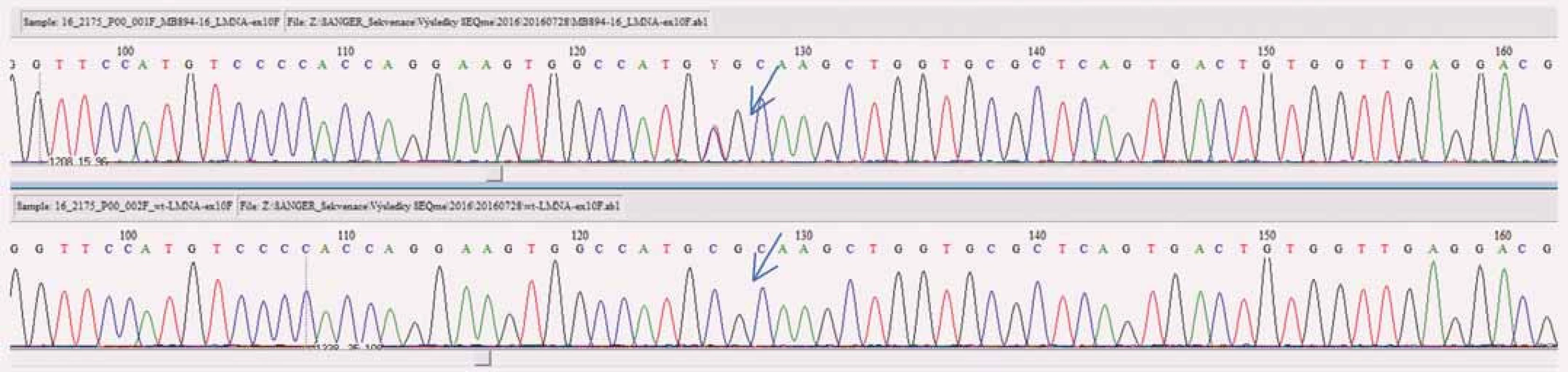
Tato kazuistika je příkladem rodiny, kde byla nalezena mutace, která již byla v databázích popsána v asociaci s onemocněním. Pomocí sestavení rodokmenu a následné segregační analýzy pokrevních příbuzných byla její kauzalita v tomto případě potvrzena.
V současné době probíhá vyšetření dalších přímých příbuzných k detekci presymptomatických jedinců nebo naopak k vyloučení nosičství patogenní varianty.
Závěr
V posledních letech vzrůstá význam molekulárně-genetického vyšetření u nemocných trpících různými typy kardiomyopatií a jejich rodin. Toto vyšetření upřesňuje diagnózu a v některých případech i prognózu a pomáhá určit riziko výskytu onemocnění u příbuzných. S přihlédnutím k převážně autozomálně dominantnímu typu dědičnosti, tedy 50% riziku přenosu na potomky, by měli být vyšetřeni všichni příbuzní probanda z první, druhé a třetí generace. U všech by mělo být provedeno kardiologické vyšetření zahrnující fyzikální vyšetření, echokardiografii, EKG, v indikovaných případech další pomocné metody jako MR, ergometrie, Holterovo monitorování a podobně. Příbuzní by také měli podstoupit genetické poradenství. Pokud je odhalena mutace nebo více variant odpovědných za dané onemocnění, je možné provést molekulární diagnostiku i u příbuzných a zahájit včasnou profylaktickou terapii. Při negativním výsledku u příbuzného lze naopak pacienta vyřadit ze sledování.
Analýza 97 genů zapojených do patogeneze kardiomyopatií a kanalopatií metodou NGS pomohla rozšířit možnosti molekulárně genetického testování. Přesto se u některých pacientů nepodaří nalézt patologickou variantu asociovanou s onemocněním. To je dáno velkou genetickou heterogenitou této klinické jednotky a možností výskytu změn v genech, které nejsou zavzaté do vyšetřovacího panelu. Příbuzní probandů, u kterých se nenašla genetická podstata jejich nemoci, by i při negativitě vstupního klinického vyšetření měli zůstat v pravidelném preventivním kardiologickém sledování. U dětí a mladých dospělých do 20 let s pozitivní rodinnou anamnézou doporučujeme klinické kontroly s nasnímáním EKG a echokardiografií jednou za 12–18 měsíců, u jedinců starších 20 let min. jednou za pět let. Doporučený vyšetřovací algoritmus je schematicky znázorněn na obr. 3.
Obr. 3. Doporučený algoritmus vyšetřování příbuzných pacienta s dědičným typem kardiomyopatie (KMP). 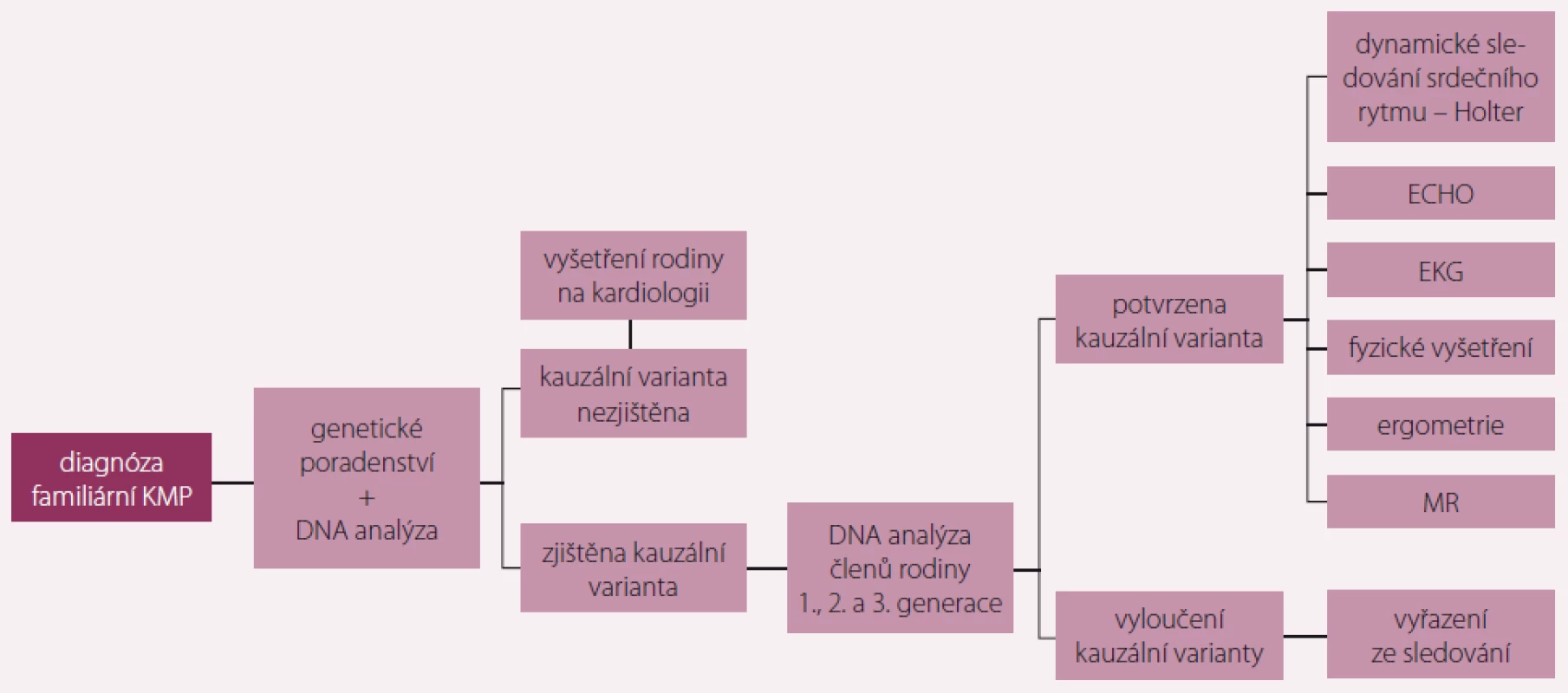
Doručeno do redakce: 29. 9. 2016
Přijato po recenzi: 13. 10. 2016
MUDr. Linda Skutková
www.fnbrno.cz
Zdroje
1. Cahill TJ, Ashrafian H, Watkins H. Genetic cardiomyopathies causing heart failure. Circ Res 2013; 113(6): 660 – 675. doi: 10.1161/ CIRCRESAHA.113.300282.
2. Ashrafian H, Watkins H. Reviews of translational medicine and genomics in cardiovascular disease: new disease taxonomy and therapeutic implications cardiomyopathies: therapeutics based on molecular phenotype. J Am Coll Cardiol 2007; 49(12): 1251 – 1264.
3. Tfelt-Hansen J, Winkel BG, Grunnet M et al. Cardiac channelopathies and sudden infant death syndrome. Cardiology 2011; 119(1): 21 – 33. doi: 10.1159/ 000329047.
4. Ackerman MJ, Priori SG, Willems S et al. HRS/ EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm 2011; 8(8): 1308 – 1339.
5. Richards S, Aziz N, Bale S et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 2015; 17(5): 405 – 423. doi: 10.1038/ gim.2015.30.
6. Saj M, Bilinska ZT, Tarnowska A et al. LMNA mutations in Polish patients with dilated cardiomyopathy: prevalence, clinical characteristics, and in vitro studies. BMC Med Genet 2013; 14 : 55. doi: 10.1186/ 1471-2350-14-55.
7. Małek ŁA, Labib S, Mazurkiewicz Ł. A new c1621 C > G, p.R541G lamin A/ C mutation in a family with DCM and regional wall motion abnormalities (akinesis/ dyskinesis): genotype - phenotype correlation. J Hum Genet 2011; 56(1): 83 – 86. doi: 10.1038/ jhg.2010.137.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2016 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Rok 2016 – rok srdečního selhání
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání -
Komentář k Doporučeným postupům ESC/ ČKS
Farmakoterapie srdečního selhání -
Komentář k Doporučeným postupům ESC/ ČKS
Poruchy srdečního rytmu a přidružená onemocnění -
Komentář k Doporučeným postupům ESC/ ČKS
Akutní srdeční selhání - Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
- MikroRNA v kardiologii – přehled pro klinickou praxi
- Aplikace molekulární diagnostiky kardiomyopatií v pediatrické praxi
- Železo a ateroskleróza
- Léčba hypertenze starších nemocných
- Duální inhibice receptoru angiotenzinu a neprilysinu – revoluční princip léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Lipertance® – dva problémy, jedno řešení
- Co zaznělo na kongresu AHA 2016 v New Orleans
- Kongres International Society of Hypertension 2016 Soul
- Srdíčkáři zdolali Praděd
-
Z kongresu Evropské kardiologické společnosti
Léčba hypertenze – kombinace jako klíč k úspěchu - 10 let sitagliptinu – účinná léčba s minimem komplikací
- Apremilast – dlouhodobě bezpečný v léčbě psoriázy a psoriatické artritidy
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání - Léčba hypertenze starších nemocných
- Lipertance® – dva problémy, jedno řešení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



