-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
Role of echocardiography in the assessment of aortic stenosis and mitral regurgitation
Valvular heart disease represents an important cause of cardiovascular morbidity and mortality. In European countries, aortic stenosis and mitral regurgitation are the most frequent valvular diseases. Echocardiography is the most important method for their quantification. Measurement of the jet velocity across the aortic valve, measurement of the mean transaortic gradient and the assessment of valve area by the continuity equation are standard parameters for the quantification of the aortic stenosis severity. For quantification of mitral regurgitation severity, measurement of vena contracta and the PISA method are used. Assessment of the impact of the valvular disease on the heart chambers is very important as well. In the evaluation of a patient for valvular intervention, echocardiography is one of a number of modalities. It is also important to assess the patient´s symptoms, comorbidities and wishes.
Keywords:
echocardiography – aortic stenosis – mitral regurgitation
Autoři: L. Koc 1; T. Zatočil 1; J. Špinar 1,2
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(2): 136-140
Kategorie: Kardiologická revue
Souhrn
Chlopenní vady se významnou měrou podílejí na celkové kardiovaskulární morbiditě a mortalitě. V evropských zemích se nejčastěji vyskytuje aortální stenóza a mitrální regurgitace. Echokardiografie je nejdůležitější metodou k jejich kvantifikaci. Měření rychlosti toku přes aortální chlopeň, měření středního tlakového gradientu mezi levou komorou a aortou a výpočet plochy ústí aortální chlopně jsou standardní parametry ke kvantifikaci tíže aortální stenózy. Ke kvantifikaci tíže mitrální regurgitace pak používáme měření veny contracty a metodu PISA. Neméně důležité je posouzení vlivu chlopenního onemocnění na ostatní srdeční oddíly. U indikace operačního řešení chlopenní vady však nezáleží pouze na echokardiografickém nálezu, zásadní je komplexní posouzení symptomů, komorbidit a přání pacienta.
Klíčová slova:
echokardiografie – aortální stenóza – mitrální regurgitaceÚvod
Chlopenní vady představují důležitou jednotku podílející se na celkové kardiovaskulární morbiditě a mortalitě. Literatura uvádí, že prevalence středně významných a významných chlopenních vad v evropské a severoamerické populaci činí 2,5 % [1]. Suverénní roli v hodnocení chlopenních vad hraje echokardiografie. Umožňuje potvrzení diagnózy chlopenní vady, kvantifikaci její tíže a posouzení vlivu na ostatní srdeční oddíly. Následující text podává přehled o principech metod používaných ke kvantifikaci nejčastějších chlopenních vad vyskytujících se v našich podmínkách – aortální stenózy a mitrální regurgitace. Důraz je kladen zejména na limitace jednotlivých metod a na nejčastější chyby a nepřesnosti, které mohou ovlivnit správnost měření.
Aortální stenóza
Aortální stenóza (AS) vznikající na podkladě kalcifikací chlopně je v rozvinutých zemích nejčastější chlopenní vadou [2 – 3]. U mladších pacientů je častější stenóza na bikuspidální aortální chlopni, ta navíc bývá spojena s významnou dilatací ascendentní aorty [4]. Obstrukce na supra ‑ a subvalvární úrovni je vzácná a vzniká nejčastěji kongenitálně [5 – 6]. Lokalizaci obstrukce rozpoznáme zobrazením turbulentních toků při vyšetření barevným dopplerovským mapováním (color flow mapping – CFM) nebo zjištěním akcelerace rychlosti v zúženém místě při pulzním způsobu dopplerovského vyšetření (pulse wave – PW). Revmatické postižení chlopně, které v celosvětovém měřítku (tedy převážně v rozvojových zemích) převažuje, se od degenerativního postižení liší morfologicky. Při revmatickém postižení dochází k fúzování komisur při bazích, spotřebování cípů ve středu, a ústí má tak tvar zmenšujícího se trojúhelníku. Při degenerativním postižení se kalcifikace nachází zejména v anulu a při volných okrajích cípů, čímž brání jejich plnému otevírání, i když k samotnému fúzování cípů nedochází. Ústí má tak typicky hvězdicovitý tvar [7].
Ke kvantifikaci AS se standardně používá měření rychlosti toku přes aortální chlopeň, měření středního tlakového gradientu mezi levou komorou a aortou a výpočet plochy ústí stenoticky změněné aortální chlopně [8].
Rychlost toku přes aortální chlopeň měříme pomocí dopplerovského vyšetření – kontinuálním způsobem (continual wave – CW), nejčastěji z apikální projekce [9]. Pro těžkou AS svědčí rychlost toku > 4 m/ s, již tvar získané rychlostní křivky nám však umožní odhadnout tíži AS. Zatímco lehké stenózy mají vrcholový gradient v časné systole a tvar křivky je trojúhelníkovitý, u těžké stenózy je křivka zaoblená, souměrná, s maximem ve střední systole (obr. 1) [7]. Tvar křivky nám také umožní odlišit dynamickou obstrukci výtokového traktu levé komory, která může vzniknout při hypertrofické kardiomyopatii. Zde při postupném vyprazdňování levé komory během ejekční fáze dochází ke vzrůstající obstrukci výtokového traktu, a tím k vzestupu tlakového gradientu, jehož vrchol se tak posouvá do pozdní systoly s typickým obrazem rychlostní křivky (obr. 2) [10].
Obr. 1. Zobrazení průtoku přes těžkou aortální stenózu CW Dopplerem. 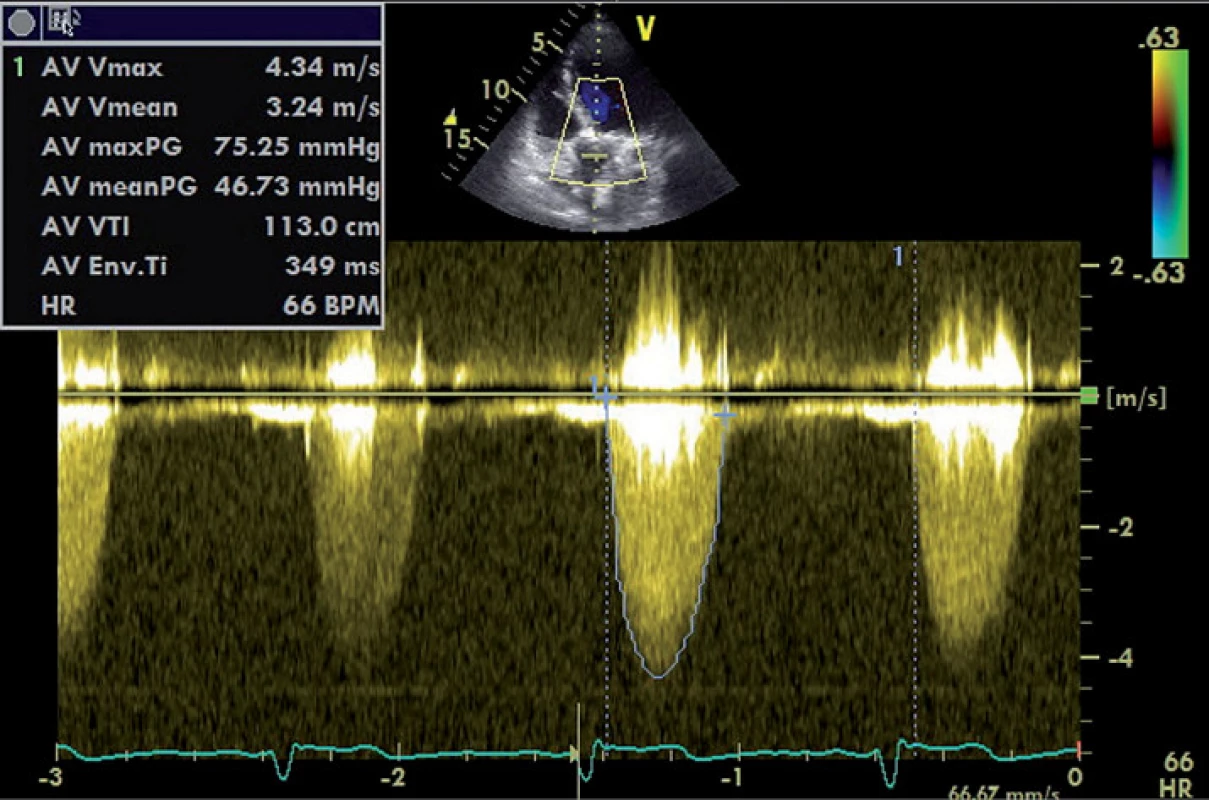
Obr. 2. Zobrazení průtoku CW Dopplerem při obstrukci LVOT u nemocného hypertrofickou kardiomyopatií. 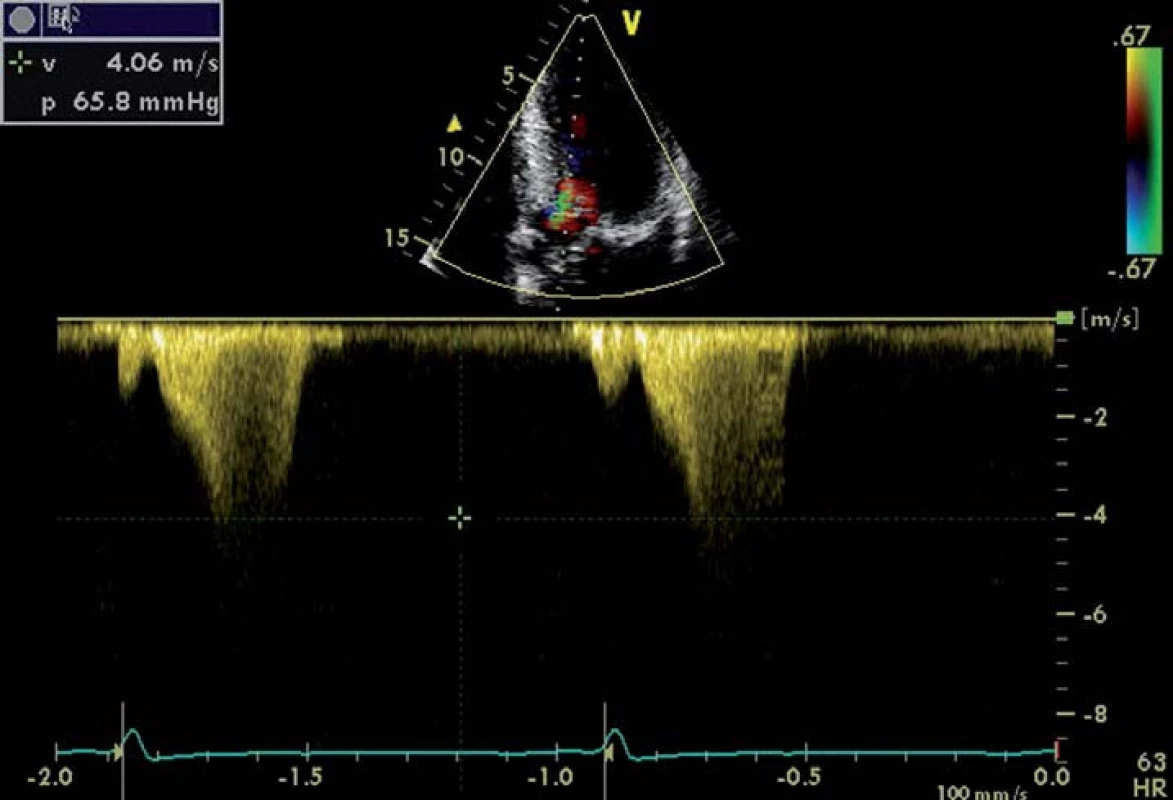
Při měření je třeba dbát, aby incidenční úhel, který svírá linie dopplerovského kurzoru s průtokem, byl co nejmenší. Pokud překročí hodnotu 15°, dochází již k významnému podhodnocení naměřené rychlosti, a tím k podhodnocení vady [11]. Dále si musíme být jisti, že při CW vyšetření opravdu zaznamenáváme tok přes aortální chlopeň. Vzhledem k anatomickým poměrům lze místo toku přes aortální chlopeň zaznamenat regurgitační tok při nedomykavosti mitrální chlopně. K potvrzení správného místa nám pomůže CFM vyšetření. Vždy je také třeba vybrat reprezentativní vzorek, což může být obtížné zejména při nepravidelném srdečním rytmu. Při předčasném stahu budou naměřené hodnoty nižší vzhledem k nižšímu preloadu a naopak. Takto vzniklé chyby lze minimalizovat vyhodnocením více stahů a jejich zprůměrováním [7].
Z rychlosti proudění přes aortální chlopeň lze pomocí zjednodušené Bernoulliho rovnice ∆P = 4v2 vypočítat rozdíl tlaků (tlakový gradient) mezi levou komorou a aortou [12]. Vypočítaná hodnota maximálního tlakového gradientu oproti změřené maximální rychlosti proudění nenese novou informaci. Tou je až hodnota gradientu středního, která představuje průměr okamžitých gradientů během ejekční fáze. Je vypočítán automaticky přístrojem po obtažení rychlostní křivky. Pro těžkou AS svědčí gradient > 40 mm Hg [8].
Nepřesnosti, kterých se při hodnocení tlakového gradientu můžeme dopustit, jsou shodné s nepřesnostmi uvedenými při hodnocení rychlostního toku, jsou ale zvýrazněné vzhledem k tomu, že naměřená rychlost toku je při výpočtu tlakového gradientu umocněna na druhou.
Jak již bylo zmíněno, výše uvedená měření jsou závislá na tocích přes aortální chlopeň, jsou tedy ovlivněna např. náplní cévního řečiště či funkcí levé komory. Kalkulovaná plocha aortálního ústí (aortic valve area – AVA) je faktor na zmíněných podmínkách do jisté míry nezávislý [13]. Kalkulace je založena na platnosti rovnice kontinuity – předpokladu, že tepový objem procházející výtokovým traktem levé komory se shoduje s tepovým objemem krve procházejícím přes aortální ústí. Tepový objem vypočítáme vynásobením integrálu rychlosti proudění v průběhu jeho trvání (velocity time interval – VTI) s plochou průřezu v místě měření. VTI přístroj vypočítá automaticky po obtažení rychlostní křivky. Pro kalkulaci AVA tedy potřebujeme zjistit tři parametry – rychlost toku přes aortální chlopeň, rychlost toku ve výtokovém traktu levé komory (left ventricle outflow tract – LVOT) a plochu LVOT. Měření rychlosti toku přes aortální chlopeň pomocí CW Dopplera bylo zmíněno výše (obr. 1). Průměr LVOT měříme co nejblíže aortálního anulu, ve střední fázi systoly, mezi endokardem septa a předním cípem mitrální chlopně (obr. 3). Předpokládáme, že má tvar kruhu, jeho plochu tedy vypočítáme podle známého vzorce plocha LVOT = π(D/2)2. Rychlost toku ve LVOT měříme pomocí PW Dopplera ve stejném místě, ve kterém byl změřen průměr LVOT, ideálně v oblasti aortálního anulu (obr. 4). Z naměřených veličin pak plochu aortálního ústí vypočítáme podle vzorce AVA = (Plocha LVOT × VT1LVOT) / / VT1 AVA [13].
Obr. 3. Měření průměru LVOT (rozměr 1) a rozměrů aorty (rozměry 2–4). 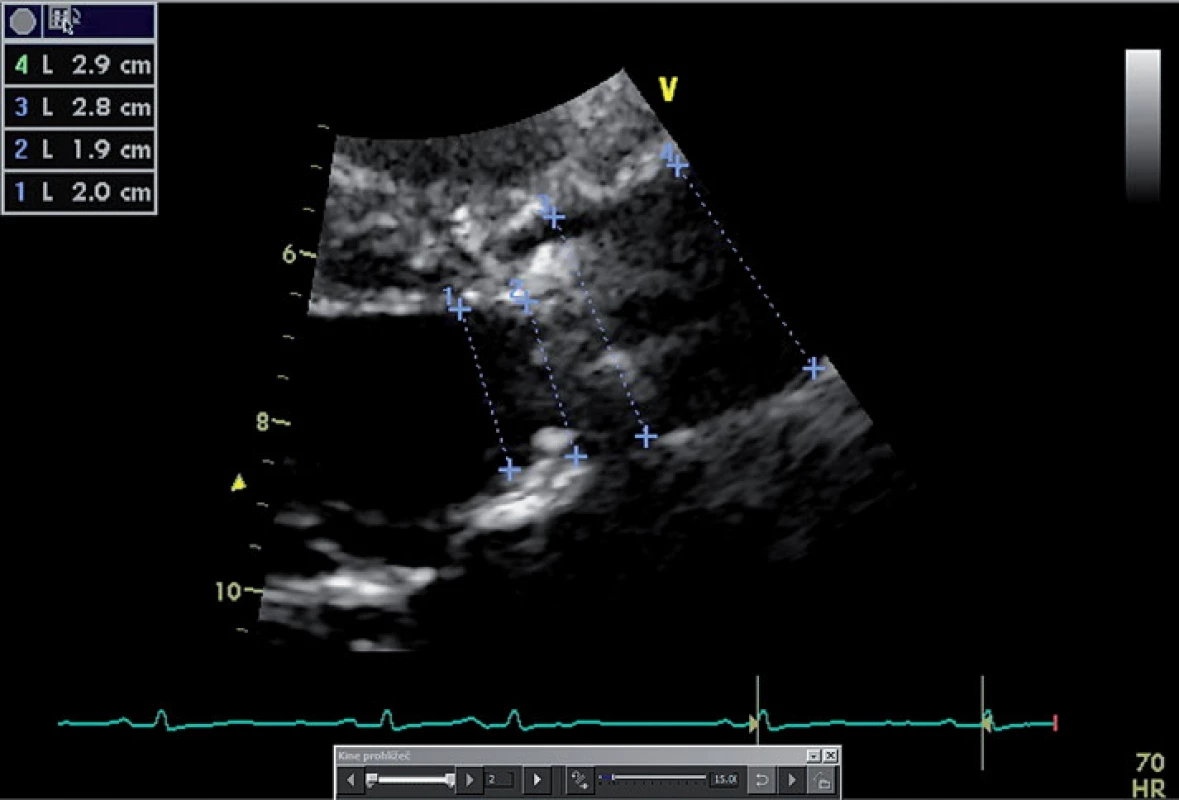
Obr. 4. Zobrazení průtoku přes LVOT PW Dopplerem. 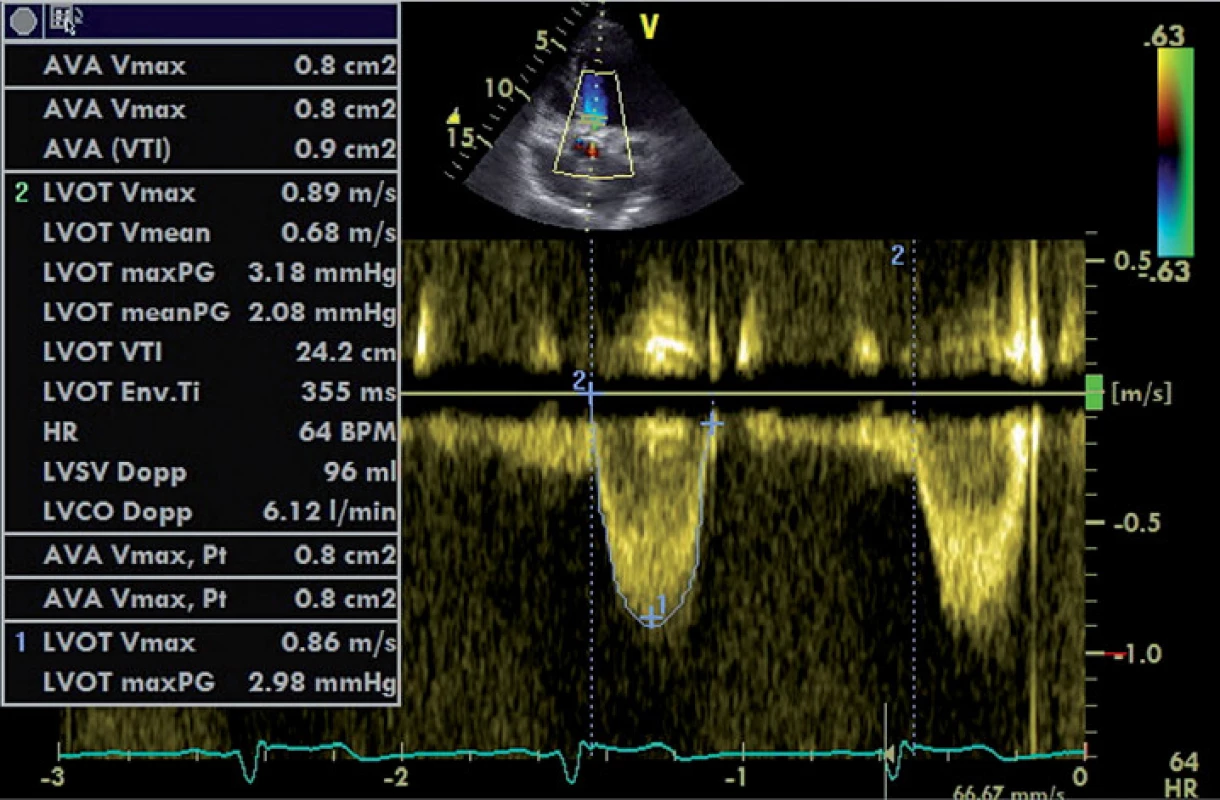
Celková chyba při kalkulaci je závislá na chybě provedené při každém měření, přičemž nejobtížněji se jeví správné určení plochy LVOT. Průměr LVOT je třeba měřit ve stejném místě, v němž byl změřen rychlostní tok PW Dopplerem, ideálně v oblasti aortálního anulu. Přesnost měření rychlosti PW Dopplerem předpokládá laminární proudění, což oblast aortálního anulu ve většině případů nesplňuje. Měření je tedy nutné posunout apikálně. Zde se ovšem okrouhlý tvar LVOT stává více eliptickým, což může ovlivnit výsledek výpočtu ve smyslu podhodnocení tíže vady. Zjištěná hodnota průměru LVOT je dále umocněna na druhou, pokud tedy byla změřena nepřesně, chyba v kalkulaci se nadále zvyšuje [7]. Jako těžkou hodnotíme AS při ploše ústí < 1 cm2. Pokud plochu ústí vztahujeme k ploše povrchu těla (body surface area – BSA), což je výhodné zejména u jedinců s nízkým BSA, jako významnou hodnotíme AS při hodnotě < 0,6 cm2/ m2 [8].
Hodnoty získané při využití výše uvedených metod je třeba brát v kontextu celkového echokardiografického obrazu, jelikož přidružené srdeční abnormality měření ovlivňují. Například při významné aortální regurgitaci se vlivem návratu určitého objemu z aorty do levé komory zvyšují toky přes aortální chlopeň, což vede ke zvýšení rychlostních toků a tlakových gradientů. Naopak při současné mitrální regurgitaci se při systole část náplně levé komory vrací zpět do levé síně, tok přes aortální chlopeň je snížen a tíže aortální stenózy může být podhodnocena.
Zvláště obtížné je pak hodnocení významnosti AS u jedinců s dysfunkcí levé komory. Zde je při nálezu středně významné AS nesnadné odlišit, zda se opravdu jedná o vadu, která nedosahuje hemodynamické významnosti, nebo jde o AS významnou, avšak dysfunkční komora již není schopna vytvořit dostatečný tlakový gradient [7].
Mitrální regurgitace
Mitrální regurgitace je v evropských zemích druhou nejčastější chlopenní vadou vyžadující chirurgické řešení [1]. Může se jednat buď o organické (primární) postižení chlopně, nebo je regurgitace funkční (sekundární). V rámci primárního postižení chlopně se v našich podmínkách nejčastěji vyskytují vady degenerativní etiologie, dále prolaps chlopně různých etiologií a poškození (dysfunkce způsobená ischemií, perforací, rupturou, utržením) jednotlivých částí chlopně (papilární sval, šlašinky, cípy) při zánětech či infarktu. Při sekundárním postižení k regurgitaci nedochází kvůli poškození chlopně samotné, ale vlivem dilatace mitrálního anulu při dilatační kardiomyopatii či ischemické chorobě srdeční [14].
K potvrzení diagnózy mitrální regurgitace (MR) a hrubému odhadu její tíže slouží CFM dopplerovské vyšetření. Detekce širokých excentrických toků sahajících po zadní stěnu levé síně predikuje těžkou vadu, naopak drobné, úzké toky zasahující pouze těsně pod mitrální chlopeň obvykle značí vadu nevýznamnou. I při těžké MR se však objem regurgitačního toku nemusí jevit významný, např. vlivem vysokého tlaku v levé síni či při přítomnosti excentrického toku šířícího se při stěnách síně [15]. Proto by se vyšetření CFM Dopplerem nemělo ke kvantifikaci vady používat a při nálezu toku, který není na první pohled zcela nevýznamný, bychom měli přistoupit k přesnějším metodám.
Prvním z nich je měření vena contracta. Vena contracta je nejužší část regurgitačního toku těsně pod mitrální chlopní (obr. 5). Vzhledem k tomu, že regurgitační ústí nemá tvar dokonalého kruhu, je třeba ji měřit pokud možno ze dvou rovin, přičemž bereme v potaz nejvyšší naměřenou hodnotu [16]. Hodnota nižší než 3 mm ukazuje na lehkou vadu, hodnota vyšší než 7 mm pak na vadu těžkou. Výhodou metody je relativní nezávislost na hemodynamických parametrech srdečních oddílů. Nevýhodou je, že se při měření pohybujeme ve velmi malých číslech, drobná nepřesnost pak může vyústit ve značnou chybu. Metodu pak nelze použít při přítomnosti většího množství regurgitačních jetů, nepřesná je i pokud se regurgitační ústí svým tvarem příliš vzdaluje od kruhovitého [17].
Obr. 5. Měření vena contracta u pacienta s prolapsem mitrální chlopně. 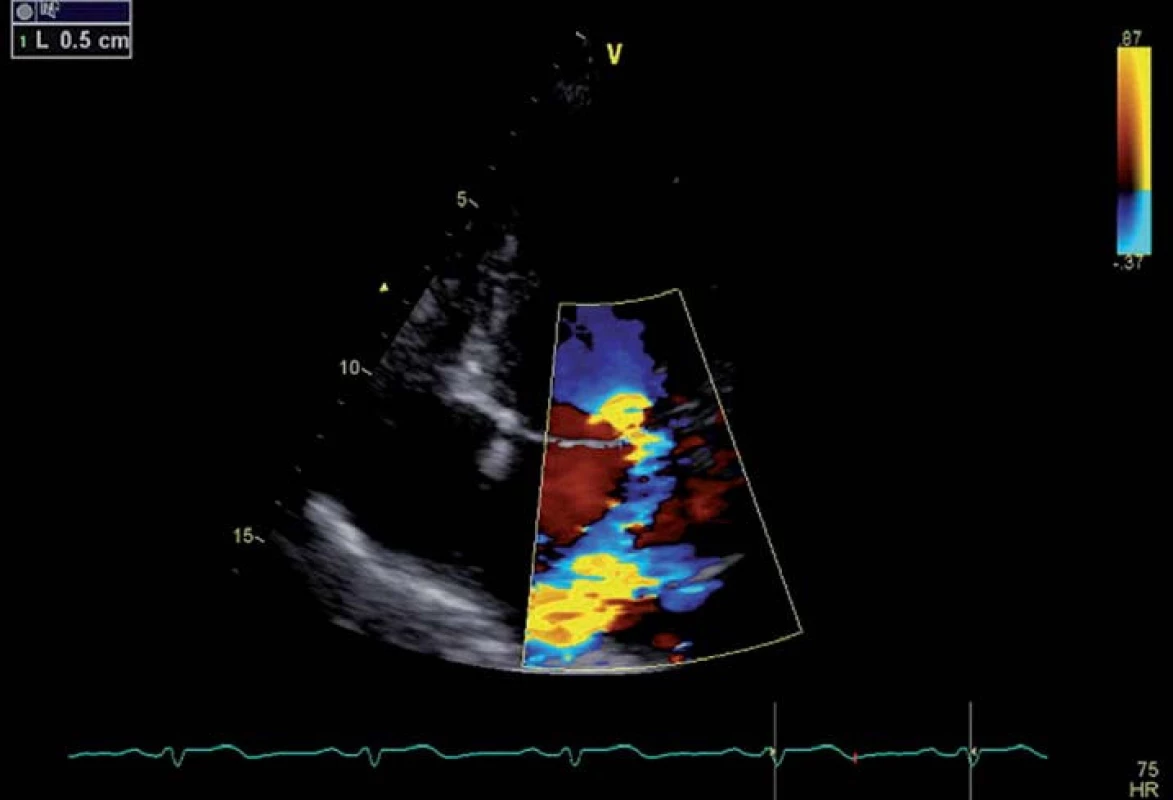
PISA
Nejvhodnější metoda ke kvantifikaci mitrální regurgitace je pomocí principu PISA (proximal isovelocity surface area) [17].
Krevní tok před průchodem přes regurgitační ústí vytváří polokulovité oblasti, ve kterých je rychlost proudění shodná. Ty lze zobrazit CFM Dopplerem pomocí fenoménu nejednoznačnosti, ke kterému dochází při dosažení rychlosti nastaveného Nyquistova limitu (obr. 6). Plochu této polokoule vypočítáme pomocí vzorce PISA = 2πr2, kde r je vzdálenost plochy chlopně od hranice polokoule. Rychlost okamžitého průtoku krve přes tuto polokouli Q pak zjistíme pomocí vzorce Q = Va × PISA, kdy Va je nastavená rychlost Nyquistova limitu. Maximální efektivní plocha regurgitačního ústí (effective regurgitant orifice area – EROA) je získána podílem rychlosti okamžitého průtoku Q a maximální rychlostí regurgitačního toku zjištěnou CW Dopplerem (obr. 7). Chceme‑li dále zjistit regurgitační objem (RV), vypočítáme ho jednoduše dle vzorce RV = EROA × VTI, kdy VTI získáme obtažením křivky CW Dopplera [18,19]. Za těžkou považujeme MR při hodnotách EROA > 40 mm2 s RV > 60 ml, pokud se jedná o primární onemocnění chlopně, při ischemické mitrální regurgitaci je za těžkou hodnocena MR již při hodnotách EROA > 20 mm2 s RV > 30 ml [8].
Obr. 6. Zobrazení polokulovité PISA, měření jejího poloměru. 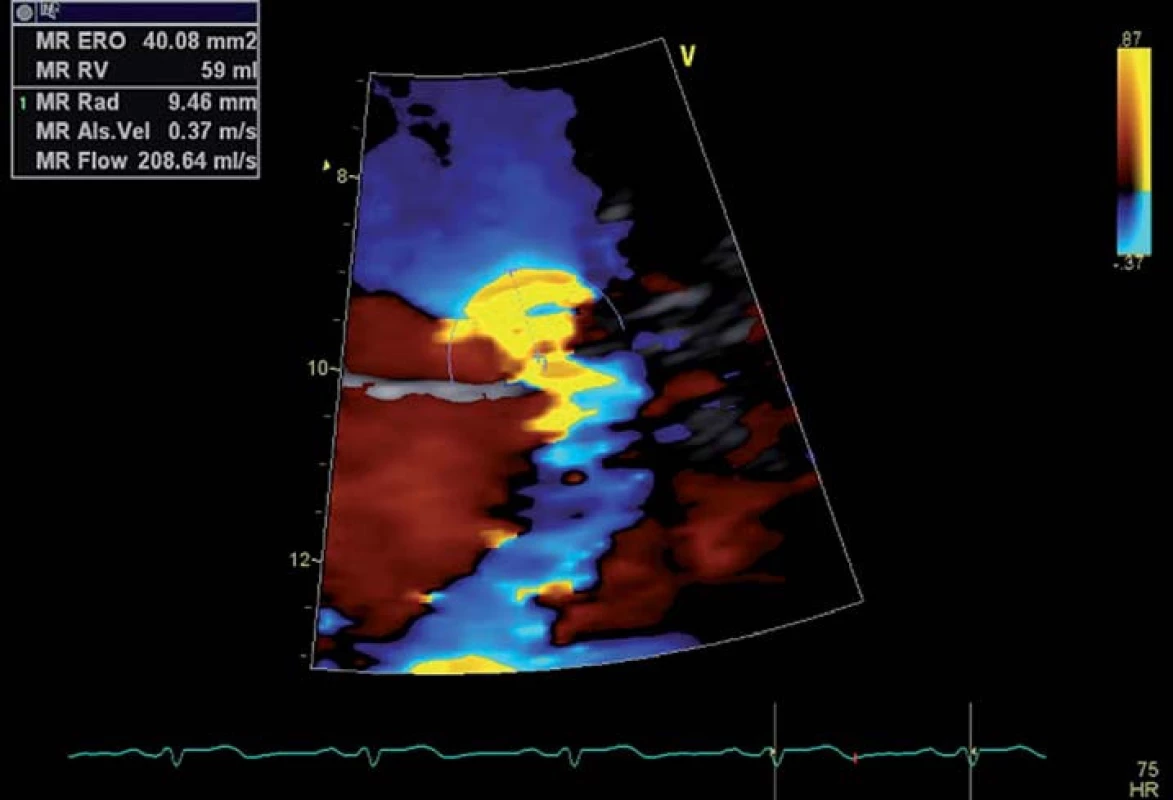
Obr. 7. Zobrazení maximální rychlosti regurgitačního toku CW Dopplerem. 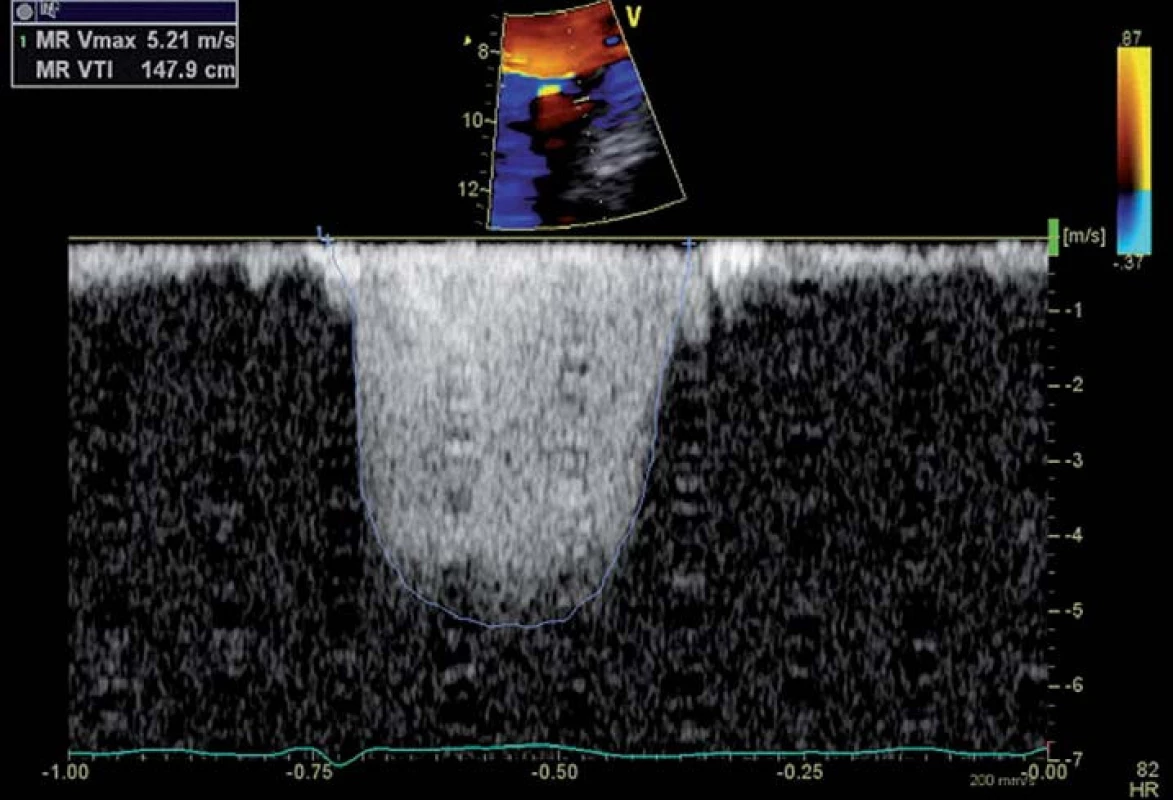
Výhodou metody PISA je, že přesnost kalkulace není ovlivněna hemodynamickými parametry či současným onemocněním další chlopně. Je však třeba vzít v potaz variabilitu regurgitačního ústí během systoly komor, která se vyskytuje zejména při prolapsu mitrální chlopně, k podhodnocení vady pak může dojít také při přítomnosti eliptického ústí u funkční mitrální regurgitace [20]. Další limitací jsou zejména excentrické a vícečetné jety, komplexní anatomie. Pokud vidíme (nejlépe na spektrálním Doppleru) nerovnoměrný průtok přes ústí (tzv. dynamický tok), musíme brát spočtenou EROA jako největší hodnotu, která se však neuplatňuje během celé systoly, a více vypovídající v takovém případě bude spočítaný RV. Nesmíme také zapomenout, že vzhledem ke způsobu výpočtu je při 10% chybě měření poloměru PISA výsledná chyba v kalkulaci regurgitačního ústí více než 20 %.
Vždy je tedy dobré v celkovém hodnocení vady přihlížet i k pomocným ukazatelům významnosti vady jako vysoká denzita regurgitačního toku na spektrálním Doppleru a vlivu mitrální regurgitace na ostatní srdeční oddíly. Trvale zvýšená objemová zátěž levé komory a levé síně vede k jejich dilataci a vlivem zvýšených tlaků v levé síni může dojít k rozvoji postkapilární plicní hypertenze. End‑systolický rozměr levé komory větší než 45 mm, pokles ejekční frakce pod 60 %, objem levé síně větší než 40 ml/ m2 či systolický tlak v plicnici vyšší než 50 mm Hg svědčí pro těžkou vadu [17].
Rozvoj záchovných operací bez nutnosti náhrady mitrální chlopně výrazně zlepšil prognózu nemocných s MR. K dosažení co nejlepších operačních výsledků je třeba znát co nejvíce informací o anatomii mitrální chlopně a mechanizmu regurgitace, které nám echokardiografie poskytuje. Přítomnost širokého centrálního regurgitačního jetu, těžká dilatace mitrálního anulu či jeho významné kalcifikace patří mezi ukazatele těžkého postižení chlopně, kdy výsledky záchovné operace nejsou příliš příznivé [21].
Závěr
Echokardiografie je neinvazivní, běžně dostupná, přesná a opakovatelná technika, která hraje v hodnocení chlopenních vad zásadní úlohu. Zmíněné metody pomohou v rozhodnutí, zda je chlopenní vada hemodynamicky významná. Záměrně zde však neuvádíme indikace k případnému intervenčnímu výkonu, o kterém by měl vždy rozhodovat komplexní kardiotým na základě platných doporučených postupů [8]. Zásadní je totiž posuzovat pacienta jako celek, se zvážením jeho symptomů, komorbidit a v neposlední řadě také jeho přání. Echokardiografický nález je pak pouze jednou z modalit, ke které je třeba přihlédnout.
Doručeno do redakce: 15. 3. 2015
Přijato po recenzi: 1. 4. 2015
MU Dr. Lumír Koc
www.fnbrno.cz
lkoc@fnbrno.cz
Zdroje
1. Iung B, Vahanian A. Epidemiology of acquired valvular heart dinase. Can J Cardiol 2014; 30 : 962 – 970. doi: 10.1016/ j.cjca.2014.03.022.
2. Nkomo VT, Gardin JM, Skelton TN et al. Burden of valvular heart diseases: a population‑based study. Lancet 2006; 368 : 1005 – 1011. doi: 10.1016/ S0140 - 6736(06)69208 - 8.
3. Eveborn GW, Schirmer H, Heggedlund G et al. The evolving epidemiology of valvular aortic stenosis. The Tromsø Study. Heart 2013; 99 : 396 – 400. doi: 10.1136/ heartjnl ‑ 2012-302265.
4. Ward C. Clinical significance of the bicuspid aortic valve. Heart 2000, 83 : 81 – 85. doi: 10.1136/ heart.83.1.81.
5. Stamm Ch, Friehs I, Ho SY et al. Congenital supravalvar aortic stenosis: a simple lesion? Eur J Cardiothorac Surg 2001; 19 : 195 – 202. doi: 10.1016/S1010 - 7940(00)00647-3.
6. Etnel JRG, Takkenberg JM, Spaans LG et al. Paediatric subvalvular aortic stenosis: a systematic review and meta‑analysis of natural history and surgical outcome. Eur J Cardiothorac Surg 2014. [online] Available from: http:/ / ejcts.oxfordjournals.org/ content/ early/ 2014/ 11/ 05/ ejcts.ezu423. doi: 10.1093/ ejcts/ ezu423.
7. Baumgartner H, Hung J, Bermejo J et al. Echocardiographic assessment of valve stenosis: EAE/ ASE recommendations for clinical practice.Eur J Echocardiogr 2009, 10 : 1 – 25. doi: 10.1093/ ejechocard/ jen303.
8. Vahanian A, Alfieri O, Andreotti F et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33 : 2451 – 2496. doi: 10.1093/ eurheartj/ ehs109.
9. Currie PJ, Seward JB, Reeder GS et al. Continuous ‑ wave Doppler echocardiographic assessment of severity of calcific aortic stenosis: a simultaneous Doppler ‑ catheter correlative study in 100 adult patients. Circulation 1985; 71 : 1162 – 1169. doi: 10.1161/ 01.CIR.71.6.1162.
10. Kizilbash AM, Heinle SK a Grayburn PA. Spontaneous variability of left ventricular outflow tract gradient in hypertrophic obstructive cardiomyopathy. Circulation 1998; 97 : 461 – 466. doi: 10.1161/ 01.CIR.97.5.461.
11. Hattle LB, Angelsen A, Tromsdal A. Non ‑ invasive assessment of aortic stenosis by Doppler ultrasound. Br Heart J 1980; 43 : 284 – 292. doi: 10.1136/ hrt.43.3.284.
12. Oh JK, Taliercio CP, Holmes DR et al. Prediction of the severity of aortic stenosis by Doppler aortic valve area determination: prospective Doppler ‑ catheterization correlation in 100 patients. J Am Coll Cardiol 1988; 11 : 1227 – 1234.
13. Skjaerpe T, Hegrenaes L, Hatle T. Noninvasive estimation of valve area in patients with aortic stenosis by Doppler ultrasound and two‑dimensional echocardiography. Circulation 1985; 72 : 810 – 818. doi: 10.1161/ 01.CIR.72.4.810.
14. Yiu SF, Enriquez ‑ Sarano M, Tribouilloy Ch et al. Determinants of the degree of functional mitral regurgitation in patients with systolic left ventricular dysfunction A quantitative clinical study. Circulation 2000; 102 : 1400 – 1406. doi: 10.1161/ 01.CIR.102.12.1400.
15. Chaliki HP, Nishimura RA, Enriquez ‑ Sarano M et al. A simplified, practical approach to assessment of severity of mitral regurgitation by Doppler color flow imaging with proximal convergence: validation with concomitant cardiac catheterization. Mayo Clin Proc 1998; 73 : 929 – 935. doi: 10.4065/ 73.10.929.
16. Heinle SK, Hall SA, Brickner ME et al. Comparison of vena contracta width by multiplane transesophageal echocardiography with quantitative doppler assessment of mitral regurgitation. Am J Cardiol 1998; 81 : 175 – 179. doi: 10.1016/ S0002 - 9149(97)00878 - 3.
17. Lancellotti P, Moura L, Pierard LA et al. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 2: mitral and tricuspid regurgitation (native valve disease). Eur J Echocardiogr 2010; 11 : 307 – 332. doi: 10.1093/ ejechocard/ jeq031.
18. Enriquez ‑ Saran M, Miller FA, Hayes SN et al. Effective mitral regurgitant orifice area: clinical use and pitfalls of the proximal isovelocity surface area method. J Am Coll Cardiol 1995; 25 : 703 – 709. doi: 10.1016/ 0735 - 1097(94)00434 - R.
19. Enriquez ‑ Sarano M, Avierinos JF, Messika ‑ Zeitoun D et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med 2005; 352 : 875 – 883. doi: 10.1056/ NEJMoa041451.
20. Iwakura K, Ito H, Kawano S et al. Comparison of Orifice Area by Transthoracic Three ‑ Dimensional Doppler Echocardiography Versus Proximal Isovelocity Surface Area (PISA) Method for Assessment of Mitral Regurgitation. Am J Cardiol 2006; 97 : 1630 – 1637. doi: 10.1016/ j.amjcard.2005.12.065.
21. Omran AS, Woo A, David TE et al. Intraoperative transesophageal echocardiography accurately predicts mitral valve anatomy and suitability for repair. J Am Soc Echocardiogr 2002; 15 : 950 – 957. doi: 10.1067/ mje.2002.121534.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Náhlá srdeční smrtČlánek Akutní stavy v tyreologii
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2015 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Skórovací systémy a predikce kardiovaskulárního rizika
- Náhlá srdeční smrt
- Skórovací systémy preventivní kardiologie
- Skórovací systémy u pacientů s akutním koronárním syndromem
- Skórovací systémy u fibrilace síní
- Skórovací systémy u tromboembolické nemoci
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
- Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Skórovací systémy před kardiochirurgickou operací
- Nové léky pro akutní srdeční selhání
- Primární hyperaldosteronizmus – nejčastější forma sekundární hypertenze
- Cushingův syndrom a kardiovaskulární riziko
- Saturace jodem v České republice a ve světě – nedostatky a perspektivy
- Akutní stavy v tyreologii
- Diferenciální diagnostika hyponatremie
- Endokrinologie stárnutí – krátký přehled
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinické klasifikace a skórovací systémy u srdečního selhání
- Skórovací systémy u tromboembolické nemoci
- Diferenciální diagnostika hyponatremie
- Akutní stavy v tyreologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



