-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cushingův syndrom a kardiovaskulární riziko
Cushing’s syndrome and cardiovascular risk
Cushing’s syndrome is a rare disorder characterised by increased autonomous production of cortisol and its exaggerated effects on virtually all tissues in the human body. Therefore its clinical presentation is very complex. One of its main features is significantly increased morbidity and mortality mainly due to cardiovascular disorders. This article reviews basic knowledge about Cushing’s syndrome, pathogenesis of clinical signs, mainly those related to increased cardiovascular risk and basics of diagnosis and treatment of Cushing’s syndrome.
Keywords:
Cushing’s syndrome – hypertension – metabolic syndrome – cardiovascular risk
Autoři: M. Kršek
Působiště autorů: III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(2): 161-166
Kategorie: Interní medicína
Souhrn
Cushingův syndrom je vzácné onemocnění charakterizované autonomní nadprodukcí kortizolu a jeho zvýšenými účinky na prakticky všechny tkáně lidského těla. Jeho klinický obraz je proto velmi komplexní. Jednou z hlavních charakteristik Cushingova syndromu je významné zvýšení morbidity a mortality především v důsledku kardiovaskulárního postižení. Tento článek shrnuje základní poznatky o Cushingově syndromu, patogenezi klinických příznaků, zejména těch, které mají vztah ke zvýšenému kardiovaskulárnímu riziku, a základy diagnostiky a léčby Cushingova syndromu.
Klíčová slova:
Cushingův syndrom – hypertenze – metabolický syndrom – kardiovaskulární rizikoÚvod
Cushingův syndrom (CS) vzniká v důsledku autonomní nadprodukce kortizolu a jeho působením na buňky a tkáně organizmu [1]. Jedná se o vzácné onemocnění s odhadovanou incidencí 1 – 3 nové případy/ 1 000 000 obyvatel/ 1 rok. Své nositele postihuje komplexně na mnoha úrovních a aktivní CS je charakterizován významně zvýšenou morbiditou a mortalitou především v důsledku kardiovaskulárního postižení. Zvýšené kardiovaskulární riziko u pacientů s Cushingovým syndromem má komplexní patogenezi, která bude rozebrána níže. Vzhledem k závažnosti onemocnění je nutné včasné stanovení jeho přesné etiologické diagnózy a včasná a správná léčba.
Etiologie a patogeneze Cushingova syndromu
Endogenní CS je onemocnění s vícečetnou etiologií. Základní rozdělení podle nadprodukce adrenokortikotropního hormonu (ACTH) je na ACTH ‑ dependentní CS, který představuje přibližně 75 % případů endogenního CS, a ACTH ‑ independentní CS představující přibližně 25 % případů endogenního CS. ACTH ‑ dependentní CS způsobený primárně nadprodukcí ACTH dále dělíme na převažující centrální CS či Cushingovu chorobu, za kterou je zodpovědný ACTH produkující adenom hypofýzy, a tzv. paraneoplastický CS či ektopický ACTH syndrom vznikající v důsledku ektopické nadprodukce ACTH jinými tumory v těle. ACTH ‑ independentní CS je v 98 – 99 % způsoben kortizol produkujícím tumorem nadledvin, adenomem či karcinomem, za 1 – 2 % je zodpovědná bilaterální hyperplazie nadledvin buď ACTH ‑ independentní makronodulární adrenální hyperplazie (AIMAH), nebo primární pigmentovaná nodulární adrenální nemoc (PPNAD) dříve nazývaná též mikronodulární adrenální hyperplazií. Stručné shrnutí etiologie CS je uvedeno v tab. 1 [2].
Tab. 1. Etiologie endogenního Cushingova syndromu. Upraveno dle [2]. ![Etiologie endogenního Cushingova syndromu. Upraveno dle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3141411062b0f764d65c06ea26ecbed7.png)
V prvním sloupci je uvedeno přibližné zastoupení ACTH-dependentních a ACTH-independentních forem v rámci endogenního Cushingova syndromu. Ve druhém sloupci pak zastoupení jednotlivých forem v rámci těchto podskupin. Klinický obraz Cushingova syndromu
Klinický obraz CS je velmi pestrý a variabilní a souhrn příznaků vede obvykle k závažnému postižení svého nositele [3]. Mezi základní klinické příznaky patří centrální (trunkální) obezita kontrastující s tenkými končetinami. Tuk se deponuje zejména ve viscerální oblasti, dále v oblasti obličeje (měsícovitý obličej – moon face), v oblasti šíje (býčí šíje – buffalo hump), v supraklavikulárních prostorách, ale i v mediastinu, v oblasti páteře. Kůže a podkoží jsou tenké, snadno zranitelné, rány se obtížně hojí, časté jsou kožní infekce, zejména bakteriální. Typickým, nikoli však konstantním příznakem jsou lividní strie typicky široké až cca 1 cm vyskytující se na břiše, ale i v méně typických lokalizacích, jako jsou stehna, hýždě, prsa, axilly. U žen se vlivem androgenů na kůži vyskytuje často akné, hirzutizmus nebo alopecie. Svaly jsou postižené tzv. steroidní myopatií, dochází k jejich atrofizaci, která se podílí na vzhledu tenkých končetin kontrastujícím s trunkální obezitou a která postihuje více pletencové svalstvo. Pacienti proto špatně vstávají ze dřepu, chodí do schodů, obtíže jim dělá práce pažemi zejména nad horizontálou.
Komplexní jsou příznaky způsobené metabolickými účinky glukokortikoidů, kromě redistribuce tuku dochází k proteokatabolizmu a poruše glukózové tolerance. Tyto příznaky spolu se změnami spektra lipoproteinů, poruchou glukózové tolerance, arteriální hypertenzí, retencí sodíku a tekutin a hyperkoagulačním stavem vedou ke zvýšení kardiovaskulárního rizika a budou rozebrány níže. Dalším metabolickým příznakem je negativní kalciová bilance a úbytek kostní hmoty se vznikem osteopenie a osteoporózy.
Základní klinické příznaky jsou uvedeny v tab. 2 [3 – 6]. Typický vzhled pacientky s Cushingovým syndromem je uveden na obr. 1.
Tab. 2. Klinické příznaky Cushingova syndromu. Upraveno dle [4]. ![Klinické příznaky Cushingova syndromu. Upraveno dle [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b6e906b421518f2ac3f286c3f23e53b4.png)
Obr. 1. Vzhled pacientky s Cushingovým syndromem (archiv autora). 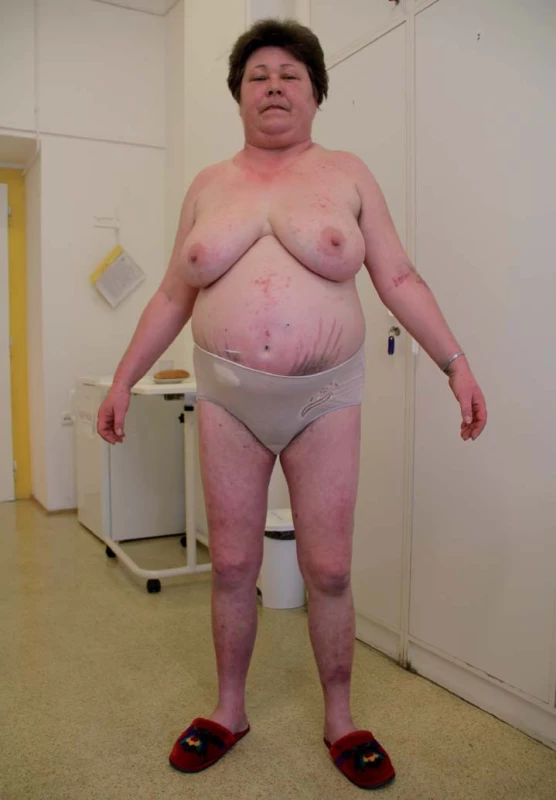
Kardiovaskulární riziko u Cushingova syndromu
CS je onemocnění závažné, provázené významně zvýšenou celkovou morbiditou a mortalitou, v případě aktivního onemocnění až 4× vyšší v porovnání s běžnou populací. Na zvýšené celkové morbiditě a mortalitě se nejvyšší měrou podílí právě postižení kardiovaskulární. Zvýšené kardiovaskulární riziko je dáno především komplexním postižením metabolickým (viscerální obezita, porucha glukózové tolerance a diabetes mellitus, porucha metabolizmu lipidů a lipoproteinů, retence sodíku a vody), k nim dále přistupuje arteriální hypertenze a hyperkoagulační stav.
Metabolický syndrom a obezita
Jak vyplývá z výše uvedeného souhrnu metabolických příznaků CS, splňuje velké množství pacientů diagnostická kritéria metabolického syndromu. V literatuře se uvádí, že je to nejméně u 30 % pacientů a rovněž u více než 30 % pacientů s CS je při vyšetření diagnostikovatelná přítomnost aterosklerotických plátů. Za hlavní patogenetický faktor vzniku metabolického syndromu je pokládána viscerální obezita, jejíž patogeneze je komplexní, ale podstatnou úlohu v jejím vzniku hrají účinky kortizolu [7]. Kortizol zvyšuje chuť k jídlu, stimuluje diferenciaci adipocytů, stimuluje aktivitu lipoproteinové lipázy a aktivitu syntázy mastných kyselin.
Porucha glukózové tolerance a diabetes mellitus
Patří k základním klinickým znakům CS a jsou dalším zásadním faktorem vedoucím k rozvoji metabolického syndromu. U více než 50 % pacientů se setkáváme s některou z poruch glukózového metabolizmu, zvýšenou glykemií na lačno, porušenou glukózovou tolerancí, nebo manifestním diabetes mellitus. Je ale pravděpodobné, že výskyt těchto poruch bude ještě vyšší, protože ne u všech pacientů s CS se rutinně provádí orální glukózový toleranční test. Hlavním patogenetickým momentem poruchy glukózového metabolizmu jsou přímo účinky kortizolu, jehož zvýšené koncentrace vedou k inzulinové rezistenci periferních tkání (především v jaterní, příčně pruhovaném svalstvu a tukové tkáni), dále pak k dysfunkci betabuněk pankreatu a ke snížení inzulinotropního účinku GLP‑1 (glucagon‑like peptid ‑ 1) [9 – 11].
Dyslipidemie
Dyslipidemie je považována za další významný kardiovaskulární faktor u CS. Údaje o změnách koncentrací lipoproteinů u CS jsou však nejednotné. Nejčastěji je popisováno zvýšení koncentrací celkového cholesterolu, zvýšení koncentrací triacylglycerolů a zvýšený poměr LDL cholesterol : HDL cholesterol. I přesto, že tyto údaje nejsou konsenzuální, zdá se být zřejmé, že u CS existuje řada změn metabolizmu lipoproteinů, které ke zvýšení kardiovaskulárního rizika vedou a které jsou důsledkem přímých nebo nepřímých účinků kortizolu. Nadbytek glukokortikoidů vede v tukové tkáni ke stimulaci aktivity lipoproteinových lipáz (hormonsenzitivní lipázy a lipázy triacylglycerolů tukové tkáně), permisivnímu vlivu na lipomobilizační účinek katecholaminů v tukové tkáni, stimulaci lipolýzy, stimulaci adipogenezy ve viscerální tukové tkáni a inhibici aktivity AMP ‑ aktivované proteinkinázy (AMPK) ve viscerální tukové tkáni. Na jaterní úrovni vedou glukokortikoidy k inzulinové rezistenci, zvýšení glukoneogeneze, hromadění triacylglycerolů, zvýšení syntézy VLDL částic, zvýšení lipogeneze, inhibici betaoxidace volných mastných kyselin, zvýšení aktivity AMPK, vzniku jaterní steatózy [15].
Arteriální hypertenze
Vyskytuje se až u 75 % pacientů s CS a CS patří mezi základní typy sekundární hypertenze s často typickými znaky, jako je rychlý rozvoj, tíže hypertenze, rezistence na léčbu, vymizení cirkadiánního rytmu TK, u vysoce aktivních případů rovněž hypokalemie. Patogeneticky se na rozvoji arteriální hypertenze u CS podílí řada faktorů [13]. Nadbytek volného kortizolu v renálních tubulech stimuluje mineralokortikoidní receptory, které jsou stimulovány též intermediárními steroidními metabolity s mineralokortikoidní aktivitou. U CS je popisována aktivace systému renin‑angiotenzin. Kortizol potencuje inotropní a presorické účinky vazoaktivních látek (katecholaminů, angiotenzinu II, vazopresinu) a naopak snižuje aktivitu vazodilatačních mechanizmů (snižuje aktivitu NO syntázy, oslabuje vazodilatační aktivitu prostacyklinu a systému kinin‑kalikrein) [14]. Důležitou úlohu pravděpodobně hraje i aktivace glukokortikoidních a mineralokortikoidních receptorů v centrálním nervovém systému.
Srdce u Cushingova syndromu
O funkci a morfologii srdce u CS neexistuje mnoho prací. U aktivního CS je popisována porucha geometrie levé komory srdeční s hypertrofií svaloviny a s diastolickou dysfunkcí, zejména poruchou relaxace a plnění komory. Systolická funkce bývá zachována. Popisované změny jsou většinou reverzibilní po úspěšné léčbě CS. U CS je popisována i dysbalance mezi sympatikem a parasympatikem a alterovaná variabilita srdeční frekvence, které rovněž mohou přispívat ke zvýšené kardiovaskulární morbiditě a mortalitě. U pacientů s CS je proto doporučováno provádět holterovské monitorování EKG k průkazu němých arytmií a/ nebo ischemií [15].
Cévy u Cushingova syndromu
Hlavní cévní změnou prokazovanou u CS je ateroskleróza. V řadě studií byla prokázána zvýšená intimomediální tloušťka karotid (IMT) u pacientů s aktivním CS ve srovnání se zdravými kontrolami přetrvávající řadu let po úspěšné léčbě a svědčící pro pravděpodobné přetrvávající kardiovaskulární riziko. Některé studie zaznamenaly i alteraci parametrů endoteliální funkce, zvýšení koncentrací endotelinu, vaskulárního endoteliálního růstového faktoru, adhezivních cévních molekul a některých dalších cytokinů asociovaných se zvýšením kardiovaskulárního rizika [16].
Diagnostika a léčba Cushingova syndromu
Vzhledem k závažnosti CS je nutná včasná a přesná etiologická diagnostika, která umožní časnou a etiologicky správnou léčbu. Na tomto místě budou uvedeny jen jejich základní principy.
Diagnostika Cushingova syndromu
Základním momentem je průkaz autonomní nadprodukce kortizolu. Za test první volby při podezření na CS je považován dexametazonový supresní test s nízkou dávkou dexametazonu (LDDST). LDDST testuje funkci zpětnovazebné kontroly sekrece kortizolu, resp. autonomii jeho nadprodukce. V nejjednodušší, tzv. zkrácené („overnight“) variantě, pacientům podáváme ve 23 : 00 hod perorálně 1 mg dexametazonu a druhý den ráno v 8 : 00 hod odebíráme krev na stanovení koncentrace kortizolu. Hodnoty kortizolu po dexametazonu pod 50 nmol/ l s 99% spolehlivostí CS vylučují, hodnoty nad 148 nmol/ l jsou suspektní s přítomností CS, hodnoty 50 – 148 nmol/ l představují tzv. šedou zónu, kdy vyšetření opakujeme a doplňujeme další testy. Vylučování volného močového kortizolu za 24 hod je vyšetření, které používáme pro kvantifikaci nadprodukce kortizolu. Vzhledem k variabilitě vylučování kortizolu je doporučováno vycházet z nejméně tří stanovení. Vyšetření nočního kortizolu (24.00) v séru (plazmě). U pacientů s CS dochází k oploštění cirkadiánního rytmu sekrece kortizolu a k vymizení fyziologického nočního poklesu. K nadiru sekrece kortizolu dochází fyziologicky v noci po usnutí. Technicky správně má být proto odběr proveden u spícího pacienta z předem zavedené nitrožilní kanyly. Fyziologicky dochází v noci k poklesu kortizolemie pod 148 nmol/ l, hodnoty vyšší jsou suspektní z přítomnosti CS. Vyšetření nočního kortizolu ve slinách je metodou v současnosti zaváděnou na řadě pracovišť specializovaných na diagnostiku CS. Odběr slin je prováděn do speciálních zkumavek zpravidla ve 23.00 hod. Výhodou je, že koncentrace ve slinách reflektují koncentrace volného kortizolu a že slinné koncentrace jsou méně a pomaleji ovlivnitelné stresem. Metoda je však náročná technicky především na odběr a zpracování slin a standardizaci měření se stanovením vlastních diskriminačních hodnot.
Základní algoritmus diagnostiky CS je uveden na obr. 2 [17,18].
Obr. 2. Algoritmus diagnostiky Cushingova syndromu Upraveno dle [19]. ![Algoritmus diagnostiky Cushingova syndromu Upraveno dle [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7c7fb46a4853efe50e65086fbc4a65dd.jpg)
CS – Cushingův syndrom; DST – dexametazonový supresní test Diferenciální diagnostika Cushingova syndromu
Diferenciální diagnostika CS syndromu patří mezi nejobtížnější v klinické endokrinologii, a její podrobný popis proto přesahuje rámec této publikace [17,18].
Základní rozlišení mezi základními formami podle sekrece ACTH provádíme po dvou nezávislých ranních měřeních jeho plazmatických koncentrací.
Normální nebo zvýšené koncentrace ACTH (nad 10 pg/ ml) svědčí pro ACTH ‑ dependentní CS. V tomto případě pokračujeme diferenciální diagnostikou mezi hypofyzární a ektopickou sekrecí ACTH. Suprimované koncentrace ACTH (pod 5 pg/ ml) svědčí pro primární (nadledvinovou) etiologii. V tomto případě následuje zobrazení nadledvin pomocí výpočetní tomografie nebo magnetické rezonance.
Základní algoritmus diferenciální diagnostiky a jejích výstupů pro léčbu je uveden na obr. 3 [19].
Obr. 3. Schéma diferenciální diagnostiky a terapeutických výstupů u Cushingova syndromu. 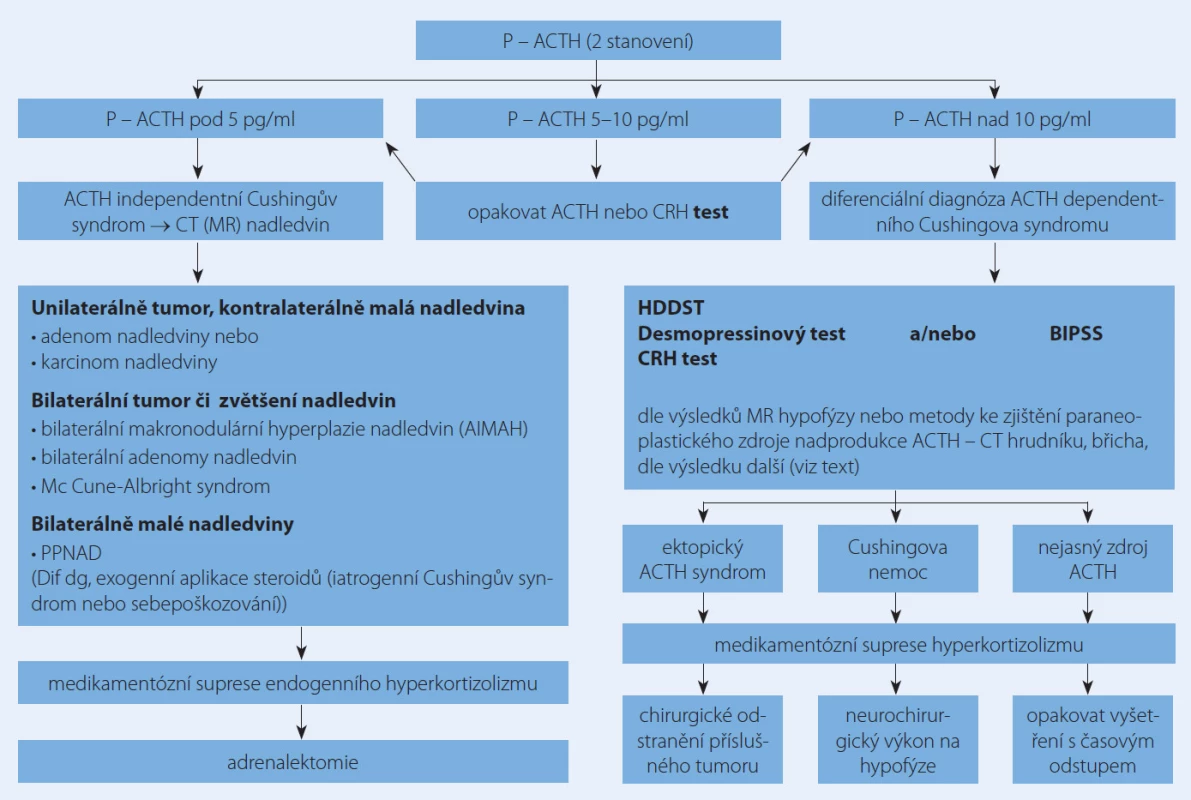
ACTH – adrenokortikotropní hormon, AIMAH – ACTH independentní makronodulární adrenální hyperplazie (ACTH independent macronodular adrenal hyperplasia), BIPSS – bilaterální katetrizace sinus petrosi inferiores s odběry (bilateral inferior petrosal sinuses sampling), CRH – kortikoliberin (corticotropin releasing hormone), CT – výpočetní tomografi e (computer tomography), HDDST – dexametazonový supresní test s vysokou dávkou dexametazonu (high dose dexamethasone suppression test), MR – magnetická rezonance, PPNAD – primární pigmentovaná adrenální nodulární nemoc (primary pigmented nodular adrenal disease) Léčba Cushingova syndromu
Léčba CS je specifická pro každou jeho etiologickou formu. Podrobný popis opět překračuje rámec této publikace.
Cushingovu nemoc, tedy ACTH produkující adenom hypofýzy, léčíme primárně neurochirurgicky. Při neúspěchu neurochirurgické léčby je indikována reoperace nebo stereotaktická radiační léčba. Při trvající hormonální aktivitě musíme léčit medikamentózně, často kombinací různých léků.
Paraneoplastický Cushingův syndrom řešíme individuálně podle toho, jaký tumor produkuje ACTH. Ve většině případů je metodou první volby léčba chirurgická.
Periferní Cushingův syndrom. Jeho příčinou je v 98 – 99 % tumor jedné nadledviny a metodou volby je provedení adrenalektomie, v dnešní době většinou laparoskopické. U adenomu nadledviny jde o výkon kurativní, v případě karcinomu záleží na stadiu onemocnění a kompletnosti výkonu. U vzácné AIMAH můžeme zkusit specifickou léčbu medikamentózní, ale u většiny případů je nakonec indikována bilaterální adrenalektomie. U PPNAD je metodou volby bilaterální adrenalektomie. Po bilaterální adrenalektomii následuje doživotní léčba hypokortikalizmu.
Podrobný popis léčby Cushingova syndromu v ČR je shrnut v doporučeních České endokrinologické společnosti pro léčbu CS v dospělosti [20].
Léčba přidružených poruch
Ke správné léčbě CS a zlepšení jejich prognózy však nepatří pouze specifická endokrinologická léčba, ale je nutné ovlivňování všech přidružených poruch a rizik, a to nejen v době aktivního CS, ale i po jeho úspěšné léčbě, neboť existují doklady pro přetrvávající riziko, zejména kardiovaskulární, i mnoho let po úspěšném vyléčení CS. K léčbě CS tedy nedílně patří dietní a režimová opatření, aerobní trénink, redukce hmotnosti, léčba poruchy glukózové tolerance či diabetes mellitus, důsledná léčba arteriální hypertenze a léčba dyslipidemie. Dlouhodobě léčíme i další přidružené choroby, např. osteoporózu [20].
Doručeno do redakce: 11. 3. 2015
Přijato po recenzi: 25. 3. 2015
prof. MU Dr. Michal Kršek, CSc.
www.vfn.cz
michal.krsek@lf1.cuni.cz
Zdroje
1. Cushing HW. The basophil adenomas of the pituitary body and their clinical manifestations (pituitary basophilism). Bull Johns Hopkins Hosp 1932; 50 : 137 – 195.
2. Kršek M, Hána V, Vymazal J et al. Cushingův syndrom. Praha: Galén 2006.
3. Ross EJ, Linch DC. Cushing’s syndrome ‑ killing disease: discriminatory value of signs and symptoms aiding early diagnosis. Lancet 1982; 2 : 646 – 649.
4. Nieman LK. Cushing’s syndrome. In: De Groot LJ, Jameson JL. (Eds), Endocrinology. 4th ed. Philadelphia: W. B. Saunders 2001.
5. Urbanic RC, George JM. Cushing’s disease – 18 years’ experience. Medicine (Baltimore) 1981; 60 : 14 – 24.
6. Soffer LJ, Iannaccone A, Gabrilove JL. Cushing’s syndrome: A study of fifty patients. Am J Med 1961; 300 : 129 – 135.
7. Pivonello R, Faggiano A, Lombardi G et al. The metabolic syndrome and cardiovascular risk in Cushing’s syndrome. Endocrinol Metab Clin North Am 2005; 34 : 327 – 339.
8. Tataranni PA, Larson DE, Snitker S et al. Effects of glucocorticoids on energy metabolism and food intake in humans. Am J Physiol 1996; 271: E317 – E325.
9. Qi D, Rodrigues B. Glucocorticoids produce whole body insulin resistance with changes in cardiac metabolism. Am J Physiol Endocrinol Metab 2007; 292: E654 – E667.
10. Hansen KB, Vilsbøll T, Bagger JI et al. Reduced glucose tolerance and insulin resistance induced by steroid treatment, relative physical inactivity and high‑calorie diet impairs the incretin effect in healthy subjects. J Clin Endocrinol Metab 2010; 95 : 3309 – 3317. doi: 10.1210/ jc.2010 ‑ 0119.
11. Pivonello R, De Leo M, Vitale P et al. Pathophysiology of diabetes mellitus in Cushing’s syndrome. Neuroendocrinology 2010; 92 (Suppl 1): 77 – 81. doi: 10.1159/ 000314319.
12. Greenman Y. Management of dyslipidemia in Cuhsing’s syndrome. Neuroendocrinology 2010; 92 (Suppl 1): 91 – 95. doi: 10.1159/ 000314294.
13. Saruta T, Suzuki H, Handa M et al. Multiple factors contribute to the pathogenesis of hypertension in Cushing’s syndrome. J Clin Endocrinol Metab 1986; 62 : 275 – 279.
14. Mitchell BM, Webb RC. Impaired vasodilatation and nitric oxid synthase activity in glucocorticoid‑induced hypertension. Biol Res Nurs 2002; 4 : 16 – 21.
15. Arnaldi G, Scandali VM, Trementino L et al. Patophysiology of dyslipidemia in Cushing’s syndrome. Neuroendocrinology 2010; 92 (Suppl 1): 86 – 90.
16. Pereira AM, Delgado V, Romijn JA et al. Cardiac dysfunction is reversed upon successful treatment of Cushing’s syndrome. Eur J Endocrinol 2010; 162 : 331 – 340. doi: 10.1530/ EJE ‑ 09 ‑ 0621.
17. Faggiano A, Pivonello R, Spiezia S et al. Cardiovascular risk factors and common carotid artery calibre and stiffness in patients with Cushing’s disease during active disease and 1 year after disease remission. J Clin Endocrinol Metab 2003; 88 : 2527 – 2533.
18. Newell‑Price J. Diagnosis/ differential diagnosis of Cushing‘ s syndrome: a review of best practice. Best Pract Res Clin Endocrinol Metab 2009; 23 (Suppl 1): S5 – S14. doi: 10.1016/ S1521 ‑ 690X(09)70003 ‑ X.
19. Nieman LK, Biller BM, Findling JW et al. The Diagnosis of Cushing’s Syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93 : 1526 – 1540. doi: 10.1210/ jc.2008 ‑ 0125.
20. Kršek M, Čáp J, Hána V et al. Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti. Diabetologie, metabolismus, endokrinologie, výživa 2013; 16 : 63 – 71.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Náhlá srdeční smrtČlánek Akutní stavy v tyreologii
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2015 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Skórovací systémy a predikce kardiovaskulárního rizika
- Náhlá srdeční smrt
- Skórovací systémy preventivní kardiologie
- Skórovací systémy u pacientů s akutním koronárním syndromem
- Skórovací systémy u fibrilace síní
- Skórovací systémy u tromboembolické nemoci
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
- Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Skórovací systémy před kardiochirurgickou operací
- Nové léky pro akutní srdeční selhání
- Primární hyperaldosteronizmus – nejčastější forma sekundární hypertenze
- Cushingův syndrom a kardiovaskulární riziko
- Saturace jodem v České republice a ve světě – nedostatky a perspektivy
- Akutní stavy v tyreologii
- Diferenciální diagnostika hyponatremie
- Endokrinologie stárnutí – krátký přehled
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinické klasifikace a skórovací systémy u srdečního selhání
- Skórovací systémy u tromboembolické nemoci
- Diferenciální diagnostika hyponatremie
- Akutní stavy v tyreologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



