-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné použití biologik v léčbě revmatoidní artritidy
Biologics in the treatment of rheumatoid arthritis
The last few decades have seen major progress in the treatment of rheumatoid arthritis, mainly thanks to the advances in biotechnology. In addition to the basic, synthetic disease ‑ modifying antirheumatic drugs, new generation drugs – biologics – have been used in the treatment of patients suffering from rheumatoid arthritis since 1998. Biologics intervene directly in the pathogenic immune processes leading to disease progression. They were developed through a better understanding of the pathogenesis of inflammation in rheumatoid arthritis, the function of cytokines, and immune system cells. Currently we use biologics for either blocking some of the inflammatory cytokines (anti‑TNF, IL‑1 and IL‑6), or the cellular mechanisms (anti‑CD20, CTLA ‑ 4). Their clinical efficacy and ability to practically stop radiographic progression of the disease has been demonstrated in many clinical trials for rheumatoid arthritis. The negative aspects of the treatment include some of the side ‑ effects and price.
Keywords:
rheumatoid arthritis – biologics – anti‑TNF therapy – rituximab – abatacept – biosimilars
Autoři: J. Tomasová Studýnková
Působiště autorů: Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(5): 420-425
Kategorie: Interní medicína
Souhrn
V terapii revmatoidní artritidy došlo v posledních desetiletích k významným změnám. Kromě základních, tzv. syntetických chorobu modifikujících léků se od roku 1998 v léčbě používají i léky nové generace – biologické léky. Biologika jsou preparáty zasahující přímo do systému imunitních mechanizmů vedoucích k projevům choroby. Vznikly na základě využití nových poznatků o patogenezi zánětlivého kloubního onemocnění, lepšího pochopení funkce cytokinů, buněk imunitního systému a také díky pokroku v biotechnologiích. V současnosti se využívají biologika blokující některé z prozánětlivých cytokinů (anti‑TNFα, IL‑1, IL‑6) nebo buněčných mechanizmů (anti‑CD20, CTLA ‑ 4). Jejich vysoká klinická účinnost i schopnost prakticky zastavovat rentgenovou progresi u nemocných s revmatoidní artritidou byla ověřena v mnoha klinických studiích. Negativními aspekty této léčby jsou některé nežádoucí účinky a stále také její cena.
Klíčová slova:
revmatoidní artritida – biologická léčba – anti‑TNFα terapie – rituximab – abatacept – biosimilarsÚvod
Revmatoidní artritida (RA) je chronické zánětlivé onemocnění postihující přibližně 1 % obyvatel [1]. Je charakterizované kloubními záněty vedoucími v případě, že nejsou adekvátně léčeny, až k destrukci kloubu [2]. Může být provázena i systémovými projevy a tvorbou autoprotilátek. Aktivita onemocnění a s ní spojená omezení jsou zcela reverzibilní, ale poškození kloubů způsobené aktivním zánětem podmíněným imunitními mechanizmy je pak nevratné. Cílem léčby RA je proto maximálně a co nejrychleji snížit aktivitu onemocnění, a tím zmírnit nebo zastavit trvalé poškození kloubů. Léčba pacientů s RA by měla být proto zahájena záhy a agresivně, s jasně definovaným cílem, kterým je dosažení kompletní remise co nejrychleji od zahájení léčby [3].
Právě intenzivní snaha o nalezení nových léčebných postupů směřujících k co nejrychlejšímu zastavení aktivity a progrese onemocnění a k jeho kompletní remisi vedla k vývoji biologických léků (biologik).
Biologické léky
Biologika patří do skupiny tzv. chorobu modifikujících léků (DMARDs). Biologickými DMARDs (bDMARDs) je nazýváme proto, že jde o biologické preparáty bílkovinné povahy připravené pomocí metod molekulární biologie. Tyto léky přinesly dramatickou změnu v léčbě, a tedy i v prognóze nemocných s RA. Terapeutický zásah pomocí monoklonálních protilátek vedený přímo do jednotlivých patogenetických mechanizmů imunitní reakce je velmi efektivní cestou k dosažení remise onemocnění, která se stala cílem této léčby [4].
Působení zatím používaných preparátů je zaměřeno buď proti určitému prozánětlivému cytokinu (např. TNF‑α, IL‑1, IL‑6), nebo buňkám imunitního systému (př. CD20, CTLA ‑ 4).
V současnosti máme k dispozici v léčbě RA devět různých biologických léků. Sedm z nich inhibuje prozánětlivé cytokiny, zejména TNF‑α (etanercept, infliximab, adalimumab, certolizumab a golimumab), dále protilátka proti IL‑6 receptoru (tocilizumab) a nebo IL‑1 (anakinra). Další dva léky ovlivňují receptory T a B lymfocytů – protilátka CTLA4 (abatacept) a anti‑CD20 (rituximab) [5].
Všechny tyto léky mají zhruba podobné profily účinnosti a jsou schváleny jako léky první nebo druhé linie léčby u pacientů, kteří neodpovídají na klasická, tj. syntetická DMARDs (sDMARDs). Současná doporučení pro léčbu RA nadále užívají jako základní léky sDMARDS, zejména metotrexát (MTX), biologická léčba by měla být zvažována až po nedostatečném efektu sDMARDs [3]. Přes veškeré výhody použití biologické léčby stále jen nízký počet pacientů dosáhne stabilní remise, a proto nadále pokračuje hledání nové a účinnější léčby a každým rokem jsou testovány další a další preparáty jak biologické, tak nově i nebiologické, syntetické, ale působící na imunitní systém cíleně.
Strategie léčby revmatoidní artritidy
Současná doporučení pro léčbu RA byla vyvinuta mezinárodním týmem expertů EULAR (European League Against Rheumatism) (tab. 1). Vyplývá z nich, že včasná, agresivní léčba je spojena s lepšími klinickými výsledky. Léčba RA má být vedena k cíli („treat to target“), kterým je remise onemocnění nebo alespoň dlouhodobě nízká aktivita. K jeho dosažení je nutné časté hodnocení aktivity onemocnění pomocí specifických kompozitních indexů a následná optimalizace léčby [3,4].
Tab. 1. Doporučení EULAR 2013 pro strategii léčby RA. 
Syntetická DMARDs (zejména MTX) byla po dlouhá desetiletí, a stále ještě jsou, základem léčby RA. Mírní klinické příznaky, u části pacientů omezují poškození kloubů a umožňují dosažení remise. Zavedením biologik, zejména v kombinaci s sDMARD, dochází ale ještě k lepšímu efektu na zlepšení klinických projevů (aktivita onemocnění, funkční kapacita) i strukturálního poškození [6]. Rentgenová progrese poškození kloubu u RA je největší v časném stadiu onemocnění [5]. Randomizované klinické studie [7 – 10] prokázaly účinnost všech TNF‑α inhibitorů u nemocných se středně těžkou a těžkou aktivní RA s nedostatečným účinkem MTX. I přes současnou širokou škálu nových terapeutických možností však výsledky léčby RA stále nejsou optimální. Přibližně 50 % pacientů léčených anti‑TNF nedosahuje dostatečně klinickou odpověď a jen malá část dosáhne kompletní remise onemocnění [6,11]. Podobné výsledky v klinických studiích vykazují i abatacept, tocilizumab a rituximab [6].
Rizika spojená s léčbou biologickými léky
Biologické léky jsou velmi efektivní, ale jejich přímé imunomodulační vlastnosti vyvolávají řadu obav. Jejich bezpečnost byla ověřována v mnoha klinických studiích. U méně častých nežádoucích účinků poskytují podrobnější informace postmarketingová hlášení. Porovnání bezpečnostních profilů jednotlivých biologických léků je obtížné z důvodu nedostatku head ‑ to ‑ head studií a rozdílů v designu jednotlivých studií. Některá rizika jsou společná pro všechna DMARDs. Patří k nim zejména zvýšené riziko virových a bakteriálních infekcí. Pacienti na bDMARDs však mají oproti sDMARDs vyšší riziko závažnějších infekcí a vzniku nebo reaktivace tuberkulózy (TBC) [12]. Před zahájením léčby je proto nutný screening TBC. Léčba bDMARDs je také spojena se zvýšeným rizikem infekce herpes zoster.
Zatím nejasné je riziko bDMARDs z hlediska vzniku malignit. Dosud dostupná data jednoznačně pro vzrůst incidence maligních onemocnění nesvědčí (tab. 2) [12,13].
Tab. 2. Nežádoucí účinky bDMARDs. 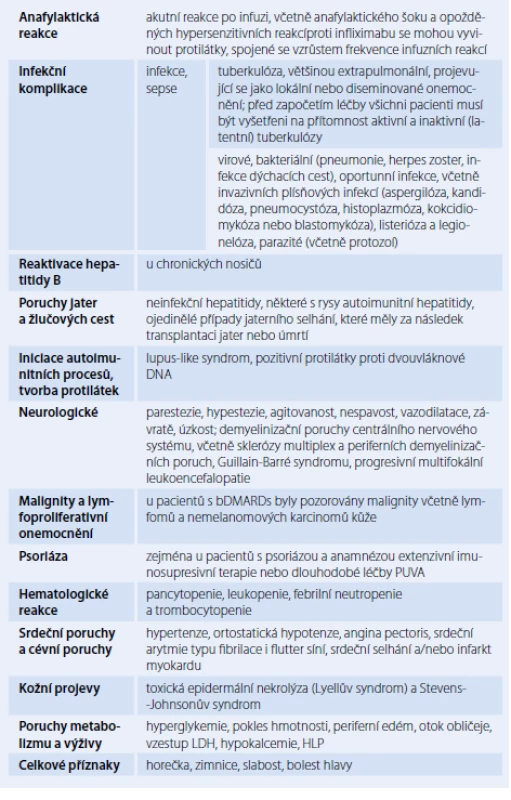
Přehled biologik užívaných k léčbě revmatoidní artritidy
Preparáty zaměřené proti prozánětlivým cytokinům
Prvním proticytokinovým lékem uvedeným do klinické praxe byl inhibitor TNFα – etanercept. Pro léčbu RA byl schválen již v roce 1998. Je to rekombinantní lidský solubilní receptor pro TNFα, který je fuzován s lidským Fc fragmentem imunoglobulinu G1. Má krátký biologický poločas (3 – 6 dnů) a je podáván subkutánně. Klinická účinnost etanerceptu byla prokázána jak v monoterapii [7], tak i v kombinaci s MTX [8]. Užití kombinace vykazuje lepší výsledky než MTX nebo etanercept v monoterapii [9].
Studie z nedávné doby prokázaly, že u pacientů, kteří na kombinaci MTX s etanerceptem dlouhodobě vykazují nízkou aktivitu onemocnění, je možné dávku etanerceptu redukovat na polovinu nebo podávat v prodlouženém intervalu [10].
Infliximab je chimérická (myší/ lidská) monoklonální protilátka IgG1 směřující rovněž proti rozpustnému i na membránu vázanému TNFα. Obsahuje myší Fab část imunoglobulinu, proti které byla pozorována tvorba antimyších protilátek (HACA – Human Anti‑Chimeric Antibodies). Tvorba HACA se podstatně snižuje při souběžném podávání infliximabu s MTX.
V randomizovaných kontrolovaných studiích byla prokázána účinnost infliximabu v kombinaci s MTX jak na zmírnění klinických symptomů, tak na snížení na klinické odpovědi nezávislé, rentgenologicky měřené progrese onemocnění a zlepšení fyzické funkce [14].
Adalimumab je první plně humánní anti‑TNF monoklonální protilátka. Výhodou je, stejně jako u etanerceptu, její subkutánní podávání. Na rozdíl od něj má ale delší poločas (cca 13 dnů), což umožňuje méně časté aplikace. Klinická účinnost adalimumabu v kombinaci s MTX byla prokázána u pacientů s časnou, agresivní RA [15] stejně jako u pacientů, u kterých došlo k selhání léčby jiným bDMARD [15].
V letošním roce bylo provedeno zajímavě postavené klinické hodnocení, které sledovalo účinnost kombinace MTX a adalimumabu v porovnání s monoterapií u pacientů s časnou RA, u kterých došlo k poklesu aktivity onemocnění (studie OPTIMA) [16]. Jeho výsledky ukazují, že po 76 týdnech přibližně u 90 % pacientů, kteří pokračovali v kombinaci (ve srovnání s přibližně 80 % pacientů jen s MTX), došlo k udržení nízké aktivity onemocnění [16].
Golimumab patří mezi novější inhibitory TNFα schválené pro indikaci RA. Je to plně humánní monoklonální protilátka. Účinnost golimumabu byla prokázána zejména při léčbě středně těžkých až těžkých pacientů s revmatoidní artritidou, kteří nereagovali na sDMARDs, nebo pacientů naivních na MTX stejně jako u pacientů, kteří nereagovali na alespoň jednu anti‑TNF terapii [17].
Certolizumab pegol je Fab fragment pegylované, humanizované protilátky anti‑TNF. Vzhledem k chybějící Fc části neindukuje pomocí aktivace komplementu apoptózu ani buněčně zprostředkované cytotoxické mechanizmy. Pegylace (přidání polyetylenglykolu) zpomaluje její vylučování a prodlužuje biologický poločas (cca 14 dnů). Účinnost a bezpečnost u pacientů s RA byla potvrzena studií REALISTIC [18], následně i studí CERTAIN [19]. Lze jej podávat i v monoterapii.
Další z anticytokinových léků působících na cytokin IL‑1 je anakinra – rekombinantní lidský IL‑1 receptor. Má velmi krátký poločas rozpadu (4 – 6 hod), a proto musí být podáván denně. Vzhledem k této skutečnosti spolu s menší účinností anakinry ve srovnání s dalšími subkutánně podávanými inhibitory TNFα (etanercept, adalimumab, certolizumab) je u pacientů s RA anakinra lékem 2. linie [20]. Nicméně anakinra se s úspěchem užívá k léčbě juvenilní revmatoidní artritidy a jiných systémových onemocnění [21].
Tocilizumab je humanizovaná rekombinantní monoklonální IgG1 protilátka, která váže receptor pro IL‑6. Je určena k nitrožilnímu podání. V Evropě i USA byla nedávno schválena subkutánní forma tohoto přípravku. U RA byla prokázána jeho účinnost jak u pacientů s nedostatečnou odpovědí na sDMARD, tak v léčbě RA refrakterní na anti‑TNF terapii [22]. Tocilizumab lze také podávat v monoterapii. Jeho účinnost v monoterapii byla porovnána ve studiích s MTX (AMBITION) [23] a s adalimumabem (ADACTA), kde se tocilizumab ukazuje jako výhodnější [24].
Léky ovlivňující T a B lymfocyty
Rituximab je chimérická monoklonální protilátka namířená proti antigenu CD20. Selektivně způsobuje depleci lymfocytů exprimujících CD20 (maturované B lymfocyty a pre‑B lymfocyty), které se podílejí na produkci protilátek, stejně tak jako v indukci aktivace T buněk a produkci prozánětlivých cytokinů [25]. Původně byl schválen k léčbě non‑Hodgkinova lymfomu. Až v roce 2006 byl schválen jako lék 2. linie léčby (po selhání anti‑TNF) u pacientů se středně těžkou až těžkou RA. Rituximab je klinicky účinný a vede k potlačení rentgenové progrese, toto se ale zdá být o něco méně výrazné než u TNFα inhibitorů. Klinický účinek léčby je obvykle lepší u pacientů s pozitivitou revmatoidních faktorů (RF) než u pacientů negativních na RF [25]. Účinnost rituximabu byla také prokázána u refrakterní formy onemocnění a u pacientů s dlouhým trváním choroby. Kromě toho se rituximab zdá být relativně bezpečný u pacientů s komorbiditami, včetně maligního onemocnění a opakované infekce [26].
Dalším lékem schváleným pro léčbu pacientů s nedostatečnou odpovědí na jedno nebo více sDMARDs nebo bDMARDs je abatacept. Jedná se o plně humánní fúzní protein obsahující extracelulární doménu CTLA ‑ 4 (cytotoxické T lymfocyty spojené antigen ‑ 4) a modifikovanou Fc část lidského IgG1. Blokuje kostimulační signál zprostředkovaný receptorem CD28 na T buňkách a receptorem CD80/ 86 na antigen prezentující buňce (APC). Zabraňuje tak aktivaci, proliferaci, diferenciaci a přežívání T lymfocytů, a tím produkci zánětlivých cytokinů (IL‑2, TNF). Je podáván v infuzích (jednou za čtyři týdny) nebo subkutánně (jednou týdně). Obě možnosti léčby ukázaly srovnatelnou účinnost a bezpečnost u pacientů s nedostatečnou odpovědí na MTX [27].
Terapeutické možnosti RA v nedávné době rozšířila zcela nová skupina nebiologických léků, tzv. cíleně působící sDMARDs, která podobně jako biologické léky cíleně zasahuje do patogenetických imunitních mechanizmů. Prvním takovým lékem schváleným pro léčbu RA, zatím pouze FDA a některými dalšími, především mimoevropskými státy, je tofacitinib. Jedná se o selektivní inhibitor Janusových kináz (JAK) 1 a 3 (v menší míře JAK2), které zprostředkovávají transmebránový přenos signálu. Tofacitinib může být používán v monoterapii nebo v kombinaci s MTX nebo jinými sDMARDs. Klinická účinnost tofacitinibu je obdobná anti‑TNF adalimumabu [28].
Biosimilars
V posledních letech se do klinického použití ve stále vyšší míře dostávají tzv. biosimilars, tj. léky podobné biologickým lékům. Generika neboli ne tak drahé kopie originálních léků jsou v terapii využívána běžně. V případě biologik dosud takové ekvivalenty neexistovaly. Biosimilars ale nelze vnímat jako klasická generika, protože originální molekule jsou pouze podobná. Důvodem je to, že biologické látky jsou hůře charakterizovatelné než látky chemické. Tyto rozdíly vyvolaly určité obavy, pokud jde o účinnost, imunogenicitu a bezpečnostní profil zamýšlených kopií. V důsledku toho je registrační a schvalovací proces pro biosimilars podstatně náročnější než pro farmaceutická generika. Prvními „kopiemi“ bDMARDs, které se objevily, byly přípravky infliximabu [29].
Závěr
Díky novým znalostm patogeneze RA došlo v posledních desetiletích k vývoji zcela nové skupiny léků – léků biologických (tab. 3). Účinek těchto preparátů je cílený přímo do imunitních mechanizmů vedoucích k projevům choroby, což přineslo větší možnost kontrolovat a zvládat toto zánětlivé onemocnění.
Tab. 3. Přehled a terapeutické využití biologických preparátů v léčbě RA. 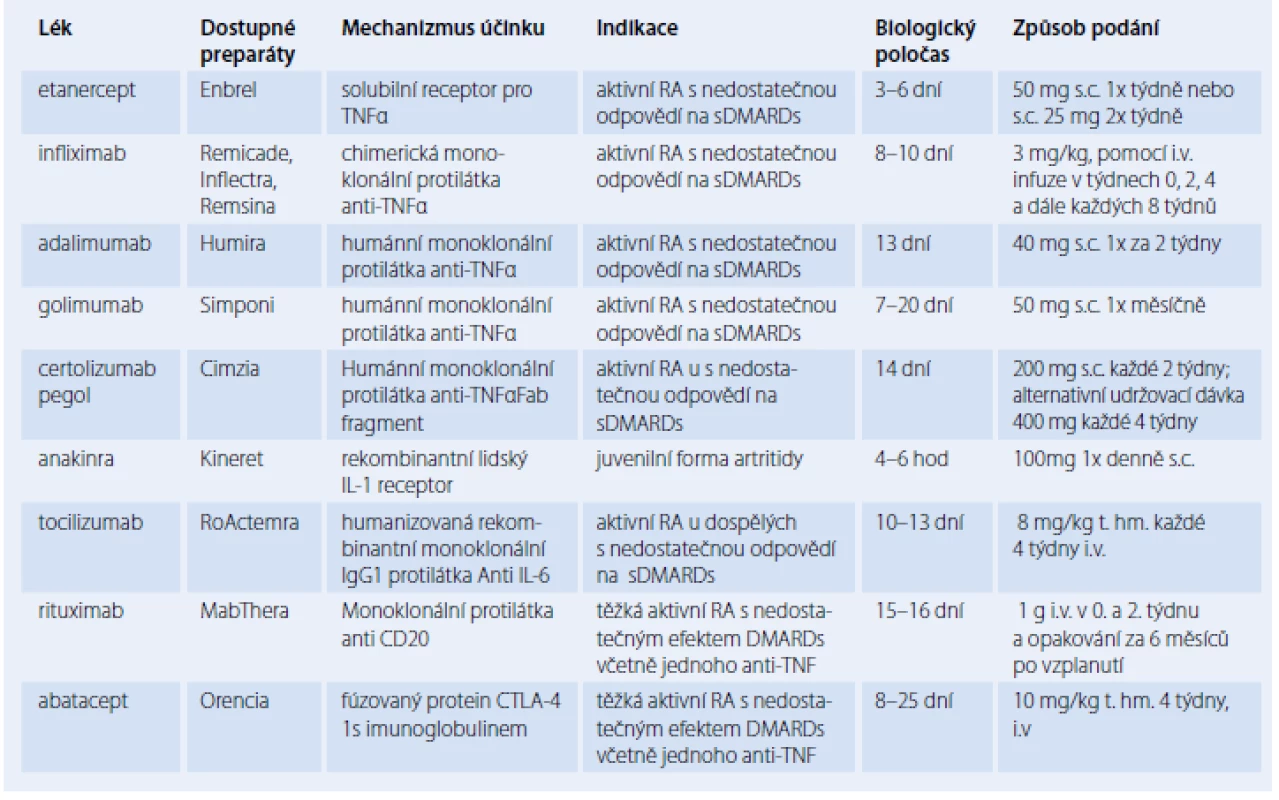
Hlavní výhodou biologik ve srovnání se syntetickými, chorobu modifikujícími léky je rychlejší nástup účinku a mnohem efektivnější zabránění radiologické progresi. Je známo, že agresivní a včasná léčba vede v dlouhodobém horizontu k lepším výsledkům. Nadále ale zůstává otázkou, zda by tato léčba měla zahrnovat i použití biologik. Biologická léčba je proto zatím vyhrazena pro pacienty, kteří nereagovali alespoň na jeden sDMARD, nejčastěji MTX.
Podstatná je i změna v celkovém přístupu k léčbě, kdy lepší diagnostické a prognostické možnosti, ve spojení s častějším hodnocením aktivity onemocnění pomocí specifických kompozitních indexů, vedou k optimalizaci léčby s cílem („treat to target“) remise nebo alespoň k nízké aktivitě onemocnění.
Biologická léčba v ČR je indikována dle současných doporučení České revmatologické společnosti (ČRS) ČLS JEP [30], která vycházejí z doporučení EULAR 2013 [3]. Je vyhrazena pouze Centrům biologické léčby. K evidenci biologické terapie byl ČRS vytvořen klinický registr ATTRA, což je celonárodní databáze vytvořená s cílem dlouhodobě sledovat účinnost a bezpečnost biologické léčby v běžné klinické praxi.
Rozvoj biologické léčby významně posunul terapeutické možnosti u pacientů s revmatoidní artritidou. Ovšem stále ne všichni pacienti reagují dostatečně. Nadále proto pokračují klinické studie hodnotící účinek nových – jak biologických, tak i syntetických DMARDs, které by v dohledné době mohly rozšířit spektrum účinné terapie pro pacienty s revmatoidní artritidou.
Doručeno do redakce: 15. 9. 2014
Přijato po recenzi: 1. 10. 2014
MUDr. Jana Tomasová Studýnková, Ph.D.
www.revma.cz
tomasova@revma.cz
Zdroje
1. Alamanos Y, Voulgari PV, Drosos AA. Epidemiology of rheumatic diseases in Greece. J Rheumatol 2004; 8 : 1669 – 1670. doi: 10.1016/ j.autrev.2004.09.002.
2. Neogi T, Aletaha D, Silman AJ et al. The 2010 American College of Rheumatology/ European League Against Rheumatism classification criteria for rheumatoid arthritis: Phase 2 methodological report. Arthritis Rheum 2010; 62 : 2582 – 2591. doi: 10.1002/ art.27580.
3. Smolen JS, Landewé R, Breedveld FC et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease ‑ modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2014; 73 : 492 – 509. doi: 10.1136/ annrheumdis ‑ 2013 ‑ 204573.
4. Smolen J., Aletaha D, Bijlsma JW et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69 : 631 – 637. doi: 10.1136/ ard.2009.123919.
5. Nam JL, Ramiro S, Gaujoux ‑ Viala C et al. Efficacy of biological disease ‑ modifying antirheumatic drugs: a systematic literature review informing the 2013 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 2014; 73 : 516 – 528. doi: 10.1136/ annrheumdis ‑ 2013 ‑ 204577.
6. Smolen JS, Aletaha D, Koeller M et al. New therapies for treatment of rheumatoid arthritis. Lancet 2007; 370 : 1861 – 1874.
7. Genovese MC, Bathon JM, Martin RW et al. Etanercept versus methotrexate in patients with early rheumatoid arthritis: two‑year radiographic and clinical outcomes. Arthritis Rheum 2002; 46 : 1443 – 1450. doi: 10.1002/ art.10308.
8. Emery P, Breedveld FC, Hall S et al. Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomised, double‑blind, parallel treatment trial. Lancet 2008; 372 : 375 – 382. doi: 10.1016/ S0140 ‑ 6736(08)61000 ‑ 4.
9. van der Heijde D, Klareskog L, Rodriguez ‑ Valverde Vet al. Comparison of etanercept and methotrexate, alone and combined, in the treatment of rheumatoid arthritis: two‑year clinical and radiographic results from the TEMPO study, a double‑blind, randomized trial. Arthritis Rheum 2006; 54 : 1063 – 1074. doi: 10.1002/ art.21655.0.
10. Smolen JS, Nash P, Durez P et al. Maintenance, reduction, or withdrawal of etanercept after treatment with etanercept and methotrexate in patients with moderate rheumatoid arthritis (PRESERVE): a randomised controlled trial. Lancet 2013; 381 : 918 – 929. doi: 10.1016/ S0140 ‑ 6736(12)61811 ‑ X.
11. Smolen JS, Aletaha D, Bijlsma JW et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69 : 631 – 637. doi: 10.1136/ ard.2009.123919.
12. Ramiro S, Gaujoux ‑ Viala C, Nam JL et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73 : 529 – 535. doi: 10.1136/ annrheumdis ‑ 2013 ‑ 204575.
13. Carmona L, Abasolo L, Descalzo MA et al. Cancer in patients with rheumatic diseases exposed to TNF antagonists. Semin Arthritis Rheum 2011; 41 : 71 – 80. doi: 10.1016/ j.semarthrit.2010.08.005.
14. Lipsky PE, van der Heijde DM, St Clair EW et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti‑Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med 2000; 343 : 1594 – 1602. doi: 10.1056/ NEJM200011303432202.
15. Breedveld FC, Weisman MH, Kavanaugh AF et al. The PREMIER study: A multicenter, randomized, double‑blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum 2006; 54 : 26 – 37. doi: 10.1002/ art.21519.
16. Smolen JS, Emery P, Fleischmann R et al. Adjustment of therapy in rheumatoid arthritis on the basis of achievement of stable low disease activity with adalimumab plus methotrexate or methotrexate alone: the randomised controlled OPTIMA trial. Lancet 2014; 383 : 321 – 332. doi: 10.1016/ s0140 ‑ 6736(13)61751 ‑ 1.
17. Keystone EC, Genovese MC, Klareskog L et al. Golimumab, a human antibody to tumour necrosis factor a given by monthly subcutaneous injections, in active rheumatoid arthritis despite methotrexate therapy: the GO ‑ FORWARD Study. Ann Rheum Dis 2009; 68 : 789 – 796. doi: 10.1136/ ard.2008.099010.
18. Weinblatt ME, Fleischmann R, Huizinga TW et al. Efficacy and safety of certolizumab pegol in a broad population of patients with active rheumatoid arthritis: results from the REALISTIC phase IIIb study. Rheumatology 2012; 51 : 2204 – 2214. doi: 10.1093/ rheumatology/ kes150.
19. Smolen JS, Emery P, Ferraccioli GF et al. Certolizumab pegol in rheumatoid arthritis patients with low to moderate activity: the CERTAIN double‑blind, randomised, placebo ‑ controlled trial. Ann Rheum Dis 2014. doi: 10.1136/ annrheumdis ‑ 2013 ‑ 204632.
20. Singh JA, Christensen R, Wells GA et al. A network meta‑analysis of randomized controlled trials of biologics for rheumatoid arthritis: a Cochrane overview. CMAJ 2009; 181 : 787 – 796. doi: 10.1503/ cmaj.091391.
21. Sandborg C, Mellins ED. A new era in the treatment of systemic juvenile idiopathic arthritis. N Engl J Med 2012; 367 : 2439 – 2440. doi: 10.1056/ NEJMe1212640.
22. Genovese MC, McKay JD, Nasonov EL et al. Interleukin‑6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease ‑ modifying antirheumatic drugs: the tocilizumab in combination with traditional disease ‑ modifying antirheumatic drug therapy study. Arthritis Rheum 2008; 58 : 2968 – 2980. doi: 10.1002/ art.23940.
23. Jones G, Sebba A, Gu J et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patients with moderate to severe rheumatoid arthritis: the AMBITION study. Ann Rheum Dis 2010; 69 : 88 – 96. doi: 10.1136/ ard.2008.105197.
24. Gabay C, Emery P, van Vollenhoven R et al. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double‑blind, controlled phase 4 trial. Lancet 2013; 381 : 1541 – 1550. doi: 10.1016/ S0140 ‑ 6736(13)60250 ‑ 0.
25. Dörner T, Burmester GR. The role of B cells in rheumatoid arthritis: mechanisms and therapeutic targets. Curr Opin Rheumatol 2003; 15 : 246 – 252. doi: 10.1097/ 00002281 ‑ 200305000 ‑ 00011.
26. Cohen SB, Emery P, Greenwald MW et al. REFLEX Trial Group Rituximab for rheumatoid arthritis refractory to anti‑tumor necrosis factor therapy: results of a multicenter, randomized, double‑blind, placebo ‑ controlled, phase III trial evaluating primary efficacy and safety at twenty ‑ four weeks. Arthritis Rheum 2006; 54 : 2793 – 2806. doi: 10.1002/ art.22025.
27. Genovese MC, Covarrubias A, Leon G et al. Subcutaneous abatacept versus intravenous abatacept: a phase IIIb noninferiority study in patients with an inadequate response to methotrexate. Arthritis Rheum 2011; 63 : 2854 – 2864. doi: 10.1002/ art.30463.
28. van Vollenhoven RF, Fleischmann R, Cohen S et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med 2012; 367 : 508 – 519. doi: 10.1056/ NEJMoa1112072.
29. Scheinberg MA, Kay J. The advent of biosimilar therapies in rheumatology – “O brave new world”. Nat Rev Rheumatol 2012; 8 : 430 – 436. doi: 10.1038/ nrrheum.2012.84.
30. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Čes Revmatol 2010; 4 : 182 – 191.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- ESC 2014 Barcelona – kombinační léčba hypertenze
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Stručný průvodce putováním od nové přes novější k nejnovější léčbě DM2
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



