-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba anémie a nedostatku železa z pohledu hematologa
Treatment of anemia and iron deficiency from the hematologist’s perspective
Iron deficiency anemia represents the most frequent hematological disorder worldwide. Basic mechanisms involved in iron metabolism regulation have been described over the past 20 years, e. g. the system of IRP/ IRP regulatory proteins or the discovery of hepcidin, a key regulatory peptide involved in the regulation of iron metabolism and synthesis. Increased iron loss from the body is the most common reason for iron deficiency, the combination of serum ferritin level and transferrin saturation represent the most effective laboratory tools for the diagnosis of iron deficiency. A combination of several parameters is usually necessary for an exact diagnosis of iron deficiency in conditions with a combined iron metabolism disorder (e. g. anemia of chronic diseases). Iron deficiency may be corrected with the administration of medications containing iron salts. Parenteral administration of iron is indicated in patients with altered iron absorption from the gut; new drugs with regular and gradual release of iron molecules, even in large amounts (e. g. ferric carboxymaltose), may effectively correct iron depletion in these patients. High bioavailability of these preparations could also be effective in the initial correction of severe sideropenic anemia in patients with poor toleration of oral iron medications.
Keywords:
iron deficiency anemia – iron metabolism – diagnosis – treatment – hepcidin – parenteral iron drugs
Autoři: J.čermák
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(5): 359-363
Kategorie: Kardiologická revue
Souhrn
Anémie z nedostatku železa je v celosvětovém měřítku nejčastějším hematologickým onemocněním vůbec. V posledních 20 letech byly popsány základní mechanizmy regulace metabolizmu železa, ať již se jedná o systém regulačních proteinů IRP/ IRE či o objev hepcidinu, klíčového peptidu metabolizmu železa a mechanizmů regulace jeho syntézy. Příčinou sideropenie je nejčastěji zvýšená ztráta železa z organizmu, v diagnostice se uplatňuje zejména kombinace hladiny feritinu v séru a saturace transferinu. U stavů s kombinovanou poruchou metabolizmu železa (např. anémie u chronických onemocnění) je většinou k odhalení sideropenie třeba vyšetření několika parametrů. V léčbě sideropenie se uplatňuje substituce přípravky obsahujícími železo. Parenterální podávání železa je indikováno u stavů s porušenou resorpcí železa ze střeva, jako velmi efektivní se u těchto stavů ukazuje být podání nových přípravků s rovnoměrným postupným uvolňováním i vysokého obsahu železa v molekule (např. Fe3+ v komplexu s karboxymaltózou). Velmi dobrá biologická využitelnost těchto přípravků by mohla být výhodná i při iniciální korekci těžké sideropenie u nemocných špatně tolerujících perorální přípravky železa.
Klíčová slova:
anémie z nedostatku železa – metabolizmus železa – diagnostika – léčba – hepcidin – parenterální přípravky Fe
Anémie z nedostatku železa (Fe) je nejčastějším hematologickým onemocněním a v celosvětovém měřítku nejčastější chorobou vůbec. Incidence sideropenické anémie je v našem regionu cca 5 % u mužů a 8 – 20 % u žen, ale v rozvojových zemích je popisován výskyt až u 30 – 70 % populace. Pro lidský organizmus je však přinejmenším stejně nebezpečný i nadbytek Fe, jenž může vést při delším trvání k ireverzibilnímu poškození zejména srdce, jater a endokrinního systému toxickým účinkem hromadícího se Fe.
Metabolizmus železa a jeho regulace
Železo vstřebané z trávicího traktu je dopravováno do cílových tkání v trojmocné formě především ve vazbě na transferin. Transferin se na povrchu buňky váže na transferinový receptor a celý komplex podléhá endocytóze. Při poklesu pH v endocytickém váčku dochází k uvolnění Fe, které je redukováno na dvojmocnou formu reduktázou Steap 3 a následně transportováno do nitra buňky pomocí DVMT1 (transportér pro dvojmocné Fe, jenž zprostředkovává i transport Fe ze střeva přes membránu střevního epitelu). Uvolněné Fe se váže buď na mitochondriální feritin a je dále utilizováno v mitochondriích nebo je ukládáno v zásobní formě feritinu [1]. Metabolizmus Fe v erytroidních prekurzorech je znázorněn na obr. 1. Na přelomu 80. a 90. let minulého století byl popsán mechanizmus, jakým se samotné Fe podílí na regulaci objemu Fe, které je přijímáno buňkou, a jaká část tohoto množství je ukládána do zásobní formy a kolik Fe je k dispozici pro metabolické pochody. V nepřepisované části mRNA pro tvorbu řady proteinů uplatňujících se v metabolizmu Fe byla popsána konstantní sekvence nukleotidů nazvaná IRE (iron regulatory element – okrsek regulovaný železem), na niž se váže tzv. IRP 1 či IRP 2 (iron responsive proteins – proteiny odpovídající na železo), vazba proteinu na regulační úsek na RNA je závislá na cytoplazmatické hladině Fe v tzv. labilním poolu, vazba je pevná jen při jeho nízké hladině, při stoupající hladině Fe se vytváří kubická struktura obsahující Fe ‑ S, která vazbě brání [2]. Přítomnost komplexu IRE s navázaným IRP v iniciální nepřepisované páté oblasti mRNA blokuje iniciaci translace. Tímto způsobem je tlumena syntéza feritinu (zásobního proteinu pro Fe), feroportinu (proteinu zodpovědného za transport Fe extracelulárně) či δ aminolevulát syntetázy (klíčového enzymu pro tvorbu hemu) při nedostatku Fe v organizmu. Naopak, přítomnost komplexu IRE/ IRP v koncové třetí nepřepisované oblasti mRNA zvyšuje stabilitu RNA, a tím stimuluje translaci. Takto je zvyšována tvorba transferinového receptoru (zodpovědného za přívod Fe do buňky) a divalentního transportéru kovů 1 (DVMT 1, jenž přenáší Fe do nitra buňky ze střeva a rovněž transportuje do cytoplazmy Fe uvolněné z vazby na transferinový receptor) při nedostatku Fe. Při nadbytku Fe naopak stoupá tvorba feritinu a feroportinu a snižuje se syntéza transferinového receptoru a DVMT 1 (obr. 2) [3,4].
Obr. 1. Metabolismus Fe v erytroidních prekurzorech (upraveno dle Ganze et al) 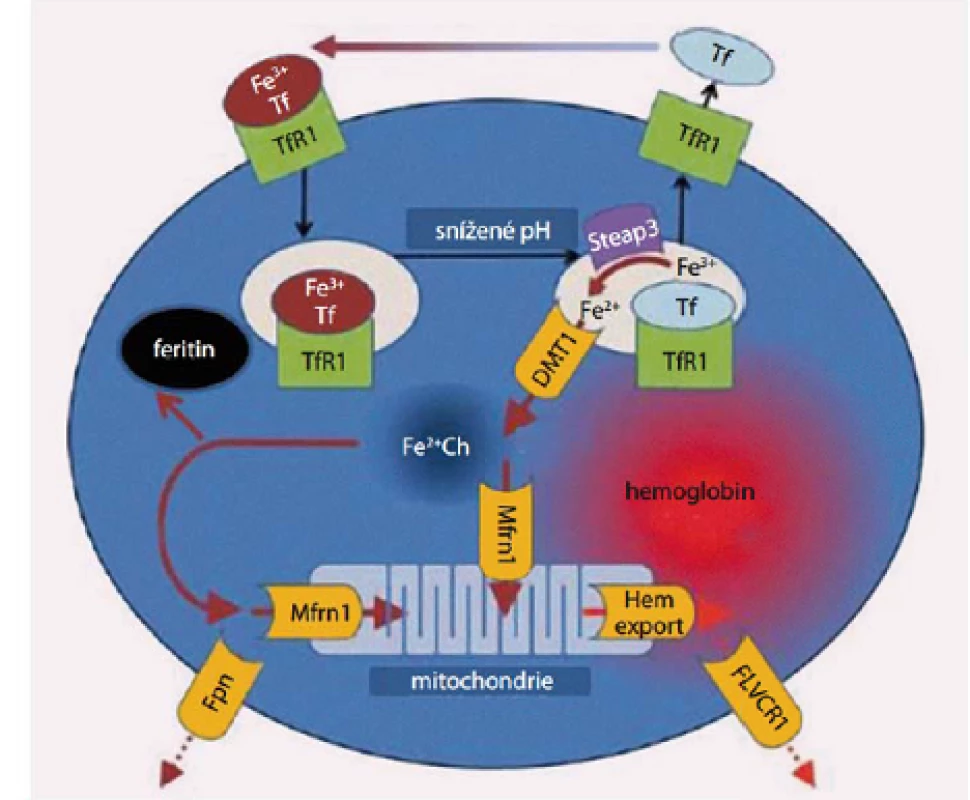
Transferin (Tf ) transportující trojmocné Fe se váže na povrchu buňky na transferinový receptor 1 (TfR1), celý komplex podléhá endocytóze, v kyselém prostředí pak dochází k uvolnění Fe3+ z vazby na komplex Tf-TfR1 a jeho redukci na dvojmocnou formu účinkem reduktázy Steap3. Transport Fe2+ do nitra buňky je zprostředkován DVMT1, z intracelulárního prostoru je buď odsunováno vázané na mitochondrální feritin (Mfrn1) do mitochondrií či je ukládáno do zásobní formy feritinu. Vytvořený hem je vázán s globinem, za určitých okolností může být Fe též transportováno extracelulárně (zprostředkováno feroportinem 1 – Fpn) stejně tak jako vznikající hem (vazbou s FLVC receptorem-FLVCR1). Obr. 2. Regulace tvorby feritinu, transferinového receptoru, feroportinu a DVMT-1 hladinou nitrobuněčného železa v tzv. labilním poolu cestou vazby IRP na IRE. 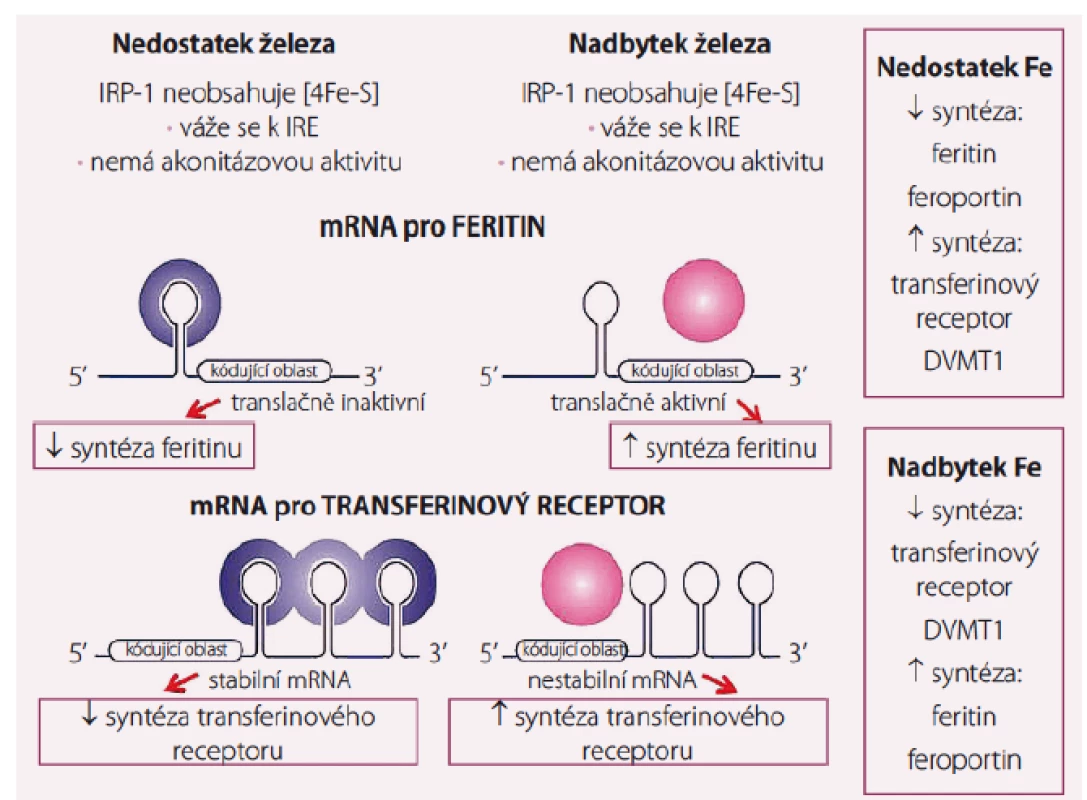
V roce 2000 byl objeven hepcidin, polypeptid syntetizovaný v játrech, jenž hraje klíčovou úlohu v regulaci metabolizmu Fe. Úlohou hepcidinu je degradace feroportinu ‑ 1, jenž zprostředkovává přenos Fe extracelulárně, důsledkem stoupající hladiny hepcidinu je tedy snížení výdeje Fe z buňky. Na regulaci tvorby hepcidinu se podílí řada faktorů, tzv. protein dědičné hemochromatózy (HH či HFE protein) se váží v buňce na transferinový receptor kompetitivně s Fe uvolněným z transferinu, volný HFE protein se váže transferinovým receptorem 2 a tento komplex indukuje tvorbu hepcidinu cestou aktivace tzv. BMP (bone morphogenic protein) receptoru a jeho signální dráhy (SMAD). V poslední době se ukazuje, že větší regulační význam má zřejmě přímá stimulace aktivity BMP receptoru proteinem BMP6 (Bone Morphogenic Protein 6), jehož hladina je závislá na koncentraci Fe v parenchymatózních orgánech, zejména v játrech. Dalšími regulačními proteiny simulujícími aktivitu BMP receptoru jsou hemojuvelin a matriptáza ‑ 2 (MT ‑ 2 neboli TM ‑ PRSS6). Tímto způsobem je citlivě regulován výdej Fe z monocyto ‑ makrofágového systému do cirkulace a druhotně resorpce Fe ze střeva při stoupající intracelulární hladině Fe. Obdobně stimuluje tvorbu hepcidinu hemojuvelin a též zvýšená hladina některých cytokinů (IL‑1,IL‑6) při zánětu, tento mechanizmus je základním patogenetickým momentem při rozvoji anémie při chronickém onemocnění. Anémie s hypoxií a vystupňovaná erytropoéza naopak tlumí tvorbu hepcidinu, cílem je zvýšení výdeje Fe do cirkulace za účelem přesunu do funkčního poolu v kostní dřeni a v poslední době bylo prokázáno, že tento efekt je zprostředkován proteinem nazvaným erytroferon [5], jehož sekrece zřejmě závisí na hladině endogenního erytropoetinu. Tento moment se spolupodílí na rozvoji přetížení železem u některých anémií s vystupňovanou inefektivní erytropoézou (talasemie, myelodysplastický syndrom) (obr. 3). Na obr. 4 je znázorněn metabolizmus Fe v monocyto ‑ makrofágovém systému po fagocytóze zanikajících erytrocytů.
Obr. 3. Přehled jednotlivých mechanizmů uplatňujících se v regulaci tvorby hepcidinu. 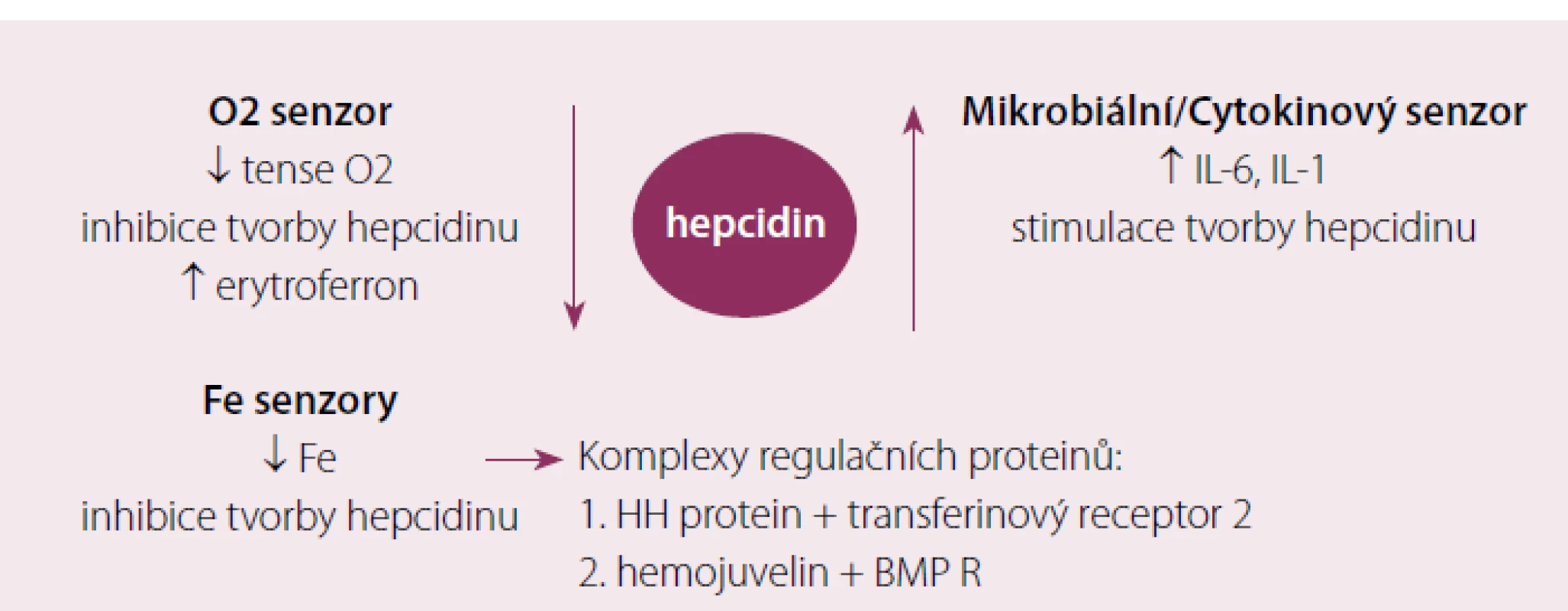
Obr. 4. Metabolizmus Fe v mikrofázích. 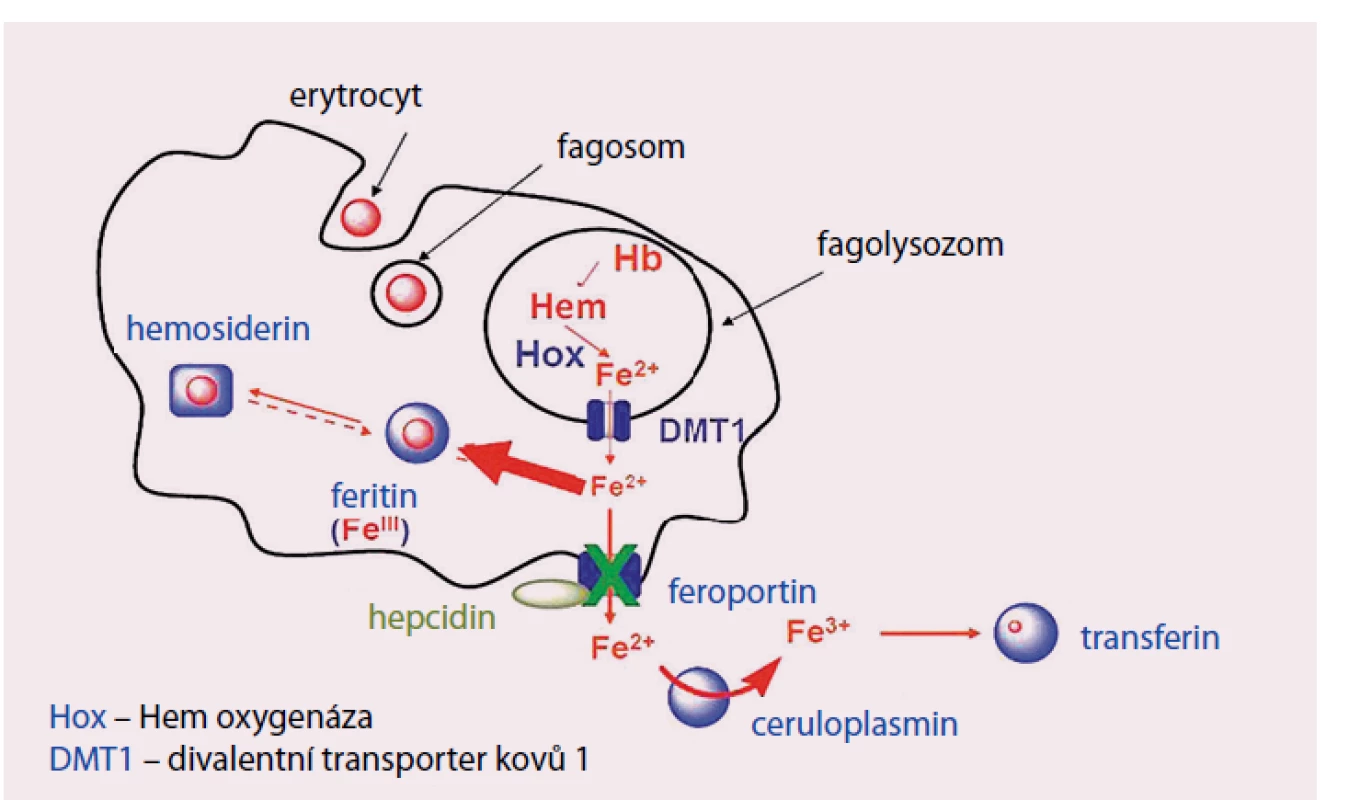
Železo z hemoglobinu fagocytovaného erytrocytu se ve fagolysozomu uvolňuje z vazby na hem účinkem hem oxygenázy (Hox) a ve dvojmocné formě je transportováno DVMT1 (DMT) do nitra buňky. Následně je buď ukládáno do zásobní formy feritinu či může být transportováno extracelulárně – zprostředkováno ferroportinem 1. Aktivita ferroportinu je ovlivňována vazbou hepcidinu. Fe2+ je extracelulárně oxidováno na trojmocnou formu účinkem ceruloplazminu a může se opět vázat na transferin. Příčiny nedostatku železa
Nejčastější příčinou sideropenie jsou nadměrné ztráty Fe z organizmu. U žen je častým zdrojem krvácení urogenitální trakt. Během menstruace činí krevní ztráta v průměru 40 – 60 ml za cyklus, což odpovídá cca 16 – 25 mg Fe. U žen se proto již fyziologicky uplatňuje první regulační mechanizmus, kterým se organizmus brání rozvoji sideropenie. Denní resorpce Fe z potravy je zvýšena ze 7 – 10 % na 20 – 25 % přijaté dávky. Při krevních ztrátách přesahujících 70 – 80 ml za cyklus však již organizmus nestačí kompenzovat ztráty Fe zvýšenou resorpcí a pokud není dostatečně zvýšen obsah Fe v potravě (z běžných 10 – 15 mg denně na cca 18 – 20 mg), dochází k postupnému rozvoji sideropenie. Značné krvácení mohou způsobit jak benigní, tak maligní nádory dělohy. Nefrolitiáza, ureterolitiáza a zánětlivé afekce ledvin a močových cest bývají méně častou, ale nezanedbatelnou příčinou chronických ztrát Fe. Krvácení do trávicího ústrojí je další častou příčinou sideropenie a uplatňuje se zejména u mužů a u žen v menopauze. Z celé řady možných afekcí v GIT je nutno zdůraznit zejména peptický vřed, brániční kýlu s refluxní ezofagitidou, jícnové varixy hemoroidy, divertikly, ale také benigní či maligní nádory. Je třeba připomenout, že krvácení do GIT mohou vyvolávat i některé léky – kyselina acetylsalicylová, glukokortikoidy, nesteroidní antirevmatika, antikoagulancia, vzácněji např. chlorid draselný. Do trávicího ústrojí mohou krvácet i nemocní s krvácivými chorobami vyvolanými poruchou funkce destiček či koagulačních faktorů. Mezi vzácnější příčiny sideropenie patří krvácení z dýchacího ústrojí a artificiální ztráty např. při hemodialýze či odběrech krve. U dárce je každý odběr krve spojen se ztrátou cca 150 – 200 mg Fe. Nedostatečný přívod Fe v potravě je v oblastech se skladbou stravy obdobnou naší poměrně vzácný. Krom přímého nedostatku Fe v potravě se může na jeho sníženém přívodu podílet i nadbytek látek, jež mohou inhibovat jeho resorpci (fosfáty, fytáty, tanáty, oxaláty). Častěji je nedostatečný příjem Fe projevem malabsorpce při celiakii, Crohnově chorobě či po resekci žaludku nebo střeva, kdy je omezená resorpční plocha a zrychlená pasáž potravy. U parazitárních onemocnění může jít o kombinaci porušeného vstřebávání s krvácením do GIT. Ke komsumpci Fe s jeho následným nedostatkem může vést i infekce Helicobacterem pylori.
Zvýšené nároky na přívod Fe jsou přítomny v těhotenství, kdy jeho potřeba stoupá na 20 – 25 mg denně. Ztráta železa během gravidity se odhaduje na 900 – 1 000 mg a zejména v posledním trimestru vzniká bez substituce Fe sideropenie u více než 70 % těhotných. Během kojení činí ztráty Fe cca 1 mg denně. Zvýšená spotřeba železa je typická i pro období růstu. U dvouletých dětí by měl přívod Fe činit cca 15 mg denně, menstruující ženy mezi 14. a 30. rokem věku potřebují přibližně 18 mg železa denně. Zejména u chronických zánětlivých onemocnění střeva však může metabolizmus železa ovlivňovat řada faktorů (porucha vstřebávání v GIT, krvácení do GIT, porucha distribuce Fe v organizmu) a většinou je třeba použít kombinace několika laboratorních vyšetření k odhalení přítomnosti a hloubky skutečného deficitu Fe a ke správné indikaci substituční léčby – viz níže.
Nedostatek železa omezuje tvorbu fyziologicky důležitých bílkovin, ve kterých je vázáno buď ve formě hemu (hemoglobin, myoglobin, cytochromy, kataláza, peroxidáza) či v nehemové formě (akonitáza, sukcinátdehydrogenáza, xanthinoxidáza, ribonukleotidreduktáza, α ‑ glycerolfosfátdehydrogenáza aj.). Sideropenie se většinou rozvíjí pomalu při dlouhodobé negativní bilanci železa vznikající nepoměrem mezi chronicky zvýšenými ztrátami a nedostatečně zvýšeným množstvím Fe v přijímané potravě. Při rozvoji sideropenie rozeznáváme tři stadia. V období prelatentní sideropenie dochází k postupnému vyčerpání zásob Fe, ale dodávka pro potřeby erytropoézy je ještě dostatečná. Tento stav většinou není spojen s klinickými příznaky. Ve fázi latentní sideropenie jsou zásoby Fe již zcela vyčerpány a je snížena jeho dodávka do erytroblastů kostní dřeně, avšak tento pokles zatím nelimituje proliferaci buněk. Ve stadiu manifestní sideropenie již nedostatek Fe tlumí proliferaci a vzniká obraz anémie jako důsledek neschopnosti erytropoézy kompenzovat normální či mírně zvýšený zánik erytrocytů.
Diagnostika nedostatku železa
Již v období prelatentního nedostatku železa se uplatňují kompenzační mechanizmy organizmu: zvýšení resorpce Fe z GIT, snížení jeho výdeje a útlum tvorby feritinu – zásobního proteinu Fe. Je zvýšena resorpce radioželeza (59Fe) z GIT a snížen jeho výdej močí, klesá obsah barvitelného Fe v monocyto ‑ makrofágovém systému kostní dřeně a hladina feritinu v séru se snižuje pod dolní hranici normy u více než 50 % nemocných. Pro klinickou praxi je rozhodující včasná diagnostika latentní sideropenie. V této fázi je snížena hladina feritinu v séru pod 12 µg/ l u více než 90 % nemocných, je snížena hladina Fe v séru a zvýšena celková vazebná kapacita transferinu pro Fe, saturace transferinu klesá pod 16 %. Kombinací vyšetření hladiny feritinu v séru a saturace transferinu lze odhalit až 95 % nemocných s latentní sideropenií a obě vyšetření jsou zásadní pro diagnostiku sideropenie. Současně je zvýšena koncentrace solubilních cirkulujících transferinových receptorů v séru (nad 5 – 8 mg/ l) a koncentrace volného protoporfyrinu v erytrocytech. V kostní dřeni klesá počet sideroblastů z 50 – 60 % pod 30 %. Manifestní sideropenie je charakterizována hypochromií, mikrocytární anémií, hladina feritinu v séru je snížena pod 5 µg/ l, saturace transferinu klesá pod 10 %, v kostní dřeni chybí zásobní Fe a nalézáme zde méně než 10 % sideroblastů.
Tab. 1. Diferenciální diagnostika anémie z nedostatku železa. 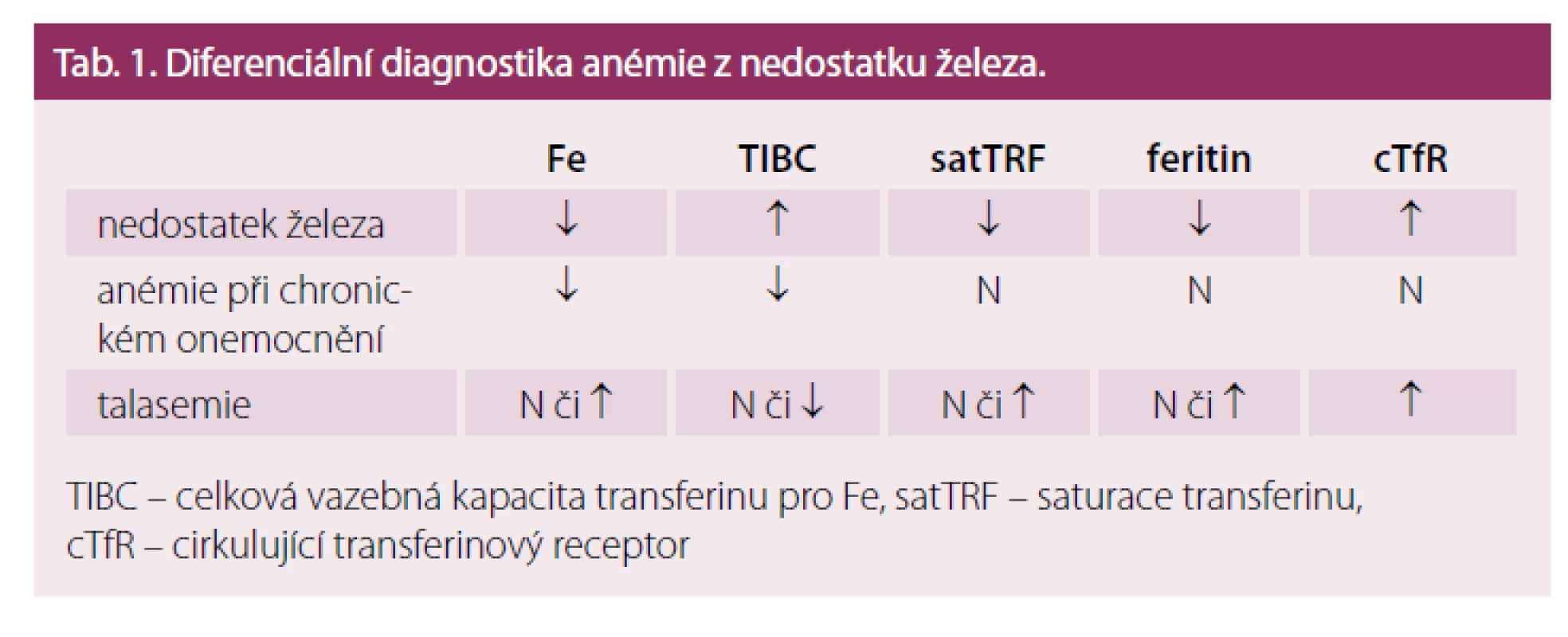
TIBC – celková vazebná kapacita transferinu pro Fe, satTRF – saturace transferinu, cTfR – cirkulující transferinový receptor Současně s diagnózou sideropenie je vždy nutno pátrat po příčině nedostatku Fe, nedílnou součástí vyšetřovacího postupu je proto opakované vyšetření stolice na okultní krvácení, moči a močového sedimentu, gynekologické vyšetření a event. instrumentární vyšetření GIT. V diferenciální diagnostice je třeba odlišit mírnější formy sideropenie od anémie při chronickém onemocnění a od heterozygotních forem talasemie. U nemocných s heterozygotní β ‑ talasemií je přítomna nápadná mikrocytóza a hypochromie bez výraznější anémie, počet erytrocytů může být naopak i lehce zvýšen. Hladiny Fe a feritinu v séru nejsou zvýšeny, charakteristické jsou změny v elektroforéze hemoglobinu. Vzácně je třeba odlišit kongenitální sideroblastickou anémii. U anémie při chronickém onemocnění je přítomna snížená koncentrace železa v séru v důsledku poruchy jeho distribuce v organizmu, na rozdíl od pravé sideropenie není snížena hladina feritinu v séru ani saturace transferinu. Počet cirkulujících transferinových receptorů není zvýšen (tab. 1). Jak již bylo uvedeno výše, u řady chronických onemocnění, zejména u chronických zánětů střevních, však může být přítomna kombinace zvýšených ztrát Fe, jeho snížené resorpce a distribučních poruch. Snížený výdej Fe do cirkulace představuje u anémie při chronickém onemocnění (ACD) určitý obranný mechanizmus bránící dodávce Fe jako růstového faktoru, invadujícím mikroorganizmům či nádorovým buňkám, a proto je třeba Fe do organizmu dodat pouze při jeho prokázaném skutečném deficitu. Hladina feritinu bývá u ACD nespecificky zvýšena díky retenci Fe v monocyto ‑ makrofágovém systému, a proto má pro detekci přítomnosti deficitu Fe u ACD malý význam. Citlivějším ukazatelem je vyšetření hladiny cirkulujících transferinových receptorů (cTFR), její zvýšení odráží zvýšenou syntézu transferinového receptoru v buňce při nedostatku utilizovatelného Fe (viz výše popsané regulační mechanizmy). Ještě přesnější je stanovení poměru hladiny cTFR k log feritinu. Průkaz zvýšené hladiny hepcidinu v séru může svědčit pro převahu distribučních změn, zatím se však toto vyšetření rutinně neprovádí. V tab. 2 je uvedena doporučovaná kombinace vyšetření pro přesnou diagnostiku stavu zásob Fe u chronických onemocnění a jejich interpretace.
Tab. 2. Diagnostika deficitu železa u anémie při chronických onemocněních. 
cTfR – cirkulující transferinový receptor Léčba nedostatku železa
První zásadou léčby sideropenie je odstranění její příčiny. Druhou zásadou je substituce dostatečným množstvím železa po dostatečně dlouhou dobu. Optimální léčba sideropenie by měla vést k vzestupu hodnot Hb o 2 g/ l denně, k tomu je třeba vstřebat 50 – 60 mg elementárního Fe, což odpovídá při optimální resorpci dodávce nejméně 180 – 200 mg prvkového Fe denně per os. Přípravky Fe je nutno podávat rovnoměrně během dne a pokud možno na lačno nejméně 1/2 hod před jídlem či nejméně 2 hod po jídle. Řada látek v potravě může snižovat resorpci Fe, naopak aminokyseliny, kyselina askorbová a citronová a některé cukry vstřebávání Fe podporují, toho je využíváno v některých přípravcích Fe. S resorpcí Fe mohou interferovat i některé léky (antacida, antagonisté H2 - receptorů, pankreatická lipáza, penicilamin aj.). Podávání kombinovaných přípravků železa (většinou s vitaminem B12 a kyselinou listovou) je namístě pouze u skutečně prokázaného kombinovaného deficitu těchto látek či profylakticky v těhotenství. Kontrolu účinnosti léčby provádíme v prvé fázi vyšetřením hodnot Hb, po normalizaci hodnot Hb je vhodné opakovaně kontrolovat hladinu feritinu v séru a pokračovat v léčbě do naplnění zásob Fe v organizmu na optimální hodnoty, jež činí 300 – 500 mg, hodnota 1 µg/ l feritinu v séru přitom odpovídá cca 8 mg zásobního Fe.
Parenterální podávání Fe je dle současných doporučení indikováno pouze u nemocných, kde je příčinou nedostatku Fe jeho malabsorpce z GIT. Běžné dávkování je 62,5 mg (Fe3+ komplex s glukonátem sodným) nebo 100 mg (Fe3+ sacharózový komplex) elementárního Fe 1× denně. Nevýhodou těchto přípravků je poměrně rychlé uvolnění Fe z komplexu v cirkulaci, což může snižovat jeho utilizaci vzhledem k limitované proliferaci kvůli přítomné sideropenii. Rychlé uvolnění Fe do cirkulace je též nejčastější příčinou vedlejších nežádoucích účinků spojených s parenterálním podáním přípravků Fe. Komplex Fe3+ s karboxymaltózou umožňuje pomalé a rovnoměrné uvolňování i vysokých dávek Fe obsažených v přípravku, což je spojeno s utilizací více než 90 % podaného Fe při minimu vedlejších účinků a možností aplikace 1× týdně [6]. Změny metabolizmu Fe u afekcí GIT mají často multifaktoriální příčinu a jak již bylo uvedeno výše, diagnostika skutečného deficitu Fe vyžaduje většinou kombinaci několika laboratorních vyšetření. Zcela obecně a velmi zjednodušeně lze říci, že pokles hladiny feritinu v séru pod 50 µg/ l a saturace transferinu pod 16 – 18 % může být u těchto onemocnění známkou vznikajícího absolutního deficitu Fe. Nicméně, sami jsme pozorovali známky deficitu Fe při opakovaném krvácení do GIT u nemocného s ulcerózní kolitidou a chronickou jaterní lézí i při hodnotě feritinu v séru 490 µg/ l, přičemž hodnota cTFR činila 12,9 mg/ l a index cTFR/ log feritin byl 4,45.
Z pohledu hematologa je nutno pečlivě indikovat i podávání parenterálních přípravků Fe u nemocných s chronickou renální insuficiencí léčených rekombinantním lidským erytropoetinem (rHuEPO). Část nemocných má známky určitého stupně přetížení Fe kvůli základnímu chronickému onemocnění a opakovaným transfuzím erytrocytů. V naší studii změn zásob Fe u nemocných s chronickou renální insuficiencí léčených podáváním rHuEPO byla substituce přípravky Fe již během prvního měsíce léčby nutná jen u nemocných s iniciální hladinou feritinu v séru < 30 µg/ l, u nemocných s hladinou feritinu v séru 50 – 100 µg/ l byla substituce započata od třetího měsíce léčby a u nemocných s iniciální hodnotu feritinu v séru > 100 µg/ l bylo možno substituci Fe zahájit až po prvním roce léčby, přičemž u nemocných s počáteční hladinou feritinu v séru > 750 µg/ l nebylo nutno podávání přípravků Fe třeba zahájit během 36 měsíců léčby rHuEPO vůbec a podávání samotného erytropoetinu naopak vedlo k efektivnímu snížení nadbytečných zásob Fe [7], což je zřejmě možno vysvětlit recentně popsaným inhibičním efektem erytropoetinu na tvorbu hepcidinu [5].
U řady dalších onemocnění probíhají studie možného příznivého efektu parenterálně podávaného Fe. Z hematologických onemocnění se jeví možnou racionální indikací podání parenterálního Fe v komplexu s karboxymaltózou těžká sideropenie s projevy anemického syndromu u nemocných, kteří velmi obtížně tolerují efektivní dávku jakéhokoli perorálního přípravku Fe. Zde by mohlo podání přípravku s vysokým procentem efektivní utilizace urychlit na rozdíl od jiných parenterálních forem Fe korekci anémie a vytvoření určitého stupně zásob Fe, což by umožnilo použít v další léčbě nižší a lépe tolerované dávky perorálních přípravků Fe.
Doručeno do redakce: 22. 9. 2014
Přijato po recenzi: 10. 10. 2014
doc. MU Dr. Jaroslav Čermák, CSc.
www.uhkt.cz
cermak@uhkt.cz
Zdroje
1. Ganz T, Nemeth E. Iron metabolism: interactions with normal and disordered erythropoiesis. Cold Spring Harb Perspect Med 2012; 2: a011668. doi: 10.1101/ cshperspect.a011668.
2. Rouault TA. The role of iron regulatory proteins in mammalian iron homeostasis and disease. Nat Chem Biol 2006; 2 : 406 – 414.
3. Roy CN, Enns CA. Iron homeostasis: new tales from the crypt. Blood 2000; 96 : 4020 – 4027.
4. Eisenstein RS, Blemings KP. Iron regulatory proteins, iron responsive elements and iron homeostasis. J Nutr 1998; 128 : 2295 – 2298.
5. Kautz L, Jung G, Valore E et al. The erythroid factor erythroferrone nad its role in iron homeostasis. Blood 2013; 122 : 4.
6. Geisser P. The pharmacology nad safety profile of ferric carboxymaltose (Ferriprox®): structure/ reactivity relationships of iron preparations. Port J Nephrol Hypert 2009; 23 : 11 – 16.
7. Čermák J, Gregora E, Lachmanová J et al. Sledování zásob železa u nemocných s chronickým selháním ledvin léčených rekombinantním lidským erytropoetinem. Vnitř Lék 1994; 40 : 174 – 178.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- ESC 2014 Barcelona – kombinační léčba hypertenze
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Stručný průvodce putováním od nové přes novější k nejnovější léčbě DM2
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



