-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
Mechanical circulatory support in the treatment of cardiogenic shock – review
The maintenance of adequate end‑organ perfusion is the cornerstone of cardiogenic shock management, which still carries a poor prognosis. Mechanical circulatory support to ensure organ perfusion is required once pharmacological therapy together with the effort to affect the cause of heart failure is less effective or fails. There are currently several circulatory support options, including intra ‑ aortic balloon counterpulsation, extracorporeal membrane oxygenation and percutaneously or surgically implanted ventricular assist devices. The role of, and experience with, each of these support devices in the management of cardiogenic shock is broadly discussed in this review.
Keywords:
cardiogenic shock – mechanical circulatory support – review
Autoři: M. Šimek 1; M. Hutyra 2; O. Zuščich 1; A. Klváček 1
Působiště autorů: Kardiochirurgická klinika FN Olomouc 1; I. interní klinika – kardiologická FN Olomouc 2
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(2): 116-122
Kategorie: Kardiologická revue
Souhrn
Udržení adekvátní perfuze cílových orgánů hraje zásadní roli v managementu kardiogenního šoku, který je stále zatížen vysokou mortalitou. Pokud farmakologická léčba společně se snahou o ovlivnění příčiny srdečního poškození selhávají, je nutno bezprostředně zvážit zavedení mechanické podpory oběhu k zajištění orgánové perfuze. K dočasné podpoře oběhu je využíváno více typů podpor zahrnující intraaortální balonkovou kontrapulzaci, mimotělní membránovou oxygenaci, perkutánně nebo chirurgicky implantované srdeční podpory. V přehledu je šířeji diskutována problematika jednotlivých typů podpor oběhu, zkušenosti s nimi a jejich role v managementu kardiogenního šoku.
Klíčová slova:
kardiogenní šok – mechanická podpora oběhu – přehledÚvod
Akutní srdeční selhání manifestující se kardiogenním šokem (KŠ) má stále vysokou mortalitu. Etiologicky se jedná o pestrou paletu onemocnění závažně alterující srdeční funkci (tab. 1). Nejlépe je problematika KŠ zmapována u akutního infarktu myokardu (AIM), kdy náhlá ztráta funkce (zpravidla) více než 40 % myokardiální masy levé komory srdeční vede k rozvoji KŠ (hemodynamicky charakterizovaného poklesem srdečního indexu < 2,2 l/ min, elevace tlaku v zaklínění plicnice – pulmonary artery wedge pressure – PAWP > 18 mmHg, systémovou hypotenzí se setrvalým poklesem systolického tlaku pod < 90 mmHg a kritickým omezením perfuze cílových orgánů). Podle literárních údajů je až 8 % AIM (dominantně s elevacemi ST segmentu) komplikováno rozvojem KŠ. Primární perkutánní koronární intervence (PCI) v rámci reperfuzní strategie léčby AIM zásadním způsobem přispěla k poklesu mortality KŠ [1].
Tab. 1. Etiologické příčiny kardiogenního šoku. 
V managementu KŠ hraje zásadní roli časový interval, ve kterém se podaří stabilizovat (makro)hemodynamiku umožňující adekvátní krevní průtok do cílových orgánů. Mikrocirkulace v cílovém orgánu je primárně alterována touto krevní hypoperfuzí. Následně se rozvíjí kaskáda sekundárních inzultů na podkladě ischemicko‑reperfuzního postižení a aktivace systémové zánětlivé odpovědi. Úprava hemodynamiky v této fázi již však nemusí obligátně vést ke zlepšení orgánové perfuze [2]. Snaha o stabilizaci hemodynamiky přiměřenou volumoterapií a inotropní a vazopresorickou podporou oběhu jsou iniciálními kroky v managementu KŠ společně s ovlivněním příčiny postižení myokardu (revaskularizace myokardu nebo rekanalizace plicního řečiště, odstranění srdeční tamponády, odstranění vyvolávajících příčin). Nevede‑li tento iniciální krok k promptnímu úspěchu, je nutno zvážit bez odkladu indikaci a zavedení mechanické podpory oběhu (INTERMACS profil 1) [3].
Mechanická podpora oběhu (mechanical circulatory support – MCS) není kauzální léčbou srdečního selhání. Umožní ale zlepšit nebo normalizovat hemodynamické parametry a perfuzi cílových orgánů. Dále pozitivně ovlivňuje poměr nabídky/ spotřeby O2 v myokardu cestou poklesu komorového plnění, zvýšení koronární perfuze, event. i poklesem afterloadu [4]. Tím je omezeno další postižení myokardu a získán čas k úpravě srdečních funkcí (bridge to recovery), k implantaci dlouhodobé podpory za hemodynamicky stabilních podmínek (bridge to bridge), k provedení srdeční transplantace (bridge to transplant/ candidancy) anebo k následnému zhodnocení stavu a plánu dalšího postupu (bridge to decision) [3,4]. Z praktického hlediska je u nemocných v KŠ zásadní včasné napojení podpory po zvážení jeho celkového stavu, kontraindikací MCS a také reálného benefitu podpory (tab. 2). Jakým směrem bude nemocný na podpoře přemostěn, určuje následně vývoj jeho celkového stavu, srdeční funkce a dostupnost srdečního transplantátu či možnost destinační terapie.
Tab. 2. Kontraindikace zavedení krátkodobé mechanické podpory oběhu. 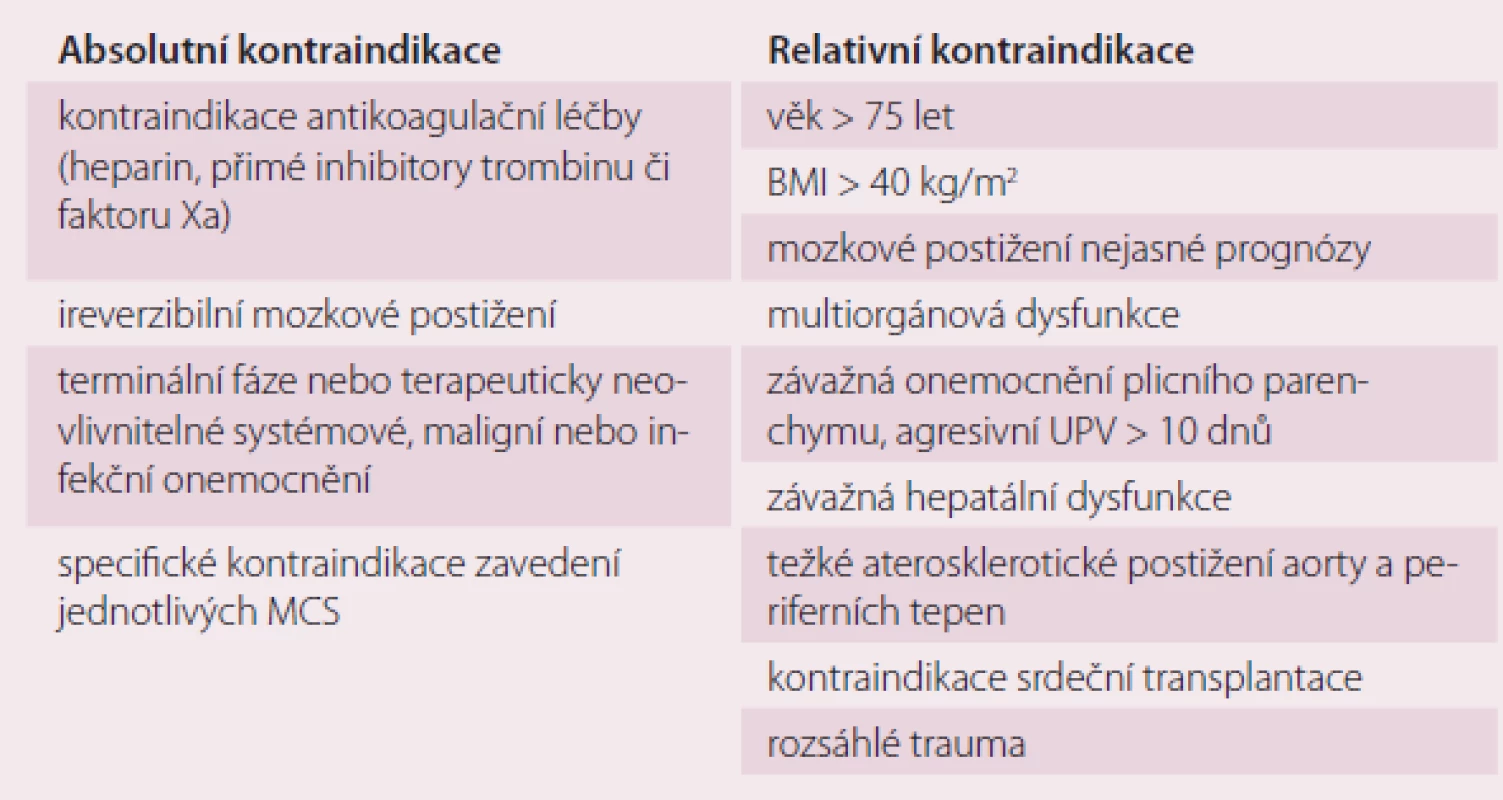
Mechanické podpory oběhu určené ke krátkodobému použití (< 30 dnů)
1. Intraaortální balonková kontrapulzace (IABK)
IABK byla klinicky poprvé použita v léčbě KŠ v první polovině 60. let. Principem podpory je rytmické nafukování (inflace) a vyfukování (deflace) tvarově preformovaného balonu zavedeného do descendentní aorty. Inflace balonu, která je časována bezprostředně po uzávěru aortální chlopně, vede ke zvýšení diastolického tlaku v ascendentní aortě a aortálním oblouku. Dochází ke zvýšení koronární a mozkové perfuze (diastolická augmentace). Deflace balonu těsně před otevřením aortální chlopně (fáze izovolumické kontrakce) vede ke snížení napětí stěny LK v důsledku náhlého poklesu afterloadu. Klesá enddiastolický tlak LK a spotřeba O2 (presystolická augmentace). Vliv IABK na zvýšení srdečního výdeje je omezený (≈ 0,5 – 1 l/ m), navíc je závislý na přítomnosti viabilního myokardu, především ischemicky alterovaného [5]. IABK pravděpodobně pozitivně ovlivňuje funkci i PK, a to cestou zvýšené koronární perfuze a snížení její práce v důsledku poklesu hodnot tlaku v plicnici [5]. Pro funkci IABK je zásadní správné umístění balonu a míra obturace diametru descendentní aorty. Velikost zvoleného balonu se odvíjí od výšky nemocného, která lépe koreluje s délkou sestupné aorty. Funkce IABK je synchronizována se srdečním cyklem na základě analýzy EKG záznamu anebo změny křivky arteriálního tlaku. Optický senzor společně s fibrooptickým vedením zajištují bezprostřední reakci na změnu tlakové křivky. Moderní kontrapulzační systémy jsou zaváděny perkutánně 7F instrumentáriem cestou femorální tepny [6]. V současnosti je na základě výsledků studie IABP ‑ SHOCK II zcela evidentní trend odklonu od použití IABK v managementu pacientů s AIM komplikovaným kardiogenním šokem v důsledku těžké systolické dysfunkce levé komory [7]. IABK je nicméně možné zvážit v terapii KŠ u mechanických komplikací AIM (defekt komorového septa, akutní mitrální regurgitace) jako přemostění k chirurgickému výkonu a u postkardiotomického srdečního selhání [5,6]. Implantovaná IABK vyžaduje antikoagulační léčbu heparin s cílovou hodnotou aPTT 40 – 60 s anebo terapeutickou dávku LMWH [8].
IABK v léčbě KŠ
Původní evidence pro použití IABK u KŠ komplikující AIM vyšla z výsledků observačních studií a dat z registrů zejména před érou katetrizační revaskularizace myokardu. Retrospektivní analýza ze studie GUSTO ‑ I poukázala lepší krátkodobé a střednědobé přežívaní nemocných, u kterých byla IABK použita včas ve srovnání s nemocnými, kde nebyla použita nebo byla aplikována opožděně [9]. Podobně i data z registru SHOCK ukázala benefit IABK zvláště v kombinaci s podáním trombolytické léčby (TL) [10]. Na druhou stranu první prospektivní randomizovaná studie TACTICS nepotvrdila ovlivnění šestiměsíční mortality KŠ u AIM zavedením IABK k podání TL [11]. První randomizovaná studie srovnávající PCI s PCI doplněnou o zavedení IABK u KŠ (IABP ‑ SHOCK) neprokázala rozdíl v závažnosti multiorgánového postižení či ovlivnění minutového srdečního výdeje. Byl pozorován pouze přechodný pokles hodnot mozkového natriuretického faktoru (BNP) u nemocných s delším zavedením IABK (> 3 dny) [12]. Následně ani velká prospektivní multicentrická randomizovaná studie (IABP ‑ SHOCK II) neprokázala signifikantní rozdíl v 30denní a jednoleté mortalitě ve skupině léčené IABK v porovnání s kontrolní skupinou (30denní mortalita 39,7 % vs 41,3 %; p = NS). Navíc zavedení IABK bylo spojeno s vyšším rizikem krvácení, končetinové ischemie, sepse nebo cévní mozkové příhody (CMP) [7]. Podobné výsledky popisuje i metaanalýza devíti observačních studií srovnávajících efekt IABK v léčbě KŠ u AIM. V pretrombolytické éře vedlo použití IABK k 29% redukci mortality a v éře TL k 18% redukci mortality. Nicméně v případě IABK u pacientů léčených direktní PCI bylo prokázáno zvýšení relativního rizika mortality o 6 % [13]. Časná revaskularizace myokardu vede ke snížení krátkodobé i dlouhodobé mortality nemocných v KŠ u AIM, ale limituje efekt IABK na zlepšení hemodynamiky nebo na zmenšení rozsahu infarktového ložiska. IABK nachází svůj význam při nedostupnosti PCI, technickém neúspěchu nebo jejím suboptimálním efektu, kdy zvýšení end‑diatolického tlaku může být zásadní pro udržení koronární perfuze [7]. Konfliktnost dat pro IABK dokumentuje i recentně publikovaná metaanalýza 16 observačních studií, která ukázala, že IABK snižuje mortalitu u nemocných v KŠ u AIM. Nemá však vliv na incidenci recidivy IM či ischemie. U nemocných s AIM bez známek KŠ nepřináší zavedení IABK žádný benefit, ba naopak zvyšuje riziko nezávažného i závažného krvácení [14]. V guidelines Evropské kardiologické společnosti (ESC) je zavedení IABK v rámci terapie KŠ komplikujícího AIM ve třídě IIB [15]. Účinnost IABK je limitována reziduální myokardiální funkcí, arytmiemi, uzávěrem nebo kritickou stenózou koronárních tepen. I když jsou dostupná data o její účinnosti pouze pro KŠ u AIM, je IABK široce používána i v léčbě KŠ jiné etiologie a využívána v kombinaci s jinými typy MCS [4,5].
Kontraindikací zavedení IABK jsou: aortální regurgitace, aortální disekce a periferní vaskulární postižení nedovolující zavedení IABK. Zavedení IABK je spojeno s 20 – 30% rizikem komplikací. K nejfrekventovanějším patří trombocytopatie, krvácení a infekce v místě zavedení, tromboembolické komplikace, končetinová ischemie, ruptura balonu či nesprávné zavedení. Vyšetření periferních tepen před zavedením IABK a použití 7F instrumentária snížilo riziko závažné končetinové ischemie na úroveň 1 – 2 % [5,6,8].
2. Perkutánně zaváděné mechanické podpory oběhu (pVAD)
Perkutánní mechanické srdeční podpory jsou určeny ke krátkodobé podpoře především funkce LK. Jsou zaváděny perkutánně Seldingerovou technikou nebo chirurgickou preparací periferních cév a cíleny pod kontrolou skiaskopie nebo transeozofageální echokardiografie (TEE). V současné době jsou k dispozici tři systémy: Impella™, TandemHeart™ a PulseCath™.
2.1. TandemHeart™ (Cardiac Assist Technologies Inc., USA)
Jedná se o parakoroporální podporu oběhu poháněnou centrifugální pumpou. Nasávací (inflow) 21F kanyla je zavedena perkutánně femorální žílou a umístěna po transseptální punkci do levé síně. Průtok je generován nízkorychlostní centrifugální pumpou s maximálním výdejem 4,5 l/ min. Krev je vracena retrográdním tokem přes výpustní (outflow) 17F kanylu zavedenou ve femorální tepně. Systém generuje průtok dostatečný pro perfuzi cílových orgánů. Drenáž levé síně snižuje plnicí tlaky LK, napětí její stěny a spotřebu O2 [3]. TandemHeart může být zaveden i jako pravostranná podpora s nasávací kanylou umístěnou do pravé síně a výpustí do kmene plicnice [16]. Během podpory je vyžadována účinná antikoagulace heparinem s cílovým aktivovaným srážecím časem (ACT) > 250 s.
TandemHeart™ v léčbě KŠ
Ve dvou randomizovaných studiích byl srovnáván TandemHeart™ s IABK u nemocných v KŠ u AIM. Bylo dosaženo signifikantního zlepšení parametrů hemodynamiky a poklesu hodnoty laktátu ve skupině TandemHeart™ [17,18]. V žádné studii však nebyl nalezen rozdíl v 30denní mortalitě (43 % vs 45 % a 53 % vs 64 %). Podpora byla průměrně použita 4 dny a vedla k vyšší četnosti krvácivých komplikací ve srovnání s IABK. Recentně publikovaná data v souboru 117 nemocných dokladují významné zlepšení ukazatelů hemodynamiky a orgánové perfuze při použití této podpory u KŠ se 40% 30denní mortalitou [19].
Přítomnost trombu v levé síni, defekt komorového septa, závažné aterosklerotické postižení periferních cév a těžké koagulopatie jsou kontraindikace zavedení této podpory. Četnost komplikací je závislá na délce vedení podpory, kdy narůstá riziko trombocytopenie, krvácení a infekce. Dále jsou popisovány komplikace v souvislosti s punkcí interatriálního septa a omezení perfuze končetiny v důsledku zavedené arteriální kanyly [16].
2.2. Impella™ (Abiomed Europe GmbH, Germany)
Podpora je založena na mikroaxiální pumpě, která je zavedena intrakorporálně přes aortální chlopeň do dutiny LK. Rotací turbíny je krev nasávána (inflow část kanyly) v LK a je vypuštěna (outflow část kanyly) do ascendentní aorty. K dispozici jsou dvě velikosti pumpy generující průtok do 2,5 l/ min, resp. do 4,5 l/ min (Impella 2,5™ a 5™). Použití systému vede ke zvýšení srdečního výdeje v závislosti na použitém typu pumpy a vzestupu středního arteriálního tlaku (MAP). Dekomprese LK snižuje napětí stěny LK, snižuje spotřebu O2 myokardem a vede k poklesu enddiastolického tlaku LK [3]. Dále dochází ke zlepšení koronární perfuze v důsledku poklesu rezistence koronárního řečiště [20]. Pozice inflow kanyly je kontrolována pomocí TEE, optimálně zasahuje 4 cm pod aortální chlopeň tak, aby nedošlo ke kontaktu se subvalvulárním aparátem mitrální chlopně či stěnou LK [4]. Impella 2,5™ umožnuje perkutánní zavedení cestou 10 – 12F instrumentária, pro zavedení Impella 5™ je nutná chirurgická preparace femorální nebo podklíčkové arterie (18F instrumentárium). Nemocný je antikoagulován s cílovým ACT > 250 s [4].
Impella™ v léčbě KŠ
Impella 2,5™ byla srovnávána s IABK v prospektivní randomizované studii zahrnující 26 nemocných v KŠ u AIM. Její použití vedlo ke zvýšení srdečního výdeje a MAP, nebylo však prokázáno ovlivnění mortality ve srovnání s IABK [21]. Výsledky Impella EUROSHOCK ‑ registru čítající 120 nemocných udávají 64,2% mortalitu nemocných v KŠ při použití Impella 2,5™ [22]. Výkonnější Impella 5™ má lepší predispozici pro léčbu nemocných v KŠ. Důvodem je vyšší výkon pumpy, vyšší dosažené hodnoty srdečního výdeje a MAP. Recentně publikované výsledky retrospektivního souboru 47 nemocných ukázaly 25% 30denní mortalitu KŠ u AIM při použití Impella 5™ [23]. Podobná recentní zkušenost s Impella 5™ u 46 nemocných s postkardiotomickým selháním demonstrovala 39,6% 30denní přežívaní nemocných čili srovnatelné výsledky s chirurgicky implantovanou podporou [24].
Za kontraindikace zavedení systému jsou považovány: trombus v LK, středně významná až závažná stenóza nebo insuficience aortální chlopně, mechanická náhrada aortální chlopně a významné aterosklerotické postižení periferních cév [3]. Evropská certifikace umožnuje sedmidenní použití podobně jako u jiných pVAD [23]. Mírná hemolýza představuje nejčastěji uváděnou komplikaci při použití menší Impella 2,5™. Z registru je referováno 7% riziko závažného krvácení a 4 % vaskulárních komplikací. Riziko periprocedurálního poranění srdce či srdeční tamponády je velmi malé [25].
2.3 PulseCath™ (PulseCath B.V., Nizozemsko)
Jde o jednoduchou pneumatickou parakorporální podporu, která je poháněna klasickou konzolí IABK. Vlastní zařízení se skládá z polyuretanového katetru a dvoupláštové komory. Synchronizovaná inflace/ deflace helia v této komoře tlačí krev v diastole přes jednocestnou chlopeň do ascendentní aorty. V systole je krev naopak nasávána do komory přístroje z hrotu katetru uloženého v LK [26]. Podpora je dostupná ve dvou verzích iVAC3L™ a iVAC2L™ s definovaným výdejem do 3, resp. 2 l/ min. Klinická zkušenost je omezená. iVAC3L™ byl použit k podpoře chirurgické revaskularizace bez mimotělního oběhu, u postkardiotomického selhání a k podpoře drenáže LK u ECMO [27 – 29]. IVAC3L™ (21 F) je zaváděn chirurgicky nebo cestou podklíčkové arterie, iVAC2L™ (17 F) lze zavést i punkčně cestou femorální tepny. Limitací je omezený průtok a významná dependence na úrovni dotížení [26].
3. Mimotělní membránová oxygenoterapie (ECMO)
Membránová oxygenoterapie se vyvinula z přístroje pro mimotělní oběh a stala se v poslední dekádě atraktivní volbou podpory pro nemocné s refrakterním selháním oběhu a/ nebo plic. Nespornou výhodou ECMO podpory je možnost perkutánního zavedení, krátký čas potřebný ke kompletizaci systému a jeho spuštění (< 15 min), univerzalita jedné konfigurace pro uni ‑ nebo biventrikulární selhání, plná oxygenační podpora při současném selhání plic a možnost transportu na podpoře. Tyto vlastnosti předurčují k úvaze o použití ECMO podpory u všech nemocných s refrakterním selháním oběhu [3,4]. Na druhou stranu je ECMO spojeno s nepřehlédnutelným rizikem komplikací vázaných na místo kanylace, rizikem krvácení v souvislosti s antikoagulací nutnou pro běh systému a dalšími komplikacemi. Četnost jednotlivých komplikací je závislá na délce podpory, která je tímto limitována (< 30 dnů) [30].
Pro oběhovou podporu (veno‑arteriální, V ‑ A ECMO) je vstupní venózní kanyla (19 – 25F) zavedena cestou femorální žíly, optimálně do místa odstupu dolní duté žíly. Žilní krev je do okruhu nasávaná centrifugální pumpou, oxygenována membránovým oxygenátorem a vracena zpět výstupní tepennou kanylou (15 – 21F), která je umístěna do periferní tepny (arteria femoralis/ subclavia). V případě, že byla provedena sternotomie, může být ECMO napojeno centrálně [31]. Vtoková kanyla je zavedena do pravé síně a výtoková přes interpozitum protézy do ascendentní aorty (centrální V ‑ A ECMO) [31]. Právě vývoj na poli centrifugálních pump, membránových oxygenátorů a biokompatibilní úpravy povrchů stojí za bezpečným použitím mimotělní podpory v řádu týdnů. Centrifugální pumpy s malým plnicím objemem (cca 30 ml) a bezložiskovým nebo jednoložiskovým uchycením rotoru (CentriMag™, GmbH, Švýcarsko Rotaflow™, Maquet GmbH, Německo) limitují riziko tromboembolických komplikací a hemolýzy [4]. Polymetylpentenové membrány oxygenátoru zaručují jeho spolehlivou funkci s malým rizikem tvorby trombů či plazmatického úniku [4]. Pro usnadnění transportu nemocných jsou jednotlivé komponenty integrovány společně s pohonnou řídicí jednotkou a s bed ‑ side monitorem (Cardiohelp™, Maquet GmbH, Německo).
ECMO pracuje principiálně jako biventrikulární podpora, navíc s přídatnou oxygenační kapacitou. Při plné podpoře (průtok > 4 l/min) je omezeno plnění srdečních oddílů o podíl krve nasávané do systému, což vede k poklesu plnicích tlaků komor a k poklesu spotřeby O2 [31]. Retrográdní tok okysličené krve zasahující do aortálního oblouku může mít podíl na zvýšení afterloadu a omezení ejekce LK. Dochází pak ke zvýšení plnicích tlaků a spotřeby O2 v LK. Důsledkem může být plicní kongesce, zvláště je‑li přítomna významná mitrální regurgitace nebo krevní stáza v těžce dysfunkční dilatované komoře. Řešením této situace může být snížení průtoku ECMO za cenu navýšení inotropní podpory, drenáž LK intervenčně (7F pigtail) nebo chirurgicky zavedeným katetrem (ventem). Dále je možné podpořit funkci LK zavedením IABK nebo jiné perkutánní podpory. Nejinvazivnějším přístupem je konverze na chirurgicky implantovanou podporu, která spolehlivě vydrénuje LK a uleví plicní kongesci [4,31,32].
Nejčastější komplikací zavedené ECMO podpory je krvácení (40 – 70 % nemocných) v místě zavedení kanyl či jiných perkutánních nebo chirurgických intervencí. Závažným problémem je intracerebrální krvácení (5 – 10 %) a krvácení do gastrointestinálního traktu [30,31,33]. Na krvácení se podílí nezbytná antikoagulace heparinem (cílové ACT 180 – 200 s, aPTT 50 – 60 s), trombocytární dysfunkce, konzumpce srážecích faktorů a aktivace fibrinolýzy v důsledku delšího kontaktu krve s ECMO komponenty [33]. Zavedení arteriální kanyly doprovází 10 – 20% riziko ischemie končetiny. Z toho důvodu zavádí řada pracovišť katetry pro distální perfuzi končetiny a bedlivě monitoruje stav prokrvení nejen mozku, ale i kanylované končetiny [34]. Tromboembolické komplikace zahrnují riziko embolizace do CNS nebo končetin a dále tvorbu trombů v komponentách ECMO okruhu. Použití moderních systémů a správný management ECMO nemocných téměř eliminuje rizika mechanického selhání komponent, rozpojení nebo zavzdušnění systému [33].
Z technického hlediska jsou kontraindikacemi ECMO aortální disekce, závažná aortální regurgitace, těžké aterosklerotické postižení aorty či periferních tepen a rovněž trombóza přístupových žil [31,33].
ECMO v léčbě KŠ
Data ECMO podpory u KŠ vycházejí z observačních, většinou retrospektivních studií, navíc etiologicky velmi heterogenních (AIM, postkardiotomické selhání, myokarditidy, kardiomyopatie atd.). Metaanalýza 84 publikovaných prací zahrnující 1 494 nemocných napojených na ECMO z důvodu KŠ (533 nemocných) nebo srdeční zástavy (675 nemocných) do roku 2005 udává 82,8% pravděpodobnost odpojení od podpory, 51,2% šanci na propuštění domů u KŠ, 71,5 % a 44,9 % pak u srdeční zástavy [35]. V recentní studii 73 nemocných bylo 76 % nemocných úspěšně odpojeno a 63 % propuštěno z nemocnice. ECMO bylo použito dominantně jako most k zotavení, u 4 % nemocných byla implantována dlouhodobá podpora [36]. Nemocní napojení na ECMO z důvodu postkardiotomického selhání mají vyšší krátkodobou (55 % vs 37 %; p < 0,01) i dlouhodobou mortalitu (67 % vs 37 %; p < 0,01) ve srovnání s KŠ u AIM [37]. Při použití ECMO podpory jako přemostění k implantaci dlouhodobé srdeční podpory je popisováno až 80% jednoroční a 24% pětileté přežití nemocných, kteří byli úspěšně odpojeni z ECMO [38,39]. Tyto výsledky podporují vhodnost ECMO podpory ke stabilizaci nemocných a jejich přemostění k dlouhodobé podpoře (bridge to bridge), zvláště ve světle neuspokojivých výsledků implantace dlouhodobé mechanické podpory u nemocných v kritickém stavu [40]. Velmi slibné výsledky má použití ECMO u masivní plicní embolie. U 16 nemocných napojených urgentně na podporu z důvodu refrakterního KŠ nebo srdeční zástavy byli všichni následně úspěšně odpojeni od ECMO a 83,3 % nemocných bylo propuštěno domů. 42 % nemocných bylo ponecháno pouze na antikoagulační léčbě heparinem, 42 % dostalo TL a 26 % nemocných podstoupilo katetrovou embolektomii [41]. V retrospektivní studii srovnávající výsledky ECMO (32 nemocných) s Impella 5™ (30 nemocných) nebyl nalezen rozdíl v 30denní mortalitě (44 % vs 38 %, NS) či propuštění z nemocnice (41 % vs 59 %, NS). Zavedení ECMO bylo spojeno s vyšším výskytem vaskulárních komplikací (18,8 % vs 3,4 %; p < 0,05) a spotřebou krevních derivátů. Obdobné výsledky byly publikovány i v retrospektivním srovnání ECMO a TandemHeart™ podporou [42,43].
4. Chirurgicky zaváděné mechanické podpory oběhu (sVAD)
U nemocných v KŠ je sVAD zaváděna ze střední sternotomie a s podporou mimotělního oběhu. V případě levokomorové podpory (LVAD) je vtoková kanyla umístěna do levé síně nebo srdečního hrotu a výtoková do vzestupné aorty, u podpory pravokomorové (RVAD) je krev odváděna kanylou z pravé síně a vracena cestou kmene plicnice, u podpory obou komor (BiVAD) jsou použity obě kanylační techniky [4,44,45]. Průtok krve do systémového nebo plicního řečiště je generován čerpadlem. Pneumaticky poháněná čerpadla vypuzují přesně definovaný objem (60 – 70 ml), čímž napodobují systolickou funkci srdeční komory a generují pulzní charakter toku krve. Vlastní čerpadlo je umístěno parakorporálně a je spojeno s rozměrnou konzolí pohonu Thoratec PVAD™ (Thoratec Corporation, USA), Abiomed BVS, AB 5000™ (Abiomed Inc, USA), Berlin Excor (Berlin Heart GmbH, Německo). Tyto systémy jsou určeny ke krátko ‑ a střednědobé podpoře (< 6 měsíců) [4,44]. Historicky byl pulzatilní tok spojován s lepší perfuzí cílových orgánů a poklesem vaskulární rezistence [46]. Z důvodu nižšího rizika tromboembolických příhod, hemolýzy, krvácení či infekce je dnes preferováno použití centrifugální pumpy [3,40]. Nejčastěji je využívána nízkoobjemová pumpa pracující na podkladě magnetické levitace Centrimag™ (Levitronix GmbH, Švýcarsko), která generuje nepulzatilní kontinuální tok. Pumpa je dedikována ke krátkodobé podpoře (< 30 dnů) a vyžaduje nízkou úroveň antikoagulance (aPTT > 40 s, ACT 160 – 180 s) [44,45]. V případě život ohrožujícího krvácení lze při dostatečném průtoku (> 4 l/ min) antikoagulanci přerušit až na dobu 48 hod [47]. Hlavní výhodou VAD je zaručení kompletní drenáže komory, vysokého systémového průtoku (≈ 10 l/ min), pokles myokardiální spotřeby O2 v důsledky poklesu napětí stěny a plnicích tlaků srdeční komory. Nevýhodou je nutnost provedení sternotomie, použití mimotělního oběhu a riziko závažného krvácení nebo infekčních komplikací [3,4,47].
sVAD v léčbě KŠ
Publikovaná data jednotlivých center a data z registrů udávají, že přibližně 50 % nemocných napojených v KŠ na pneumatickou podporu je úspěšně přemostěno k srdeční transplantaci, implantaci dlouhodobé podpory nebo k úpravě srdeční funkce. Propuštění z nemocnice se dožívá 30 – 35 % nemocných [48]. Recentní výsledky Centrimag™ VAD podpory implantované nemocným v KŠ ukazují až 80% pravděpodobnost odpojení od podpory. 68 % nemocných bylo propuštěno domů po následné implantaci dlouhodobé srdeční podpory nebo po transplantaci srdce. Dvě třetiny nemocných jsou primárně napojeny na biventrikulární podporu. Dále studie ukazují 40 – 45% tříměsíční přežívaní nemocných po odpojení z krátkodobé podpory [49,50]. Za úmrtím nemocných na podpoře stojí nejčastěji multiorgánová dysfunkce a sepse. Nejčastější komplikace VAD podpory představují krvácení (21 – 35 %), neurologické postižení (11 – 17 %), infekce (5 – 8 %) a hemolýza (3 %). Riziko selhání centrifugální pumpy Centrimag™ se ukazuje být minimální [47,49,50].
5. Volba typu MCS v léčbě kardiogenního šoku
Primární volba krátkodobé MCS (< 30 dnů) u nemocných v KŠ se odvíjí od formy srdečního selhání, dostupnosti a zkušenosti pracoviště s jednotlivými typy podpor [47,51]. Za absolutní kontraindikaci podpory je považována kontraindikace antikoagulační léčby, ireverzibilní postižení CNS, terminální nebo terapeuticky neovlivnitelná malignita, systémové onemocnění či infekce. Pokročilý věk, morbidní obezita, multiorgánové selhání a nesplnění kritérií srdeční transplantace jsou relativními kontraindikacemi, do kterých se promítají regule jednotlivých pracovišť a možnosti destinační terapie (tab. 2) [3,4,31,44].
IABK je nejčastěji zaváděnou podporou z důvodu její dostupnosti, jednoduchosti zavedení, spolehlivosti a dlouhodobé zkušenosti s jejím užíváním. Je možnou volbou pro nemocné s částečně zachovanou komorovou funkcí při relativně stabilní hemodynamice, např. při ruptuře komorové septa k oddálení operační korekce. Dále je možný transport nemocného s běžící IABK mezi nemocnicemi a IABK lze kombinovat s jinými typy podpor. Dostupnost a zkušenost s ECMO v kardiovaskulárních centrech vede k jejímu širšímu primárnímu použití. Důvodem je možnost bed ‑ side perkutánního zavedení, plné biventrikulární podpory, podpora funkce plic a také možnost transportu na podpoře. Společně s IABK je nezanedbatelná i menší finanční nákladnost z pohledu spotřebního materiálu oproti jiným typům podpor. Z perkutánních podpor je slibné použití Impella 5™ pro vedení krátkodobé mechanické podpory pacientů s akutním levostranným selháním, a to z důvodu výkonu pumpy a nepříliš komplikované implantace. Společně s implantací TandemHeart™ vyžaduje katetrizační zázemí, u TandemHeart™ je navíc nutná zkušenost s transseptální punkcí. U nemocných, kde je vyžadována kompletní komorová drenáž (těžká mitrální regurgitace, refrakterní plicní kongesce) a plná komorová podpora, je volbou krátkodobá chirurgicky implantovaná podpora nebo časná konverze na ni (obr. 1).
Obr. 1. Algoritmus volby typu krátkodobé mechanické podpory oběhu. 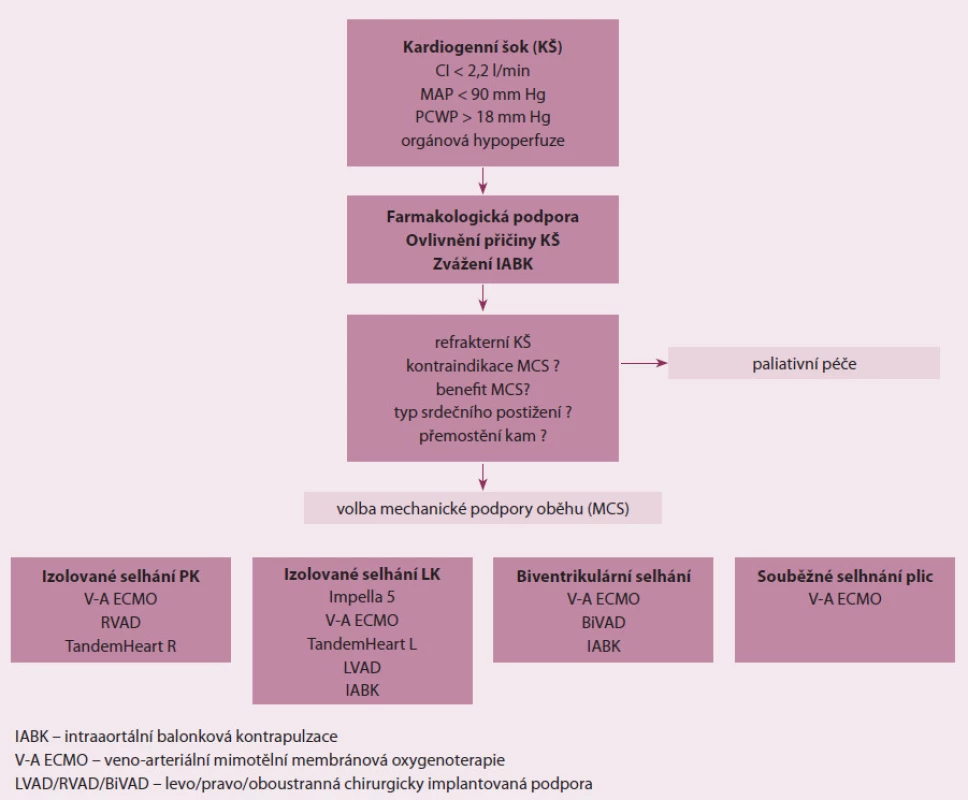
Závěr
Kardiovaskulární centra dnes rutině disponují IABK, ECMO či některou z forem perkutánní a chirurgicky implantované podpory. Indikace a zavedení je vedeno v konsenzu kardiologů a kardiochirurgů. Program implantace dlouhodobých podpor je vázán na transplantační centra. Výsledky velkých center naznačují, že rutinní implementace MCS by mohlo zlepšit výsledky nemocných s KŠ a v blízké budoucnosti posunout hospitalizační mortalitu pod úroveň 40 % [23,36,49,50].
Práce byla podpořena programem instituciální podpory MZ ČR č.1 RVO-FNOL2013.
Doručeno do redakce 31. 3. 2014
Přijato do redakce 7. 4. 2014
MUDr. Martin Šimek
www.fnol.cz
martin.simek@fnol.cz
Zdroje
1. Babaev A, Frederick PD, Pasta DJ et al. Trends in management and outcomes of patients with acute myocardial infarction complicated by cardiogenic shock. JAMA 2005; 294 : 448 – 454.
2. Hochman JS. Cardiogenic shock complicating acute myocardial infarction: Expanding the paradigm. Circulation 2003; 107 : 2998 – 3002.
3. Esper SA, Subramaniam K. Heart failure and mechanical circulatory support. Best Pract Res Clin Anaesthesiol 2012; 26 : 91 – 104. doi: 10.1016/ j.bpa.2012.03.003.
4. Subramaniam K, Boisen M, Shah PR et al. Mechanical circulatory support for cardiogenic shock. Best Pract Res Clin Anaesthesiol 2012; 26 : 131 – 146. doi: 10.1016/ j.bpa.2012.05.001.
5. Kapelios CJ, Terrovitis JV, Siskas P et al. Counterpulsation: A concept with a remarkable past, an established present and a challenging future. Int J Cardiol 2014; 172 : 318 – 325. doi: 10.1016/ j.ijcard.2014.01.098.
6. Kopřiva K, Ošťádal P, Mates M et al. Intraaortální balonková kontrapulzace v klinické kardiologii. Interv Akut Kardiol 2013; 12 : 130 – 134.
7. Thiele H, Zeymer U, Neumann FJ et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367 : 1287 – 1296. doi: 10.1056/ NEJMoa1208410.
8. Manďák J. Intraaortální balonková kotrapulzace. Praha: Grada Publishing 2006.
9. Anderson RD, Ohman EM, Holmes DR Jr et al. Use of intraaortic balloon counterpulsation in patients presenting with cardiogenic shock: observations from the GUSTO ‑ I Study. Global utilization of streptokinase and TPA for occluded coronary arteries. J Am Coll Cardiol 1997; 30 : 708 – 715.
10. Sanborn TA, Sleeper LA, Bates ER et al. Impact of thrombolysis, intra ‑ aortic balloon pump counterpulsation, and their combination in cardiogenic shock complicating acute myocardial infarction: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK? J Am Coll Cardiol 2000; 36 (3 Suppl A): 1123 – 1129.
11. Ohman EM, Nanas J, Stomel RJ et al. Thrombolysis and counterpulsation to improve survival inmyocardial infarction complicated by hypotension and suspected cardiogenic shock or heart failure: results of the TACTICS Trial. J Thromb Thrombolysis 2005; 19 : 33 – 39.
12. Prondzinsky R, Lemm H, Swyter M et al. Intra ‑ aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock: the prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome. Crit Care Med 2010; 38 : 152 – 160. doi: 10.1097/ CCM.0b013e3181b78671.
13. Sjauw KD, Engström AE, Vis MM et al. A systematic review and meta‑analysis of intra ‑ aortic balloon pump therapy in ST ‑ elevation myocardial infarction: should we change the guidelines? Eur Heart J 2009; 30 : 459 – 468. doi: 10.1093/ eurheartj/ ehn602.
14. Bahekar A, Singh M, Singh S et al. Cardiovascular outcomes using intra ‑ aortic balloon pump in high‑risk acute myocardial infarction with or without cardiogenic shock: a meta‑analysis. J Cardiovasc Pharmacol Ther 2012; 17 : 44 – 56. doi: 10.1177/ 1074248410395019.
15. Steg PG, James SK, Atar D et al. ESC Guidelines for the management of acute myocardial infarction in patients presentingwith ST‑segment elevation. Task Force on the managementof ST‑segment elevation acute myocardial infarctionof the European Society of Cardiology (ESC). Eur Heart J 2012; 33 : 2569 – 2619. doi: 10.1093/ eurheartj/ ehs215.
16. Neužil P, Kmoníček P, Reddy V et al. Perkutánně zaváděná mechanická podpora levé srdeční komory (pVAD) u nemocných s kardiogenním šokem – technika implantace. Interv Akut Kardiol 2006; 3 : 131 – 134.
17. Thiele H, Sick P, Boudriot E et al. Randomized comparison of intra ‑ aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005; 26 : 1276 – 1283.
18. Burkhoff D, Cohen H, Brunckhorst C et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the tandem heart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J 2006; 152 : 469.e1 – e8.
19. Kar B, Gregoric ID, Basra SS et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. J Am Coll Cardiol 2011; 57 : 688 – 696. doi: 10.1016/ j.jacc.2010.08.613.
20. Remmelink M, Sjauw KD, Henriques JPS et al. Effects of left ventricular unloading by Impella recover LP2.5 on coronary hemodynamics. Catheter Cardiovasc Interv 2007; 70 : 532 – 537.
21. Seyfarth M, Sibbing D, Bauer I et al. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra ‑ aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol 2008; 52 : 1584 – 1588. doi: 10.1016/ j.jacc.2008.05.065.
22. Lauten A1, Engström AE, Jung C et al. Percutaneous left ‑ ventricular support with the Impella ‑ 2.5 - assist device in acute cardiogenic shock: results of the Impella ‑ EUROSHOCK ‑ registry. Circ Heart Fail 2013; 6 : 23 – 30. doi: 10.1161/ CIRCHEARTFAILURE. 112.967224.
23. Lemaire A, Anderson MB, Lee LY et al. The Impella device for acute mechanical circulatory support in patients in cardiogenic shock. Ann Thorac Surg 2014; 97 : 133 – 138. doi: 10.1016/ j.athoracsur.2013.07.053.
24. Engström AE, Granfeldt H, Seybold ‑ Epting W et al. Mechanical circulatory support with the Impella 5.0 device for postcardiotomy cardiogenic shock: a three ‑ center experience. Minerva Cardioangiol. 2013; 61 : 539 – 546.
25. Cheng JM, den Uil CA, Hoeks SE et al. Percutaneous left ventricular assist devices vs. intra ‑ aortic balloon pump counterpulsation for treatment of cardiogenic shock: a meta‑analysis of controlled trials. Eur Heart J 2009; 30 : 2102 – 2108. doi: 10.1093/ eurheartj/ ehp292.
26. Niclauss L, Segesser LK. PulseCath iVAC 3LTM hemodynamic performance for simple assisted flow. Interact Cardiovasc Thorac Surg 2011; 12 : 912 – 913. doi: 10.1510/ icvts.2010.264051.
27. Amico A, Brigiani MS, Vallabini A et al. PulseCath, a new short‑term ventricular assist device: our experience in off ‑ pump coronary artery bypass graft surgery. J Cardiovasc Med 2008; 9 : 423 – 426. doi: 10.2459/ JCM.0b013e3282eee851.
28. Arrigoni SC, Kuijpers M, Mecozzi G et al. PulseCath(R) as a right ventricular assist device. Interact Cardiovasc Thorac Surg 2011; 12 : 891 – 894. doi: 10.1510/ icvts.2010.257576.
29. Anastasiadis K, Chalvatzoulis O, Antonitsis P et al. Left ventricular decompression during peripheral extracorporeal membrane oxygenation support with the use of the novel iVAC pulsatile paracorporeal assist device. Ann Thorac Surg 2011; 92 : 2257 – 2259. doi: 10.1016/ j.athoracsur.2011.05.063.
30. Bělohlávek J, Rohn V, Kunstýř J et al. Profil pacientů léčených extrakorporální membránovou oxygenací (ECMO). Interv Akut Kardiol 2010; 9 : 121 – 128.
31. Ošťádal P, Bělohlávek J. ECMO – Extrakorporální membránová oxygenace. Praha: Maxdorf 2013.
32. Di Bella I, Da Col U, Ramoni E et al. Peripheral extracorporeal membrane oxygenation: a useful option to allow recovery in acute cardiogenic shock. J Cardiovasc Med 2011; 12 : 681 – 685. doi: 10.2459/ JCM.0b013e32833dad56.
33. Van Meurs K, Lally KP, Peek G et al. ECMO Extracorporeal cardiopulmonary support in critical care. 3rd ed. Ann Arbor, USA: ELSO 2005, 203 – 215.
34. Aziz F, Brehm CE, El ‑ Banyosy A et al. Arterial Complications in Patients Undergoing Extracorporeal Membrane Oxygenation via Femoral Cannulation. Ann Vasc Surg 2014; 28 : 178 – 183. doi: 10.1016/ j.avsg.2013.03.011.
35. Nichol G, Karmy ‑ Jones R, Salerno C et al. Systematic review of percutaneous cardiopulmonary bypass for cardiac arrest or cardiogenic shock states. Resuscitation. 2006; 70 : 381 – 394.
36. Loforte A, Montalto A, Ranocchi F et al. Peripheral extracorporeal membrane oxygenation system as salvage treatment ofpatients with refractory cardiogenic shock: preliminary outcome evaluation. Artif Organs 2012; 36: E53 – E61. doi: 10.1111/ j.1525 – 1594.2011.01423.x.
37. Liden H, Wiklund L, Haraldsson A et al. Temporary circulatory support with extra corporeal membrane oxygenation in adults with refractory cardiogenic shock. Scand Cardiovasc J 2009; 43 : 226 – 232. doi: 10.1080/ 14017430802596420.
38. Hoefer D, Ruttmann E, Poelzl G et al. Outcome evaluation of the bridge ‑ to ‑ bridge concept in patients with cardiogenicshock. Ann Thorac Surg 2006; 82 : 28 – 33.
39. Smedira NG, Moazami N, Golding CM et al. Clinical experience with 202 adults receiving extracorporeal membrane oxygenation for cardiac failure: survival at five years. J Thorac Cardiovasc Surg 2001; 122 : 92 – 102.
40. Kirklin JK, Naftel DC, Kormos RL et al. The fourth INTERMACS annual report: 4000 implants and counting. J Heart Lung Transplant 2012; 31 : 117 – 126. doi: 10.1016/ j.healun.2011.12.001.
41. Hashiba K, Okuda J, Maejima N et al. Percutaneous cardiopulmonary support in pulmonary embolism with cardiac arrest. Resuscitation 2012; 83 : 183 – 187. doi: 10.1016/ j.resuscitation.2011.10.019.
42. Lamarche Y, Cheung A, Ignaszewski A et al. Comparative outcomes in cardiogenic shock patients managed with Impella microaxial pump or extracorporeal life support. J Thorac Cardiovasc Surg 2011; 142 : 60 – 65. doi: 10.1016/ j.jtcvs.2010.07.075.
43. Chamogeorgakis T, Rafael A, Shafii AE et al.Which is better: a miniaturized percutaneous ventricular assist device or extracorporeal membrane oxygenation for patients with cardiogenic shock? ASAIO J 2013; 59 : 607 – 611. doi: 10.1097/ MAT.0b013e3182a8baf7.
44. Netuka I, Malý J, Szárszoi O. Mechanické srdeční podpory v terapii terminálního srdečního selhání. Cor et Vasa 2008; 50 : 207 – 214.
45. Horváth V, Nemec P, Ondrášek J et al. Kratkodobá mechanická srdeční podpora centrifugalní pumpou Levitronix Centrimag. Cor et Vasa 2011; 53 : 144 – 147.
46. Minami K, el ‑ Banayosy A, Posival H et al. Improvement of survival in patients with cardiogenic shock by using non‑pulsatile and pulsatile ventricular assist device. Int J Artif Organs 1992; 15 : 715 – 721.
47. Ziemba EA, John R. Mechanical circulatory support for bridge to decision: which device and when to decide. J Card Surg 2010; 25 : 425 – 433. doi: 10.1111/ j.1540-8191.2010.01038.x.
48. Entwistle JW 3rd, Bolno PB, Holmes E et al. Improved survival with ventricular assist device support in cardiogenic shock aftermyocardial infarction. Heart Surg Forum 2003; 6 : 316 – 319.
49. John R, Long JW, Massey HT et al. Outcomes of a multicenter trial of the Levitronix CentriMag ventricular assist system for short‑term circulatory support. J Thorac Cardiovasc Surg 2011; 141 : 932 – 939. doi: 10.1016/ j.jtcvs.2010.03.046.
50. Loforte A, Montalto A, Ranocchi F et al. Levitronix CentriMag third ‑ generation magnetically levitated continuous flow pump as bridge to solution. ASAIO J 2011; 57 : 247 – 253. doi: 10.1097/ MAT.0b013e31821f2116.
51. Sayer GT, Baker JN, Parks KA. Heart rescue: the role of mechanical circulatory support in the management of severe refractory cardiogenic shock. Curr Opin Crit Care 2012; 18 : 409 – 416. doi: 10.1097/ MCC.0b013e328357f1e6.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Možnosti sledování stavu oběhu a vliv dálkové monitorace na srdeční selhání
- Problematika nonrespondérů resynchronizační léčby
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Observační studie pacientů léčených lerkanidipinem v podmínkách běžné klinické praxe v České republice
- Stabilita a jednoduchost ovládly Washington
- Ischemická choroba srdeční u nemocných s diabetes mellitus 1. typu
- Výsledky velkých kardiologicko‑diabetologických studií posledních let (EXAMINE, ORIGIN, SAVOR)
- Nové možnosti farmakoterapie diabetu
- Principy terapie bazálním inzulinem u diabetu 2. typu
- Selfmonitoring jako prevence komplikací diabetu
- Centrálně působící antihypertenziva – rilmenidin
- Into the Heart of Stroke
- Výroční sjezd ČKS v Brně
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Současnost a budoucnost léčby srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
- Současné možnosti optimalizace nastavení biventrikulární stimulace k maximálnímu využití resynchronizační léčby
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Centrálně působící antihypertenziva – rilmenidin
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



