-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Katetrizační ablace komorových tachykardií
Catheter ablation of ventricular tachycardia
Ventricular tachycardias comprise a wide spectrum of arrhythmias originating in ventricular myocardium and/or in ventricular conduction system tissue. Prognostically, it is useful to differentiate benign idiopathic forms and arrhythmias associated with structural heart disease that may be life-threatening. The most frequent arrhythmia in the former group is focal ventricular tachycardia from the right (or less frequently left) ventricular outflow tract and/or reentrant tachycardia originating in the conduction system of the left ventricle. In both cases, catheter ablation has become the method of choice and allows successful elimination of arrhythmia in high percentage of cases (more than 90%). Implantable cardioverters-defibrillators are more and more frequently used in management of ventricular tachycardias associated with structural heart disease. However, catheter ablation can be used in the case of more frequent arrhythmia episodes in order to modify arrhythmogenic substrate and prevent arrhythmia recurrences. Catheter ablation is preferred in incessant ventricular tachycardias and/or in management of arrhythmia storms. Modern electrophysiologic mapping systems enable exact characterization of the arrhythmogenic substrate and precise identification of target for radiofrequency ablation.
Keywords:
catheter ablation – ventricular tachycardia – ischemic heart disease – cardiomyopathy
Autoři: J. Kautzner
Působiště autorů: Klinika kardiologie IKEM, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2006, 8(Supplementum): 37-42
Souhrn
Komorové tachykardie tvoří široké spektrum arytmií, které vznikají v komorové svalovině nebo v tkáni převodního systému komor. Z prognostického hlediska je vhodné rozdělení na benigní idiopatické formy a na arytmie provázející organické onemocnění srdce, které mohou ohrožovat na životě. Ve skupině idiopatických komorových tachykardií jde nejčastěji o fokální tachykardii z výtokového traktu pravé, vzácněji levé komory, nebo o reentry tachykardii pocházející z převodního systému levé komory. V obou případech je katetrizační ablace metodou volby a dovoluje úspěšné odstranění arytmie ve vysokém procentu případů (nad 90 %). U komorových tachykardií provázejících organické onemocnění srdce se stále častěji využívá profylaktické implantace ICD. V případech četnějších recidiv arytmie však lze pomocí katetrizační ablace modifikovat arytmogenní substrát a zabránit opakování arytmie. Katetrizační ablace je preferována v případě incesantních forem nebo k řešení arytmické bouře. Použití moderních mapovacích systémů umožňuje přesnou charakteristiku individuálních anatomických poměrů a identifikaci míst k provedení katetrizační ablace.
Klíčová slova:
katetrizační ablace – komorová tachykardie – ischemická choroba srdeční – kardiomyopatieObecný úvod
Komorové tachykardie (KT) představují široké spektrum arytmií, které vznikají buď v komorové svalovině nebo v tkáni převodního systému distálně od Hisova svazku. Přestože se v léčbě KT stále více uplatňují implantabilní kardiovertery-defibrilátory, rozšiřují se i možnosti katetrizačních ablací. U některých typů KT nebo v některých situacích je katetrizační ablace metodou první volby. Jindy je tento výkon prováděn k zvládnutí četných epizod arytmie u nemocných již předem zajištěných implantabilním přístrojem. Následující text přibližuje stručnou formou problematiku katetrizačních ablací u KT.
Terminologický úvod
KT lze třídit podle mnoha kritérií. Jedním z nich je EKG-obraz. Podle něj rozdělujeme KT na monomorfní nebo polymorfní. Dalším kritériem, které má prognostický dopad, je přítomnost, nebo chybění strukturního onemocnění srdce. Tzv. idiopatické formy KT monomorfní KT jsou považovány za prognosticky benigní a léčba by měla být indikována pouze v přítomnosti potíží nebo vzniku dysfunkce komor. Výjimkou jsou některé formy idiopatické polymorfní KT nebo KT v přítomnosti tzv. syndromu vrozeného prodloužení intervalu QT. Opačná situace je u KT v přítomnosti strukturního postižení srdce. Strukturní onemocnění srdce (zejména dysfunkce levé komory) přináší svému nositeli zvýšené riziko úmrtí na náhlou srdeční smrt. Z hlediska mechanizmu vzniku a strategie katetrizační ablace rozdělujeme KT na fokální a nefokální formy. V prvním případě může jít o manifestaci ohraničeného ložiska zvýšené automacie nebo spouštěné aktivity, vzácně o okruh mikro-reentry. Strategie ablace je principiálně jednoduchá a spočívá v hledání nejčasnější komorové aktivity při arytmii nebo ektomii. V druhém případě krouží vzruch po větším nebo menším okruhu, obvykle v oblasti jizevnaté tkáně (tj. morfologického substrátu pro KT). Tehdy je mechanizmem reentry a při katetrizační ablaci je nutno identifikovat charakter okruhu a jeho kritické komponenty.
Idiopatické komorové tachykardie
Idiopatická KT je označením pro KT u nemocných bez strukturního onemocnění srdce, které tvoří zhruba 10 % všech KT v populaci [2]. Vyskytují se obvykle u mladších nemocných a z prognostického hlediska jsou považovány za benigní. Vzhledem k fokální povaze je nejužitečnější klasifikací dělení podle EKG-morfologie, která odpovídá místu vzniku.
KT z pravé komory
Jsou častější (70 % idiopatických KT) a postihují více ženy. Mechanizmem vzniku je katecholaminy navozená spouštěná aktivita (zprostředkovaná c-AMP) nebo abnormální automacie [3]. Díky tomu je arytmie často spouštěna fyzickou aktivitou a manifestuje se buď jako repetitivní, nebo jako paroxyzmální forma. I u repetitivní formy lze často po námaze zaznamenat běh setrvalé KT. Subjektivní příznaky bývají výraznější u formy paroxyzmální. EKG-obraz svědčí pro místo vzniku KT ve výtokovém traktu pravé komory: morfologie blokády levého raménka Tawarova s vertikálním sklonem osy ve frontální rovině (obr. 1).
Obr. 1. Charakteristická morfologie ektopického komplexu QRS u pacientky s běhy repetitivní idiopatické KT z výtokového traktu pravé komory (prostřední část panelu). Za povšimnutí stojí morfologie komplexů QRS tvaru blokády levého raménka se sklonem osy doprava a přechodovou zónou v hrudních svodech ve V<sub>3</sub>. Pravá část panelu dokumentuje výsledek pacemappingu v místě nejčasnější aktivace (tj. poměrně přesné napodobení morfologie komplexů QRS jako při spontánní ektopii). V levé části panelu je 3rozměrná mapa pravé komory sestrojená pomocí systému NAVx (pravá šikmá projekce). Místa úspěšné ablace jsou vyznačena ve výtokovém traktu (RVOT) v podobě 3 hnědých bodů. 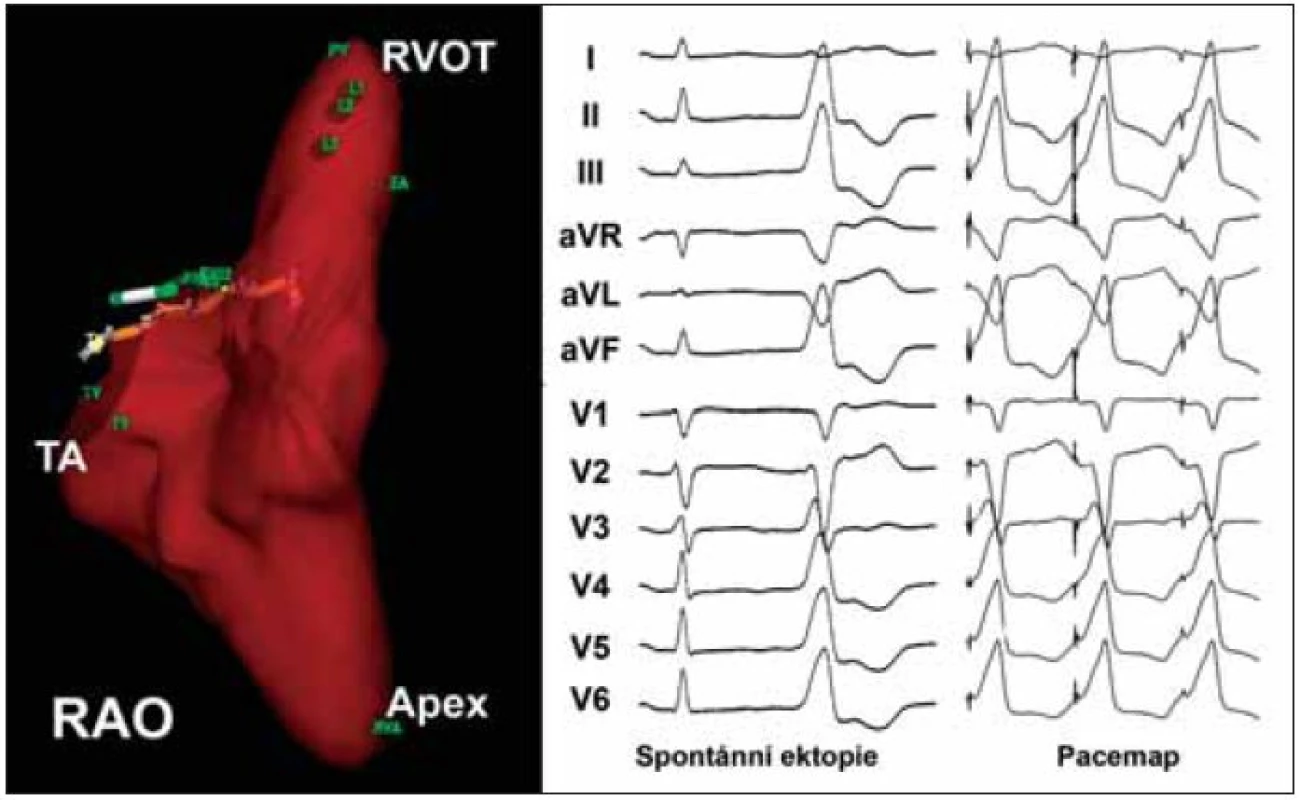
Katetrizační léčba je indikována u symptomatických případů. Její úspěšnost se pohybuje okolo 80-90 % při minimálním riziku komplikací. Podstatou je mapování nejčastější aktivace při izolované komorové ektopii nebo běžící KT (tzv. mapování aktivační sekvence). Stimulace z hrotu katétru v místě nejčasnější aktivace reprodukuje morfologii KT na EKG (tzv. pacemapping). K označení takového místa je s výhodou použít některého z 3rozměrných mapovacích systémů (CARTO nebo NAVx; obr. 1). Katetrizačně lze arytmogenní fokus odstranit obtížněji v případech, v nichž je lokalizován subepikardiálně nebo ve svalovině horní části septa mezi plicnicí a aortou. Na tuto eventualitu lze myslet tehdy, když je v EKG-svodech V1-2 patrný prominující a poměrně široký kmit r a přechodní zóna je posunuta proti směru ručiček (tj. ve svodu V3 bývá obraz Rs) [4] (obr. 2). V takových případech lze někdy uspět ablací z kapsičky aortální nebo pulmonální chlopně [4-6], jindy nelze katetrizační ablaci provést vůbec (při lokalizaci fokusu blízko kmene levé koronární tepny). KT může vzácně vznikat i v jiné oblasti pravé komory. Tehdy je nutno pátrat po přítomnosti počínající arytmogenní dysplazie pravé komory (podobně při výskytu 2 různých morfologií arytmie).
Obr. 2. Ukázka repetitivních běhů idiopatické KT. V EKG-obrazu je patrna přechodní zóna ve V<sub>2</sub> s úplnou pozitivitou QRS ve svodu V<sub>3</sub>. Arytmie pocházela z fokusu přístupného z kapsičky pulmonální chlopně. 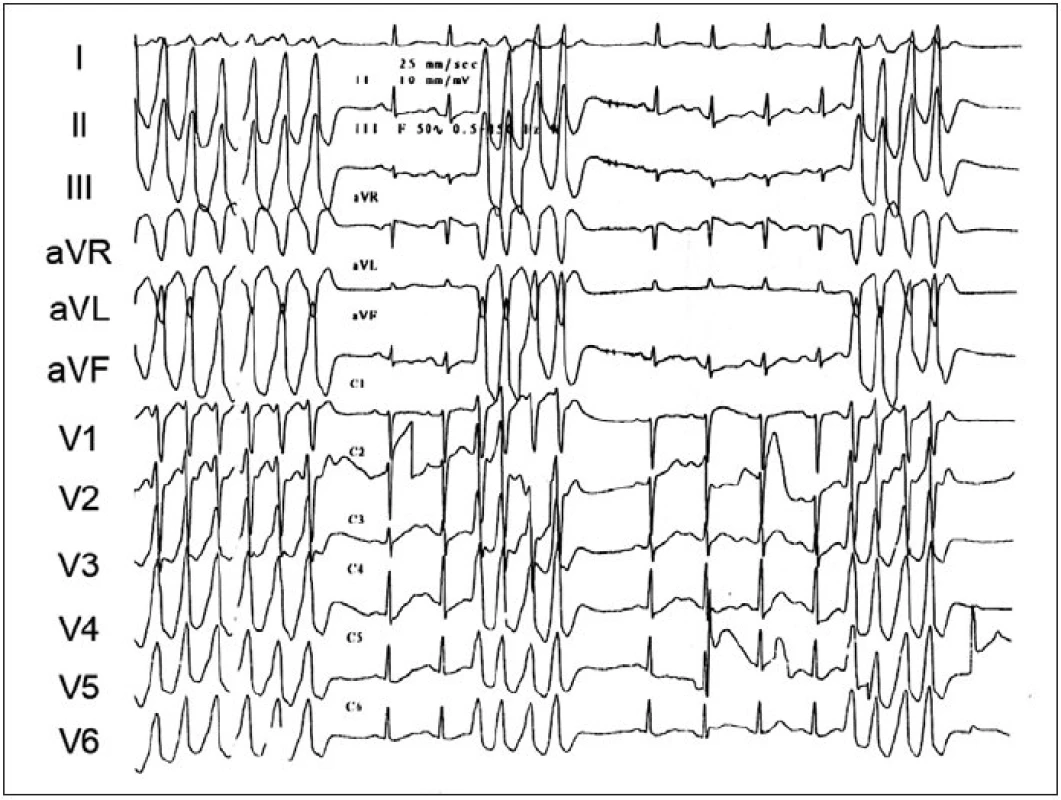
KT z levé komory
Mohou se vyskytovat ve 3 klinických formách:
- (a) tzv. verapamil-senzitivní tachykardie charakteru intrafascikulární reentry
- (b) tzv. adenozin-senzitivní tachykardie na podkladě spouštěné aktivity zprostředkované c-AMP, vznikající v mezikomorovém septu nebo výtokovém traktu
- (c) tzv. propranolol-senzitivní, mající původ ve zvýšené automacii KT podporované katecholaminy [7].
První (a) z nich se vyskytuje obvykle v záchvatovité formě, přičemž muži jsou postiženi častěji. Vzhledem k místu vzniku v specializované tkáni převodního systému bývá nazývána též fascikulární reentry tachykardií. Díky původu reentry lze arytmii reprodukovatelně indukovat programovanou elektrickou stimulací komor. V EKG-obrazu je morfologie blokády pravého raménka Tawarova se sklonem osy doleva a relativně štíhlé komplexy QRS, což svědčí pro vznik a šíření v převodním systému (obr. 3). Sklon osy doleva svědčí pro místo vzniku v tkáni zadního svazečku v dolní části mezikomorového septa na rozhraní mezi apikální a střední třetinou komory. Při sklonu osy doprava pochází arytmie z oblasti předního svazečku anteroapikálně. Tuto arytmii lze odstranit s vysokou úspěšností pomocí katetrizační ablace. Její strategie může být různá. Obvykle je hledán nejčasnější potenciál z převodního systému (Purkyňův potenciál) při KT. Stále častěji je využíváno moderních mapovacích systémů, které dovolují zmapovat a označit průběh celého převodního systému (tj. v tomto případě substrátu pro reentry) a provést katetrizační ablaci v kritickém místě okruhu reentry.
Obr. 3. Typická morfologie komplexů QRS při idiopatické fascikulární formě KT z oblasti zadního svazečku levé komory. Místo malého okruhu reentry je uloženo v střední části septa a tomu odpovídá obraz blokády pravého raménka Tawarova s relativně štíhlými komplexy QRS a sklonem osy doleva. 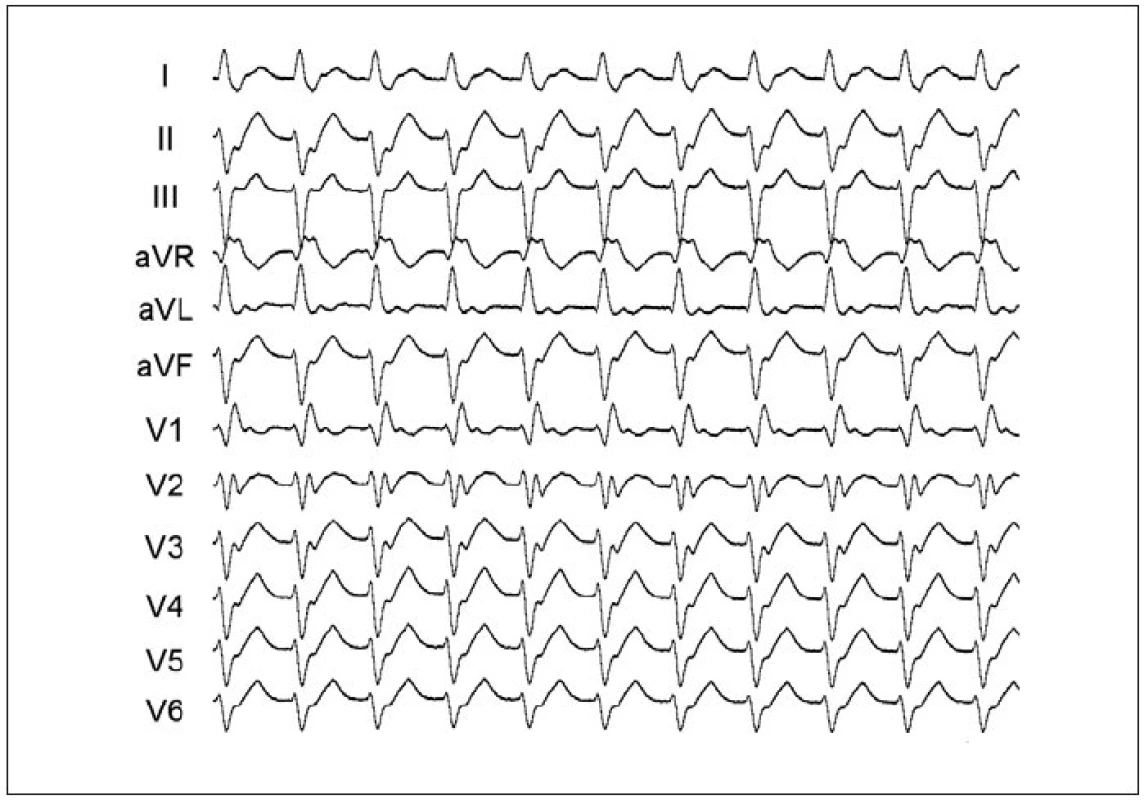
Adenozin-senzitivní forma (b) se vyskytuje nejčastěji v podobě repetitivních běhů KT, které se vyskytují spíše v souvislosti s fyzickou zátěží a nelze je reprodukovatelně nastartovat programovanou stimulací komor. Vychází obvykle ze svaloviny mezikomorového septa nebo z oblasti výtokového traktu. V takovém případě má podobný charakter jako KT pocházející z výtokového traktu pravé komory, pouze v EKG-obrazu bývá přechodní zóna před svodem V3 (tj. převažující R nad S). Také léčba a její principy jsou shodné. Kromě této formy idiopatické KT byla popsána i jiná charakteristická forma idiopatické KT z výtokového traktu levé komory, při níž je místo vzniku lokalizováno v jeho zadní části (poblíže levého fibrózního trigona). Typickým rysem této formy je EKG-obraz blokády pravého raménka se sklonem osy doprava a širokými kmity R od V1-V6, který odráží lokalizaci zdroje arytmie v zadní části výtokového traktu v oblasti aortomitrální kontinuity. Tento fokus lze bezpečně odstranit katetrizační ablací [8].
Třetí (c), nejméně častou, klinickou formou je KT pocházející z jiných míst v levé komoře a nereagující na podání verapamilu ani adenozinu. V tomto případě se nejspíše jedná o projev zvýšené nebo abnormální automacie. Arytmii nelze reprodukovat ani pomocí programované stimulace ani po podání katecholaminů. Vyžaduje obvykle mapování a katetrizační ablaci při spontánně vzniklé epizodě.
Komorové tachykardie při strukturním postižení srdce
Tyto KT zahrnují široké spektrum arytmií s různým arytmogenním substrátem. V naprosté většině případů jde o arytmie původu reentry, při nichž vzruch krouží po různě velkém okruhu. Může jít o arytmie monomorfní, nebo polymorfní. V tomto přehledu bude diskutována pouze problematika monomorfních KT.
KT ve spojení s ischemickou chorobou srdeční
Ischemická choroba srdeční je nejčastější příčinou setrvalé monomorfní KT u nemocných s organickým postižením srdce. Typ arytmie, její morfologie a frekvence záleží na okolnostech jejího vzniku (akutní, subakutní nebo chronická fáze infarktu myokardu).
Podkladem KT v akutní fázi (48 hodin) infarktu myokarduje především ischemie myokardu. S tím souvisí skutečnost, že v tomto období převažuje výskyt polymorfní KT nebo fibrilace komor. Monomorfní KT se v akutní fázi infarktu vyskytuje poměrně zřídka (podle dostupných údajů v méně než 0,5 % případů) [9]. Je pravděpodobné, že mechanizmem jejího vzniku je zvýšená, nebo abnormální automacie, nelze vyloučit ani funkční reentry při ischemii. Tato arytmie reaguje dobře na antiarytmika typu lidokainu nebo amiodaronu a nebývá předmětem katetrizační ablace.
KT v subakutní fázi (3-60 dní) infarktu myokardu postihuje převážně nemocné s výrazným postižením koronárního řečiště a pokročilou dysfunkcí levé komory [10]. U vysokého procenta nemocných (okolo 80-85 %) lze arytmii indukovat při programované stimulaci komor. To svědčí pro reentry mechanizmus na podkladě vyvíjejícího se nebo již dříve vyvinutého anatomického substrátu. Pro akutní přerušení KT má proto trimekain podstatně menší význam než u KT souvisejících s akutní ischemií. Naopak prokainamid, ajmalin nebo amiodaron mohou být úspěšnější ve vyšším procentu případů (až 80 %). Bezpečnější je přerušení KT pomocí elektrické kardioverze. Ta je nezbytná v případě špatné tolerance KT. Pro riziko opakování KT v dalším období by měla být poskytnuta individualizovaná profylaktická léčba, obvykle implantace ICD. V případě nezvládnutelné KT je indikována katetrizační ablace na pracovišti, které má s touto léčbou bohaté zkušenosti.
KT u chronické ischemické choroby srdeční se vyskytuje nejčastěji měsíce až roky po infarktu myokardu (obr. 4). V takových případech bývá charakteristicky typu reentry [10,11]. Nemocní mívají větší rozsah jizvení v myokardu, jak lze dokumentovat i podle přítomnosti pozdních potenciálů (tj. lokálních elektrogramů o nízké amplitudě, které lze zaznamenat až za komplexem QRS) při sinusovém rytmu. Ty vznikají opožděnou aktivací okrajové části jizvy po infarktu, kde se prolíná vazivo s životaschopným myokardem. Neinvazivní metodou jejich záznamu z povrchu hrudníku je tzv. signal-averaged EKG [12]. Takové místo opožděné aktivace predisponuje k vzniku KT typu reentry (další zpomalení vedení vzruchu danou oblastí, např. v důsledku časné komorové extrasystoly, může způsobit, že vzruch vyjde do okolní svaloviny v době, kdy je již znovu vzrušení schopná, a nastartuje se tak jeho kroužení). Proto lze arytmii nastartovat reprodukovatelně pomocí programované stimulace komor až v 95 % případů [10]. U těchto nemocných nemá preventivní podávání antiarytmik jako jediné terapie (s výjimkou masové profylaxe betablokátorem) žádný význam. Podle dostupných údajů poskytuje obecně nejúčinnější profylaxi proti náhlé arytmické smrti implantace ICD, zejména u nemocných po prodělané srdeční zástavě nebo při současné významné dysfunkci levé komory srdeční (EF pod 35 %) [13,14]. K omezení recidiv KT může být tato léčba doplněna podáváním antiarytmik, nejčastěji amiodaronu. Pokud je u nemocného indikována revaskularizační operace, je výhodné doplnit výkon peroperačním mapováním a resekcí (nebo kryoablací) arytmogenního substrátu. U nemocných s uspokojivou systolickou funkcí levé komory je možné za terapii volby vybrat katetrizační ablaci. Ta je jednoznačně indikována u nemocných s incesantními (nepřetržitými) běhy KT nebo v případě arytmické bouře nereagující na sedaci a podávání betablokátorů.
Obr. 4. Ukázka 3rozměrné elektroanatomické voltážové mapy levé komory srdeční (zadopřední projekce) u pacienta s KT pocházející ze substrátu v rozsáhlém aneuryzmatu hrotu a přední stěny. Červená barva dokumentuje rozsah poinfarktového poškození (nízká voltáž pod 0,5 mV), šedé oblasti označují denzní jizvu, kde nelze ani stimulovat. Kritický istmus KT byl v oblasti mezi dvěma denzními jizvami, oblast exitu směrem dolů ke hrotu. Mapa byla sestrojena při sinusovém rytmu a hnědé body ukazují ablační léze vedoucí k odstranění vyvolatelnosti arytmie. B. EKG-záznam klinické KT u daného pacienta. Široké komplexy QRS se sklonem osy doleva a konkordantním tvarem od V<sub>1</sub>–V<sub>6</sub> ukazují na KT s exitem v apikální oblasti. 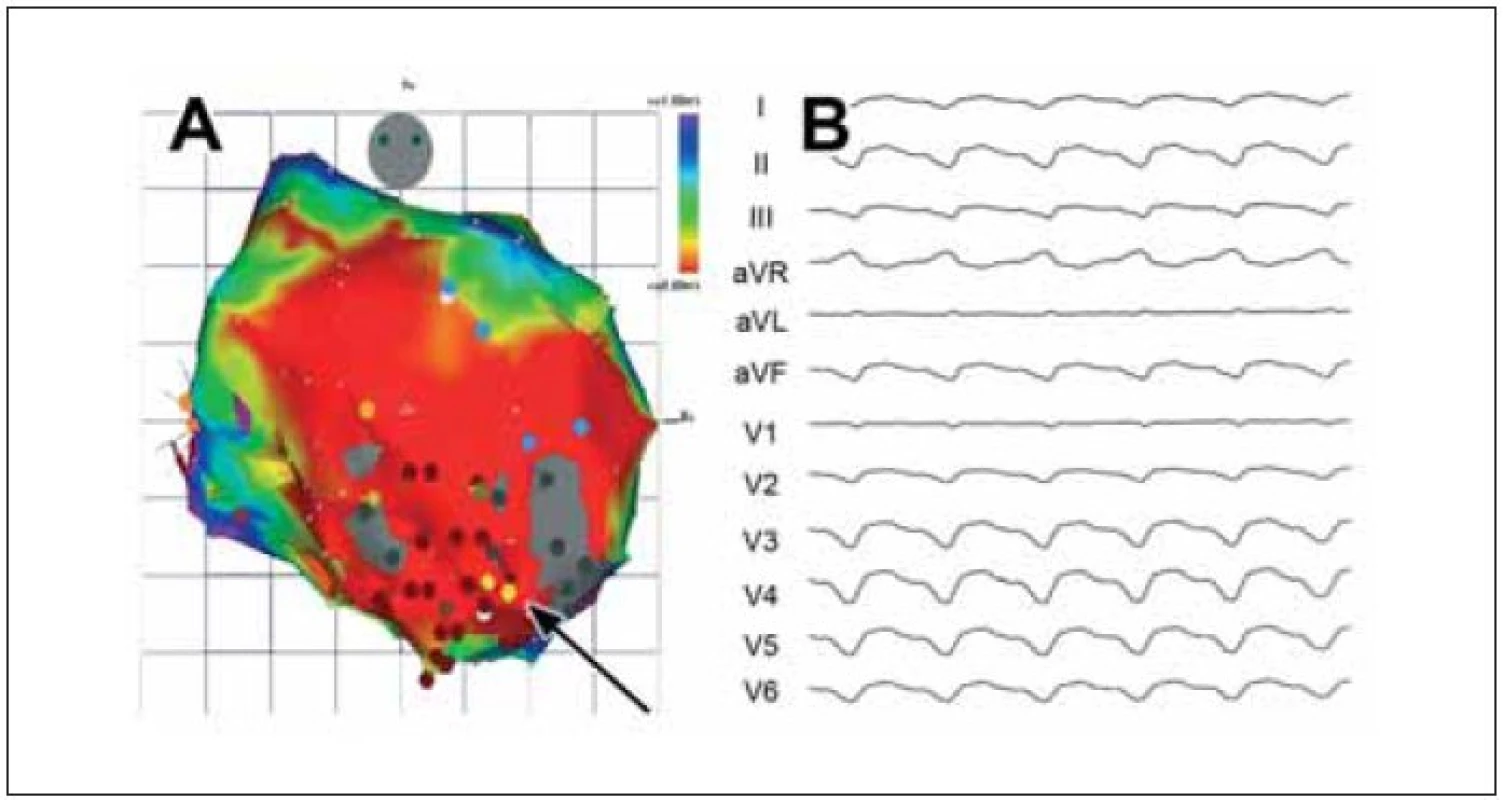
Pokud nemocný arytmii toleruje, je možno identifikovat pomocí mapování a stimulačních technik kritické oblasti reentry okruhu a arytmii eliminovat radiofrekvenční ablací [15,16]. Bohužel arytmii toleruje pouze 5-10 % takových nemocných. Úspěšnost se pohybovala na pracovištích se značnými zkušenostmi okolo 70 % a více. V současnosti jsou ke katetrizační ablaci KT při strukturním postižení srdce používány mapovací systémy dovolující identifikaci arytmogenního substrátu a jeho následnou modifikaci pomocí radiofrekvenčního proudu i při sinusovém rytmu [17-20]. Pomocí tzv. substrátového mapování lze zkonstruovat 3rozměrnou voltážovou mapu levé nebo pravé komory, podle amplitudy lokálních elektrogramů nebo testování lokálního zachycení stimulací (capture) se orientovat o přítomnosti jizvy a pomocí stimulace z mapovacího katétru při sinusovém rytmu sledovat charakteristiky šíření vzruchu v substrátu a výslednou morfologii komplexů QRS na EKG (obr. 4). Takto lze charakterizovat detailně i rozsáhlý substrát pro KT a následně jej modifikovat sérií lézí napříč kritickými oblastmi. Odstranění klinické formy arytmie lze dosáhnout ve více než 90 % případů, odstranění všech indukovatelných forem arytmie pak asi v 60-70 % případů. Vzhledem ke komplexnosti problematiky by mělo být předpokladem kvalifikovaného rozhodnutí o optimální dlouhodobé léčbě vyšetření na specializovaném pracovišti.
U malého procenta nemocných s chronickou ICHS a dilatací levé komory může být monomorfní KT charakteru raménkové nebo interfascikulární reentry (viz níže).
Komorová tachykardie ve spojení s kardiomyopatiemi
KT jsou běžné u všech forem kardiomyopatií. Podobně jako u ICHS může i v tomto případě být KT monomorfní nebo polymorfní. Monomorfní KT se vyskytují nejčastěji u arytmogenní dysplazie pravé komory nebo u dilatační kardiomyopatie.
Arytmogenní dysplazie (kardiomyopatie) pravé komory
Takto se označuje relativně vzácná forma kardiomyopatie postihující převážně pravou komoru a manifestující se v podobě KT nebo náhlé smrti [21,22]. Onemocnění se často manifestuje u mladých jedinců a ve většině případů je zřejmě geneticky podmíněno – zpravidla se jedná o autozomálně dominantní typ dědičnosti s nekompletní penetrancí.
Morfologickým substrátem pro komorové arytmie je náhrada různě rozsáhlých oblastí svaloviny pravé komory fibrolipomatózní tkání. Tento proces, který je ve své podstatě progresivní, vede k vytvoření zón pomalého vedení vzruchu a anatomických bloků podobně jako jizevnatá tkáň po infarktu myokardu. Predilekčními místy pro fibrolipomatózní infiltraci jsou oblast vtokové části komory při trikuspidální chlopni, hrot a infundibulum (tzv. trojúhelník dysplazie). Vzhledem k charakteru postižení pravé komory nepřekvapuje, že u většiny nemocných lze nalézt pozdní komorové potenciály [23]. Opožděná aktivace pravé komory při sinusovém rytmu se často manifestuje i na povrchovém elektrokardiogramu v podobě vln epsilon. Kromě toho jsou charakteristickým nálezem negativní vlny T ve svodech z pravého prekordia. Echokardiograficky lze prokázat dilataci pravé komory se ztenčením stěn a lokalizovanými dyskinezami. Dále byla popsána dezorganizace trabekul nebo snížení systolické funkce pravé komory. Strukturální abnormity pravé komory lze detekovat i angiograficky. V poslední době se diagnostika stává doménou magnetické rezonance, která dovoluje přímé zobrazení tukové tkáně ve stěně pravé komory. K standardizaci diagnostiky byla navržena skupinou expertů diagnostická kritéria [24].
Mechanizmem vzniku KT je podobně jako u chronické ischemické choroby srdeční reentry. Vzhledem k tomu, že arytmie pochází z pravé komory, bývá při tachykardii na EKG charakteristická morfologie blokády levého raménka Tawarova. Metody léčby jsou podobné jako u KT při chronické ICHS (obr. 5).
Obr. 5. Obrázek přibližuje voltážové mapy obou komor u pacienta s arytmogenní dysplazií pravé komory (A,B) a klinickou KT, která vycházela ze substrátu při trikuspidální chlopni (C). A. Mapa v pravé šikmé projekci zachycuje nevelkou jizvu na volné stěně u trikuspidální chlopně a druhou jizvu ve výtokovém traktu (červená barva). B. Korespondující mapa v levé šikmé projekci ukazuje nevelký rozsah jizvy ve výtokovém traktu (v takových případech je potřeba odlišit arytmogenní dysplazii od idiopatické formy KT). C. EKG-záznam KT ukazuje charakteristický obraz blokády levého raménka Tawarova se širokými komplexy QRS a pozitivní výchylkou ve svodu I a V<sub>5,6</sub> (exit z reentry okruhu na volné stěně při trikuspidální chlopni). 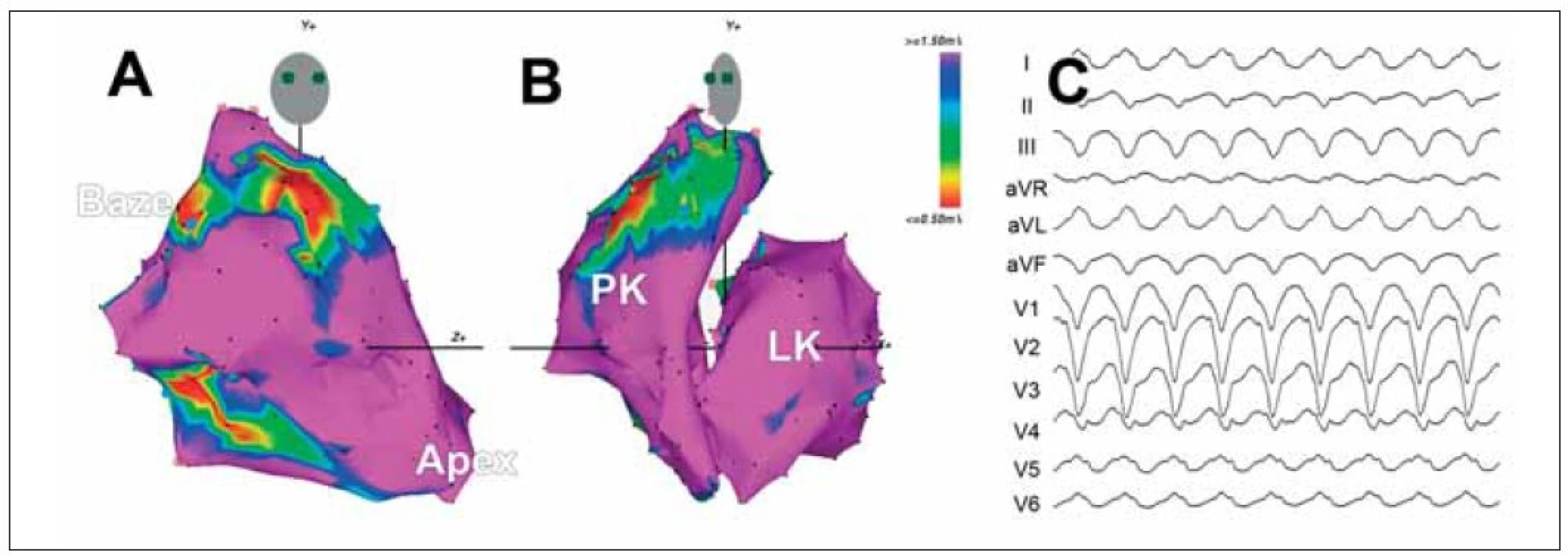
Idiopatická dilatační kardiomyopatie
Je charakterizována dilatací a dysfunkcí levé komory nejasné etiologie. Histologické změny jsou v pozdějších stadiích nespecifické a zahrnují především difuzní intersticiální fibrózu, degeneraci myofibril atd [25]. Důležité je, že stupeň strukturálních změn souvisí s pravděpodobností vzniku KT. Mechanizmem vzniku KT může být intramyokardiální reentry, podobně jako po infarktu myokardu. Intersticiální fibróza usnadňuje také častější uplatnění fokálního mechanizmu KT, než je tomu u pacientů s ICHS. Na rozdíl od nemocných s ICHS lze proto u pacientů s dilatační kardiomyopatií indukovat setrvalou monomorfní KT pomocí programované stimulace komor méně často. Také pozdní komorové potenciály lze prokázat mnohem vzácněji [26]. Častější je uložení kritické části okruhu reentry subepikardiálně, obvykle poblíž mitrálního prstence. Terapeutické možnosti se podobají možnostem léčby monomorfní KT při ICHS.
Setrvalá monomorfní KT u nemocných s dilatační kardiomyopatií může nezřídka vznikat na podkladě raménkové reentry (bundle-branch reentry) [27,28]. Vzniká na podkladě dobře definovaného okruhu makroreentry, který je tvořen Hisovým svazkem, oběma raménky Tawarovými, Purkyňovými vlákny a transeptálním myokardiálním vedením. Kritickým předpokladem vzniku arytmie je převodní porucha v Hisově-Purkyňově systému, která se manifestuje na povrchovém EKG-záznamu jako nespecifická porucha nitrokomorového vedení, nebo jako blokáda levého raménka Tawarova. Dilatace levé komory napomáhá zřejmě udržení reentry okruhu (prodloužením dráhy kroužení vzruchu). Nejčastějším klinickým projevem je setrvalá monomorfní KT o morfologii blokády levého raménka s paradoxně úzkým rS-komplexem v prekordiálních svodech (obr. 6). Tomu odpovídá kroužení vzruchu antegrádně pravým raménkem a retrográdně raménkem levým. V malém množství případů krouží vzruch obráceně a komplex QRS má morfologii tvaru blokády pravého raménka Tawarova. Diagnózu lze definitivně ověřit pouze elektrofyziologickým vyšetřením se záznamem elektrokardiogramu Hisova svazku. Radiofrekvenční katetrizační ablace pravého raménka je léčbou volby, neboť vede k účinnému odstranění této formy KT [31]. V některých případech je poté nutno implantovat pro výslednou převodní poruchu kardiostimulátor, případně ICD pro přetrvávající vyvolatelnost jiné formy KT.
Obr. 6. Komorová tachykardie typu raménkové reentry. Panel A ukazuje vybrané EKG-svody a intrakardiální elektrogramy z oblasti Hisova svazku (His) a pravé komory (RV). Panel B přibližuje typickou morfologii na 12svodovém EKG (morfologie blokády levého raménka Tawarova se širokými komplexy QRS, často s malým kmitem r v iniciální části a v tom případě s úzkým kmitem rS, který kontrastuje s jinak velmi širokým komplexem QRS). Jednou z diagnostických známek je přítomnost potenciálu Hisova svazku (H) před každým komorovým potenciálem při KT a trvání HV-intervalu při KT delší než při sinusovém rytmu. 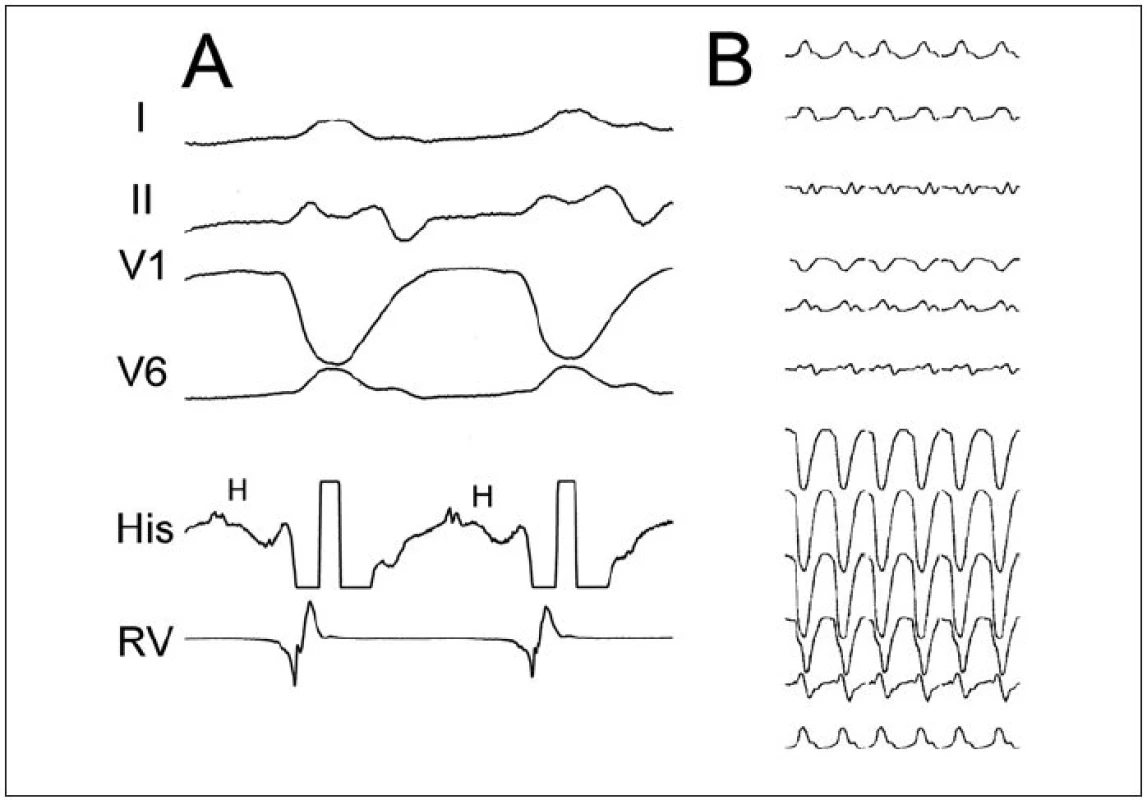
Komorová tachykardie po chirurgické korekci vrozených srdečních vad
Recidivující KT je popisována jako komplikace v pozdním pooperačním průběhu nemocných po operačních korekcích vrozených srdečních vad, které zahrnují ventrikulotomii (především Fallotova tetralogie, defekty komorového septa nebo stenózy plicnice) [29]. Tito nemocní mívají často pozitivní pozdní komorové potenciály [30]. U nemocných po korekci Fallotovy tetralogie ukázalo podrobné elektrofyziologické mapování, že jde v naprosté většině případů o makroreentry KT na podkladě kroužení vzruchu okolo ventrikulotomické jizvy nebo okolo záplaty ve výtokovém traktu pravé komory. Podle směru kroužení může mít KT buď morfologii blokády pravého raménka (při kroužení vzruchu ve směru ručiček), nebo blokády raménka levého (při obráceném kroužení vzruchu). Podobně jako v případě ostatních tachykardií na podkladě reentry lze při tolerované KT definovat pomocí katetrizačního mapování charakteristiky reentry okruhu a provést účinnou radiofrekvenční ablaci [31,32]. V poslední době se opět stále častěji používá k ozřejmení substrátu a podpoře katetrizační ablace substrátového mapování (obr. 7). V ostatních případech je obvykle indikována implantace ICD.
Obr. 7. 3rozměrná voltážová elektroanatomická mapa obou komor u nemocného s KT po radiální korekci Fallotovy tetralogie. A. Pohled zepředu, B. Pohled zezadu. Šedá barva na volné stěně pravé komory označuje jizvu po ventrikulotomii a rozšíření výtokového traktu pravé komory záplatou, šedá barva, nahoře pod chlopní je vidět šedý okrsek odpovídající záplatě komorového defektu. Šipky označují kanál mezi oběma bariérami, který je uložen v jizevnaté tkáni (červená barva) a který tvořil istmus pro arytmii typu reentry. Katetrizační ablace v tomto kanálu vedla k odstranění indukovatelnosti KT. 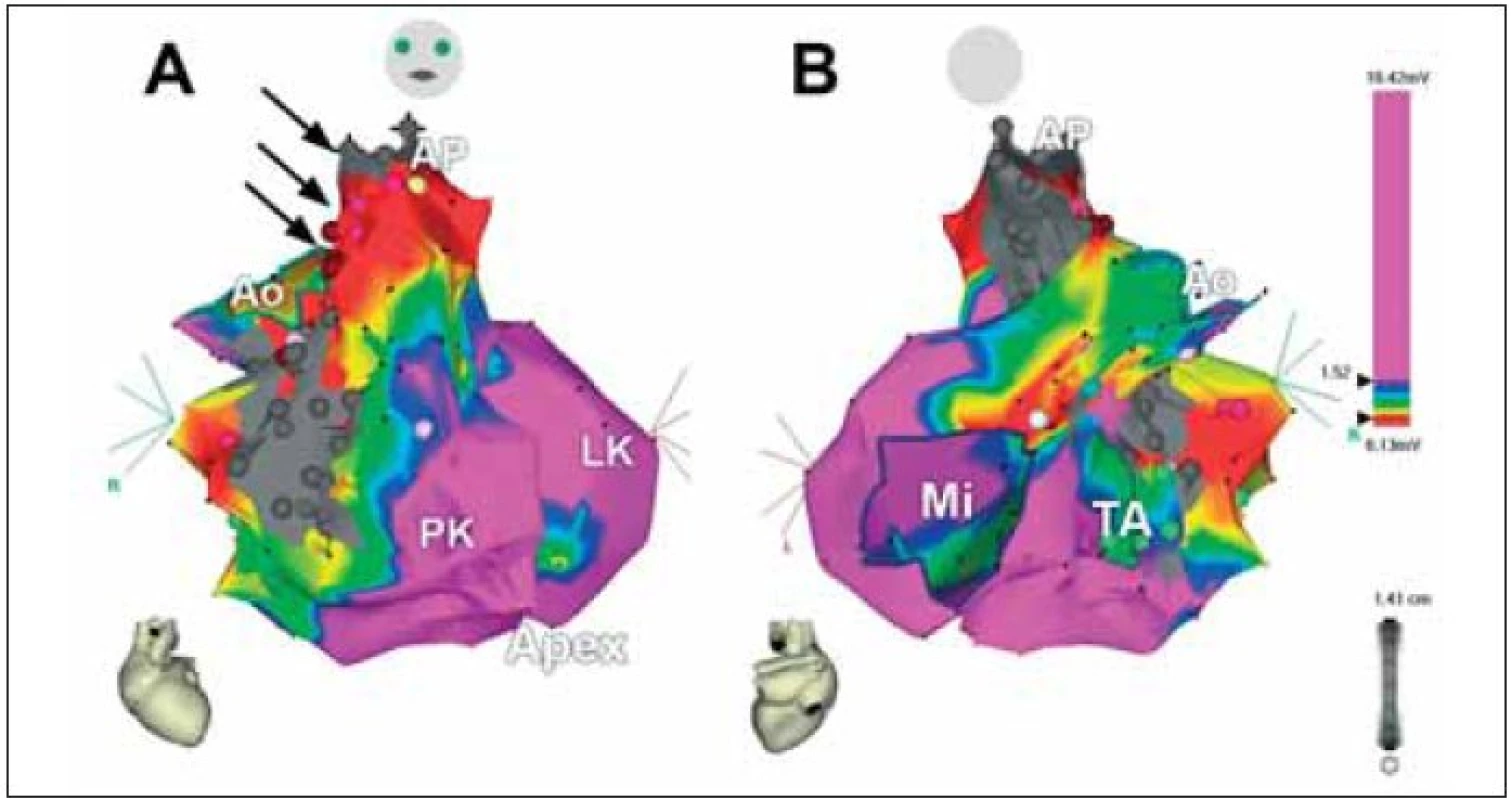
Závěry
Katetrizační ablace se stala metodou volby u většiny idiopatických KT. V některých případech je touto metodou léčena i symptomatická frekventní komorová ektomie. U nemocných s organickým postižením srdce je katetrizační ablace indikována primárně v případech incesantní KT nebo při četných epizodách arytmie. Katetrizační ablací lze vyřešit specifickou formu KT, kterou je tzv. raménková reentry KT a katetrizační léčbu lze nabídnout jako léčbu volby i nemocným s KT při uspokojivé funkci levé komory. V ostatních případech je katetrizační ablace považována za léčbu doplňkovou. Obvykle bývá indikována u nemocných s implantabilním kardioverterem-defibrilátorem v případě častějších recidiv arytmie. Při arytmických bouřích může být katetrizační ablace život zachraňujícím výkonem. Zatímco katetrizační ablace idiopatických KT patří až na výjimky ke konvenčním výkonům, které jsou prováděny na většině arytmologických pracovišť, ablační výkony u nemocných se strukturním postižením srdce by měly být soustředěny do omezeného počtu center, která disponují potřebným přístrojovým vybavením a zkušenostmi s prováděním tohoto typu výkonů.
prof. MUDr. Josef Kautzner, CSc., FESC
Klinika kardiologie IKEM, Praha
prof. MUDr. Josef Kautzner, CSc., FESC (1957)
Promoval na 1. LF UK v Praze. Po více než deseti létech práce na II. interní klinice 1. LF UK v Praze, dvouletém pobytu v nemocnici St George’s v Londýně a opakovaných krátkodobých pobytech v dalších kardiologických centrech v USA a Evropě pracuje od roku 1996 v IKEM v Praze. Je specialistou v oboru klinické elektrofyziologie, od roku 2001 přednostou Kliniky kardiologie IKEM v Praze a profesorem pro obor vnitřní nemoci (2005) na 1. LF UK v Praze. Je členem České kardiologické společnosti a vědeckým sekretářem výboru její Pracovní skupiny pro arytmie a kardiostimulaci. Dále je členem Heart Rhythm Society (HRS) pro kardiostimulaci a elektrofyziologii (NASPE), Evropské asociace srdečního rytmu. Je autorem mnoha vědeckých sdělení, pedagogických textů a přehledových prací.
Zdroje
1. Kautzner J. Klinické spektrum komorových tachykardií. Čas Lék Čes 2000; 139 : 557-563.
2. Varma A, Josephson ME. Therapy of “idiopathic” ventricular tachycardia. J Cardiovasc Electrophysiol 1997; 8 : 104-116.
3. Lerman BB, Stein KM, Markowitz SM. Idiopathic right ventricular outflow tract tachycardia: a clinical approach. PACE 1996; 19 : 2120-2137.
4. Tanner H, Hindricks G, Schirdewahn P et al. Outflow tract tachycardia with R/S transition in lead V3: six different anatomic approaches for successful ablation. J Am Coll Cardiol 2005; 45 : 418-423.
5. Shimoike E, Ohnishi Y, Ueda N et al. Radiofrequency catheter ablation of left ventricular outflow tract tachycardia from the coronary cusp: a new approach to the tachycardia focus. J Cardiovasc Electrophysiol 1999; 10(7): 1005-1009.
6. Sekiguchi Y, Aonuma K, Takahashi A et al. Electrocardiographic and electrophysiologic characteristics of ventricular tachycardia originating within the pulmonary artery. J Am Coll Cardiol 2005; 45(6): 887-895.
7. Lerman BB, Stein KM, Markowitz SM. Mechanisms of idiopathic left ventricular tachycardia. J Cardiovasc Electrophysiol 1997; 8 : 571-583.
8. Shimoike E, Ohba Y, Yanagi A et al. Radiofreqency catheter ablation of left ventricular outflow tract tachycardia: report of two cases. J Cardiovasc Electrophysiol 1998; 9 : 196-202.
9. Eldar M, Sievner Z, Goldbourt U et al. Primary ventricular tachycardia in acute myocardial infarction: clinical characteristics and mortality. The SPRINT Study Group. Ann Intern Med 1992; 117 : 31-36.
10. Josephson ME. Recurrent ventricular tachycardia. In: Josephson ME (ed). Clinical Cardiac Electrophysiology: Techniques and Interpretations. Lea & Febiger: Philadelphia 1993 : 417-615.
11. DeBakker JMT, VanCapelle FJL, Janse MJ et al. Reentry as a cause of ventricular tachycardia in patients with chronic ischemic heart disease: Electrophysiologic and anatomic correlation. Circulation 1988; 77 : 589-606.
12. A statement by a task force committee of the European Society of Cardiology, the American Heart Association, and the American College of Cardiology. Standards for analysis of ventricular late potentials using high-resolution or signal-averaged electrocardiography. J Am Coll Cardiol 1991; 17 : 999-1006.
13. Reiffel JA, Reiter MJ, Blitzer M. Antiarrhythmic drugs and devices for the management of ventricular tachyarrhythmia in ischemic heart disease. Am J Cardiol 1998; 82 : 311-401.
14. Richter S, Duray G, Gronefeld G et al. Prevention of sudden cardiac death: lessons from recent controlled trials. Circ J 2005; 69(6): 625-629.
15. Stevenson WG, Khan H, Sager P et al. Identification of reentry circuit sites during catheter mapping and radiofrequency ablation of ventricular tachycardia late after myocardial infarction. Circulation 1993; 88 : 1647-1670.
16. Stevenson WG, Friedman PL, Sager PT et al. Exploring postinfarction reentrant ventricular tachycardia with entrainment mapping. J Am Coll Cardiol 1997; 29 : 1180-1189.
17. Hsia HH. Substrate mapping: the historical perspective and current status. J Cardiovasc Electrophysiol 2003; 14 : 530-532.
18. Kautzner J, Čihák R, Peichl P et al. Catheter ablation of ventricular tachycardia following myocardial infarction using a 3-D electroanatomical mapping. Pacing Clin Electrophysiol 2003; 26(1,2): 342-347.
19. Soejima K, Stevenson WG, Maisel WH et al. Electrically unexcitable scar mapping based on pacing threshold for identification of the reentry circuit isthmus: feasibility for guiding ventricular tachycardia ablation. Circulation 2002; 106 : 1678-1683.
20. Reddy VY, Neuzil P, Taborsky M, Ruskin JN. Short-term results of substrate mapping and rediofrequency ablation of ischemic ventricular tachycardia using a saline-irrigated catheter. J Am Coll Cardiol 2003; 41 : 2228-2236.
21. Marcus FI, Fontaine G. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: A review. Pacing Clin Electrophysiol 1995; 18 : 1298-1314.
22. Basso C, Thiene G, Corrado D et al. Arrhythmogenic right ventricular cardiomyopathy: dysplasia, dystrophy or myocarditis? Circulation 1996; 94 : 983-991.
23. Leclerq JR, Coumel P. Late potentials in arrhythmogenic right ventricular dysplasia: prevalence, diagnostic and prognostic values. Eur Heart J 1993; 14(Suppl E): 80-83.
24. McKenna Wj, Thiene G, Nava A, et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Br Heart J 1994; 71 : 215-218.
25. Lo YSA, Billingham M, McKinnie J et al. Histopathologic and electrophysiologic correlations in idiopathic dilated cardiomyopathy and sustained ventricular tachycardia. Am J Cardiol 1989; 64 : 1063-1066.
26. Middlekauff HR, Stevenson WG, Woo MA et al. Comparison of frequency of late potentials in idiopathic dilated cardiomyopathy and ischemic cardiomyopathy with advanced congestive heart failure and their usefulness in predicting sudden death. Am J Cardiol 1990; 66 : 1113-1117.
27. Blanck Z, Akhtar M. Therapy of ventricular tachycardia in patients with nonischemic cardiomyopathies. J Cardiovasc Electrophysiol 1996; 7 : 671-683.
28. Kautzner J, Bytešník J. Komorová tachykardie charakteru raménkové reentry. Cor Vasa 1999; 41 : 338-343.
29. Zimmerman FJ, Benson DW jr. Role of invasive EP testing in the evaluation and management of congenital heart disease related ventricular arrhythmias. CEPR 1997; 1 : 461-463.
30. Janousek J, Paul T, Bartakova H. Role of late potentials in identifying patients at risk for ventricular tachycardia after surgical correction of congenital heart disease. Am J Cardiol 1995; 75 : 146-150.
31. Chinushi M, Aizawa Y, Kitazawa H et al. Successful radiofrequency catheter ablation for macroreentrant ventricular tachycardias in a patient with tetralogy of Fallot after corrective surgery. Pacing Clin Electrophysiol 1995; 18 : 1713-1716.
32. Kautzner J, Bytešník J. Radiofrekvenční katetrizační ablace komorové tachykardie po chirurgické korekci Fallotovy tetralogie. Cor Vasa 1999; 41 : 199-203.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2006 Číslo Supplementum- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Neselektivní ablace AV-uzlu: nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie
- Katetrizační ablace atrioventrikulární nodální reentry tachykardie: léčba první volby?
- Katetrizační ablace akcesorních spojek: vyřešená otázka?
- Katetrizační léčba typického flutteru síní včera a dnes
- Katetrizační ablace fibrilace síní: naděje pro všechny výrazně symptomatické pacienty
- Katetrizační ablace postincizionálních tachykardií: konečné řešení nebo paliativní léčba?
- Katetrizační ablace komorových tachykardií
- Katetrizační ablace srdečních arytmií
- Katetrizační ablace fibrilace komor: realita nebo fikce?
- Katetrizační ablace srdečních arytmií v České republice – současný stav
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Katetrizační ablace atrioventrikulární nodální reentry tachykardie: léčba první volby?
- Katetrizační léčba typického flutteru síní včera a dnes
- Katetrizační ablace akcesorních spojek: vyřešená otázka?
- Neselektivní ablace AV-uzlu: nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




