-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti léčby klostridiové kolitidy a výhled do budoucnosti
Current treatment options for Clostridioides difficile colitis and future pro-spects
Clostridioides difficile colitis is a leading cause of nosocomial infectious diarrhea in adults. The therapeutic challenge are frequent recurrences. The basis of therapy is antibiotic therapy and restoration of the intestinal microflora using fecal microbiota transplantation. There is a few of effective antibiotics currently available, therefore the development of new antibiotics and alternative treatment strategies has received a great attention.
Keywords:
fecal microbiota transplantation – Clostridioides difficile colitis – antibiotic therapy
Autoři: Lenka Vojtilová
Působiště autorů: Klinika infekčních chorob LF MU a FN Brno
Vyšlo v časopise: Geriatrie a Gerontologie 2021, 10, č. 3: 141-146
Kategorie: Přehledový článek
Souhrn
Klostridiová kolitida je nejčastější příčinou nozokomiálních infekčních průjmů u dospělých. Terapeutickým problémem je častý rekurentní průběh. Základem terapie je antibiotická terapie a obnova střevní mikroflóry pomocí fekální bakterioterapie. K dispozici je omezené množství antibiotik, proto je vývoji nových antibiotik a alternativních léčebných strategií věnována velká pozornost.
Klíčová slova:
klostridiová kolitida – antibiotická terapie – fekální bakterioterapie
Úvod
Kolitida vyvolaná infekcí Clostridioides difficile (CDI) představuje stále významný zdravotnický problém ve vyspělých zemích (pozn. autora: Clostridium difficile bylo při změně taxonomie v roce 2016 reklasifikováno na Clostridioides difficile). I přesto, že si C. difficile po 30 letech zachovává ve více než 96 % citlivost na metronidazol a vankomycin, antibiotika běžně používaná k terapii CDI, nedaří se zcela zamezit šíření a rekurencím onemocnění. Infekce vyvolaná C. difficile je nyní nejčastější příčinou nozokomiálních infekčních průjmů u dospělých. Rekurentní průběh se vyskytuje až u 25–30 % adekvátně léčených pacientů. Stále častěji se můžeme setkat i s CDI akvírovanou v komunitě u nerizikových pacientů po podávání širokospektrálních antibiotik. Podle údajů z Epidatu sbíraných v České republice pod diagnózou MKN 10 A04.7 (Enterokolitida, původce: Clostridium difficile) od roku 2007 stoupal postupně výskyt onemocnění. V roce 2007 bylo poprvé hlášeno 153 případů, v roce 2011 již 1552 případů. Nejvíce hlášených případů bylo v roce 2015, a to 5163. Od roku 2018 se podle údajů ISIN (Informační systém infekčních nemocí) drží výskyt CDI pod 5000 případů ročně. Skutečný výskyt onemocnění může být ještě vyšší chybou neúplného hlášení.
Clostridioides difficile patří k běžným komenzálům sliznice tlustého střeva člověka i zvířat, včetně toxigenních kmenů. V dospělé populaci se výskyt odhaduje na 3–4 %. Během hospitalizace dochází až u 20 % pacientů ke kolonizaci nemocničními kmeny C. difficile již po pouhém týdnu hospitalizace. Kolonizace dále výrazně stoupá během pobytu v nemocnici až na 50 %, v závislosti na délce hospitalizace.(1,2) K rozvoji infekce dochází jen za určitých okolností. Rizikové faktory vzniku onemocnění jsou věk pacienta nad 65 let, poruchy celkové, a zejména střevní slizniční imunity (při nespecifických střevních zánětech, onkologických onemocněních, malnutrici...), stavy spojené se sníženou peristaltikou střeva, celková imobilita pacienta, hospitalizace. Spouštěčem infekce je většinou střevní dysmikrobie po předchozím užívání antibiotik. Každé celkově podávané antibiotikum má za následek více či méně porušení střevní mikroflóry, i antibiotika používaná k terapii CDI. Mezi nejrizikovější patří potencované aminopeniciliny, cefalosporiny, linkosamidy a fluorochinolony. Onemocnění může vzniknout i několik týdnů po podávání vyvolávajících antibiotik (až 3 měsíce), někdy již po podání pouze jedné dávky.
V intenzivním výzkumu úlohy střevního mikrobiomu, patogenity různých ribotypů C. difficile a vývoji nových léků a vakcín se za poslední desetiletí udělal obrovský pokrok. Do běžné praxe se v ČR v roce 2009 dostala fekální bakterioterapie,(3) systematicky se monitoruje výskyt epidemických ribotypů C. difficile,(4) do praxe bylo zavedeno selektivní střevní antibiotikum fidaxomicin a celosvětově probíhají klinické studie dalších nadějných léků a kandidátních vakcín pro prevenci CDI.
Diagnostika a terapie CDI se v ČR řídí doporučeným postupem ČLS JEP z roku 2014, který vychází z evropských doporučení ESCMID 2014 (European Society of Clinical Microbiology and Infectious Diseases).(5,6) Diagnostika a terapie jsou shrnuty na obrázku 1 a 2. Vzhledem k roku vydání doporučeného postupu se v dalším textu více zaměříme na aktuální terapeutické možnosti CDI v ČR, doplněné o přehled nových testovaných léčiv v terapii a prevenci CDI.
Obr. 1. Diagnostický algoritmus při průkazu C. difficile ve stolici, převzaté z dokumentu ESCMID z roku 2016 (6) 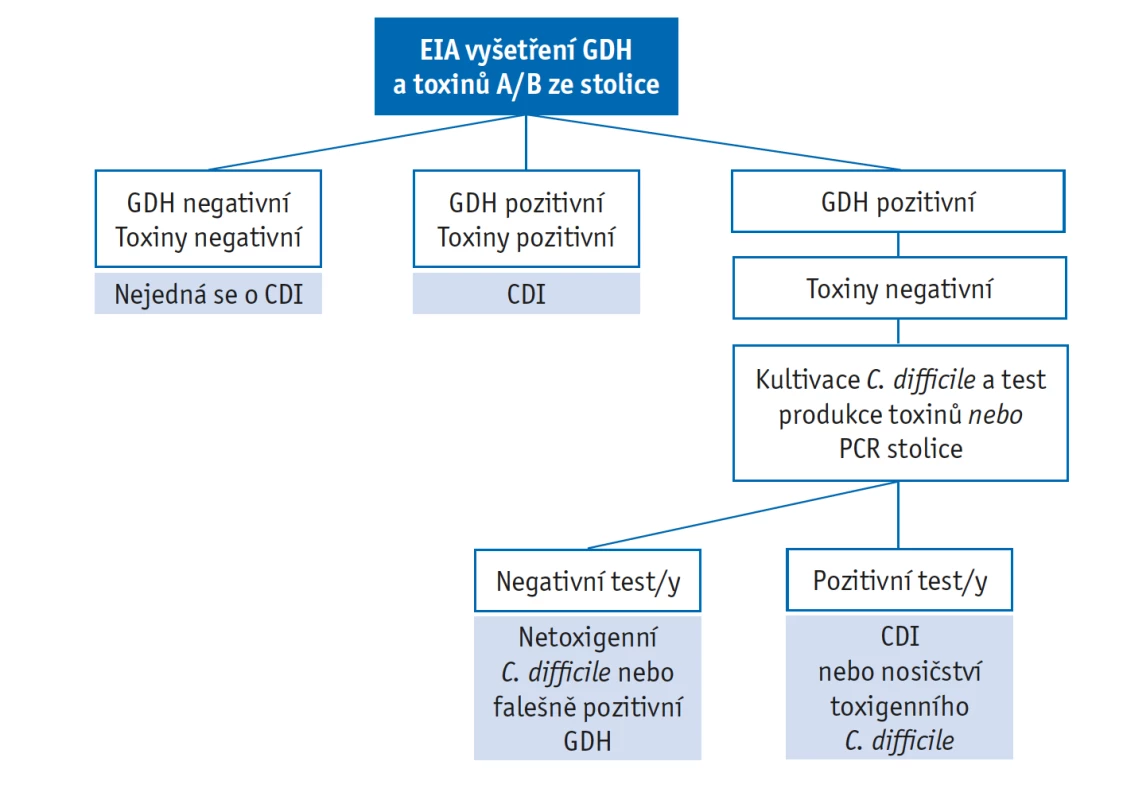
EIA – enzymoimunoesej, GDH – klostridiová glutamátdehydrogenáza, PCR – polymerázová řetězová reakce Obr. 2. Terapeutický algoritmus CDI, převzaté z Doporučeného postupu diagnostiky a léčby kolitidy vyvolané C. difficile, ČLS JEP z roku 2014 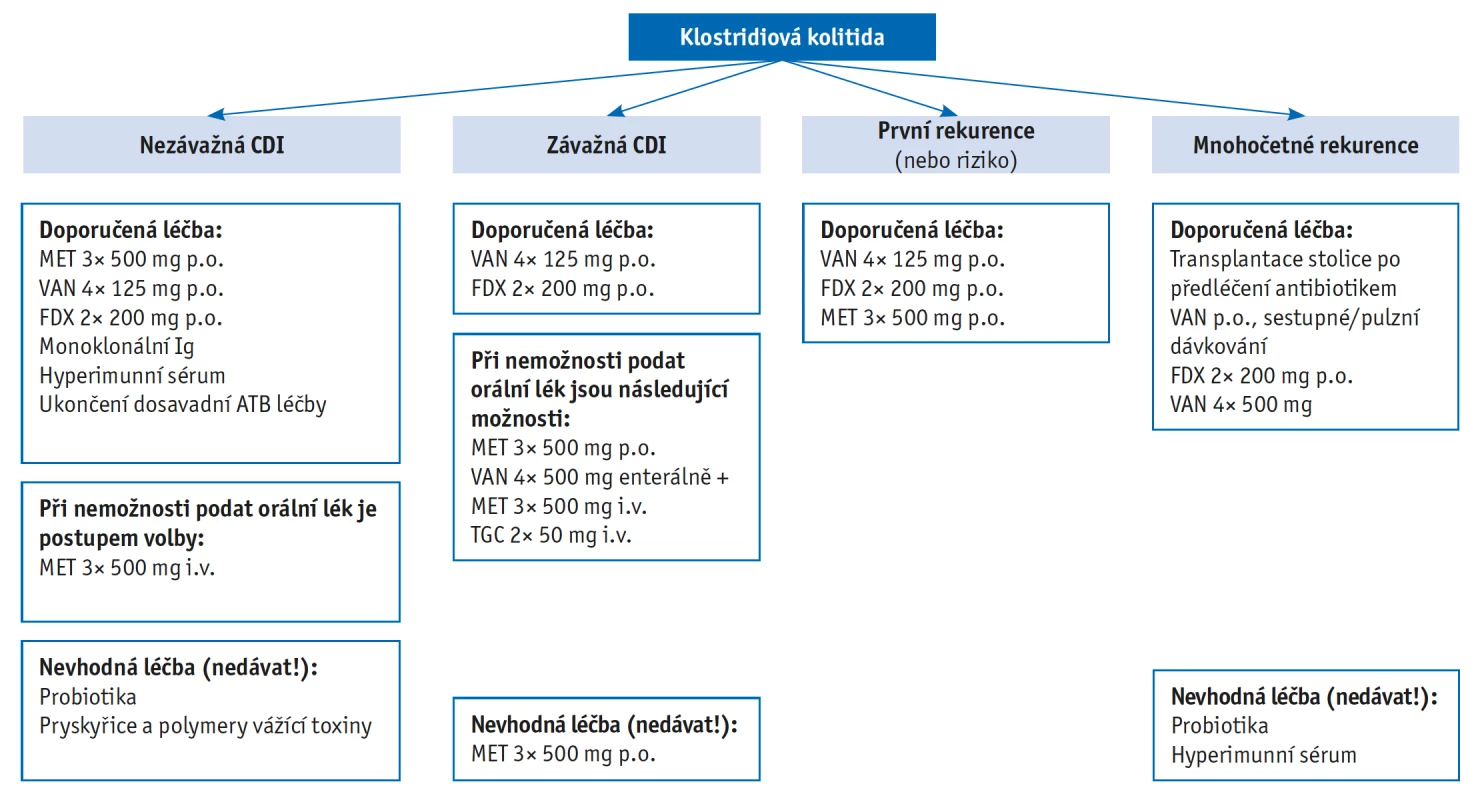
MET – metronidazol, VAN – vankomycin, FDX – fidaxomicin, TGC – tigecyklin Klinický obraz
Kolitida vyvolaná C. difficile se projevuje jako akutní průjmové onemocnění, konzistence stolice je kašovitá až vodnatá, typicky s příměsí hlenu, někdy má hnilobný zápach. Častým příznakem je bolest břicha, nemusí být provázena horečkami. Stolice je vyměšována často jen v malých porcích, u starších a nespolupracujících pacientů může být zaměněna za inkontinenci. Břicho je často meteoristické, difuzně bolestivé, zvracení je většinou spojeno až s rozvojem komplikací, vznikem subileu až ileu, rozvojem toxického megakolon. Rozvoj komplikací, zejména u starých a imunokompromitovaných pacientů, může být nečekaně rychlý, doprovázen narůstající apatií a kvantitativní poruchou vědomí.
Podezření na CDI by mělo být vysloveno zejména v následujících situacích:
– akutní průjmové onemocnění vzniklé u osob užívajících antibiotika (nebo do dvou týdnů po antibiotické kůře);
– akutní průjmové onemocnění provázené nápadným meteorismem, subileózním stavem, bolestmi břicha a/nebo leukocytózou, přičemž chirurg vyloučil náhlou příhodu břišní;
– akutní průjmové onemocnění vzniklé v nemocnici, zejména v případech, kdy jde o starší a imobilní osoby.
Definice těžké CDI je shrnuta v tabulce 1. Pacienti ve věku ≥ 65 let, se závažnými komorbiditami a/nebo se závažnou poruchou imunity mají být léčeni ve stejném režimu jako nemocní s těžkým průběhem klostridiové kolitidy. Totéž platí pro pacienty přijaté na JIP.
Tab. 1. Příznaky svědčící pro těžký průběh CDI 
Rekurence mohou mít lehčí, ale i těžší průběh než předchozí ataka. Obvykle k nim dochází do 2 měsíců od předchozí ataky. Po první atace se pravděpodobnost rekurence pohybuje v rozmezí 15–25 %. Objevila-li se druhá ataka, dosahuje pravděpodobnost další rekurence 40–65 %. Pacient s opakovanými atakami klostridiové kolitidy je ohrožený dehydratací, minerálovým rozvratem, malnutricí a celkovým fyzickým i psychickým vyčerpáním.
Přehled léků dostupných v ČR
Metronidazol je antibiotikum působící na většinu anaerobně rostoucích bakterií. Je běžně používaný a levný, při > 90% biologické dostupnosti po perorálním podání nedosahuje v kolon dostatečných koncentrací.(7) Nevýhodou metronidazolu je nižší účinnost ve srovnání s vankomycinem a fidaxomicinem, která se projevuje pozdějším nástupem úzdravy a také větším rizikem terapeutického selhání a rekurence. Podle dat z velké multicentrické studie metronidazol nedosahuje efektu klinického vyléčení jako vankomycin nezávisle na závažnosti onemocnění (72,7 % proti 81,8 %, p = 0,02), nejen u těžkých forem CDI (66,3 % proti 78,5 %, p = 0,059).(8) V současnosti by měl být používán na primoataku CDI pouze při nedostupnosti jiné terapie.
Vankomycin je v ČR standardem v léčbě CDI. Vankomycin se nevstřebává z GIT, orální podání tedy není spojeno s rizikem orgánové toxicity. V ČR nejsou registrovány žádné tabletové přípravky obsahující vankomycin. Lék může být proto připraven přímo na oddělení rozpuštěním 500 mg prášku na přípravu infuze v 20 ml vody na injekci; vzniklý roztok pacient vypije ve čtyřech dávkách s odstupem vždy 6 hodin. Stabilita roztoku při uchování v chladničkové teplotě činí 48 hodin. Vankomycin k orální léčbě lze užívat i ve formě kapslí, které vyrobí lékárna magistraliter.
Fidaxomicin je antibiotikum s úzkým spektrem, které je registrováno pouze pro léčbu CDI, v ČR je registrován od roku 2012. Nevstřebává se z GIT, nemá tedy žádné systémové nežádoucí účinky. Inhibuje proteosyntézu na bakteriálních ribosomech, to znamená, že u C. difficile zastavuje syntézu toxinů. Účinek tohoto antibiotika je proto rychlejší než účinek metronidazolu i vankomycinu. Fidaxomicin snižuje výskyt rekurencí oproti vankomycinu (14,1 % proti 26 %),(9) i vzhledem k jeho výrazně vyšší ceně proti vankomycinu může v konečném důsledku snížit zdravotní výdaje za rekurence CDI. Proti standardnímu dávkování fidaxomicinu (2× denně 200 mg p.o. 10 dnů) se ukazuje výhodnější prodloužené přerušované dávkování (2× 200 mg 1–5 dnů a následně 200 mg obden 7–25 dnů), které podle studie EXTEND u pacientů nad 60 let vede k trvalé úzdravě ve srovnání s léčbou vankomycinem.(10) Fidaxomicin by měl být v našich podmínkách lékem první volby u pacientů ve vysokém riziku relapsu onemocnění (imunosuprimovaní pacienti, onkologičtí pacienti atd.).
V červnu 2021 byl ve Spojených státech amerických vydán nový doporučený postup IDSA (Infectious Diseases Society of America) a SHEA (Society for Healthcare Epidemiology of America), kde je fidaxomicin již lékem první volby jak na první epizodu, tak na další rekurence CDI (standardně nebo v prodlouženém schématu). U rekurencí pak následuje podání monoklonální protilátky bezlotoxumab (viz níže), u 3. a další epizody fekální bakterioterapie.(11)
Tigecyklin je širokospektré parenterální antibiotikum tetracyklinové řady, registrované pro komplikované infekce kůže a měkkých tkání a komplikované nitrobřišní infekce. Účinnost tigecyklinu je dokumentována retrospektivní observační studií léčby těžké CDI, zatím není prospektivní studie k průkazu jeho účinnosti v této indikaci.(12) Uplatnění tedy nachází jen v případech, kdy nelze použít standardní léčbu. Jde zejména o těžké případy klostridiové kolitidy spojené se zástavou peristaltiky, kde orálně podávané přípravky nemohou proniknout do ložiska infekce. Tigecyklin se podává 100 mg v úvodní infuzi, dále 50 mg i.v. každých 12 hodin. Na našem pracovišti máme dobrou zkušenost s léčbou tigecyklinem u těžké CDI a v případech selhání standardní terapie.
Fekální bakterioterapie (FBT) neboli „transplantace“ stolice je založena na poznatku, že stolice zdravého jedince je až z 80 % tvořena intestinální mikroflórou. Nyní je v ČR běžně používanou metodou k léčbě rekurentní CDI a probíhají klinické studie k jejímu uplatnění i v jiných indikacích. Před FBT jsou pacienti léčeni 10–14 dní vankomycinem nebo fidaxomicinem. Z indikace CDI je preferována dolní cesta podání. Homogenizovaná stolice zdravého dárce je podána jednorázově, buď vysokým klyzmatem nebo s pomocí endoskopu až do céka s přibližně stejnou úspěšností.(13) Úspěšnost této terapie u rekurentních forem CDI je udávána různými autory ve více než 84–93 % případů. Výkon je pacienty obvykle dobře tolerován, krátkodobě se může vyskytnout průjmová stolice. Rizika FBT jsou totožná s riziky endoskopického vyšetření, při podání klyzmatem se snižují na minimum. V současnosti je metoda již dostupná v několika desítkách infektologických a gastroenterologických pracovišť v ČR a výkon fekální bakterioterapie již lze od 1. 1. 2020 vykázat na pojišťovnu jak u příjemce, tak u dárce stolice.
Při selhání konzervativní terapie je nutná chirurgická intervence v rámci komplikací CDI (těžká kolitida s orgánovým selháváním, toxické megakolon). Indikována je kolektomie s terminální ileostomií, výkon je provázen vysokou mortalitou. Nové pozitivní zkušenosti jsou s laparoskopickou kličkovou ileostomií a kolonickou laváží roztokem polyetylenglykolu, která se následně využívá pro podávání vankomycinu v kombinaci s metronidazolem i.v.(14,15)
Krátký přehled terapeutických možností ve výhledu do budoucnosti
Nová antibiotika jsou od vzniku epidemie CDI stále v klinickém zkoušení, ve srovnání se standardem současné terapie vankomycinem jich zatím vychází příznivě jen málo (fidaxomicin). Cadazolid ve studii IMPACT neprokázal noninferioritu nad vankomycinem v léčbě CDI, proto byl jeho vývoj ukončen.(16) Surotomycin podle výsledků 3. fáze studie selhal ve srovnání s vankomycinem v primárních i sekundárních cílech.(17) Ridinilazol je v současnosti ve 3. fázi klinického zkoušení, ve srovnání s vankomycinem i s fidaxomicinem, na výsledky studie si musíme počkat.
V rámci pasivní imunizace byla v říjnu 2016 uvedena na trh v USA lidská monoklonální protilátka bezlotoxumab, cílená protilátka proti toxinu B (protilátka proti toxinu A neprošla klinickým zkoušením pro nedostatečný efekt samostatně ani v kombinaci). Bezlotoxumab neutralizuje toxin B ve střevě a brání poškození střevní sliznice. Podává se intravenózně, v infuzi trvající minimálně 1 hodinu, účinkuje ve střevní sliznici a jeho plazmatický poločas je 19 dní. Je indikován u pacientů v rámci prevence rekurence CDI, podává se během standardní léčby primoataky nebo rekurence CDI. Klinický efekt bezlotoxumabu byl prokázán na rekurenci CDI oproti placebo skupině (17 % versus 27 %).(18,19) Nevýhodou je jeho vysoká cena, jedna dávka stojí kolem 4000 dolarů.(20)
Aktivní imunizace by mohla zabránit šíření infekce u rizikových skupin pacientů, také snížit závažnost onemocnění nebo počet rekurencí. U cílové věkové skupiny je však problematická imunogenicita vakcín a zatím v prevenci není dostupná žádná vakcína. Bivalentní toxoidová vakcína firmy Sanofi Pasteur neprokázala účinnost v prevenci CDI, vývoj byl ukončen.(21) Společnost Pfizer uveřejnila výsledky 2. fáze zkoušení bivalentní toxoidové vakcíny u 855 zdravých dospělých ve věku 65–85 let, výsledky jsou zatím slibné. Vývoj pokračuje také u rekombinantní proteinové vakcíny firmy Valneva Austria.(22,23)
Probiotika nevykazují prokazatelný efekt v léčbě CDI. V profylaxi CDI byl efekt probiotik prokázán u hospitalizovaných dospělých pacientů metaanalýzou PRISMA. V metaanalýze bylo zahrnuto 19 randomizovaných studií na 6261 pacientech léčených probiotiky (Saccharomyces boulardii, Lactobacillus spp., Bifidobacterium spp. a Streptococcus spp., samostatně nebo v kombinaci) po antibiotické léčbě. V probiotické kohortě byla incidence CDI 1,6 %, nižší než u kontrol 3,9 %, p < 0,001. Časné podávání probiotik již do 2 dnů snížilo riziko CDI nejvíc.(24)
Ve snaze o přesnější definování složení bakterií v rámci principu metody FBT jsou ve vývoji různé fekální deriváty, definované bakteriální kultury, kapsle s lyofilizovanou stolicí, autologní transplantace stolice atd. Příkladem je vývoj standardizované mikrobiální suspenze obsahující živé fekální bakterie od zdravých dárců, vyvíjené pod názvem RBX2660. Může být uchovávána zmrazená a podává se pacientovi klyzmatem. V současnosti je ve 3. fázi klinického zkoušení.(25) Dalším definovaným mikrobiálním preparátem z lidské stolice je preparát SER-109, kde je hmotnost purifikovaných bakteriálních spor snížena 200násobně do jednotlivých 5mg perorálních dávek. Preparát prokázal bezpečnost a účinnost v prevenci rekurence CDI ve 2. fázi klinického hodnocení.(26)
Na základě kompetice funguje podávání spor netoxigenních kmenů C. difficile, které vedlo ve 2. fázi klinických studií k signifikantnímu snížení rekurence oproti placebu (5 % versus 30 %).(27) Dalším slibným přístupem v budoucnu je fágová terapie, zatím ještě naráží na více úskalí v rámci preklinických testů.(25)
Zajímavým přístupem k prevenci CDI je protekce střevního mikrobiomu během intravenózního používání betalaktamových antibiotik perorálním použitím enzymů betalaktamáz. Látka s označením ribamaxase (SYN-004) ve 2. fázi klinického zkoušení u pacientů s infekcí dolních dýchacích cest léčených intravenózním ceftriaxonem prokázala efekt v redukci CDI ve srovnání s placebem, výzkum bude pokračovat dále.(28)
Závěr
Budeme muset počkat na další výsledky klinických studií k rozšíření terapie CDI. Také je očekáván nový evropský doporučený postup terapie. Nesmíme však zapomínat, že vzniku a šíření tohoto onemocnění můžeme předcházet zejména my klinici, a to racionální antibiotickou terapií našich pacientů.
Korespondenční adresa:
MUDr. Lenka Vojtilová, Ph.D.
Klinika infekčních chorob LF MU a FN Brno
Jihlavská 20, 625 00 Brno
Tel: 532 23 21 85
e-mail: vojtilova.lenka@fnbrno.cz
MUDr. Lenka Vojtilová, Ph.D.
Promovala v roce 2003 na Lékařské fakultě Univerzity Komenského v Bratislavě. V roce 2006 absolvovala základní kmen v oboru Interní medicína a v roce 2008 atestaci v oboru Infekční lékařství, doktorské studium ukončila v roce 2014 v oboru Vnitřní nemoci. Od roku 2004 pracuje na Klinice infekčních chorob Fakultní nemocnice Brno a zároveň je odbornou asistentkou předmětu Infekční nemoci Lékařské fakulty Masarykovy univerzity v Brně. Od roku 2014 se věnuje problematice fekální bakterioterapie.
Zdroje
- Maroo S, Lamont TJ. Reccurent Clostridium difficile. Gastroenterology 2006; 130 : 1311–1316.
- Padua D, Pothoulakis CH. Novel approaches to treating Clostridium difficile-associated colitis. Expert Rev Gatroenterol Hepatol 2016; 10(2), 193–204.
- Polák P, Freibergerová M, Juránková J, et al. První zkušenosti s fekální bakterioterapií v léčbě relabující pseudomembranózní kolitidy způsobené Clostridium difficile. Klin Mikrobiol Inf Lék 2011; 17(6): 214–217.
- Krůtová M, Matějková J, Nyč O. První výsledky molekulární typizace Clostridium difficile v ČR. Zprávy CEM. SZÚ; Praha 2013; 22 (12): 399–401.
- Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20: Suppl 2 : 1–26.
- Crobach MTJ, et al. European Society of Clinical Microbiology and Infectious Diseases: udpate of diagnostic guidance document for Clostridium difficile infection. Clinical Microbiology and Infection 2016; 22: S63–S81.
- Bollton RP, Culshaw MA. Fecal metronidazole concentrations during oral and intravenous therapy for antibiotic assosiated colitis due to Clostridium difficile. Gut 1986; 27 : 1169–1172.
- Johnson S, Louie TJ, Gerding DN, et al. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: result from two multinational, randomized, controlled trials. Clin Infect Dis 2014; 59(3): 345–354.
- Cornely OA, Crook DW, Esposito E, et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada and the USA: double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012; 12 : 281–289.
- Guery B, Menichetti F, Antilla VJ, et al. Extended-pulsed fidaxomicin versus vancomycin for Clostridium difficile infection in patients 60 years and older (EXTEND): a randomised, controlled, open-label, phase 3b/4 trial. Lancet Infect Dis 2017.
- Johnson S, Lavergne V, Skinner AM, et al. Clinical Practice Guideline by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA): 2021 Focused Update Guidelines on Management of Clostridioides difficile Infection in Adults. Clinical Infectious Diseases, ciab549.
- Gergely Szabo B, Kadar B, Szidonia Lenart K, et al. Use of intravenous tigecycline in patients with severe Clostridium difficile infection: a retrospective observational cohort study. Clin Microbiol Infect 2016; 22 : 990–995.
- Kassam Z, Lee CH, Yuan Y, Hunt RH. Fecal microbiota transplantation for Clostridium difficile infection: systematic review and metaanalysis. Am J Gastroenterol 2013; 108 : 500–508.
- Neal MD, Alverdy JC, Hall DE, et al. Diverting loop ileostomy and colonic lavage: an alternative to total abdominal colectomy for the treatment of severe, complicated Clostridium difficile associated disease. Ann Surg 2011; 254 : 423–429.
- Waltz P, Zuckerbraun B. Novel therapies for severe Clostridium difficile colitis. Curr Opin Crit Care 2016; 22(2): 167–173.
- Gerding DN, Cornely OA, Grill S, et al. Cadazolid for the treatment of Clostridium difficile infection: results of two double-blind, placebo-controlled, non-inferiority, randomised phase 3 trials. Lancet Infect Dis 2019; 19(3): 265–274.
- Boix V, Fedorak RN, Mullane KM, et al. Primary Outcomes From a Phase 3, Randomized, Double-Blind, Active-Controlled Trial of Surotomycin in Subjects With Clostridium difficile Infection. Open Forum Infect Dis 2017; 4(1): ofw275.
- Wilcox MH, Gerding DN, Poxton IR, et al. Bezlotoxumab for prevention of reccurent Clostridium difficile infection. N Eng J Med 2017; 376 : 305–317.
- Villafuerte Gálvez JA, Kelly CP. Bezlotoxumab: anti-toxin B monoclonal antibody to prevent reccurence of Clostridium difficile infection. Expert Rev Gatroenterol Hepatol 2017; 11(7): 611–622.
- Chapin RW, Lee T, McCoy C, et al. Bezlotoxumab: Could This be the answer fo Clostridium difficile Reccurence? Ann Pharm 2017; 51(9): 804–810.
- Bruyn G, Gordon DL, Steiner T, et al. Safety, immunogenicity, and efficacy of a Clostridioides difficile toxoid vaccine candidate: a phase 3 multicentre, observer-blind, randomised, controlled trial. Lancet Infect Dis 2021; 21(2): 252–262.
- Kitchin N, Remich SA, Peterson J, et al. A Phase 2 Study Evaluating the Safety, Tolerability, and Immunogenicity of Two 3-Dose Regimens of a Clostridium difficile Vaccine in Healthy US Adults Aged 65 to 85 Years. Clin Infect Dis 2020; 70(1): 1–10.
- Bézay N, Ayad A, Dubischar K, et al. Safety, immunogenicity and dose response of VLA84, a new vaccine candidate against Clostridium difficile, in healthy volunteers. Vaccine 2016; 34 (23): 2585–2592.
- Shen NT, MAW A, Tmanova LL, et al. Timely Use of Probiotics in Hospitalized Adults Prevents Clostridium difficile Infection: A Systematic Review With Meta-Regression Analysis. Gastroenterology 2017; 152(8): 1889–1900.
- Mills JP, Krishna R and Young VB. Probiotics for Prevention of Clostridium difficile Infection. Curr Opin Gastroenterol 2018; 34(1): 3–10.
- McGovern BH, Ford CB, Henn MR, et al. SER-109, an Investigational Microbiome Drug to Reduce Recurrence After Clostridioides difficile Infection: Lessons Learned From a Phase 2 Trial. Clin Infect Dis 2021; 72(12): 2132–2140.
- Gerding DN, Meyer T, Lee C, et al. Administration of spores of nontoxigenic Clostridium difficile strain M3 for prevention of reccurent C. difficile infection. JAMA 2015; 313 : 1719.
- Kaleko M, Bristol JA, Hubert S, et al. Development of SYN-004, an oral beta-lactamase treatment to protect the gut microbiome from antibiotic-mediated damage and prevent Clostridium difficile infection. Anaerobe 2016; 41 : 58–67.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2021 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Editorial
- Očkování u seniorů – nejen SARS-CoV-2 vakcinace
- Antikoagulační terapie – známe její interakce?
- Efektivní řešení chronické bolesti může zlepšit kvalitu života i complianci starších nemocných
- Současné možnosti léčby klostridiové kolitidy a výhled do budoucnosti
- Výživa a hydratace u geriatrických pacientů v paliativní péči
- Point of Care Ultrasound (POCUS) v geriatrii se zaměřením na dehydrataci
- Sociální charakteristiky akutně hospitalizovaných seniorů a dynamika jejich změn během 25 let na geriatrii
- Analýza vývoje invalidity pro duševní onemocnění a kritérií invalidity
- Spolupráce lékaře a logopeda v komplexní péči o pacienty – naše zkušenosti z Centra následné péče FN Motol
- Představení nového pracoviště – Geriatrické interní kliniky 2. LF UK a FN Motol
- Zpráva o činnosti konziliárního týmu paliativní péče v dospělé části FN Motol
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současné možnosti léčby klostridiové kolitidy a výhled do budoucnosti
- Výživa a hydratace u geriatrických pacientů v paliativní péči
- Antikoagulační terapie – známe její interakce?
- Spolupráce lékaře a logopeda v komplexní péči o pacienty – naše zkušenosti z Centra následné péče FN Motol
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




