-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aktuální pohled na terapii nesteroidními antirevmatiky u seniorů
Actual view on the non-steroidal anti-inflammatory drugs in geriatrics treatment
Non-steroidal anti-inflammatory drugs (NSAIDs) are among the most commonly used drugs. Their administration is accompanied by a relatively frequent occurrence of adverse gastrointestinal events. Coxibs have been developed to reduce the risk of adverse events in the gastrointestinal tract, but it was later found that they could increase the incidence of cardiovascular events. Recently, however, it has been shown that the cardiotoxic effect to varying degrees all NSAIDs, for example, and diclofenac, ibuprofen, etc. The concomitant use of acetylsalicylic acid (KAS) reduces the risk of cardiovascular events when administered with celecoxib, meloxicam or indomethacin, However, its effect can be reduced by concomitant administration of ibuprofen. Benefit of coxibs in the gastrointestinal tract than traditional NSAIDs is maintained in the case of concomitant use KAS, have simultaneously compared with neselektivnímu NSA lower incidence of side effects in the lower gastrointestinal tract. Consideration should be given for each individual gastroinestinálního ratio and cardiovascular risk, assess other risk factors, and according to then choose the optimal therapeutic approach.
Key words:
NSAIDs – coxibs – cardiovascular accident – gastrointestinal toxicity
Autoři: M. Forejtová
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Geriatrie a Gerontologie 2013, 2, č. 1: 24-31
Kategorie: Přehledové články
Souhrn
Nesteroidní antirevmatika (NSA) představují jedny z nejčastěji používaných léků ve stáří. Jejich podávání je však provázeno poměrně častým výskytem nežádoucích gastrointestinálních příhod. Koxiby byly vyvinuty za účelem snížení rizika nežádoucích příhod v oblasti zažívacího traktu, později bylo ale zjištěno, že mohou zvyšovat výskyt kardiovaskulárních příhod. V poslední době však bylo prokázáno, že tento kardiotoxický efekt mají různou měrou všechna NSA, a to například i diklofenak, ibuprofen atd. Současné užívání kyseliny acetylsalicylové (KAS) redukuje riziko vzniku kardiovaskulárních příhod, pokud je podávána spolu s celekoxibem, meloxikamem nebo indometacinem, její účinek však může být snižován současným podáváním ibuprofenu. Benefit koxibů v oblasti gastrointestinálního traktu oproti tradičním NSA je zachován i v případě současného užívání KAS, mají současně v porovnání s neselektivními NSA menší výskyt nežádoucích účinků v oblasti dolního gastrointestinálního traktu. Je nutné zvážit u každého jedince poměr gastroinestinálního i kardiovaskulárního rizika, vyhodnotit i další rizikové faktory, a podle toho pak zvolit optimální terapeutický postup.
Klíčová slova:
nesteroidní antirevmatika – koxiby – kardiovaskulární příhoda – gastrointestinální toxicitaÚvod
Nesteroidní antirevmatika (NSA) jsou léky, které mají protizánětlivé, analgetické a antipyretické vlastnosti. Jsou základním symptomatickým lékem při léčbě většiny revmatických onemocnění, neboť ovlivňují bolest, otok, zatuhnutí a zlepšují funkci postiženého kloubu.
Podávání NSA je však provázeno poměrně častým výskytem nežádoucích příhod v oblasti gastrointestinálního traktu (GIT). Gastroduodenální vředy se vyskytují u 15–30 % pravidelných uživatelů neselektivních NSA, vážné komplikace (tj. perforace, obstrukce a krvácení) pak postihují 1–2 % uživatelů NSA, přičemž mortalita v těchto případech se pohybuje mezi 10–15 % a stoupá s věkem(1–3). Některé endoskopické studie hovoří dokonce o 40–60 % výskytu endoskopicky prokazatelných gastroduodenálních erozí u chronických uživatelů NSA(4), výskyt ulcerací v oblasti tenkého střeva byl popsán u více než 8 %(5).
NSA se selektivní inhibicí cyklooxygenázy-2 (COX-2) neboli koxiby byly vyvinuty za účelem snížení výskytu těchto nežádoucích účinků, především v oblasti gastrointestinálního traktu. Postupně však bylo prokázáno, že koxiby zvyšují výskyt kardiovaskulárních příhod. Při dalším výzkumu se ovšem zjistilo, že nežádoucí účinek na kardiovaskulární aparát mají všechna NSA, a to selektivní i neselektivní.
Nesteroidní antirevmatika přesto stále představují jedny z nejčastěji užívaných léků, kdy podle některých observačních studií ve vyspělých zemích tyto léky užívá až 30 % starších lidí, okolo 70 % pak udává příležitostné užití NSA alespoň jedenkrát týdně(6). Například v USA bylo zjištěno, že u pacientů s revmatoidní artritidou a osteoartrózou je podávání NSA spojeno se 107 000 hospitalizacemi ročně a se 16 500 případy úmrtí(7).
Nežádoucí účinky v oblasti gastrointestinálního traktu
Mezi nejčastější nežádoucí účinky NSA patří nežádoucí účinky vzniklé v oblasti GIT. V různých případech v kontrolovaných studiích vycházejících z nemocničních databází byly prokázány rizikové faktory pro rozvoj vředové choroby gastroduodena (tab. 1)(2, 8). Bylo ale také prokázáno, že výskyt NSA-indukované gastropatie snižuje misoprostol, inhibitory protonové pumpy (PPI), antagonisté H2-receptorů (H2RA)(9). Další cestou snížení výskytu této gastropatie je užívání koxibů namísto neselektivních NSA(9–13). V důsledku dodržování doporučení pro prevenci NSA-indukované gastropatie byl v poslední době zaznamenán v různých zemích trend ke snížení výskytu symptomatických vředů a jejich komplikací u pacientů s revmatoidní artritidou(14).
Tab. 1. 6 nejdůležitějších rizikových faktorů pro vývoj vředové choroby GIT u pacientů užívajících NSA (podle literatury <sup>2</sup>) 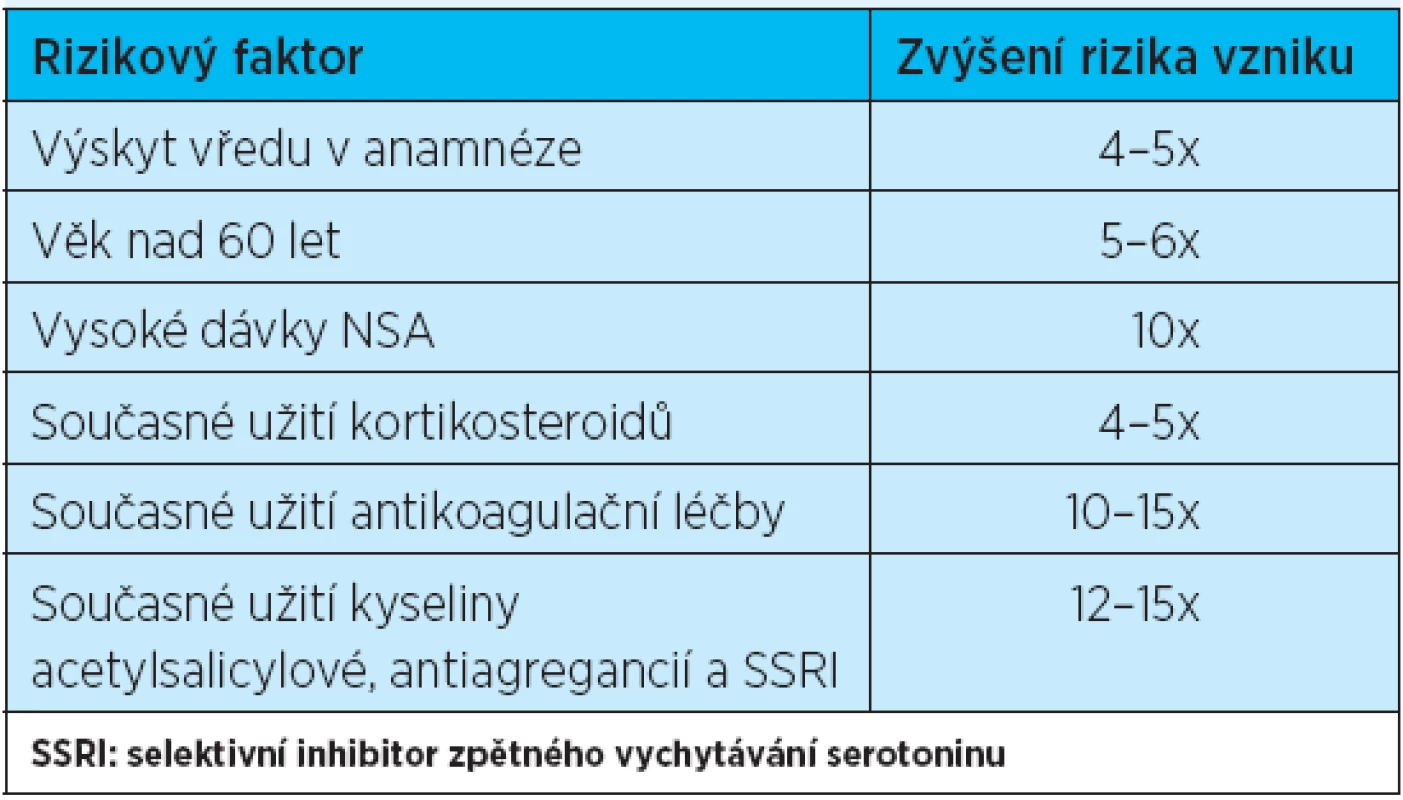
NSA ale mohou způsobovat postižení nejen horního, ale i dolního gastrointestinálního traktu (tab. 2). Jsou také mimo jiné poměrně často příčinou okultního krvácení z dolního traktu. Kromě toho NSA zvyšují riziko krvácení nebo perforace dolního GIT. Analýzy randomizovaných klinických studií hovoří dokonce o tom, že 33–50 % všech vážných nežádoucích účinků se objevuje v oblasti dolního traktu(15). Významné byly proto výsledky studie CONDOR, která sledovala vliv samotného celekoxibu nebo diklofenaku podávaného spolu s inhibitory protonové pumpy na celý GIT(16). Studie probíhala u pacientů s rizikem vředu (prokázaná vředová choroba v anamnéze nebo věk nad 60 let). Bylo zařazeno 4484 jedinců (2238 dostávalo celekoxib; 2246 diclofenak plus omeprazol). 20 (0,9 %) pacientů dostávajících celekoxib a 81 (3,8 %) dostávajících diklofenak plus omeprazol (hazard ratio 4,3, 95 % CI 2,6–7,0; p < 0,0001) splnilo kritéria vzniku gastrointestinální příhody, a to v oblasti horního i dolního gastrointestinálního traktu včetně vzniku krvácení z GIT nebo vzniku významné anemie.114 (6 %) pacientů léčených celekoxibem oproti 167 pacientům (8 %) léčených diklofenakem plus omeprazolem předčasně ukončilo studie z důvodu nežádoucích GI účinku (p = 0,0006). V této studii byl tedy prokázán menší vývoj sledovaných nežádoucích příhod v celém GIT u celekoxibu v porovnání s kombinovanou léčbou diklofenakem + omeprazolem, neboť inhibitor PPI chrání při užívání NSA před poškozením pouze jeho horní část.
Tab. 2. Gastrointestinální toxicita spojená s užíváním NSA 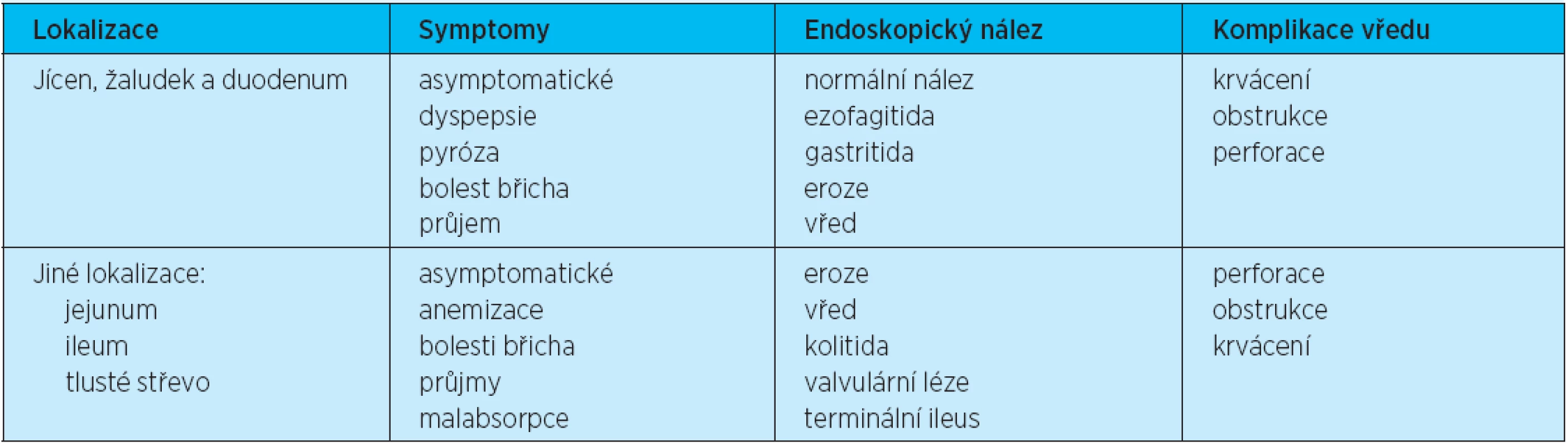
Nežádoucí účinky v oblasti kardiovaskulárního aparátu
Koxiby byly vyvinuty za účelem snížení rizika gastro-intestinálních nežádoucích příhod. V souvislosti se studií VIGOR, kdy byl ověřován efekt léčby rofekoxibem u pacientů s revmatoidní artritidou v porovnání s naproxenem, se ovšem začal diskutovat možný negativní vliv koxibů na kardiovaskulární aparát, neboť v této studii byl prokázán 5x častější výskyt nefatálního infarktu myokardu u pacientů léčených rofekoxibem v porovnání s naproxenem. Výsledky dalších studií s rofekoxibem nakonec vedly ke stažení rofekoxibu z trhu. Poté se vedly rozsáhlé diskuze o tom, zda je zvýšené kardiovaskulární riziko rofekoxibu důsledkem „class-efektu celé skupiny koxibů“ nebo přímo „class efektem celé skupiny NSA“. Výsledky jednotlivých klinických i epidemiologických studií týkající se KV bezpečnosti ostatních koxibů byly značně nesourodé a rozporuplné, u neselektivních NSA rozsáhlejší klinické studie chybí. Zprávy o KV účinku neselektivních NSA vycházejí spíše z populačních observačních studií(17–19), přičemž v některých z nich se naopak diskutoval jejich možný kardioprotektivní vliv. V roce 2011 byly v British Medical Journal publikovány výsledky studie zabývající se kardiovaskulární bezpečností nesteroidních antirevmatik(20). Do této metaanalýzy bylo zahrnuto celkem 116 429 pacientů z 31 studií, přičemž pacienti zde byli léčeni NSA celkem 115 000 tzv. pacientských roků. V porovnání s placebem měl nejvyšší kardiovaskulární riziko rofekoxib (RR = 2,12; 95 % CI 1,25–3,56), dále pak lumirakoxib (RR = 2,0; 95 % CI 0,71–6,21). Nejvyšší riziko cerebrovaskulárních příhod měl ibuprofen (RR = 3,36; 95 % CI 1,00–11,6) a diklofenak (RR = 2,86; 95 % CI 1,09–8,36). Etorikoxib (RR = 4,07; 95 % CI 1,23–15,7) a diklofenak (RR = 3,98; 95 % CI 1,48–12,7) byly asociovány s nejvyšším výskytem úmrtí z kardiovaskulárních příčin.
Recentní práce tak podporují názor, že výskyt KV příhod zvyšují všechna NSA, a to selektivní i neselektivní. Z neselektivních NSA má největší riziko pravděpodobně diklofenak, ze selektivních NSA pak nejvyšší riziko bylo zjištěno pro rofekoxib, který byl poté také stažen z trhu. Pro celekoxib bylo vyšší riziko zjištěno jen v menšině studií, a to především ve vyšších dávkách. Etorikoxib je asociován s vyšším výskytem hypertenze a vyšším výskytem úmrtí z kardiovaskulárních příčin v porovnání s celekoxibem. Kromě selektivních i neselektivních NSA bylo dokonce prokázáno, že riziko vzniku KV příhod zvyšuje i pravidelné užívání acetaminofenu(19).
Z kardiovaskulárního hlediska se z neselektivních NSA považuje za nejbezpečnější naproxen, u kterého bylo in vivo prokázáno, že pokud je podáván v dávce 2 x 500 mg denně, inhibuje biosyntézu tromboxanu podobně jako nízké dávky KAS.
Neselektivní NSA, stejně jako koxiby, ovlivňují také výši krevního tlaku a zvyšují výskyt srdečního selhání. V epidemiologických studiích bylo prokázáno, že užívání jakéhokoliv NSA vede v populaci ke dvojnásobnému zvýšení hospitalizace pro srdeční selhání, vliv je samozřejmě vyšší u pacientů s preexistujícím srdečním onemocněním(21). Riziko je závislé na dávce podávaného NSA a je poněkud vyšší během prvního měsíce podávání.
Při předpisu NSA musíme tedy vždy sledovat, jaký je poměr výše gastrointestinálního i kardiovaskulárního rizika u daného pacienta. Z výsledků metaanalýzy studií sledujících nežádoucí kardiovaskulární i gastrointestinální účinky různých NSA vyplývá, že u mnohých NSA máme nedostatek informací o poměru jejich rizika a benefitu, údaje o některých nežádoucích účincích (například hemorhagická cévní mozková příhoda) jsou velmi sporé(22). Přesnější odpověď by samozřejmě přinesly prospektivní randomizované studie provedené jak s koxiby, tak s různými neselektivními NSA, jejich realizace je však z mnoha důvodů velmi obtížná (potřeba mnohaměsíčního podávání k ověření kardiotoxicity, otázka financování studií generickými firmami atd.). Jisté však je, že naopak existují důkazy o nižším výskytu vážných nežádoucích účinků v oblasti horního i dolního GIT při podávání koxibů v porovnání s neselektivními NSA.
NSA a osteoartróza
Jedním z velmi častých důvodů, kdy jsou pacientům předepisována NSA, je osteoartróza (OA), která představuje nejčastěji se vyskytující kloubní onemocnění.
Bolest u OA může mít svůj původ v oblasti entezí, ligament, burz v okolí postiženého kloubu, v důsledku intraartikulární hypertenze, synovitidy, spasmu svalů, subchondrálních mikrofraktur atd. Důležitým aspektem je fakt, že zatímco v dřívějších letech byla osteoartróza považována za degenerativní onemocnění, kde důvodem je stárnutí chrupavky, dnes převládá názor, že v patogenezi OA hraje důležitou úlohu zánět(23). V posledních letech byla publikována doporučení EULAR (European League Against Rheumatism) při léčbě OA v oblasti kyčle, kolena a rukou(24–26). Léčba OA by dle těchto doporučení měla být vedena individuálně a měly by při ní být využity farmakologické i nefarmakologické postupy. Podle doporučení EULAR má být při léčbě bolesti u OA používán na prvním místě paracetamol, při jeho nedostatečném efektu volíme pak nesteroidní antirevmatika. Začínáme vždy nižšími dávkami a hledáme co možná nejnižší účinnou dávku. Měli bychom pokud možno vždy začínat s terapií NSA s krátkým poločasem, zásadně je používáme v režimu „on demand“, tedy pacient si je bere pouze v případě bolesti, nikoliv pravidelně, v denním užívání. S výhodou můžeme užívat při léčbě OA i NSA v lokální podobě, například ve formě mastí, gelů, sprejů atd. Výhodou NSA je, že jsou nenávyková a mají výrazný analgetický a antiflogistický efekt, který spočívá v inhibici syntézy prostaglandinů, mediátorů zánětu a bolesti. Z tohoto důvodu v případě zánětlivé dekompenzace osteoartrózy užíváme NSA jako lék první volby, kdy dáváme krátkodobě plné protizánětlivé dávky NSA. NSA při léčbě OA můžeme kombinovat, případně alterovat i s opioidy (například s tramadolem).
Bylo prokázáno, že NSA mohou mít negativní vliv i na metabolismus chrupavky ve smyslu snížení syntézy proteoglykanů a kyseliny hyaluronové v chondrocytech. Ve studiích in vitro bylo zjištěno, že v tomto smyslu je k chondrocytům šetrnější kyselina tiaprofenová, diklofenak, oxikamy a koxiby, naopak negativně působí indometacin, pyrazolidiny a salicyláty. Neexistuje příliš mnoho studií, které by negativní působení NSA na chrupavku prokázaly in vivo. V jedné klinické studii bylo zjištěno, že u čekatelů na operaci kyčle docházelo k rychlejší progresi koxartrózy u pacientů, kteří užívali pravidelně indometacin v porovnání s pacienty, kteří dostávali azapropazon(27). Ve studii LINK bylo zjištěno, že pacienti po ročním užívání 3x 25 mg indometacinu denně měli rychlejší progresi gonartrózy v porovnání s placebem, zatímco u pacientů užívajících kyselinu tiaprofenovou 2x 300 mg tato rychlejší progrese gonartrózy zjištěna nebyla(28). Studie však probíhala pouze rok, po zjištění progrese OA po indometacinu byla zastavena z etických důvodů.
V roce 2012 byly publikovány výsledky systematického přehledu klinických studií u pacientů s osteoartrózou, kde bylo potvrzeno, že diklofenak zůstává nejčastěji používaným NSA u osteoartrózy, neboť u něj byl opakovaně prokázán významný efekt na uvolnění bolesti. Proto je dodnes diklofenak v klinických studiích nejčastějším komparátorem používaným při vývoji nových léků určených k léčbě bolesti u osteoartrózy(29).
Užití NSA u revmatoidní artritidy
U pacientů s revmatoidní artritidou (RA) NSA používáme k léčbě bolesti, otoků i ztuhlosti kloubů i měkkých tkání. Pokud pacient nemá kontraindikace k podávání NSA, používáme v době aktivity onemocnění plné protizánětlivé dávky. Je třeba ale zdůraznit, že NSA mají u pacientů s RA pouze symptomatický efekt, nebyl u nich prokázán žádný vliv na průběh onemocnění ani na zpomalení rentgenové progrese.
NSA a ankylozující spondylitidy
U ankylozující spondylitidy jsou naopak NSA lékem první volby. Pokud nejsou žádné kontraindikace, pacient by měl při aktivitě onemocnění dostávat plnou denní dávku NSA, neboť bylo prokázáno, že jejich dlouhodobé podávání vede ke zpomalení rentgenové progrese onemocnění(30). Pacienti užívají NSA obvykle jako monoterapii, často mnoho let (desetiletí). S výhodou užíváme nesteroidní antirevmatika s delším poločasem (například meloxicam nebo β-cyklodextrinpiroxicam). Ten umožňuje jednoduché podávání NSA jedenkrát denně a například při jejich večerním podání účinek přetrvává celou noc a dále i v ranních hodinách, kdy mívá pacient maximum potíží. Z COX-2 selektivních či preferenčních preparátů, které snižují výskyt nežádoucích gastrointestinálních příčin, byly úspěšně u ankylozující spondylitidy zkoušeny například meloxicam nebo celekoxib.
Lékové interakce NSA
Nesteroidní antirevmatika jsou jedny z nejčastěji užívaných léků. Často jsou používána u starších, polymorbidních pacientů, kteří užívají i řadu jiných léků, proto může při jejich podávání docházet k mnohým interakcím. Interakce mohou být farmakokinetické nebo farmakodynamické.
Nejdůležitější je interakce mezi NSA a perorálními antidiabetiky, antikoagulancii, antihypertenzivy, antikonvulzivy a lithiem. K těmto interakcím dochází nejčastěji z důvodu metabolizace stejným mikrozomálním systémem P-450 v játrech. Další interakce vzniká kompetitivní vazbou na bílkoviny plazmy, kdy podání dalšího léčiva společně s NSA může vést ke zvýšení plazmatické koncentrace (indometacin) nebo k jejímu snížení (ibuprofen, naproxen). NSA dále snižují odpověď na diuretika, především pak kličková. Tento efekt je způsoben sníženou syntézou prostaglandinů. NSA také oslabují účinek inhibitorů angiotenzin-konvertujícího enzymu, především v důsledku retence sodíku. Hlavní interakce NSA s různými farmaky ukazuje tabulka 3.
Tab. 3. Interakce NSA s jinými léky 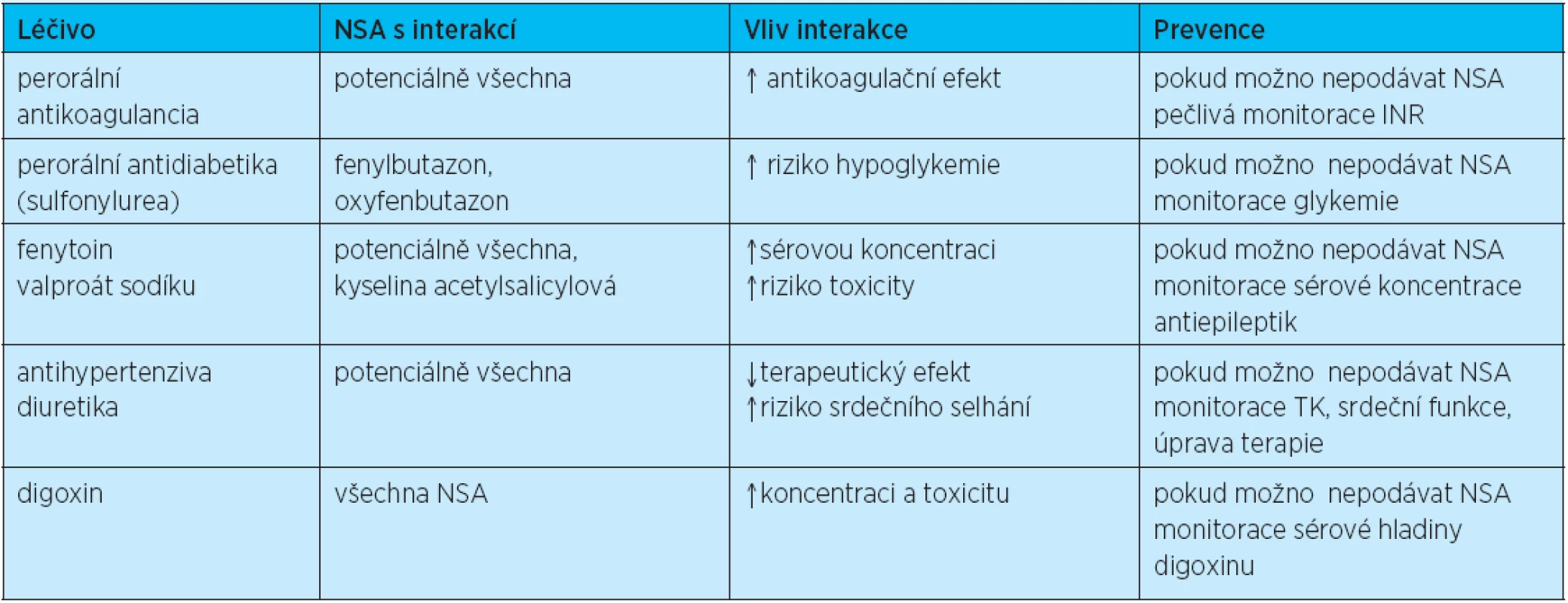
Důležitá může být i interakce NSA s methotrexátem (MTX). Byla popsána interakce mezi MTX a současně podávanými salicyláty, která vede k vyšším plazmatickým hladinám MTX a jeho sníženému vylučování ledvinami. Snížené tubulární vylučování MTX bylo popsáno i po fenylbutazonu a ketoprofenu. Naopak bylo prokázáno, že některá NSA vylučování MTX neovlivňují (celekoxib). Klinicky významná interakce se může vyskytnout také mezi NSA a cyklosporinem, především u fenylbutazonu a indometacinu.
Rozsáhlé kohortové studie prokázaly, že současné užívání aspirinu redukuje riziko vzniku kardiovaskulárních příhod, pokud je aspirin podáván spolu s rofekoxibem, celekoxibem, sulindakem, meloxikamem a indometacinem, jeho účinek však může být snižován současným podáváním ibuprofenu nebo naproxenu(31). Bylo prokázáno, že při současném podávání ibuprofenu nebo naproxenu a kyseliny acetylsalicylové dochází k farmakodynamické interakci mezi oběma léky. Dle doporučení amerického Úřadu pro kontrolu potravin a léčiv FDA (Food and Drug Administration) tato farmakodynamická interakce může být minimalizována, pokud je ibuprofen podán nejméně 8 hodin před nebo nejméně 30 minut po podání KAS, naproxen by měl být podáván 2 hodiny po kyselině acetylsalicylové.
Lokální nesteroidní antirevmatika
Řadu let se diskutuje účinnost lokální aplikace NSA, kdy snahou je vyhnout se celkovým nežádoucím účinkům NSA při jejich systémovém podávání. Výsledky řady metaanalýz i studií z posledních let dokládají, že i lokálně podávaná NSA mají své terapeutické účinky.
Účinnost lokálních NSA je dokumentovaná především u tupých poranění i mimokloubního revmatismu(32). Tato onemocnění nejsou ale přesně definována, skupiny jsou značně heterogenní a onemocnění mají také tendenci spontánně ustupovat. V metaanalýze 34 klinických studií u pacientů s chronickou muskuloskeletální bolestí byla prokázána úleva od bolesti větší v porovnání s placebem, u lokálně podávaného diklofenaku byl efekt obdobný jako efekt perorálně podávaných NSA u pacientů s osteoartrózou rukou a kolen(33).
Nejvíce studií týkajících se artropatií bylo provedeno u osteoartrózy kolenních kloubů(34). Americká revmatologická společnost ACR (American College of Rheumatology) i evropská EULAR ve svých doporučeních již účinnost lokálních antirevmatik akceptují. Dosud ale neexistují výsledky studií zabývajících se účinností lokálních NSA v léčbě zánětlivých revmatických onemocnění. Výhody i nevýhody podávání lokálních NSA udává tabulka 4.
Tab. 4. Výhody a nevýhody aplikace lokálních nesteroidních antirevmatik 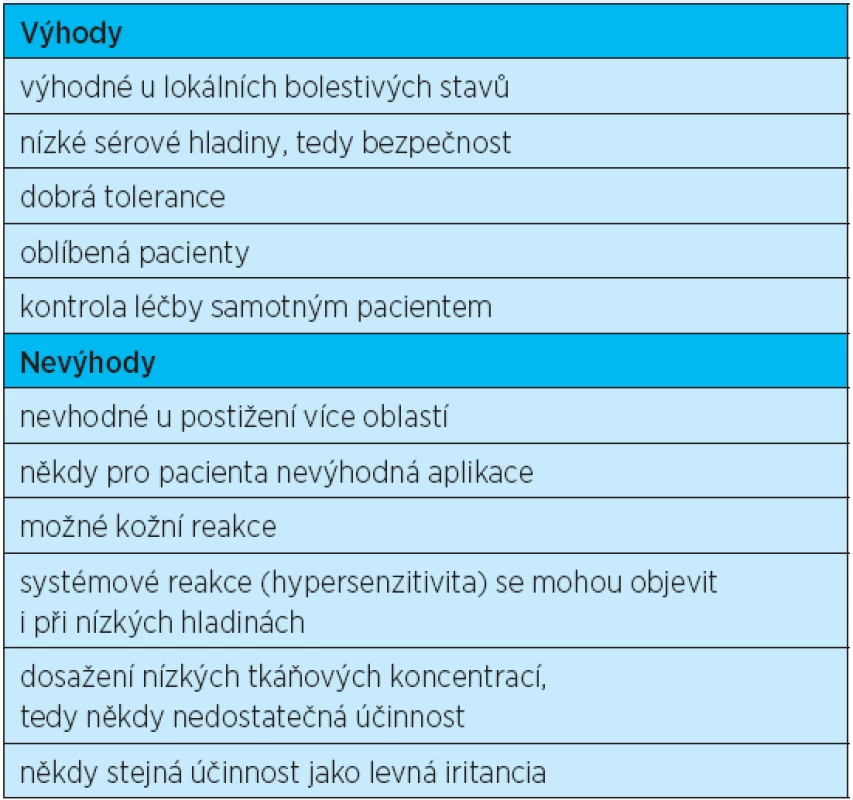
Nejvíce pozitivních studií o účinnosti lokálních NSA existuje u tupých poranění dolních končetin. Studie proběhly i u chronických onemocnění, jako je periarthritis humeroscapularis. V indikaci akutních poranění bylo prokázáno, že indometacin podávaný ve spreji má stejnou účinnost jako perorální indometacin. Nežádoucí účinky lokálních NSA lze rozdělit na lokální (kožní) a systémové. Kožní reakce se vyskytují u 1–2 % pacientů. Nejčastěji se jedná o erytém, pruritus, iritaci kůže, pocity pálení kůže a dermatitidu. Rozdíly mezi jednotlivými přípravky jsou dosud nejasné, byly popsány i případy reakcí po placebu, kdy se pravděpodobně jednalo o reakci na vehiculum. Vážnější reakce byly popisovány po lokální aplikaci ketoprofenu, nicméně dle prohlášení EMEA z roku 2010 dosud převyšuje užitek nad rizikem při této aplikaci, pacient nicméně musí být upozorněn na možnost vzniku fotosenzitivní reakce a nutnost ochrany kůže před sluncem po potření kůže(35). Z tohoto důvodu byl ketoprofen ve formě mastí a gelů stažen z volného trhu. Systémové nežádoucí účinky lokálních NSA jsou zcela výjimečné. Může se jednat o gastrointestinální, renální nebo kardiovaskulární účinky a reakce z přecitlivělosti. Byly zaznamenány i astmatické záchvaty nebo bronchospasmus po podání lokálního NSA.
Lokální NSA jsou dostupná v řadě galenických forem (tab. 5). Existuje i řada generik, a proto jejich počet dosahuje v současnosti několika stovek. Za indikace lokálních NSA tedy dnes považujeme léčbu tupých poranění, lokalizované formy mimokloubního revmatizmu i incipientní formy osteoartrózy, především kolen a drobných ručních kloubů. Hlavní indikace podávání lokálních NSA ukazuje tabulka 6.
Tab. 5. Dostupné formy lokálních nesteroidních antirevmatik 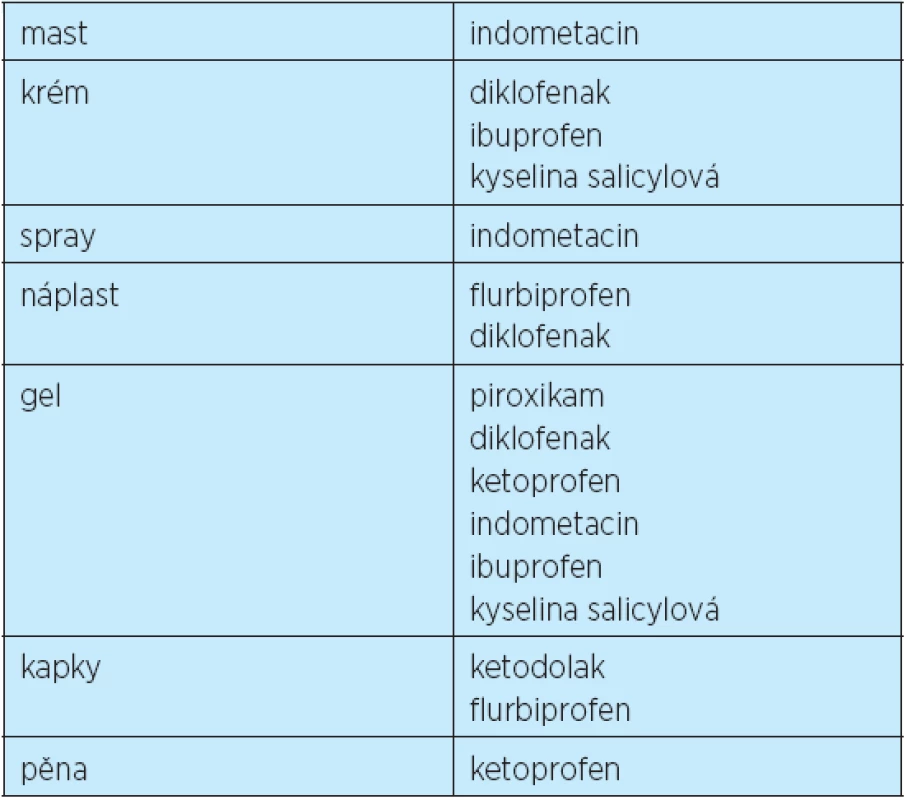
Tab. 6. Hlavní indikace pro lokální nesteroidní antirevmatika 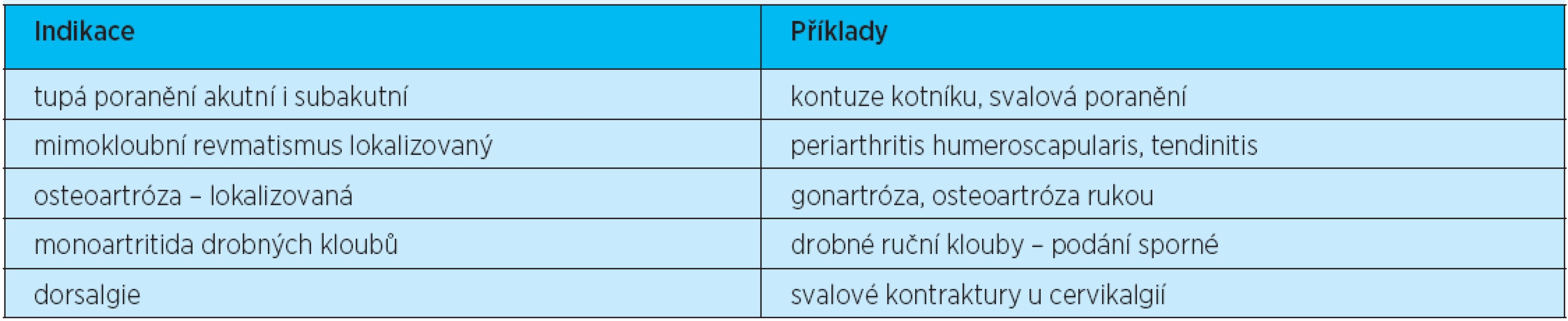
Jak postupovat při předpisu NSA
Lékaři by měli vždy předpisovat co nejnižší dávku NSA, a to po co možná nejkratší dobu(2, 36). Pacienti s anamnézou vředové choroby by měli být testováni na infekci Helicobacter pylori před zahájením léčby NSA, a pokud je tato prokázána, infekce by měla být eradikována. U starších pacientů i u dalších pacientů s poruchou renálních funkcí bychom se měli vyhnout předpisu NSA s dlouhým poločasem, neboť hrozí větší riziko vzniku všech nežádoucích účinků, mimo jiné i v oblasti ledvin (tabulka 7).
Tab. 7. Nežádoucí renální účinky nesteroidních antirevmatik 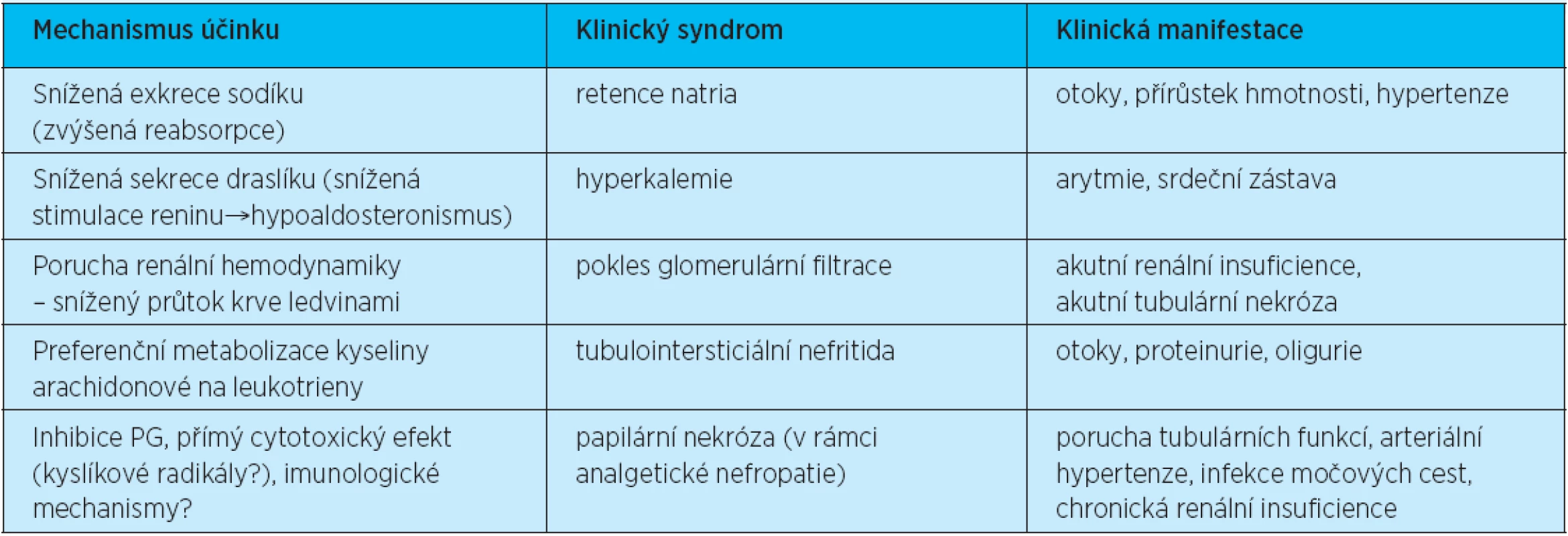
U pacientů s nízkým KV rizikem má být NSA předepisováno dle výše rizika vzniku GI a KV příhody (tab. 8)(2). Pacienti s nízkým KV i GI rizikem by měli být léčeni neselektivními NSA, pacienti se středně vysokým GI rizikem by měli dostávat neselektivní NSA + PPI nebo koxiby. Pacienti s vysokým GI rizikem mohou být léčeni koxiby + PPI, pokud má ale pacient současně vysoké KV riziko, podávání NSA není vhodné.
Tab. 8. Doporučení pro podávání NSA dle výše gastrointestinálního (GI) a kardiovaskulárního (KV) rizika (podle literatury <sup>2</sup>) 
Dříve se ještě doporučovalo podávat tzv. preferenční NSA (nimesulid, meloxikam), dnes však od tohoto dělení bylo upuštěno a nimesulid i meloxikam se řadí mezi neselektivní NSA. Nimesulid je kromě toho podle nejnovějšího doporučení EMEA možno podávat pouze pro indikaci akutní bolesti, a to nejdéle po dobu 14 dnů, osteoartróza ani zánětlivá revmatická onemocnění nejsou dnes indikacemi pro jeho předpis. U pacientů s vyšším kardiovaskulárním rizikem je vhodné podávat naproxen, při současně zvýšeném gastrointestinálním riziku je pak vhodné se podání NSA raději vyhnout. Přehled nejčastěji užívaných NSA ukazuje tabulka 9.
Tab. 9. Příklady běžně užívaných NSA 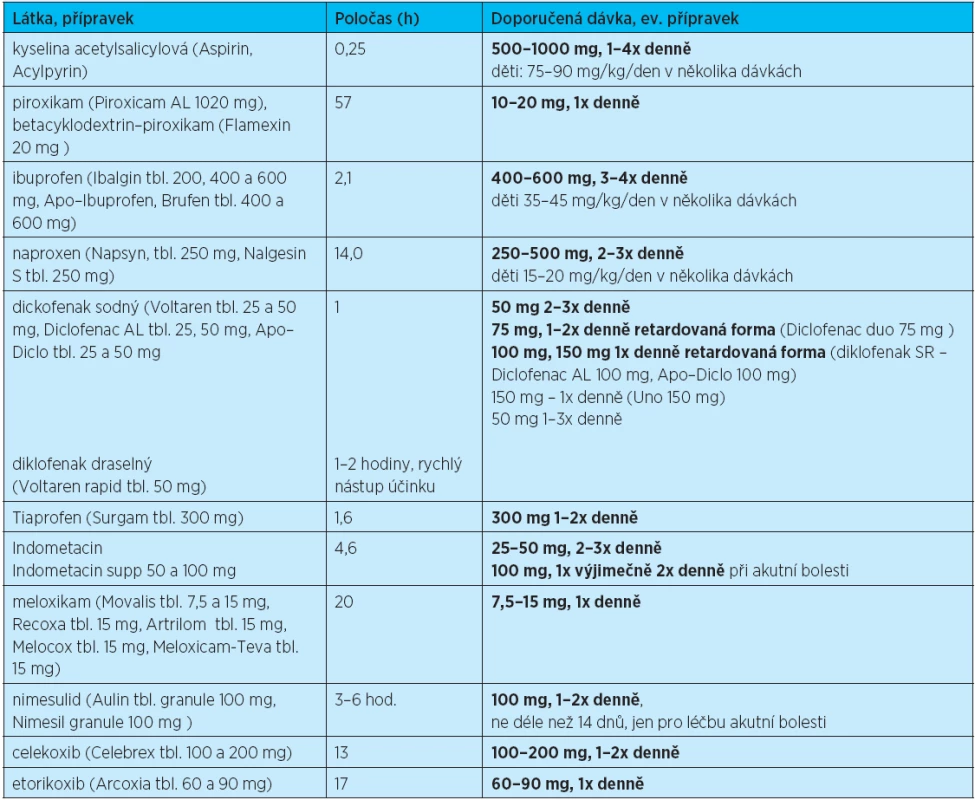
Závěr
Nesteroidní antirevmatika zůstávají pro svůj dobrý analgetický a antiflogistický efekt stále jednou z nejčastěji předepisovaných skupin léků. Jejich podávání však může být provázeno řadou vážných komplikací, což je nutné zohlednit především proto, že NSA jsou často podávána starším a tedy polymorbidním pacientům. NSA mají být proto užívána co nejkratší dobu a v co nejnižší dávce, s výhodou je vhodné současně s NSA používat inhibitory protonové pumpy. Musí být brán vždy v potaz poměr kardiovaskulárního a gastrointestinálního rizika, zároveň je ale třeba zdůraznit, že pravděpodobnost a závažnost možných nežádoucích účinků se liší u jednotlivých pacientů, ale závisí i na typu preparátu, jeho dávce i délce podávání.
Na závěr je nutno připomenout, že tlumení bolesti vede k funkčnímu zlepšení a ke zvýšení kvality života pacienta. Je třeba si ale uvědomit, že samotná bolesti má ale i jistou ochrannou funkci, která chrání nemocný kloub před jeho přetěžováním a tím i před další traumatizací. Měli bychom se tedy pokud možno vždy snažit léčit prvotní příčinu bolesti, samotné snížení bolesti nemůže být jediným cílem terapie.
MUDr. Šárka Forejtová
Revmatologický ústav Praha
MUDr. Šárka Forejtová
e-mail: fore@revma.cz
Promovala na FVL UK roku 1987. V roce 1991 absolvovala atestaci z vnitřního lékařství I. stupně, v roce 1997 atestaci z vnitřního lékařství II. stupně a v roce 2000 z revmatologie. V letech 1987–1984 pracovala na interním oddělení nemocnice v Rakovníku, poté v letech 1994–1998 na I. interní klinice FNKV. Od r. 1999 působí jako vedoucí lékařka lůžkového oddělení v Revmatologickém ústavu, současně je odbornou asistentkou Revmatologické kliniky 1. LF UK. Je autorkou a spoluautorkou více než 60 českých a zahraničních publikací, spoluautorkou knihy Revmatologie (2012).
Zdroje
1. Langman MJ, Weil J, Wainwright P et al.: Risk of bleeding peptic ulcer associated with individual nonsteroidal antiinflammatory drugs. Lancet 1994; 343 : 1075–1078.
2. Vonkemann HE, van der Laar M.: Nonsteroidal anti-inflammatory drugs: adverse effects and their prevention. Semin Arthritis Rheum 2010; 39 : 294–312.
3. Pirmohamed M, James S, Meakin S et al.: Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients. BMJ 2004; 329 : 1519.
4. Talley NJ, Evans JM, Fleming KC et al.: Nonsteroidal antiinflammatory drug and dyspepsia in the elderly. Dig Dis Sci l995; 40 : 1345–1350.
5. Allison MC, Howatson AG, Torrance CJ et al.: Gastrointestinal damage associated with the use of non-steroidal anti-inflammatory drugs. N Engl J Med 1992; 327 : 749–754.
6. Singh H, Triadafilopoulos G.: Epidemiology of NSA-induced GI complications. J Rhemuatol 1999; 26 : 18–24.
7. Shah S, Mehta V.: Controversies and advances in nonsteroidal anti-inflammatory drug (NSAID) analgesia in chronic pain managment. Postgrad Med J 2012; 88 : 73–78.
8. Shorr RJ, Ray WA, Daugherty JR et al.: Concurent use of nonsteroidal anti-inflammatory drugs and oral anticoagulants places elderly persons at high risk for hemorrhagic peptic ulcer diseases. Arch Intern Med 1993; 153 : 1665–1670.
9. Rostom A, Dube C, Wells GA et al.: Prevention of NSAID-induced gastroduodenal ulcers (Review). Cochrane Database Syst Rev. 2002; (4): CD002296.
10. Bombardier C, Laine L, Reicin A et al.: Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343(21): 1520–1528.
11. Silverstein FE, Faich G, Goldstein JL et al.: Gastrointestinal toxicity with celekoxib vs. nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis; the CLASS study: a randomized controlled trial. Celekoxib long-therm artrhritis safety study. JAMA 2000; 284(10): 1247–1255.
12. Schnitzer T, Burmester GR, Mysler E et al.: Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), reduction in ulcer complications: randomised controlled trial. Lancet 2004; 364 : 665–674.
13. Hawkey CJ, Gitton X, Hoexter E et al.: Gastrointestinal tolerability of lumiracoxib in patients with osteoarthritis and rheumatoid arthritis. Clin Gastroenterol Hepatol 2006; 4 : 57–66.
14. Fries JF, Williams Ca, Bloch DA et al.: Nonsteroidal anti-inflammatory drugs associated gastropathy: incidence and risk factor model. Am J Med 1991 : 91 : 213–222.
15. Chan FKL, Cryer B, Goldstein JL et al.: A novel composite endpoint to evaluate the gastrointestinal (GI) effects of nonsteroidal antiinflammatory drugs through the entire GI tract. J Rheumatol 2010; 37 : 167–174.
16. Chan FK, Lanas A, Scheiman J et al.: Celecoxib versus omeprazole and diclofenac in patients with osteoarthritis and rheumatoid arthritis (CONDOR): a randomised trial. Lancet 2010; 376(9736): 173–179.
17. Graham DJ, Campen D, Hui R et al.: Risk of acute maocardial infarction and sudden cardiac death in patiens treated with cyclooxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet 2005; 365 : 475–481.
18. Lee TA, Bartle B, Weiss KB.: Impact of NSAIDS on mortality and the effect of preexisting coronary artery disease in US veterans. Am J Med 2007; 120 : 98e9–16
19. Chan AT, Manson JE, Albert CHM et al.: Nonsteroidal Antiinflammatory Drugs, Acetaminophen, and the Risk of Cardiovascular Events. Circulation 2006; 113 : 1578–1590.
20. Trelle S, Reichenbach S, Wandel S et al.: Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ 2011 : 342 : c7086. doi: 10.1136/bmj.c7086.
21. Hudson M, Hugues R, Pilote L.: Differences in outcomes of patiens with congestive heart failure precribed celekoxib, rofecoxib, or non-steroidal anti-inflammatory drug: population based study. BMJ 2005; 330 : 1365–1370.
22. Salvo F, Fourrier-Réglát A, Bazin F et al.: Cardiovascular and gastrointestinal safety of NSAIDs: a systemic review of meta-analyses of randomized clinical trials. Clinical Pharmacology &Therapeutics 2011; 89(6): 855–866.
23. Dieppe PA, Lohmander LS: Pathogenesis and management of pain in osteoarthritis. Lancet 2005; 365 : 965–973.
24. Jordan KM, Arden N, Doherty M et al.: EULAR Recommendation 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Comittee for International Clinical Studies including Therapeutisc Trials (ESCISIT). Ann Rheum Dis 2003; 62 : 1145–1155.
25. Zhang W, Doherty M, Arden N et al.: EULAR evidence based recommendation for the management of hip osteoarthritis: Report of a Task Force of the EULAR Standing Comittee for International Clinical Studies including Therapeutisc (ESCISIT) Ann Rheum Dis 2005; 64 : 669–681.
26. Zhang W, Doherty M, Leeb BF et al.: EULAR evidence based recommendation for the management of hand osteoarthritis: Report of a Task Force of the EULAR Standing Comittee for International Clinical Studies including Therapeutisc (ESCISIT) Ann Rheum Dis 2007; 66 : 377–388.
27. Rashad S, Revell P, Hemingway et al.: Effect of non-steroidal anti-inflammatory drugs on the course of osteoarthritis. Lancet 1989; 2 : 519–522.
28. Huskisson EC, Berry H, Gishen P et al.: Effects of antiinflammatory drugs on the progression of osteoarthritis of the knee. LINK Study Group. Longitudinal Investigation of Nonsteroidal Antiinflammatory Drugs in Knee Osteoarthritis. J Rheumatol 1995; 22 : 1941–1946.
29. Pavelka K. A comparison of the therapeutic efficacy of diclofenac in osteoarthritis: a systemic review of randomised controlled trials. Current Medical Research &Opinion 2012; 28(1): 163–175.
30. Poddubnyy D, Rudwaleit M, Haibel H et al.: Effect of non-steroidal anti-inflammatory drugs on radiographic spinal progression in patients with axial spondylarthritis: results from the German Spondylarthritis Inception Cohort. Ann Rheum Dis 2012; 71 : 1616–1622.
31. Strand V. Are COX-2 inhibitors preferable to non-selective non-steroidal anti-inflammatory drugs in patients with risk of cardiovascular events taking low-dose aspirin? Lancet 2008; 370 : 2138–51.
32. Kuehl K, Carr W, Yanchick J et al.: Analgesic efficacy and safety of the diclofenac epolamine topical patch 1.3 % (DETP) in minor soft tissue injury. Int J Sports Med. 2011; 32(8): 635–643.
33. Derry S, Moore RA, Rabbie R: Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev 2012 Sep 12;9:CD007400. doi: 10.1002/14651858.CD007400.pub2.
34. Trnavský K, Fischer V, Vogtle-Jinkert et al.: Efficacy and safety of 5 % ibuprofen Cream treatment in knee OA. Results of randomised, double-blind , placebo - controlled study. J Rheumatol 2004; 32 : 565–72.
35. EMEA Press Release: European Medicine Agency confirms positive benefit-risk Balance of topical formulations of ketoprofen. London, UK, EMEA, 2010 Doc REl EMA/CHMP/455633/2010.
36. Peters MJL, Symmons DPM, McCarey D et al.: EULAR evidence-based recommendation for cardiovascular risk managment in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2010; 69 : 325–331.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2013 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Perorální antitrombotická léčba v roce 2013 –přehled léčiv, indikace a řešení komplikací léčby
- Aktuální pohled na terapii nesteroidními antirevmatiky u seniorů
- Farmakoterapie u seniorů: „Vybírejte moudře!“
- Symptomatické léky osteoartrózy s dlouhodobým efektem (SYSADOA)
- Deprese ve vyšším věku a její léčba
- Pleiotropní účinek citalopramu u geriatrických nemocných
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ a její využití pro diagnózu geriatrické křehkosti v klinické praxi
- Racionální farmakoterapie ve stáří: Expertní konsensus ČR 2012 v oblasti léčiv a lékových postupů potenciálně nevhodných u seniorů
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Symptomatické léky osteoartrózy s dlouhodobým efektem (SYSADOA)
- Deprese ve vyšším věku a její léčba
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ a její využití pro diagnózu geriatrické křehkosti v klinické praxi
- Racionální farmakoterapie ve stáří: Expertní konsensus ČR 2012 v oblasti léčiv a lékových postupů potenciálně nevhodných u seniorů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




