-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Personalizovaná medicína v diabetológii v kontexte odporúčaní ADA/EASD 2015
Personalized medicine in diabetology in the context of consensual statement of the ADA/EASD 2015
The patient centred approach provides health care that is respectful of and responsive to individual patient preferences, needs, and values, and ensuring that patient values guide all clinical decisions. In their study the authors discuss the approach to defining glycemic targets and to the treatment of patients with type 2 diabetes mellitus in the context of new findings and of the consensual statement of the American Diabetes Association and the European Association for the Study of Diabetes (ADA/EASD) 2015.
Key words:
patient-centred approach – type 2 diabetes mellitus - glycemic targets – pharmacotherapy
Autoři: Vladimír Uličiansky 1; Zbynek Schroner 2; Zuzana Némethyová 3; Peter Galajda 4; Marián Mokáň 4
Působiště autorů: Via medica s. r. o., Košice 1; SchronerMED s. r. o., Košice 2; Dia centrum plus, s. r. o., Bratislava 3; I. interná klinika JLF UK a UNM, Martin 4
Vyšlo v časopise: Forum Diab 2015; 4(2): 102-118
Kategorie: Hlavná téma: prehľadová práca
Souhrn
Prístup zameraný na pacienta je zdravotná starostlivosť s rešpektovaním a s vnímavosťou na individuálne preferencie, potreby a hodnoty pacienta so zaručením, že hodnoty pacienta usmerňujú všetky klinické rozhodnutia. Autori v práci rozoberajú prístup k stanoveniu glykemických cieľov a k liečbe pacientov s diabetes mellitus 2. typu v kontexte nových poznatkov a konsenzuálneho stanoviska Americkej diabetologickej asociácie a Európskej asociácie pre štúdium diabetu (ADA/EASD) 2015.
Kľúčové slová:
diabetes mellitus 2. typu – farmakoterapia – glykemické ciele – prístup zameraný na pacientaPrístup zameraný na pacienta – úvod
História medicíny je spojená s hľadaním odpovede na príčiny, rozpoznávanie a liečbu chorôb. Hľadajú sa rôzne spôsoby ovplyvnenia ochorení, zachovania života a zdravia. Zjednodušene povedané je to hľadanie “kameňa múdrosti” a “elixíru života”. Vedecké poznatky narastajú exponenciálne. Cieľom tejto práce je aktualizácia našej spoločnej publikácie Algoritmus liečby diabetes mellitus 2. typu 2011 v klinickej praxi [1] v kontexte nových poznatkov a odporúčaní medzinárodných odborných spoločností. V roku 2015 sme však urobili posun od algoritmu ku prístupu zameranému na pacienta.
Klasická medicína postupuje od anamnézy cez fyzikálne vyšetrenie a vyšetrovacie postupy k diagnóze, liečbe a prevencii. V našom stredoeurópskom prostredí bol vždy v záujme lekára pacient, za čo môžeme ďakovať našim učiteľom, či už na lekárskych fakultách alebo v klinickej praxi.
V posledných rokoch sa vo svetovej literatúre zdôrazňuje individualizovaný (personalizovaný) prístup k liečbe pacienta [2–4]. Potreba zdôraznenia osobnosti pacienta vznikla v dôsledku zavádzania nových prístupov a technológii do medicíny (odosobnenie, odľudštenie medicíny), snahou o nalinkovanie jednotných diagnostických a terapeutických postupov pre všetkých pacientov s preferenciou len účinnosti a nákladovej efektívnosti v dôsledku rôznych organizačných, ekonomických a sociálnych faktorov v poskytovaní zdravotnej starostlivosti v rôznych krajinách sveta.
Ďalším dôvodom bolo konštatovanie, že medicína dôkazov (evidence based medicine – EBM) nedokáže zodpovedať všetky otázky klinickej praxe. EBM poskytuje hierarchiu dôkazov pre klinické rozhodovanie na základe vopred definovaných kritérií. Randomizované kontrolované klinické štúdie (RKŠ) sú zamerané na vybrané populácie pacientov, ktorí sú zaraďovaní na základe inklúznych a exklúznych kritérií, nie sú generalizované na širšie populácie a nie sú individualizované na špecifického pacienta. RKŠ pri liečbe diabetu sú zvyčajne krátke na to, aby mohli dokumentovať úspešnosť pri dlhšom podávaní účinnej látky. Týka sa to ako vplyvu na metabolickú kompenzáciu, tak predovšetkým na ovplyvnenie chronických komplikácií alebo v posledných rokoch diskutovaného hodnotenia kancerogenity niektorých látok [5]. Terapeutické závery RKŠ sú založené na štatistickom hodnotení (priemer, medián a podobne). Strácajú sa špecifiká pacienta, ktorý reaguje na liečbu nedostatočne alebo veľmi dobre. Lekár má však pred sebou individuálneho pacienta. Zodpovedá tento pacient typickému pacientovi z RKŠ? Dajú sa na neho aplikovať výsledky z RKŠ? Medicínska prax prináša často otázky, na ktoré nemôžu dať odpoveď RKŠ. Medicínske rozhodnutia často vychádzajú z klinických skúseností a znalostí lekára za predpokladu ich racionálneho zhodnotenia [4–7].
V literatúre a aj na kongresoch sa často diskutuje o prístupe zameranom na pacienta, o prístupe zameranom na zákazníka (pozícia pacienta sa presúva na zákazníka, klienta či spotrebiteľa zdravotnej starostlivosti) a o personalizovanej medicíne. Terminológia rôznych autorov sa často prekrýva, čím môžu nastať určité nedorozumenia.
Personalizovaná medicína (PM) môže byť definovaná rôznym spôsobom:
- PM je multidisciplinárny vedný odbor, ktorý sa na rôznych úrovniach zaoberá optimalizáciou liečených a diagnostických postupov u konkrétneho pacienta s využitím moderných metód informatiky.
- PM je filozofia v zdravotnej starostlivosti, ktorá smeruje k využívaniu nových inovatívnych biotechnológií pri predikcii ochorení a ku vývoju správne načasovanej prevencie a k plánovaniu individuálnej terapie.
- PM využíva poznatky genomiky a iných technológií molekulovej biológie v klinickej starostlivosti. Vývoj PM s použitím -omics technológií (genomics, transcriptomics, epigenomics, proteomics, metabolomics, lipomics a iné) a s definovaním biomarkerov (diagnostických, rizikových, prognostických a prediktívnych) poskytuje nové možnosti na liečbu pacientov, ktoré môžu viesť k lepšej cielenej liečbe, k vyhnutiu sa medicínskych chýb a k zníženiu nežiaducich účinkov liekov [7–12].
- Podľa názoru expertov Európskej komisie (European Commision) personalizovaná medicína nie je revolúcia, ale evolúcia. Očakávajú sa však nové poznatky na tomto rýchlo rastúcom poli [13].
Prístup zameraný na pacienta je definovaný ako zdravotná starostlivosť s rešpektovaním a s vnímavosťou na individuálne preferencie, potreby a hodnoty pacienta so zaručením, že hodnoty pacienta usmerňujú všetky klinické rozhodnutia. V konečnom dôsledku pacient rozhoduje o zmene životného štýlu a do určitej miery aj o farmakologickej liečbe. Pri spoločnom rozhodovacom procese sú lekár a pacient vzájomnými partnermi pri zvažovaní diagnostických a terapeutických možností [3,14]. Má to však aj druhú stranu mince. Medicína prináša nové možnosti, nové postupy, ktoré bude možné zo strany pacienta prijať alebo odmietnuť – prijať to, čo bude technicky a ekonomicky možné, ale aj ľudsky prijateľné. Klasicky je v rozhodovacom procese hlavným faktorom lekár. Etické (a zároveň požadované z právneho hľadiska) je, aby pacient sám zaujal stanovisko k návrhu lekára na možný liečebný postup. Vynára sa tu však otázka, či je kompetentný alebo či dokáže kompetentne posúdiť možný úžitok s definovanou mierou rizika [15].
Názory na liečbu DM a na význam glykemickej kompenzácie sa v priebehu rokov neustále menia. Aj niektoré názory publikované v konsenzuálnych stanoviskách Americkej diabetologickej asociácie a Európskej asociácie pre štúdium diabetu (ADA/EASD) v rokoch 2009, 2012 a 2015 boli rôzne podľa toho, aké boli dostupné dôkazy v rámci EBM. Je v nich možné pozorovať posun od striktnejšieho algoritmického prístupu k voľnejšiemu výberu liekov, znížili sa obavy ohľadom pankreatickej alebo onkologickej bezpečnosti niektorých liekových skupín, otvorené sú otázky najoptimálnejšej kombinácie liekov a ďalšie [3,16,17].
Aký je najnovší odkaz v aktualizovanom stanovisku ADA/EASD Manažment hyperglykémie pri diabetes mellitus 2. typu, 2015: Prístup zameraný na pacienta?
Hlavným cieľom liečby diabetes mellitus 2. typu (DM2T) zostáva glykemická kompenzácia v kontexte zníženia kardiovaskulárnych rizikových faktorov:
- prestať fajčiť
- zdravý životný štýl
- kontrola krvného tlaku
- manažment lipidov s prioritou statínovej liečby
- antiagregačná liečba (v niektorých prípadoch)
Význam zníženia glykémie na základe veľkých klinických štúdií:
- zníženie glykémie odďaľuje začiatok a progresiu mikrovaskulárnych komplikácií
- vplyv glykemickej kompenzácie na kardiovaskulárne komplikácie ostáva neurčitý; je však prítomný mierny priaznivý účinok, ktorý sa prejavuje po mnohých rokoch zlepšenej kompenzácie
- výrazne agresívna snaha o kompenzáciu u starších ľudí s pokročilým ochorením nemusí mať signifikantný priaznivý účinok a môže predstavovať určité riziko
- namiesto uniformného prístupu ku glykemickej kompenzácii je nevyhnutná personalizácia s vyvážením benefitov kontroly glykémie s jej potenciálnymi rizikami, so zohľadnením nežiaducich účinkov liekov znižujúcich glykémiu (predovšetkým hypoglykémie) a okrem iných okolností aj veku pacienta a jeho zdravotného stavu [17]
Ako postupovať v klinickej praxi?
Individualizovaný prístup zameraný na pacienta z pohľadu glykemickej kompenzácie zahŕňa tieto prvky: zhodnotenie celkového klinického stavu chorého, určenie stupňa rozvoja ochorenia, stanovenie individualizovaných glykemických cieľov a individualizovaný výber terapie so znalosťou vlastností lieku pri rešpektovaní osobnosti pacienta. Dôležité je zvážiť stupeň edukácie, sociálne zázemie, náklady a systém zdravotnej starostlivosti (schéma 1).
Schéma 1. Individualizovaný prístup zameraný na pacienta 
Všeobecné ciele glykemickej kompenzácie podľa odborných spoločností ADA/EASD 2015 a AACE/ACE2015 sú v tab. 1 [18,19].
Tab. 1. Ciele glykemickej kompenzácie 
* zameranie na postprandiálnu glykémiu môže byť vtedy, ak neboli dosiahnuté ciele HbA1c napriek dosiahnutiu preprandiálnych glykemických cieľov ADA/EASD, American Diabetes Association/the European Association for the Study of Diabetes AACE/ACE, American Association of Clinical Endocrinologists/American College of Endocrinology Je dokázané, že zníženie HbA1c na hodnoty 7 % DCCT (53 mmol/mol) alebo menej znižuje výskyt mikrovaskulárnych komplikácií. Ak tieto hodnoty boli dosiahnuté včasne po stanovení diagnózy DM, sú asociované s dlhodobým znížením makrovaskulárnych ochorení [18].
Spôsob stanovenia cieľových hodnôt HbA1c a pri výbere liečby DM môže byť rôzny.
Prínosné je použitie postupu podľa autorov Pozzilli et al [2] na základe hodnôt glykovaného hemoglobínu (HbA1c), veku, telesnej hmotnosti, komplikácií a dĺžky trvania DM – v skratke: A1C and ABCD (Age, Body weight, Complications and Disease Duration). Kým u pacienta do 40 rokov, s krátkou dĺžkou trvania DM a bez chronických komplikácií DM je možné sa usilovať o tesnú metabolickú kompenzáciu HbA1c v rozmedzí od 6 do 6,5 % DCCT (42,1–47,5 mmol/mol), u pacienta nad 70 rokov s dĺžkou trvania DM nad 10 rokov a s prítomnými vaskulárnymi komplikáciami DM by mali byť liečebné ciele menej prísne – HbA1c 7–8 % DCCT(53–63,9 mmol/mol).
Ismail-Beighi et al [20] publikovali spôsob individualizácie glykemických cieľov, ktorý bol následne upravovaný v odporúčaniach ADA/EASD 2012 a 2015. Všeobecná cieľová hodnota HbA1c je < 7 % DCCT (53 mmol/mol). Pri modifikácii intenzity znižovania glykémie sa berú do úvahy tieto faktory: riziká potenciálne spojené s hypoglykémiou a ďalšími nežiaducimi účinkami liekov, dĺžka trvania ochorenia, očakávaná dĺžka života, dôležité komorbidity, dokázané cievne komplikácie, postoj pacienta a očakávané terapeutické úsilie, zdroje a podporný systém. Autori predpokladajú, že adherencia pacienta sa môže edukáciou zlepšiť a že je možné optimalizovať starostlivosť v kontexte s bežným zdravotným poistením alebo finančnými prostriedkami pacienta.
Podľa ADA 2015 striktné ciele HbA1c < 6,5 % DCCT (47,5 mmol/mol) sú vhodné vtedy, ak sa môžu dosiahnuť bez signifikantnej hypoglykémie alebo iných nežiaducich účinkov liečby. Môže ísť o pacientov s krátkym trvaním DM, o pacientov liečených režimovými opatreniami alebo len metformínom, s dlhou očakávanou dĺžkou života a bez signifikantného kardiovaskulárneho ochorenia [18].
Menej striktné ciele < 8,0 % DCCT (63,9 mmol/mol) sú vhodné u pacientov s anamnézou ťažkých hypoglykémií, s limitovanou očakávanou dĺžkou života, s pokročilými mikrovaskulárnymi alebo makrovaskulárnymi komplikáciami, so závažnými sprievodným ochoreniami a s dlhotrvajúcim DM, u ktorých je problematické dosiahnuť všeobecné glykemické ciele napriek edukácii, primeranému selfmonitoringu glykémií a účinným dávkam viacerých antidiabetických liekov, včítane inzulínu [18].
Raz et al [4] definovali pacientov, u ktorých nie sú vhodné štandardné ciele HbA1c (tab. 2).
Tab. 2. Skupina pacientov, u ktorých nie sú vhodné štandardné ciele HbA<sub>1c</sub> 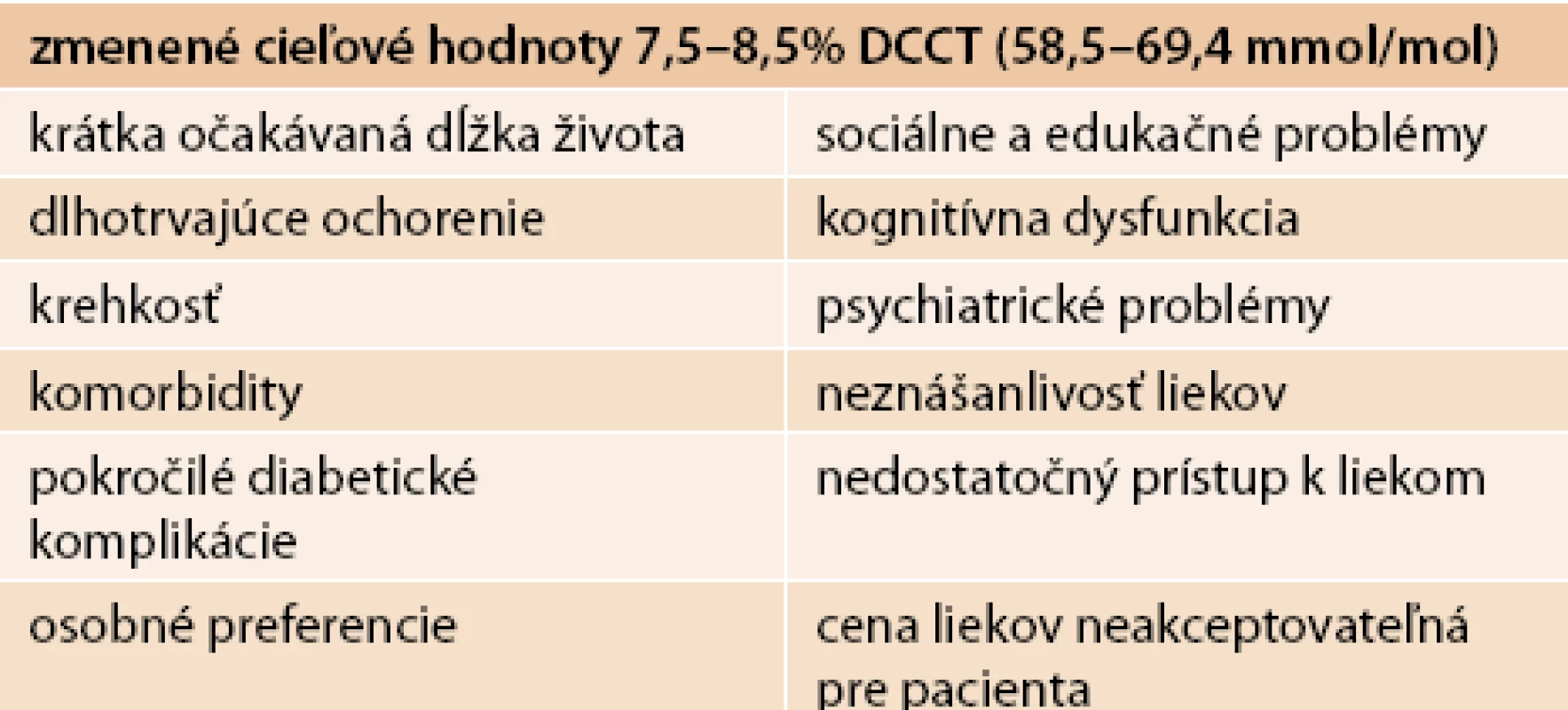
Ako postupovať v konkrétnom prípade pri individualizácii liečby?
Hodnotenie z pohľadu pacienta
V prvom rade je potrebné klinické vyšetrenie pacienta s doplnením vhodných pomocných vyšetrení so starostlivým a odborným zvážením rôznych možností prístupu k pacientovi.
Personalizovaný prístup k pacientovi zahrňuje zhodnotenie hlavne týchto tematických okruhov [2,3,7,20,21]:
- zhodnotenie celkového klinického stavu
- osobnosť pacienta
- genotyp, fenotyp
- rasa, etnický pôvod
- vek
- pohlavie
- vek v čase diagnózy, dĺžka trvania DM, stupeň progresie ochorenia
- zhodnotenie metabolického stavu: stupeň metabolickej kompenzácie – výška hyperglykémie, druh prevažujúcej hyperglykémie (hyperglykémia nalačno, postprandiálne) HbA1c, ketolátky v moči
- patofyziologické hľadisko: inzulínová rezistencia, deficit inzulínu, sekundárny diabetes, iné
- telesná hmotnosť
- prítomnosť mikrovaskulárnych komplikácií (retinopatia, nefropatia, neuropatia)
- prítomnosť makrovaskulárnych ochorení (infarkt myokardu, srdcové zlyhávanie, cievna mozgová príhoda, periférne artériové ochorenie dolných končatín)
- hypertenzia, dyslipidémia
- zhodnotenie renálnych funkcií
- zhodnotenie hepatálnych funkcií
- určenie prítomnosti ďalších ochorení
- krehkosť
- stanovenie individualizovaných terapeutických cieľov
- zváženie selfmonitoringu glykémie
- sociálne zázemie pacienta a ekonomické zázemie
- dlhodobá adherencia pacienta k liečbe
Osobnosť pacienta. Rešpektovanie osobnosti pacienta a jeho priania patria medzi základné prístupy v modernej medicíne.
Vek. V mladšom veku je možný aktívnejší prístup k diagnostike a liečbe DM. U pacientov s manifestáciou DM v staršom veku sa mikrovaskulárne komplikácie vzhľadom na limitovanú očakávanú dĺžku života nemajú čas vyvinúť, ale ak sú už prítomné, významným spôsobom môžu ovplyvniť spôsob liečby a prognózu pacienta. Naproti tomu makrovaskulárne ochorenia sú časté a vyžadujú zvýšenú pozornosť. V staršom veku sa obávame hypoglykémie. Riziko vzniku hypoglykémie závisí od spôsobu liečby a výberu konkrétneho liečiva.
Vek v čase diagnózy. Ženy, u ktorých sa diagnostikoval DM2T po 65. roku, majú zvýšenú mortalitu, kým mortalita mužov v tomto veku je porovnateľná s nediabetikmi. Dlhotrvajúci DM v staršom veku má inú prognózu ako novozistená cukrovka.
Pohlavie. Medzi ženami a mužmi neboli zistené významné rozdiely v účinnosti antihyperglykemickej liečby. Rozdiely sú vo výskyte nežiaducich účinkov pri liečbe tiazolidíndiónmi – v niektorých štúdiách u starších žien bol pozorovaný zvýšený výskyt zlomenín nôh, rúk a ramien.
Genotyp. Nové možnosti molekulovej genetiky umožnili identifikovať viaceré ochorenia vznikajúce na genetickom a najmä monogénovom podklade. Z tohto pohľadu nastal rozmach v oblasti monogénového diabetu a kongenitálneho hyperinzulinizmu. Umožňuje presná diagnostika cielenú liečbu? HNF1α-MODY (MODY 3) sa vyznačuje progresívnym priebehom, citlivosťou na deriváty sulfonylurey a vysokým rizikom mikrovaskulárnych komplikácií. Potvrdenie tejto diagnózy DNA analýzou umožňuje u pacientov spočiatku liečených inzulínom zmenu na liečbu sulfonylureou. HNF4α-MODY (MODY 4) je podobne ako MODY 3 citlivý na liečbu derivátmi sulfonylurey. NF1β-MODY (MODY 5) je asociovaný s obličkovými cystami, jeho liečba je takmer výlučne inzulínom. Glukokinázový diabetes (GCK-MODY) (MODY-2) má vysokú prevalenciu a dobrú prognózu. Odhaduje sa, že tvorí približne 0,5 % spomedzi všetkých ľudí s diabetom. U detí s GCK-MODY nie je indikovaná žiadna medikamentózna liečba, u dospelých je vhodná racionálna strava, zriedka deriváty sulfonylurey, v prípade gravidity je riziko vzniku makrozómie, čo je indikáciou liečby inzulínom [22].
Z genetického hľadiska medzi najvýznamnejšie kandidátske gény, ktoré ovplyvňujú sekréciu inzulínu, patrí gén pre transkripčný faktor 7 podobný faktoru 2 (TCF7L2). Práce slovenských autorov dokázali vzťah medzi prítomnosťou alely Lys23 KCNJ11 a lepšou odpoveďou na liečbu derivátmi sulfonylurey a tiež vzťah medzi rizikovou alelou T polymorfizmu TCF7L2 rs7903146 a menšou terapeutickou odpoveďou na deriváty sulfonylurey. Autori ďalej zistili signifikantne väčší rozdiel v zmene HbA11c medzi rôznymi TCF7L2 genotypmi u pacientov liečených 6 mesiacov gliklazidom v porovnaní s pacientami, ktorí boli taký istý čas liečení glimepiridom, glibenklamidom alebo glipizidom. V inej štúdii približne 20 % pacientov s DM2T, ktorí sú homozygóti pre variantnú alelu A polymorfizmu SLC47A1 rs2289669, mali 2krát väčšiu redukciu HbA1c počas prvých 6 mesiacoch liečby metformínom v porovnaní s nosičmi G alely tohto polymorfizmu. V ďalšej práci zistili asociáciu medzi variantami CAPN10 génu a zníženou odpoveďou na liečbu metformínom pri DM2T [23–25]. Iní autori zistili, že varianty TCF7L2 (rs7903146) a WFS1 (rs10010131) ovplyvňujú slabšiu odpoveď na exogénny glukagónu podobný peptid 1 (GLP-1) [26]. Farmakogenetické štúdie môžu mať v budúcnosti praktické implikácie pre personalizovanú medicínu.
Fenotyp. V súvislosti s pozorovateľným prejavom (expresiou) určitého génu sa používa termín fenotyp daného génu, čo platí aj pre expresiu väčšieho počtu špecifických génov, resp. i celého genómu. V klinickej praxi fenotyp poskytuje základné orientačné body pri rozhodovaní o liečbe pacienta (napr. hmotnosť, výška, typ obezity). Väčšina hypoglykemizujúcich liekov je účinná u väčšiny pacientov, ale sú pacienti, ktorí nereagujú na niektorú konkrétnu liečbu. Hľadajú sa prediktory dobrej terapeutickej odpovede.
Podnetný spôsob na individuálne terapeutické rozhodnutia publikovali Tsapas a Matthews [27]. Ide o štúdiu s 1 pacientom (N of 1), randomizovanú, skríženú, v ktorej pacient je vlastnou kontrolou pri porovnávaní účinnosti a bezpečnosti rôznych spôsobov liečby. Štúdia využíva dizajn a štatistické postupy štandardných populačných klinických štúdií, včítane randomizácie, vymývacích periód, skrížených periód a placeba. V štúdii je zahrnutý názor pacienta a jeho preferencie výberu liečby. Tento prístup poskytuje významné podklady pre individuálne rozhodnutia [27,28].
Dĺžka trvania diabetes mellitus. Už pri prvom stretnutí sa s pacientom je dôležité zvážiť časový faktor a určiť, či ide o novovzniknutý DM s krátkou dobou trvania alebo o novozachytený, či nediagnostikovaný DM s pravdepodobnou dĺžkou trvania niekoľko mesiacov alebo rokov. Z diferenciálno-diagnostického hľadiska nám môže pomôcť vyšetrenie HbA1c. Pri novovzniknutom DM2T s mierne zvýšenými glykémiami je niekedy možné začať len s diétnou liečbou a optimalizáciou životného štýlu. V prípade DM2T s dlhším trvaním je racionálne hneď v úvode nasadiť medikamentóznu liečbu. Dĺžka trvania DM má výrazný vplyv na manifestáciu chronických diabetických komplikácií.
Metabolická kompenzácia (HbA1c). Pri hodnotení metabolického stavu zvažujeme výšku glykémie nalačno a postprandiálne, glykemický profil, variabilitu glykémií, prítomnosť hypoglykémie, hodnotu HbA1c, ketolátky v moči a ďalšie parametre. Ťažká symptomatická hyperglykémia sa musí aktívne liečiť. Na odstránenie klinických symptómov DM je potrebné znížiť glykémiu na hodnoty 6–11 mmol/l.
Variabilita glykémií (oscilácia glykémií) sa môže posudzovať napr. podľa priemerných amplitúd výchyliek glykémií (MAGE – mean amplitude of glycaemic excursions), či presnejšie pomocou systému kontinuálneho glukózového monitorovania (CGMS – continuous glucose monitoring system). Zníženie amplitúdy glykémií pri hodnote HbA1c, ktorá je porovnateľná so stavom pri vysokej amplitúde glykémií, vedie k zníženiu oxidačného stresu, a tým i rizika rozvoja komplikácií [29,30].
Patofyziológia. DM je heterogénne ochorenie. Medzi základné patofyziologické poruchy pri DM2T patrí inzulínová rezistencia v pečeni a vo svalstve a zlyhávanie B-buniek pankreasu. V priebehu času dochádza k progresívnemu zlyhávaniu B-buniek, čo vedie k vývoju poruchy glukózovej tolerancie (PGT)/hraničnej glykémie nalačno (impaired fasting glucose – IFG), prípadne k DM2T. Hyperglykémia nalačno (GNL) z fyziologického hľadiska odráža hepatálnu produkciu glukózy pri jej nedostatočnej supresii inzulínom v dôsledku jeho absolútneho alebo relatívneho nedostatku (inzulínová rezistencia v pečeni). Postprandiálna hyperglykémia (PPG) je ukazovateľom nedostatočnej stimulácie sekrécie inzulínu alebo zníženej periférnej utilizácie glukózy (inzulínová rezistencia vo svalstve). Glykovaný hemoglobín HbA1c poskytuje integrovaný spätný pohľad na glykémie uplynulého obdobia. Hladiny HbA1c zodpovedajú priemernej hodnote glykémie v priebehu posledných 6–8 týždňov, ktorá je ekvivalentom prežívania erytrocytov. U dobre kontrolovaných pacientov (HbA1c < 7,3 % DCCT) sa na výslednej hodnote HbA1c z väčšej miery podieľa postprandiálna glykémia (PPG 70 %). U chorých so zlou metabolickou kompenzáciou (HbA1c > 10,2 % DCCT) na výslednej hodnote HbA1c prevažuje vplyv glykémie nalačno a vplyv PPG je len okolo 30 %. Hodnoty HbA1c sú indikátorom rozvoja mikrovaskulárnych a makrovaskulárnych komplikácií. Lieky, ktoré majú vplyv na funkciu B buniek a na inzulínovú rezistenciu, môžu mať dlhodobejší vplyv na zníženie HbA1c.
Na vzniku hyperglykémie sa podieľa minimálne 8 hormonálnych faktorov, ktoré definoval De Fronzo v známom „hrozivom oktete“ [31]. Na základe nových poznatkov sa vyvíjajú nové lieky, ktoré ovplyvňujú, okrem vyššie uvedených patofyziologických porúch, dysfunkciu inkretínových hormónov (GLP-1 a GIP), zvýšenú renálnu reabsorpciu glukózy, zvýšenú sekréciu glukagónu A bunkami pankreasu, inzulínovú rezistenciu v adipocytoch, dysfunkciu neurotransmiterov a ďalšie poruchy. Takýto široký záber na rôzne patofyziologické abnormality nemôže mať len jeden liek, a z toho vyplýva potreba kombinácie viacerých liekov s rôznym mechanizmom účinku na dosiahnutie cieľových hodnôt HbA1c [31,32].
Telesná hmotnosť a jej dynamika patria medzi významné faktory liečby DM. Je dôležité zabrániť nedostatočnej výžive, ale aj prírastku hmotnosti. U obéznych pacientov už mierne zníženie hmotnosti skoro vždy zlepšuje hladiny glykémie.
Mikrovaskulárne alebo makrovaskulárne komplikácie. Zo sprievodných ochorení kladieme dôraz hlavne na prítomnosť mikrovaskulárnych a makrovaskulárnych ochorení. Intenzita prístupu a ciele liečby u pacienta s DM2T sú zohľadnené vo vyššie spomenutých odporúčaniach.
Liečbu DM môžu komplikovať somatické faktory (porucha zraku, tremor, artritída, znížená pohyblivosť kĺbov, nedostatočné rozoznávanie hladu a smädu), ale aj mentálne problémy, ako sú zlá pamäť, neschopnosť učiť sa nové veci, ustálené zvyklosti či zlozvyky.
Krvný tlak, lipidy. Dosiahnutie cieľových hodnôt krvného tlaku a lipidov môže významným spôsobom znížiť výskyt chronických komplikácií cukrovky a patrí medzi kľúčovú úlohy liečby pacienta s DM.
Funkčný stav pacienta
Funkčné vyšetrenie v geriatrii zahrňuje oblasť biomedicínsku, psychickú, socioekonomickú a zistenie celkových funkčných schopností v základných všedných činnostiach. U nezávislého sebestačného pacienta sa môžeme usilovať o striktnú kontrolu glykémie a krvného tlaku. U relatívne nezávislého pacienta je cieľom optimalizácia kontroly glykémie a krvného tlaku. V oboch prípadoch je vhodné zvážiť zníženie hladín lipidov. Ak je pacient vysoko závislý a krehký, cieľom liečby je kontrola symptómov. Dôležité je vyvarovať sa hypoglykémii a excesívnemu monitoringu.
Povolanie. Povolanie pacienta môže ovplyvniť výber liečby. Niektorí pacienti majú variabilný spôsob života – práca na smeny, práca vo výškach, cestovanie, nepravidelné stravovacie návyky, športové aktivity. Títo pacienti vyžadujú flexibilný liečebný režim. U pacientov v rizikových povolaniach je potrebné sa vyhýbať liečivám, ktoré majú vyššie riziko vyvolania hypoglykémie.
Životná prognóza. Význam očakávanej dĺžky života na stanovenie terapeutických cieľov a na intenzitu liečby je závažný. V tomto bode je dôležité zdôrazniť etickú zložku rozhodovania v hraničných situáciách.
Sociálne zázemie ovplyvňuje celkovú starostlivosť o pacienta s DM. Čím je pacient krehkejší, tým je závislejší od vonkajšej podpory.
Hodnotenie z pohľadu liekov
Podávanie liekov je indikované vtedy, keď liečba diétou, pohybovou aktivitou a zmenou životného štýlu nevedie k primeranej úprave metabolického stavu.
Liečivá, ktoré sa používajú na liečbu hyperglykémie pri DM, sa líšia chemickou štruktúrou, farmakokinetickými a farmakodynamickými vlastnosťami, ale ich spoločnou črtou je vplyv na znižovanie glykémie. Z pohľadu personalizovanej medicíny pri výbere antidiabetika pre konkrétneho pacienta je dôležité zvážiť vplyv lieku na glukózovú triádu (HbA1c, glykémia nalačno, postprandiálna glykémia), na telesnú hmotnosť, riziko hypoglykémie a výskyt nežiaducich účinkov. Stále väčší dôraz sa kladie na kardiovaskulárnu a onkologickú bezpečnosť lieku.
Vlastnosti ideálneho antidiabetika [4,33]:
- účinné a bezpečné zníženie HbA1c
- stabilný a dlhodobo pretrvávajúci účinok
- definitívne ovplyvnenie progresie ochorenia
- minimálne nežiaduce účinky (zvlášť hypoglykémia)
- zlepšenie kardiovaskulárnych rizikových faktorov (t.j. telesná hmotnosť, lipidy, krvný tlak)
- zníženie kardiovaskulárnej a inej morbidity a mortality
Počet dostupných liekov v klinickej praxi sa v posledných dvoch desaťročiach výrazne zvýšil. Výber konkrétneho lieku pre pacienta si vyžaduje široké odborné znalosti a klinické skúsenosti.
Prehľad dostupných liekov na liečbu hyperglykémie s rozdelením podľa skupín, s uvedením mechanizmu účinku, zhodnotením ich výhod, nevýhod a ceny uvádza tab. 3 [17].
Raz et al [4] si kladú otázku: Poskytuje nám tento široký výber väčšiu flexibilitu pri návrhu personalizovaných liečebných režimov? Alebo to vytvára problémy znásobovaním výberu? Pre špecialistov z tohto pohľadu problémy nevznikajú. Pre lekárov primárnej starostlivosti, ktorí musia súčasne udržiavať krok na rôznych poliach medicíny, rozširujúce možnosti výberu antidiabetickej liečby môžu byť niekedy až zastrašujúce.
Liečivá uvedené v tab. 3 sa do určitej miery líšia intenzitou hypoglykemizujúceho účinku, hoci vo všeobecnosti majú porovnateľný účinok vo vzťahu k iniciálnej hodnote HbA1c. Sčasti sa to dá vysvetliť tým, že do klinických štúdií so staršími liekmi boli zaradení pacienti s vyššími úvodnými hodnotami HbA1c. Ak sú vyššie úvodné hladiny HbA1c, dochádza k výraznejším poklesom glykemických hladín bez ohľadu na typ liečby. V novších priamych porovnávacích štúdiách boli rozdiely v účinku na glykemickú kompenzáciu medzi antidiabetikami malé.
Tab. 3. Dostupné antihyperglykemické lieky 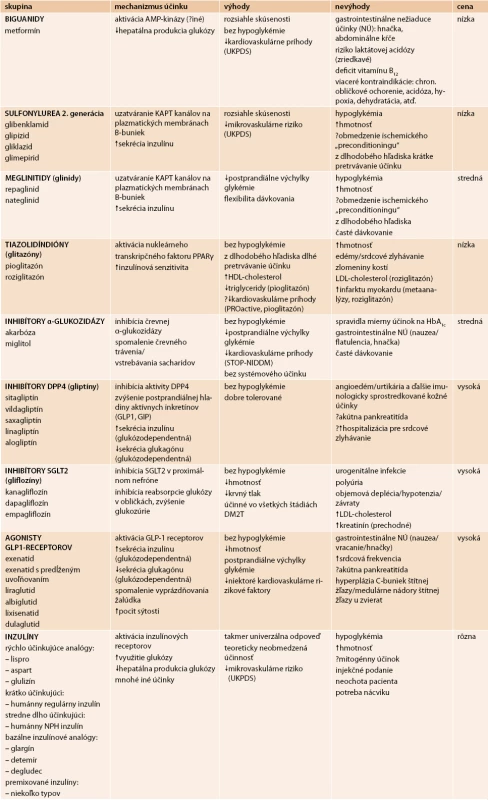
UKPDS – štúdia UK Prospective Diabetes Study PROactive – štúdia Prospective Pioglitazone Clinical Trial in Macrovascular Events STOP-NIDDM – štúdia Study to Prevent Non-Insulin-Dependent Diabetes Mellitus PPARγ – receptor γ aktivovaný peroxizómovými proliferátormi U metformínu, derivátov sulfonylurey, tiazolidíndiónov a agonistov GLP1-receptorov sa očakáva zníženie HbA1c od 1,0 do 1,5 %. Pri liečbe glinidmi, inhibítormi DPP4 a inhibítormi SGLT2 je pokles o niečo nižší (0,5–1,0 %). Najúčinnejším liekom na zníženie glykémie je inzulín.
Dôležitým faktorom pri hodnotení antidiabetickej liečby je predominantný vplyv na glykémiu nalačno (GNL) a na postprandiálnu glykémiu (PPG), hoci tieto účinky sa navzájom ovplyvňujú.
Výrazný vplyv na GNL majú metformín, sulfonylurea, tiazolidíndióny, inhibítory DPP4, inhibítory SGLT2 a bazálne inzulíny.
PPG podstatne znižujú repaglinid, inhibítory alfa-glukozidázy, inhibítory SGLT2, prandiálne inzulíny a metformín. Inhibítory DPP4 a agonisty GLP1 receptorov, zvlášť s krátkou dobou účinku (exenatid, lixisenatid) ovplyvňujú postprandiálnu hyperglykémiu glukózo-dependentným spôsobom, čím sa znižuje riziko hypoglykémie.
Pri zahajovaní liečby pri vyšších hodnotách HbA1c je nutné sa prvotne zamerať na ovplyvnenie GNL. Pri nižších hodnotách HbA1c je vhodnejšie upriamiť pozornosť na PPG [3,17,21,34].
Výhodné môže byť použitie kombinácie dvoch alebo viacerých antidiabetík s rôznym mechanizmom účinku. Pri niektorých liečivách sú dostupné fixné kombinácie antidiabetík.
Z pohľadu iných účinkov, ako je riziko hypoglykémie a vplyv na telesnú hmotnosť, sa tieto skupiny liekov líšia. Vplyv dostupných antihyperglykemizujúcich liekov na parametre glykemickej kompenzácie, na riziko hypoglykémie a na telesnú hmotnosť uvádza tab. 4 [3,17,19].
Tab. 4. Vplyv dostupných antihyperglykemických liekov na parametre glykemickej kompenzácie, na riziko hypoglykémie a na telesnú hmotnosť 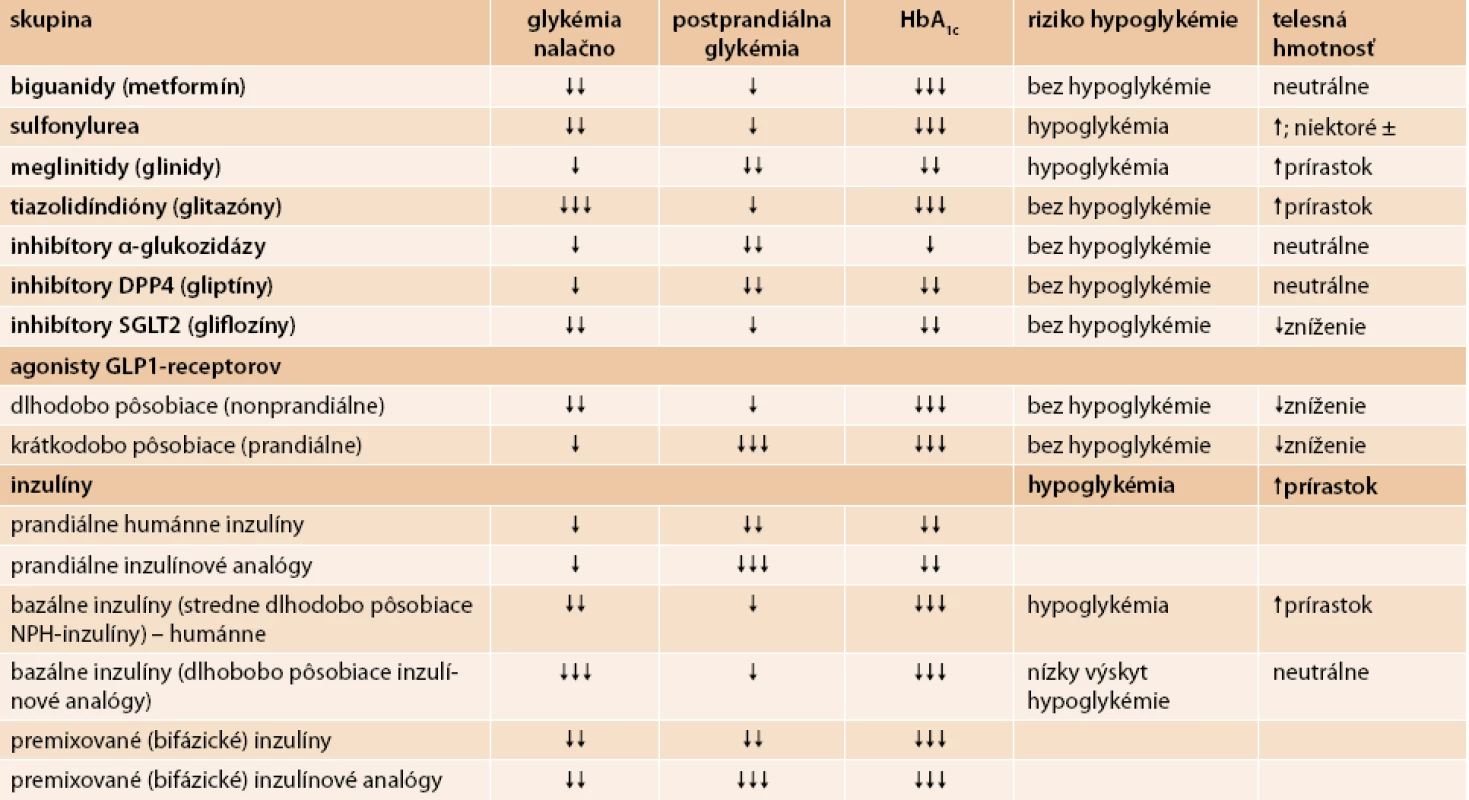
Veľmi dôležitým faktorom je posúdenie rizika hypoglykémie. Toto riziko je nízke pri monoterapii metformínom, agonistami GLP1-receptorov, inhibítormi DPP4, inhibítormi alfa-glukozidázy, tiazolidíndiónmi a inhibítormi SGLT2. Glinidy majú mierne riziko hypoglykémie. Preparáty sulfonylurey majú minimálne až signifikantné riziko hypoglykémie v závislosti od konkrétnej látky. Najväčšie riziko hypoglykémie má podávanie inzulínu. Dôležitý je však výber inzulínu či inzulínového analógu, typ inzulínového režimu, dávka inzulínu a zosúladenie diéty, fyzickej aktivity a liečby inzulínom.
Antidiabetická liečba má rôzny vplyv na telesnú hmotnosť. K úbytku hmotnosti vedie podávanie agonistov GLP1-receptorov, inhibítorov SGLT2 a do určitej miery aj liečba metformínom a inzulínom detemir. Hmotnostne neutrálne sú inhibítory DPP4, inhibítory alfa-glukozidázy a gliklazid MR. Nízky prírastok na hmotnosti majú dlhodobo pôsobiace inzulínové analógy. K prírastku hmotnosti vedú tiazolidíndióny, glinidy, niektoré preparáty sulfonylurey a prandiálne humánne inzulíny a inzulínové analógy.
Aký má vplyv telesná hmotnosť pacienta na účinnosť liečby? Pri výraznej obezite sú výhodné agonisty GLP1-receptorov. Tiazolidíndióny, aj keď môžu viesť k prírastku hmotnosti, sú účinnejšie u obéznych pacientov.
Z dlhodobého hľadiska trvanie hypoglykemizujúceho účinku je najdlhšie u tiazolidíndiónov (5–6 rokov). Pri podávaní sulfonylurey je maximum účinku v priebehu 6 mesiacov, pričom hladiny glykémie sa vracajú k úvodným hodnotám do 3 rokov. Metformín má z tohto pohľadu intermediárny účinok [35].
Z patofyziologického hľadiska pri DM2T dochádza k progresívnemu zhoršovaniu funkcie B-buniek a k zníženiu masy B-buniek. Protektívny vplyv na funkciu B-buniek majú tiazolidíndióny, agonisty GLP1-receptorov, inhibítory DPP4 a včasná inzulínová liečba.
Pri farmakoterapii je dôležité zvážiť nielen výber konkrétneho lieku, ale používať skôr nižšie a stredné terapeutické dávky podľa klinického stavu a laboratórnych výsledkov.
Bezpečnosť liečiv je sledovaná v rámci registračných štúdií, ale aj pri postmarketingovom monitorovaní. Znášanlivosť liečiv je možné ovplyvniť správnou indikáciou liečiva a postupným zvyšovaním terapeutickej dávky. Výhodné sú aj liečivá s postupným uvoľnovaním účinnej látky (napr. gliklazid MR – hydrofilná matrica, metformín XR s postupným uvoľňovaním účinnej látky) [7,17].
Funkcia obličiek
U pacienta sa DM sa môže vyskytovať celé spektrum obličkových ochorení. Stupeň obličkového poškodenia výrazným spôsobom ovplyvňuje výber antidiabetík v klinickej praxi.
Vzhľadom na to, že častým limitujúcim faktorom pri výbere farmakoterapie je znížená glomerulová filtrácia (GF), je dôležité mať na zreteli funkciu obličiek. S poklesom GF sa znižuje aj eliminácia niektorých perorálnych antidiabetík alebo ich aktívnych metabolitov obličkami. Slovenská nefrologická a Slovenská diabetologická spoločnosť vypracovali v roku 2012 odporúčané postupy s názvom „Diabetická nefropatia – diagnostika, prevencia a liečba“, v ktorých je uvedené podávanie antidiabetík pri rôznych stupňoch obličkového poškodenia podľa klasifikácie K/DOQI (National Kidney Foundation – Kidney Disease Outcome Quality Initiative) [36]. V tab. 5 je uvedený výber z pôvodnej práce týkajúci sa orálnych antidiabetík rozšírený o novú skupinu inhibítorov SGLT2 a s doplnením klasifikácie chronického obličkového ochorenia podľa KDIQO 2012 (Kidney Disease Improving Global Outcomes).
Funkcia pečene
K najčastejším ochoreniam pečene u diabetikov patrí steatóza pečene a nealkoholová steatohepatitída. Prítomnosť pečeňového ochorenia vedie k prehĺbeniu inzulínovej rezistencie, čo vedie k sťaženiu dosiahnutia metabolickej kompenzácie diabetu. V pokročilých štádiách cirhózy pečene a karcinómu pečene úbytkom funkčného pečeňového parenchýmu klesá glukoneogenetická schopnosť pečene a u týchto chorých môže klesať potreba antidiabetickej liečby a zvyšuje sa riziko hypoglykémie.
Mierne zvýšenie pečeňových testov (menej ako 2,5–3-násobok normy) pri inak normálnej funkcii pečene obvykle nepredstavuje významnejšie obmedzenie z hľadiska antidiabetickej liečby a nezodpovedá termímu pečeňová insuficiencia [38].
Súhrnný prehľad dostupných antihyperglykemických liekov je v tab. 3. V ďalšej časti textu sú doplňujúce a rozširujúce údaje podľa jednotlivých liekových skupín.
Liekové skupiny
Biguanidy – metformín
Metformín [1,3,17,19,33] sa považuje za liek prvej voľby za predpokladu, že nie sú prítomné kontraindikácie. Jeho hlavným účinkom je zníženie hepatálnej produkcie glukózy, menej výrazné je zvýšenie periférnej utilizácie glukózy v kostrovom svalstve a v tukovom tkanive. Metformín pôsobí aj ako aktivátor AMP-aktivovanej proteinkinázy, enzýmu s pozitívnymi účinkami na metabolizmus lipidov a sacharidov. Metformín patrí medzi inzulínové senzitizéry – znižuje hladinu glykémie bez stimulácie sekrécie inzulínu. Výraznejšie znižuje glykémiu nalačno ako postprandiálnu glykémiu. V monoterapii má nízke riziko hypoglykémie a je hmotnostne neutrálny, prípadne pri jeho užívaní dochádza k poklesu hmotnosti. Je rovnako účinný u pacientov vo všetkých hmotnostných kategóriách (normálna hmotnosť, nadhmotnosť, obezita). Metformín má anorektický účinok; môže viesť k deficitu vitamínu B12. Z dlhodobého hľadiska má dlhé pretrvávanie účinku.
Podľa výsledkov UKPDS a ďalších klinických štúdií metformín vedie k zníženiu výskytu kardiovaskulárnych komplikácií. Výsledky observačných štúdií s metformínom poukazujú na pokles incidencie malígnych ochorení. Metformín má potenciál na nové indikácie, ako je syndróm polycystických ovárií, gestačný diabetes a obézni pacienti s DM1T (tieto indikácie však nie sú v SPC). V štúdii Diabetes Prevention Program (DPP) liečba metformínom viedla k zníženiu rizika vývoja DM u pacientov s poruchou glukózovej tolerancie. V roku 2014 bola zahájená univerzitami v Oxforde a Cambridge štúdia GLINT (Glucose Lowering in Non-diabetic Hyperglycemia Trial). Ide o veľkú randomizovanú kontrolovanú štúdiu zameranú na koncové klinické ukazovatele so sledovaním vplyvu metformínu na kardiovaskulárne ochorenia a na rakovinu. Dĺžka sledovania pacientov bude 5–7 rokov.
Medzi najčastejšie nežiaduce účinky metformínu patria gastrointestinálne ťažkosti, ktorým sa dá v niektorých prípadoch predísť postupnou titráciou dávky metformínu alebo podávaním metformínu XR s predĺženým uvoľňovaním, ktorý má výrazne nižší výskyt gastointestinálnych nežiaducich účinkov a zlepšuje komplianciu pacientov.
Ďalej je treba zvážiť kontraindikácie, hlavne z pohľadu rizika vzniku laktátovej acidózy (porucha funkcie obličiek, pečene, hypoxia, acidóza, kardiorespiračná nedostatočnosť, ťažké akútne ochorenia, pneumónia, dehydratácia, šok).
Podľa najnovšieho znenia SPC z apríla roku 2015 metformín môžu užívať pacienti s miernou poruchou funkcie obličiek stupeň 3a (clearence kreatinínu [CrCl] 45–59 ml/min) alebo odhadovaná hodnota glomerulárnej filtrácie [eGF] 45–59 ml/min/1,73 m2 iba v prípade, že netrpia iným ochorením, ktoré by zvyšovalo riziko laktátovej acidózy. Dávku metformínu je nutné znížiť (maximálna denná dávka 1 000 mg rozdelená do 2 dávok). Stupeň 3b a závažné zlyhanie obličiek (clearence kreatinínu [CrCl] < 45 ml/min alebo eGF < 45 ml/min/1,73 m2 sú kontraindikáciou podávania metformínu.
Metformín je indikovaný v monoterapii aj v kombinovanej liečbe prakticky so všetkými antidiabetikami, včítane inzulínu. Pri kontraindikácii alebo intolerancii metformínu podľa AACE 2015 akceptovateľnými alternatívami metformínu v monoterapii sú agonisty GLP1-receptorov, inhibítory SGLT2, inhibítory DPP4 a inhibítory α-glukozidázy. ADA/EASD 2015 k tomu pridáva aj deriváty sulfonylurey.
Sulfonylurea
Deriváty sulfonylurey [1,3,17,19,33,39,40] patria medzi inzulínové sekretagogá. Po väzbe na sulfonylureové receptory (SUR) B-buniek Langerhansových ostrovčekov pankreasu, uzáverom ATP-dependentných káliových kanálov, stimulujú sekréciu inzulínu. Ovplyvňujú bazálnu aj prandiálnu sekréciu inzulínu. Ich metabolické účinky sa prekrývajú s účinkom inzulínu. SU-derivaty majú rýchly nástup účinku, najvýraznejší hypoglykemizujúci účinok majú v rozsahu polovičnej maximálnej odporúčanej dávky. Ďalšie zvyšovanie dávky hypoglykemizujúci účinok významne nezosiľňuje, ale zvyšuje sa výskyt nežiaducich účinkov. Ich použitie je spojené s miernym prírastkom na hmotnosti (v štúdii ADVANCE s gliklazidom nebol pozorovaný vzostup hmotnosti) a s rizikom hypoglykémie.
Hlavným nežiaducim účinkom SU je riziko hypoglykémie, ktoré závisí okrem iného od dávky a dĺžky trvania účinku jednotlivých derivátov SU. Dlhodobopôsobiace prípravky (glibenklamid, glipizid GITS s predĺženým uvoľňovaním) majú väčšiu pravdepodobnosť vyvolať hypoglykémiu ako gliklazid, glimepirid a glipizid. Riziko hypoglykémie je vyššie u starších pacientov s komorbiditami. V kontrolovanej klinickej štúdii GUIDE mal gliklazid MR nižšie riziko potvrdenej symptomatickej hypoglykémie < 3,0 mmol/l v porovnaní s glimepiridom.
Deriváty SU znižujú riziko mikrovaskulárnych komplikácií (UKPDS). V 10-ročnom sledovaní po ukončení štúdie UPKDS došlo k zníženiu infarktu myokardu a úmrtí z akejkoľvek príčiny u pacientov pôvodne randomizovaných na liečbu SU. V štúdii ADVANCE s gliklazidom stratégia s intenzívnou glykemickou kontrolou viedla k 10% relatívnemu zníženiu kombinovaného hodnotiaceho kritéria zloženého z makrovaskulárnych a mikrovaskulárnych príhod. V pokračujúcom sledovaní v štúdii ADVANCE-ON v iniciálne intenzívnej skupine štúdie ADVANCE nebol pozorovaný nepriaznivý dopad na kardiovaskulárne úmrtia a bol pozorovaný signifikantný kumulatívny pozitívny účinok na terminálne obličkové zlyhanie.
Lepšie pochopenie farmakogenomiky umožní lepšie diferencovať medzi pacientami, ktorí priaznivo reagujú na liečbu SU. Výhodou derivátov sulfonylurey pre použitie v širšom merítku je ich relatívne nízka cena.
Glinidy
Glinidy (deriváty meglitinidu – repaglinid, nateglinid) [1,3,17,19,33] patria medzi rýchlo a krátkodobo účinkujúce nesulfonylureové sekretagogá. Zvyšujú hladinu inzulínu podobným mechanizmom ako SU. Glinidy znižujú postprandiálnu glykémiu a majú nízke riziko hypoglykémie. Môžu sa podávať tesne pred každým jedlom. Sú vhodné aj u pacientov so zníženou funkciou obličiek. U nás je dostupný len repaglinid. Predstavuje alternatívu derivátov SU.
Inhibítory α-glukozidázy
Inhibítory alfa-glukozidázy (akarbóza, miglitol) [1,3, 41] spomaľujú vstrebávanie komplexných sacharidov a disacharidov. Tieto lieky sú menej účinné ako ostatné skupiny perorálnych antidiabetík, majú nízke riziko hypoglykémie a sú hmotnostne neutrálne. Nežiaduce účinky z pohľadu gastrointestinálneho traktu môžu limitovať liečbu, ale môžu byť výhodné u pacientov s obstipáciou. V štúdii STOP-NIDDM pri liečbe akarbózou došlo k zníženiu výskytu kardiovaskulárnych ochorení.
Tiazolidíndióny (glitazóny)
Tiazolidíndióny (TZD) [3,5,17,19,33,35] sú selektívne agonisty nukleárnych receptorov PPARγ (receptor γ aktivovaný peroxizómovými proliferátormi). Vedú k aktivácii transkripcie inzulín-senzitívnych génov, ktoré sú zapojené do sacharidového a lipidového metabolizmu. TZD zvyšujú senzitivitu svalov, tukového tkaniva a pečene na endogénny a exogénny inzulín (inzulínové senzitizéry). Počas užívania majú ochranný vplyv na funkciu B-buniek pankreasu. Komplexným spôsobom znižujú hyperinzulinémiu a hyperglykémiu, ovplyvňujú široké spektrum kardiovaskulárnych rizikových faktorov. TZD nezvyšujú riziko hypoglykémie. Nástup účinku TZD sa prejavuje po 6 týždňoch liečby, s plným účinkom až po 6 mesiacoch. V štúdii ADOPT roziglitazón mal dlhodobejšie trvanie účinku v porovnaní s metformínom a glibenklamidom. V súčasnosti je u nás dostupný len pioglitazón. Roziglitazón bol stiahnutý z klinického použitia v Európe a v USA vzhľadom na možné zvyšovanie kardiovaskulárneho rizika. V súčasnosti FDA zrušil túto reštrinkciu. Pri liečbe pioglitazónom v štúdii PROactive po 3 rokoch sledovania došlo k 16% redukcii sekundárneho kardiovaskulárneho ukazovateľa (úmrtie, infarkt myokardu, cievna mozgová príhoda).
Medzi nežiaduce účinky TZD patrí prírastok hmotnosti, retencia tekutín, ktorá sa zvyčajne manifestuje ako periférny edém, ale niekedy sa môže prejaviť ako novovzniknuté alebo zhoršené srdcové zlyhávanie u predisponovaných pacientov. Zriedkavo môže dôjsť ku kostným zlomeninám, prevažne u žien. Predchádzajúce obavy ohľadom asociácie liečby pioglitazónom s rakovinou močového mechúra na základe zhodnotenia údajov od 1,01 milióna pacientov sa nepotvrdili.
Inhibítory DPP4 (gliptíny)
Inhibítory dipeptidylpeptidázy – 4 (sitagliptín, vildagliptín, saxagliptín, linagliptín, alogliptín) [1,17,19,43–50] spôsobujú inhibíciu DPP4, ktorá vedie ku zvýšeniu hladín GLP1 vo fyziologickom rozmedzí. Následne dochádza k zvýšenej odpovedi sekrécie inzulínu na glukózový podnet a k zníženiu hladín glukagónu. V dôsledku týchto faktorov dochádza k zníženiu postprandiálnej glykémie, variability glykémie a k zníženiu glykémie nalačno.
Inhibítory DPP4 nevyvolávajú hypoglykémiu a sú hmotnostne neutrálne. Môžu sa od začiatku podávať v cieľovej dávke, bez postupnosti titrácie, vzhľadom na to, že majú nízky výskyt nežiaducich účinkov.
V Slovenskej republike (SR) inhibítory DPP4 je možné podávať v monoterapii (sitagliptín, vildagliptín, linagliptín), v kombinácii s metformínom, so sulfonylureou (ak je metformín kontraindikovaný), metformínom + sulfonylureou a s inzulínom (s metformínom alebo bez neho). V algoritme ADA/EASD 2015 je uvedená ešte aj kombinácia s tiazolidindiónom a inhibítorom SGLT2. Pridanie DPP4 k predchádzajúcej liečbe metformínom nevyžaduje meniť dávkovanie. Pri kombinácii so sulfonylureou je vhodné znížiť dávku SU-derivátu.
Všetky inhibítory DPP4 sa môžu používať aj pri rôznych štádiách chronického obličkového ochorenia. Linagliptín sa môže podávať bez úpravy dávky pri každej hladine glomerulárnej filtrácie (tab. 5).
Tab. 5. Perorálne antidiabetiká pri zníženej obličkovej funkcii 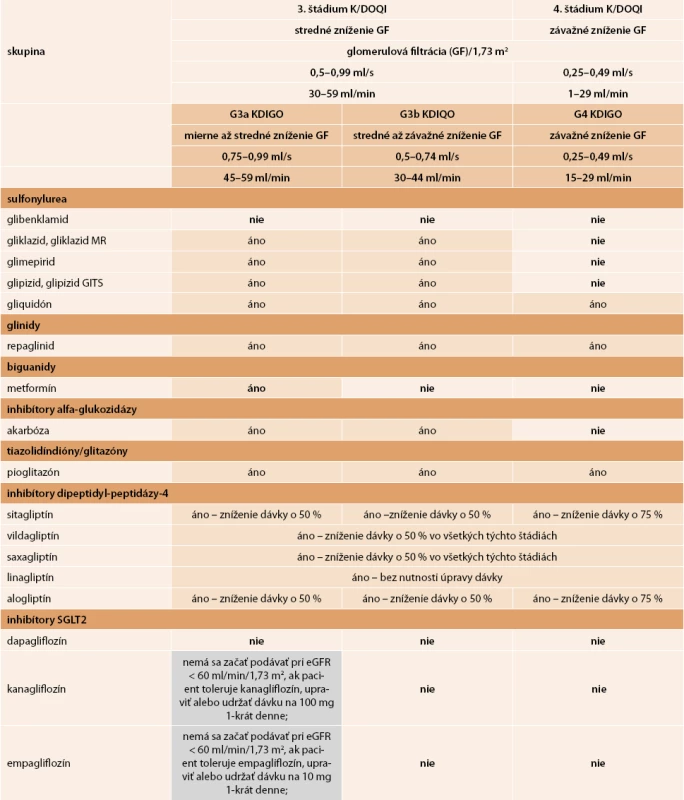
Diskutuje sa aj otázka pankreatickej bezpečnosti inhibítorov DPP4. Na základe veľkých observačných databáz, ako aj dvoch veľkých kardiovaskulárnych štúdií, nebol zistený zvýšený výskyt pankreatických ochorení (pankreatitída, neoplázia pankreasu). Ďalšou otázkou je možné ovplyvnenie proliferačných a imunitných procesov.
Medzi rizikové faktory kardiovaskulárnych ochorení sa najnovšie zaraďuje aj zvýšená variabita glykémie. Vo viacerých štúdiách vildagliptín v porovnaní so sitagliptínom výraznejšie znížil glukózovú variabilitu (na základe monitorovania glukózy CGMS), znížil hladiny glukagónu a zvýšil koncentráciu GLP1. Pokles hodnôt HbA1c bol porovnateľný.
Na základe metaanalýzy údajov o liečbe vildagliptínom v porovnaní so všetkými komparátormi metodikou podľa FDA je možné konštatovať, že liečba vildagliptínom nie je asociovaná so zvýšením rizika KV príhod.
V roku 2013 bola ukončená štúdia EXAMINE s alogliptínom, v ktorej autori sledovali výskyt kardiovaskulárnych príhod a účinnosť alogliptínu v porovnaní so štandardnou liečbou u pacientov s DM2T po akútnej koronárnej príhode. V skupine pacientov liečených alogliptínom nebol pozorovaný zvýšený výskyt závažných nežiaducich kardiovaskulárnych príhod v porovnaní s placebom.
Ďalšou ukončenou štúdiou v roku 2013 bola štúdia SAVOR TIMI-3 so saxagliptínom. Cieľom tejto štúdie bolo hodnotenie vplyvu saxagliptínu na kardiovaskulárne príhody u diabetikov 2. typu. Liečba saxagliptínom v porovnaní s placebom nezvyšovala a ani neznižovala výskyt ischemických príhod. V štúdii bol pozorovaný zvýšený výskyt hospitalizácií pre srdcové zlyhávanie pri liečbe saxagliptínom v porovnaní s placebom.
V štúdii TECOS bol sledovaný účinok pridania sitagliptínu v bežnej diabetologickej starostlivosti na kardiovaskulárne príhody a na klinickú bezpečnosť. Podrobné výsledky štúdie budú prednesené v júni 2015 na kongrese ADA. Podľa predbežných informácií bola dosiahnutá non-inferiorita sitagliptínu pre primárny kardiovaskulárny ukazovateľ (čas do prvej potvrdenej kardiovaskulárnej príhody – ide o združený ukazovateľ, ktorý je definovaný ako kardiovaskulárne úmrtie, nefatálny IM, nefatálna cievna mozgová príhoda alebo nestabilná angina pectoris vyžadujúca hospitalizáciu). Zo sekundárnych ukazovateľov sitagliptín nezvyšoval hospitalizáciu pre srdcové zlyhávanie.
Inhibítory SGLT2 (gliflozíny)
K najnovším terapeutickým trendom patria inhibítory sodíkovo-glukózového kotransportéra 2 (SGLT2) [3,17,19, 51–59]. Inhibítory SGLT2 predstavujú najväčšiu zmenu v liečebných možnostiach v nových odporúčaniach ADA/EASD 2015 v porovnaní s rokom 2012, keď ešte tieto lieky neboli dostupné v klinickej praxi. Na Slovensku k 1. máju 2015 je dostupný dapagliflozín, kanagliflozín a empagliflozín.
Sodíkovo-glukózový kotransportér 2 sa nachádza v proximálnom tubule obličiek. Jeho hlavnou funkciou je aktívny kotransport sodíka a glukózy. Inhibítory SGLT2 pôsobia v obličkách – blokujú zvýšenú reabsorpciu glukózy, zvyšujú glykosúriu s následným znížením glykémie [51,52]. V závislosti od liečiva a jeho dávky sa pri liečbe inhibítormi SGLT2 denne vylúči približne 70 až 80 g glukózy (čo zodpovedá 280 až 320 kcal/deň). Vylučovanie glukózy močom vedie k strate energie a k zníženiu hmotnosti, k osmotickej diuréze a k zvýšeniu objemu moču približne o 375 ml/deň a k miernej hemokoncentrácii. Inhibícia glukózy a kontrasportu sodíka je spojená s miernym zvýšením diurézy a prechodnou natriurézou.
Účinok inhibítorov SGLT2 je nezávislý na sekrécii alebo účinku inzulínu. Sú účinné bez ohľadu na funkciu B-bunky. Môžu byť použité vo včasnej i neskoršej fáze DM2T. Dlhodobo zlepšujú glykemickú kompenzáciu bez zvýšeného rizika hypoglykémie, sú asociované so znížením krvného tlaku (pokles systolického TK o 2–4 mm Hg, diastolického TK o 1–2 mm Hg) a s poklesom telesnej hmotnosti (okolo 2 kg).
V randomizovanej klinickej štúdií pokles hmotnosti pri kombinácii dapagliflozínu s metformínu súvisel so stratou glukózy močom. Pri dlhodobom nedopĺňaní tejto energetickej straty dochádzalo k zníženiu tukového tkaniva (podľa magnetickej rezonancie a duálnej RTG absorpciometrie DXA). Dapagliflozín znižoval obvod pásu, objem viscerálneho i subkutánneho tuku. Znižovanie hmotnosti bolo progresívneho charakteru, po stabilizácii pretrvávalo až 4 roky.
Liečba inhibítormi SGLT2 vedie k zníženiu hladín kyseliny močovej a k zníženiu albuminúrie.
Účinnosť inhibítorov SGLT2 závisí od funkcie obličiek, ich účinnosť je znížená u pacientov so stredne ťažkou a ťažkou poruchou funkcie obličiek. Mierne rozdiely v indikácii inhibítorov SGLT2 vo vzťahu ku glomerulovej filtrácii sú uvedené v tab. 5. V priebehu liečby je vhodné pravidelné monitorovanie renálnych funkcií.
Z nežiaducich účinkov je potrebné sledovať asociáciu so zvýšeným rizikom infekcií urogenitálneho traktu (zvýšený výskyt infekcií močových ciest a zvýšené riziko mykotických infekcií genitálu). Väčšina infekcií v klinických štúdiách bola mierneho až stredne závažného stupňa a dobre reagovala na štandardnú liečbu. Infekcie boli častejšie u žien s anamnézou opakovaných urogenitálnych problémov. Riziko volumovej deplécie pri použití inhibítorov SGLT2 je nízke, za predpokladu, že pacient má primeraný príjem tekutín. U starších pacientov, ktorí užívajú diuretiká, je nutné monitorovanie ohľadom posturálnej hypotenzie. Pri liečbe inhibítormi SGLT2 sa sleduje účinok na kostný metabolizmus.
Na základe metaanalýz kardiovaskulárnych príhod v klinických programoch s inhibítormi SGLT2 táto liečba nebola asociovaná so zvýšeným kardiovaskulárnym rizikom. V súčasnosti prebiehajú dlhodobé klinické štúdie zamerané na kardiovaskulárne príhody. Pri liečbe dapagliflozínom došlo v niektorých štúdiách k nevýrazným zmenám lipidov – k zníženiu triacylglycerolov a k zvýšeniu HDL-cholesterolu. Pri liečbe kanagliflozínom bol zistený malý vzostup LDL-cholesterolu (5 %).
Podľa SPC inhibítory SGLT2 sú indikované v monoterapii a v prídavnej kombinovanej liečbe s inými liekmi znižujúcimi hladinu glukózy, vrátane inzulínu. V algoritme ADA/EASD 2015 je znázornená dvojkombinácia metformín + inhibítor SGLT2 a trojkombinácie: metformín + inhibítor SGLT2 + sulfonylurea alebo tiazolidíndión alebo inhibítor DPP4 alebo inzulín. V algoritme AACE/ACE 2015 je uvedená aj monoterapia inhibítormi SGLT2, podobne aj v texte odporúčaní ADA/EASD 2015.
Podľa indikačného obmedzenia v SR od 1. 5. 2015 je možná trojkombinačná liečba
- metformín + sulfonylurea + inhibítor SGLT2
- inzulín + metformín + inhibítor SGLT2
Budúcnosť tejto skupiny liekov – inhibítorov SGLT2 a ich miesto v liečbe DM2 sa ukáže od ich reálneho efektu v bežnej klinickej praxi.
Agonisty GLP1-receptorov
Agonisty GLP1-receptorov (GLP1 RA) [17,19,33, 60–65] napodobňujú účinky endogénneho GLP1. Podávajú sa subkutánne, stimulujú pankreatickú sekréciu inzulínu v závislosti od glukózy, potláčajú neprimerane zvýšenú sekréciu glukagónu, spomaľujú vyprázdňovanie žalúdka a potláčajú chuť do jedla. Vedú k redukcii telesnej hmotnosti. Medzi nežiaduce účinky patrí mierna až stredne závažná nauzea, ktorá postupne ustupuje v priebehu liečby. Zvýšené riziko pankreatitídy pri liečbe GLP-RA sa nepotvrdilo, napriek tomu je nutné u pacientov s anamnézou pankreatitídy postupovať opatrne.
Liečba agonistom GLP1-receptorov má nízky výskyt hypoglykémie a okrem účinku na glykemickú kompenzáciu (zníženie glykémie nalačno a hlavne postprandiálnej glykémie, potenciálny účinok na masu B-buniek pankreasu) má aj potencionálny kardioprotektívny účinok (zníženie krvného tlaku a v porovnaní s placebom signifikantné zníženie biomarkerov kardiovaskulárneho rizika – triacylglycerolov, inhibítora aktivácie plazminogénu 1, B-typu nátrium-uretického peptidu).
GLP1 RA sa rozdeľujú do rôznych skupín podľa chemickej štruktúry, farmakokinetického profilu a podľa vplyvu na evakuáciu žalúdka, glykémiu nalačno a postprandiálnu glykémiu.
Exenatid je syntetická verzia exendinu 4, ktorý bol izolovaný zo slín kôrnatca jedovatého (Heloderma suspectum). Exenatid sa skladá z 39 aminokyselín, je z 53 % homológny s natívnym GLP1, je rezistentný voči štiepeniu enzýmom DPP4. Biologický polčas exenatidu je 2,4 hod. Podľa farmakokinetického profilu sa zaraďuje sa medzi krátkodobo pôsobiace GLP1 RA a podľa účinku na evakuáciu žalúdka, glykémiu nalačno (GNL) a postprandiálnu glykémiu (PPG) medzi prandiálne GLP1 RA (výrazné spomalenie vyprázdňovania žalúdka, zníženie prevažne PPG a zníženie exkurzií postprandiálnej glykémie). Podáva sa 2-krát denne.
Lixisenatid sa zaraďuje medzi medzi krátkodobo pôsobiace prandiálne GLP1 RA. Základná štruktúra lixisenatidu je odvodená od exendínu 4. Lixisenatid je zložený z 44 aminokyselín s amidáciou na C konci, je na ~50 % homológny s natívnym GLP1, pričom je rezistentný na degredáciu dipeptidyl peptidázou 4 (DPP4). Po subkutánnom podaní biologický polčas je medzi 2,7–4,3 hodinami. Podáva sa 1-krát denne,
Dlhodobo pôsobiace non-prandiálne GLP1 RA pôsobia viac na glykémiu nalačno, sú o niečo účinnejšie na zníženie HbA1c, majú relatívne malý vplyv na vyprázdňovanie žalúdka (anorektický účinok je sprostredkovaný pôsobením v centrálnom nervovom systéme) a majú nižší výskyt gastrointestinálnych nežiaducich účinkov.
Exenatid s postupným uvoľňovaním (exenatid QW) patrí medzi dlhodobo pôsobiace non-prandiálne GLP1 RA. Kontinuálnu hladinu exenatidu poskytuje mikrosférový systém. Ide o jediný GLP1 RA v klinickej praxi, ktorý sa aplikuje 1-krát týždenne (once weekly). Tento preparát nie je vhodný na kombinovanú liečbu s inzulínom.
Liraglutid je dlhodobo pôsobiaci non-prandiálny GLP1 RA, ktorý je z 97 % homológny s natívnym GLP1. Biologický polčas liraglutidu je 11–15 hodín, podáva sa subkutánne 1-krát denne.
Rozdiely medzi jednotlivými GLP1 RA umožňujú individualizovaný výber liečby pacienta podľa princípov personalizovanej medicíny. Hlavné terapeutické miesto GLP1 RA je v prídavnej liečbe pri nedostatočne kompenzovanom DM orálnymi antidiabetikami.
V posledných rokoch bola dokázaná účinnosť kombinácie GLP1 RA s bazálnym inzulínom. Táto kombinácia bola porovnateľná alebo o niečo účinnejšia ako pridanie prandiálneho inzulínu s výhodou úbytku na hmotnosti a s menším výskytom hypoglykémie.
Podľa algoritmu ADA/EAD 2015 pri snahe o dosiahnutie cieľových hodnôt glykémie u pacientov s DM do úvahy prichádza dvojkombinácia metformín + GLP1 RA a trojkombinácia metformín + GLP1 RA + sulfonylurea alebo tiazolidíndión alebo bazálny inzulín. Novým prístupom je zvažovanie pridania GLP1 RA alebo prandiálneho inzulínu k predchádzajúcej liečbe bazálnym inzulínom.
Podľa indikačných obmedzení v SR je liečba GLP1 RA indikovaná v kombinácii s metformínom alebo s metformínom + sulfonylureou.
Inzulín
Základné rozdelenie inzulínov je v tab. 3. V klinickej praxi sú rozlišujeme 3 skupiny inzulínov, ktoré sa môžu použiť v rôznych terapeutických režimoch: prandiálne inzulíny (rýchlo účinkujúce inzulínové analógy, krátko účinkujúci humánny regulárny inzulín), bazálne inzulíny (stredne dlho účinkujúci humánny NPH-inzulín, bazálne inzulínové analógy) a premixované inzulíny (premixované humánne inzulíny, premixované inzulínové analógy) [5, 17,19,66–74]. Najčastejším nežiaducim účinkom liečby inzulínom je hypoglykémia a prírastok na hmotnosti.
Na substitúciu prandiálnej sekrécie inzulínu a ovplyvnenie glykémie po jedle sa používajú prandiálne inzulíny. Podávanie rýchlo účinkujúcich inzulínových analógov (inzulín lispro, aspart, glulizín) vedie k lepšej postprandiálnej glykemickej kontrole v porovnaní s humánnym krátkoúčinkujúcim inzulínom (regulárnym inzulínom), ktorý má menej vhodný farmakokinetický profil.
Bazálnu sekréciu inzulínu je možné pokryť rôznymi bazálnymi inzulínmi, ktoré ovplyvňujú glykémiu nalačno a posúvajú krivku celodenných glykémií smerom nadol. Napriek dosiahnutiu normálnych hodnôt glykémie nalačno pri ich použití zostáva zvýšená postprandiálna glykémia. Začiatok účinku a trvanie účinku dlhodobo pôsobiacich inzulínových analógov (glargín, detemir) sa viac približuje fyziologickej bazálnej sekrécii inzulínu. Tieto analógy majú predĺžený bezvrcholový účinok trvajúci 24 hodín a sú spojené s nižšou variabilitou účinku. Dlhodobo pôsobiace inzulínové analógy (glargín, detemir) majú v porovnaní s NPH inzulínom nižší výskyt nočnej hypoglykémie a nižší prírastok na hmotnosti (detemir). Pri porovnávacích štúdiách dlhodobo pôsobiacich inzulínových analógov bolo rozdielne dávkovanie – vyššie priemerné dávkovanie mal detemir v porovnaní s glargínom. Najnovším ultra dlhodobo pôsobiacim bazálnym inzulínovým analógom je degludek. Inzulín degludek má dlhotrvajúci stabilný účinok s nízkou medzidennou variabilitou. Pri jeho podávaní je nízky výskyt hypoglykémie, hlavne nočnej, čo umožňuje jeho bezpečnejšiu a intenzívnejšiu titráciu na dosiahnutie cieľových hodnôt glykemickej kompenzácie v snahe o minimalizáciu rizika chronických komplikácií DM.
Čiastočné krytie postprandiálnej a bazálnej sekrécie inzulínu umožňujú premixované (bifázické) inzulíny (MIX). Ovplyvňujú glykémiu nalačno aj postprandiálne. Odporúčajú sa u pacientov s DM2T, ak pomer jednotlivých zložiek prandiálneho a bazálneho inzulínu zodpovedá pacientovým požiadavkám na inzulín. Premixované (bifázické) inzulínové analógy majú priaznivejší farmakokinetický profil v porovnaní s premixovanými humánnymi inzulínmi. Majú rýchlejší nástup účinku a kratší eliminačný polčas rýchlej zložky, čím vedú k účinnejšej kontrole postprandiálnych glykémií.
Podľa AACE 2015 liečba inzulínom je indikovaná, ak kombinovaná liečba inými antidiabetikami nevedie k dosiahnutiu cieľových hodnôt glykemickej kompenzácie alebo ak má pacient HbA1c > 9 % a príznaky hyperglykémie. Môže sa jednať o pacienta bez predchádzajúcej liečby alebo o pacienta s antihyperglykemickou liečbou. Na začiatku inzulínovej liečby je možné použiť bazálny inzulín, režim bazál bolus, prandiálny inzulín alebo premixovaný inzulín. Inzulín sa spočiatku podáva v nízkych dávkach (0,1–0,2 UI kg-1 deň -1), hoci pri výraznej hyperglykémii sa môžu podávať aj vyššie dávky (0,3–0,4 UI kg-1 deň -1).
Po pridaní bazálneho inzulínu k predchádzajúcej terapii sa pokračuje v liečbe metformínom. Metformín vedie k zníženiu celkovej dávky inzulínu a k zníženiu prírastku hmotnosti. Pri použití bazálneho inzulínu pokračovanie v liečbe inzulínovým sekretagógom (sulfonylurea, glinid) môže minimalizovať iniciálne zhoršenie glykemickej kontroly. Ak sa začne liečba prandiálnym alebo premixovaným inzulínom, postprandiálne exkurzie glykémie sú lepšie ovplyvnené týmito inzulínmi, vtedy je potrebné sekretagogum vynechať.
Pri liečbe tiazolidíndiónom je nutné znížiť dávku, aby sa predišlo edémom alebo excesívnemu prírastku na hmotnosti. Kvôli zvýšenému riziku srdcového zlyhávania je potrebné zvážiť súčasné užívanie tiazolidíndiónov s inzulínom. U niektorých pacientov s vysokými požiadavkami na inzulín v dôsledku ťažkej inzulínovej rezistencie môžu však inzulínové senzitizéry napomáhať pri znižovaní HbA1c a minimalizovaní potrebnej dávky inzulínu.
Kombinácia bazálneho inzulínu a agonistov GLP1-receptorov znižuje glykémiu nalačno a postprandiálnu glykémiu, minimalizuje riziko prírastku na hmotnosti a riziko hypoglykémie v porovnaní s režimom bazál bolus. Kombinácia inhibítorov DPP4 a inhibítorov SGLT2 znižuje riziko hypoglykémie.
Bezpečnosť a dlhodobú účinnosť včasného pridania bazálneho inzulínu glargín potvrdila prospektívna randomizovaná klinická štúdi ORIGIN. Podávanie inzulínu glargín viedlo k normalizácii glykémie nalačno, malo ochranný vplyv na funkciu B-buniek, znížilo riziko prechodu prediabetu do diabetu o 28 %, malo nízky výskyt hypoglykémie a minimálny prírastok na hmotnosti. Inzulín glargín nezvyšoval kardiovaskulárne riziko a ani riziko malignít [73].
Inzulínový režim má byť individualizovaný podľa potrieb konkrétneho pacienta. Dôležité je zosúladenie dávky inzulínu so stravovacími návykmi pacienta, s frekvenciou jedla, s časom príjmu jedla, množstvom prijatých sacharidov a s fyzickou aktivitou. Významnou pomocou pri stanovení dávky inzulínu sú výsledky selfmonitoringu glykémie.
Záver
Individualizovaný prístup k pacientovi si vyžaduje od lekára osobnostné vlastnosti, ako sú vzdelanie, klinické skúsenosti, racionálne rozhodovanie a záujem o človeka. Pravdepodobnosť dosiahnutia pozitívnych terapeutických výsledkov vo veľkej miere však závisí od adherencie pacienta a jeho prístupe ku vlastnému zdraviu. Riziko komplikácií diabetes mellitus sa dá znížiť dodržiavaním liečebným opatrení. Prospešnosť modernej liečby DM je vyššia ako riziko liečby, materiálna, psychologická a sociálna cena liečby. Diabetes mellitus je závažné ochorenie. Je potrebné k nemu pristupovať zodpovedne, s úctou a s pokorou.
Doručené do redakcie 29. 4. 2015
Prijaté po recenzii 4. 5. 2015
MUDr. Vladimír Uličiansky
vladouli@centrum.sk
Via medica, s.r.o., Košice
doc. MUDr. Zbynek Schroner, PhD.
SchronerMED s.r.o., Košice
MUDr. Zuzana Némethyová, CSc.
Dia centrum plus, s.r.o., Bratislava
doc. MUDr. Peter Galajda, CSc.
prof. MUDr. Marián Mokáň, DrSc., FRCP Edin
I. interná klinika JLF UK a UNM, Martin
Zdroje
1. Uličiansky V, Schroner Z, Galajda P et al. Algoritmus liečby diabetes mellitus 2. typu 2011 v klinickej praxi. Diabetes a obezita 2011; 11(22): 9–32.
2. Pozzilli P, Leslie RD, Chan J et al. The A1C and ABCD of glycaemia management in type 2 diabetes: a phycisian´s personalized approach. Diabetes Metab Res Rev 2010; 26(4): 239–244.
3. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of Hyperglycemia in Type 2 Diabetes. A Patient-Centered Approach. Position Statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012; 35(6): 1364–1379.
4. Raz I, Ridle MC, Rosenstock J et al. Personalized Management of Hyperglycemia in Type 2 Diabetes. Reflection from a Diabetes Care Editors´ Expert Forum. Diabetes Care 2013; 36(6): 1779–1788.
5. Škrha J. Úskalí současných poznatků v terapii. In: Škrha J. Cesta diabetologie aneb Kde vše začíná a končí. Maxdorf Jessenius: Praha 2014 : 61–87. ISBN 9788073453855.
6. Matthews DR. Wisdom-based and evidence-based medicine. Diabetes Obes Metab 2012; 14(Suppl 1): 1–2.
7. Uličiansky V. Personalizovaná medicína. In: Uličiansky V (ed). Diabetes mellitus v zrelom veku. Quick Print: Martin 2013 : 34–46.
8. Topolčan O, Kinkorová J. Personalizovaná medicína. Klin Farmakol Far 2012; 26(3): 121–122.
9. Sadee W. Genomics and personalized medicine. Int J Pharm 2011; 415(1–2): 2–4.
10. Florence AT, Lee VHL: Personalised medicines: More tailored drugs, more tailored delivery. Int J Pharm 2011; 415(1–2): 29–33.
11. Chen R, Mias GI, Li-Pook-Than J et al. Personal omics profiling reveals dynamic molecular and medical phenotypes. Cell 2012; 148(6): 1293–1307.
12. Smith RJ, Nathan DM, Arslanian SA et al. Individualizing therapies in type 2 diabetes mellitus based on patient characteristics: what we know and what we need to know. J Clin Endocrinol Metab 2010; 95(4): 1566–1574.
13. European Commission. Research & Innovation – Health. Towards Personalised Medicine. Dostupné z http: <http://ec.europa.eu/research/health/policy-issues-personalised-medicine_en.html>.
14. Mullan RJ, Montori VM, Shah ND et al. The diabetes mellitus medication choice decision aid: a randomized trial. Arch Intern Med 2009; 169(17): 1560–1568.
15. Ďuriš I, Hulín I, Bernardič M. Editorial. In: Ďuriš I, Hulín I, Bernardič M. Princípy internej medicíny 1. Slovak Academic Press: Bratislava 2001. ISBN 80–88908–69–8.
16. Nathan M, Buse JB, Davidson MB et al. Medical management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2009; 52(1): 17–30.
17. Inzuchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015; 38(1):140–149.
18. American Diabetes Association. Standards of medical care in diabetes – 2015. 6. Glycemic Targets. Diabetes Care 2015; 38(Suppl 1): S33–S40. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15-S009>.
19. AACE/ACE Diabetes Guidelines. Endocr Pract 2015; 21(Suppl 1):4. Dostupné z WWW: <https://www.aace.com/files/dm-guidelines-ccp.pdf>.
20. Ismail-Beigi F, Moghissi E, Tiktin E et al. Individualizing glycemic targets in type 2 diabetes mellitus: implications of recent clinical trials. Ann Intern Med 2011; 154(8): 554–559.
21. Uličiansky V. Algoritmus liečby diabetes mellitus 2. typu. Via medica: Košice 2008. ISBN 978–80–970058–3-2.
22. Staník J, Gašperíková D, Klimeš I. Monogénový diabetes mellitus. In: Staník J, Gašperíková D, Klimeš I. Monogénové poruchy sekrécie a účinku inzulínu. Univerzita Komenského: Bratislava 2015. ISBN 978–80–223–3803–5.
23. Schroner Z, Javorsky M, Tkacova R et al. Effect of sulphonylurea treatment on glycaemic control is related to TCF7L2 genotype in patients with type 2 diabetes. Diabetes Obes Metab 2011; 13(1): 89–91.
24. Javorský M, Klimčáková L, Schroner Z et al. KCN11 gene E23K variant and therapeutic response to sulfonylureas. Eur J Intern Med 2012; 23(3): 245–249.
25. Tkáč I, Javorský M, Klimčáková L et al. A pharmacogenetic association between a variation in calpain 10 (CAPN10) gene and the response to metformin treatment in patients with type 2 diabetes. Eur J Clin Pharmacol 2015; 71(1): 59–63.
26. Smushkin G, Sathananthan M, Sathananthan A et al. Diabetes-associated common genetic variation and its association with GLP-1 concentrations and response to exogenous GLP-1. Diabetes 2012; 61(5): 1082–1089.
27. Tsapas A, Matthews DR. N of 1 trials in diabetes: making individual therapeutic decisions. Diabetologia 2008; 51(6): 921–925.
28. O Lillie E, Patay B, Diamant J et al. The n-of-1 clinical trial: the ultimate strategy for individualizing medicine? Per Med 2011; 8(2): 161–173.
29. Nalysnyk L, Hemandez-Medina M, Krishnarajah G. Glycamic variability and complications in patients with diabetes mellitus: evidence from systemic review of the literature. Diabetes Obes Metab 2012; 12(4): 288–298.
30. Monnier L, Colette C. Glycemic variability: should we and can we prevent it? Diabetes Care 2008; 31(Suppl 2): S150-S154.
31. DeFronzo RA. From the Triumvirate to the Ominous Octet: A New Paradigm for the Treatment of Type 2 Diabetes Mellitus. Diabetes 2009, 58(4): 773–796.
32. Kahn SE, Cooper ME, Del Prato S. Pathopysiology and treatment of type 2 diabetes: perspectives on the past, present and future. Lancet 2014; 383(9922): 1068–1083.
33. Haluzík M. Průvodce léčbou diabetu 2. typu pro internisty. Mladá fronta: Praha 2015. ISBN 978–80–204–2405–1.
34. Del Prato S, LaSalle J, Matthaei S et al. Global Partnership for Effective Diabetes Management. Tailoring treatment to the individual in type 2 diabetes practical guidance from the Global Parthership for Effective Diabetes Management. Int J Clin Pract 2010; 64(3): 295–304.
35. Viberti G, Kahn SE, Greene DA et al. A Diabetes Outcome Progression Trial (ADOPT). An international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes. Diabetes Care 2002; 25(10): 1737–1743.
36. Okša A, Ponťuch P, Spustová V et al. Diabetická nefropatia: Diagnostika, prevencia a liečba. Odporúčané postupy Slovenskej nefrologickej spoločnosti a Slovenskej diabetologickej spoločnosti. Forum Diab 2013; 2(Suppl 1): S1-S6.
37. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl (2011) 2013; 3(1): 5–14.
38. Haluzík M. Léčba diabetiků s chronickým onemocněním jater. In: Haluzík M, Rychlík I (eds). Léčba pacientů s onemocněním ledvin a jater. Mladá fronta: Praha 2012 : 115–125. ISBN 978–80–204–2671–0.
39. Romeo GR., Abrahamson MJ, Goldfine AB. Insulin Segretagogues: Sulfonylureas and Glinides. In: Umpierrez GE (ed) Therapy for Diabetes Mellitus and Related Disorders. 6th ed. American Diabetes Association 2014 : 359–376. ISBN 978–1580405096.
40. Zoungas S, Chalmers J, Neal B et al. ADVANCE-ON Collaborative Group. Follow-up of Blood-Pressure Lowering and Glucose Control in Type 2 Diabetes. N Engl J Med 2014; 371(15):1392–1406.
41. Chiasson JL, Josse RG, Gomis R et al. Acarbose for prevention of type 2 diabetes mellitus: the STOP-NIDDM randomised trial. Lancet 2002; 359(8323):2072–2077.
42. Kuo HW, Tiao MM, Ho SC, Yang CY. Pioglitazone use and the risk of bladder cancer. Kaohsiung J Med Sci 2014; 30(2): 94–97.
43. Schroner Z, Uličiansky V. Inhibítory dipeptidyl-peptidázy-4 – základná charakteristika a mechanizmus účinku. In: Schroner Z, Uličiansky V. Liečba diabetes mellitus 2. typu založená na účinku inkretínov. 2. rozšírené vyd. SchronerMed: Košice 2011 : 41–62.ISBN 9788097071479.
44. Egan AG, Blind E, Dunder K et al. Pancreatic safety of incretin-based drugs. FDA and EMA assessment. N Engl J Med 2014; 370(9): 794–797.
45. Štulc T, Šedo A. Inhibition of multifunctional dipeptidyl peptidase-IV: is there a risk of oncological and immunological adverse effects? Diabetes Res Clin Pract 2010; 88(2): 125–131.
46. Marfella R, Barbieri M, Grella R et al. Effects of vildagliptin twice daily vs sitagliptin once daily on 24-hour acute glucose fluctuations. J Diabetes Complications 2010; 24(2): 79–83.
47. Schweizer A, Dejager S, Foley JE et al. Assesing the cardio-vascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab 2010; 12(6): 485–494.
48. White WB, Cannon CHP, Heller SR et al. EXAMINE Investigators. Alogliptin after Acute Coronary Syndrome in Patients with Type 2 Diabetes. N Engl J Med 2013; 369(14): 1327–1335.
49. Scirica BM, Bhatt DL, Braunwald E et al. SAVOR-TIMI 53 Steering Committee and Investigators. Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus. N Engl J Med 2013; 369(14):1317–1326.
50. Nainggolan L. TECOS: No Increase in HF Hospitalization With Sitagliptin. Medscape Medical News. Dostupné z WWW: <http://www.medscape.com/viewarticle/843830>.
51. Bays H. Sodium Glucose Co-transporter Type 2 (SGLP2) Inhibitors: Targeting the Kidney to Improve Glycemic Control in Diabetes Mellitus. Diabetes Ther 2013; 4(2): 195–220.
52. DeFronzo RA, Davidson JA, Del Prato S. The role of the kidneys in glucose homeostasis: a new path towards normalizing glycaemia. Diabetes Obes Metab 2012; 14(1): 5–14.
53. Schroner Z. SGLT-2 inhibítory a iné nové trendy liečby diabetes mellitus 2. typu. In: Uličiansky V, Schroner Z, Galajda P et al. Diabetes mellitus v zrelom veku. Martin: Quick Print 2013 : 93–106.
54. Uličiansky V. Nová stratégia v liečbe diabetu mellitus 2. typu – inhibícia renálnej reabsorpcie glukózy. Interná Med 2014; 14(4): 179–185.
55. Bolinder J, Ljunggren O, Kullberg J et al. Effects of dapagliflozin on body weight, total fat mass and regional adipose tissue distribution in patients with type 2 diabetes mellitus with inadequate glycemic control on metformin. J Clin Endocrinol Metab 2012; 97(3): 1020–1031.
56. Schroner Z, Uličiansky V. Nová cesta v liečbe diabetes mellitus 2. typu – SGLT2 inhibítory. Diabetes a obezita 2014; 14(28): 31–35.
57. Stenlof K, Cefalu WT, Kim KA et al. Efficacy and safety of canagliflozin monotherapy in subjects with type 2 diabetes mellitus inadequately controlled with diet and exercise. Diabetes Obes Metab 2013; 15(4): 372–382.
58. Galajda P, Samoš M, Mokáň M et al. Nový SGLT2 inhibítor – empagliflozín. Diabetes a obezita 2014; 14(28): 37–46.
59. Häring HU, Merker L, Seewald-Becker E et al. Empagliflozin as add-on to metformin in patients with type 2 diabetes: a 24-week, randomized, double-blind, placebo-controlled trial. Diabetes Care 2013; 36(11): 3396–3404.
60. Kendall DM, Cuddihy RM, Bergenstal RM. Clinical application of incretin-based therapy: therapeutic potential, patient selection and clinical use. Am J Med 2009; 122(Suppl 6):S37-S50.
61. Nauck M, Smith U. Increatin - based therapy: how do incretin mimetics and DPP-4 inhibitors fit into treatment algorithms for type 2 diabetic patients? Best Pract Res Clin Endocrinol Metab 2009; 23(4): 513–523.
62. Buse J, Rosenstock J, Sesti G et al. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6). Lancet 2009; 374(9683): 39–47.
63. Stonehouse A, Walsh B, Cuddihy R. Exenatide Once-Weekly Clinical Development. Safety and Efficacy Across a Range of Background Therapies. Diabetes Technol Ther 2011; 13(10): 1063–1069.
64. Meier JJ. GLP‑1 receptor agonists for individualized treatment of type 2 diabetes mellitus. Nat Rev Endocrinol 2012; 8(12):728–742.
65. Horowitz M, Rayner CK, Jones KL. Mechanisms and clinical efficacy of lixisenatide for the management of type 2 diabetes. Adv Ther 2013; 30(2):81–101.
66. Owens DR. Stepwise intensification of insulin therapy in Type 2 diabetes management – exploring the concept of the basal-plus approach in clinical practice. Diabet Med 2013; 30(3): 276–288.
67. Fonseca V, Davidson J, Home P et al. Startins insulin therapy with basal insulin analog or premix insulin analog in T2DM: a pooled analysis of treat-to-targe trials. Curr Med Res Opin 2010; 26(7): 1621–1628.
68. Martinka E. Liečba inzulínom u pacientov s diabetes melltius 2. typu. In: Mokáň M, Martinka E, Galajda P a kol: Diabetes mellitus a vybrané metabolické ochorenia. Vydavateľstvo P+M: Martin 2008 : 323–331. ISBN 978–80–969713–9-8,
69. Halimi S, Raskin P, Liebl A et al. Efficacy of biphasic insulin aspart in patients with type 2 diabetes. Clin Ther 2005; 27(Suppl B): S57-S74.
70. Holman RR, Thorne KI, Farmer AJ et al. 4-T Study Group. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N Engl J Med 2007; 357(17): 1716–1730.
71. Holst JJ, Vilsboll T. Combining GLP-1 receptor agonists with insulin: therapeutic rationales and clinical findings. Diabetes Obes Metab 2013; 15(1): 3–14.
72. Ratner RE, Gough SC, Mathieu C et al. Hypoglycaemia risk with insulin degludec compared with insulin glargine in type 2 and type 1 diabetes: a pre-planned meta-analysis of phase 3 trials. Diabetes Obes Metab 2013; 15(2): 175–184.
73. Gerstein HC, Bosch J, Dagenais GR et al. The ORIGIN Trial Investigators. Basal Insulin and Cardiovascular and Other Outcomes in Dysglycemia. N Eng J Med 2012; 367(4): 319–328.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
2015 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Personalizovaná medicína v diabetológii v kontexte odporúčaní ADA/EASD 2015
- Akútne komplikácie diabetes mellitus z pohľadu ambulantnej praxe
- Význam selfmonitoringu glykémie
- Kompliancia a individualizovaný cieľ liečby u pacientov s DM2T liečených gliptínmi v monoterapii alebo v kombinácii s inými antidiabetikami: štúdia CITADELA
- Najčastejšie gynekologické problémy u žien s diabetom
- Dermatologické manifestácie diabetu
- Autodidaktický test hodnotený kreditmi SACCME
- 12. vedecká konferencia v Topoľčiankach venovaná pamiatke prof. MUDr. Rudolfa Koreca, DrSc.
-
Spomíname na MUDr. Juraja Vozára, CSc.
15. 3. 1946 – 9. 7. 2014 - Diabetes mellitus v ambulantnej praxi – editorial
- Chronické komplikace diabetu z pohledu moderní diabetologie
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akútne komplikácie diabetes mellitus z pohľadu ambulantnej praxe
- Dermatologické manifestácie diabetu
- Najčastejšie gynekologické problémy u žien s diabetom
- Chronické komplikace diabetu z pohledu moderní diabetologie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



