-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKompliancia a individualizovaný cieľ liečby u pacientov s DM2T liečených gliptínmi v monoterapii alebo v kombinácii s inými antidiabetikami: štúdia CITADELA
Compliance and individualized therapeutic targets in patients with DM2T treated with gliptins in monotherapy or in combination with other antidiabetic drugs: CITADELA Study
Introduction:
The recommendations of ADA/EASD professional associations on the management of hyperglycemia in patients with type 2 diabetes mellitus from 2015 emphasize that the care should be adapted to the needs of specific groups of patients. The setting of individual therapeutic goals and the level of their fulfilment in the treatment with gliptins in clinical practice had not been monitored until now in Slovakia.The aim of the study:
The primary aim was to establish the achievement of an individual therapeutic goal of glycemic compensation (HbA1c) in predefined therapeutic regimens containing gliptins in patients with type 2 diabetes mellitus in Slovakia. The secondary aims consisted in monitoring the ways in which demographic characteristics and the presence of other vascular complications affected the reaching of an individual target HbA1c and compensation of the intraday blood glucose variability assessed by means of MAGE algorithm from the 7-point large glycemic profile obtained within domestic monitoring of glycemia.Methods:
CITADELA (TArgets for T2D patiEnt’s using gLiptins Alone or as add on therapy) was a 6-month prospective observation study which monitored 615 patients from 41 centres in the Slovak Republic. The cohort included adult patients with type 2 diabetes mellitus (DM) whose metabolic compensation was insufficient (glycosylated haemoglobin (HbA1c) was within the range of 7% – 11%), and whose initial therapy was intensified by gliptins depending on the physician‘s discretion and based on normal clinical practice. The indicators of glycemic compensation and a comprehensive health status of the patient were recorded at three patient visits.Results:
The average HbA1c level decreased during the course of the study from 8.79% ± 1.26% on entering the study to 7.89%± 1.16% after 3 months, and to 7.57% ± 1.1% after 6 months of therapy, this indicating a positive effect of the treatment with gliptins (p < 0.0001). The average individual target levels expected by physicians for HbA1c were 7.6% after 3rd month and 7.1% after 6th month of treatment. Overall 40.5% of the patients achieved these individually set target HbA1c levels after 3 months and 31.4% after 6 months of treatment. The average daily glucose levels decreased from 10.3 ± 2.2 mmol/l on entering the study to 8.7 ± 1.7 after 3 months and decreased to 8.4 ± 1.6 after 6 months of treatment (p<0.001). Low daily glycemic variability (MAGE≤ 2.8) was observed in 50% of the patients at the time of their inclusion in the study, in 70% after 3 months of treatment and in up to 79% of the patients after 6 months of treatment (p<0.001). It can be definitely stated that the compensation of intraday blood glucose variability significantly increased in the course of the monitoring.Conclusion:
The therapy with gliptins reached the reduction in HbA1c and the intraday glycemic variability in all the predefined therapeutic regimens. The comparison of the results with the expected individual targets of glycemic compensation leads to the conclusion that the goals established by physicians in the clinical practice are more ambitious than the change actually attained.Key words:
type 2 diabetes mellitus – oral antidiabetic drugs – gliptins
Autoři: Zuzana Némethyová 1; Dagmar Bucková 2; Miroslav Helbich 3
Působiště autorů: Dia centrum plus, s. r. o., Bratislava 1; Novartis Slovakia s. r. o., Bratislava 2; Caldera s. r. o, Banská Štiavnica 3
Vyšlo v časopise: Forum Diab 2015; 4(2): 129-134
Kategorie: Hlavná téma: pôvodná práca
Souhrn
Úvod:
V odporúčaniach odborných spoločností ADA/EASD pre manažment hyperglykémie u pacientov s diabetes mellitus 2. typu z roku 2015 sa dôraz kladie na prispôsobenie starostlivosti potrebám špecifických skupín pacientov. Stanovenie individuálnych liečebných cieľov a miera ich naplnenia pri liečbe gliptínmi v reálnej klinickej praxi na Slovensku neboli dosiaľ sledované.Cieľ štúdie:
Primárnym cieľom bolo stanoviť dosahovanie individuálneho liečebného cieľa glykemickej kompenzácie (HbA1c) v preddefinovaných liečebných režimoch gliptínov u pacientov s diabetes mellitus 2. typu na Slovensku. Sekundárnymi cieľmi bolo sledovať ako demografické charakteristiky a prítomnosť iných vaskulárnych komplikácií ovplyvňuje dosahovanie individuálneho cieľového HbA1c a kompenzáciu dennej variability hladín krvného cukru hodnotenú pomocou algoritmu MAGE zo 7-bodového veľkého glykemického profilu získaného v rámci domáceho monitorovania glykémie.Metódy:
CITADELA (TArgets for T2D patiEnt’s using gLiptins Alone or as add on therapy) bola 6 mesačná prospektívna, observačná štúdia, v ktorej sa sledovalo 615 pacientov zo 41 centier v Slovenskej republike. Zaradení boli dospelí pacienti s diabetes mellitus (DM) 2. typu, ktorí neboli dostatočne metabolicky kompenzovaní: glykovaný hemoglobín (HbA1c) sa nachádzal v rozmedzí od 7 % do 11 %, u ktorých bola pôvodná liečba intenzifikovaná gliptínmi podľa uváženia lekára a na základe bežnej klinickej praxe. Ukazovatele glykemickej kompenzácie a komplexný zdravotný stav pacienta sa zaznamenávali na 3 návštevách.Výsledky:
Priemerná hodnota HbA1c klesala počas štúdie z 8,79 % ± 1,26 % pri zaradení na 7,89 % ± 1,16 % po 3 mesiacoch a 7,57 % ± 1,1 % po 6 mesiacoch liečby poukazujúc na pozitívny efekt liečby gliptínmi (p < 0,0001). Priemerné individuálne cieľové hodnoty očakávané lekármi pre HbA1c boli 7,6 % po 3. mesiaci a 7,1 % po 6. mesiaci liečby. Celkovo 40,5 % pacientov dosiahlo tieto individuálne stanovené cieľové hodnoty HbA1c po 3 mesiacoch a 31,4 % po 6 mesiacoch liečby. Priemerné denné hodnoty glykémie sa znížili z 10,3 ± 2,2 mmol/l pri zaradení na 8,7 ± 1,7 po 3 mesiacoch a 8,4 ± 1,6 po 6 mesiacoch liečby (p < 0,001). Nízka hodnota dennej variability glykémie (MAGE ≤ 2,8) sa pozorovala u 50 % pacientov v čase zaradenia do štúdie, po 3 mesiacoch liečby u 70 % a až u 79 % po 6 mesiacoch liečby (p < 0,001). Jednoznačne možno konštatovať výrazný nárast kompenzácie dennej variability glykémie počas sledovania.Záver:
Terapia gliptínmi viedla k redukcii HbA1c a dennej variability glykémie vo všetkých preddefinovaných terapeutických režimoch. Porovnanie výsledkov s očakávanými individuálnymi cieľmi glykemickej kompenzácie vedie k záveru, že ciele stanovené lekármi v reálnej klinickej praxi sú ambicióznejšie ako skutočne dosiahnutá zmena.Key words:
diabetes mellitus 2. type – gliptins – oral antidiabetic drugsÚvod
Diabetes mellitus 2. typu (DM2T) je chronické progresívne metabolické ochorenie, ktoré je charakterizované hyperglykémiou vyplývajúcou z viacerých metabolických abnormalít, ako sú periférna rezistencia na inzulín, porušená sekrécia inzulínu, zvýšená novotvorba glukózy v pečeni a hyperglukagonémia. Prevalencia DM2T v dospelej populácii (vo veku 20–79 rokov) sa pohybuje v európskych krajinách na úrovni 6,8 % a v roku 2013 DM postihoval celosvetovo 382 miliónov dospelých. Do roku 2035 sa očakáva nárast prevalencie DM na 7,7 % a postihnutých bude 592 miliónov dospelých [1].
V nových odporúčaniach odborných spoločností (American Diabetes Association – ADA & European Association for the Study of Diabetes – EASD) pre manažment hyperglykémie u pacientov s DM2T z roku 2015 sa dôraz kladie na prispôsobenie starostlivosti potrebám špecifických skupín pacientov.
EASD/ADA Štandardy zdravotníckej starostlivosti pri DM2T odporúčajú redukciu glykovaného hemoglobínu (HbA1c) < 7,0 % u pacientov s DM2T s cieľom redukovať riziko mikrovaskulárnych komplikácií. S ohľadom na minimalizáciu rizika hypoglykémií a významných nežiaducich účinkov sú prísnejšie cieľové hodnoty HbA1c v intervale 6,0–6,5 % odporúčané iba pre skupinu pacientov, u ktorých bolo ochorenie diagnostikované iba nedávno, očakáva sa u nich dlhé prežívanie a nie sú prítomné známky kardiovaskulárnych ochorení. Naopak, menej prísne cieľové hodnoty v intervale 7,5–8,0 %, sú vhodné pre pacientov s ťažkými hypoglykémiami v anamnéze, kratšou očakávanou dĺžkou života, rozvinutými komplikáciami, mnohopočetnými pridruženými ochoreniami alebo problematickým dosahovaním cieľovej hodnoty napriek viackombinačnej intenzívnej terapii.
Hoci je metformín vo všeobecnosti preferovaným nákladovo najefektívnejším iniciálnym liekom v liečbe DM2T, o iniciálnej liečbe dvoma perorálnymi antidiabetikami alebo inzulínom je treba uvažovať, ak je glykovaný hemoglobín > 9,0 %. Použitie inzulínu ako iniciálneho lieku sa dôrazne odporúča, ak je hodnota HbA1c v intervale medzi 10,0 % až 12,0 %. Ak monoterapiou nie je možné v priebehu 3 mesiacov dosiahnuť individuálny cieľový HbA1c, odporúča sa pridať druhé perorálne antidiabetikum (PAD), GLP1 agonistu alebo inzulín. Ak aj napriek intenzifikácii liečby nedôjde k zlepšeniu kompenzácie, je možné liečbu pridaným antidiabetikom ukončiť a nahradiť ho iným antidiabetikom s rozdielnym mechanizmom účinku. Pridaním tretieho antidiabetika iného ako inzulín s komplementárnym mechanizmom účinku je možné dosiahnuť ďalší terapeutický prospech, ale za najlepšie riešenie sa považuje pridanie inzulínu predovšetkým u pacientov, u ktorých zostáva hodnota HbA1c > 8,5 % [2].
Gliptíny predstavujú novú triedu PAD patriacu do skupiny inhibítorov dipeptidyl peptidázy 4 (DPP4). Gliptíny inhibujú inaktiváciu glukagónu podobného peptidu 1 (GLP1) a glukózo-dependentného inzulinotropného polypeptidu pomocou inhibície enzýmu DPP4, čím umožňujú GLP1 a GIP stimulovať sekréciu inzulínu z betabuniek, a súčasne potláčať sekréciu glukagónu z alfabuniek Langerhansových ostrovčekov v pankrease [3].
ADA/EASD odporúčania poznamenávajú, že manažment glykémie pri DM2T sa stáva čoraz komplikovanejším vzhľadom k stúpajúcemu počtu dostupných liečiv. Narastajú obavy nielen z potenciálnych nežiaducich účinkov vyvolaných týmito liekmi, ale narastá aj neistota ohľadom rizika kardiovaskulárnych dôsledkov navodených intenzívnou glykemickou kontrolou [4].
Štúdia CITADELA bola observačná štúdia vychádzajúca z reálnej klinickej praxe, ktorej primárnym cieľom bolo sledovať dosahovanie individuálneho liečebného cieľa glykemickej kompenzácie (HbA1c) v preddefinovaných liečebných režimoch gliptínov v súlade so schválenými indikáciami jednotlivých gliptínov.
Sekundárnymi cieľmi bolo sledovať vplyv demografických a anamnestických parametrov v čase zaradenia pacienta do štúdie na dosahovanie individuálneho cieľa pre HbA1c a na dosiahnutie kompenzácie dennej variability glykémie určenej podľa algoritmu MAGE (mean amplitude of glycemic excursion) [5,6] v jednotlivých liečebných režimoch. Sledoval sa aj výskyt mikrovaskulárnych komplikácií v sledovanej populácii pacientov a dosahovanie individuálneho cieľa pre očakávanú zmenu telesnej hmotnosti.
V tejto práci uvádzame výsledky finálnej analýzy zo štúdie CITADELA (TArgets for T2D patiEnt’s using gLiptins Alone or as add on therapy).
Metódy
Dizajn štúdie
CITADELA (Kompliancia a individualizovaný cieľ liečby u pacientov s DM2T, ktorí sú liečení gliptínmi v monoterapii alebo v kombinácii s inými antidiabetikami) bola 6 mesačná prospektívna, observačná štúdia, v ktorej sa sledovalo 615 pacientov zo 41 centier v Slovenskej republike. Zaradení boli dospelí pacienti s DM2T, ktorých glykovaný hemoglobín HbA1c nebol dostatočne kompenzovaný, bol v rozmedzí od 7 % do 11 %, a ktorí začali liečbu gliptínmi podľa uváženia lekára, bežnej klinickej praxe a podľa schválených indikácií gliptínov, pričom nesmeli byť liečení gliptínmi dlhšie ako 4 týždne pred zaradením do sledovania. Pacienti museli byť ochotní monitorovať si hladinu krvného cukru glukomerom v rámci domáceho monitorovania glykémie. Pacienti nesmeli mať závažné komplikácie obličiek, pečene a iné závažné ochorenia. Vylúčení boli aj pacienti so známou precitlivelosťou na gliptíny alebo pomocné látky, ktoré sa v zodpovedajúcich liekoch nachádzajú. Výsledky boli hodnotené za všetkých pacientov aj samostatne v preddefinovaných terapeutických režimoch podľa prídavnej liečby. Hodnoty kompenzácie glykémie a zdravotný stav pacienta sa zaznamenávali na 3 návštevách – pri zaradení, po 3. mesiacoch a po 6. mesiacoch od zaradenia pacienta do štúdie.
Cieľové ukazovatele účinnosti a znášanlivosti
Primárnym cieľovým ukazovateľom bol podiel pacientov dosahujúcich individuálne cieľové hodnoty kompenzácie HbA1c (metodika DCCT) na jednotlivých návštevách. Kompenzácia dennej variability hladín krvného cukru, ktorá sa ukazuje byť významným faktorom kompenzácie DM2T [7], bola vyhodnotená zo 7-bodového veľkého glykemického profilu získaného v rámci domáceho monitorovania glykémie pomocou algoritmu MAGE [5,6]. Za dobrú kompenzáciu sa považovala hodnota MAGE ≤ 2,8. Výskyt mikrovaskulárnych komplikácií bol zaznamenaný retrospektívne pri zaradení pacienta do štúdie. Pacienti, u ktorých nebolo možné hodnotiť HbA1c alebo glykemický profil k danej návšteve z dôvodu chýbajúcich údajov, nie sú zaradení do príslušnej analýzy.
Analýza primárnych a sekundárnych cieľových ukazovateľov účinnosti a znášanlivosti
Primárny cieľ – podiel pacientov dosahujúcich individuálny liečebný cieľ glykemickej kompenzácie (HbA1c) v terapeutických ramenách – bol porovnaný c2-testom. Štatistická významnosť zmeny hodnôt a analýza vplyvu demografických, anamnestických a liečebných charakteristík na dosiahnutie cieľových hodnôt bola realizovaná pomocou ANCOVA pre spojité premenné a pomocou logistickej regresie pre podiel pacientov dosahujúcich cieľové hodnoty.
Jednotlivé parametre sú popísané štandardnými metódami deskriptívnej štatistiky. Spojité premenné sú popísané ako priemer ± SD doplnené príslušným 95% intervalom spoľahlivosti, diskrétne premenné ako n (%) pacientov v danej kategórii. Všetky štatistické testy sú 2-stranné. Výsledky sú považované za štatisticky významné pri hranici a = 5 %.
Výsledky
Populácia pacientov a východiskové charakteristiky
Do štúdie bolo zaradených 615 pacientov zo 41 centier v Slovenskej republike, ktorí spĺňali kritériá pre zaradenie a svoj súhlas so zaradením vyjadrili podpísaním informovaného súhlasu pacienta. Údaje zo sledovania neboli dostupné u 12 (2 %) pacientov po 3 mesiacoch a u 28 (4,5 %) pacientov po 6 mesiacoch sledovania.
Priemerný vek pacientov (tab. 1) pri zaradení bol 60,9 ± 9,6 roku, trvanie DM2T bolo 8,7 ± 6,0 roku a priemerná hodnota HbA1c bola 8,8 ± 1,3 %. Priemerný BMI pri zaradení bol 33,3 ± 9,0 kg/m2, pričom väčšina pacientov (76,3 %) bola obéznych s BMI > 30 kg/m2. Pacienti, ktorí sa venujú aeróbnej aktivite (27,6 %), majú nižšie BMI. Približne polovica pacientov (49 %) žije v meste. Väčšina pacientov mala stredoškolské vzdelanie (62 %), univerzitné vzdelanie malo iba 9 % pacientov. Dôchodcovia tvorili 49,6 % populácie. Miera nezamestnanosti bola 14,3 % zo všetkých zamestnateľných pacientov a je porovnateľná s celkovou mierou nezamestnanosti na Slovensku. Liečba DM2T pred zaradením do štúdie pozostávala prevažne z liečby metformínom (85,4 %) a sulfonylureou (SU) (46,7 %). Inzulín užívalo 14,1 % pacientov, liečbu antihypertenzívami malo 74 % pacientov a hypolipidemikami 53 % pacientov. Gliptíny boli pri zaradení najčastejšie predpísané ako prídavná liečba k metformínu (41,1 %) alebo ku kombinácii metformín + sulfonylurea (13,0 %). Použitie gliptínov ako druholíniovej monoterapie u pacientov, u ktorých metformín nie je vhodný pre kontraindikáciu alebo intoleranciu, je veľmi zriedkavé (tab. 1).
Tab. 1. Demografia a východiskové charakteristiky pacientov 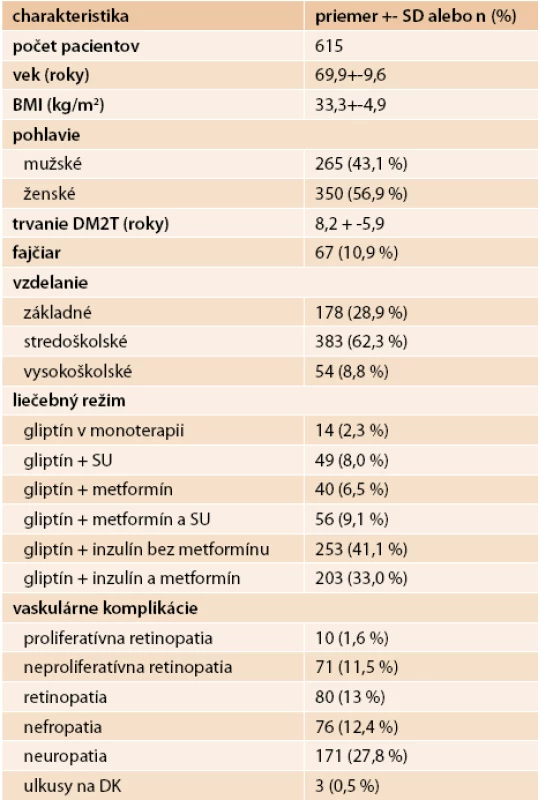
Primárne a sekundárne cieľové ukazovatele
Priemerná hodnota HbA1c klesala počas štúdie z 8,79 % ± 1,26 % pri zaradení na 7,89 % ± 1,16 % po 3 mesiacoch a 7,57 % ± 1,1 % po 6 mesiacoch liečby, poukazujúc na pozitívny efekt liečby gliptínmi (tab. 2). Priemerná zmena bola -0,87 % (95 % CI = -0,95, -0,78; p < 0,0001) v 3. mesiaci a -1,17 %; (95 % CI = -1,26, -1,08; p < 0,0001) v 6. mesiaci liečby. Podiel pacientov s HbA1c ≥ 10 % klesol z 19,8 % na 4,3 %.
Tab. 2. Primárne a sekundárne cieľové ukazovatele účinnosti 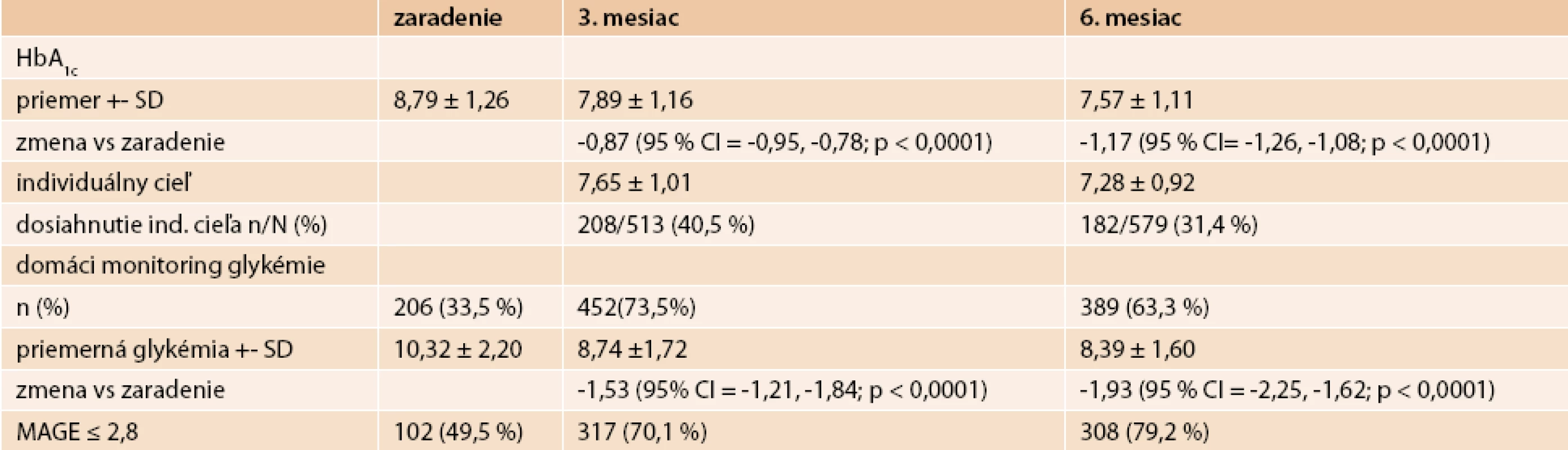
Multivariačná analýza (ANCOVA) ukázala, že redukcia HbA1c je vyššia u pacientov z vysokou vstupnou hodnotou HbA1c (p < 0,01), univerzitným vzdelaním (p = 0,011) a v liečebnom režime, kde gliptín bol pridaný k liečbe metformínom (p = 0,005). Nižšia zmena HbA1c bola dosiahnutá u pacientov s vysokým BMI (p < 0,001) a inzulínovou liečbou (p < 0,01). Nebola zistená závislosť na trvaní diabetu, veku, pohlaví, fajčení a prítomnosti vaskulárnych komplikácií.
Individuálne ciele HbA1c pre nasledujúcu návštevu boli nastavené na návšteve pri zaradení do štúdie a na návšteve po 3 mesiacoch liečby. Individuálne ciele majú široké spektrum hodnôt, pričom vyššie cieľové hodnoty sú stanovené pre pacientov s vysokým vstupným HbA1c. Priemerné očakávané cieľové hodnoty boli 7,6 % ± 1,0 % po 3. mesiaci a 7,1 % ± 0,9 % po 6. mesiaci liečby. V porovnaní so skutočne dosiahnutými hodnotami glykémie (očakávaná zmena medzi zaradením a hodnotami po 3. mesiacoch o -1,20 % vs skutočná zmena o -0,87 % ; očakávaná zmena medzi 3. a 6. mesiacom o -0,72 %, skutočná zmena o -0,31 %) možno konštatovať, že ciele stanovené lekárom sú ambicióznejšie ako reálne dosiahnutá zmena v klinickej praxi (graf. 1). Celkovo 40,5 % pacientov dosiahlo cieľové hodnoty HbA1c po 3. mesiaci a 31,4 % po 6. mesiaci liečby. Multivariačná analýza (logistická regresia) preukázala, že dosahovanie individuálneho cieľa je nižšie u pacientov s nízkym vstupným HbA1c (p < 0,001) a vysokou očakávanou zmenou HbA1c (p < 0,001). Dosiahnuté výsledky môžeme interpretovať nasledovne: vysoké očakávania pri nízkom vstupnom HbA1c nie sú v reálnej klinickej praxi naplnené.
Graf 1. Zmena priemerného HbA<sub>1c</sub> 
Veľký glykemický profil pozostával zo 7 meraní denne. Miera dennej variability glykémie bola stanovená pomocou MAGE algoritmu u pacientov s aspoň 6 zaznamenanými dennými meraniami glykémie. Hodnota MAGE ≤ 2,8 znamenala nízku hladinu dennej variability.
Glykemický profil bol dostupný retrospektívne u 33 % pacientov v čase pred zaradením do štúdie a prospektívne u 70 % po 3. mesiaci a u 63 % pacientov po 6. mesiaci od zaradenia (tab. 2). Podiel pacientov s domácim monitoringom jednoznačne narástol vplyvom zaradenia pacienta do štúdie.
Nebol zistený žiadny rozdiel medzi hodnotami glykémie počas pracovného dňa a cez víkend a pre ďalšie analýzy bola použitá hodnota z pracovného dňa. Priemerné denné hodnoty glykémie sa znížili z 10,3 mmol/l ± 2,2 pri zaradení na 8,7 mmol/l ± 1,7 v 3. mesiaci 8,4 mmol/l ± 1,6 v 6. mesiaci (p<0,001 vs hodnota pri zaradení). Nízka hodnota dennej variability bola dosiahnutá u 50 % pacientov v čase zaradenia do štúdie, 70 % po 3. mesiaci a 79 % po 6. mesiaci liečby (p < 0,001). Jednoznačne možno konštatovať výrazný nárast kompenzácie dennej variability počas sledovania. Mutlivariačná analýza (logistická regresia) nezistila žiadne štatisticky významné prediktory dosiahnutia dobrej kompenzácie dennej variability glykémie.
Údaje o výskyte mikrovaskulárnych komplikácií boli zaznamenané v čase zaradenia pacienta do štúdie. Najčastejšou komplikáciou DM2T bola diabetická polyneuropatia, ktorá sa vyskytla u 171 (27,8 %), diabetická retinopatia u 80 (13,0 %) s prevažne neproliferatívnou formou a nefropatia u 76 (12,4 %) pacientov (tab. 1). Ulkusy na dolných končatinách sa vyskytli len u 3 (0,5 %) pacientov. Z retrospektívnych údajov vyplýva, že v priebehu 6 mesiacov sledovania iného špecialistu navštívilo 92,5 % pacientov s retinopatiou, 57 % pacientov s diagnostikovanou neuropatiou a 62 % pacientov s diagnostikovanou nefropatiou. Výsledky poukazujú, že časť pacientov zostáva bez dispenzarizácie u špecialistu pre danú komplikáciu.
Vyššia incidencia retinopatie, nefropatie a neuropatie bola pozorovaná u pacientov s dlhším trvaním diabetu (p<0,01) a pri liečbe inzulínom (p < 0,01). Nezistil sa vplyv veku, pohlavia, fajčenia, vzdelania, ani vstupnej hodnoty HbA1c. Vyšší BMI viedolo k vyššiemu výskytu neuropatie (p = 0,029), ale nie retinopatie, ani nefropatie.
Počas sledovania došlo k miernemu, ale štatisticky významnému zníženiu telesnej hmotnosti pacientov. Priemerná zmena bola -0,86 kg po 3 mesiacoch a -1,50 kg po 6 mesiacoch sledovania. Dosiahnuté zmeny sú výrazne nižšie ako očakávania lekára. Individuálne ciele pre zmenu hmotnosti boli -2,75 kg medzi zaradením a 3. mesiacom liečby a -2,68 kg medzi 3. a 6. mesiacom liečby. Podiel pacientov, ktorí dosiahli cieľové hodnoty zmeny hmotnosti, bol 28,7 % po 3 mesiacoch a 23,7 % po 6 mesiacoch liečby a poukazuje na nepomer medzi vysokými očakávaniami lekára a reálne dosiahnutou redukciou hmotnosti.
Ku koncu sledovania lekári vypísali celkové subjektívne hodnotenie dosiahnutia individuálnych cieľov pre konkrétneho pacienta (graf 2). Hodnotenie súhlasí so závermi štúdie, že najľahšie je redukovať HbA1c pomocou farmakologickej liečby, náročnejšie je presvedčiť pacientov k domácemu monitoringu glykémie a najťažšie je primäť pacientov zmeniť životný štýl prezentovaný ako zvýšenie aeróbnej aktivity a redukciu hmotnosti.
Graf 2. Subjektívne hodnotenie dosiahnutia cieľov lekárom 
Analýza bezpečnosti
Zisťovanie a hlásenie nežiaducich účinkov vychádzalo zo schémy dobrovoľného hlásenia, čo je najčastejšie používaná metóda na zisťovanie nežiaducich účinkov pre nové lieky v klinickej praxi [7,8]. Nežiaduce udalosti boli vo všeobecnosti zriedkavé, pravdepodobne nedostatočne hlásené v celkovej populácii ako aj na Slovensku. Celkovo bolo hlásených len 11 prevažne nezávažných nežiaducich účinkov. Súvis s liečbou glitpínmi bol len u 7 pacientov. Z dôvodu malého počtu udalostí sa nevykonala štatistická analýza rozdielov medzi skupinami.
Diskusia
Štúdia poskytla údaje s vysokou kvalitou a mierou sledovania pacientov. Kvalita vstupných údajov prevyšovala očakávania autorov. Výnimku predstavujú údaje o kompliancii pacientov, ktorá nebola správne pochopená a vyplnená. Kompliancia pravdepodobne nemôže byť hodnotená čisto na základe subjektívneho hodnotenia lekárom a počtu vrátených tabliet a vyžadovala by samostatný dizajn štúdie.
Hlavné metodologické obmedzenie štúdie spočíva v neintervenčnom dizajne a nekontrolovanom nábore pacientov. Nábor pacientov do longitunálnej štúdie nesie so sebou riziko zaradenia pacientov, ktorí pravidelne navštevujú diabetológa, sú ochotní spolupracovať a zaujímajú sa o manažment svojho ochorenia viac ako je priemer všeobecnej populácie diabetikov.
Štúdia preukázala, že došlo k poklesu hodnôt glykovaného hemoglobínu (HbA1c) vo všetkých preddefinovaných terapeutických režimoch ako dôsledok liečby gliptínmi. Na redukciu HbA1c mohli mať vplyv aj ďalšie faktory, ako sú zvýšená pozornosť k ochoreniu vyplývajúca z účasti v štúdii a zvýšenej frekvencie domáceho monitoringu glykémie alebo povzbudenie k aeróbnej aktivite a redukcii telesnej hmotnosti. Vplyv iniciatívy pacienta demonštruje zistenie, že u pacientov s vysokoškolským vzdelaním došlo k vyššej redukcii HbA1c, pravdepodobne vďaka svedomitejšiemu prístupu k manažmentu ochorenia. Čistý efekt vplyvu liečby gliptínov na redukciu HbA1c je možné hodnotiť len v randomizovanej klinickej štúdii.
Záver
Údaje zo štúdie CITADELA preukázali, že v reálnej klinickej praxi pridanie gliptínov u pacientov s nedostatočnou kontrolou glykémie viedlo k štatisticky významnej redukcii HbA1c vo všetkých preddefinovaných liečebných režimoch. Výsledky naznačujú, že očakávania lekárov sú ambiciózne a individuálne ciele glykemickej kompenzácie stanovené pre pacienta nie sú v reálnej klinickej praxi dostatočne naplnené. Výsledky štúdie ukazujú, že v reálnej klinickej praxi je najjednoduchšie redukovať HbA1c pomocou farmakologickej liečby, náročnejšie je presvedčiť pacientov k domácemu monitoringu glykémie a najťažšie je primäť pacientov k zdravšiemu životnému štýlu.
Investigátori (uvedení v abecednom poradí)
MUDr. Jana Babíková, Rimavská Sobota; MUDr. Viera Belková, Turzovka; MUDr. Oľga Beňušová, Štúrovo; MUDr. Jozef Brečka, Bratislava; MUDr. Mária Čákyová, Poprad; MUDr. Ján Čulák, Preividza; MUDr. Jolana Drotárová, Dunajská Streda; MUDr. Blažena Dysková, Keržmarok; MUDr. Ľudmila Forbaková, Liptovský Hrádok; MUDr. Daniela Garajová, Zlaté Moravce; MUDr. Alžbeta Ginelliová, Kráľovský Chlmec; MUDr. Vladimír Grumel, Vranov nad Topľou; MUDr. Anna Gyuttmentová, Bánovce nad Bebravou; MUDr. Mária Iváková, Žilina; MUDr. Gabriela Ivaničová, Košice; MUDr. Peter Kentoš, PhD., Banská Bystrica; MUDr. Valéria Krajčovičová, Galanta; MUDr. Daniela Kollárová, PhD., Šurany; MUDr. Júlia Krnáčová, Hnúšťa; MUDr. Gabriela Lacková, Levice; MUDr. Katarína Malicherová, Čadca; MUDr. Martina Merčiaková, Sabinov; MUDr. Zuzana Némethyová, CSc., Bratislava; MUDr. Elena Nehajová, Čadca; MUDr. Agneša Okellová, Topoľčany; MUDr. Ladislav Pavlík, Šaľa; MUDr. Radovan Plášil, Vrútky; MUDr. Oľga Polková, Martin; MUDr. Eva Prekopová, Komárno; MUDr. Karol Rummer, Veľký Meder; MUDr. Oľga Rybárová, Revúca; MUDr. Mária Škovránová, Snina; MUDr. Lujza Štrbová, Pezinok; MUDr. Gabriela Švrčková, Skalica; MUDr. Ján Truban, Dolný Kubín; MUDr. Monika Urbanová, Nitra; MUDr. Anton Vargovič, Svidník; MUDr. Zlatica Vasilenková, Humenné; MUDr. Daniela Vojtková, Košice; MUDr. Renáta Žalúdková, Michalovce; MUDr. Jozef Žilinka, Piešťany
Doručené do redakcie 30. 4. 2015
Prijaté po recenzii 11. 5. 2015
MUDr. Zuzana Némethyová , CSc.
zuzana.nemethyova@mail.t-com.sk
Dia centrum plus, s.r.o., Bratislava
Zdroje
1. Guariguata L, Whiting DR, Hambleton I et al. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Res Clin Pract 2014; 103(2): 137–149.
2. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach. Update to a Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2015; 38(1): 140–149. Diabetologia 2015; 58(3): 429–442. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–014–3460–0>.
3. Ahrén B, Landin-Olsson M, Jansson PA et al. (2004). Inhibition of dipeptidyl peptidase-4 reduces glycemia, sustains insulin levels, and reduces glucagon levels in type 2 diabetes. J Clin Endocrinol Metab 2004; 89(5): 2078–2084.
4. Weiss D. ADA Issues New Type 2 Diabetes Treatment Guidelines. Dostupné z WWW: <http://www.pharmacytimes.com/news/ADA-Issues-New-Type-2-Diabetes-Treatment-Guidelines#sthash.wrnxmCxD.dpuf>.
5. Martin Haluzík. Glykemická variabilita: nový parametr kompenzace diabetu? Forum Diab 2012; 1(2–3): 71–76.
6. Hill NR, Oliver NS, Choudhary P et al. Normal reference range for mean tissue glucose and glycemic variability derived from continuous glucose monitoring for subjects without diabetes in different ethnic groups. Diabetes Technol Ther 2011; 13(9): 921–928.
7. Siegelaar SE, Holleman F, Hoekstra JB et al. Glucose variability; does it matter? Endocr Rev 2010; 31 : 171–182.
8. Perez Garcia M, Figueras A. The lack of knowledge about the voluntary reporting system of adverse drug reactions as a major cause of underreporting: direct survey among health professionals. Pharmacoepidemiol Drug Saf 2011; 20(12): 1295–1302.
9. Hazell L, Shakir SA. Under-reporting of adverse drug reactions: a systematic review. Drug Saf 2006; 29(5): 385–396.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
2015 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Personalizovaná medicína v diabetológii v kontexte odporúčaní ADA/EASD 2015
- Akútne komplikácie diabetes mellitus z pohľadu ambulantnej praxe
- Význam selfmonitoringu glykémie
- Kompliancia a individualizovaný cieľ liečby u pacientov s DM2T liečených gliptínmi v monoterapii alebo v kombinácii s inými antidiabetikami: štúdia CITADELA
- Najčastejšie gynekologické problémy u žien s diabetom
- Dermatologické manifestácie diabetu
- Autodidaktický test hodnotený kreditmi SACCME
- 12. vedecká konferencia v Topoľčiankach venovaná pamiatke prof. MUDr. Rudolfa Koreca, DrSc.
-
Spomíname na MUDr. Juraja Vozára, CSc.
15. 3. 1946 – 9. 7. 2014 - Diabetes mellitus v ambulantnej praxi – editorial
- Chronické komplikace diabetu z pohledu moderní diabetologie
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akútne komplikácie diabetes mellitus z pohľadu ambulantnej praxe
- Dermatologické manifestácie diabetu
- Najčastejšie gynekologické problémy u žien s diabetom
- Chronické komplikace diabetu z pohledu moderní diabetologie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



