-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stanovení antimikrobiálních účinků slizu plže Achatina reticulata
Determination of antimicrobial activity of Achatina reticulata slime
Backgrounds: Snails (Gastropoda) have a mechanism for the production of a significant amount of slime and substances contained therein they use to protect themselves against bacterial or fungal pathogens. These active substances are involved in both humoral and cellular immune responses of the gastropods. The antibacterial or antifungal effect of the humoral immune component of slime lies in cytotoxic and haemagglutination activity against potential microbial pathogens. The activity of antibacterial agents present in Achatina reticulata slime against bacterial strains of Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, and Pseudomonas aeruginosa was tested.
Material and Methods: A total of five samples of slime from laboratory reared Achatina reticulata were tested. To eliminate potential microbial contamination, slime samples were sterilized by UV radiation. To screen slime samples for antibacterial activity, the simple diffusion method on Mueller-Hinton agar was used. Samples diluted in guaiacol glycerol ether were used in the testing.
Results: The results show that the biologically active substances present in Achatina reticulata slime have an antimicrobial activity which is almost commensurate with that of the conventional antibiotics used to treat bacterial infections. The results of the determination of the antimicrobial effects of Achatina reticulata slime also highlighted viridation (partial hemolysis of erythrocytes after 24 hours of slime cultivation exposed to UV light for 60 minutes on Columbia blood agar.
Conclusions: The results of the antimicrobial activity testing of selected Achatina reticulata slime samples show that the gastropod slime contains biologically active substances with a relatively significant antimicrobial activity.
Keywords:
Achatina reticulata – antimicrobial activity of snail slime
Autoři: D. Chmelař 1; R. Hinštová 2; J. Kuzma 1; M. Hájek 1
Působiště autorů: Katedra biomedicínských oborů, Pracoviště mikrobiologie a imunologie, Lékařská fakulta Ostravské univerzity 1; Katedra biologie a ekologie, Přírodovědecká fakulta Ostravské univerzity 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 2, s. 65-70
Kategorie: Původní práce
Souhrn
Cíl práce: Plži (Gastropoda) disponují mechanismem tvorby značného množství slizu a v něm obsažených látek, které využívají k obraně před bakteriálními či mykotickými patogeny. Tyto účinné látky se podílejí na realizaci jak humorální, tak i buněčné imunity plžů. Antibakteriální či antimykotický účinek humorální složky slizu plžů spočívá v cytotoxické a hemaglutinační aktivitě vůči potencionálním mikrobiálním patogenům. Účinek antibakteriálních látek přítomných ve slizu plžů Achatina reticulata byl testován na kmenech bakterií Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae a Pseudomonas aeruginosa.
Materiál a metody: Celkem bylo testováno 5 vzorků slizu odebraných z laboratorního chovu plže Achatina reticulata. Kvůli eliminaci případné mikrobiální kontaminace vzorků slizu bylo ke sterilizaci slizu použito UV záření. Ke stanovení účinků antibakteriálních účinků vzorků slizu byla použita prostá difuzní metoda na Mueller-Hinton agaru. K testování antimikrobiálních účinků slizu byly používány jeho naředěné vzorky v guaiacol glycerid éteru.
Výsledky: Výsledky stanovení antimikrobiálních účinků slizu plže Achatina reticulata svědčí o tom, že biologicky aktivní látky přítomné ve slizu hlemýždě Achatina reticulata vykazují téměř souměřitelnou účinnost jako klasická antibiotika používaná pro léčbu bakteriálních infekcí. Výsledky stanovení antimikrobiálních účinků slizu plže Achatina reticulata taktéž upozornily na viridaci (částečnou hemolýzu erytrocytů) po 24hodinové kultivaci slizu exponovaného UV zářením po dobu 60 minut na Columbia krevním agaru.
Závěr: Výsledky stanovení antimikrobiálních účinků vybraného slizu hlemýždě Achatina reticulata svědčí o tom, že sliz hlemýžďů ze skupiny Gastropoda obsahuje biologicky účinné látky s poměrně výrazným antimikrobiálním účinkem.
Klíčová slova:
Achatina reticulata – antimikrobiální účinky slizu plžů
ÚVOD
V současné době vyvstává potřeba účinné léčby celé řady kožních onemocnění. Nejenom zajímavou, ale i relativně účinnou formou řešení tohoto problému se jeví aplikace jednotlivých látek přítomných ve slizu plicnatých plžů (Gastropoda). Plži disponují mechanismem tvorby značného množství slizu a v něm obsažených látek, které využívají k obraně před bakteriálními či mykotickými patogeny. Tyto účinné látky se podílejí na realizaci jak humorální, tak i buněčné imunity plžů. Mezi nejčastěji produkovanými látkami tohoto typu ve slizu plžů patří především achacin, lektin, mytimacin-AF a celá řada dalších látek (acharan sulfát, glutation-S-transferáza, superoxiddismutáza, mucin). Antibakteriální či antimykotický účinek humorální složky slizu plžů spočívá v cytotoxické a hemaglutinační aktivitě vůči potencionálním patogenům. Účinnost výše zmíněných látek nemusí být vždy dostačující k usmrcení jednotlivých patogenů, avšak dokáže narušit exponenciální fází růstu především mikrobiálních patogenů, popř. tyto látky mohou indukovat aglutinaci grampozitivních a gramnegativních bakterií [8].
Bakterie a kvasinky druhů Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Staphylococcus epidermidis a Candida albicans způsobují u člověka řadu kožních onemocnění a jsou původci komunitních infekcí. Mezi nejčastější soudobé kožní onemocnění se řadí např. lupénka, atopický ekzém, akné, infekční onemocnění kůže, kožní onemocnění vyvolávaná patogenními plísněmi, viry a parazity (viry bradavic, herpes viry) a autoimunní onemocnění – lupus erythematosus (systémový lupus). Značné množství těchto patogenních agens pochází z nemocničního prostředí, kde se pravidelně dostávají do kontaktu s dezinfekčními prostředky či antibiotiky a stávají se rezistentními. Také mnohé látky používané k léčbě kožních onemocnění (např. kortikoidy) nejsou dlouhodobě účinné a stávají se nefunkčními. Ke stanovení antibakteriálního a antimykotického účinku slizu plžů jsme experimentálně používali vhodně naředěné vzorky slizu těchto plžů. K získání polárních a nepolárních frakci látek byla vybrána různá rozpouštědla podle jejich polarity: destilovaná voda, broncholyzin, guaiacol glyceryl ether a hexan [6].
Sliz plžů obsahuje kromě účinných látek i fakultativně (symbiotické) patogenní bakterie, které osídlují jejich tělní dutiny a mohly by být patogenní i pro člověka. Z tohoto důvodu bylo ze vzorků slizu izolováno 5 kmenů gramnegativních bakterií (viz obr. 2], které byly identifikovány pomocí hmotnostní spektrometrie s laserovou desorpcí a ionizací (MALDI-TOF). Identifikace těchto kmenů prokázala, že se jednalo o 3 půdní bakterie – Leclercia adecarboxylata, Escherichia hermannii, Pseudomonas extremorientalis. S ohledem na výskyt těchto druhů gramnegativních bakterií, které byly přítomny v testovaných vzorcích slizu plžů, byla zavedena sterilizace těchto vzorků pomocí UV záření [5].
Obr. 1. Vzorek slizu plžů exponovaný UV zářením po dobu 60 minut po 24hodinové kultivaci na Columbia krevním agaru Viditelná viridace – částečná hemolýza beraních erytrocytů v místě očkovací čáry, kde nebyl detekován žádný nárůst bakterii, což svědčí o biologickém účinku látek přítomných ve slizu.
Figure 1. Slime sample exposed to UV radiation for 60 minutes after 24 hours of culture on Columbia blood agar Visible alpha haemolysis – partial haemolysis of sheep erythrocytes along the inoculation line where no bacterial growth was detected, which indicates biological activity of the substances present in snail slime.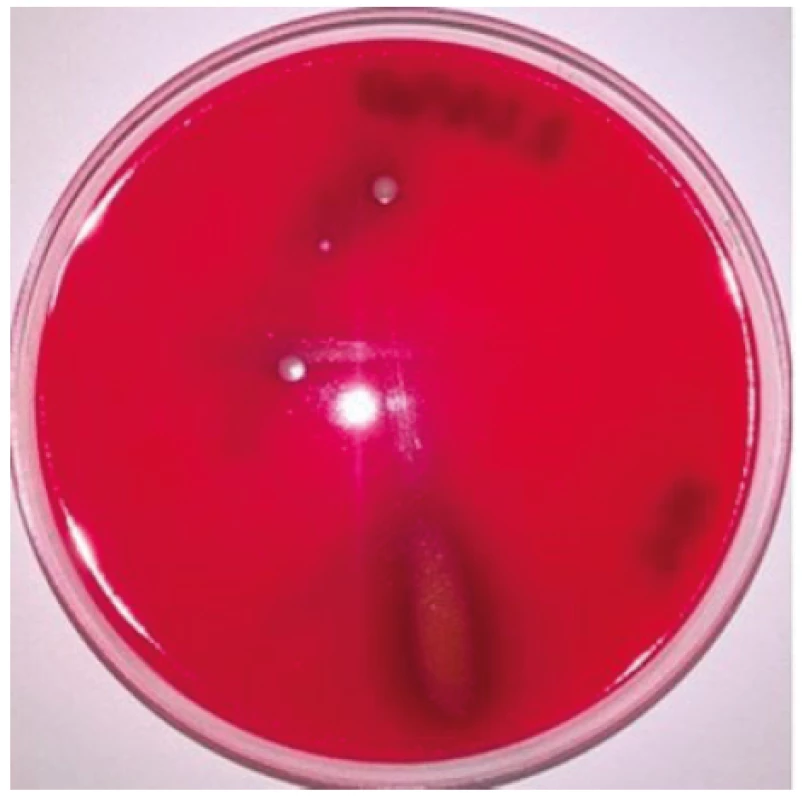
Obr. 2. Vzorek slizu kultivovaný 24 hodin na Columbia krevním agaru
Sliz – neředěný a ředěný (na snímku vpravo) – je kontaminován půdní bakteriální mikrobiotou.
Figure 2. Slime sample cultured for 24 hours on Columbia blood agar
Slime – undiluted and diluted (pictured on the right) – is contaminated by soil bacterial microbiota.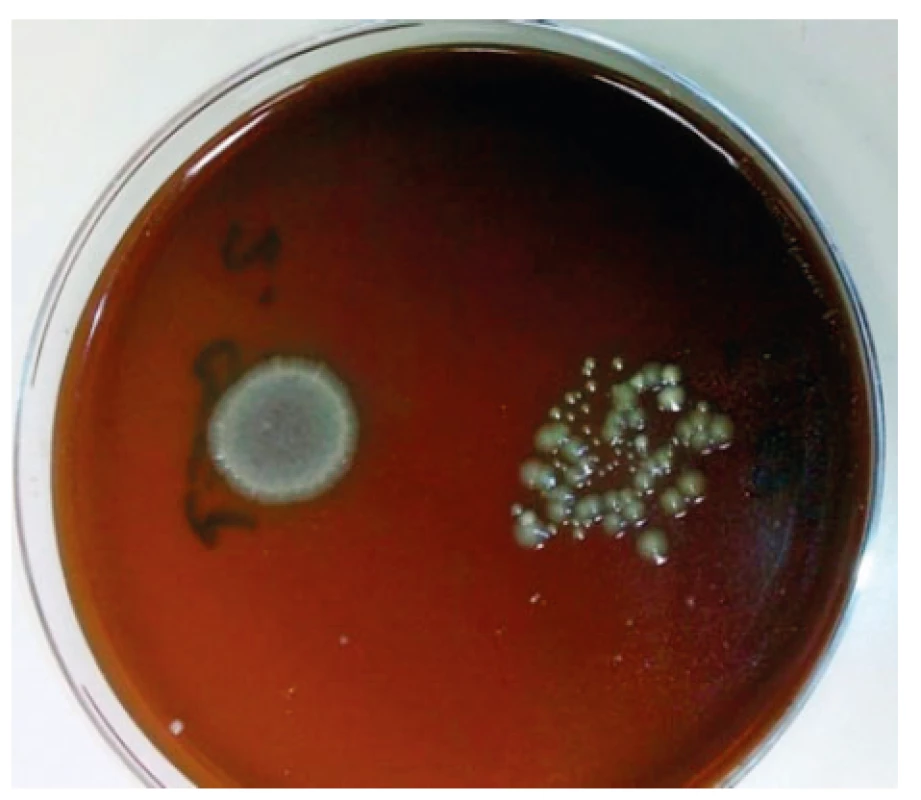
Mechanismus antibakteriálního a antimykotického účinku látek: achacin, lektin, mytimacin – AF a acharan sulfát
Mezi účinné látky plžů, které mají antibakteriální a antimykotický účinek, patří lektin, achacin, mytimacin – AF, acharan sulfát a mnoho dalších. Řada organismů má získanou a vrozenou imunitu, která stojí za tvorbou obranných a ochranných látek podílejících se na inaktivaci patogenů. Plži však adaptivní imunitu nemají, a proto se na obranných účincích podílí pouze imunita vrozená. Obecně skupina měkkýšů, kam jsou řazení i plži, disponuje dvěma obrannými mechanismy vrozené imunity – buněčnými obrannými reakcemi a reakcemi zprostředkovanými humorálními obrannými faktory. Buněčné obranné reakce zahrnují fagocytující buňky a možnost zapouzdření patogenů a cizorodého materiálu. Humorální obranné faktory obsahují látky, jako jsou například lysozymy, lektiny, antibakteriální a antivirové faktory či opsonizace [4].
Jednou z hojně zastoupených složek slizu plžů je skupina proteinů nazývajících se lektiny. Lektiny jsou proteiny, které jsou v případě plžů vylučovány do jejich slizu skrze plášť límce, kde specificky rozpoznávají cukry a jejich zbytky a váží se na ně. Tyto proteiny plžů se významně podílí na ochraně před patogeny, a to především svou hemaglutinační aktivitou. Na rozdíl od jiných látek přítomných ve slizu, lektiny neinhibují růst bakterií, ale indukují aglutinaci grampozitivních a gramnegativních bakterií. U plžů byly a jsou testovány různé typy lektinů (např. lektiny typu C), které jsou Ca2+ dependentní, a taktéž mnoho z nich je specifických k vazbě na kyselinu sialovou (tzv. cukerná kyselina). Kyselina sialová je derivát kyseliny neuraminové (monosacharidu s devíti atomy uhlíku), která se nachází ve specifické formě (kyselina N-acetylneuraminová) i u patogenních bakterií. Tato kyselina je pro patogenní bakterie zdrojem uhlíku a dusíku a často je ukotvena na povrchu bakteriálních buněk. Lektiny jsou schopné se na tato místa specificky vázat a způsobovat inaktivaci těchto patogenů [8].
Další nejhojněji zastoupenou látkou ve slizu plžů je achacin, který je již podle jména specifický pro plže rodu Achatina, podle kterého byl pojmenován. Achacin je vylučován do slizu pomocí límce těla plže a vykazuje l-aminokyselinooxidázovou aktivitu. Analýza sekvencí odhalila, že achacin obsahuje alfa enzymy ze skupiny amino oxidáz, které katalyzují oxidační deaminace L-aminokyselin za vzniku příslušných K-ketokyselin, peroxidu vodíku (H2O2) a amoniaku (NH3). Antibakteriální aktivity achacinu je docíleno cytotoxickým účinkem H2O2, který může vést až k indukované apoptóze a k agregaci trombocytů. Koncentrace achacinu ve slizu však není vždy dostačující k usmrcení bakterií, ale slouží především k inhibici jejich růstové fáze, a tím značně přispívá k obraně vůči těmto patogenům [2].
Mytimacin–AF (MAF) je látka patřící mezi mytimacinové peptidy, které byly identifikovány a získány ze suchozemního žijícího plže Lissachatina fulica. MAF je složen z 80 aminokyselinových zbytků, mezi nimiž dominuje 10 molekul cysteinu. Mytimacin-AF vykazuje u suchozemských plžů antimikrobiální účinek a tvoří nedílnou součást jejich vrozené imunity. Tento peptid se aktivně podílí na eliminaci gramnegativních i grampozitivních bakteriíí, kvasinek Candida albicans a brání replikaci virů. Během testování na mikroorganismech bylo zjištěno, že již v malé koncentraci (1,9 μg/ml), působí cidně proti kmenům Staphylococcus aureus. Testováním této látky byla taktéž potvrzena nižší hemolytická aktivita vůči červeným krvinkám [10].
Acharan sulfát je látka patřící mezi glykosaminoglykany (GAG), což jsou látky, v jejichž struktuře se nacházejí disacharidické jednotky, z nichž vždy jedním členem je uronová kyselina a druhým členem je glukosamin. Acharan sulfát (AS) podobně jako GAG je složen z opakujících se disacharidických jednotek v podobě 2-acetyl,2-deoxy-alfa-D-glukopyranózy a 2-sulfo-alfa-l-idopyranosyluronické kyseliny, čímž je AS podoben strukturně i funkčně heparinu a heparan sulfátu. Acharan sulfát je látka získávaná z těla plže Achatina fulica ve formě sekretu z vnitřních granulí slinných žláz, odkud je transportován na povrch plže v podobě slizu. V těle plže byla tato látka lokalizována v jeho různých částech, nejen ve slinných žlázách a slizu, ale i v organickém plášti matrixu, což dokazuje jeho distribuci mezi jednotlivými orgány. Acharan sulfát je látka, která je intenzivně studována a testována pro svou protinádorovou aktivitu a účinek. Tato látka zvyšuje fagocytární aktivitu a produkci cytosinů (TNF-alfa a IL-1 beta faktor). Jeho působením dochází k uvolňování oxidu dusnatého z makrofágových buněčných linií RAW 264.7., čímž jsou detekovány antigenně se prezentující buňky [3, 9].
MATERIÁL A METODY
Případný účinek antibakteriálních látek přítomných ve slizu plžů Achatina reticulata, byl testován na kmenech bakterií Escherichia coli (ESCO), Staphylococcus aureus (STAU), Klebsiella pneumoniae (KLPN) a Pseudomonas aeruginosa (PSAE). Všechny testované kmeny bakterií byly divoké kmeny bakterií izolované z lidských klinických materiálů ze spádové oblasti laboratoře Agel Vítkovické nemocnice v Ostravě. Kmeny ESCO, STAU a PSAE byly dobře citlivé na antibiotika, kmen KLPN byl producentem širokospektrých betalaktamáz typu ESBL (Extended Spectrum Beta Lactamases). Celkem bylo testováno 5 vzorků slizu odebraných z laboratorního chovu plže Achatina reticulata.
Laboratorní chov plžů
Laboratorní chov plže (Achatina reticulata) zahrnuje odlišné a specifické podmínky, které se neztotožňují s běžným chovem. Plži byli chovaní ve dvou plastových transparentních boxech (Samla, Ikea, Švédsko) o rozměrech 56 × 39 × 42 cm a o objemu 65 l. Boxy byly umístěny v zástinu, ale s přísunem slunečního světla při teplotě v rozmezí 23–25 °C a vlhkosti kolem 75 %.
Příprava humorální složky (slizu) plže
Odběry humorální složky (slizu) plže byly provedeny pomocí sterilní injekční stříkačky, a to z límce a celé plochy svalnaté nohy plže. Vzorky byly skladovány v lednici při teplotě 5 oC po dobu 24 h. Ředění podle viskozity konkrétního vzorků slizu, tzn. 2 ml vzorku slizu, bylo ředěno ve 2 ml guaiacol glyceryl éteru (Sigma-Aldrich). Vzorky byly zvortexovány a s ohledem na nutnou mikrobiální sterilitu vzorků slizu byl proveden test sterilizace pomocí UV záření.
Test UV sterilizace
Kvůli eliminaci případné mikrobiální kontaminace vzorků slizu bylo ke sterilizaci slizu použito UV záření. K UV záření byl použit biohazard box s UV lampou (Philips, Nizozemsko, 30 W). Otevřené Petriho misky s naředěnými vzorky slizu byly umístěny pod UV lampu ve vzdálenosti 30 cm. Jednotlivé vzorky byly exponovány UV zářením po dobu 30, 45, 60 a 90 minut – obrázek 1. Po několikanásobném testování sterility byla stanovena účinná sterilizační doba působení UV záření na 120 minut.
Eliminace kontaminace vzorků slizu
UV sterilizace probíhala u jednotlivých vzorků slizu po dobu 120 minut. Každý testovaný vzorek slizu byl poté rozetřen po povrchu Columbia krevního agaru (Trios, ČR) a MacConkeyova agaru (Trios, ČR) pomocí kovových stěrek ve formě křížových ředících očkovacích čar. Vzorky byly následně inkubovány po dobu 24 h. při teplotě 36,5 °C.
Z plžů Achatina reticulata bylo odebráno 5 vzorků slizu, z nichž byly izolovány a určeny 3 druhy gramnegativních nefermentujících tyček. Izolované kmeny bakterií byly identifikovány pomocí systému MALDI–TOF bakterie Leclercia adecarboxylata, Escherichia hermannii a Pseudomonas extremorientalis.
Stanovení antimikrobiálních účinků slizu
S ohledem na přítomnost velkého množství látek slizovitého charakteru bylo nutné aktivní látky ze slizu uvolnit jeho macerací v rozpouštědle. K testování antimikrobiálních účinků slizu byl jako rozpouštědlo slizu použit guaiacol glyceryl éter (Sigma – Aldrich, USA). Všechny naředěné roztoky slizu byly po dobu 24 hodin protřepávány na třepačce. Nakonec byly roztoky přefiltrovány přes sterilní filtrační papír. Během celé doby přípravy i doby testování byly roztoky slizu uchovávány v temnu v chladničce při 5 oC. Nejlepší účinky byly zaznamenány v případě použití guaiacol glyceryl etheru (Sigma – Aldrich, USA) o koncentraci 10 mg/ml, která byla vybrána jako koncentrace rozpouštědla pro rozpouštění slizu.
Testování antimikrobiálních účinků slizu
Na sledování antibakteriálních účinků vzorků slizu byla použita prostá difuzní metoda na Mueller-Hinton agaru. Je založena na principu inhibice růstu bakteriální kultury extraktem ze slizu plžů difundujícího do živného kultivačního média. Tato metoda byla použita jako varianta klasické difuzní metody kvalitativního stanovení citlivosti na antibiotika (EUCAST – European Committee on Antibiotic Susceptibility Testing) s ohledem na charakter rozpouštědel slizu plžů. Antimikrobiální účinky slizu byly testovány na 4 různých kmenech bakteriálních původců infekčních onemocnění u lidí: Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae a Pseudomonas aeruginosa. Jednotlivé testované kmeny bakterií byly ve formě náplavu o denzitě inokula 0,8 podle McFarlanda – 2,4 x 108 CFU/ml aplikovány na povrch Trypton Soya Agaru (HiMedia, Indie) na Petriho miskách. Vzorky slizu byly před vlastní aplikací na povrch Trypton Soya Agaru sterilizovány pomocí UV záření po dobu 120 min. na otevřených Petriho miskách ze vzdálenosti 30 cm od UV lampy (Philips, Nizozemsko, 30 W). Na náplavy bakteriálních kultur bylo následně pipetováno 50 µl roztoku samotného guaiacol glyceryl etheru (příprava vodného roztoku: 10 mg guaiacol glyceryl éteru/1 ml sterilní demineralizované vody), samotného slizu bez rozpouštědla a guaiacol glyceryl éteru + slizu v poměru 2 : 1 (dvakrát na každou plotnu s testovaným kmenem dané bakterie). Pipetování bylo prováděno u každého testovaného bakteriálního kmene duplicitně. Testované kmeny bakterií byly poté kultivovány po dobu 24 hodin v termostatu při 36,5 °C. Po vytažení z termostatu byly změřeny jednotlivé velikosti inhibičních zón testovaných bakterií na kultivačních plotnách pomocí digitálního posuvného měřítka – šupléry a stereomikroskopu při přímém zvětšení 12krát. Antimikrobiální aktivita slizu byla vyhodnocována na základě výsledné hodnoty velikosti inhibičních zón testovaných kmenů bakterií. Celkem byly testovány 4 kmeny bakterií a 5 vzorků slizu. Účinnost každého vzorku slizu byla testována na každém bakteriálním kmeni paralelně dvakrát. Výsledky velikostí 40 změřených inhibičních zón byly zprůměrovány.
VÝSLEDKY A DISKUSE
Výsledky stanovení antimikrobiálních účinků slizu hlemýždě Achatina reticulata jsou uvedeny v tabulce 1 a v grafu 1.
Tab. 1. Výsledky stanovení antimikrobiálních účinků slizu hlemýždě Achatina reticulata
Table 1. Results of antimicrobial activity testing of Achatina reticulata slime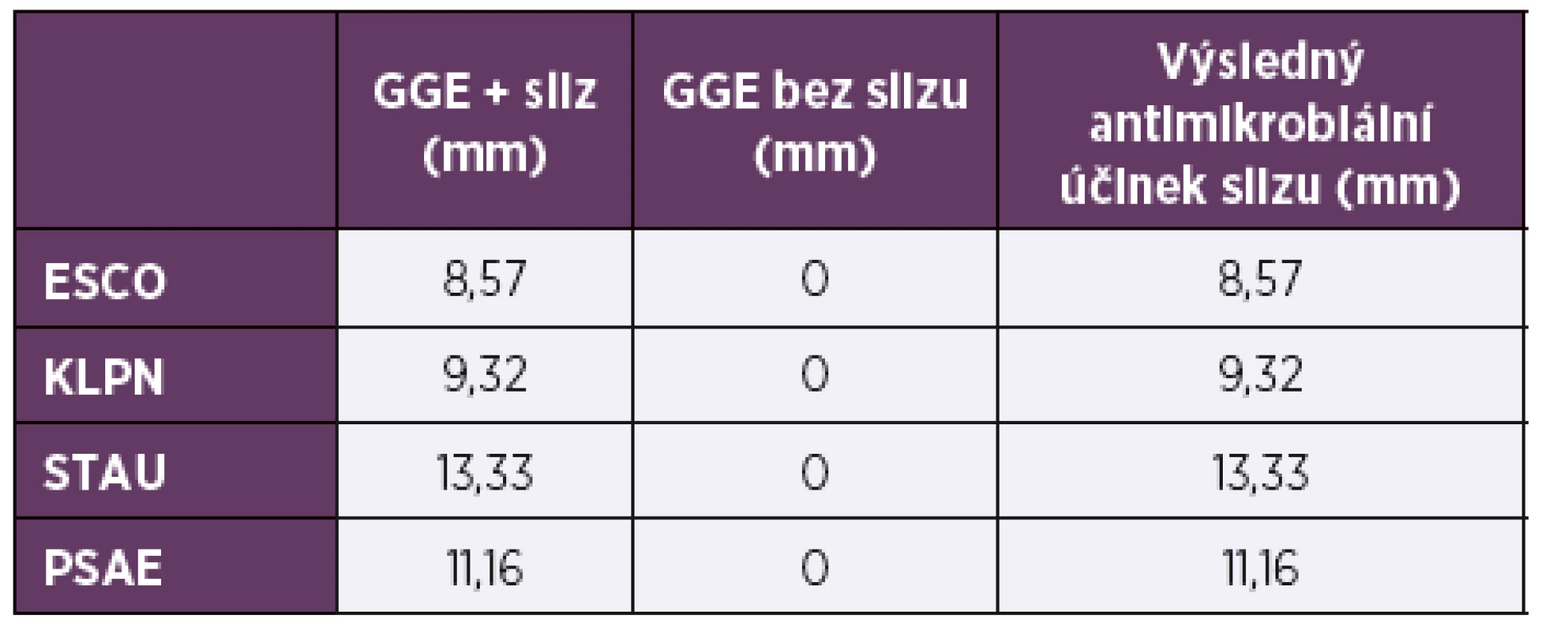
Velikost inhibičních zón v mm.
Vysvětlivky: ESCO – Escherichia coli; KLPN – Klebsiella pneumoniae, STAU – Staphylococcus aureus; PSAE – Pseudomonas aeruginosa; GGE – guaiacol glycerid éter.
Inhibition zone size in mm.
Explanatory Notes: ESCO – Escherichia coli; KLPN – Klebsiella pneumoniae, STAU – Staphylococcus aureus; PSAE – Pseudomonas aeruginosa; GGE – guaiacol glycerol ether.Graf 1. Antimikrobiální účinek slizu hlemýždě Achatina reticulata rozpuštěného v guaiacol glycerid éteru (2 : 1)
Vysvětlivky: ESCO – Escherichia coli; KLPN – Klebsiella pneumoniae, STAU – Staphylococcus aureus; PSAE – Pseudomonas aeruginosa
Graph 1. Antimicrobial activity of Achatina reticulata slime dissolved in guaiacol glycerol ether (2 : 1)
Notes: ESCO – Escherichia coli; KLPN – Klebsiella pneumoniae, STAU – Staphylococcus aureus; PSAE – Pseudomonas aeruginosa
Stanovení případného antibakteriálního účinku slizu hlemýždě Achatina reticulata přineslo kromě jeho antimikrobiálních účinků také celou řadu dalších výsledků. Stanovení antibakteriálního účinku slizu bylo prováděno přímo pomocí celého slizu a nikoliv stanovením antimikrobiálních účinků jednotlivých látek a složek, které obsahuje. Sliz je hlemýždi produkován nikoliv ve formě jednotlivých látek, ze kterých se skládá, ale jako jejich komplexní, hutná směs. Případné biologické účinky slizu jsou pravděpodobně docilovány spolupůsobením všech v něm obsažených látek a složek [6].
Prvním důležitým výsledkem testování je aplikace UV záření coby velice účinného faktoru vedoucího k potlačení nežádoucí, přirozené mikrobioty hlemýžďů přítomné v jejich slizu (viz obr. 1 a 2). UV záření vedlo po jeho 120minutové aplikaci k úplné eliminaci hlemýždí mikrobioty přítomné ve slizu. Na druhé straně, 30wattové UV záření nevedlo k destrukci biologicky účinných látek přítomných ve slizu hlemýžďů (viz obr. 1). Jejich aktivita je i po 120minutovém působení UV záření nezměněná. Praktická aplikace tohoto faktu by mohla mít velký dopad a využití v kosmetickém průmyslu (extrakce účinných látek přítomných ve slizu a eliminace jeho bakteriálního znečištění) a také v dermatologii při aplikaci slizu hlemýžďů ve formě jeho případného použití jako léčebného přípravku.
Navzdory tomu, že nebyly přesně známy a definovány koncentrace účinných látek obsažených v testovaných vzorcích slizu plžů (mg/l), vykazovaly tyto vzorky slizu plžů souměřitelnou účinnost jako klasická antibiotika používaná pro léčbu bakteriálních infekcí. Porovnáním účinků testovaného slizu s breakpointy antibiotik stanovených difuzní metodou ve formě velikosti změřených inhibičních zón podle údajů European Committee on Antimicrobial Susceptibility Testing [1] je zřejmé, že antimikrobiální účinky slizu téměř dosahují hodnot break pointu (BP) a tedy účinků gentamycinu (BP = 14 mm), ampicilinu (BP = 14 mm) a ceftazidimu (BP = 13 mm) v případě testovavaných bakterií ze skupiny Enterobacteriaceae (Escherichia coli a Klebsiella pneumoniae); nitrofurantoinu (BP = 13 mm) a trimetoprimu (BP = 14 mm) v případě Staphylococcus aureus a netilmycinu (BP = 12 mm), gentamycinu (BP = 15 mm) a trimetoprim – sulfometoxazolu (BP = 16 mm) v případě Pseudomonas aeruginosa.
Výsledky projektu taktéž upozornily na viridaci (částečnou hemolýzu erytrocytů) po 24 kultivaci slizu exponovaného UV zářením po dobu 60 minut na Columbia krevním agaru (obr. 1 a 2). K této částečné hemolýze beraních erytrocytů došlo v místě očkovací čáry, kde nebyl detekován žádný nárůst bakterií, což svědčí o hemolytickém účinku látek přítomných ve slizu. Mezi tyto antimikrobiální látky s hemolytickým účinkem přítomné ve slizu patří především lektiny a mytimaciny – AF (viz kapitola: Mechanismus antibakteriálního a antimykotického účinku látek).
Dosud provedené testy detekce antimikrobiálního účinku slizu hlemýžďů byly prováděny se slizem od hlemýžďů Achatina fulica. Tyto testy prokázaly inhibiční účinek slizu pouze v případě bakterií Staphylococcus aureus a Staphylococcus epidermidis. U jiných testovaných jak gramnegativních, tak i grampozitivních bakterií nebyl zaznamenán žádný inhibiční účinek testovaného slizu [7].
Jiní autoři testovali antimikrobiální účinky hlemýžďů Helix aspersa. Tyto testy prokázaly inhibiční účinek slizu pouze v případě bakterií Pseudomonas aeruginosa. I v tomto případě nebyl u jiných testovaných jak gramnegativních, tak i grampozitivních bakterií zaznamenán žádný inhibiční účinek. Sliz byl před aplikací na půdy s testovanými bakteriemi ředěn ve fosfátovém pufru 1 : 3 a byl na tyto půdy aplikován nakapáním 50 µl jeho supernatantu na sterilní papírový disk, ze kterého pak difundoval do agarové půdy s náplavem bakterií [6].
Výsledky našich testů, které nebyly prováděny s jakkoliv separovaným slizem hlemýždě Achatina reticulata, potvrzují domněnku vyslovenou jinými autory [6, 7] hovořící o tom, že inhibičního účinku slizu hlemýžďů je pravděpodobně dosahováno komplexním účinkem všech jeho složek a nikoliv jen působením jeho jednotlivých aktivních látek.
Výsledky naší práce svědčí o tom, že celý sliz plžů vykazuje antibakteriální účinky proti širšímu spektru testovaných bakterií (viz tab. 1), což může být zapříčiněno vybraným druhem plže Achatina reticulata, jehož sliz dosud nebyl nijak testován a vykazuje širší antimikrobiální spektrum účinku. Na rozdíl od výše zmíněných publikací byl antimikrobiální účinek slizu tohoto hlemýždě detekován v podobě inhibičních zón o velikosti 8,57 mm a 9,32 mm i v případě bakteriálních druhů Escherichia coli a Klebsiella pneumoniae. Rozdílnost našich výsledků a výsledků získaných jinými autory pravděpodobně spočívá v užití jak odlišných metodik testování antimikrobiálních účinků slizu, tak především ve zvolení jiného druhu plže. Skutečnost, že antimikrobiální účinek celého slizu hlemýždě Achatina reticulata byl zaznamenán i u gramnegativních bakterií Escherichia coli a Klebsiella pneumoniae se jeví jako velmi významná.
ZÁVĚR
Výsledky stanovení antimikrobiálních účinků slizu hlemýždě Achatina reticulata svědčí o tom, že sliz hlemýžďů ze skupiny Gastropoda obsahuje biologicky účinné látky s poměrně výrazným antimikrobiálním účinkem. Obě tyto skutečnosti by mohly vést k celé řadě praktických aplikačních výstupů upotřebitelných a realizovaných jak v kosmetickém průmyslu, tak i nejenom v orientální, ale i v tradiční západní medicíně.
Výsledky této práce byly získány díky finančním prostředkům čerpaným v rámci řešení projektu SGS08/LF/OU studentské grantové soutěže specifického VŠ výzkumu Ostravské univerzity.
Do redakce došlo dne 26. 11. 2018.
Adresa pro korespondenci:
doc. RNDr. Dittmar Chmelař, Ph.D.
Katedra biomedicínských oborů, Lékařská fakulta
Ostravská univerzita
Syllabova 19
703 00 Ostrava-Zábřeh
e-mail: dittmar.chmelar@osu.cz
Zdroje
1. Breakpoint tables for interpretation of MICs and zone diameters, Version 8.1 European Committee on Antimicrobial Susceptibility Testing, valid from 2018-05-15. Dostupné na www: http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/v_8.1_Breakpoint_Tables.pdf).
2. Ehara T, Kitajima S, Kanzawa N, Tamiya T, Tsuchiya T. Antimicrobial action of achacin is mediated by L-amino acid oxidase activity. FEBS Letters, 2002;531(3):509–512.
3. Jeong J, Toida T, Muneta Y, Kosiishi I, Imanari T, Linhardt RJ, Kim YS. Localization and characterization of acharan sulfate in the body of the giant African snail Achatina fulica. Comparative Biochemistry and Physiology - B Biochemistry and Molecular Biology, 2001;130(4):513–519.
4. Locker Eric S. Gastropod Immunobiology. Boston: Springer, 2010;17–43. DOI: 10.1007/978-1-4419-8059-5_2.
5. Pawar K, Dar M, Rajput B, Kulkarni G. Enrichment and Identification of Cellulolytic Bacteria from the Gastrointestinal Tract of Giant African Snail, Achatina fulica. Applied Biochemistry and Biotechnology, 2015;175(4):1971–1980.
6. Pitt SJ, Graham MA, Dedi CG, Taylor-Harris PM, Gunn A. Antimicrobial properties of mucus from the brown garden snail Helix aspersa. British Journal of Biomedical Science, 2015;2(4):174–181.
7. Santana WA, Melo CM, Cardoso JC, et al. Assessment of Antimicrobial Activity and Healing Potential of Mucous Secretion of Achatina fulica. J Morphol, 2012;30 : 365–373.
8. Shigeru I, Shimizu M, Nagatsuka M, Kitajima S, Honda M, Tsuchiya T, Kanzawa N. High Molecular Weight Lectin Isolated from the Mucus of the Giant African Snail Achatina fulica. Bioscience, Biotechnology, and Biochemistry, 2011;75(1):20–25.
9. Vieira TCRG, Costa-Filho A, Salgado NC, Allodi S, Valente A.-P, Nasciutti LE, Silva L.-CF. Acharan sulfate, the new glycosaminoglycan from Achatina fulica Bowdich 1822. Structural heterogeneity, metabolic labeling and localization in the body, mucus and the organic shell matrix. European Journal of Biochemistry, 2004;271(4):845–854.
10. Zhong J, Wang W, Yang X, Yan X, Liu R. A novel cysteine-rich antimicrobial peptide from the mucus of the snail of Achatina fulica. Peptides, 2013;39(1):1–5.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2019 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Diagnostika a léčba bartonelových endokarditid
- K životnímu jubileu prof. MUDr. Heleny Tlaskalové-Hogenové, DrSc.
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
- Stanovení antimikrobiálních účinků slizu plže Achatina reticulata
- Snížení dávkování thymoglobulinu ze 7,5 mg/kg na 6 mg/kg v rámci přípravného transplantačního režimu prodloužilo dobu do první detekce lidského cytomegaloviru u pacientů po alogenní transplantaci krvetvorných buněk
- Surveillance antibiotické rezistence u Streptococcus pneumoniae v České republice, výsledky respirační studie za roky 2010–2017
- Tularémie – zoonóza s rizikem bioterorismu
- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Tularémie – zoonóza s rizikem bioterorismu
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



