-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKlinické a mikrobiologické charakteristiky klostridiové kolitidy u dětí hospitalizovaných na KDIN v Brně v letech 2013–2017
Clinical and microbiological characteristics of Clostridium difficile infection in children hospitalized at the Departement of Paediatric Infectious Diseases in Brno between 2013 and 2017
Aims:
Clostridium difficile (C. difficile) plays a minor but important role in paediatrics. The aims of this study were to objectivise data, to show their significance in clinical practice, and to present our experience with the treatment of paediatric patients.
Materials and methods:
A retrospective study was conducted in patients (0–19 years of age) hospitalized for Clostridium
difficile infection (CDI) in the Department of Paediatric Infectious Diseases, University Hospital in Brno between 2013 and 2017. Each patient was tested using a two-step diagnostic screening algorithm including immunochromatography and polymerase chain reaction assays.Results:
Thirty-five patients with a median age of 10.3 years (range 1–17.5 years) were enrolled in the study. Almost 70% of patients were aged between 6 and 19 years. No risk factor was identified in one patient, 41.6% of cases were patients with malignancy or inflammatory bowel disease, and 2.5% of patients had short bowel syndrome. After targeted CDI treatment, the median time to resolution of diarrhoea was 2.5 days. Metronidazole was used in more than half of cases. Five patients received fidaxomicin, which was well tolerated. Metronidazole failed in three cases. Recurrence after incomplete treatment with metronidazole occurred in one patient. Health care-associated CDI was recorded in 86% of cases. Recurrent CDI was reported in four children (two with malignancy, one with inflammatory bowel dissease, and one with short bowel syndrome).
Conclusions:
The course of CDI is generally mild in the paediatric population. CDI without a risk factor is rare. Paediatric patients respond well to metronidazole. Fidaxomicin was well tolerated by all patients. We prefer the treatment with fidaxomicin in high-risk groups (immunocompromised condition, inflammatory bowel disease, and short bowel syndrome).
Keywords:
body mass index – diarrhoea – fidaxomicin – Clostridium difficile – Clostridium colitis
Autoři: V. Musil 1; L. Homola 1; M. Vrba 2; A. Braunová 1; M. Malá 1; P. Holečková 1; L. Krbková 1
Působiště autorů: Klinika dětských infekčních nemocí Fakultní nemocnice, Brno a Lékařské fakulty Masarykovy univerzity, Brno 1; Oddělení klinické mikrobiologie Fakultní nemocnice, Brno 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 1, s. 15-22
Kategorie: Původní práce
Souhrn
Cíl práce:
Clostridium difficile (C. difficile) sehrává okrajovou, ale významnou úlohu v pediatrii. Cílem práce je objektivizace dat a jejich význam v klinické praxi, sdělit naše zkušenosti s léčbou pediatrických pacientů.
Materiál a metodika:
Sběr dat probíhal retrospektivně u pacientů (0–19 let) z pětiletého období 2013–2017 hospitalizovaných s diagnózou klostridiová kolitida na Klinice dětských infekčních nemocí (KDIN) FN Brno. Každý pacient byl testován dvoustupňovým diagnostickým algoritmem metodou imunochromatografického testu a polymerázové řetězové reakce (PCR).
Výsledky:
35 pacientů s mediánovým věkem 10,3 roků (1–17,5 roku) bylo zapsáno do studie. Věková skupina 6–19 let tvořila dohromady téměř 70 %. U jednoho pacienta nebyl odhalen žádný rizikový faktor, 41,6 % případů tvořili pacienti s onkologickou diagnózou a nespecifickými střevními záněty, ve 2,5 % syndrom krátkého střeva. Mediánová doba ústupu průjmů byla 2,5 dne po cílené léčbě na klostridiovou kolitidu. Ve více jak polovině případů byl použit metronidazol. V 5 případech byl podáván fidaxomicin s dobrou tolerancí. Ve 3 případech došlo k selhání terapie po metronidazolu. K rekurenci po nedokončené léčbě došlo v jednom případě. V 86 % případů se jednalo o klostridiovou kolitidu spojenou se zdravotní péčí. Více atak kolitidy bylo zaznamenáno u čtyř dětí (2krát malignita, 1krát nespecifický střevní zánět, 1krát syndrom krátkého střeva).
Závěr:
Průběh klostridiové kolitidy je obecně v pediatrické populaci mírný, bez rizikového faktoru je vzácná. Pediatričtí pacienti dobře odpovídají na léčbu metronidazolem. Fidaxomicin byl úspěšně tolerován ve všech případech. U vysoce rizikových skupin (imunosuprese, syndrom krátkého střeva, nespecifický střevní zánět) preferujeme primárně léčbu fidaxomicinem.
Klíčová slova:
fidaxomicin – deti – Clostridium difficile – klostridiová kolitida – průjem
ÚVOD
C. difficile představuje dlouhodobě u dospělých celosvětový problém pro svoji morbiditu i mortalitu. V pediatrii sehrávala bakterie spíše okrajovou roli, v posledních letech se zájem zvýšil [1–3]. Většina doporučení však vychází extrapolací z dospělých doporučení a v některých ohledech nemusí zcela vyhovovat zvláštnostem v jednotlivých dětských věkových skupinách.
Účelem práce je objektivizovat naše data a jejich význam do klinické praxe, sdělit naše zkušenosti s léčbou pediatrických pacientů, nikoliv vytvořit všeobecný přehled nebo doporučený postup problematiky klostridiové kolitidy.
MATERIÁL A METODY
Materiál a subjekty
Představujeme retrospektivní shrnutí pediatrických pacientů hospitalizovaných za pětileté období, v letech 2013–2017, na Klinice dětských infekčních nemocí (KDIN) ve FN Brno s diagnózou klostridiová kolitida. Zařízení provozuje ambulantní a lůžkovou část zahrnující jednotku intenzivní péče a 2 standardní oddělení (s celkovým počtem 60 lůžek) pro dětské pacienty do dovršení 19. roku věku s různým spektrem pediatrických diagnóz. Od každého pacienta byl vyšetřen minimálně jeden vzorek stolice v ambulantním úseku Pracoviště dětské medicíny FN Brno nebo za hospitalizace na Klinice dětských infekčních nemocí či jiné klinice. Podmínkou zahrnutí pacienta je hospitalizace na KDIN. Kromě KDIN jsou pacienti v určitých případech s klostridiovou kolitidou izolováni i na Dětské onkologické klinice, v souboru nebyli zařazeni.
Inkluzivní a exkluzivní kritéria
Zahrnutá skupina pacientů byla definována přítomností průjmovitých stolic nebo změnou charakteru a počtu stolic (přítomnost klinických symptomů) a pozitivního výsledku stolice na toxin/toxigenní kmen (imunochromatograficky toxin +/PCR gen pro toxin +). Definice těžké formy klostridiové kolitidy byla použita z národního doporučeného postupu pro klostridiovou kolitidu, a to podle tabulky „Příznaky svědčící pro těžký průběh klostridiové kolitidy“ [3]. Komunitně získaná klostridiová kolitida byla určena absencí hospitalizace v předchozích 3 měsících a doba hospitalizace netrvající déle než 48 hodin v čase odběru stolice. Klostridiová kolitida spojená se zdravotní péčí byla definována historií hospitalizace (méně než 3 měsíce) a/nebo dobou hospitalizace trvající déle než 48 hodin v čase odběru stolice. Rekurence byla definována jako více než jedna ataka klostridiové kolitidy. Pro praktičnost není rozlišován relaps od reinfekce.
Sběr dat
Data pacienta zahrnující věk, pohlaví, délku hospitalizace, rizikové faktory (malignity, hematologické poruchy, stavy imunosuprese, nespecifické střevní záněty – IBD nebo další gastrointestinální poruchy včetně poruchy motility, předchozí antibiotická expozice do 12 týdnů od odběru stolice; orgánové transplantace nejsou zahrnuty) a detaily terapie. Laboratorní data zahrnující výsledky krve (leukocytóza, posun doleva, C-reaktivní protein, kreatinin, albumin) a mikrobiologické vyšetřování stolice na alternativní střevní patogeny byly zaznamenávány. Informace byly získávány ze zdravotních záznamů databáze FN Brno. Informace o souboru pacientů jsou aktuální k 15. 8. 2018. Od začátku roku 2018 k tomuto datu se žádný pacient ze zahrnutého souboru s diagnózou klostridiová kolitida na KDIN nebo jiném pracovišti dětské medicíny FN Brno s další atakou neobjevil.
Detekce, identifikace C. difficile
Vzorek stolice byl po odběru uchováván při teplotě 4 °C a transportován ve sterilním kontejneru. Analýza stolice na C. difficile byla provedena do 24 hodin od odběru vzorku. Diagnóza klostridiové kolitidy je založena na dvoustupňovém algoritmu. Každý fekální vzorek byl testován imunochromatografickou metodou na přítomnost glutamát-dehydrogenázy a toxinu A, B (Techlab C. diff quick chek complete, Abbott, Spojené státy americké). Vzorky stolice, které se ukázaly jako glutamát-dehydrogenáza negativní a toxin A/B-negativní, byly hodnoceny jako negativní. Stolice, které byly glutamát-dehydrogenáza pozitivní a toxin A/B-pozitivní, byly hodnoceny jako pozitivní – „klostridiová kolitida“. Vzorky stolice s výsledkem glutamát-dehydrogenáza pozitivní, ale toxin A/B-negativní byly konfirmovány metodou PCR (GeneXpert Clostridium difficile, Cepheid, Spojené státy americké) na přítomnost genu pro toxin B, binární toxin a delece tcdC v nukleotidu 117. Glutamát-dehydrogenáza pozitivní a PCR gen pro toxin B pozitivní vzorky byly interpretovány jako „suspektní klostridiová kolitida“ (toxigenní kmen C. difficile) [3], pacienti s tímto výsledkem jsou zahrnuti v souboru klostridiových kolitid. U jednoho pacienta splňujícího kritéria pro závažnou formu klostridiové kolitidy se pokus o kultivaci a následnou typizaci kmene C. difficile nezdařil, jinak kultivace a typizace stolice nebyla prováděna. Každý fekální vzorek byl vyšetřován kultivačně na obligátní střevní patogeny a kromě 7 pacientů s imunochromatografickým testem na detekci rotaviru, noroviru a adenoviru (Immunoquick NoRotAdeno, Biosynex, Francie). Vzorky byly zpracovány v akreditované laboratoři Oddělení klinické mikrobiologie, FN Brno.
Etické schválení
Rodiče pacienta nebo zákonný zástupce podepsali doporučený souhlas FN BRNO, kde mimo jiné souhlasí s odběrem stolice: „Záznam o souhlasu s poskytováním informací o zdravotním stavu“.
VÝSLEDKY
Demografická data, klinické a laboratorní charakteristiky jsou uvedeny v tabulce 1. Do souboru je zahrnuto 35 pacientů s mediánovým věkem 10,3 let (1–17,5 let). Počet případů v jednotlivých letech, 2013–2017, je zpřehledněn v grafu 1. Věková distribuce pacientů je zobrazena v grafu 2.
Tab. 1. Demografické, klinické a laboratorní charakteristiky pacientů s klostridiovou kolitidou, 2013–2017
Table 1. Demographic, clinical, and laboratory characteristics of patients with Clostridium difficile infection, 2013–2017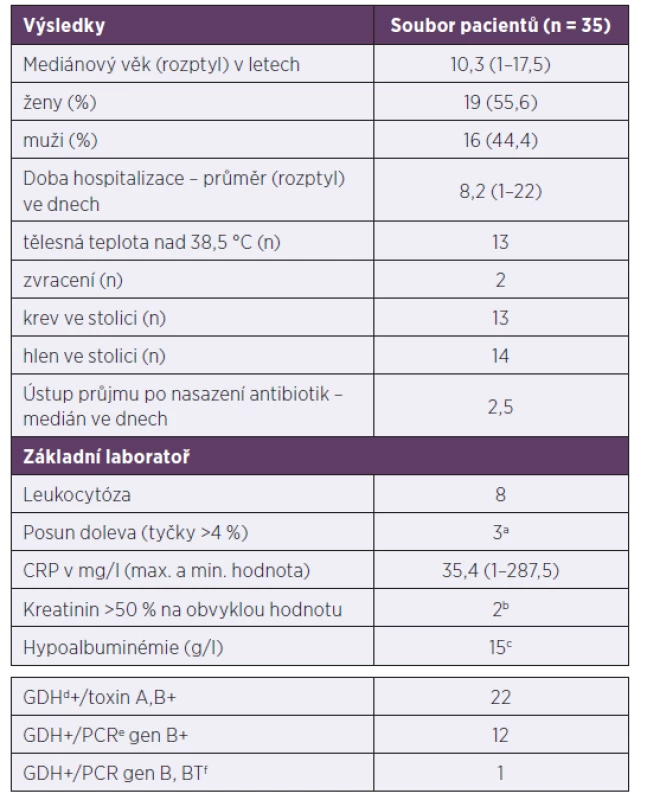
amikroskopický obraz leukocytů proveden u 9 dětí, bodebráno u 34 dětí, codebráno u 27 dětí, dglutamát-dehydrogenáza, epolymerázová řetězová reakce, fbinární toxin
awhite blood cell microscopy performed in nine children, bcollected from 34 children, ccollected from 27 children, dglutamate dehydrogenase, epolymerase chain reaction, fbinary toxinGraf 1. Počet případů a rekurencí klostridiové kolitidy v jednotlivých letech Rekurence je definována jako opětovné propuknutí nemoci. Není rozlišován relaps od reinfekce.
Figure 1. Cases and recurrences of Clostridium difficile infection by year A recurrence is defined as the return of the disease. No distinction is made between recurrence and re-infection.
Graf 2. Věková distribuce hospitalizovaných pacientů s klostridiovou kolitidou
Figure 2. Age distribution of hospitalized patients with Clostridium difficile infection
U jednoho pacienta nebyl odhalen žádný rizikový faktor, 41,6 % případů tvořili pacienti s onkologickou diagnózou a nespecifickými střevními záněty (IBD), ve 2,5 % se syndromem krátkého střeva. Zahrnuté děti s onkologickou diagnózou byly ve 3 z 8 případů ve febrilní neutropenii. Rizikové faktory jsou zpřehledněny v grafu 3, použitá antibiotika do 12 týdnů od propuknutí ataky klostridiové kolitidy v grafu 4. Skupina dětí do tří let se základními charakteristikami je zpřehledněna v tabulce 2. Pro srovnání odlišné délky klinických potíží a délky hospitalizace celého vzorku pacientů a vybraných rizikových skupin je prezentováno v grafu 5.
Graf 3. Rizikové faktory (absolutní počet) u hospitalizovaných pacientů na KDIN 2013–2017
Vysvětlivky: ATB – antibiotická terapie do 12 týdnů od propuknutí ataky kolitidy, IBD – nespecifické střevní záněty
Figure 3. Risk factors (absolute number) in patients hospitalized at the Clinic for Paediatric Infectious Diseases in 2013–2017
Note: ATB – antibiotic treatment within 12 weeks after the onset of Clostridium difficile infection, IBD – inflammatory bowel disease
Graf 4. Antibiotika u hospitalizovaných pacientů podána do 12 týdnů před atakou klostridiovou kolitidou
Vysvětlivky: CEF – cefalosporiny, PIP/TAZ – piperacilin/tazobaktam
Figure 4. Antibiotics in hospitalized patients within 12 weeks before the onset of Clostridium difficile infection
Note: CEF – cephalosporins, PIP/TAZ – piperacillin/tazobactam
Graf 5. Srovnání průměrné délky hospitalizace a průměrné délky ústupu kliniky po antibiotikách ve dnech u pacientů s klostridiovou kolitidou v jednotlivých letech Pacienti s IBD (nespecifickými střevními záněty) v letech 2014 a 2016 nebyly na Klinice dětských infekčních nemocí s diagnózou klostridiová kolitida hospitalizováni.
Figure 5. The mean length of hospital stay and the mean time to resolution of symptoms after the treatment with antibiotics in patients with Clostridium difficile infection in days by year No patient with inflammatory bowel disease and Clostridium difficile infection was hospitalized at the Department of Paediatric Infectious Diseases in 2014 and 2016.
Tab. 2. Pacienti do tří let hospitalizováni pro klostridiovou kolitidu, 2013–2017
Table 2. The patients under 3years old hospitalized due to Clostridium difficile infection, 2013–2017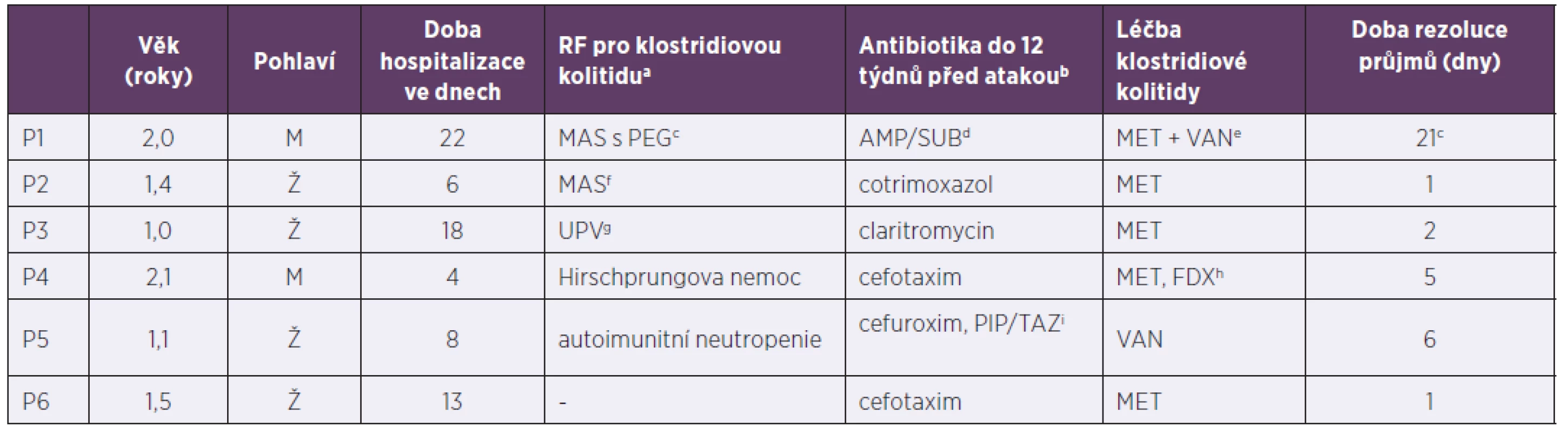
arizikový faktor pro vznik klostridiové kolitidy (vyjmenovány v sekci „Materiál a metodika“), antibiotika nejsou zahrnuta, bantibiotika jsou uvedena bez ohledu na rizikovost pro propuknutí klostridiové kolitidy, cimunodeficit (toho času neurčen) s malabsorpčním syndromem a zavedenou perkutánní endoskopickou gastrostomií, délka rezoluce řídkých stolic ovlivněna primární diagnózou a zvládnutím septického stavu, dampicilin/sulbaktam, emetronidazol i.v. + vankomycin per os, fmalabsorpční syndrom (na podkladě toho času nezjištěného střevního procesu),gstav po umělé plicní ventilaci pro refrakterní obstrukční bronchitidu (imobilita pacienta), hmetronidazol pátý den vysazen, doléčen fidaxomicinem, ipiperacilin/tazobaktam
aClostridium difficile infection risk factors (listed in the Material and methods section), antibiotics are not included, bantibiotics are indicated regardless of Clostridium difficile infection risk level, cimmunodeficiency (as yet undiagnosed) with malabsorption syndrome and inserted percutaneous endoscopic gastrostomy tube, time to resolution of diarrhoea varies with primary diagnosis and sepsis control, dampicillin/sulbactam, eintravenous metronidazole + oral vancomycin, fmalabsorption syndrome (in the presence of as yet undetermined intestinal pathology),gpreviously on mechanical ventilation for refractory obstructive bronchitis (immobilised patient), hmetronidazole discontinued on day 5, switched to fidaxomicin, ipiperacillin/tazobactamV našem souboru pacientů byl podán ve více než 50 % případů metronidazol s dobrým efektem a krátkou rezolucí průjmů (tab. 3). Selhání léčby bylo zaznamenáno u 3 rizikových pacientů (2krát Hirschprungova nemoc, 1krát Crohnova choroba na imunosupresivní terapii), ti byly ve dvou případech dále léčeni fidaxomicinem (FDX), v jednom byla nutná chirurgická intervence, pacient byl dále doléčen FDX. U ostatních léčebných režimů nebylo selhání primárně nastavené terapie zaznamenáno.
Tab. 3. Terapie klostridiové kolitidy za hospitalizace, 2013–2017
Table 3. In-hospital treatment of Clostridium difficile infection, 2013–2017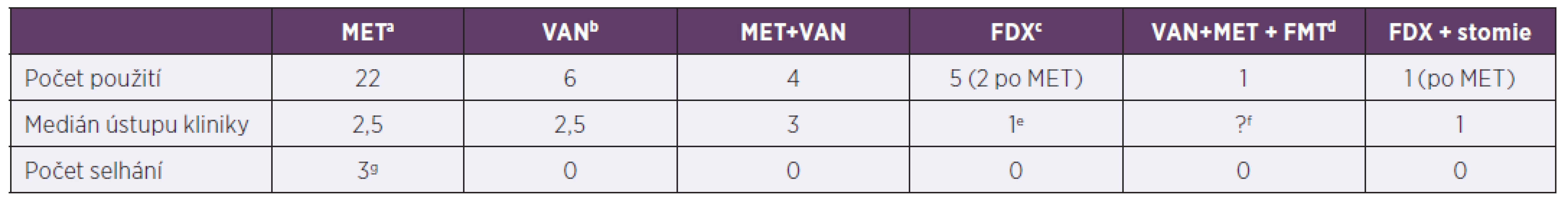
ametronidazol, bvankomycin, cfidaxomicin, dfekální bakterioterapie, ev jednom případě pacient nedoléčen, viz pacient č. 3 v odkazug, fFMT horní cestou nebyla úspěšná, pacient obsah vyzvracel, g1. pacient: 16,3 roků, Crohnova choroba na imunosupresivech, změna léčby 6. den na fidaxomicin, 2. pacient: 2,1 roků, Morbus Hirschprung, rozvoj klostridiové kolitidy po salmonelové sepsi, postupně rozvoj paralytického ileu, stav řešen chirurgicky + doléčen fidaxomicinem, 3. pacient: 4,5 roku, Morbus Hirschprung, rozvoj klostridiové kolitidy při bronchopneumonii, změn léčby 3. den na fidaxomicin, pro respirační selhání překlad na oddělení anesteziologie a resuscitace, léčba pro klostridiovou kolitidu přerušena, 1 měsíc na extrakorporální membránové oxygenaci, za 2,5 měsíce recidiva kolitidy, léčen vankomycinem
ametronidazole, bvancomycin, cfidaxomicin, dfaecal bacteriotherapy, etreatment failure, see patient 3 in pointg, fFMT by upper delivery failed due to vomiting, gpatient 1: 16.3 years, Crohn’s disease, treated with immunosuppressants, switched to fidaxomicin on day 6, patient 2: 2.1 years, Morbus Hirschsprung, Clostridium difficile infection following Salmonella sepsis, progressive development of paralytic ileus, treated by surgery + fidaxomicin, patient 3: 4.5 years, Morbus Hirschsprung, Clostridium difficile infection during bronchopneumonia, switched to fidaxomicin on day 3, due to respiratory failure, transferred to PACU, treatment of Clostridium difficile infection discontinued, extracorporeal membrane oxygenation for 1 month, Clostridium difficile infection recurred 2.5 months later, treated with vancomycinVšichni pacienti zařazeni do souboru byli kultivačně negativní na obligátní střevní bakteriální patogeny. Z 27 dětí, jejichž stolice byla testována virologicky, byl u jednoho dítěte prokázán ve stolici norovirus. Vzhledem k páté atace klostridiové kolitidy (insuficientní data z předchozích atak klostridiové kolitidy včetně vyšetřování na alternativní patogeny, pacient nebyl v předchozí době nikdy léčen na Pracovišti dětské medicíny FN Brno) byla indikována po terapii vankomycinem (VAN) fekální transplantace.
V 86 % případů se jednalo o klostridiovou kolitidu spojenou se zdravotní péčí. Více atak kolitidy bylo zaznamenáno u čtyř dětí, ve dvou případech se jednalo o onkologické pacienty (z toho jeden ve febrilní neutropenii), jeden pacient patřil do skupiny IBD, jeden pacient s Hirschprungovou chorobou zrelaboval po předchozí nedoléčené atace klostridiové kolitidy.
Podle kritérií závažnosti klostridiové kolitidy bylo identifikováno 15 závažných kolitid z 35 pacientů. Čtyři pacienti měli onkologi ckou diagnózu (z toho dva ve febrilní neutropenii), dva syndrom krátkého střeva na podkladě Hirschprungovy choroby, jeden měl zavedenou perkutánní endoskopickou gastrostomii, jeden se léčil s IBD, zbylých šest pacientů patřilo mezi primárně zdravé jedince a dostali klostridiovou kolitidu kvůli antibiotické terapii při infektu. Medián ústupu průjmu po nasazené léčbě byl 2,5 dne. Podrobnější údaje o léčbě jsou uvedeny v tabulce 4.
Tab. 4. Terapie závažných klostridiových kolitid za hospitalizace, 2013–2017
Table 4. In-hospital treatment of severe Clostridium difficile infection, 2013–2017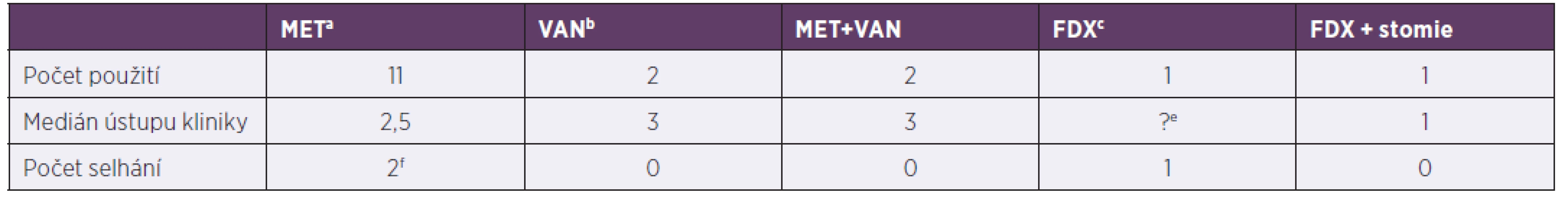
ametronidazol, bvankomycin, cfidaxomicin, dfekální bakterioterapie, epacient nedoléčen, viz pacient č. 2 v odkazuf, f1. pacient: 2,1 roků, Morbus Hirschprung, rozvoj klostridiové kolitidy po salmonelové sepsi, postupně rozvoj paralytického ileu, stav řešen chirugicky + doléčen fidaxomicinem, 2. pacient: 4,5 roku, Morbus Hirschprung, rozvoj klostridiové kolitidy při bronchopneumonii, změna léčby 3. den na fidaxomicin, pro respirační selhání překlad na oddělení anesteziologie a resuscitace, léčba pro klostridiovou kolitidu přerušena, 1 měsíc na extrakorporální membránové oxygenaci, za 2,5 měsíce recidiva kolitidy, léčen vankomycinem
ametronidazole, bvancomycin, cfidaxomicin, dfaecal bacteriotherapy, etreatment discontinued, see patient 2 in pointf, fpatient 1: 2.1 years, Morbus Hirschsprung, Clostridium difficile infection following Salmonella sepsis, progressive development of paralytic ileus, treated by surgery + fidaxomicin, patient 2: 4.5 years, Morbus Hirschsprung, Clostridium difficile infection during bronchopneumonia, switched to fidaxomicin on day 3, due to respiratory failure transferred to PACU, treatment of Clostridium difficile infection discontinued, extracorporeal membrane oxygenation for 1 month, Clostridium difficile infection recurred 2.5 later, treated with vancomycinDISKUSE
Klostridiová kolitida představuje v pediatrii spíše okrajovou záležitost. V případě trendu incidence a prevalence klostridiových kolitid u pediatrických pacientů některé studie, zejména z USA a Itálie [4–6], zdůrazňují vzestupný trend, naopak recentní práce z Nizozemí a Spojeného království rozporují tyto údaje. U souboru pacientů z KDIN tento trend rovněž nepozorujeme. Odlišné výsledky mohou být dány jednak fenoménem hypervirulentních kmenů, zvýšeným povědomím o nemoci a jejího vyšetřování v dětské populaci, zlepšenou diagnostikou [7–9].
Pediatrická populace se v ČR v roce 2017 podílela asi 2 % na celkovém počtu hlášených případů klostridiové kolitidy (údaj získán ze SZÚ), z toho pracoviště KDIN pouze 0,13 % (tedy necelých 6,5 % v pediatrické populaci). Podobný údaj je prezentován v nedávno zveřejněném holandském epidemiologickém přehledu, kde se pohybuje kolem 2,8 % [7]. Vzhledem k nejednotnosti indikace vyšetřování stolic u nejmladších věkových populací, dostupnosti vyšetření a často limitních znalostí pediatrů se snahou o zjištění etiologie střevních potíží je tento počet orientační a spíše nadhodnocený. V případě doporučení vyšetřování na klostridiovou kolitidu má nejpřínosnější přístup Americká pediatrická společnost, která zohledňuje zvýšené asymptomatické nosičství C. difficile u mladší populace dětí, ale za určitých okolností přiznává i možnost propuknutí kolitidy. Do roku věku doporučuje vyšetřování jen v případě specifických poruch motility střeva, např. Hirschprungova choroba, nebo v případě kontaktu s nákazou, u dětí do 3 let pak zdůrazňuje vyšetřovat i alternativní patogeny [10]. Na KDIN cíleně testujeme C. difficile v případě přítomnosti rizikového faktoru (viz níže) a kauzální léčbu nasazujeme individuálně, alternativní patogeny testujeme vždy.
Mediánový věk dětských pacientů je v zahraničních studiích udáván v rozmezí 1,5–10 roků [7–9]. Prezentovaný soubor pacientů se pohybuje kolem 10 let, kde jsme ve shodě s nizozemskou prací, naopak např. britská publikace udává 1,5 roku [7]. V případě věkového rozložení lze v našem souboru předpokládat dominanci věku 6–19 let, které dohromady tvoří téměř 70 % (n = 24). Rozporné výsledky jednotlivých pramenů jsou dány jednak malými soubory zahrnutých pacientů a rovněž například regionálním přístupem k vyšetřování bakterie u nejmladších věkových skupin, tedy odlišnostmi v metodice studie.
V době porodu je lidské střevo sterilní. Ve starších pramenech je udáváno, že v novorozeneckém věku (do 28 dnů věku) se nosičství toxigenním kmenem C. difficile pohybuje s velkou variabilitou, průměrně kolem 37 % [11, 12]. V novějších přehledech navzdory senzitivnějšímu diagnostickému algoritmu se hodnoty pohybují v rámci jednotek procent [12, 13]. Zásadním faktorem, který nízkou hodnotu nosičství u novorozenců mohl ovlivnit, je zřejmě zvýšený hygienický standard v poporodní péči i v domácnostech. Mezi prvním až 12 měsícem klesá nosičství na 10–25 %. Pro zmíněné věkové období je typická přechodná asymptomatická kolonizace toxigenními kmeny C. difficile [11]. Tento fakt je dán nižší schopností mikrobiomu potlačovat růst C. difficile a jeho proměnlivostí [11, 14], která je do velké míry ovlivněna stravovacími návyky (kojení versus umělé mléčné formule, zavádění příkrmů) a způsobem porodu [11, 15]. Ve druhém roce věku klesá kolonizace k 5–10 %, do 3 let se stabilizuje kolem 3 % [11, 16, 17, 18]. Navzdory vysokému procentu kolonizace toxigenními kmeny, nejmladší věkové skupiny zůstávají poměrně rezistentní vůči infekci C. difficile [5, 11]. Mechanismus rezistence je nejasný. Nízká morbidita je často vysvětlována ochrannými protilátkami v mateřském mléce, progresivním vzestupem IgG protilátek v séru proti toxinu A, B od narození do 24 měsíců [5, 11]. Klíčové jsou hypotézy o absenci buněčných komponent pro internalizaci toxinů či nedostatek receptorů pro toxin A na střevním epitelu. Tyto informace byly demonstrovány na zvířecích modelech králíků a křečků v devadesátých letech [19, 20]. Novější studie ovšem tyto poznatky zpochybňuje a přiznává existenci cytopatického efektu na střevní sliznici novorozených selat po internalizaci toxinu [21]. Toto tvrzení bylo podpořeno i jednotlivými kazuistikami klostridiové kolitidy u novorozenců [22]. Je tedy jasné, že ačkoliv nemocnost klostridiové kolitidy u nejmladší dětské populace je minimální, nelze přímo potvrdit nebo vyvrátit její existenci. V našem souboru hospitalizovaných pacientů chybí věková skupina mladší 1 roku, skupina batolat (1–3 roky) se podílí 17 % (n = 6). Kromě již výše zmíněných komplikací s diagnostikou může být malý počet pacientů dán absencí nespecifických střevních zánětů a nízkou incidencí onkologických diagnóz v této věkové populaci, což jsou dvě hlavní rizikové skupiny pro klostridiovou kolitidu u hospitalizovaných dětí na našem pracovišti.
Faktory disponující k rozvoji klostridiové kolitidy jsou obecně shodné pro všechny věkové kategorie. Nízký počet kolitid v dětském věku je do velké míry ovlivněn „dobře fungujícím organismem“ dětí a absencí komorbidit. Věková predilekce v pediatrickém věku u klostridiové kolitidy nebyla zjištěna. V našem souboru převládají pacienti s onkologickou diagnózou a nespecifickými střevními záněty, kde dochází ke kumulaci více faktorů. Orgánové transplantace se kvůli centralizaci péče na našem pracovišti objevují sporadicky. Za zmínku stojí pacienti se syndromem krátkého střeva na podkladě Hirschprungovy choroby, jejichž průběhy klostridiové kolitidy bývají podle zahraniční literatury [23] i podle našich zkušeností komplikované a často vyžadují chirurgickou intervenci. Z užívaných antibiotik před atakou klostridiové kolitidy je v popředí cefotaxim. Cefalosporiny patří vzhledem k četnosti užívaní v pediatrii k nejčastějším vyvolavatelům klostridiové kolitidy u dětí [8]. Naopak po klindamycinu, ačkoliv je používán na KDIN běžně a v literatuře patří k nejrizikovějším antibiotikům [3], epizody kolitidy nevídáme. Pro rekurentní klostridiovou kolitidu Nicholson et al. identifikovali v pediatrii čtyři nejvýznamnější rizikové faktory: malignity, nedávný chirurgický výkon (do 60 dnů od ataky), antibiotická expozice (do 30 dnů od ataky), přítomnost perkutánní endoskopické gastrostomie [24].
C. difficile je historicky spojeno s nemocničním prostředím. Některé pediatrické práce v poslední době zdůrazňují nárůst komunitně získaných infekcí. Obvykle se jedná o epidemiologické přehledy, které neberou v úvahu kliniku [25, 26]. Jiné studie dokonce zpochybňují spojení tradičních rizikových faktorů a komunitně získané klostridiové kolitidy [5, 27]. Pravděpodobně se jedná o chybně určené kolitidy, které mohly souviset se špatným diagnostickým algoritmem na klostridiovou kolitidu, nedostatečnou diagnostikou alternativních patogenů na daném pracovišti, insuficientními anamnestickými daty o pacientovi nebo odlišným nastavením kritéria „komunitně získaná klostridiová kolitida“. V našem souboru hospitalizovaných pacientů představuje pouze 14 % (5/35).
Léčba klostridiové kolitidy v pediatrické populaci je shodná s doporučenou terapií u dospělých. Obecně bývá preferována v dětské medicíně jako první volba metronidazol i přes jeho nižší účinnost a pomalejší nástup účinku [3, 28]. U mírných průběhů klostridiové kolitidy bývá obvykle dostačující, u závažnějších průběhů, rizikových pacientů a rekurentních případů kolitidy selhává a je doporučeno zvolit alternativní léčbu. Lékem první volby je orální vankomycin [2]. Podávání fidaxomicinu je u dětských pacientů off-label terapie. Druhá fáze klinické studie, která probíhala na souboru 38 dětských pacientů (11 měsíců až 17 let) s onkologickou diagnózou nebo gastrointestinální poruchou, prokázala dobrou toleranci a farmakokinetický profil jako u dospělých. Bylo použito dávkování 16 mg/kg na dávku po 12 hod do maximální dávky 200 mg [29]. V našem souboru pacientů byl předepsán ve více než polovině případů metronidazol vesměs s dobrým efektem a krátkou rezolucí průjmů. Zahraniční literatura podporuje u dětských pacientů jeho podávání při mírném průběhu [9, 28]. Z naší zkušenosti v případech, kde nechceme nebo nemůžeme riskovat selhání léčby (u vysoce rizikových skupin), volíme již při první atace fidaxomicin s výborným efektem. V zahraniční literatuře je zvažován u rizikových dětských pacientů spíše jako rezervní u závažných a rekurentních klostridiových kolitid [28]. Rekurence jsme zaznamenali v 11,4 %, po naší léčbě v jednom případě (3 %). V zahraničních pramenech se pohybuje kolem 20 % [30], tedy obdobně jako u dospělých [3,31]. Nízký počet rekurencí v našem případě může být ovlivněn jednak celkově malým vzorkem pacientů (statistická chyba), jednak nezahrnutím ambulantních pacientů, kteří zejména na gastroenterologických a onkologických ambulancích jsou při mírném průběhu odesílání do domácí léčby s metronidazolem.
Závažné průběhy klostridiové kolitidy jsou u dětí méně běžné než u dospělých, ale jsou popisovány [2]. Kritéria pro hodnocení těžké kolitidy jsou součástí oficiálních doporučení primárně pro dospělou populaci [1–3]. Řada zahraničních prací se proto snaží o extrapolaci na dětské pacienty, nebo vytvořily vlastní hodnotící postup s různým efektem [1, 3, 7, 8, 13, 32]. Podle „českých“ kritérií [3] vycházejících z evropských doporučení [1] jsme určili 15 pacientů, kteří byli vyhodnoceni jako „závažné klostridiové kolitidy“. Tíže průběhu kolitidy neodpovídala danému zařazení, ačkoliv se v řadě případů jednalo o primárně závažně nemocné pacienty, což např. kritizují i britští autoři [8]. Mediánová doba rezoluce průjmu byla v porovnání celým souborem pacientů totožná. Skupina vesměs dobře odpovídala na léčbu metronidazolem. Ačkoliv námi zvolený hodnotící systém má tendenci nadhodnocovat, na druhou stranu identifikoval všechny pacienty s komplikovaným průběhem.
Studie má řadu limitací. Mezi zásadní omezení patří malý vzorek pacientů, které přináší riziko statistické chyby. Dále zahrnutí pouze našeho pracoviště, ačkoliv představuje majoritu pacientů s diagnózou klostridiová kolitida na Pracovišti dětské medicíny FN Brno. Identifikace virových patogenů byla omezena jen na tři viry. Střevní parazité nebyli určování pro předpokládanou nízkou incidenci v dané populaci. Autoři si uvědomují, že vyloučení jiné příčiny v rámci této práce u pacienta se „suspektní klostridiovou kolitidou“ je značně kontroverzní i vzhledem k omezenosti použitých mikrobiologických vyšetření a ne zcela vyhovující diagnostice klostridiové kolitidy. V rámci praxe jsou lékaři často nuceni zahájit cílenou terapii na klostridiovou kolitidu po zvážení rizikových faktorů a celkového zdravotního stavu pacienta. Další připomínky jsou již zmíněny v rámci jednotlivých odstavců.
ZÁVĚR
Průběh klostridiové kolitidy je obecně v pediatrické populaci mírný. Klostridiová kolitida bez rizikového faktoru je vzácná. V našem souboru převládala klostridiová kolitida spojená se zdravotní péčí. Pediatričtí pacienti dobře odpovídají na léčbu metronidazolem. Fidaxomicin byl úspěšně tolerován ve všech případech. U vysoce rizikových skupin (imunosuprese, syndrom krátkého střeva, nespecifické střevní záněty) preferujeme primárně léčbu fidaxomicinem.
Konflikt zájmů
Autoři prohlašují, že nemají žádný konflikt zájmu.
Poděkování
Děkujeme MUDr. Michaele Špačkové z Oddělení epidemiologie infekčních nemocí, CEM, Státní zdravotní ústav a PhDr. Martinu Gašpárkovi z Národního referenčního centra pro analýzu epidemiologických dat, Oddělení biostatistiky, Státní zdravotní ústav za poskytnutí údajů celostátní nemocnosti dětské populace na klostridiovou kolitidu v roce 2017.
Do redakce došlo dne 10. 9. 2018.
Adresa pro korespondenci:
MUDr. Václav Musil
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: Musil.Vaclav@fnbrno.cz
Zdroje
1. Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect Dis, 2014;20 Suppl 2 : 1–26.
2. McDonald LC, Gerding DN, Johnson S, et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis, 2018;66(7):e1–48.
3. Beneš J, Husa P, Nyč O, et al. Diagnosis and therapy of Clostridium difficile infection: Czech national guidelines. Klin. Mikrobiol. Inf. Lek, 2014;20 : 56–66.
4. Borali E, Ortisi G, Moretti C, et al. Community-acquired Clostridium difficile infection in children: A retrospective study. J Ital Soc Gastroenterol Ital, 2015;47(10):842–846.
5. Antonara S, Leber AL. Diagnosis of Clostridium difficile Infections in Children. J Clin Microbiol, 2016;54(6):1425–1433.
6. Sammons JS, Toltzis P. Recent trends in the epidemiology and treatment of C. difficile infection in children. Curr Opin Pediatr, 2013;25(1):116–121.
7. van Dorp SM, Smajlović E, Knetsch CW, et al. Clinical and Microbiological Characteristics of Clostridium difficile Infection Among Hospitalized Children in the Netherlands. Clin Infect Dis, 2017;64(2):192–198.
8. Pai S, Aliyu SH, Enoch DA, et al. Five Years Experience of Clostridium difficile Infection in Children at a UK Tertiary Hospital: Proposed Criteria for Diagnosis and Management. PLOS ONE, 2012;7(12):e51728.
9. McFarland LV, Ozen M, Dinleyici EC, et al. Comparison of pediatric and adult antibiotic-associated diarrhea and Clostridium difficile infections. World J Gastroenterol, 2016;22(11):3078–3104.
10. Schutze GE, Willoughby RE. Clostridium difficile Infection in Infants and Children. Pediatrics, 2013;131(1):196–200.
11. Jangi S, Lamont JT. Asymptomatic colonization by Clostridium difficile in infants: implications for disease in later life. J Pediatr Gastroenterol Nutr, 2010;51(1):2–7.
12. Rousseau C, Lemée L, Le Monnier A, et al. Prevalence and diversity of Clostridium difficile strains in infants. J Med Microbiol, 2011;60(Pt 8):1112–1118.
13. Sathyendran V, McAuliffe GN, Swager T, et al. Clostridium difficile as a cause of healthcare-associated diarrhoea among children in Auckland, New Zealand: clinical and molecular epidemiology. Eur J Clin Microbiol Infect Dis, 2014 Oct;33(10):1741–1747.
14. Adlerberth I, Huang H, Lindberg E, et al. Toxin-producing Clostridium difficile strains as long-term gut colonizers in healthy infants. J Clin Microbiol, 2014;52(1):173–179.
15. Penders J, Vink C, Driessen C, et al. Quantification of Bifidobacterium spp., Escherichia coli and Clostridium difficile in faecal samples of breast-fed and formula-fed infants by real-time PCR. FEMS Microbiol Lett, 2005;243(1):141–147.
16. Nicholson MR, Thomsen IP, Edwards KM. Controversies Surrounding Clostridium difficile Infection in Infants and Young Children. Child Basel Switz, 2014;1(1):40–47.
17. Lees EA, Miyajima F, Pirmohamed M, et al. The role of Clostridium difficile in the paediatric and neonatal gut – a narrative review. Eur J Clin Microbiol Infect Dis, 2016;35(7):1047–1057.
18. Schäffler H, Breitrück A. Clostridium difficile – From Colonization to Infection. Front Microbiol, 2018;9 : 646.
19. Eglow R, Pothoulakis C, Itzkowitz S, et al. Diminished Clostridium difficile toxin A sensitivity in newborn rabbit ileum is associated with decreased toxin A receptor. J Clin Invest, 1992;90(3):822–829.
20. Rolfe RD. Binding kinetics of Clostridium difficile toxins A and B to intestinal brush border membranes from infant and adult hamsters. Infect Immun, 1991;59(4):1223–1230.
21. Keel MK, Songer JG. The distribution and density of Clostridium difficile toxin receptors on the intestinal mucosa of neonatal pigs. Vet Pathol, 2007;44(6):814–822.
22. Parsons SJ, Fenton E, Dargaville P. Clostridium difficile associated severe enterocolitis: a feature of Hirschsprung’s disease in a neonate presenting late. J Paediatr Child Health, 2005;41(12):689–690.
23. Mc Laughlin D, Friedmacher F, Puri P. The impact of Clostridium difficile on paediatric surgical practice: a systematic review. Pediatr Surg Int, 2014;30(8):853–859.
24. Nicholson MR, Thomsen IP, Slaughter JC, et al. Novel risk factors for recurrent Clostridium difficile infection in children. J Pediatr Gastroenterol Nutr, 2015;60(1):18–22.
25. Wendt JM, Cohen JA, Mu Y, et al. Clostridium difficile infection among children across diverse US geographic locations. Pediatrics, 2014;133(4):651–658.
26. Sammons JS, Toltzis P. Pitfalls in Diagnosis of Pediatric Clostridium difficile Infection. Infect Dis Clin North Am, 2015;29(3):465–476.
27. Kociolek LK, Patel SJ, Zheng X, et al. Clinical and Microbiologic Assessment of Cases of Pediatric Community-associated Clostridium difficile Infection Reveals Opportunities for Improved Testing Decisions. Pediatr Infect Dis J, 2016;35(2):157–161.
28. D’Ostroph AR, So T-Y. Treatment of pediatric Clostridium difficile infection: a review on treatment efficacy and economic value. Infect Drug Resist, 2017;10 : 365–375.
29. O’Gorman MA, Michaels MG, Kaplan SL, et al. Safety and Pharmacokinetic Study of Fidaxomicin in Children With Clostridium difficile-Associated Diarrhea: A Phase 2a Multicenter Clinical Trial. J Pediatr Infect Dis, 2017;31.
30. Nicholson MR, Crews JD, Starke JR, et al. Recurrent Clostridium difficile Infection in Children: Patient Risk Factors and Markers of Intestinal Inflammation. Pediatr Infect Dis J, 2017;36(4):379–383.
31. McFarland LV, Elmer GW, Surawicz CM. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol, 2002;97(7):1769–1775.
32. Jacobson SM, Slain D. Evaluation of a bedside scoring system for predicting clinical cure and recurrence of Clostridium difficile infections. Am J Health-Syst Pharm, 2015;72(21):1871–1875.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2019 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Klinické a mikrobiologické charakteristiky klostridiové kolitidy u dětí hospitalizovaných na KDIN v Brně v letech 2013–2017
- Progresivní multifokální leukoencefalopatie – epidemiologie, imunitní odpověď, klinické rozdíly, léčba
- Vývoj v zastoupení genotypů HCV u injekčních uživatelů drog v České republice během 15 let
- Botulismus – vzácné, ale stále se vyskytující život ohrožující onemocnění
- Dekontaminace zasahujících složek při kontaminaci vysoce rizikovými biologickými agens
- Břišní tyfus v České republice a případ importovaného onemocnění po návštěvě Rainbow Gatheringu v Itálii
- Zemřel prof. MUDr. Jan Šejda, DrSc.
- Zemřela RNDr. Eva Aldová, CSc. (*21. 11. 1922 – †20. 12. 2018)
- Prevalence infekce virem hepatitidy C u dospělých s rizikovými faktory
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Botulismus – vzácné, ale stále se vyskytující život ohrožující onemocnění
- Progresivní multifokální leukoencefalopatie – epidemiologie, imunitní odpověď, klinické rozdíly, léčba
- Břišní tyfus v České republice a případ importovaného onemocnění po návštěvě Rainbow Gatheringu v Itálii
- Dekontaminace zasahujících složek při kontaminaci vysoce rizikovými biologickými agens
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



