-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mycological diagnosis of pulmonary Aspergillus infections with a focus on serological methods
Mycological diagnosis of pulmonary Aspergillus infections with a focus on serological methods
Aspergillus are ubiquitous fungi that can cause serious illnesses in susceptible individuals. The most commonly infected organ is the lungs. The severity of the disease depends on the degree of the invasion of the lung tissue by fungi, which rises proportionally with the development of immunodeficiency. The only way to clearly determine the degree to which the lungs have been invaded is to carry out a histological examination of a sample of the infected tissue. Conventional mycological methods can detect the presence of the fungus in samples from a patient's airways by using microscopy or culture techniques. Furthermore, it is possible to determine the presence of the specific Aspergillus antigen, galactomannan, and of non-specific beta-D-glucan in the serum or bronchoalveolar lavage fluid. The detection of antibodies against Aspergillus is only relevant for chronic forms of the disease.
This article discusses the benefits of different mycological examination methods in the diagnosis of various forms of pulmonary aspergillosis.Keywords:
pulmonary aspergillosis – microscopic examination – culture methods – galactomannan – beta-D-glucan – lateral flow device
Autoři: N. Mallátová
Působiště autorů: Pracoviště parazitologie a mykologie, Centrální laboratoře, Nemocnice České Budějovice, a. s.
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 4, s. 174-181
Kategorie: Souhrnné sdělení
Souhrn
Aspergily jsou ubikvitní houby, které u vnímavých jedinců mohou způsobit závažná onemocnění. Nejčastěji infikovaným orgánem jsou plíce. Závažnost onemocnění je závislá na stupni invaze houby do plicní tkáně, ta stoupá úměrně s rozvojem imunodeficitu pacienta. Invazivitu procesu prokáže jednoznačně pouze histologické vyšetření vzorku infikované plicní tkáně. Klasické mykologické metody detekují mikroskopickými nebo kultivačními technikami přítomnost houby ve vyšetřovaných vzorcích z dýchacích cest. Dále je možné prokázat v séru nebo bronchoalveolární tekutině specifický aspergilový antigen galaktomanan a nespecifický beta-D-glukan. Detekce protilátek proti aspergilům má přínos pouze u chronických forem onemocnění.
V článku se autorka zabývá přínosem jednotlivých mykologických vyšetřovacích metod v diagnostice různých forem plicní aspergilózy.Klíčová slova:
plicní aspergilóza – mikroskopické a kultivační metody – galaktomanan – beta-D-glukan – lateral flow deviceÚVOD
Aspergily jsou ubikvitní saprofytické houby. Jsou přítomny v půdě, vzduchu, na rostlinných i živočišných zbytcích, ve vodě, potravě. Jsou schopny přežívat v teplotním rozmezí 12–65 °C, při pH 2,1–8,8. Rod Aspergillus patří mezi askomycety, do čeledi Eurotiales. Známo je téměř 250 druhů, rozdělených do 17 sekcí. Nejčastěji uváděným je Aspergillus fumigatus sensu stricto ze sekce Fumigati. V této sekci najdeme přes 30 druhů, které jsou morfologicky velmi podobné (např. Aspergillus lentulus, Aspergillus fimigatiaffinis, Aspergillus pseudofisheri, Aspergillus hiratsukae, Aspergillus viridinutans atd.) a v rutinní praxi zůstanou většinou skryty pod označením A. fumigatus. Mezi další významné skupiny zmiňované v souvislosti s lidským onemocněním patří sekce Flavi, Nigri, Terrei, Nidulante s hlavními zástupci Aspergillus flavus, Aspergillus niger, Aspergillus terreus, Aspergillus nidulans [1, 2]. Hubka et al. molekulárně identifikovali 178 izolátů Aspergillus spp. získaných z klinických materiálů v České republice (ČR). Identifikováno bylo 32 druhů z 12 sekcí. U 46 pacientů s prokázanou a pravděpodobnou invazivní aspergilózou (IA) podle kritérií EORTC/MSG (European Organisation for Research and Treatment of Cancer/Mycoses Study Group) byl nejčastěji prokázán A. fumigatus (70 %), překvapivě však následovaly např. Aspergillus calidoustus a A. lentulus (oba 7 %) a Aspergillus sydowii či Aspergillus tubingensis (oba 4 %). Všechny izoláty od pacientů s chronickou plicní aspergilózou byly určeny jako A. fumigatus, ten převažoval i u pacientů s aspergilomem či sinusitidou [3].
Pro rod Aspergillus je typické zakončení konidioforu měchýřkem porostlým fialidami v jedné či dvou řadách, jejich uspořádání je charakteristické pro jednotlivé druhy. Přes ně uvolňuje houba do prostředí mikrokonidie velikosti 2–5 µm. Ty se volně pohybují vzduchem a ulpívají na předmětech, proto je nejčastější branou vstupu infekce dýchací trakt a nejčastěji postiženým orgánem jsou plíce. Spóry mohou pouze kolonizovat sliznice dýchacích cest nebo v závislosti na stupni obranyschopnosti hostitele může dojít i k rozvoji infekce. Kolonizace může vést k senzibilizaci pacienta a rozvoji alergických forem nemoci. U pacientů s nezávažným plicním onemocněním, bez výrazné systémové poruchy imunity, dochází ke vzniku kolonizačních forem onemocnění označovaných jako aspergilom. Chronické formy pak postihují převážně pacienty se závažným onemocněním plic (chronická obstruktivní plicní nemoc [CHOPN], tuberkulóza, fibrózy atd.), často léčené kortikoidy. Při výrazném snížení obranyschopnosti hostitele dochází k rozvoji invazivní plicní aspergilózy (IPA), která může vyústit i v generalizovanou formu onemocnění. Jednotlivé klinické syndromy, jejich diagnostika a léčba jsou podrobně popsány v doporučeném postupu diagnostiky a léčby plicní aspergilózy pro pneumology [4]. Spóry aspergilů pronikají díky své velikosti snadno do alveolů, u imunodeficitního hostitele mohou vyklíčit a růst ve formě vláken (hyf) až do podoby mycelia. Základním předpokladem je dostatek živin, hlavně glukózy, v okolní tkáni. Houba využívá hostitele jako zdroj stavebních materiálů pro svoji buněčnou stěnu. Během růstu jsou uvolňovány do okolí některé součásti buněčné stěny aspergilů, jako je galaktomanan (GM), který se pak dá detekovat v bronchoalveolární tekutině (BAT). U silně imunosuprimovaných pacientů prorůstá houba i cévní stěnou (angioinvazivita procesu), a pak je možné GM detekovat i v séru [5].
Vzhledem k nízké senzitivitě kultivačních metod získala detekce GM významné postavení v diagnostice plicních forem aspergilózy, pozitivita GM je jedním ze základních parametrů při rozhodování o nasazení antimykotické terapie. Avšak interpretace výsledku není jednoduchá, vždy je nutné posoudit veškeré aspekty spojené s odběrem materiálu, jeho zpracováním, souvislost s ostatními výsledky a klinický stav pacienta.
Hlavním cílem článku je přispět ke správné interpretaci výsledků získaných v mykologických laboratořích s důrazem na interpretaci pozitivního nálezu GM v BAT.
DIAGNOSTICKÁ KRITÉRIA
EORTC/MSG publikovala kritéria pro definování prokázané, pravděpodobné a možné diagnózy invazivního fungálního onemocnění (IFD) [6]. Podle těchto kritérií je IFD jednoznačně prokázáno pouze v případě, že je pozitivní histologický, mikroskopický či kultivační nález houby z primárně sterilních lokalit vykazujících známky infekce. Za pravděpodobnou lze diagnózu považovat tehdy, pokud u predisponovaného pacienta s klinickými známkami infekce je prokázán alespoň některý z mikrobiologických markerů infekce. Mezi ně se řadí mikroskopický či kultivační průkaz houby z méně validních klinických vzorků (BAT, aspirát z dýchacích cest, sekret z paranazálních dutin) nebo pozitivní průkaz biologických markerů ze séra či jiných tělních tekutin (tab. 1). Molekulárně genetické metody detekce byly navrženy mezi diagnostická kritéria z důvodů nedostatečné standardizace metody až v loňském roce, zatím ovšem mezi platná kritéria nepatří. EORTC/MSG kritéria jsou výchozí i pro další diagnostické postupy doporučené v intenzivní medicíně či v plicním lékařství [7, 8]. Oporu pro výběr vhodných diagnostických postupů a interpretaci nálezů je možné hledat také v doporučení ECIL (European Conference on Infections in Leukemia) pro užití klasických diagnostických metod i detekce biologických markerů v klinické mykologii [9, 10].
Tab. 1. Diagnostická kritéria pro IFD vyvolaná vláknitými houbami (upraveno podle [6]) Table 1. Diagnostic criteria for IFD induced by fibrous fungi (adapted from [6]) ![Diagnostická kritéria pro IFD vyvolaná vláknitými houbami (upraveno podle [6])
Table 1. Diagnostic criteria for IFD induced by fibrous fungi (adapted from [6])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e873181177524ea274d824d9759d8674.png)
LABORATORNÍ METODY PŘÍNOSNÉ V DIAGNOSTICE PLICNÍ ASPERGILÓZY
Mykologické vyšetřovací metody je možné rozdělit na klasické (mikroskopie, kultivace) a metody detekující biologické markery (průkaz houbových antigenů) v klinických vzorcích. Průkaz protilátek proti nim má význam u non-neutropenických pacientů s chronickým průběhem onemocnění. Kromě mikrobiologických metod mají v diagnostice aspergilózy významnou roli i metody histologické a v současné době rychle se rozvíjející metody molekulárně genetické, které ale nejsou předmětem tohoto sdělení.
Histologické vyšetření umožní kromě diagnostiky houbové infekce prokázat také invazivitu procesu. Problematické je ovšem získání vhodného vzorku (plicní tkáň), a proto jsou tato vyšetření prováděna zřídka, většinou až post mortem. Za standardní metodu pro průkaz hub je považováno barvení podle Grocotta, které je díky stříbření velmi kontrastní a umožní dobře rozeznat tmavě zbarvená houbová vlákna. PAS (Periodic Acid Schiff) je barvení, které cílí na glykogen ve tkáních, dokáže lépe zobrazit okolní struktury a sílu invaze houbových vláken. Prokazatelná jsou houbová vlákna i v klasickém hematoxylin-eosin barvení – obrázek 1 [11]. Při interpretaci nálezu je třeba mít na paměti, že histologické barvení neodliší aspergily od ostatních hyalohyfomycet. Aspergily je možné identifikovat z parafinových bločků tkáně s využitím hybridizace in situ nebo pomocí imunohistochemických metod, které využívají monoklonální protilátku k identifikaci houbových vláken v bločcích vyšetřované tkáně. Materiály poslané k histologickému vyšetření nejsou díky ošetření formaldehydem dále použitelné pro mykologické vyšetření. Je proto třeba již při odběru myslet na to, že vzorek bude poslán do více laboratoří.
Obr. 1. Aspergilová vlákna v histologickém preparátu, barvení hematoxylin-eosinem (Patologie Nemocnice Č. Budějovice, a. s.) Figure 1. Aspergillus filaments in a hematoxylin-eosin stained histological sample (Pathology Service, České Budějovice Hospital, JSC) 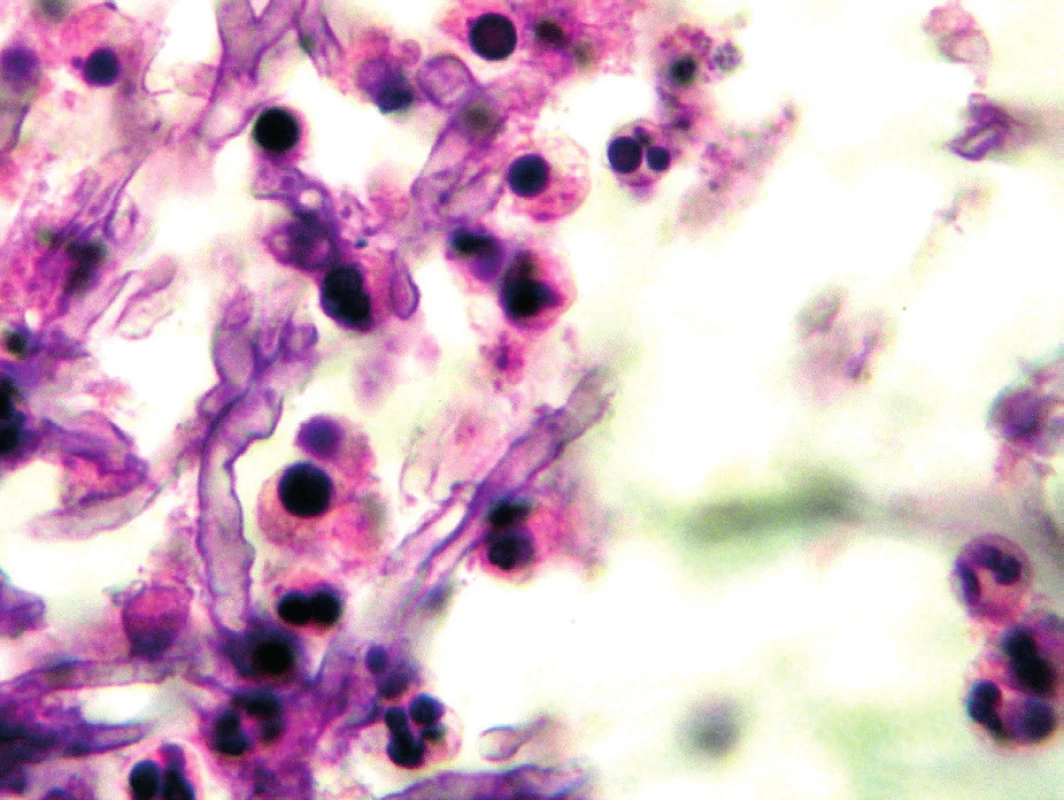
MYKOLOGICKÉ VYŠETŘOVACÍ METODY
Odběr klinického materiálu
Mykologické vyšetření vzorků z dýchacích cest může přinést zásadní diagnostický poznatek v závislosti na druhu a kvalitě odebraného materiálu. Za optimální považujeme materiál z dolních dýchacích cest získaný invazivními metodami, nejlépe tkáň nebo BAT. Práce Escribano et al. však ukazuje na možný přínos vyšetření i jiných materiálů z dýchacích cest. Autoři vyšetřili BAT a některé z dalších materiálů odebraných z dýchacích cest (sputum, tracheální sekret, bronchiální sekret, pleurální tekutina) u 14 pacientů s prokázanou a pravděpodobnou aspergilózou (CHOPN 43%, hematologické malignity 22%). Jednotlivé izoláty Aspergillus spp. (celkem 155) ze všech druhů materiálů identifikovali molekulárně geneticky. V 93% byly izolované druhy Aspergillus spp. shodné v BAT a některém dalším materiálu z dýchacích cest [12]. Přesto je nutné každý mykologický nález posuzovat individuálně, zvážit možnost kolonizace dýchacích cest (zvláště postižených jiným chronickým procesem) nebo i kontaminace vzorku při odběru či v laboratoři.
Vzorky je třeba odebrat za přísně aseptických podmínek do sterilních nádobek. Transport do laboratoře by měl být rychlý, do dvou hodin je možné vzorky ponechat při pokojové teplotě, při předpokládané delší době transportu je třeba zajistit chladničkovou teplotu (4–8 °C), tkáň je možné zalít sterilním fyziologickým roztokem proti vyschnutí [13, 14]. Vzorky by měly být zpracovávány v biohazardních boxech, aby nedošlo k environmentální kontaminaci. Při skladování vzorků v laboratoři je třeba respektovat postupy doporučené výrobci diagnostických souprav.
KLASICKÉ MYKOLOGICKÉ METODY
Mikroskopické vyšetření
Mikroskopicky lze vyšetřovat nativní vzorky optickým mikroskopem po přidání 20% KOH, dále preparáty barvené běžnými mikrobiologickými postupy (Gram, Giemsa, Gram-Weigert) nebo fluorescenčním mikroskopem po obarvení fluorochromy. Rod Aspergillus má septované hyfy 3–12 µm široké, větvící se do tvaru písmene V (dichotomické větvení, úhel pod 45 stupni, obr. 2). Metoda je rychlá, levná, nevýhodou je nízká senzitivita [9]. Mikroskopický obraz aspergilózy však není jednoznačný, podobný nález můžeme vidět i u ostatních hyalohyfomykóz (fuzarióza, scedosporióza), proto je nezbytný i kultivační průkaz agens, který umožní jednoznačnou identifikaci druhu.
Obr. 2. Aspergilová vlákna v bronchoalveolární tekutině, barvení podle Grama (foto autorka) Figure 2. Aspergillus filaments in Gram stained bronchoalveolar lavage fluid (photo by the author) 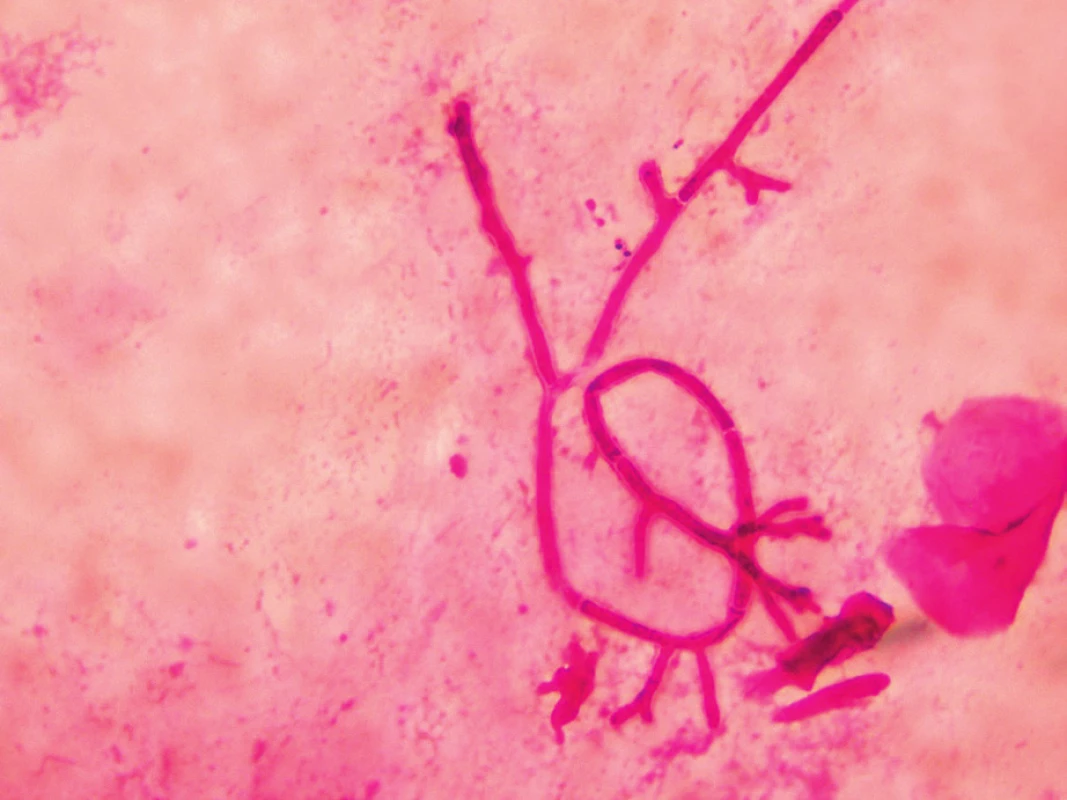
Kultivační vyšetření
Kultivační vyšetření má v případě pozitivního nálezu vysokou specificitu (až 92%), avšak nízkou senzitivitu (< 50%) [15]. Vzorky se kultivují na Sabouraudově agaru, eventuálně s přídavkem antibiotik (chloramfenikol, gentamicin) k potlačení růstu bakterií, při teplotě 35 až 37 °C. Kmeny rodu Aspergillus tvoří kolonie za 2–7 dní, pokud je pacient léčen antimykotiky i později. Nález Aspergillus spp. v hemokultuře je obvykle považován za kontaminaci. Záchyt je velmi vzácný, většinou při terminálních fázích akutní IA [9].
K identifikaci houby jsou využívány specifické znaky mikromorfologické (konidiofor, fialidy, mikrokonidie) a makromorfologické (barva kolonií, charakter a rychlost růstu), které se více projeví přeočkováním izolátů na média s vyšším obsahem živin (Czapkův agar, agar se sladovým extraktem). Identifikace do druhu pomocí charakteristických růstových a mikroskopických znaků není přesná. A. fumigatus sensu stricto (obr. 3) je v optickém mikroskopu nerozeznatelný od ostatních druhů rodu Aspergillus sekce Fumigati, např. A. lentulus nebo A. fumigatissimus. Jednoznačnou identifikaci poskytnou molekulárně genetické metody. Novinkou je metoda hmotnostní spektrometrie MALDI-TOF (Matrix Assisted Laser Desorption/Ionization – Time of Flight), která identifikuje druhy na základě jedinečného hmotnostního spektra proteinů charakteristického pro daný mikroorganismus. Určovat takto je možné ovšem pouze druhy, které mají svá hmotnostní spektra identifikovaná a vložená do databáze přístroje [16].
Obr. 3. Aspergillus fumigatus v optickém mikroskopu (foto autorka) Figure 3. Aspergillus fumigatus under an optical microscope (photo by the author) 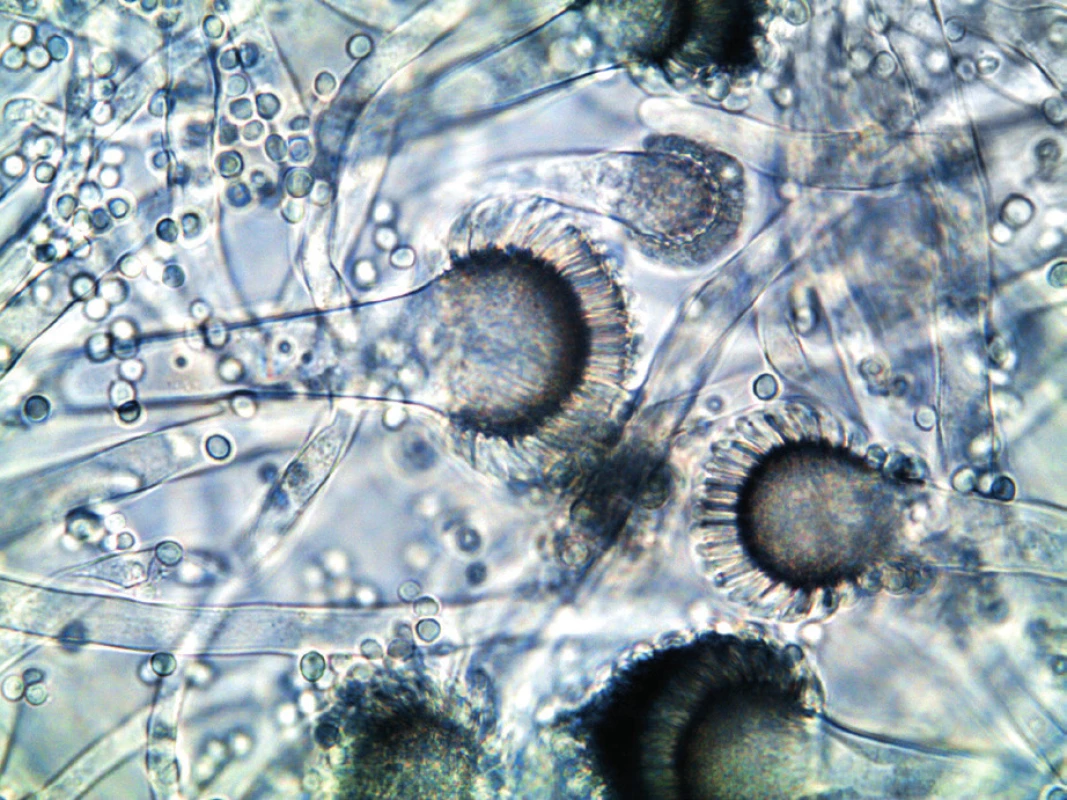
Další z výhod kultivačního vyšetření je možnost stanovit citlivost izolovaného agens k antimykotikům. V současné době jsou k dispozici standardizované postupy CLSI (Clinical Laboratory Standards Institute) a EUCAST (European Committee for Antimicrobial Susceptibility Testing) i komerčně vyráběné testy Etest (bioMérieux, Marcy l‘Etoile, Francie) a Sensititre YeastOne (TREK Diagnostic Systems, Cleveland, USA) umožňující stanovit MIC (minimální inhibiční koncentraci) ke všem běžně používaným systémovým antimykotikům [17, 18, 19]. A. fumigatus je obvykle dobře citlivý k azolům (vyjma flukonazolu, ke kterému je primárně rezistentní) i amfotericinu B. Linden et al. zpracovali multicentrickou studii (22 center z 19 zemí) a v souboru 3 788 izolátů Aspergillus sekce Fumigati izolovaných od pacientů s prokázanou a pravděpodobnou aspergilózou prokázali rezistenci k azolům v průměru 3,2% [20]. Situace v jednotlivých centrech se však významně lišila (0–26,1%). Mortalita u pacientů s IA vyvolanou rezistentními izoláty byla 88%. Pacienti infikovaní rezistentními izoláty neměli v anamnéze léčbu azoly. Autoři podpořili teorii o vzniku rezistentních druhu A. fumigatus v přírodě díky nadužívání fungicidních azolů v zemědělství [21, 22].
U pacientů s chronickou formou aspergilózy, kteří jsou dlouhodobě léčeni azoly, dochází ke vzniku rezistence pravděpodobně i díky selekci rezistentních kmenů A. fumigatus [23]. Expertní skupina v čele s Paulem Verweijem doporučuje u pacientů s chronickou formou aspergilózy provádět během léčby opakovaná kultivační vyšetření sputa, v případě pozitivního nálezu vždy stanovit MIC, a to z několika izolovaných kolonií současně k odhalení rezistentních variant [24].
Problematické jsou ovšem i některé další druhy ze sekce Fumigati jako např. již zmíněný A. lentulus nebo A. fumigatissimus, které bývají rezistentní k azolům i amfotericinu B [25]. Mezi dalšími druhy rezistentními k azolům bývá zmiňován A. ustus, jako necitlivý k amfotericinu B A. terreus.
DETEKCE SPECIFICKÝCH BIOLOGICKÝCH MARKERŮ
Test na průkaz galaktomananu
GM je termostabilní lipopolysacharid buněčné stěny hub o velikosti 25–75 kDa skládající se z mananu a imunogenních galaktofuranozylových řetězců. GM je uvolňován do okolí během růstu houby. Kromě aspergilů je přítomen i ve stěně dalších hub, jako jsou např. rody Penicillium, Fusarium nebo Alternaria. Množství uvolněného GM je závislé na velikosti mykotické nálože a na imunitním stavu hostitele [5].
Pro detekci GM je celosvětově používaná komerční sendvičová enzymimunoanalýza (Platelia Aspergillus [BioRad, Francie], dále GM ELISA), která využívá k detekci krysí monoklonální protilátku MAb EB-A2 identifikující galaktofuranozylové řetězce molekuly GM. Detekční limit je 1 ng/ml. Výsledek je udáván jako index pozitivity (IP) nebo GM index, což je poměr mezi optickou denzitou naměřenou ve vyšetřovaném vzorku a kontrolním séru. Jako pozitivní je hodnocen vzorek s IP ≥ 0,5. Původně byla hraniční hodnota IP ≥ 1,5. Maertens et al. však prokázali, že snížení hraniční hodnoty IP > 0,5 vede ke zvýšení senzitivity z 76,3 % na 97,4% při snížení specificity pouze o 7% [26]. ECIL doporučuje hodnotit pacienta jako pozitivního, pokud má jeden vzorek s IP > 0,7 nebo 2 za sebou jdoucí vzorky s IP > 0,5 [10]. Kritéria EORTC jsou méně striktní, postačuje 1 vzorek s IP > 0,5. U pacientů s akutní leukémií je GM časný marker, předchází pozitivní klinické a radiologické známky infekce o 5–8 dní v 65, respektive 72% případů [27]. ECIL proto doporučuje monitorování GM 2krát týdně u pacientů ve vysokém riziku aspergilózy. Detekce GM v séru má nejvyšší diagnostický přínos u neutropenických pacientů s hematologickými malignitami. Pfeiffer et al. udávají v metaanalýze zahrnující 27 studií z let 1999–2005 specificitu 89% a senzitivitu 71% [28]. K podobným výsledkům došli i Leeflang et al., kteří zpracovali do své metaanalýzy 30 studií publikovaných v letech 1998–2007 (senzitivita byla 79% a specificita 82%) [29]. Aktualizace metaanalýzy z roku 2015 zahrnující 50 studií a 5 660 pacientů (z toho 586 mělo prokázanou a pravděpodobnou IA) prokázala při IP ≥ 0,5 senzitivitu testu 82% a specificitu 81%. Se stoupajícím IP (≥ 1,5) se sice zvýšila specificita testu, neúměrně však klesla senzitivita (93%, respektive 61%) [30]. Cordonnier et al. prokázali, že hladiny GM stoupají u pacientů se zvyšující se neutropenií [31]. GM může být využit i k monitorování léčby. Významným faktorem je i podání antimykotické profylaxe, které vede naopak ke snížení senzitivity testu [32]. Vysoké negativní prediktivní hodnoty (NPV) testu ukazují na značný přínos metody při diferenciální diagnóze.
Metoda má však i svá omezení. Falešná pozitivita je nejčastěji nalézána při podávání beta-laktamových antibiotik, což je pravděpodobně způsobeno kontaminací přípravků při výrobě. Další častou příčinou falešné pozitivity je podání roztoku PlasmaLyte, který také může, díky biotechnologickému postupu, obsahovat zbytky GM. Pro získání správného výsledku je třeba vyloučit PlasmaLyte z podávání minimálně 24 hodin. Méně častou příčinou falešné pozitivity může být přítomnost některých jiných hub nebo i bakterií ve střevě, či přítomnost fragmentů galaktofuranu v potravinách, zvláště u pacientů s poškozením intestinální slizniční bariéry. Příčinou falešné negativity je nejčastěji antimykotická léčba [10].
Souprava byla původně standardizována pouze pro sérum a později pro BAT. Postupně však byla prokázána možnost stanovení GM i v jiných tělních tekutinách (mozkomíšní mok, moč) [33]. Protože aspergilózou jsou nejčastěji zasaženy plíce, získala detekce GM v BAT významné postavení. Maertens et al. analyzovali 99 BAT od pacientů s hematologickými malignitami. BAT vyšetřili mikroskopicky, kultivačně a na průkaz GM ELISA metodou [34]. Vyhodnotili senzitivitu, specificitu, NPV a pozitivní prediktivní hodnotu (PPV) při různých hodnotách IP (> 0,5; > 1,0; > 1,5; > 2,0) v souboru prokázaných IPA a prokázaných a pravděpodobných IPA. Jako optimální hodnotu při detekci GM z BAT doporučili IP ≥ 1,0, kdy senzitivita v souboru prokázaných a pravděpodobných IPA byla 91,3 %, specificita 87,7 %, NPV 96 % a PPV 76,3 %.Zásadní rozdíl byl hlavně v PPV, která při hodnotě IP ≥ 0,5, byla pouhých 68%.
GM v BAT má vysokou senzitivitu i specificitu také u pacientů s nehematologickým onemocněním (solidní orgánové transplantace, CHOPN, pacienti na jednotkách intenzivní péče). Senzitivita testu souvisí s antigenní náloží v místě detekce. Rozvoj houbové infekce a její invazivita probíhá v závislosti na stupni obranyschopnosti hostitele. U pacientů s vysokým stupněm imunosuprese houba invaduje během růstu v plicní tkáni do okolí včetně cévního systému a uvolňuje GM, který je pak detekovatelný v místě ložiska infekce i v séru. U pacientů s méně výraznou imunosupresí indukovanou např. dlouhodobou kortikoterapií (CHOPN, plicní fibrózy) je tendence k angioinvazivitě výrazně nižší, růst houby je pomalejší a GM nebývá u těchto pacientů detekován v séru, ale pouze v materiálu z dýchacích cest [35, 36]. Detekce z BAT má tedy vyšší senzitivitu i specificitu než detekce ze séra. Guo et al. udávají ve své metaanalýze z roku 2010 senzitivitu pro IPA z BAT 86 % a specificitu 89% při IP > 0,5 a 85% a 94% při IP > 1,0.[37] Výskyt falešné pozitivity je tedy možné částečně korigovat zvýšením hodnoty IP. To dokazuje i studie Zhanga et al., kteří sledovali přínos detekce GM z BAT pro diagnostiku IPA u pacientů s CHOPN. Během 2 let shromáždili 125 pacientů s CHOPN, z toho 3 s prokázanou a 8 s pravděpodobnou IPA. Při hodnotě IP > 0,5 byla senzitivita, specificita, PPV a NPV 90,9%, 62,5%, 25% a 98%. V BAT, při hodnotě IP > 1,0, se senzitivita testu nezměnila, ovšem specificita se zvýšila na 95%, PPV a NPV na 71,4% a 98,7%. Kultivačně bylo ve skupině s IPA pozitivních 64% vzorků, v kontrolní skupině 14% vzorků [38]. Z toho je zřejmé, že při hodnocení nálezu u non-neutropenických pacientů je nutné mít na paměti to, že i kolonizace dýchacích cest může způsobit pozitivitu testu na GM a neodliší ji ani kultivační vyšetření ze sputa či BAT. To potvrzuje i nižší specificita testu na GM u pacientů po transplantaci plic nebo u pacientů s chronickou aspergilózou, u kterých je kolonizace dýchacích cest bez klinických příznaků popisována často [39, 40]. Detekce GM ze séra a BAT je dnes metodou, na které je postavena tzv. pravděpodobná diagnóza IA podle kritérií EORTC/MSG a svoji pozici si získala i u diagnostiky chronických forem. Vždy je ale třeba hodnotit výsledek v souvislosti s dalšími laboratorními výsledky, klinickým nálezem a výsledky zobrazovacích metod.
Lateral flow device (LFD)
LFD je detekční test založený na principu imunochromatografie. Thorton využil tuto technologii již dříve při detekci vláknitých hub v půdě [41]. Test využívá monoklonální myší protilátku (MAb JF5), která váže epitopy extracelulárního glykoproteinu uvolňujícího se z buněčné stěny aspergilů během jejich růstu. Vzniklý komplex je detekován na nitrocelulózové membráně pomocí koloidních partikulí zlata. Komplex antigen-protilátka-zlato je viditelný v případě pozitivního výsledku jako proužek různé intenzity do 10–15 minut po nanesení vyšetřované tekutiny (obr. 4). Jako interní kontrola slouží imobilizovaný komplex myší protilátky inkorporovaný v membráně a viditelný v případě pozitivního i negativního výsledku jako poměrně intenzivně se barvící proužek. Výhodou testu je nenáročná příprava vzorku. Thorton prokázal i vysokou specificitu MAb JF5, ta se váže výhradně na antigeny uvolňující se během růstu hub rodu Aspergillus. Speciálně testoval druhy hub, u kterých je známo, že mohou vyvolat falešnou pozitivitu v GM ELISA (rody Penicillium, Alternaria, Fusarium, Acremonium, Cladosporium...). Zkřížená reakce byla pozorována pouze u některých druhů rodu Penicillium. Metaanalýza sedmi studií z let 2008 až 2015 zahrnovala celkem 630 pacientů v riziku IA, z nichž 278 byly hematologické malignity, 233 mělo onemocnění plic, 68 solidní orgánové transplantace, další pacienti různá jiná onemocnění. Prokázaná nebo pravděpodobná IA byla diagnostikována u 115 pacientů. Testováno bylo celkem 220 sér a 430 BAT. Senzitivita a specificita v BAT byla 86% a 93%, v séru 68% a 87%, nejvyšší byla u pacientůs hematologickými malignitami, nižší u pacientů s onemocněním plic [42]. Metoda má srovnatelnou specificitu i senzitivitu s GM ELISA i PCR. White et al. demonstrovali na souboru 103 hematologických pacientů ve vysokém riziku IA (8 prokázaná IA, 14 pravděpodobná, 22 možná, 59 kontrolní skupina) specificitu LFD odpovídající PCR (98 vs. 96,6%) a vyšší než GM ELISA (98 vs. 77,3%). Senzitivita LFD byla nižší než PCR (81,8 vs. 95,5%), avšak vyšší než GM ELISA (81,8 vs. 77,3%).[43] Jako velice pozitivní hodnotili autoři rychlost a jednoduchost provedení LFD testu. Metoda zatím není zařazena mezi kritéria EORTC pro diagnostiku IA.
Obr. 4. Lateral flow device – demonstrace pozitivního výsledku (foto autorka) Figure 4. Lateral flow device – appearance of a positive result (photo by the author) 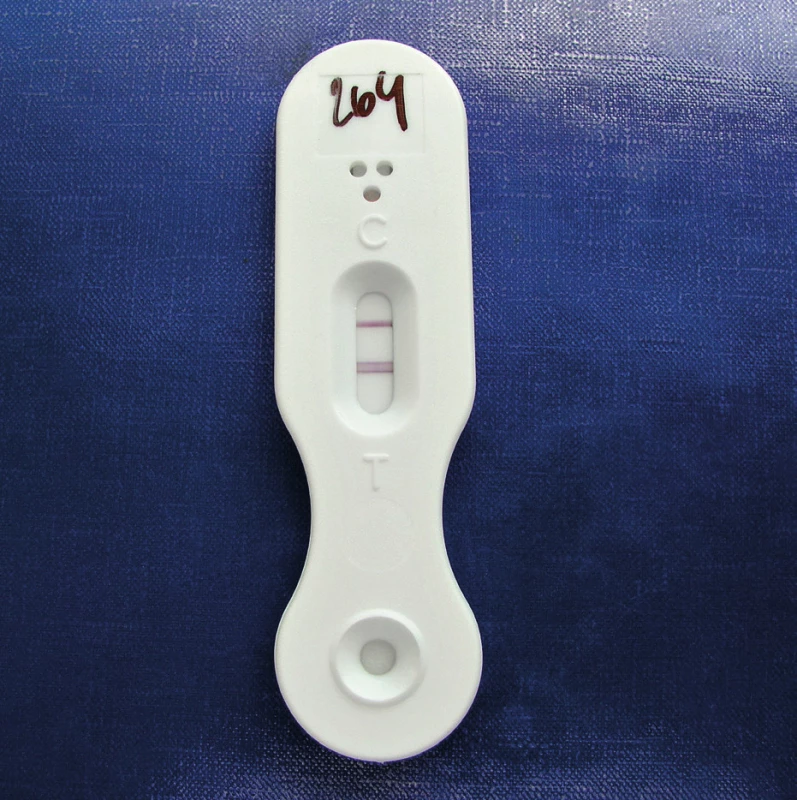
Dechový test
Zajímavá z hlediska nekultivační diagnostiky IPA se jeví práce Koo et al. publikovaná v loňském roce, kdy autoři identifikovali in vitro sekundární metabolity (monoterpeny) specifické pro některé klinicky významné druhy rodu Aspergillus. Následně se pokusili o jejich identifikaci v dechu pacientů se suspektní IA, a to s vysokou úspěšností (senzitivita 94%, specificita 93%) [44].
DETEKCE NESPECIFICKÝCH BIOLOGICKÝCH MARKERŮ
Test na průkaz beta-D-glukanu (Limulus test)
Beta-D-glukan (BDG) je polysacharid buněčné stěny mnoha druhů mikromycet a je uvolňován do okolí v počátečních fázích růstu houby. Detekován může být u většiny z nich (Candida spp., Trichosporon spp., Aspergillus spp., Fusarium spp., Acremonium spp., Pneumocystis jirovecii a další), u některých je obsažen v prakticky nedetekovatelném množství (řád Mucorales, Cryptococcus spp.). Hovoříme proto o tzv. panfungálním antigenu a jeho přítomnost v séru pacientů signalizuje blíže neurčenou mykotickou infekci.
Test je založen na schopnosti BDG reagovat s lyzátem amébocytů ostrorepa Limulus polyphenus (odtud název Limulus test) nebo Tachypleus tridentatus, čímž dojde k aktivaci serinové proteázy. Rychlost vzniklé kaskádové reakce je pak úměrná koncentraci BDG ve vzorku. Vzniklý produkt se měří kolorimetricky nebo turbidimetricky v závislosti na druhu použité soupravy. V ČR je k dispozici souprava Fungitell™ (Associates of Cape Cod, USA), detekční limit je 60–80 pg/ml. Senzitivita a specificita testu je 64–100% a 45–92% v závislosti na typu vyšetřované populace a designu studie [10]. Ke zvýšení senzitivity přispívá duplicitní vyšetřování vzorků [10, 45]. Přínos metody pro diagnostiku IA u neutropenických pacientů zhodnotili ve studii Senn et al., kdy senzitivita a specificita testu dosahovaly u této skupiny pacientů 63% a 93%. Pozitivní výsledek předcházel nálezu z klasických mikrobiologických a radiologických metod [46]. Recentní metaanalýzy Karageorgopoulose et al. a Onishiho et al. potvrdily přínos detekce BDG u široké skupiny pacientů se suspektní invazivní kandidózou, IA a zvláště infekcí způsobenou Pneumocystis jirovecii [47, 48]. Za přínos je považována relativně vysoká NPV testu (73–100%), PPV je udávána 37–89%. Falešně pozitivní reakce jsou popsány při kontaktu se zdravotnickými prostředky obsahujícími D glukany nebo celulózu, což je třeba gáza nebo celulózová membrána při hemodialýze, dále při podání některých antibiotik a krevních derivátů nebo při bakteriémii [10]. Nespecifita reakce a relativně nízká PPV jsou limitující faktory testu, nicméně díky vysoké NPV má metoda, zvláště v kombinaci s GM ELISA či specifickou PCR, své opodstatnění i při diagnostice IA.
Detekce BDG v BAL není standardizována, ojedinělé práce ukazují na srovnatelnou senzitivitu s GM při detekci IA, avšak na výrazně nižší specificitu (71% a 67%) [49].
Hoenigl et al. prezentovali studii srovnávající GM ELISA, BDG, LFD, PCR a klasické diagnostické metody na souboru 78 vzorků BAT získaných od pacientů v riziku IPA (3 jistá IPA, 14 pravděpodobná, 17 možná, 44 kontrolní skupina). Senzitivita GM ELISA (IP ≥ 0,5), BDG (≥ 80 pg/ml)a LFD byla srovnatelná (82% vs. 88% vs. 88%), specificita byla výrazně vyšší u GM a LFD testu (95%) stejně jako PPV (88%) ve srovnání s BDG (73% a 56%). PCR prováděné u pacientů s prokázanou a pravděpodobnou IPA mělo vysokou specificitu (100%) při nižší senzitivitě (70%). Klasické metody byly limitovány nízkou senzitivitou (53%), BDG nízkou PPV i specificitou (56% a 73%). Zvýšení hraniční hodnoty IP > 1 u GM ELISA vedlo ke zvýšení specificity a PPV a snížení senzitivity reakce. Za optimální autoři považovali kombinaci GM ELISA (IP > 1) a PCR, kde v souboru prokázaných a pravděpodobných IPA dosáhla senzitivita a NPV 100%. V případě nemožnosti provést PCR doporučili kombinaci GM ELISA a LFD [50].
Protilátková odpověď
Detekce specifických anti-aspergilových protilátek také není zařazena mezi kritéria EORTC/MSG. Je to spojeno hlavně s výskytem IA, která v minulosti postihovala převážně neutropenické pacienty, u kterých se rozvoj protilátkové odpovědi nepředpokládal. Spektrum pacientů, které postihuje IA, se však v posledních letech významně rozšiřuje mezi non-neutropenické pacienty. To vede ke zvyšujícímu se zájmu o sérologické metody detekce protilátek. K dispozici jsou imunoenzymatické, imunochromatografické, fluorescenční, komplement-fixační i hemaglutinační metody. Chybí však studie, které by zhodnotily přínos jednotlivých metod. Znovuobjevení se protilátek u pacientů s hematologickými malignitami je považováno za prognosticky příznivý znak. Naopak přítomnost protilátek u příjemců transplantátů z hematopoietických kmenových buněk (HSCT) může signalizovat rozvoj IA v posttransplantační fázi [51]. Své místo mezi mykologickými vyšetřovacími metodami má detekce specifických protilátek třídy IgG, stanovovaných většinou precipitační reakcí u pacientů s chronickou aspergilózou, při suspektním nálezu v zobrazovacích metodách a při klinických známkách chronické plicní infekce [8, 36].
ZÁVĚR
Laboratorní diagnostika plicních onemocnění vyvolaných zástupci rodu Aspergillus neposkytuje většinou jednoznačný závěr, proto by výsledky měly být vždy interpretovány zkušeným odborníkem. Přínos nejčastěji používaných mykologických metod je shrnut v tabulce 2.Základním testem, na kterém je dnes laboratorní diagnostika invazivních forem plicní aspergilózy postavena, je průkaz GM. Při interpretaci nálezu je třeba mít na paměti všechny aspekty, které mohou výsledek ovlivnit – klinický stav pacienta, jeho léčba, odběr materiálu, transport, zpracování v laboratoři i biologické vlastnosti dané mikromycety. Ke stanovení diagnózy a eventuálnímu doporučení léčby je pak nutné hodnotit laboratorní nález vždy v kombinaci s klinickými symptomy, nálezy ze zobrazovacích metod a predispozičními faktory pacienta, což vyžaduje úzkou spolupráci jednotlivých odborníků.
Tab. 2. Přínos mykologických laboratorních metod v diagnostice plicní aspergilózy (upraveno podle [6, 8, 9, 10]) Table 2. Benefit of mycological laboratory methods in the diagnosis of pulmonary aspergillosis (adapted from [6, 8, 9, 10]) ![Přínos mykologických laboratorních metod v diagnostice plicní aspergilózy (upraveno podle [6, 8, 9, 10])
Table 2. Benefit of mycological laboratory methods in the diagnosis of pulmonary aspergillosis (adapted from [6, 8, 9, 10])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c34de0ecc7a45931da358d62a6ba4e6d.png)
+++ silně doporučeno +++ strongly recommended ++ doporučeno ++ recommended + okrajově doporučeno + marginally recommended – nedoporučeno – not recommended Do redakce došlo dne 4. 10. 2016.
Adresa pro korespondenci:
MUDr. Naďa Mallátová
Pracoviště parazitologie a mykologie, Centrální laboratoře
Nemocnice České Budějovice, a. s.
Němcové 54
370 01 České Budějovice
e-mail: mallatova@nemcb.cz
Zdroje
1. Samson RA, Hong SB, Frisvald JC. Old and new concepts of species differentiation in Aspergillus. Medical Mycology, 2006;44(Suppl.1): 127–131.
2. Sugui JA, Peterson SW, Figat A, et al. Genetic relatedness versus biological compatibility between Aspergillus fumigatus and related species. J Clin Microbiol, 2014;52(10): 3707–3721.
3. Hubka V, Kubatova A, Mallatova N, et al. Rare and new etiological agents revealed among178 clinical Aspergillus strains obtained from Czech patients and characterized by molecular sequencing. Med Mycol, 2012;50(6): 601–610.
4. Haber J, Vašáková M, Mallátová N, et al. Plicní aspergilové syndromy – diagnostika a léčba, doporučené postupy odborných společností. Stud Pneumol Phthiseol, 2016;76(3): 82–88.
5. Mennink-Kersten MA, Donnelly JP, Verweij PE. Detection of circulating galactomannan for the diagnosis and management of invasive aspergillosis. Lancet Infect Dis, 2004;46(4): 349–357.
6. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis, 2008;46(12): 1813–1821.
7. Blot SI, Taccone FS, Van den Abeele AM, et al. A clinical algorithm to diagnose invasive pulmonary aspergillosis in critically ill patients. Am J Respir Crit Care Med, 2012;186(1): 56–64.
8. Denning DW, Cadranel J, Beigelman-Aubry C, et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management. Eur Respir J, 2016;47(1): 45–46.
9. Arendrup MC, Bille J, Dannaoui E, et al. ECIL-3 classical diagnostic procedures for the diagnosis of invasive fungal diseases in patients with leukaemia. Bone Marrow Transplant, 2012;47(8): 1030–1045.
10. Marchetti O, Lamoth F, Mikulska M, et al. ECIL recommendations for the use of biological markers for the diagnosis of invasive fungal diseases in leukemic patients and hematopoietic SCT recipients. Bone Marrow Transplantation, 2012;47(6): 846–854.
11. Guarner J, Brandt ME. Histopathologic diagnosis of fungal infections in the 21st century. Clin Microbiol Rev, 2011;24(2): 247–280.
12. Escribano P, Marcos-Zambrano LJ, Peláez T, et al. Sputum and bronchial secretion samples are equally useful as bronchoalveolar lavage samples for the diagnosis of invasive pulmonary aspergilosis in selected patients. Med Mycol, 2015;53(3): 235–240.
13. Murray PR, Baron EJ, Jorgensen JH, et al. Manual of Clinical Microbiology. 9th Edition. Washington DC: ASM Press, 2007, p. 2488.
14. Zima T. Laboratorní diagnostika. Praha: Galén 2013. Laboratorní diagnostika v mikrobiologii. s. 901–1013.
15. Rickerts V, Mousset S, Lambrecht E, et al. Comparsion of histopathological analysis, culture, and polymerase chain reaction assays to detect invasive mold infection from biosy speciments. Clin Infect Dis, 2007;44(8): 1078–1083.
16. Rangue S, Normand AC, Cassagne C, et al. MALDI-TOF mass spectrometry identification of filamentous fungi in the clinical laboratory. Mycoses, 2014;57(3): 135–140.
17. National Comittee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of conidium-forming filamentous fungi. National Committee for Clinical Laboratory Standards, Wayne, PA, USA. Approved Standard M38-A (2002).
18. Subcommittee on Antifungal Susceptibility Testing of the ESCMID European Committee for Antimicrobial Susceptibility Testing. EUCAST Technical Note on the method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for conidia-forming moulds. Clin Microbiol Infect, 2008;14 : 982–984.
19. Alastruey-Izquierdo A, Melhem MS, Bonfietti LX, et al. Susceptibility test for fungi: clinical and laboratorial correlations in medical mycology. Rev Inst Med Trop Sao Paulo, 2015;57(Suppl.19): 57–64.
20. Van der Linden JWM, Arendrup MC, Waris A, et al. Prospective multicenter international surveillance of azole resistance in Aspergillus fumigatus. Emerging Infect Dis, 2015;21(6): 1041–1144.,
21. Snelders E, Huis In‘t Veld RA, Rijs AJ, et al. Possible environmental origin of resistance of Aspergillus fumigatus to medical triazoles. Appl Environ Microbiol, 2009;75 : 4053–4057.
22. Snelders E, Camps SM, Karawajczyk A, et al. Triazole fungicides can induce cross-resistance to medical triazoles in Aspergillus fumigatus. PLoS One, 2012;7: e31801.
23.Veweij PE, Chowdhary A, Melchers JG, et al. Azole resistence in Aspergillus fumigatus: Can we retain the clinical use of mold-active antifungal azoles? Clin Infect Dis, 2016;62(3): 362–368.
24.Verweij PE, Ananda-Rajah M, Andes D, et al. International expert opinion on the management of infection caused by azole-resistant Aspergillus fumigatus. Drug Resist Updat, 2015;21(22): 30–40.
25. Arendrup MC. Update on antifungal resistance in Aspergillus and Candida. Clin Microbiol Infect, 2014;20(Suppl. 6): 42–48.
26. Maertens JA, Klont R, Masson C, et al. Optimization of the cutoff value of the Aspergillus double-sandwich enzyme immunoassay. Clin Infect Dis, 2007;44(10): 1329–1336.
27. Caillot D, Mannone L, Cuisenier B, et al. Role of early diagnosis and aggressive surgery in the management of invasive pulmonary aspergillosis in neutropenic patients. Clin Microbiol Infect, 2001;7(Suppl. 2): 54–61.
28. Pfeiffer CD, Fine JP, Safdar N. Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis. Clin Infect Dis, 2006;42(10): 1417–1427.
29. Leeflang MM, Debets-Ossenkopp YJ, Visser CE, et al. Galactomannan detection for invasive aspergillosis in immunocompromized patients. Cochrane Database Syst Rev, 2008;8(4): CD007394.
30. Leeflang MM, Debets-Ossenkopp YJ, Wang J, et al. Galactomannan detection for invasive aspergillosis in immunocompromised patients. Cochrane Database Syst Rev, 2015;30(12): CD007394.
31. Cordonnier C, Botterel F, Ben Amor R, et al. Correlation between galactomannan antigen levels in serum and neutrophil counts in haematological patients with invasive aspergillosis. Clin Microbiol Infect, 2009;15(1): 81–86.
32. Marr KA, Laverdiere M, Gugel A, et al. Antifungal therapy decreases sensitivity of the Aspergillus galactomannan enzyme immunoassay. Clin Infect Dis, 2005;40(12): 1762–1769.
33. Klont RR, Mennink-Kersten MA, Verweij PE. Utility of Aspergillus antigen detection in specimens other than serum speciment. Clin Infect Dis, 2004;39(10): 1467–1474.
34. Maertens J, Maertens V, Theunissen K, et al. Bronchoalveolar lavage fluid galactomannan for the diagnosis of invasive pulmonary aspergillosis in patients with hematologic diseases. Clin Infect Dis, 2009;49(11): 1688–1693.
35. Maertens J, Theunissen K, Deeren D, et al. Defining a case of invasive aspergillosis by serum galactomannan. Med Mycol, 2006;44 : 173–178.
36. Kosmidis C, Denning D. The clinical spectrum of pulmonary aspergillosis. Thorax, 2015;70(3): 270–277.
37. Guo YL, Chen YQ, Wang K, et al. Accuracy of BAL galactomannan in diag - nosing invasive aspergillosis: a bivariate metaanalysis and systematic review. Chest, 2010;138(4): 817–824.
38. Zhang XB, Chen GP, Lin QC, et al. Bronchoalveolar lavage fluid galactomannan detection for diagnosis of invasive pulmonary aspergillosis in chronic obstructive pulmonary disease. Med Mycol, 2013;51(7): 688–695.
39. Pasqualotto AC, Xavier MO, Sanchez LB, et al. Diagnosis of invasive aspergillosis in lung transplant recipients by detection of galactomannan in the bronchoalveolar lavage fluid. Transplantation, 2010;90(3): 306–311.
40. Izumikawa K, Yamamoto Y, Mihara T, et al. Bronchoalveolar lavage galactomannan for the diagnosis of chronic pulmonary aspergillosis. Med Mycol, 2012; 50(8): 811–817.
41. Thornton CR. Development of an immunochromatographic lateral-flow device for rapid serodiagnosis of invasive aspergillosis. Clin Vaccine Immunol, 2008;15(7): 1095–1105.
42. Pan Z, Fu M, Zhang J, et al. Diagnostic accuracy of a novel lateral-flow device in invasive aspergillosis: a meta-analysis. J Med Microbiol, 2015;64(7): 702–707.
43. White PL, Parr C, Thornton C, et al. Evalution on real-time PCR, galactomannan enzyme-linked immunosorbent assay (ELISA), and a novel lateral-flow device for diagnosis of invasive aspergilosis. J Clin Microbiol, 2013;51(5): 1510–1516.
44. Koo S, Thomas HR, Daniels SD, et al. A Breath Fungal Secondary Metabolite Signature to Diagnose Invasive Aspergillosis. Clin Infect Dis, 2014;59(12): 1733–1740.
45. Ostrosky-Zeichner L, Alexander BD, Kett DH, et al. Multicenter clinical evaluation of the (1→3) β-D-glucan assay as an aid to diagnosis of fungal infections in humans. Clin Infect Dis, 2005;41(5): 654–659.
46. Senn L, Robinson JO, Schmidt S, et al. 1,3-Beta-D-glucan antigenemia for early diagnosis of invasive fungal infections in neutropenic patients with acute leukemia. Clin Infect Dis, 2008;46(6): 878–885.
47. Karageorgopoulos DE, Vouloumanou EK, Ntziora F, et al. β-D-glucan assay for the diagnosis of invasive fungal infections: a metaanalysis. Clin Infect Dis, 2011;52(6): 750–770. 48. Onishi A, Sugiyama D, Kogata Y, et al. Diagnostic accuracy of serum 1,3-β-D-glucan for Pneumocystis jiroveci pneumonia, invasive candidiasis, and invasive aspergillosis: systematic review and meta-analysis. J Clin Microbiol, 2012;50(1): 7–15.
49. Rose SR, Vallabhajosyula S, Velez M, et al. The utility of bronchoalveolar lavage beta-D-glucan testing for diagnosis of invasive fungal infections. J Infect, 2014;69(3): 278–283.
50. Hoenigl M, Prattes J, Spiess B, et al. Performance of galactomannan, beta-D-glucan, Aspergillus lateral-flow device, conventional culture, and PCR tests with bronchoalveolar lavage fluid for diagnosis of invasive pulmonary aspergillosis. J Clin Microbiol, 2014;52(6): 2039–2045.
51. Lamoth F, Alexander BD. Nonmolecular methods for the diagnosis of respiratory fungal of respiratory fungal infections. Clin Lab Med, 2014;34(2): 315–336.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek Rejstříky
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2017 Číslo 4- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Určení etiologických patogenů nozokomiální pneumonie – porovnání validity různých typů odběrů biologického materiálu: prospektivní, observační studie u mechanicky ventilovaných pacientů v intenzivní péči
- Humánní alveolární echinokokóza a přehled výskytu tasemnic Echinococcus multilocularis u zvířat v České republice
- Mycological diagnosis of pulmonary Aspergillus infections with a focus on serological methods
- Průtoková cytometrie v mikrobiologii
- Crohnova choroba a ulcerózna kolitída – súčasný pohľad na genetickú determináciu, imunopatogenézu a biologickú liečbu
- Prevalence, incidence, perzistence a možnosti přenosu infekce lidským papilomavirem (HPV)
- Průkaz antigenně specifických T lymfocytů u pacientů s neuroborreliózou
- Kongres klinické mikrobiologie, infekčních nemocí a epidemiologie – KMINE 2017
- Připomenutí profesora Karla Rašky
- Rejstříky
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Humánní alveolární echinokokóza a přehled výskytu tasemnic Echinococcus multilocularis u zvířat v České republice
- Crohnova choroba a ulcerózna kolitída – súčasný pohľad na genetickú determináciu, imunopatogenézu a biologickú liečbu
- Průtoková cytometrie v mikrobiologii
- Mycological diagnosis of pulmonary Aspergillus infections with a focus on serological methods
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



