-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Použitie metódy PCR v diagnostike enterovírusových infekcií
Use of PCR in Diagnosis of Enteroviral Infections
Enteroviruses belonging to the family Picornaviridae are important human pathogens. Although most cases of infection caused by these viruses are asymptomatic, a wide range of clinical syndromes is observed in manifest cases. Conventional laboratory diagnostic methods based on virus isolation and identification, or on the detection of specific antiviral antibodies, are costly and time consuming. Therefore, they are of little benefit to treatment.
We have implemented a commercially available PCR-based test for the detection of enteroviral infections. In 2008, we analyzed biological specimens from 125 patients with suspected enteroviral disease, most often involving the nervous system.
The presence of enterovirus was detected in 39 patients. The results were compared with those obtained by the conventional methods. PCR appeared to be a valuable method for rapid, accurate and reliable diagnosis of enteroviral infections which is of major benefit to patient management.Key words:
enteroviruses – PCR – diagnostic.
Autoři: M. Sojka; S. Bopegamage; A. Petrovičová
Působiště autorů: Oddelenie virológie, Slovenská zdravotnícka univerzita, Bratislava
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 3, s. 132-136
Souhrn
Enterovírusy, patriace do čeľade Picornaviridae, sa považujú za významné humánne patogény. Infekcia prebieha najčastejšie asymptomaticky, v prípade klinickej manifestácie je škála nimi spôsobených syndrómov veľmi široká. Klasické metódy laboratórnej diagnostiky týchto infekcií, založené na izolácii vírusu a jeho identifikácii alebo na dôkaze vírus-špecifických protilátok sú materiálne i časovo náročné. Výsledok vyšetrenia má preto často len malý vplyv na liečbu pacienta.
Implementovali sme metódu dôkazu prítomnosti enterovírusov pomocou komerčne dostupnej súpravy založenej na polymerázovej reťazovej reakcii (PCR). V priebehu roka 2008 sme vyšetrili vzorky od 125 pacientov so suspektným enterovírusovým ochorením (prevažne nervovej sústavy).
V 39 prípadoch sme v relevantnej vzorke dokázali prítomnosť enterovírusu. Výsledky sme porovnali s vyšetrením klasickými metódami. PCR predstavuje vhodnú metódu rýchlej, presnej a spoľahlivej laboratórnej diagnostiky enterovírusových infekcií, ktorej výsledok má výrazný vplyv na manažment pacienta.Kľúčové slová:
enterovírusy – PCR – diagnostika.Rod Enterovirus (Picornaviridae) zahŕňa veľký počet sérotypov (polio, coxsackie, echovírusy, enterovírusy 68 – 71). Infekcia týmito vírusmi prebieha najčastejšie subklinicky. V malom podiele infikovaných jedincov však môže mať bifázický priebeh so sekundárnou virémiou, kedy sa vírus šíri do cieľových orgánov ako srdce, orgány centrálnej nervovej sústavy, pankreas, koža a sliznice alebo priečne pruhované svalstvo [7]. V týchto prípadoch prebieha enterovírusová infekcia pod obrazom myokarditídy alebo myoperikarditídy, aseptickej meningitídy, prípadne meningoencefalitídy, herpangíny, pleurodýnie, konjunktivitídy alebo nešpecifického febrilného ochorenia. Závažná býva generalizovaná enterovírusová infekcia u novorodencov, ktorá často končí fatálne. Akútna alebo chronická enterovírusová infekcia môže byť jedným z faktorov, podieľajúcich sa na rozvoji chronických ochorení, ako sú dilatačná kardiomyopatia a diabetes mellitus prvého typu [3, 11, 20].
Najvhodnejším biologickým materiálom pre priamu diagnostiku enterovírusových infekcií je likvor v prípade infekcie nervového systému, perikardiálny výpotok alebo bioptická vzorka srdcového svalu z postihnutého miesta v prípade myokarditídy a myoperikarditídy. Počas viremickej fázy ochorenia je možné dokázať prítomnosť vírusu i v krvi alebo v sére. Dôkaz vírusu v stolici alebo v materiáloch z horných dýchacích ciest má iba podporný význam (asymptomatická infekcia týmito vírusmi je v populácii bežná najmä v letnom a v jesennom období) [12].
Priama laboratórna diagnostika enterovírusových infekcií je založená na izolácii vírusu a jeho následnej identifikácii v neutralizačnom teste s použitím známych zmesových antisér [8, 14, 18]. Udáva sa, že citlivosť tejto metódy je 65 – 75 % [15]. Dosiaľ však nie je známa bunková línia, ktorá by bola vhodným substrátom pre množenie všetkých sérotypov enterovírusov. V mnohých prípadoch, najmä keď ide o symptómy spájané s postakútnou alebo chronickou manifestáciou enterovírusových infekcií (chronické myokarditídy), sa nedarí vírus izolovať [9].
Nepriamu diagnostiku enterovírusových infekcií stanovením signifikantného vzostupu titra protilátok alebo vírus-špecifických protilátok triedy IgM rovnako komplikuje veľký počet sérotypov, náročná práca s bunkovými kultúrami a vysoká prevalencia týchto protilátok v populácii. Dôkaz lokálnej tvorby protilátok porovnaním titra protilátok v sére s titrom v inej telovej tekutine je relatívne rýchlou diagnostickou metódou, ktorá je použiteľná najmä v prípade infekcií CNS (sérum/ likvor).
Laboratórnu diagnostiku enterovírusových infekcií výrazne ovplyvnil vývoj metódy PCR. Primery pre amplifikáciu častí enterovírusového genómu použitím jednoduchej alebo nested RT‑PCR sú popísané vo viacerých štúdiách [5, 6, 13, 19]. Väčšina primerov, ktoré sú vhodné pre dôkaz prítomnosti RNA väčšiny alebo všetkých sérotypov enterovírusov, je cielená na vysoko konzervované sekvencie v 5’ neprekladanej oblasti vírusového genómu [5, 10]. Ak je správne optimalizovaná, metóda dokáže poskytnúť výsledok do 24 hodín, a teda môže mať na manažment pacienta väčší vplyv v porovnaní s kultivačnými metódami, ktoré poskytujú výsledok najskôr do 5 až 7 dní. Jej citlivosť a špecificita sa blíži k 100 % [14]. Viaceré štúdie, porovnávajúce PCR s klasickými kultivačnými metódami, poukazujú aj na šetrenie výdavkov spojených so starostlivosťou o pacienta vďaka rýchlej a presnej detekcii infekčného agensa [1, 2, 16, 17]. Limitom väčšiny PCR metód pre detekciu enterovírusov je nemožnosť identifikácie vírusu na úrovni sérotypu. Problém je možné riešiť sekvenovaním produktov PCR a ich následným porovnaním so známymi sekvenciami v databázach [10]. V súčasnosti sa na trhu objavuje čoraz viac súprav určených na PCR detekciu enterovírusov, čo umožňuje obísť prácnu optimalizáciu „in house“ techník a zaviesť túto metódu v rutinnej diagnostickej praxi.
V práci sumarizujeme výsledky laboratórnej diagnostiky enterovírusových infekcií metódou PCR v našom laboratóriu a porovnávame ich s klasickými sérologickými metódami.
Materiál a metódy
Vyšetrené boli vzorky biologického materiálu, odobraté v roku 2008 od 125 pacientov odoslané do Laboratória pre enterovírusy Slovenskej zdravotníckej univerzity, so suspektným enterovírusovým ochorením nervovej sústavy (meningitída, meningoencefalitída, encefalitída), srdca (myokarditída, perikarditída, myoperikarditída), prípadne iným ochorením s možnou enterovírusovou etiológiou (nešpecifikované febrilné ochorenia).
Ak boli dostupné párové vzorky séra (sérum z akútnej fázy infekcie a rekonvalescentné sérum), prípadne vzorka séra a likvoru od jedného pacienta, odobratá súčasne, bol v nich kvantitatívne stanovený titer protilátok proti ôsmim sérotypom coxsackievírusov: CVB1, 2, 3, 4, 5, 6, 7, 8, CVA7, 9. Na stanovenie hladiny protilátok sa použil klasický test neutralizácie vírusu na stabilizovanej bunkovej línii VERO. Markerom aktuálnej (nedávnej alebo prebiehajúcej) coxsackievírusovej infekcie bol signifikantný (najmenej štvornásobný) vzostup titra protilátok v párových vzorkách séra, zaznamenaná sérokonverzia, dôkaz prítomnosti vírus-špecifických protilátok triedy IgM, prípadne pomer titra protilátok sérum/likvor menší ako 100 (u neuroinfekcií, dôkaz intrathekálnej tvorby protilátok).
Pre vyšetrenie pomocou PCR sa vybrali vždy najvhodnejšie vzorky z dostupných materiálov od každého pacienta (tab. 1). Použila sa komerčne dostupná, certifikovaná diagnostická súprava Argene Enterovirus Consensus Complete Kit (Argene, Francúzsko), založená na amplifikácii časti 5’ neprekladanej oblasti vírusového genómu a detekcii amplifikačného produktu hybridizáciou s biotinylovanou sondou, špecifickou pre oblasť genómu, nachádzajúcu sa medzi primermi. Postupovalo sa podľa návodu výrobcu.
Tab. 1. Materiál vyšetrený PCR na prítomnosť enterovírusového genómu Table 1. Specimens tested by PCR for the presence of enteroviral genome 
L – likvor, S – sérum, PV – perikardiálny výpotok, M – myokard L – cerebrospinal fluid, S – serum, PV – pericardial exsudate, M – myocardium Výsledky a diskusia
U 39 (31 %) z celkového počtu 125 pacientov so suspektným enterovírusovým ochorením sme v relevantnej vzorke dokázali prítomnosť enterovírusového genómu (graf 1). Z týchto pacientov sme u 13 dokázali aktuálnu infekciu cosxackievírusmi aj v teste neutralizácie vírusu. U 9 pacientov bol výsledok sérologického vyšetrenia negatívny. V týchto prípadoch pravdepodobne išlo o infekciu iným sérotypom enterovírusu ako boli sledované. Výsledok PCR vyšetrenia materiálu (likvor) od jedného pacienta bol neinterpretovateľný. Porovnanie vyšetrení metódou PCR s klasickými metódami u všetkých sledovaných pacientov, je v tab 2.
Graf 1. Výsledky PCR stanovenia prítomnosti enterovírusového genómu vo vzorkách od 125 pacientov Fig. 1. PCR detection of enteroviral genome in specimens from 125 patients 
Tab. 2. Porovnanie PCR dôkazu prítomnosti enterovírusového genómu s dôkazom aktuálneho priebehu infekcie sérologickými technikami Table 2. PCR detection of enteroviral genome in comparison with serology during the course of infection 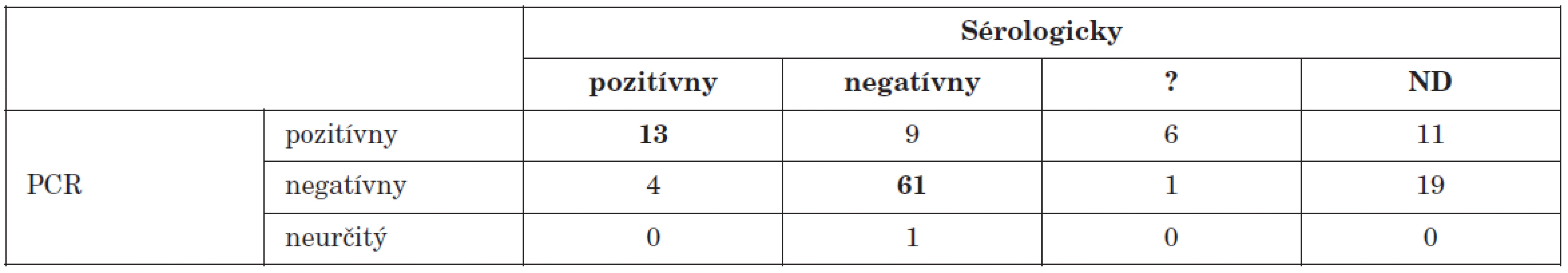
? – neinterpretovateľný výsledok, ND – nevyšetrené ? – result not interpretable, ND – not done Enterovírusy patria medzi najčastejších pôvodcov aseptických meningitíd [12]. V našom súbore tvorili pacienti s ochorením nervovej sústavy väčšinu (95) prípadov. Vo vzorkách od 34 (35,8 %) z nich sme dokázali prítomnosť enterovírusového genómu. Tento údaj koreluje s výsledkami viacerých autorov, ktorí uvádzajú podobný podiel pozitivity [20, 21]. U viacerých pacientov bol výsledok sérologického vyšetrenia neinterpretovateľný alebo nebola dodaná párová vzorka. Výsledky porovnania PCR s vyšetrením klasickými metódami sú v tab. 3.
Tab. 3. Porovnanie PCR dôkazu prítomnosti enterovírusového genómu s dôkazom aktuálneho priebehu infekcie sérologickými technikami u pacientov s ochorením nervovej sústavy Table 3. PCR detection of enteroviral genome in comparison with serology during the course of infection in patients with disease of the nervous system 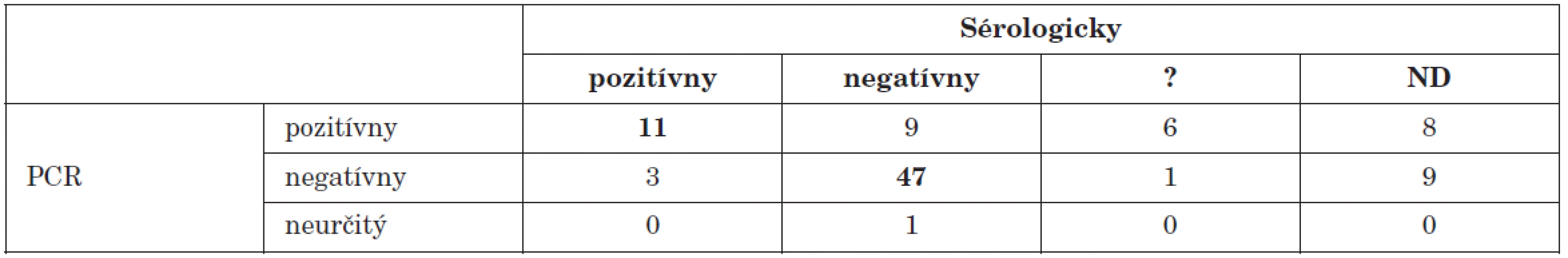
? – neinterpretovateľný výsledok, ND – nevyšetrené ? – result not interpretable, ND – not done V súbore sú zahrnuté aj vzorky od 19 pacientov, pochádzajúce z oblasti s hláseným epidemickým výskytom aseptickej meningitídy. V 14 prípadoch sme pomocou PCR dokázali prítomnosť enterovírusov v likvore. Prvé výsledky boli odoslané do 24 hodín po doručení materiálu a PCR ako rýchla diagnostická metóda výrazne ovplyvnila manažment pacienta [14].
Z 12 pacientov s ochorením srdca (myokarditída, myoperikarditída), sme prítomnosť enterovírusového genómu potvrdili vo vzorkách myokardu od dvoch pacientov a vo vzorke perikardiálneho výpotku od jedného pacienta. Práve u týchto pacientov neboli dostupné párové vzorky séra (tab 4). Naše výsledky sú v súlade so sérologickými štúdiami aj štúdiami molekulárno biologickými metódami (in situ hybridizácie, PCR) ktoré dávajú do spojitosti enterovírusovú infekciu srdca so vznikom akútnych i chronických ochorení srdca [11].
Tab. 4. Porovnanie PCR dôkazu prítomnosti enterovírusového genómu s dôkazom aktuálneho priebehu infekcie sérologickými technikami u pacientov s ochorením srdca Table 4. PCR detection of enteroviral genome in comparison with serology during the course of infection in patients with heart disease 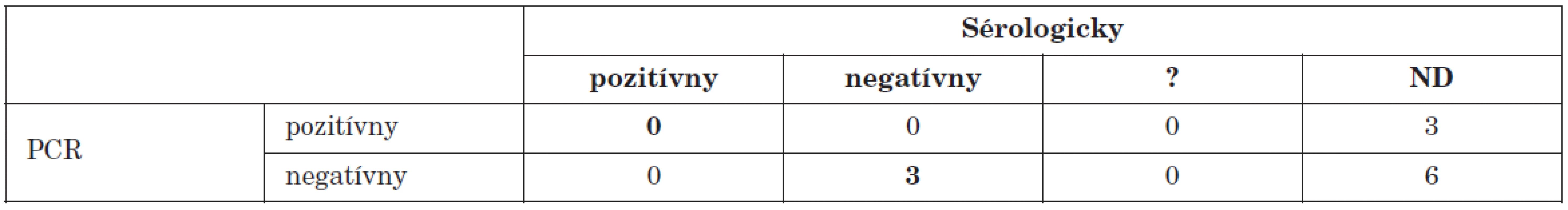
? – neinterpretovateľný výsledok, ND – nevyšetrené ? – result not interpretable, ND – not done V dvoch prípadoch z 18 pacientov s iným ochorením, ktoré mohlo byť enterovírusového pôvodu (febrilné stavy neznámeho pôvodu), sme v biologickom materiáli (sérum) dokázali prítomnosť enterovírusov (tab. 5). Táto informácia ponúka ošetrujúcemu lekárovi zaujímavú možnosť vziať v diferenciálnej diagnostike do úvahy i tieto vírusy ako agensy spôsobujúce daný stav.
Tab. 5. Porovnanie PCR dôkazu prítomnosti enterovírusového genómu s dôkazom aktuálneho priebehu infekcie sérologickými technikami u pacientov s iným suspektným enterovírusovým ochorením Table 5. PCR detection of enteroviral genome in comparison with serology during the course of infection in patients suspected of having other enteroviral disease 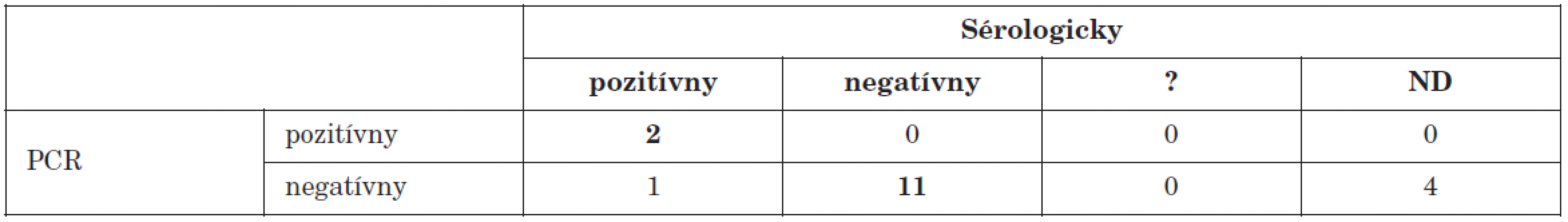
? – neinterpretovateľný výsledok, ND – nevyšetrené ? – result not interpretable, ND – not done Použitá technika PCR sa ukázala ako vhodná metóda pre rýchlu, presnú a spoľahlivú laboratórnu diagnostiku enterovírusových infekcií.
Táto práca bola podporená Grantom Ministerstva zdravotníctva SR číslo MZ SR 2006/12-SZU-07.
Do redakce došlo 21.1.2009
Mgr. Martin Sojka
RNDr. Shubhada Bopegamage, CSc.
MUDr. Anna Petrovičová, CSc.
Oddelenie virológie
Slovenská zdravotnícka univerzita
Limbová 12
833 03 Bratislava
Slovenská republika
e-mail: martin.sojka@szu.sk
Zdroje
1. Ahmed, A., Brito, F., Goto, C. Clinical utility of the polymerase chain reaction for diagnosis of enteroviral meningitis in infancy. J Pediatr, 1997, 131, 393 – 397.
2. Byington, C. L., Taggart, E. W., Carroll, K. C., Hillyard, D. R. A polymerase chain reaction –based epidemiologic investigation of the incidence of nonpolio enteroviral infections in febrile and afebrile infants 90 days and younger. Pediatrics, 1999, 103, E27.
3. Galbraith, D. N., Nairn, C., Clements, G. B. Evidence for enteroviral persistence in humans. J Gen Virol, 1997, 78, 307 – 312.
4. Hyypiä, T., Auvinen, P., Maaronen, M. Polymerase chain reaction for human picornaviruses. J Gen Virol, 1989, 70, 3261 - 3268.
5. Chapman, N. M., Tracy, S., Gauntt, C. J., Fortmueller, U. Molecular detection and identification of enteroviruses using enzymatic amplification and nucleic acid hybridization. J Clin Microbiol, 1990, 28, 843 - 850.
6. Cheng, M. F., Chen, B. C., Huang, T. S., Hsieh, K. S., Chen, S. N., Liu, Y. C. Clinical application of reverse-transcription polymerase chain reaction and intravenous immunoglobulin for enterovirus encephalitis. Jpn J Infect Dis, 2008, 61, 18 - 24.
7. de Leeuw, N., Melchers, W. J. G., Willemse, D. F. M., Balk, A. H. M., de Jonge, N., Galama, J. M. D. The diagnostic value of PCR for the detection of enteroviral infections. Serodiagn Immunother Infect Disease, 1994, 6, 189 – 195.
8. Lim, K. A., Benyesh-Melnick, M. Typing of viruses by combinations of antiserum pools: application to typing of enteroviruses (Coxsackie and echo). J Immunol, 1960, 84, 309 – 317.
9. Muir, P. Enteroviruses and heart disease. Br J Biomedical Sci, 1993, 50, 258 – 271.
10. Muir, P., Kämmerer, U., Korn, K., Mulders, M. N., Poyry, T., Weissbrich, B., Kandolf, R., Cleator, G. M., van Loon, A. Molecular typing of enteroviruses: Current status and future requirements. Clin Microb Rev, 1998, 11, 202 – 227.
11. Muir, P., Nicholson, F., Illavia, S. J., McNeil, T. S., Ajetunmobi, J. F., Dunn, H., Starkey, W. G., Reetoo, K. N., Cary, N. R. B., Parameshwar, J., Banatvala, J. E. Serological and molecular evidence of enterovirus infection in patients with end-stage dilated cardiomyopathy. Heart, 1996, 76, 243 – 249.
12. Muir, P., Nicholson, F., Jhetam, M., Neogi, S., Banatvala, J. E. Rapid diagnosis of enterovirus infection by magnetic bead and polymerase chain reaction detection of enterovirus RNA in clinical samples. J Clin Microbiology, 2003, 31, 31 – 38.
13. Nicholson, F., Meetoo, G., Aiyar, S., Banatvala, J. E., Muir, P. Detection of enterovirus RNA in clinical samples by nested polymerase chain reaction for rapid diagnosis of enterovirus infection. J Virol Methods, 1994, 48, 155 – 166.
14. Ramers, C., Billman, G., Hartin, M., Ho, S., Sawyer, M. H. Impact of a diagnostic cerebrospinal fluid enterovirus polymerase chain reaction test on patient management. JAMA, 2000, 283, 2680 – 2685.
15. Rotbart, H. A., Ahmed, A., Hickey, S. Diagnosis of enterovirus infection by polymerase chain reaction of multiple specimen types. Pediatr Infect Dis J, 1997, 16, 409 – 411.
16. Sawyer, M. H., Holland, D., Aintablain, N. Diagnosis of enteroviral central nervous system infection by polymerase chain reaction during a large community outbreak. Pediatr Infect Dis J, 1994, 13, 177 – 182.
17. Schlesinger, Y, Sawyer, M H., Storch, G. A. Enteroviral meningitis in infancy. Pediatrics, 1994, 94, 157 – 162.
18. Takami, T., Nakayama, T., Kawashima, H., Takei, Y., Takekuma, K., Hoshika, A. Determination of enterovirus serotype inferred from sequence analysis of PCR products. J Clin Virol, 2003, 26, 355 – 359.
19. Verstrepen, W. A., Kuhn, S., Kockx, M. M., van de Vyvere, M. E., Mertens, A. H. Rapid detection of enterovirus RNA in cerebrospinal fluid specimens with novel single-tube real-time reverse trancription-PCR assay. J Clin Microbiol, 2001, 4093 – 4096.
20. Why, H. J. F., Meany, B. T., Richardson, P. J., Olsen, E. G. J., Bowles, N. E., Cunningham, L., Freeke, C. A., Archard, L. C. Clinical and prognostic significance of enteroviral RNA detection in the myocardium of patients with myocarditis and dilated cardiomyopathy. Circulation, 1994, 89, 2582 – 2589.
21. Yerly, S., Gervaix, A., Simonet, V., Caflisch, M., Perrin, L., Wunderli, W. Rapid and sensitive detection of enteroviruses in specimens from patients with aseptic meningitis. J Clin Microbiol, 1996, 34, 199 – 201.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2009 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Výsledky sérologie hantavirů z klinických vzorků vyšetřených v období 1998-2008 na oddělení virologie Zdravotního ústavu v Ostravě
- Norwegian Scabies in Immunosuppressed Patient Misdiagnosed as an Adverse Drug Reaction
- Epidemický výskyt vodou přenosných chorob v České republice za období 1995 až 2005
- Použitie metódy PCR v diagnostike enterovírusových infekcií
- Apiterapia – úloha medu v procese hojenie chronických rán
- Informace o průběhu a závěrech konference Slezské dny preventivní medicíny
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Použitie metódy PCR v diagnostike enterovírusových infekcií
- Apiterapia – úloha medu v procese hojenie chronických rán
- Epidemický výskyt vodou přenosných chorob v České republice za období 1995 až 2005
- Výsledky sérologie hantavirů z klinických vzorků vyšetřených v období 1998-2008 na oddělení virologie Zdravotního ústavu v Ostravě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



