-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Závažné vrozené krvácivé poruchy s manifestací v novorozeneckém období – kazuistiky
Severe congenital bleeding disorders manifesting in the neonatal period – case reports
Congenital bleeding disorders are rare diseases. In case of a positive family history, especially in hemophilia, it is very important to prepare a plan for the birth of a child, taking into account an increased risk of bleeding. After birth of such a child, cooperation with a hematologist is key in performing necessary laboratory tests and other examinations. In a number of cases, however, the family history is silent, and the suspicion of a congenital bleeding disease arises only in the presence of bleeding associated with invasive procedures or, for example, intracranial bleed. In such case, rapid diagnosis is necessary, taking into account possible abnormal results of screening tests, ideally in collaboration with a hematologist. Replacement treatment of the coagulation disorder can stop the bleeding and prevent more severe damage or even death of the child.
Keywords:
newborn – inherited coagulation disorders – intracranial hemorrhage
Autoři: Jadvidžáková Eva; Šrámková Lucie; Komrska Vladimír; Starý Jan; Zápotocká Ester
Působiště autorů: Klinika dětské hematologie a onkologie, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (5): 287-292.
Kategorie: Kazuistika
doi: https://doi.org/10.55095/CSPediatrie2022/046Souhrn
Vrozené krvácivé choroby patří mezi vzácná onemocnění. V případě pozitivní rodinné anamnézy, zejména u hemofilie, je velmi důležitá příprava na porod dítěte, zohledňující zvýšené riziko krvácení. Po narození dítěte je klíčová spolupráce s hematologem při provedení potřebných laboratorních testů a dalších vyšetření dítěte. V řadě případů je však rodinná anamnéza němá a podezření na vrozenou krvácivou chorobu vzniká až při přítomnosti krvácení spojeného s invazivními výkony či například intrakraniálního krvácení. V tomto případě je nezbytná rychlá diagnostika se zohledněním případných abnormálních výsledků screeningových testů, ideálně ve spolupráci s hematologem. Cílená léčba koagulační poruchy může vést k zástavě krvácení a předejít těžšímu poškození, či dokonce úmrtí dítěte.
Klíčová slova:
novorozenec – vrozené koagulační poruchy – krvácení do CNS
Úvod
Krvácející novorozenec může představovat dramatickou situaci vyžadující rychlou diagnostiku a léčbu. V diferenciální diagnostice se kromě primárně hematologických příčin uplatňuje např. sepse s diseminovanou intravaskulární koagulopatií, chirurgické krvácení, nekrotizující enterokolitida aj. Dále pak krvácivá nemoc novorozence, v literatuře nově popisovaná jako VKDB (vitamin K deficiency bleeding).(1)
Krvácení z důvodu poruchy primární hemostázy má v případě trombocytopenie méně komplikovanou diagnostiku, problém může představovat trombocytopatie (množství potřebné krve k dalšímu testování). Pohled na koagulační systém novorozence se vyvíjí a odlišnosti oproti starším dětem a dospělým se shrnují pod pojmem vývojové hemostázy.(2) Opouští se statické vnímání běžných testů jako věrného obrazu stavu koagulace. APTT a PT jsou u novorozenců oproti dětem a dospělým prodloužené, problém je s dostupností referenčních rozmezí zejména pro méně zralé novorozence. Koagulační systém normálního novorozence je ve srovnání se starším dítětem a dospělým nastaven odlišně (nižší hladiny většiny koagulačních faktorů i přirozených antikoagulans, normální hladiny FVIII a FXIII, vyšší hladiny von Willebrandova faktoru, VWF), ale stále představuje velmi efektivní systém, který je celkově nastaven mírně prokoagulačně jako příprava na porodní trauma. Podávání čerstvě mražené plazmy pouze z důvodu prodloužení koagulačních časů je tedy neopodstatněné.(3) Novorozenec má fyziologicky cca 50 % hladiny většiny koagulačních faktorů, velmi nezralý novorozenec cca 30 % hladiny a dospělých hodnot dosahují děti po 6. měsíci věku. Naproti tomu hladina fibrinogenu je obvykle vyšší (fetální varianta) a fibrinolytická aktivita je nižší. Hyporeaktivitu krevních destiček vyvažuje zvýšená aktivita VWF. Avšak zejména neočekávané krvácení spolu s prodloužením koagulačních testů nebo pozitivní rodinná anamnéza mají vést neprodleně k vyšetření hladin koagulačních faktorů, obvykle po poradě s dětským hematologem. Představujeme 3 kazuistiky pacientů, u nichž se vrozená porucha koagulace projevila časně postnatálně, se závažnými až fatálními následky.
Kazuistika 1
Jedná se o dítě ze II./II gravidity, porod v termínu (40+2 g. t.), spontánní, záhlavím. Chlapec se narodil eutrofický, s dobrou poporodní adaptací. Rodinná anamnéza byla v té době bez pozoruhodností, zejména z pohledu krvácivých problémů, starší bratr byl zdráv. Matka zpětně udávala na cílený dotaz stran krvácivé anamnézy asi 3 hodiny trvající krvácení po vpichu do patičky při screeningovém vyšetření v porodnici a opakované „sáknutí“ z pupečníkového pahýlu. Dítě bylo propuštěno 3. den života. Ve 4 týdnech věku byl ambulantně vyšetřen pro opakované zvracení, sonograficky byla vyloučena pylorostenóza. V 5 týdnech věku náhle vzniká porucha vědomí, apatie, odmítání pití. Urgentně provedený ultrazvuk hlavičky ukázal velmi suspektní intrakraniální hemoragii (ICH), která byla potvrzena při CT vyšetření s nálezem rozsáhlé ICH frontálně vlevo a na bazi IV. komory, subarachnoidální krvácení, jednostranný hemoftalmus. V koagulačních odběrech bylo normální aPTT, významné prodloužení protrombinového času, PT (81,8 s, PT-R 6,8), což vedlo k podání mražené plazmy s částečnou korekcí. Neurochirurg zavedl zevní komorovou drenáž a po dohodě s hematologem bylo stanoveno již ve fázi substituce mraženou plazmou snížení hladiny koagulačního faktoru VII (FVII), což nás vedlo k vyjádření podezření na těžký deficit FVII. Z toho důvodu byla zahájena substituční léčba rekombinantním aktivovaným FVII (rFVIIa, NovoSeven) v dávce 100 μg (30 μg/kg) à 6 h, což vedlo ke kontrole krvácení. Při zavedené léčbě byla postupně zevní komorová drenáž změněna na VP shunt, byl zaveden dlouhodobý centrální žilní katétr při předpokladu dlouhodobé léčby koncentrátem FVII. Současně byla při plné substituční léčbě řešena antikoagulační léčbou trombóza sinus sagitalis superior, rectus a transversus, jež byla popsána při následujícím kontrolním zobrazení mozku a z velké části na léčbě rekanalizována. Po stabilizaci stavu, při přechodu na již preventivní podávání koncentrátu FVII (profylaxe) bylo možno stanovit bazální hladinu FVII, která byla pod 1 %, což je v souladu s těžkou formou deficitu. Genetickým vyšetřením bylo zjištěno, že chlapec je složený heterozygot pro mutace v promotoru c.-62F7 a intronu 4 c.316+1G>T genu pro F7, jež byly prokázány u rodičů. Při kontrolních zobrazeních dochází k očekávanému vývoji posthemoragického ložiska vlevo frontálně s postmalatickou přestavbou, současně byla popsána vrozená odchylka typu polymikrogyrie. V necelých 2 letech věku se objevily první příznaky sekundární epilepsie, která je farmakorezistentní. Celková prognóza dítěte je nepříznivá, definovaná těžkým neurologickým postižením s významnou retardací psychomotorického vývoje.
Obr. 1. Kazuistika 1, MR, T2 axiálně. Hypointenzní změny odpovídající prokrvácení v pravém frontálním laloku s perifokálním edémem. Širší okcipitální rohy postranních komor při vznikající obstrukci, výrazněji vlevo. 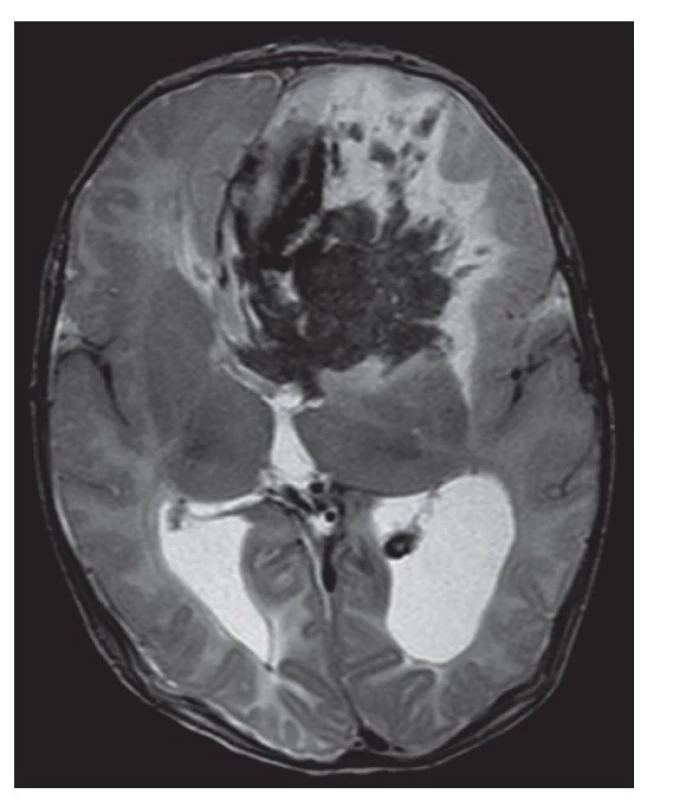
Z pohledu těžkého deficitu FVII bylo po stabilizaci krvácení pokračováno v sekundární profylaxi koncentrátem FVII (plazmatickým), jenž je podáván vzhledem ke krátkému biologickému poločasu obden cestou původně tunelizovaného jednocestného centrálního žilního katétru, který byl po 6 měsících pro dysfunkci zaměněn za implantofix. Profylaxe je podávána v dávce cca 33 IU/kg v domácím prostředí rodiči.
Faktor VII (prokonvertin) je glykoprotein patřící do rodiny serinových proteáz, vitamin K dependentní faktor, syntetizován výlučně v játrech. Jeho biologický poločas je velmi krátký: 4–6 hodin. Jako jediný faktor cirkuluje v plazmě v malém množství v aktivní podobě (FVIIa). K iniciaci koagulace je však nutná přítomnost tkáňového faktoru (TF). Vznik komplexu FVIIa + TF vede ke skokové aktivaci FIX a FX. Krvácivé projevy nejsou jasně závislé na hloubce deficitu. Gen F7 je lokalizován na 13. chromozomu. Ze vzácných vrozených koagulačních poruch patří deficit FVII k těm častějším, většinou se jedná o mírný, autozomálně dominantně dědičný deficit, který může vést k lehkému prodloužení PT či na jeho délku nemá vliv, nositel je většinou bez významnějších krvácivých obtíží. Incidence těžší formy deficitu FVII (bazální aktivita pod 10 %) je asi 1 : 500 000, úplný deficit je ještě vzácnější, jedná se o autozomálně recesivně dědičnou poruchu. Klinicky zřejmý krvácivý stav nastává obvykle při aktivitě FVII nižší než 30 %, nicméně klinická manifestace je různorodá a nekoreluje vždy s aktivitou FVII, proto může být nesnadné nastavení dlouhodobé profylaxe nebo zajištění perioperační hemostázy. Izolované prodloužení PT v souvislosti s krvácivým stavem obvykle vede k vyšetření faktorů II, V, VII a X. Nízkou aktivitu FVII je možné potvrdit imunoesejí, dědičnost pak genetickým vyšetřením (je popsáno asi 250 mutací vedoucích ke kvantitativnímu nebo kvalitativnímu deficitu). Péče o krvácivé komplikace a nastavení profylaxe u vrozeného nedostatku FVII zčásti kopíruje scénář hemofilický – k dispozici jsou z plazmy vyrobený koncentrát FVII či rekombinantní aktivovaný FVII (rFVIIa). Profylaxe je velmi limitovaná krátkým poločasem FVII, nicméně podávání minimálně 3× týdně či obden je u jedinců s krvácivými obtížemi běžná praxe.(4)
V tomto případě se jednalo o nejtěžší deficit FVII, přenašečství mutací genu F7 u rodičů bylo doloženo až zpětně. Krvácení, často právě ICH, se obvykle nedá předejít, protože až krvácení samotné bývá důvodem k vyšetření koagulačních testů.
Kazuistika 2
Jedná se o dítě matky přenašečky hemofilie typu A (inverze intronu 22 genu F8), která byla standardně sledována hematologem. Prenatální diagnostiku si rodina nepřála. Matce byl doporučen porod v centru s dostupností hematologa a koncentrátu FVIII. Zvolila porod v místě bydliště, stav přenašečství hemofilie nahlásila, ale v péči o novorozence k tomuto faktu nebylo dostatečně přihlédnuto. Dítě se narodilo ze III. gravidity (1 starší sestra zdráva), spontánním porodem, záhlavím, ve 38+1 g. t., bez použití kleští či vakuumextraktoru. Plod byl eutrofický (porodní hmotnost 3350 g). Skóre dle Apgarové 9-10-10, poporodní adaptace proběhla bez komplikací, krvácivé projevy nebyly pozorovány. Od 3. dne života chlapec méně pil, byl apatičtější, 5. den vyvinul křeče se záškuby pravostranných končetin, stáčením do opistotonu, byla přítomná anizokorie s mydriázou vpravo. Chlapec byl intubován a přeložen na novorozeneckou JIRP neonatologického centra s dostupností dětského hematologa, urgentně byl podán koncentrát FVIII. Při sonografickém vyšetření hlavičky bylo zjištěno rozsáhlé krvácení do komor s přetlakem doleva, CT mozku potvrdilo devastující ICH s rozsáhlým intraparenchymovým hematomem parietookcipitálně vpravo s provalením do komor, s přesunem středočárových struktur doleva a tentoriálním konem vpravo. Neurochirurg provedl z vitální indikace kraniotomii temporoparietálně vpravo, evakuoval hematom. Další odběry potvrdily těžkou formu hemofilie A s bazální hladinou FVIII pod 1 %. Pooperační období bylo zajištěno pravidelnou substitucí koncentrátem rekombinantního FVIII. Na zobrazení MR v odstupu 14 dnů byl zřejmý nález rozsáhlých malatických změn obou hemisfér mozku, bez vzniku hydrocefalu. Neurologicky byla zřejmá porucha vědomí s alterací kmenových reflexů, anizokorie, centrální kvadruparéza s vývojem do spasticity, s pravostrannou převahou. V dalším vývoji byl osud dítěte nepříznivý, s těžkou kvadruparézou a psychomotorickou retardací. Substituci FVIII profylakticky nedostával z důvodu limitované mobility, pouze perioperačně k zavedení gastrostomie. Inhibitor FVIII nevyvinul ani po masivních substitucích při ICH v novorozeneckém věku. Zemřel ve věku 6 let.
Obr. 2. Kazuistika 2, vstupní CT: objemný intraparenchymový hematom parietookcipitálně vpravo s provalením do komor, posun středočárových struktur vlevo, tentoriální konus vpravo 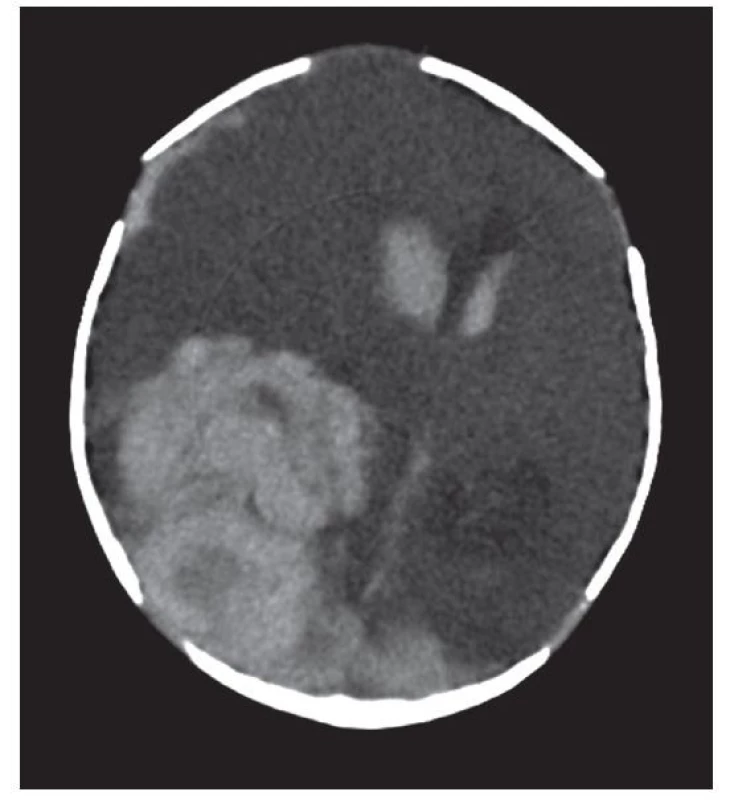
Hemofilie je na X chromozom vázané krvácivé onemocnění dané deficitem FVIII u hemofilie A a FIX u hemofilie B. Dostupná léčba zlepšila významně kvalitu života těchto dětí a jejich očekávaná délka života je dnes srovnatelná s obecnou populací. Problematika hemofilie byla podrobně zpracována v tomto časopise v čísle 3/2017. V aktuálním sdělení se autoři soustředí na možné neonatální komplikace spojené s těmito deficity.
Perinatální ICH je vzácným, ale závažným projevem hemofilie. Literární data uvádí výskyt v rozmezí 1–4 %.(5) Intrakraniání krvácení se může také vyskytovat v kombinaci s extrakraniálním krvácením (kefalhematomy, subgaleální krvácení) a takováto krevní ztráta může novorozence ohrozit hypovolemií a v minulosti i vysokou mortalitou.(6) V ČR se dlouhodobě rodí ročně 10–12 hemofiliků (z toho asi 3 s těžkou formou hemofilie). V letech 2011 až 2016 došlo v ČR k 5 krvácením do CNS u dětí s těžkou formou hemofilie typu A, z toho 3 u novorozenců.(7)
Kolem 50 % hemofiliků nemá rodinnou historii a na porod se nelze připravit. Ženám, známým přenašečkám, je nabídnuta možnost prenatální diagnostiky. Invazivní prenatální diagnostiku (biopsii choriových klků či amniocentézu) odmítá značná část gravidních přenašeček. Neinvazivní možnost zahrnuje vyšetření DNA plodu z krve matky, umožňující stanovení pohlaví. Aktuální doporučení pro porod předpokládaného hemofilika zahrnují vždy komplexní péči včetně účasti dětského hematologa.(8,9) Velmi důležité je zajistit v rámci péče následující: porod má být veden v centru s možností konzilia dětského hematologa a dostupností koncentrátu FVIII, resp. FIX. Může být veden vaginálně, ale ne instrumentálně (kleště, VEX). Vždy by se porodník měl vyhnout fetálnímu invazivnímu monitorování a odběrům z hlavičky. Měla by vždy být zvážena možnost plánované sekce, zejména při očekávaných možných komplikacích, pro nižší riziko ICH. U akutní sekce je riziko ICH stejné jako u vaginálního porodu. Stanovení hladiny FVIII u porozeného chlapce má proběhnout časně postnatálně – hladina FVIII je po porodu stejná jako u dospělého, vhodné je využití pupečníkové krve. Hladiny FIX jsou přirozeně nižší, s věkem stoupají, ale těžký deficit je stanovitelný již u novorozence. U mírných deficitů je diagnóza často stanovena až v pozdějším věku. U novorozených těžkých hemofiliků se doporučuje časné ultrazvukové vyšetření hlavičky do 24 hodin po porodu a dále pak ještě před dimisí, společně s ultrazvukovým vyšetřením dutiny břišní. Pupečník se může odstranit obvyklým způsobem, krvácení je vzácné (asi 6 % hemofiliků). Vitamin K se má podat perorálně, zavedení kanyl preferenčně zkušeným personálem, screening metabolických vad odběrem z patičky je možný s následnou delší kompresí v místě odběru. Před dimisí je zásadní zajištění další specializované péče konzultací hematologa, včetně poučení o nutnosti myslet na krvácení jako příčinu možných obtíží po propuštění. Plánovaná vakcinace je možná dle kalendáře, dle možností subkutánně, ale v řadě center, včetně našeho, je umožněno vakcinovat intramuskulárně co nejtenčí jehlou s následným minimálně 10minutovým ledováním. V zemích, kde je běžnou praxí časná cirkumcize, může být krvácení po výkonu prvním příznakem krvácivé choroby.
Obecně je snahou nepodávat koncentráty FVIII či FIX od časného novorozeneckého věku preventivně z důvodu traumatizace spojené s intravenózní aplikací a vyšším rizikem rozvoje neutralizačních protilátek proti FVIII (inhibitoru), případně FIX. Při krvácení a nutnosti aplikace koncentrátů by neměla být překračována plazmatická hladina FVIII/FIX 100 % a je nutno velmi pečlivě monitorovat přítomnost inhibitoru, protože riziko jeho rozvoje je za těchto situací poměrně vysoké.
Kazuistika 3
Jedná se o novorozence ženského pohlaví ze 4. gravidity (1× mimoděložní těhotenství, 1× UPT pro Turnerův syndrom, 1× UPT). Matka byla léčena pro hypofunkci štítné žlázy, v graviditě byla sledována genetikem. Dítě bylo narozené v termínu, spontánně, záhlavím, 3400 g. Ve 2. době porodní byly přítomné decelerace ozev plodu, při porodu byl zpozorován pupečník obtočený kolem krku. Skóre dle Apgarové bylo 7-9-9. Po porodu byla dívenka monitorována v inkubátoru 1 hodinu, krátkodobě s nutností oxygenoterapie. Pupečníkové pH bylo 7,336. Dítě bylo eutrofické, růžové, dobře prokrvené, svalový tonus byl přiměřený, břicho měkké, bez hmatné rezistence, pupečník podvázán, nekrvácel, bez zjevných vrozených vývojových vad či porodního poranění. Glykemie byla po adaptaci v normě, vitamin K byl podán perorálně.
Ve věku cca 23 hodin byly provedeny odběry pro nápadnou bledost, ublinkávání natrávené krve a příměs čerstvé krve ve stolici. Jinak byla dívenka bez makroskopických známek krvácení, měla pouze stagnační cyanózu v obličeji a petechie na čele. V odběrech byla přítomná těžká anemie (hemoglobin 76 g/l, hematokrit 0,236), počet trombocytů byl v normě, CRP nízké, lehce zvýšené renální a jaterní testy. APTT a INR nebylo vyšetřeno. Pro podezření na krvácení do trávicího traktu byl domluven překlad na vyšší pracoviště, byla kontaktována převozová služba, bohužel se opakovaně nedařilo zavést před převozem periferní žilní vstup a transfuze erymasy nestihla být podána. Cca ve věku 25,5 hodiny došlo při zavedené péči k dalšímu zhoršení stavu se známkami špatného prokrvení, dyspnoe, pro desaturace byla zahájena inhalační oxygenoterapie, později bylo dítě intubováno s ventilací 100% kyslíkem ambuvakem, dítě krvácelo extenzivně ze všech vpichů. Přes kardiopulmonální resuscitaci dítě umírá ve věku 27 hodin. Patologicko-anatomická pitva prokázala makroskopické krvácení do střev, prokrvácení plic, hematom v retroperitoneu kolem pravé ledviny a nadledviny, dále drobné petechie na pleuře a na kůži na čele. Bakteriologické a virologické nálezy byly nepřínosné. Mikroskopicky nebyly patrné známky zánětu ani nádorové infiltrace. V játrech byla poměrně hojná extramedulární hematopoéza. Vzhledem k nejasnému úmrtí novorozence bylo provedeno molekulárně genetické vyšetření DNA metodou next generation sequencing (NGS) ze zamražených vzorků. Bylo zjištěno, že dítě bylo složeným heterozygotem pro těžký deficit faktoru X (FX): missense varianty c.166G>A (p.Glu56Lys, rs756615469, NM_000504.4) v exonu 2 genu F10 maternálního původu a terminační varianty c.837C>A (p.Tyr279Ter, rs1250509122, NM_000504.4) v exonu 7 genu F10 paternálního původu. Obě varianty jsou v populaci velmi vzácné, nevyskytují se v klinických databázích ani nejsou popsány v dostupné literatuře. Obě varianty byly klasifikovány jako class 4 – pravděpodobně patogenní. U obou rodičů byla zjištěna snížená aktivita FX (u matky 44 %, koagulační časy v normě; u otce 49 %, PT-R mírně prodloužené: 1,23). U rodičů není patrná zvýšená krvácivost (ani pooperační či poúrazová). Rodiče nejsou pokrevní příbuzní. Výsledky této analýzy byly důležité pro genetické poradenství, protože u neplánovaného dalšího těhotenství byla nalezena stejná genetická konstelace, což vedlo rodinu k souhlasu s ukončením těhotenství a plánu in vitro fertilizace s preimplantační diagnostikou.
Faktor X je vitamin K dependentní serinová proteáza. Je prvním enzymem ve společné cestě tvorby trombinu. Gen F10 kóduje koagulační FX, který je klíčovou součástí koagulační kaskády. Patogenní varianty v homozygotní formě nebo jako složení heterozygoti způsobují autozomálně recesivní dědičnou deficienci faktoru X, způsobenou nefunkčním proteinem nebo jeho sníženou aktivitou. Deficit v homozygotní konstituci se vyskytuje v populaci s četností 1 na 1 milion dospělých, činí asi 10 % z celkové incidence vzácných krvácivých poruch. Klinické projevy jsou popisovány jako heterogenní, v novorozeneckém věku obvykle závažné, včetně ICH, krvácení z pupku, krvácení do GIT. Heterozygoti jsou většinou asymptomatičtí. Faktor X je syntetizován převážně v játrech, gen je lokalizován na 13. chromozomu. Stanovení hladiny FX je ve specializovaných koagulačních laboratořích běžně dostupné. Terapie nedostatku FX není jednoduchá, protože v řadě zemí nejsou k dispozici koncentráty FX. Léčebně je možno podat čerstvě mraženou plazmu s nedefinovaným obsahem FX, s rizikem transfuzních reakcí a objemového přetížení nebo koncentrát protrombinového komplexu (PCCs), který obsahuje přibližně ekvivalentní množství FIX/FX, dále faktory VI a II. Při opakovaném podávání existuje riziko tromboembolických příhod z důvodu kumulace FII.(10,11)
I v tomto případě se jednalo o perinatální katastrofickou manifestaci nejspíše velmi hlubokého deficitu FX, jenž se na podkladě rodinné anamnézy nedal předvídat. Masivní krvácení do gastrointestinálního traktu může být prvním příznakem tohoto deficitu.
Diskuse
Vrozené krvácivé choroby způsobené deficitem v sekundární hemostáze patří mezi vzácná onemocnění. Podezření na vrozenou krvácivou chorobu může být dáno rodinnou anamnézou. Může se však jednat o kombinaci neonatálního krvácení nejasné etiologie v kombinaci s alterací výsledků screeningových koagulačních testů (PT, aPTT) při negativní rodinné anamnéze. Při pátrání po příčině neonatálního krvácení je vrozená krvácivá porucha jedním z možných vysvětlení, zásadní je vždy celkový stav dítěte a možné jiné komplikace dané aktuálním stavem (obr. 3).
Obr. 3. Krvácející novorozenec 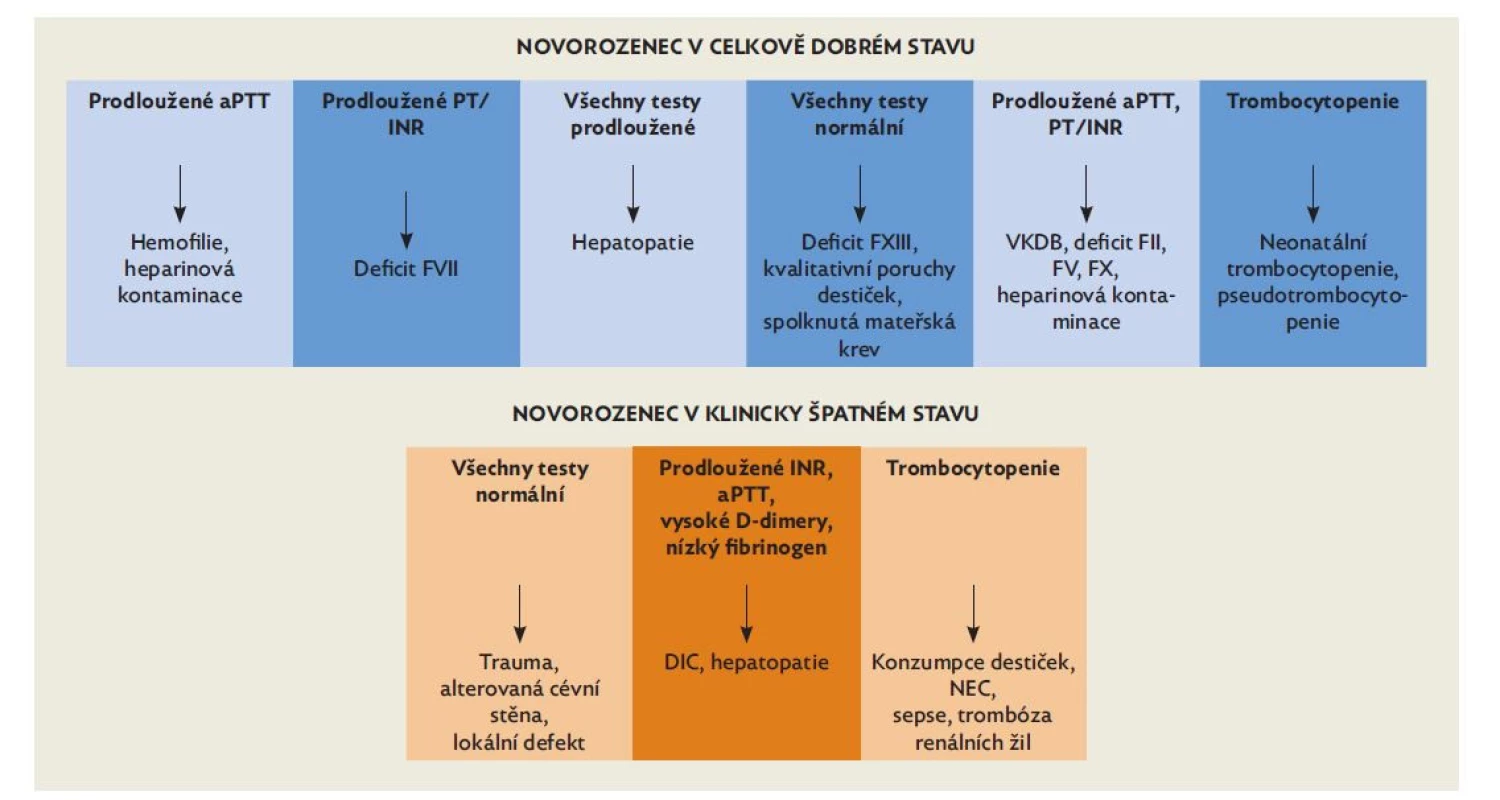
(upraveno dle Blanchette VS, et al. SickKids Handbook of Pediatric Thrombosis and Hemostasis) Von Willebrandova choroba (VWD) je nejčastějším z těchto onemocnění, s odhadovanou incidencí 1 : 1000, nicméně většinou se jedná o mírnější deficity, které se v novorozeneckém věku neprojeví a jejich diagnostika je většinou posunuta ideálně po 6. měsíci života. V případě velmi vzácné těžké formy VWD, typu 3, je přítomna také velmi nízká hladina FVIII, diagnózu lze stanovit časně, fenotyp bývá podobný těžké hemofilii.
Nejčastěji se v neonatálním období projeví hemofilie, typicky iatrogenním krvácením (venepunkce, intramuskulární injekce, invazivní výkon) či ICH. Její diagnostika je postavena buď na známé rodinné anamnéze s matkou přenašečkou, nebo na selektivním stanovení hladiny FVIII či FIX při izolovaně prodlouženém aPTT. Jak již bylo zmíněno, přirozeně je u novorozence hladina FVIII stejná jako u dospělého – deficit je tedy možno stanovit časně. Naopak u FIX se mírnější formy deficitu stanovují a konfirmují až později v raném dětství.
Ostatní deficity koagulačních faktorů s manifestací v neonatálním či velmi raném kojeneckém věku jsou velmi vzácné, častější v zemích s příbuzenskými sňatky. Nicméně v rámci diferenciální diagnostiky krvácivého stavu je nutno je zvažovat, optimálně ve spolupráci s dětským hematologem. Kromě deficitů diskutovaných v kazuistikách je namístě ještě zmínit deficit FXIII, jenž stabilizuje fibrin ve sraženině a jeho chybění se může projevit oddáleným krvácením z pupečníkového pahýlu. Zrádný pro diagnostiku je normální výsledek PT i aPTT a nutnost na tento deficit selektivně myslet a indikovat speciální test. Afibrinogenemie, deficit FVII, FV a FX jsou spojené s prodloužením jak PT, tak i aPTT. Mohou se projevit krvácením do gastrointestinálního traktu, ICH, krvácením z pupečníkového pahýlu či krvácením spojeným s invazemi (včetně např. cirkumcize). Stanovení hladin jednotlivých koagulačních faktorů je možné buď v laboratoři dané nemocnice, pokud ne, pak ve specializovaných koagulačních laboratořích.
Závěr
Závažné vrozené koagulační poruchy jsou vzácné, ale mohou vést k život ohrožujícímu krvácení v neonatálním období s devastujícími následky. Někdy však ani rychlá diagnostika a léčba nezabrání fatálnímu průběhu nebo trvalým následkům. Spolupráce gynekologa a hematologa v přípravě porodu a následně neonatologa s dětským hematologem v péči o dítě v případě očekávané přítomnosti krvácivé poruchy jsou klíčové při interpretaci výsledků a samozřejmě také při zahájení terapie, která je v současné době v našich podmínkách obvykle cílená na deficit konkrétního faktoru, případně na navazující preventivní podávání přípravků, jež mohou deficit částečně zmírňovat.
Korespondenční adresa:
MUDr. Eva Jadvidžáková
Klinika dětské hematologie a onkologie 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
Zdroje
1. Sutor AH, von Kries R, Cornelissen EA, et al. Vitamin K deficiency bleeding (VKDB) in infancy. ISTH Pediatric/Perinatal Subcommittee. International Society on Thrombosis and Haemostasis, Thromb Haemost 1999; 81(3): 456–61.
2. Formoso VR, Mota RB, Soares H. Developmental hemostasis in the neonatal period, World J Pediatr 2022; 18 : 7–15.
3. Keir AK, Stanworth SJ. Neonatal plasma transfusion: an evidence-based review. Transfus Med Rev 2016; 30 : 174–182.
4. Kaczor DA, Depasse F, Sevenet PO. Factor VII deficiency: from basics to clinical laboratory diagnosis and patient management. Clin Appl Thromb Hemost 2017; 23(7): 703–710.
5. Lee CA, et al. Textbook of hemophilia. 2nd ed. 2010 : 110–114.
6. Srivastava A, Santagostino E, Dougall A, et al. WFH Guidelines for the Management of Hemophilia, 3rd ed. Haemophilia 2020 : 26(Suppl 6): 1–158.
7. Zapletal O, Blatný J, Ovesná P, et al. Intrakraniální krvácení u pacientů s hemofilií A. Čes-slov Pediat 2019; 74(4): 233–239.
8. Chalmers E, Williams M, Brennand J, et al. Guideline on the management of haemophilia in the fetus andneonate, BJH 2011; 154 : 208–215.
9. Kletzel M, et al. Postdelivery head bleeding in hemophilic neonates, Arch J Dis Child 1989; 143; 1107–10.
10. Tarantino MD. Occurrence and management of severe bleeding episodes in patients with hereditary factor X deficiency. Haemophilia 2021; 27 : 531–543.
11. Peyvandi F, Auerswald G, Austin SK, et al. Diagnosis, therapeutic advances, and key recommendations for the management of factor X deficiency. Blood Rev 2021; 50
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Co jsme psaliČlánek Pediatrická poezie
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Století profesora Hrodka v dětské hematologii a onkologii
- Nové léčebné postupy v léčbě dětské akutní lymfoblastické leukemie
- Hodgkinův lymfom – minulost a současnost
- Transplantace kmenových buněk krvetvorby u dětí s dědičnými metabolickými poruchami a maligní infantilní osteopetrózou
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Závažné vrozené krvácivé poruchy s manifestací v novorozeneckém období – kazuistiky
- Jaterní infantilní hemangioendoteliom
- Nové možnosti echokardiografie v diagnostice subklinické formy kardiotoxicity jako následku léčby dětských onkologických onemocnění
- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Vrozené poruchy krevního srážení
- Historický rozhovor s legendou prof. MUDr. Otto Hrodek, DrSc. (1922–2022)
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Vrozené poruchy krevního srážení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



