-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hlboká venózna trombóza u dieťaťa s nefrotickým syndrómom
Deep venous thrombosis in a child with nephrotic syndrome – case report
Deep venous thrombosis in a child with nephrotic syndrome – case report
In children with nephrotic syndrome thrombosis is well known and formidable complication with incidence of 2 to 9%. Nephrotic syndrome is associated with acquired hypercoagulation status. Etiology is multifactorial. Thrombogenic milieu is a result of urinary loss (antithrombin III, protein S) and increased synthesis of procoagulation factors (fibrinogen, V and VIII factors). Impaired fibrinolysis, hemoconcentration, patient immobility especially in association with anasarca, infection and central venous catheter are further contributing factors. Deep venous thrombosis can occur at venous or arterial system, most frequently in lower limb deep veins, renal veins, pulmonary circulation. Less frequently, thrombosis is located in other areas of vascular system. Anticoagulation therapy is indicated according to severity of thrombotic complication. Prophylaxis is recommended only in children with high risk for thrombosis.
Authors present a rare case of familiar, primary corticoresistant nephrotic syndrome complicated with extensive deep venous thrombosis in an toddler.Key words:
nephrotic syndrome in children, deep venous thrombosis, anticoagulation therapy
Autoři: Ľ. Kováčiková ml. 1; M. Chocholová 1; M. Ondriska 2; Ľ. Podracká 1
Působiště autorů: 1. detská klinika LFUK a DFNsP, Bratislava prednostka prof. MUDr. Ľ. Podracká, CSc. 1; Rádiologické oddelenie DFNsP, Bratislava vedúci prim. MUDr. D. Haviar 2
Vyšlo v časopise: Čes-slov Pediat 2016; 71 (2): 91-95.
Kategorie: Kazuistika
Souhrn
Trombóza je známa a obávaná komplikácia nefrotického syndrómu u detí s incidenciou 2–9 %. Nefrotický syndróm je asociovaný so získaným hyperkoagulačným stavom. Príčiny sú multifaktoriálne. V dôsledku močových strát (antitrombín III, proteín S) a zvýšenej syntézy prokoagulačných faktorov (fibrinogén, faktory V a VIII) sa vytvára trombogénne milieu. K vzniku trombózy prispieva aj porušená fibrinolýza, hemokoncentrácia, imobilita pacientov najmä pri anasarke, infekcie a prítomnosť centrálneho venózneho katétra. Hlboká trombóza môže postihovať venózny aj artériový systém, najčastejšie je lokalizovaná v hlbokých žilách dolných končatín, renálnych vénach, pľúcnom riečisku, zriedkavejšie sa môže vyskytovať aj v iných oblastiach cievneho systému. Antikoagulačná liečba je indikovaná podľa závažnosti trombotickej komplikácie. Profylaxia sa odporúča len u detí s vysokým rizikom trombózy.
Autori prezentujú vzácnu kazuistiku batoľaťa s familiárnym, primárne kortikorezistentným nefrotickým syndrómom komplikovaným rozsiahlou hlbokou venóznou trombózou.Kľúčové slová:
nefrotický syndróm u detí, hlboká venózna trombóza, antikoagulačná liečbaÚvod
Nefrotický syndróm (NS) je najčastejšia získaná choroba glomerulov v detskom veku. Charakterizovaný je nefrotickou proteinúriou (viac ako 40 mg/m2/h), hypo-albuminémiou, edémami a hyperlipidémiou. Poškodenie glomerulovej bazálnej membrány (GBM) vedie k strate elektrického náboja a/alebo permselektivity glomerulového filtra, čo spôsobuje masívny únik bielkovín najmä albumínu, koagulačných faktorov a imunoglobulínov [l, 2]. Veľká proteinúria má závažné klinické dôsledky ako je retencia sodíka, anasarka, hypovolémia a akútne poškodenie obličiek, zvýšená náchylnosť na infekcie či riziko venóznej alebo artériovej trombózy [3–5].
Tromboembolické príhody sú obávanou komplikáciou NS, zriedkavejšie postihujú deti ako dospelých. Príčiny sú multifaktoriálne. NS per se je asociovaný s hyper-koagulačným stavom, ktorý je podmienený relatívnym nepomerom medzi pro/anti-koagulačnými faktormi (zvýšená syntéza prokoagulačných substancií a močové straty antikoagulačných proteínov). K vzniku trombózy prispieva aj hemokoncentrácia, imobilita pacientov najmä pri anasarke, infekcie a tiež prítomnosť centrálneho venózneho katétra [6, 7].
V kazuistike prezentujeme vzácny prípad batoľaťa s familiárnym nefrotickým syndrómom a trombotickou komplikáciou.
Kazuistika
Dva a pol ročné dievčatko s familiárnym, primárne kortikorezistentným nefrotickým syndrómom bolo prijaté na hospitalizáciu pre febrility a opakované vracanie. Pre základne ochorenie užívala prednizon (aktuálne 1 mg/kg//deň) a cyklofosfamid 2,5 mg/kg/deň.
Staršia 17-ročná sestra má od 2 rokov života NS s histologickým obrazom malých abnormalít glomerulov, ktorý bol primárne citlivý na steroidy, ale v ďalšom priebehu sa často opakovali relapsy. Liečená bola cyklofosfamidom, cyklosporínom A, mykofenolátom mofetilu a tiež rituximabom. Mutácie NPHS2 génu a WT1 génu boli vylúčené. Rodičia a ďalší 2 súrodenci sú zdraví.
Prezentované dievčatko malo pri prijatí febrility, generalizovaný edém s ascitom, krvný tlak pod 90. percentil, diurézu 500 ml za 24 hodín. V laboratórnom obraze dominoval rozvinutý NS s proteinúriou 2,61 g/deň a hypoalbuminémiou 17,3 g/l; v moči bola mikroskopická hematúria, eGFR zodpovedala 54 ml/min/1,73 m2. Z ďalších patologických nálezov sa zistila závažná anémia s hemoglobínom 8 g/l a vysoké CRP 181 mg/l. Zdroj infekcie sa bežnými paraklinickými vyšetreniami nenašiel, hemokultúra bola negatívna, moč sterilný. V hemokoagulačných parametroch bola prítomná hyperfibrinogenémia 10,4 g/l, znížená koncentrácia antitrombínu III na 48,5 % a pozitívne D diméry 18,5 mg/l. Pre potenciálne riziko trombózy sa u pacientky už v úvode hospitalizácie ordinovala profylaxia nízkomolekulovým heparínom v dávke 100 IU//kg/24 hodín. Napriek antikoagulačnej profylaxii sa 6. deň hospitalizácie zvýraznil bolestivý opuch celej pravej dolnej končatiny (obr. 1), koža na stehne bola napätá, miestami až livídne sfarbená, pulzácie boli hmatné, pacientka bola skleslá, febrility pretrvávali napriek kombinácii širokospektrálnych antibiotík. Pre klinické podozrenie trombózy bolo vykonané ultrasonografické vyšetrenie dopplerom, ktoré zobrazilo vo v. femoralis rozsiahly trombus tiahnuci sa až do v. iliaca externa a v. iliaca communis (obr. 2). V liečbe sa zvýšil nízkomolekulový heparín na terapeutickú dávku 200 IU/kg/deň a ponechal kontinuálne po dobu 8 týždňov. Pri pátraní po možnej genetickej príčine trombofílie sa dokázalo, že pacientka je nositeľkou homozygotnej mutácie a1298c metyléntetrahydrofolátreduktázy (MTHFR).
Obr. 1. Opuch dolnej končatiny postihnutej trombózou. Fig. 1. Edema of lower limb affected by thrombosis. 
Obr. 2. Trombus zmiešanej echogenity v oblasti femorálneho bulbu vpravo. Fig. 2. Thrombus with mixed echogenicity in the area of right femoral bulb. 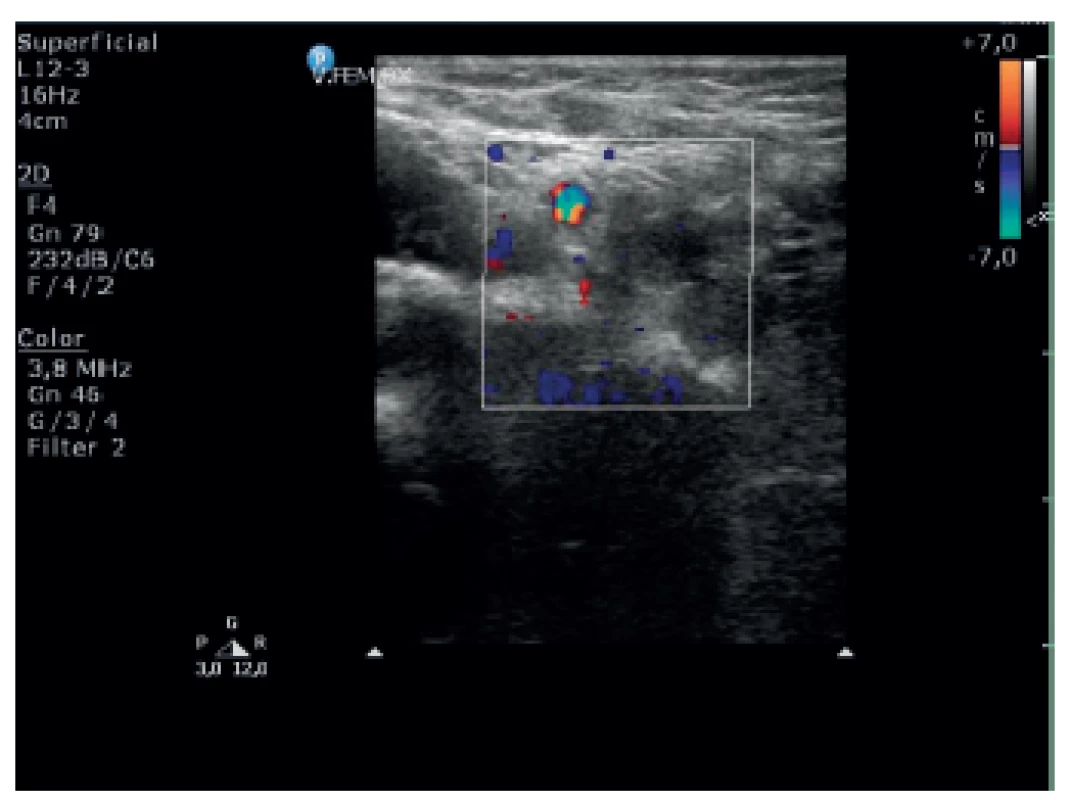
Klinický stav dievčatka sa na komplexnej imunosupresívnej a symptomatickej terapii postupne zlepšoval, opuchy ustúpili, proteinúria sa signifikantne znížila, renálna biopsia potvrdila histologický obraz malých abnormalít glomerulov s negatívnou imunofluoresciou obličkového tkaniva. Kontrolné ultrasonografické vyšetrenie dopplerom, ktoré sa realizovalo s časovým odstupom 2 mesiacov, demonštrovalo pretrvávanie uzáveru v lúmene kraniálnej časti v. iliaca s prítomným krvným tokom cez kolaterály a v. femoralis bez trombózy po rekanalizácii (obr. 3).
Obr. 3. Kontrolné dopplerovské vyšetrenie. Fig. 3. Repeated doppler ultrasound. 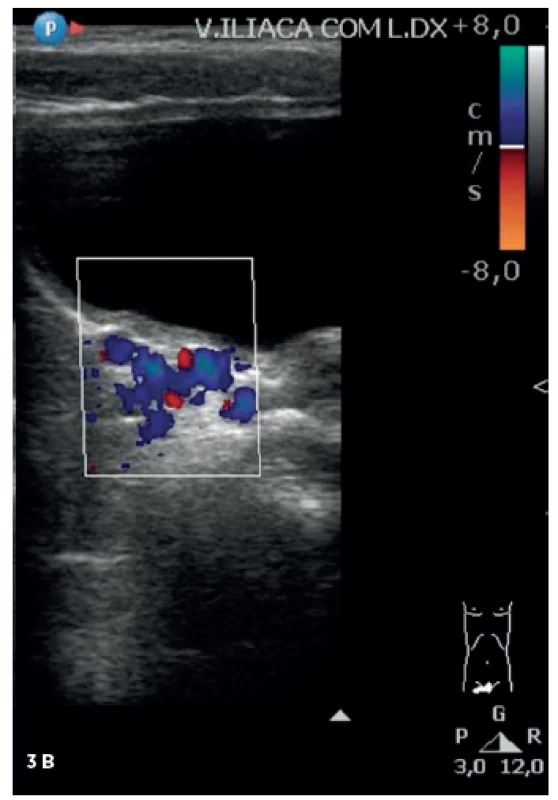
A. Pravá femorálna véna bez trombózy. B. V oblasti pravej iliackej vény prítomný tok cez kolaterály. A. Right femoral vein without thrombosis. B. Collateral circulation in the area of right iliac vein. Diskusia
Trombóza je známa komplikácia NS. Epidemiologické dáta uvádzajú incidenciu u dospelých približne 25 % [1]. U detí sa vyskytuje podstatne zriedkavejšie, incidencia kolíše od 1,8 až do 9,2 % prípadov [8, 9]. Skutočný výskyt tromboembolických komplikácií u detí s NS môže byť vyšší, keďže mnohé prípady prebiehajú asymptomaticky. Ilustruje to séria 16 detí so steroid-dependentným NS s minimálnymi zmenami glomerulov [7]. Ventilačnoperfúznym skenom sa našli defekty svedčiace pre pľúcnu embóliu u 7 detí a normálny nález iba u 9 detí. Ešte priekaznejšie to demonštruje prospektívna štúdia, ktorá CT angiografickým vyšetrením odhalila subklinickú pľúcnu embóliu až u 28 % detí s NS bez respiračných symptómov [8, 9].
Trombembolické príhody sú známou a obávanou komplikáciou NS. Prvykrát ich opísal Howship Dickinson už v 19. storočí a o niekoľko desaťročí neskôr Dereow a spol. poukázali na asociáciu venóznej trombózy so „špecifickou nefrózou“ prejavujúcou sa proteinúriou [10]. V 70-tych rokoch sa z časti objasnila patofyziologická podstata trombofilného resp. hyperkoagulačného stavu, ktorý konštantne sprevádza NS. Vychádzalo sa z nálezov zvýšených koncentrácií fibrinogénu a ostatných koagulačných faktorov, akcelerovanej tvorby tromboplastínu a trombocytózy u 35 pacientov s neliečeným NS [6]. Predpokladalo sa, že trombofilný stav pri NS vzniká v dôsledku strát endogénneho antikoagulačného proteínu – antitrombínu III do moču, ku ktorým dochádza pri poruche priepustnosti GBM. Odvtedy boli postulované viaceré patomechanizmy trombembolizmu pri NS. V princípe ide o 1) močové straty antitrombotických bielkovín, ktoré „chránia“ pred trombózou a 2) zvýšenú syntézu faktorov potencu-júcich trombózu. Relatívny nepomer medzi proteínmi regulujúcimi hemostázu a trombózu prispieva k vzniku trombogénneho milieu (obr. 4).
Obr. 4. Mechanizmy trombofilného stavu pri nefrotickom syndróme. Fig. 4. Mechanisms of the thrombophilic state in the nephrotic syndrome. 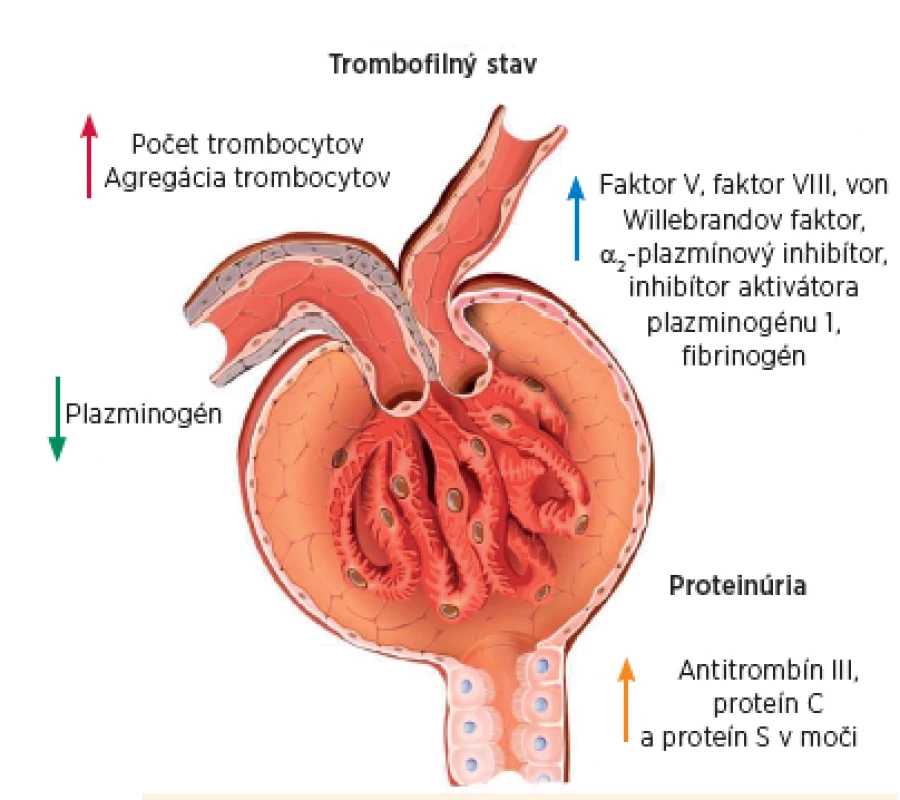
Hypotetické úvahy sa opierajú o klinické pozorovania. Tie preukázali, že 40 až 80 % pacientov má znížené cirkulujúce koncentrácie antitrombínu III, zvyčajne je prítomná aj nižšia aktivita proteínu C a proteínu S. Sprievodným javom sú laboratórne odchýlky v prokoagulačných a fibrinolytických proteínoch. Sekundárnu aktiváciu hemokoagulácie konštantne sprevádzajú zvýšené koncentrácie faktorov V a VIII, von Willebrandovho faktora, hyperfibrinogénémia a vzostup alfa-2 makroglobulínu. Predpokladá sa, že zvýšenie týchto vysokomolekulových substancií odráža nadmernú syntézu akútnej fázy, resp. v prípade hyperfibrinogenémie hepatálnu syntetickú odpoveď na hypoalbuminémiu. Zvýšený fibrinogén uľahčuje agregáciu trombocytov, stúpa viskozita krvi a agregácia erytrocytov. Na druhej strane je znížená aktivita fibrinolytického systému a porucha tvorby plazminogénu. K tromboembolizmu prispieva aj hemokoncentrácia v dôsledku intravaskulárnej objemovej deplécie alebo diuretickej liečby, imobilita, a to najmä u detí s anasarkou, infekcia a prítomnosť centrálneho venózneho katétra [11].
U detí s NS bývajú najčastejšie postihnuté hlboké žily dolných končatín, renálne vény, pľúcne artériové riečisko, dolná dutá žila a femorálna alebo iliacká artéria [12]. Zriedkavejšie sú opísané trombózy cerebrálnych a meningeálnych artérií, mezenterických či hepatálnych vén. Treba pamätať, že pľúcna embólia môže prebiehať asymptomaticky, preto ak sa na ňu nemyslí, môže ostať nepoznaná a diagnóze uniknúť [13]. Na druhej strane masívna pľúcna embólia môže byť prvým príznakom NS [14]. Trombóza renálnej vény je v detskej populácii vzácna, avšak u detí, najmä u dojčiat s kongenitálnym NS, je riziko jej výskytu signifikantne vyššie. Klinicky sa akútny kompletný uzáver renálnej vény prejaví makroskopickou hematúriou, bolesťou v oblasti obličiek a pri bilaterálnom postihnutí akútnym renálnym zlyhaním. Na dopplerovskej ultrasonografii sa zobrazí zväčšená oblička a chýbajúci prietok v renálnej véne. Naša pacientka mala mikroskopickú hematúriu, ale ostatné známky trombózy renálnej vény neboli prítomné. Korešpondujúc s bolestivým progredujúcim opuchom jednej dolnej končatiny sme sonograficky potvrdili hlbokú trombózu femorálnej vény zasahujúcu až do iliackej vény. Pri generalizovanom edéme sa však iniciálny prejav trombózy nemusí včas rozpoznať.
Trombóza vzniká zvyčajne na začiatku ochorenia a počas relapsov zrejme v dôsledku masívnej proteinúrie a akútnej intravaskulárnej deplécie. Častejšie sú ohrození pacienti s kortikorezistentným NS [9]. Podporuje to aj naša kazuistika dievčatka s torpídnym NS. Remisiu proteinúrie sa nepodarilo dosiahnuť napriek 5-mesačnej liečbe prednizonom, v čase vzniku trombózy mala generalizovanú anasarku s klinickými známkami intravaskulárnej hypovolémie a prechodným akútnym poškodením obličiek.
Ako môžu jednotlivé laboratórne abnormality predikovať rozvoj trombózy, nie je presne známe. Citak a kol. [15] uvádzajú, že nízky antitrombín III a albumín ako aj vysoké sérové koncentrácie fibrinogénu a cholesterolu môžu byť čiastočne zodpovedné za vyšší výskyt hlbokej žilovej trombózy u detí s NS. Tieto pozorovania sa prekvapivo nepotvrdili v brazílskej pediatrickej štúdii [8]. Autori retrospektívne analyzovali veľkú kohortu 200 detí s idiopatickým NS s cieľom determinovať rizikové faktory trombózy. Hlbokú venóznu trombózu prekonalo 9 pacientov. Koreláciou klinických a laboratórnych parametrov zistili, že deti s trombózou mali prebiehajúcu infekciu a signifikantne vyššie hodnoty hematokritu a triacylglycerolov v porovnaní so skupinou chorých bez trombotickej príhody [8]. Sprievodná infekcia je častou komplikáciou nefrotického syndrómu. Náchylnosť k infekciám podporujú nízke sérové koncentrácie imunoglobulínov, poruchy opsonizácie, porucha tvorby špecifických imunoglobulínov a imunosupresívna liečba [16]. Významnú súvislosť medzi infekciou a výskytom hlbokej žilnej trombózy potvrdili viacerí autori [8, 17]. Rovnako aj naša pacientka mala v čase vzniku trombózy febrilnú infekciu. Je zaujímavé, že systémová infekcia je dokonca silnejším prediktorom trombózy než vrodená trombofília. Svedčia o tom závery pilotnej asociačnej štúdie, ktorá skúmala výskyt variačných alel a polymorfizmov „trombofilných“ génov [18]. V súbore 53 detí s NS autori vyšetrili DNA analýzou mutácie faktora V Leiden Arg506→Gln, protrombínového génu 20210G→A a homozygotnú mutáciu Ala677→Val génu pre metylénetetrahydrofolát reduktázu (MTHFR). U žiadneho zo 6 detí s prekonanou trombembolickou príhodou neidentifikovali trombofilný genotyp. V protiklade k tomu, u 7 detí bez trombózy sa dokázala kauzálna mutácia (2 heterozygoti pre protrombínový variant a 5 homozygoti pre MTHFR-T). Je pozoruhodné, že aj v tejto kohorte mala polovica detí s trombózou prejavy infekcie.
Naša pacientka mala v čase hlbokej trombózy nízke koncentrácie antitrombínu III, vysoký fibrinogén, závažnú hypoalbuminémiu, veľkú proteinúriu a akútne prebiehajúcu infekciu. Ťažko určiť, či vznik trombózy mohla potencovať aj homozygotná mutácia pre MTHFR-T. Na druhej strane, je možné, že genetické riziko vysvetľuje pretrvávanie trombu v iliackej véne aj po ústupe proteinúrie a adekvátnej liečbe heparínom.
Terapia trombózy zahŕňa antikoagulanciá (infúziu konvenčného alebo nízkomolekulového heparínu), prípadne aj fibrinolytiká (aktivátor tkanivového plazminogénu). Fibrinolýza sa používa len pri klinicky závažnej trombóze, pričom je vždy potrebné zvážiť potenciálny prínos a riziká. Úpravu koncentrácií antitrombínu III možno dosiahnuť podaním koncentrátu alebo čerstvo zmrazenej plazmy, štandardne sa však neodporúča. Chirurgické odstránenie trombu sa môže zvážiť pri postihnutí periférnej artérie.
Názory na dĺžku antikoagulačnej liečby nie sú jednotné, preto sa odporúča postupovať individuálne. Niektorí podávajú antikoagulanciá 6 mesiacov, iní ukončujú liečbu po ústupe proteinúrie, keďže sa považuje za kauzálnu príčinu získaného hyperkoagulačného stavu. U našej pacientky liečba nízkomolekulovým heparínom po dobu 2 mesiacov viedla k ústupu trombózy vo femorálnej véne s potrombotickým uzáverom kraniálnej časti iliackej vény vpravo s prítomným kolaterálnym tokom. Môžeme špekulovať, či k inkompletnej rezolúcii trombu prispieva nosičstvo homozygotnej alely MTHFR.
Vzhľadom k tomu, že neexistujú spoľahlivé prediktory rozvoja trombózy u detí s NS, profylaktická antikoagulačná liečba ostáva stále kontroverzná a štandardne sa nepodáva. Antikoagulácia je spojená s rizikom krvácania a okrem toho v štúdii s malým počtom pacientov s renálnou venóznou trombózou nezabránila ďalším rekurenciám [19]. Potvrdzujú to aj naše skúsenosti. Napriek profylaxii sa u našej pacientky rozvinula hlboká venózna trombóza. Vo všeobecnosti sa volí individuálny prístup. Profylaxiu sa odporúča zvážiť, len ak má dieťa vysoké riziko trombózy, za čo sa považuje sérový albumín menej ako 20 g/L, fibrinogén viac ako 6 g/L a/alebo antitrombín III menej ako 70 % a prekonanie tromboembolickej komplikácie v minulosti [20].
Záver
Zriedkavým kazuistickým prípadom batoľaťa s hlbokou trombózou chceme poukázať na závažnú sprievodnú komplikáciu NS. Trombembolická príhoda ohrozuje najmä deti s torpídnym NS, výraznými abnorma-litami hemostázy a prebiehajúcou systémovou infek-ciou. Treba pamätať, že hlboká trombóza môže prebiehať aj asymptomaticky, preto ak sa na ňu nemyslí, môže ostať nepoznaná a diagnóze uniknúť. V terapii je potrebná dlhodobá antikoagulačná liečba. Profylaxia sa štandardne neodporúča, indikovaná je len u rizikových pacientov.
Došlo: 21. 1. 2016
Přijato: 28. 1. 2016
Prof. MUDr. Ľudmila Podracká, CSc.
1. detská klinika LFUK a DFNsP
Limbova 1
833 40 Bratislava
Slovenská republika
e-mail: ludmila.podracka@dfnsp.sk
Zdroje
1. Kerlin BA, Ayoob R, Smoyer W. Epidemiology and pathophysiology of nephrotic syndrome-associated thrombembolic disease. Clin J Am Soc Nephrol 2012; 7 : 513–520.
2. Geier P, Feber J. Léčba steroid-senzitivního nefrotického syndromu u dětí. Pediatr praxi 2010; 11 : 245–247.
3. Niaudet P. Complication of nephrotic syndrome in children. UpToDate, 2015.
4. Dickinson WH. On Renal and Urinary Afections. New York: William Wood &Company, 1885 : 32.
5. Vondrák V, Skálová S, Šulíková T, et al. Nefrotický syndrom. In: Janda J, Seeman T. Dětská nefrologie. Praha: Mladá fronta – Medical Services, 2015 : 294–307.
6. Kendall AG, Lohman RC, Dossetor JB. Nephrotic syndrome: a hypercoagulable state. Arch Intern Meed 1971; 127 : 1021–1027.
7. Hoyer PF, Gonda S, Bartheis M, et al. Thrombembolic complications in children with nephrotic syndrome. Risk and incidence. Acta Paediatr Scand 1986; 75 : 804.
8. Candelaria GTP, Belangero VMS. Predisposing factors for deep venous thrombosis in children and adolescents with nephrotic syndrome. ISRN Vascular Medicine 2011; Article ID 827483 : 1–5.
9. Kerlin BA, Blatt NB, Fuh B, et al. Epidemiology and risk factors for thromboembolic complications of childhood nephrotic syndrome: a Midwest Pediatric Nephrology Consortium (MWPNC) study. J Pediatr 2009; 155 : 105–110.
10. Derrow HA, Schlesinger MJ, Savitz HA. Chronic progressive occlusion of the inferior vena cava and the renal and portal veins. Arch Intern Med 1939; 63 : 626–647.
11. Loscalzo J. Venous thrombosis in the nephrotic syndrome. N Engl J Med 2013; 368 : 956–958.
12. Torres RA, Torres BR, de Castilho AS, et al. Venous sinus thrombosis in a child with nephrotic syndrome: a case report and literature review. Rev Bras Ter Intensiva 2014; 26 : 430–434.
13. Suri D, Ahluwalia J, Saxena AK, et al. Tromboembolic complications in childhood nephrotic syndrome: a clinical profile. Clin Exp Nephrol 2014; 18 : 803–813.
14. Fencl F, Stará V, Bláhová K, et al. Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky. Čes-slov Pediat 2013; 68 : 43–48.
15. Citak A, Emre S, Sâirin A, et al. Hemostatic problems and thromboembolic complications in nephrotic children. Pediatr Nephrol 2000; 14 : 138–142.
16. Vaisbich MH. Síndrome Nefrótica. 1st ed. Barueri, Brazil: Manole, 2009 : 573–589.
17. Lilova MI, Velkovski IG, Topalov IB. Thromboembolic complications in children with nephrotic syndrome in Bulgaria (1974–1996). Pediatr Nephrol 2000; 15 : 74–78.
18. Fabri D, Belangero VM, Annichino-Bizzacchi JM, et al. Inherited risk factors for thrombophilia in children with nephrotic syndrome. Eur J Pediatr 1998; 157 : 939–942.
19. Tinaztepe K, Buyan N, Tinaztepe B, et al. The association of nephrotic syndrome and renal vein thrombosis: a clinicopathological analysis of eight pediatric patients. Turk J Pediatr 1989; 31 : 1–18.
20. Glassock RJ. Prophylactic anticoagulation in nephrotic syndrome: a clinical conundrum. J Am Soc Nephrol 2007; 18 : 2221–2225.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Záhadná erupce na břiše
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2016 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Diagnostika primární ciliární dyskineze
- Psychosociální aspekty nespecifických střevních zánětů u dětí
- Průdušková obstrukce v časném dětském věku
- Recidivující respirační infekce
- Aktuálne poznatky o diabetes mellitus. Správa z edukačného Salzburského seminára 2015
-
Odešel významný pediatr, profesor MUDr. Jan Vavřinec, DrSc.
(23. 6. 1947 – 29. 2. 2016) - Školy při nemocnicích a dalších zdravotnických zařízeních
- Význam stanovovania nazálneho oxidu dusnatého u detí – prvé skúsenosti
- Primární bifázický synoviální sarkom jazyka u kojence: Kazuistika vzácného onemocnění s přehledem literatury
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
- Hlboká venózna trombóza u dieťaťa s nefrotickým syndrómom
- Záhadná erupce na břiše
- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Recidivující respirační infekce
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




