-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Poruchy kalciofosfátového metabolismu
Autoři: J. Lebl; Z. Šumník; M. Šnajderová; S. Koloušková
Působiště autorů: Pediatrická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (4): 268-275.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
Nakladatelství Galén připravuje k vydání novou učebnici „Klinická pediatrie“, která bude určena jak pro pregraduální studium na lékařských fakultách, tak i v rámci postgraduálního vzdělávání pro přípravu na atestaci z dětského lékařství a z praktického dětského lékařství. Autoři věří, že učebnici ocení i dětští lékaři v praxi. Ve spolupráci nakladatelství Galén a redakce Česko-slovenské pediatrie na stránkách našeho časopisu postupně uveřejňujeme jednotlivé stati z nové učebnice – a jako bonus také některé kapitoly, které se do nové učebnice už „nevešly“, protože učebnice má přesně stanovený rozsah.
1. REGULACE KALCEMIE
Kalcemie zajišťuje přiměřenou dostupnost kalcia pro svalové buňky, pro funkci myokardu a má tedy vitální důležitost. Patří proto mezi přísně regulované parametry vnitřního prostředí. Z celkového tělesného kalcia je 99 % uloženo v mineralizované kostní hmotě, zbylé 1 % je ve formě kalciových iontů součástí vnitřního prostředí organismu.
Hlavními regulátory kalcemie jsou vitamin D a parathormon. Oscilace kalcemie zmírňuje kalcitonin, jehož účinky jsou slabší. Schéma regulace kalcemie zobrazuje obrázek 1.
Obr. 1. Základní schéma regulace kalcemie. Hlavními cílovými orgány pro hospodaření s kalciem jsou střevo, ledviny a kost. Kost je zásobárnou tělesného kalcia. Vitamin D a parathormon působí v ledvinách synergisticky – posilují reabsorpci kalcia. Parathormon navíc stimuluje exkreci fosforu. Dalším důležitým orgánem v regulaci Ca/P metabolismu je střevo. Vitamin D stimuluje aktivní transport obou těchto iontů přes střevní stěnu, parathormon působí na střevo sekundárně stimulací produkce kalcitriolu. V kosti působí parathormon a vitamin D částečně proti sobě. Hlavním cílem působení vitaminu D je zajistit pro organismus maximální zásoby kalcia a uložit je do kostí, účastní se tedy novotvorby kosti. Cílem působení parathormonu je udržet kalcemii v normálním rozmezí a tím zprostředkovat dostupnost kalcia pro všechny tkáně. V kosti tedy stimuluje kostní resorpci. Kalcitonin má účinky slabé, má hypokalcemizující účinek a vyrovnává oscilace kalcemie. 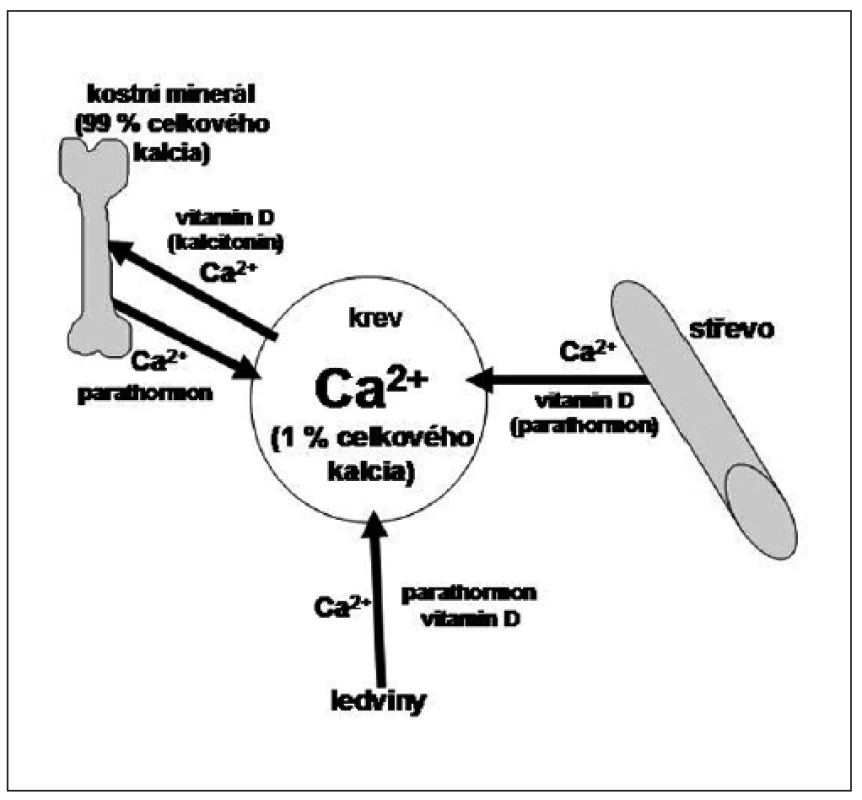
1.1. Vitamin D
Exogenním zdrojem vitaminu D je mléko a mléčné výrobky, drůbež a ryby. Potřebu vitaminu D uvádí tabulka 1. Biologicky aktivní je metabolit kalcitriol (1,25-dihydroxycholekalciferol). Endogenním zdrojem vitaminu D je 7,8-dehydrocholesterol, z něhož v kůži vlivem UV záření vzniká cholekalciferol.
Tab. 1. Denní potřeba vitaminu D. 
Cholekalciferol se hydroxyluje v játrech na 25-hydroxycholekalciferol a následně v ledvinách na nejúčinnější metabolit 1,25-dihydroxycholekalciferol. U pacientů, kteří mají těžkou hepatopatii nebo nefropatii, musíme proto substituovat vitamin D v aktivní formě, tedy kalcitriolem. Pro potřeby rychle rostoucího skeletu kojence je koncentrace vitaminu D v mateřském mléce nedostatečná. Proto je nutné u kojenců vitamin D suplementovat. Používáme nejčastěji cholekalciferol (Vigantol®) v dávce 600 IU (1 kapka) do věku 18 měsíců u dětí narozených na podzim a v zimě a do 1 roku u dětí narozených na jaře a v létě. Názory na substituci vitaminem D v ostatních věkových kategoriích jsou nejednoznačné.
1.2. Parathormon
Parathormon se vytváří v příštítných tělíscích. Jeho syntéza a sekrece je řízena jednoduchou zpětnou vazbou, která je zprostředkována kalcium-senzing receptorem v buněčné membráně buněk příštítných tělísek. Kalcium-senzing receptor patří do skupiny receptorů spojených s G-proteinem. Aktivní metabolity vitaminu D zvyšují jeho expresi. Vazba kalciových iontů na receptor vede bezprostředně ke snížení sekrece parathormonu. V delším časovém horizontu snižuje proliferaci buněk příštítných tělísek. Nedostatečná vazba na receptor naopak sekreci parathormonu posiluje a v dlouhodobějším průběhu vede k hyperplazii tělísek. Vztah mezi kalcemií a sekrecí parathormonu znázorňuje obrázek 2.
Obr. 2. Vztah mezi kalcemií (koncentrací ionizovaného kalcia v krvi v mmol/l) a sekrecí parathormonu buňkami příštítných tělísek (v % maximální hladiny parathormonu v krvi) (podle Barbory Obermannové). 
1.3. Kalcitonin
Kalcitonin se produkuje v C-buňkách (parafolikulárních buňkách) štítné žlázy. Jeho sekrece stoupá při stoupající kalcemii a naopak. Do jisté míry podporuje ukládání vápníku do kostí – v tomto smyslu je synergistou vitaminu D. Jeho účast v metabolismu kalcia je však okrajová.
2. RACHITIS
Rachitis (křivice) je porucha mineralizace kostí, která je způsobena nedostatkem nebo poruchou metabolismu vitaminu D nebo kalcia.
2.1. Rachitis z nedostatku vitaminu D (vitamin D deficitní rachitis)
Vitamin D deficitní rachitis vzniká u dětí vlivem nedostatku vitaminu D a/nebo kalcia. Ekvivalentem této nemoci v dospělosti je osteomalacie. Tento typ rachitidy byl velmi častý před zahájením celoplošné suplementace vitaminem D u kojenců a batolat, která probíhá ve vyspělých zemích od první poloviny 20. století – nejprve rybím tukem, později vitaminem D v kapkách. V současné době se rachitis z nedostatku vitaminu D může u nás vyskytnout pouze u dětí, kterým rodiče nepodávají vitamin D nebo které mají přísnou vegetariánskou (veganskou) stravu. Potřeba vitaminu D je vyšší při malabsorpčních syndromech, zejména spojených s poruchou vstřebávání tuků, protože vitamin D patří mezi liposolubilní vitaminy. Jeho vstřebávání tedy vázne při cystické fibróze, jiných poruchách zevní sekrece pankreatu, poruchách sekreci žluči, ale také při neléčené celiakii.
Při deficitu vitaminu D klesá resorpce vápníku. V první fázi to vede ke snížené nabídce kalcia pro skelet. Dochází k poruše enchondrální a periostální osifikace. Kostní matrix zůstává neosifikována, což se projeví typickými klinickými příznaky (tab. 2).
Tab. 2. Klinické projevy rachitidy na skeletu. 
Při pokračujícím deficitu vitaminu D dále klesá střevní resorpce vápníku, rozvíjí se sekundární hyperparatyreóza s cílem udržet kalcemii v normálním rozmezí, zastavuje se růst, dochází k deformacím kostí a mohou se objevit patologické fraktury. V nejtěžší fázi rachitidy klesá kalcemie, objevuje se spazmofilie, tetanie, laryngospazmus a hypokalcemické křeče. Vitamin D ovlivňuje některé funkce imunitního systému. Proto děti s rachitidou mají časté a vážněji probíhající respirační infekty. Při deformitách hrudníku se zvyšuje riziko pneumonie s plicními atelektázami.
Laboratorní známky rachitidy shrnuje tabulka 3. Na rentgenu distálního předloktí a zápěstí (případně na jiných rentgenových snímcích skeletu) nacházíme projasnění a nepravidelné ohraničení metafýz, pohárkovité deformity metafýz, rozšíření epifýz a subperiostální projasnění nebo ztluštění v oblasti diafýz (Looserovy přestavbové zóny).
Tab. 3. Biochemické nálezy při rachitidě. 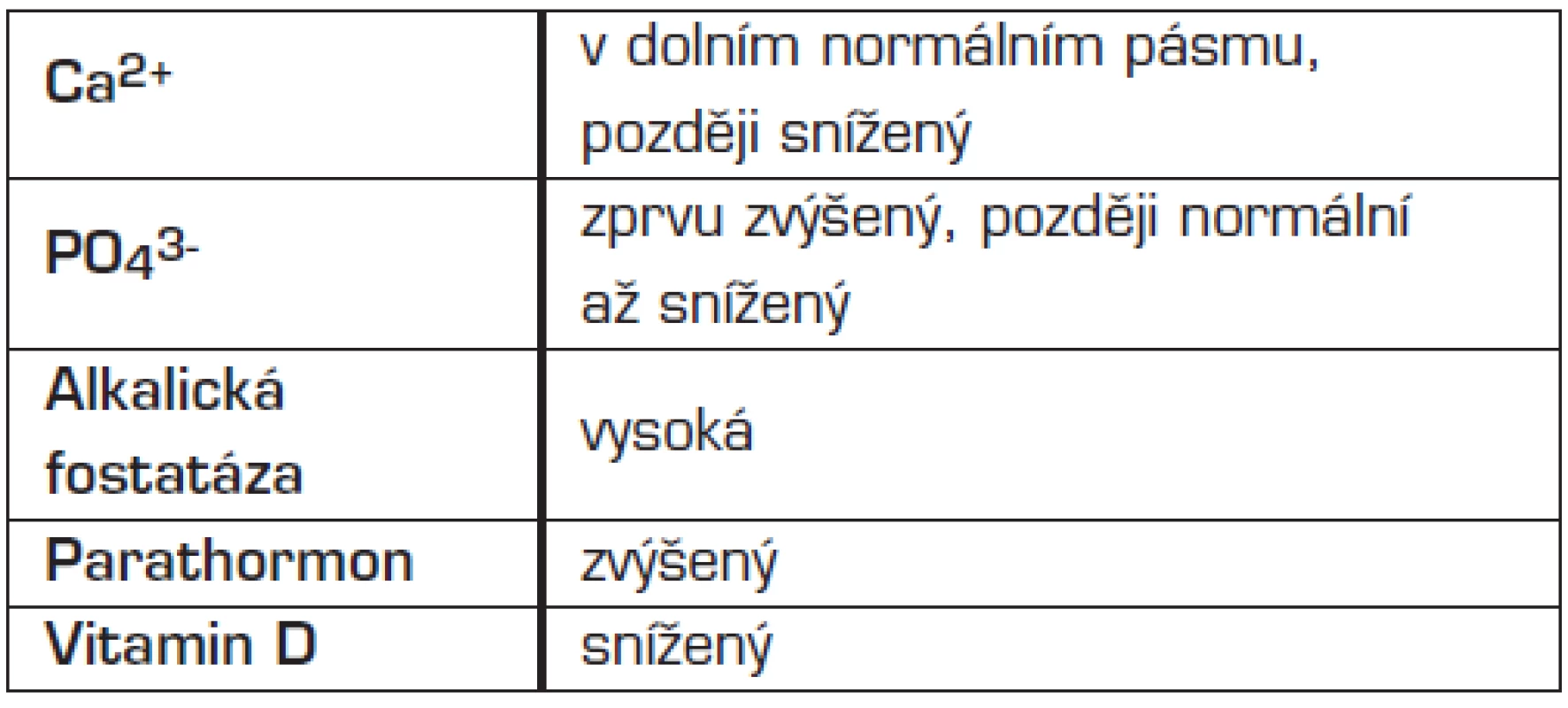
Rachitidu léčíme vitaminem D v dávce 5000 IU/den po dobu 3 týdnů. Současně je zcela nezbytné suplementovat vápník v dostatečném množství. Při manifestní tetanii je první pomocí velmi pomalá i.v. injekce 10% Calcium gluconicum.
2.2. Vitamin D dependentní rachitida typ I
Vitamin D dependentní rachitida typ I je autozomálně recesivně dědičný defekt renální 25-OH-D alfa-hydroxylázy. Je blokována syntéza kalcitriolu, nejúčinnějšího metabolitu vitaminu D.
Klinické symptomy rachitidy (viz tab. 2) vznikají u postižených dětí zpravidla ve druhém trimenonu života, a to navzdory pravidelnému podávání vitaminu D. Léčebně se podává celoživotně kalcitriol (Rocaltrol®).
2.3. Vitamin D dependentní rachitida typ II
Vitamin D dependentní rachitida typ II je autozomálně recesivní rezistence cílových tkání (střeva a skeletu) na kalcitriol. Je způsobená defektem receptoru. Hladiny všech forem vitaminu D v séru jsou vysoké.
I tato forma rachitidy se projevuje podobným souborem příznaků (viz tab. 2), je ale obtížně léčitelná, a proto u postižených dětí vede k růstové retardaci. Léčebně se podávají velmi vysoké dávky cholekalciferolu nebo kalcitriolu s cílem překonat rezistenci cílových tkání, což se zpravidla daří jen částečně.
2.4. Familiární hypofosfatemická rachitida („fosfátový diabetes“)
Familiární hypofosfatemická rachitida je X-vázaná geneticky podmíněná porucha zpětné resorpce fosfátů v proximálních tubulech ledvin s vysokou ztrátou fosfátů do moči (proto „fosfátový diabetes“). Klinické projevy se objeví až po začátku chůze, tedy ve 2. roce života. Dochází k deformacím dolních končetin (coxa vara, genua valga) a k růstové retardaci. Jiné příznaky rachitidy chybějí.
Laboratorně jsou hladiny fosfátu v séru nízké a jejich odpad v moči vysoký. Kalcemie je normální a hladina alkalické fosfatázy vysoká. Hladina parathormonu nestoupá. Základem léčby je substituce fosfátů, nedílnou součástí léčby je kalcitriol.
3. HYPOKALCEMIE
Hypokalcemií rozumíme hladinu celkového kalcia v séru pod 2,0 mmol/l. Hypokalcemie je varovným příznakem, který signalizuje, že fyziologická regulace kalcemie selhává a že organismus může být ohrožen. Příčiny a diferenciální diagnostiku hypokalcemie u dětí shrnuje tabulka 4.
Tab. 4. Diferenciální diagnostika hypokalcemie u dětí. 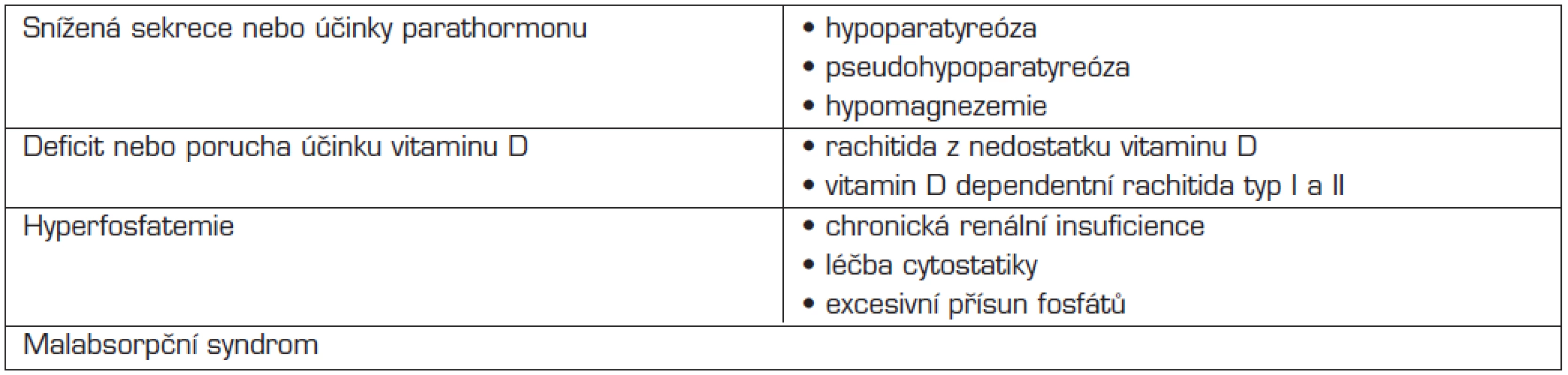
Mezi akutní příznaky hypokalcemie patří apnoe u novorozence, tetanie, záchvaty křečí, svalové spazmy, laryngospazmus, dysartrie ze spazmu maseterů a dalších orálních svalů. Na EKG se prodlužuje interval QT. U starších dětí se příznaky mohou podobat dospělým, u kterých jsou typickým projevem hypokalcemie karpopedální spazmy (včetně příznaku porodnické ruky). Zejména u menších dětí se projevy tetanie mohou podobat epilepsii. Tetanie může být generalizovaná a může být provázena pádem. EEG záznam může připomínat epilepsii, protože hypokalcemie vede i ke zvýšené dráždivosti mozkových buněk.
Latentní tetanii rozpoznáme Chvostkovým příznakem (poklep na tvář před čelistní kloub v místě n. facialis vede k záškubu v obličeji) a Trousseauovým příznakem (nafouknutá manžeta tonometru na paži vyvolá během několika minut příznak porodnické ruky).
Při chronickém průběhu hypokalcemie se projeví poruchy růstu vlasů a nehtů. Při hypoparatyreóze a pseudohypoparatyreóze patří mezi typické příznaky ukládání kalcia do měkkých tkání. Rozvíjí se katarakta, kalcifikace bazálních ganglií, nefrokalcinóza a kalcifikace podkoží, zejména v místech hematomů a drobných traumat.
3.1. Hypoparatyreóza
Hypoparatyreóza u dětí může být důsledkem (1) vrozeného defektu vývoje příštítných tělísek (DiGeorgeův syndrom), (2) aktivační poruchy kalcium-senzing receptoru, (3) autoimunitní destrukce příštítných tělísek (zpravidla v rámci autoimunitního polyglandulárního syndromu 1. typu) nebo (4) iatrogenní léze příštítných tělísek při operačním výkonu na štítné žláze. Pooperační hypoparatyreóza je častěji přechodná (vlivem pooperačního edému příštítných tělísek), ojediněle může být trvalá.
3.1.1. DiGeorgeův syndrom
DiGeorgeův syndrom je geneticky podmíněná vývojová porucha způsobená delecí části dlouhého raménka chromozomu 22. Zahrnuje hypoparatyreózu, hypoplazii či aplazii thymu s imunitním defektem a vrozenou srdeční vadu. Někteří pacienti mohou mít dysmorfické rysy obličeje a mírnou mentální retaredaci. Jednotlivé příznaky jsou rozdílně vyjádřeny.
3.1.2. Aktivační mutace kalcium-senzing receptoru
Aktivační mutace kalcium-senzing receptoru vedou k posunutí set-pointu buněk příštítných tělísek do nižších hodnot kalcemie (srov. obr. 2), což vede ke snížené produkci parathormonu a k hypokalcemii. Klesá i reabsorpce kalcia z moči, což vede k hyperkalciurii.
Klinický projevem je autozomálně dominantní hypokalcemie s hyperkalciurií. Podle závažnosti mutace se projevuje různou tíží příznaků, od těžkých symptomatických hypokalcemií v novorozeneckém období až po náhodný nález asymptomatické hypokalcemie v dospělém věku. Klinicky se hypokalcemie může projevovat křečemi, parestéziemi, laryngospazmy, výjimečně může onemocnění vést k mentální retardaci, kalcifikacím bazálních ganglií a nefrolitiáze až s následkem renálního selhání. Laboratorně je příznačná hypokalcemie, hyperfosfatemie, hladina parathormonu bývá nepřiměřeně normální nebo lehce snížená.
3.1.3. Autoimunitní polyglandulární syndrom 1. typu
Autoimunitní polyglandulární syndrom 1. typu (APS-1), zvaný také APECED (autoimunitní polyendokrinopatie, kandidóza, ektodermální dystrofie), zahrnuje autoimunitní destrukci endokrinních žláz zprostředkovanou T lymfocyty, ektodermální dystrofii s chronickou kandidózou (obr. 3a, b) a postižení dalších neendokrinních orgánů.
Obr. 3a, b. Ektodermální dystrofie u 18leté dívky s APS-1. Zejména na 2. a 3. prstech obou rukou je nápadná onychodystrofie komplikovaná onychomykózou. Mezi projevy ektodermální dystrofie patří také porucha vývoje některých zubů. 
Příčinou APS-1 je defekt genu AIRE (AutoImmune REgulator), jehož produkt je transkripčním faktorem, který se zřejmě podílí na eliminaci potenciálně autoagresivních klonů T lymfocytů v časné fázi vývoje imunitního systému. Onemocnění se dědí autozomálně recesivně.
Jako první příznak APS-1 se nejčastěji objeví v prvních letech života chronická mukokutánní kandidóza, následovaná hypoparatyreózou v důsledku autoimunitní destrukce příštítných tělísek (obr. 4). V dalších letech postupně selhávají další endokrinní žlázy. Nejzávažnější je Addisonova nemoc, která v předškolním nebo školním věku postihne většinu pacientů a může být fatální, pokud není včas správně rozpoznána a léčena. Některé z dalších komponent APS-1 shrnuje tabulka 5.
Obr. 3. Věk při manifestaci tří základních a dvou z vedlejších komponent APS-1 ve skupině 22 pacientů ze střední a východní Evropy. Kumulativní incidence vyjadřuje, u kolika u nich se v daném věku příznak již projevil. Graf ukazuje, že mukokutánní kandidóza a hypoparatyreóza se u některých dětí projeví již v prvních letech života, zatímco Addisonova nemoc vzniká zpravidla až po 5 letech věku. Do prahu dospělosti postihly tři základní komponenty již téměř všechny pacienty s APS-1 (podle Daniely Čihákové). 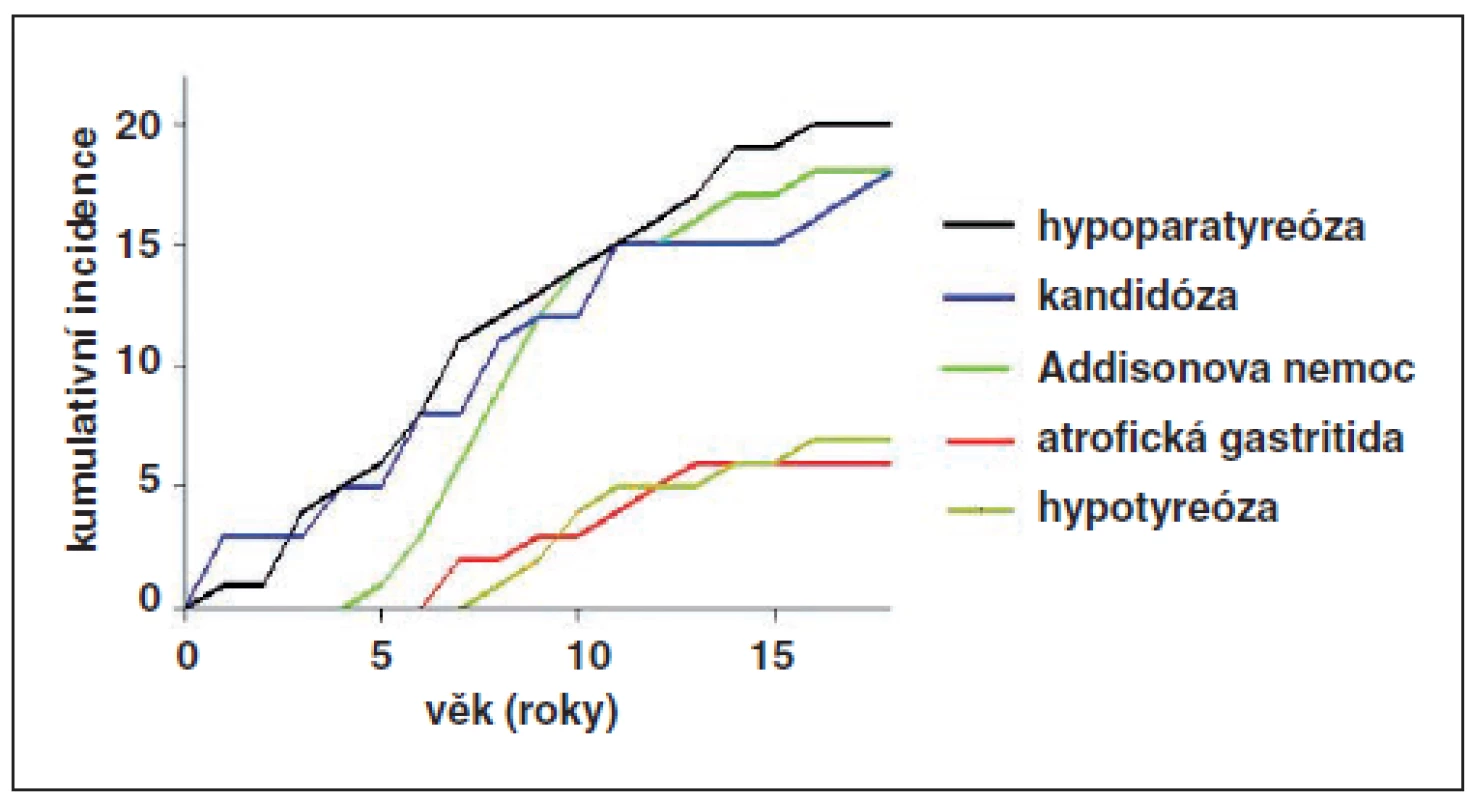
Tab. 5. Prevalence častějších komponent APS-1 (APECED) podle výsledků pěti observačních studií. Pro klinickou diagnózu je určující přítomnost alespoň dvou z prvních tří uvedených projevů (podle Daniely Čihákové). 
Klinickým diagnostickým kritériem APS-1 je přítomnost alespoň dvou ze tří hlavních komponent nemoci – hypoparatyreózy, Addisonovy nemoci a ektodermální dystrofie s mukokutánní kandidózou. Molekulárně genetické vyšetření může diagnózu potvrdit i v méně typických případech.
Terapie APS-1 je zatím stále substituční a symptomatická. Celková imunosuprese nevede ke zlepšení stavu. Používá se pouze při autoimunitní hepatitidě, kdy je většinou účinná léčba Prednisonem.
APS-1 výrazně komplikuje a zkracuje život. Vedle nerozpoznané Addisonovy nemoci jsou nejčastější příčinou smrti suicidia, selhání jater a karcinom dutiny ústní. Většina pacientů je neplodných v důsledku selhání gonád. Při keratokonjunktivitidě hrozí slepota.
3.1.4. Léčba hypoparatyreózy
V akutní fázi hypokalcemie podáváme 10% Calcium gluconicum velmi pomalu i.v. v dávce 1 až 2 ml/kg.
Vzhledem k tomu, že rekombinantní lidský parathormon v současné době není registrován pro léčbu hypoparatyreózy u dětí, používá se při léčbě hypoparatyreózy vitamin D3 nebo jeho aktivní metabolit kalcitriol. Tato léčba dokáže normalizovat kalcemii, ale není fyziologickou náhradou parathormonu. Vitamin D a jeho deriváty nemohou předejít ukládání kalcia do měkkých tkání – oční čočky, ledvin, bazálních ganglií a podkožního pojiva. Proto zpravidla podáváme jen nejnižší účinnou dávku, která udrží kalcemii v dolním normálním pásmu a je schopna udržet hladinu fosforu v normě.
3.2. Pseudohypoparatyreóza
Pseudohypoparatyreóza je způsobena rezistencí cílových orgánů k účinkům parathormonu. Hormonální rezistence může v tomto případě postihovat ještě další hormony. Součástí poruchy je také Albrightova hereditální osteodystrofie (AHO) s malým vzrůstem, kulatým obličejem, krátkým krkem, obezitou, brachydaktylií a často také mírnou mentální retardací.
Typickým laboratorním nálezem je zvýšená hladina parathormonu a dolní normální nebo snížená kalcemie.
4. HYPERKALCEMIE
Hyperkalcemií rozumíme hladinu celkového kalcia v séru nad 2,6 mmol/l. Příčiny a diferenciální diagnostiku hyperkalcemie shrnuje tabulka 6.
Tab. 6. Diferenciální diagnostika hyperkalcemie u dětí. 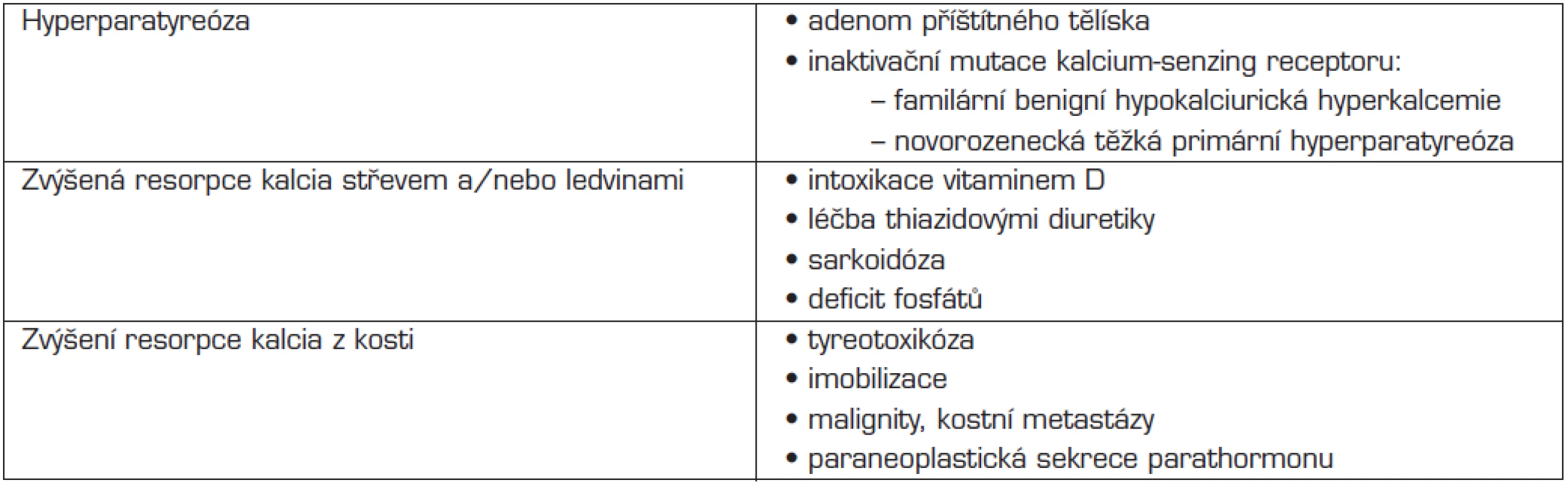
Mezi příznaky hyperkalcemie patří snížená motilita gastrointestinálního traktu se zácpou, ztrátou chuti k jídlu, nevolnostmi a zvracením, příznaky neurologické – svalová slabost, somnolence, zmatenost, halucinace až kóma a některé projevy kardiovaskulární – hypertenze, tachykardie, změny na EKG.
V případech, kdy je hyperkalcemie provázena hyperkalciurií, objevuje se polyurie a polydipsie. Příčinou je snížená citlivost V2 receptoru na antidiuretický hormon vlivem hyperkalciurie.
4.1. Adenom příštítného tělíska
Adenom příštítného tělíska je nejčastější příčinou hyperkalcemie. Vyskytuje se většinou izolovaně, může být ale i prvním projevem syndromu mnohočetné endokrinní neoplazie (MEN 1, MEN 2a i MEN 2b). Obtížné může být nalezení adenomu v méně typické lokalizaci (obr. 5a, b).
Obr. 5a, b. MIBI-SPECT CT u 12leté dívky s hyperparatyreózou na podkladě adenomu příštítného tělíska, které bylo lokalizováno ektopicky v horním mediastinu. Dívka byla vyšetřována pro bolesti v zádech a progredující skoliózu Th-L páteře. Měla kalcemii v pásmu 2,7–3,0 mmol/l a zvýšené hladiny parathormonu. 
Řešení je chirurgické – exstirpace adenomu. V pooperačním průběhu je nutno dbát na dostatečnou suplementaci kalciem a vitaminem D, protože se mohou vyskytnout hypokalcemie v důsledku atrofie zbylých tří příštítných tělísek a také vlivem rychlého ukládání vápníku do kostí a korekce osteoporózy („syndrom hladové kosti“).
4.2. Inaktivační mutace kalcium-senzing receptoru
Vzácnou příčinou hyperkalcemie jsou inaktivační mutace kalcium-senzing receptoru, které vedou k mylnému nastavení buněk monitorujících kalcemii na vyšší hodnoty (viz také obr. 2). Tyto buňky pak normokalcemické hodnoty vnímají jako nízké. Důsledkem je nadprodukce parathormonu, který nadměrně uvolňuje vápník z kostí a způsobuje hyperkalcemii. Buňky tubulů ledvin zvyšují reabsorpci kalcia, což vede k hypokalciurii.
Podle tíže mutace se vyskytují dvě formy onemocnění: mírná a často asymptomatická familiární benigní hypokalciurická hyperkalcemie (FBHH) a život ohrožující novorozenecká těžká primární hyperparatyreóza. Ta se projeví brzy po narození těžkou hyperkalcemií a extrémní demineralizací kostí s mnohočetnými frakturami skeletu (převážně žeber a dlouhých kostí končetin), které vznikají již in utero a během porodu. Charateristický je zvonovitý tvar hrudníku (obr. 6).
Obr. 4. Charakteristická zvonovitá deformita hrudníku u novorozence s těžkou primární hyperparatyreózou. Deformita je důsledkem fraktur při těžké demineralizaci kostí, které mohou vznikat již <em>in utero</em> (z archivu Barbory Obermannové). 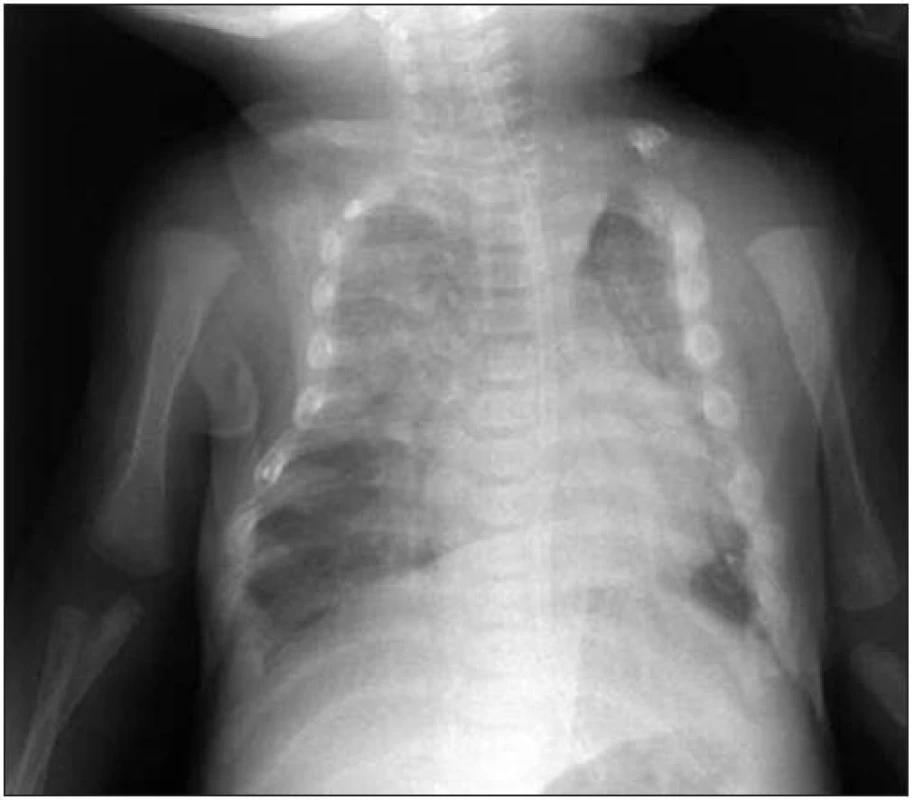
5. OSTEOPORÓZA
Osteoporóza je podle definice WHO systémové metabolické onemocnění skeletu, charakterizované poruchou mechanické odolnosti kosti a vedoucí ke zvýšenému riziku zlomenin. V dětském věku používáme klasifikaci Mezinárodní společnosti klinické denzitometrie (International Society of Clinical Denzitometry, ISCD) z roku 2007 (tab. 7).
Tab. 7. Diagnostická kritéria osteoporózy u dětí a adolescentů na základě konsensu Mezinárodní společnosti klinické denzitometrie z roku 2007. 
Diagnózu osteoporózy u dětí nelze stanovit pouze na základě denzitometrických kritérií, ale nezbytná je také klinicky významná anamnéza zlomenin. Hranice normy při denzitometrii byla stanovena pro obsah kostního minerálu (bone mineral content, BMC) nebo pro plošnou kostní minerální denzitu (areal bone mineral density, BMD) jako Z-skóre menší nebo rovno -2,0 (při denzitometrickém vyšetření pomocí DXA), při zohlednění věku, pohlaví a výšky postavy (obr. 7).
Obr. 5. Volumometrické měření kvality kosti pomocí periferní kvantitativní počítačové tomografie (pQCT). Tato metoda dovoluje přímo zhodnotit skutečný obsah kostního minerálu v daném objemu kostní tkáně. Naopak výsledky měření plošné (areální) kostní denzity, např. metodou dvoufotonové rentgenové absorpciometrie (DXA), je u dětí před vyjádřením výsledku nutné přepočítat podle věku, pohlaví, ale zejména podle výšky postavy (z archivu Ondřeje Součka). 
Primární osteoporóza je u dětí vzácná. Vyskytuje se jako osteogenesis imperfecta nebo jako idiopatická juvenilní osteoporóza.
Sekundární osteoporózou jsou ohroženy děti, které mají některý z následujících zdravotních problémů: (1) onkologická onemocnění, zejména leukemii, (2) systémová onemocnění s vysokodávkovanou léčbou kortikoidy, (3) endogenní nadprodukci kortisolu a (4) neuromuskulární onemocnění. U těchto dětí může vést osteoporóza k frakturám obratlů i končetinových kostí.
U 15–20 % dětí s leukemií se rozvinou fraktury obratlů během prvního měsíce po zahájení chemoterapie, stejně tak u 15–20 % dětí se systémovou formou juvenilní idiopatické artritidy po jednom roce léčby kortikoidy. Kompresivní fraktury obratlů mohou být jedním z prvních příznaků u dětí s Cushingovým syndromem a Cushingovou nemocí (obr. 8).
Obr. 6. Kompresivní fraktury obratlů u 14leté dívky s Cushingovým syndromem na podkladě adenomu nadledviny. Na bočním rentgenovém snímku dolní poloviny páteře je patrná porušená bederní lordóza a výrazná defigurace obratlových těl, zejména Th9, Th10, Th11 a L1 (šipky). Výrazněji defigurováno není jen tělo L5. Zachycený skelet je výrazně difuzně prořídlý. Prvním příznakem nemoci byly dlouhotrvající kruté bolesti v zádech (z archivu Marie Šmelhausové). 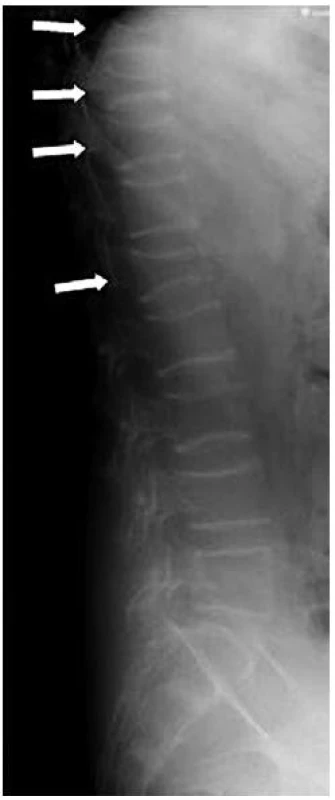
Vzhledem k tomu, že svalové kontrakce jsou důležitou podmínkou pevnosti kostí, vedou i svalové poruchy ke vzniku osteoporózy. Příčinou může být porucha inervace při spina bifida či meningomyelokéle, svalové dystrofie a chronická systémová onemocnění se zánětem a kachexií, která jsou spojena s frakturou obratlů až ve 25 % a s frakturou končetin v 15–20 %.
Podrobný přehled zdravotních poruch spojených v pediatrickém věku s rizikem osteoporózy přináší tabulka 8.
Tab. 8. Onemocnění spojená se sníženou kostní denzitou a/nebo frakturami v dětském věku. 
Prevencí osteoporózy u rizikových dětí je dostatečná fyzická aktivita, udržení svalové síly, optimalizace dodávek vitaminu D a kalcia, zajištění přiměřeného stavu výživy a účinná léčba základního onemocnění.
Léčbu osteoporózy zahajujeme při nálezu nízké kostní denzity provázené klinickými příznaky (bolest nebo zlomenina), u chronických onemocnění někdy i dříve, pokud očekáváme zhoršování stavu skeletu. Lékem volby při terapii osteoporózy u dětí jsou v současné době bisfosfonáty.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2012 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Využitie ultrasonografie pri diagnostike akútnej pyelonefritídy
- Hypothalamo-hypofyzární dysfunkce u dětí a dospívajících po mozkovém úrazu – prospektivní sledování
- Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
- Prenatálne a neonatálne prostredie a ich dôsledky na vývoj dieťaťa
- Čtení o logopedii – 2. část
- X. český pediatrický kongres s mezinárodní účastí
- Poruchy kalciofosfátového metabolismu
- Poruchy funkce nadledvin
- Poruchy funkce štítné žlázy
- Prevence návykových nemocí v rodině
- K článku „Cizí těleso v gastrointestinálním traktu a současná diagnostická a terapeutická doporučení“
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Poruchy funkce nadledvin
- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Poruchy kalciofosfátového metabolismu
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



