-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaOčkování proti tuberkulóze
Vaccination against Tuberculosis
According to the World Health Organization there are more than 9 million new cases of tuberculosis each year and 1.7 million people die from tuberculosis in the world. Tuberculosis incidence is falling in most developed countries including the Czech Republic, but stagnating globally. The control of tuberculosis lies in prevention (Bacillus Calmette-Guérin vaccination and chemoprophylaxis) and especially in finding and treatment of the patients.
The aim of this paper is to inform readers about the history of Bacillus Calmette-Guérin use in the world and in the Czech Republic, about composition of Bacillus Calmette-Guérin vaccine and about difficulties with measuring efficacy and impact of Bacillus Calmette-Guérin vaccination on tuberculosis morbidity. Adverse reactions are listed. Graphical overview of Bacillus Calmette-Guérin vaccination in Europe is presented. The author is suggesting in line with the World Health Organization‘s recommendation to cancel Bacillus Calmette-Guérin revaccination in the Czech Republic.Key words:
BCG vaccination, epidemiological situation, tuberculosis
Autoři: J. Wallenfels
Působiště autorů: Národní jednotka dohledu nad tuberkulózou, FN Na Bulovce, Praha vedoucí MUDr. J. Wallenfels
Vyšlo v časopise: Čes-slov Pediat 2009; 64 (2): 69-76.
Kategorie: Postgraduální vzdělávání
Souhrn
Podle odhadů Světové zdravotnické organizace tuberkulózou onemocní ročně více než 9 milionů lidí a 1,7 milionu lidí nemoci podlehne. I když ve většině vyspělých zemí, včetně České republiky, incidence tuberkulózy klesá, globálně incidence tuberkulózy stagnuje. Kontrola tuberkulózy spočívá v prevenci (Bacillus Calmette-Guérin vakcinace a chemoprofylaxe) a dále především ve vyhledávání a léčení tuberkulózně nemocných.
Cílem tohoto přehledového článku je seznámit čtenáře s historií používání Bacillus Calmette-Guérin vakcíny ve světě i u nás, s jejím složením a s problémy při zjišťování účinnosti a vlivu kalmetizace na nemocnost tuberkulózou. Prostor je věnován problematice nežádoucích reakcí spojených s kalmetizací. V grafické formě je zpracován aktuální přehled kalmetizace v Evropě. Autor článku navrhuje zrušení Bacillus Calmette--Guérin revakcinace v České republice, neboť je v rozporu s doporučením Světové zdravotnické organizace.Klíčová slova:
BCG vakcinace, epidemiologická situace, tuberkulózaÚvod, epidemiologie a dohled nad tuberkulózou
Tuberkulóza (TBC) je specifické infekční onemocnění, které bylo vždy vzhledem ke své zvláštnosti a závažnosti sledováno odděleně od ostatních infekčních chorob. TBC byla a je sociální chorobou a za špatných podmínek dochází k nárůstu počtu onemocnění i úmrtí, což lze dokumentovat např. výrazným zvýšením její nemocnosti a úmrtnosti během obou světových válek [20, 32]. Zkušenosti ze zahraničí, např. ze Spojených států ukazují, že vzestup incidence tuberkulózy je spojen s oslabením pozornosti vůči TBC a omezením programu její kontroly, s šířením epidemie HIV/AIDS, s přílivem imigrantů ze zemí s vysokou incidencí TBC a s nedodržováním léčebných zásad některými nemocnými [6, 20]. Podle odhadů Světové zdravotnické organizace (SZO) jen v roce 2006 onemocnělo (incidence) na světě tuberkulózou 9,2 milionů lidí (139/100 000). 83 % z nich bylo z Afriky, jihovýchodní Asie a západního Pacifiku. Odhadovaný počet nemocných (prevalence) ve stejném roce činil 14,4 milionů a počet zemřelých na TBC dosahoval 1,7 milionů [17]. V 51 zemích evropského regionu SZO (Evropa, Izrael a země bývalého Sovětského svazu) bylo v roce 2006 notifikováno 422 830 případů TBC (48/100 000) s narůstajícím západovýchodním gradientem. Průměrná hlášená incidence činila ve státech EU a Západu 17/100 tisíc, na Balkáně (bez Rumunska a Bulharska) a v Turecku 28/100 000 a na Východě (státy bývalého Sovětského svazu s výjimkou pobaltských zemí) 110/100 000 [14].
U nás je situace u TBC příznivá. V roce 2007 bylo notifikováno 871 nových případů (a recidiv) TBC, což představuje incidenci 8,4/100 000 obyvatel. Před 10 lety to bylo přibližně 2krát více, před 20 lety 3krát více a před 40 lety 10krát více. Na tuberkulózu u nás ročně umírá kolem 60 lidí. Podíl cizinců na notifikaci TBC u nás činil v roce 2007 17,6 % [47]. V řadě států západní Evropy se cizinci na notifikaci TBC podílejí i více než 50 % (např. v roce 2006 Belgie 51 %, Dánsko 57 %, Švýcarsko 59 %, Nizozemí 63 %, Velká Británie 64 %, Švédsko 72 %, Norsko 81 %). I ve srovnání s našimi sousedy je situace u nás příznivá. Lépe je na tom pouze Německo s hlášenou incidencí TBC 6,5/100 000 v roce 2006. Stejný ukazatel pro Rakousko byl 10,5, pro Slovensko 13,5 a pro Polsko 22,5 [14].
Systém kontroly a dohledu nad TBC v České republice odpovídá základním prvkům zásad přímo kontrolované krátkodobé léčby TBC (directly observed treatment short course – DOTS). Jde o strategii DOTS kontroly TBC doporučovanou celosvětově Světovou zdravotnickou organizací [20, 46]. Pokud jde o očkování, řada laiků a bohužel i lékařů se domnívá, že rozhodující metodou kontroly TBC je právě její prevence očkováním. Ve skutečnosti je vliv očkování na celkovou nemocnost TBC nízký až zanedbatelný, navíc obtížně prokazatelný a měřitelný, jak bude vysvětleno níže.
Složení BCG vakcíny a historie BCG vakcinace (kalmetizace) ve světě a u nás
Bacillus Calmette-Guérin (BCG) vakcína patří mezi nejužívanější vakcíny na světě, do EPI (Expanded Programme on Immunization) byla vakcinace proti TBC zahrnuta v roce 1974. BCG je v současnosti aplikována při narození nebo krátce po něm ve více než 100 zemích světa a je to zároveň jediná dostupná vakcína proti TBC [55]. Jedná se o živý, oslabený kmen odvozený od M. bovis, vyvinutý dvěma Francouzi, lékařem Léon Charles Albert Calmettem a veterinářem Jean-Marie Camille Guérinem v Pasteurově institutu v Lille. Očkování se provádí intradermálně (zpravidla nad distální úpon deltového svalu levé paže), v některých zemích perkutánně. Poprvé byla vakcína proti TBC podána (perorálně) člověku v roce 1921.
Prakticky všechny dnešní BCG vakcíny jsou dodávány v lyofilizovaném stavu. Proces lyofilizace a různé kultivační metody užívané různými výrobci vedou k značným rozdílům v počtu a proporci živých a mrtvých zárodků v různých BCG vakcínách, což zase vede k rozdílům mezi vakcínami jak v reaktogenitě (měřeno velikostí lokální léze), tak i v schopnosti indukovat přecitlivělost pozdního typu (tuberkulinová alergie) [13, 16, 43]. I když tradičně je tato BCG vakcínou indukovaná přecitlivělost pozdního typu považována za korelát účinnosti vakcíny, bohužel se zdá, že tomu tak není [1, 18, 27]. Např. v jedné velké britské studii bylo zjištěno, že vakcinovaní jedinci tuberkulin negativní byli proti TBC chráněni ve stejné míře, jako vakcinovaní tuberkulin pozitivní účastníci studie [18]. BCG kmeny jsou obvykle klasifikovány na silné (např. francouzský kmen 1173 (Pasteur), dánský kmen 1331 (Copenhagen)) a slabé, např. japonský kmen 172 (Tokio), brazilský kmen (Moreau) a britský kmen 1077 (Glaxo)). Klasifikace je založena především na odlišných růstových charakteristikách, reziduální virulenci u zvířat a reaktogenitě u dětí [16, 43].
BCG vakcinace se významněji začala uplatňovat v období po druhé světové válce za přispění skandinávského Červeného kříže, UNICEF a později SZO. Začátkem 50. let 20. století byly zahájeny rozsáhlé studie účinnosti vakcíny ve Velké Británii (BMRC, British Medical Research Council) a ve Spojených státech amerických (USPHS, United States Public Health Service). Brzy bylo zřejmé, že postup zvolený BMRC (kmen Copenhagen aplikovaný 13letým tuberkulin negativním dětem) zaručoval vysokou míru ochrany před TBC [19, 26, 30]. Naproti tomu postup zvolený USPHS (kmeny Park nebo Tice aplikované tuberkulin negativním různého věku) zaručoval jen nízký stupeň ochrany [8].
Na základě těchto výsledků příslušné odpovědné instituce učinily logický závěr: ve Velké Británii doporučily provádět kalmetizaci u všech tuberkulin negativních adolescentů, zatímco ve Spojených státech BCG vakcínu k rutinnímu používání nedoporučily a její použití omezily pouze na vysoce rizikové skupiny. Většina zemí světa poté zavedla rutinní kalmetizaci podle různých schémat, nejčastěji při či těsně po narození, příp. před zahájením školní docházky apod. USA a Nizozemí se však rozhodly BCG vakcínu rutinně nepoužívat a kontrolu TBC zcela založily na vyhledávání a léčbě TBC nemocných a využití tuberkulinového testu k identifikaci nakažených (LTBI) a jejich preventivní léčbě (chemoprofylaxe) isoniazidem. Na tomto místě stojí za připomenutí, že incidence TBC jak v USA, tak v Nizozemí je nižší než v České republice [14, 17].
Plošné očkování novorozenců bylo u nás zahájeno v roce 1953, stejně jako dnes ve věku od čtvrtého dne do šesti týdnů. Přeočkovávali se tuberkulin negativní v šestém, desátém, patnáctém, devatenáctém, dvacátém pátém a třicátém roce života; doočkovány byly tuberkulin negativní osoby od ročníku narození 1923 [48]. V současné době upravuje očkování proti TBC § 3 Pravidelné očkování proti tuberkulóze, vyhlášky č. 537/2006 Sb., o očkování proti infekčním nemocem [52].
V dubnu 1986 bylo ve Středočeském a Východočeském kraji a v roce 1989 i v Jihočeském kraji zastaveno celoplošné očkování. Očkováni zde byli pouze novorozenci ve zvýšeném riziku TBC a děti, jejichž rodiče si to přáli. Neočkované děti, kterých bylo do roku 1993 téměř 200 000, byly pravidelně vyšetřovány tuberkulinovým testem [11, 49, 50, 51, 53, 54]. Z tohoto počtu neočkovaných dětí onemocnělo TBC celkem 48 dětí. Z nich mělo 41 plicní formu, většinou minimálního rozsahu, 6 dětí mělo TBC podkožních krčních uzlin a 1 dítě v roce 1993 zemřelo na bazilární meningitidu. Mykobakteriózou onemocnělo 33 dětí. Roční incidence TBC u nevakcinovaných dětí činila 5,95/100 000 (2,4/100 000 u dětí v kontaktu s TBC), u vakcinovaných 1,02/100 000 (0,8/100 000 u dětí v kontaktu s TBC), neboli protektivní účinek BCG vakcinace byl přibližně 80%, resp. 65% u dětí v kontaktu s TBC zdrojem. Roční incidence mykobakterióz byla 4,1/100 000 dětí, u vakcinovaných se mykobakteriózy nevyskytovaly. Výsledky tohoto regionálního, téměř 8 let trvajícího přerušení neselektivní BCG vakcinace nebyly a dodnes nejsou hodnoceny jednoznačně. Závěr Souhrnné zprávy dr. Daňkové, doc. Trnky a dr. Švandové o projektu byl: „Z medicínského hlediska není hromadná BCG vakcinace všech dětí za uvedené situace, zejména hned po narození, opodstatněná. Cílená vakcinace dětí ohrožených tuberkulózou je však nutná. Současná situace tuberkulózy (týká se r. 1994, pozn. autora) je v ČR na rozhraní možnosti přejít na selektivní systém BCG vakcinace“ [11].
Účinnost BCG vakcíny a vliv kalmetizace na nemocnost TBC
BCG vakcína je nejúčinnější v prevenci hematogenního šíření M. tuberculosis, naopak má zřejmě jen minimální protektivní efekt na primární plicní implantaci M. tuberculosis, na infekci (vznik latentní tuberkulózní infekce) [16, 40]. Zajímá-li nás účinnost BCG vakcíny, je třeba rozlišovat, o jakou formu TBC (příp. ostatních mykobakteriálních nákaz) se jedná. Největší pozornost logicky přitahuje účinnost vakcíny v ochraně před TBC plic dospělých, neboť právě ta představuje těžiště světového problému TBC. Ostatní formy TBC (dětská tuberkulóza, včetně diseminovaných forem, mimoplicní tuberkulóza) jsou z veřejně-zdravotnického pohledu málo významné. Naneštěstí právě účinnost kalmetizace u TBC plic dospělých je nejvíce kontroverzní. Ve světě byla provedena celá řada studií účinnosti vakcíny s velmi rozdílnými výsledky od nulové účinnosti (známá studie z Chingleput v jihovýchodní Indii) [16, 45] do 80% účinnosti u TBC plic dospělých [16]. Délka doby ochrany vakcinace není jasná, zpravidla se udává v rozmezí 10–20 let [9, 16].
Důvody variability výsledků účinnosti nejsou plně objasněny, i když byla navržena řada vysvětlujících teorií, jako např.: vliv zeměpisné šířky, metodologické rozdíly mezi studiemi, odlišnosti mezi použitými BCG vakcínami, rozdíly ve virulenci geneticky odlišných kmenů M. tuberculosis, rozdílná vnímavost populací vůči TBC podmíněná odlišnou genetickou výbavou, nutričním stavem atd. [16]. Jako nejvýznamnější se zdá prvně zmiňovaná teorie, vliv zeměpisné šířky. Např. stejná vakcína, jaká byla použita ve výše zmiňované studii v Indii s nulovým efektem, při aplikaci lidem indického původu ve vyšších, chladnějších zeměpisných šířkách měla 64% účinnost [29, 44]. Mechanismus vlivu zeměpisné šířky (klimatu) na účinnost vakcíny se vysvětluje různou mírou expozice environmentálním mykobakteriím, které mohou poskytnout částečnou ochranu před TBC. Účinnost BCG vakcíny v teplých a vlhkých oblastech (poblíž rovníku) s vyšší mírou expozice environmentálním mykobakteriím je nižší než v oblastech s mírným klimatem dále od rovníku [16].
Ve srovnání s výsledky hodnocení účinnosti BCG vakcíny v ochraně před TBC plic dospělých je hodnocení její účinnosti v ochraně před těžkými formami dětské TBC (TBC meningitida a miliární TBC) mnohem jednoznačnější. Panuje shoda, že ochrana před těmito formami TBC se pohybuje kolem 80 % [7, 33]. Proto Světová zdravotnická organizace nyní zdůrazňuje význam BCG vakcinace v prevenci těžkých forem dětské TBC. Jedná se však o spíše vzácné formy tuberkulózy, které z epidemiologického hlediska nepředstavují významný problém. Jejich incidence je velmi nízká dokonce i v zemích bez BCG vakcinačního programu (pod 1/1 000 000 (milion!) u domácí populace a kolem 10/1 000 000 (milion!) u cizinců za rok) (tab. 1).
Tab. 1. Hlášená incidence TBC meningitidy a miliární TBC na 1 000 000 obyvatel podle původu a věkových skupin, 7 zemíx, 2004. 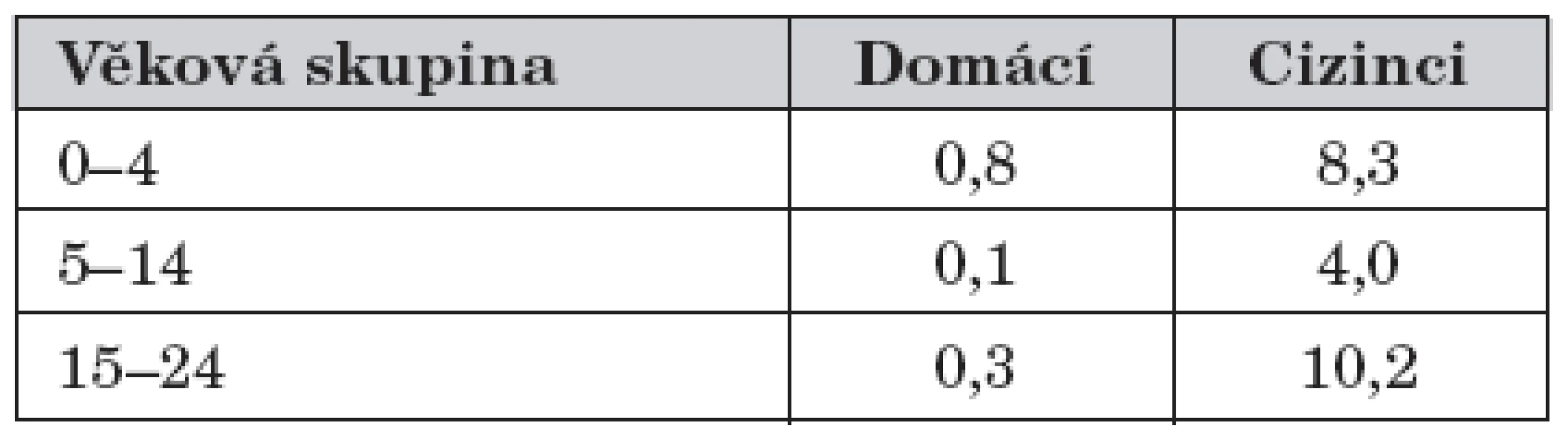
xBelgie, Island, Německo, Norsko, Rakousko, Slovinsko, Švýcarsko Incidence se může rok od roku výrazně lišit vzhledem k velmi nízkému počtu případů. Velikost populace (jmenovatel) hlásí samy země a může se vztahovat k roku před rokem 2004. Zdroj: Falzon D. EuroTB. Osobní sdělení. Výsledky hodnocení účinnosti BCG vakcíny v ochraně před dětskou TBC plic (která však není tak běžná, navíc zřídka mikroskopicky pozitivní a tak obtížněji diagnostikovatelná) jsou méně konzistentní. I zde, podobně jako u TBC plic dospělých, je však pozorována vyšší účinnost v oblastech s mírným klimatem [7, 31, 36, 45].
Pokud jde o revakcinaci, ve světě bylo provedeno mnoho studií, které neprokázaly její efekt [22, 25, 35, 42]. Na základě těchto dat vydala SZO v srpnu 1995 prohlášení, ve kterém provádění revakcinace nedoporučuje, stejně jako nedoporučuje provádění tuberkulinového testu za účelem rozhodnutí, zda revakcinovat či nikoliv [56].
Význam kalmetizace však nespočívá jen v ochraně před tuberkulózou, ale kalmetizace poskytuje určitou míru protekce i před onemocněním leprou [39], vředem Buruli (infekcí M. ulcerans) [37] a v neposlední řadě, jak ukázaly švédské [34] a naše (viz výše) zkušenosti, též před onemocněními vyvolanými environmentálními mykobakteriemi (mykobakteriózy – krční lymfadenitidy dětí).
BCG má rovněž významný imunostimulační účinek a je využíván k léčbě a profylaxi karcinomu in situ močového měchýře [5].
I přes dlouholetou masivní kalmetizaci ve více než 100 zemích světa, je vyjádření jejího vlivu na nemocnost TBC obtížné. BCG se v tomto ohledu odlišuje od ostatních široce používaných vakcín (proti záškrtu, tetanu, dávivému kašli, přenosné dětské obrně, spalničkám, zarděnkám, příušnicím, onemocněním vyvolaným Haemophilus influenzae b), u kterých byl relativně brzy po jejich začlenění do očkovacích programů patrný dramatický pokles počtu hlášených případů onemocnění. Existuje nejméně pět důvodů, které vysvětlují tyto odlišnosti a obtížnost demonstrovat vliv kalmetizace tímto způsobem [16].
Za prvé: kalmetizace v rozvinutých zemích byla zahájena v době, kdy již incidence TBC klesala, souběžně s pokroky v léčbě a vyhledávání kontaktů TBC. Oddělit vliv vlastní kalmetizace je obtížné.
Za druhé: těžiště problému tuberkulózy představuje TBC plic dospělých, přičemž vakcína je podávána především dětem. To znamená, že trvá řadu let, než vakcinované kohorty vstoupí do věku s vysokým rizikem TBC. Není jasné, zda protekce trvá dostatečně dlouho, desetiletí po vakcinaci. Toto zpoždění znásobuje problém odlišení vlivu samotné BCG vakcinace od ostatních opatření kontroly TBC.
Za třetí: skutečnost, že zdrojem transmise M. tuberculosis jsou především dospělí s TBC plic, znamená, že zavedení kalmetizace mělo jen malý dopad na incidenci infekce.
Za čtvrté: ve většině zemí světa neexistují spolehlivé dlouhodobé statistiky nemocnosti či úmrtnosti TBC. Bohužel se to týká především právě zemí s nejvyšší náloží TBC, kde lze očekávat největší přínos kalmetizace.
Za páté: v řadě zemí světa byl a je pozorován nárůst incidence TBC spojený s pandemií HIV/AIDS, migrací obyvatelstva a dalšími faktory. Tyto trendy dále komplikují identifikaci vlivu samotné BCG imunizace.
I přes shora uvedené nesnáze při zjišťování dopadu zavedení kalmetizace na nemocnost TBC existují příklady populačních dat, jež demonstrují přínos BCG vakcinace. Analýzy věkově specifických trendů nemocnosti TBC ve Velké Británii ukázaly její pokles u mladých dospělých po zavedení vakcinace. Pokles byl konzistentní s predikcí poklesu založenou na velikosti proočkovanosti a odhadu účinnosti vakcíny [4, 16, 41]. Podobné analýzy existují např. v Norsku, Švédsku a Dánsku [3, 16].
Nežádoucí reakce po BCG vakcinaci
Lokální reakce po očkování BCG vakcínou jsou obvyklé. V místě vpichu se objevuje indurace, která se mění v lokální lézi, jež může během několika týdnů ulcerovat. Tato léze se obvykle spontánně hojí a zanechává po sobě povrchovou jizvu 2–10 mm v průměru téměř u všech očkovaných osob. Zřídka může ulcerace přetrvávat v místě vpichu několik měsíců. Nedoporučuje se těsný obvaz. Obvyklé je malé zvětšení regionálních lymfatických uzlin (<1 cm) po krátkou dobu. Zvětšení axilárních lymfatických uzlin se může někdy vyskytovat i několik měsíců po očkování. Velmi zřídka se může vyskytnout lymfadenitida. Je to benigní onemocnění, které se spontánně vyhojí, ačkoli často velice pomalu. Velmi vzácně mohou po BCG vakcinaci vzniknout lokální nebo celkové komplikace. Patří k nim:
- ulcerace nebo absces v místě očkování velikosti 10 mm a více u novorozenců, 20 a více mm u školních dětí;
- zvětšení lymfatických uzlin (>1 cm) – axilárních, supraklavikulárních nebo na levé straně krku, s možností jejich kolikvace a provalení;
- podkožní nebo nitrosvalové granulomy, obvykle po aplikaci zvýšené dávky nebo po nesprávné aplikaci;
- keloidní jizvy (většinou u školních dětí), velice vzácné po aplikaci vakcíny obsahující dánský kmen;
- osteomyelitida a/nebo artritida, velice vzácné po aplikaci vakcíny obsahující dánský kmen;
- generalizovaná BCG infekce téměř pouze u pacientů s poruchou buněčné imunity [38].
V posledních přibližně 7 letech je v ČR pozorována zvýšená četnost postvakcinačních komplikací, výrazně převyšující očekávané hodnoty výskytu. Počet komplikací hlášených Státnímu ústavu pro kontrolu léčiv se mezi lety 2001–2004 zvýšil 3,4násobně. Věkové rozložení hlášených komplikací má dva vrcholy: prvý je ve věku do 7 týdnů a druhý se objevuje ve věku 3 měsíců. Jedná se nejčastěji o uzlinové reakce [24]. Výskyt vedlejších reakcí obecně může být ovlivněn druhem a dávkou vakcíny, technikou aplikace, věkem a dispozicí očkovaných, vlivem jiného očkování a dalšími, neznámými faktory. Zvýšený výskyt vedlejších reakcí může být do určité míry jen zdánlivý, začnou-li si lékaři a rodiče, ať už z jakéhokoliv důvodu, komplikací více všímat a hlásit je.
Současná BCG politika v Evropě a ve světě
BCG politika se země od země významně odlišuje (obr. 1) a mění v čase. Přesto je možno alespoň zhruba rozdělit země podle přístupu ke kalmetizaci do nejméně 4 skupin:
Obr. 1. BCG vakcinace v Evropě, 2008. ZDROJ: 1. Infuso, A., Falzon, D. European survey of BCG vaccination policies and surveillance in children, 2005. Euro Surveill. 2006;11(3): 6–11. 2. http://www.ecdc.eu.int/Health_topics/VI/VI_newsletter.html 3. http://www.euvac.net/graphics/euvac/vaccination/vaccination.html 4. http://www.who.int/vaccines/globalsummary/immunization/scheduleselect.cfm 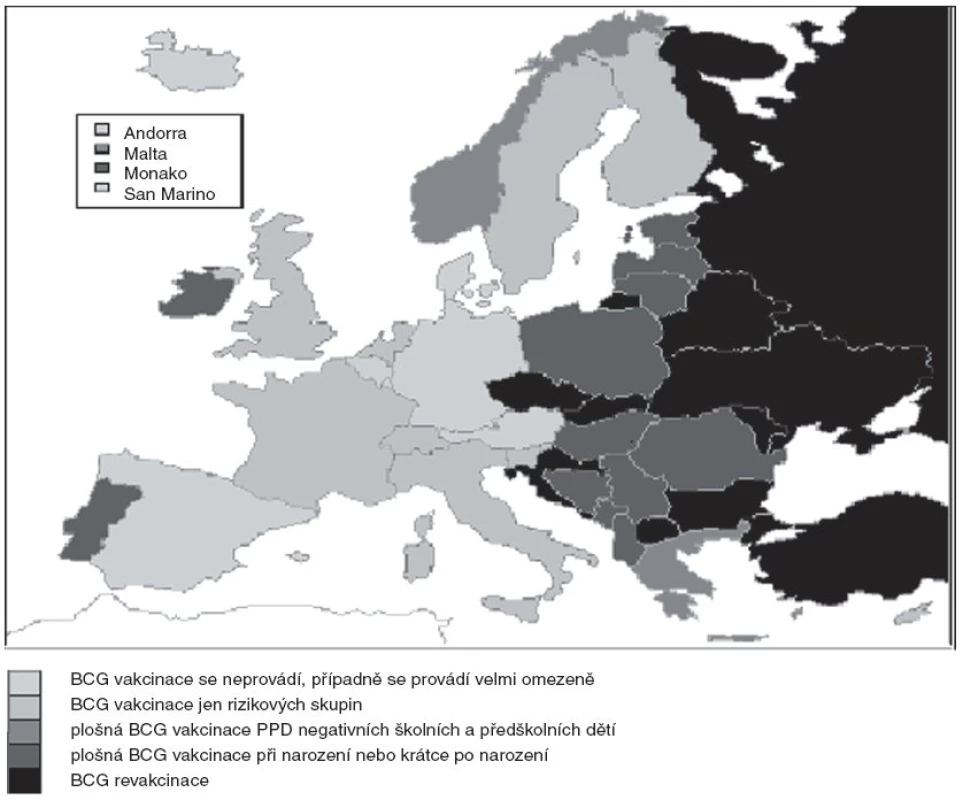
První, nejpočetnější skupinu tvoří země, které očkují jednorázově plošně novorozence při narození či krátce po narození, nejpozději do konce 1. roku života. Jedná se převážně o rozvojové země s nejvyšší náloží TBC v Africe, Asii a některých zemích Latinské Ameriky [55]. Stejnou politiku uplatňuje i řada evropských zemí s vyšší incidencí TBC a také Japonsko [28, 55]. Tento přístup je plně v souladu s doporučením SZO pro tyto země [56].
Druhou skupinu představují země, které očkují jednorázově rutinně v dětství ve školním či předškolním věku, tedy v období nízké incidence onemocnění, ještě před obdobím mladší dospělosti, spojeným s vyšším výskytem tuberkulózy. Takto postupovaly donedávna Velká Británie a Francie, z evropských států do této skupiny v současnosti patří Řecko, Norsko a Malta.
Třetí skupina zahrnuje země provádějící revakcinaci. Tímto způsobem postupují některé evropské státy s vyšší náloží TBC, včetně Ruska, dále některé mimoevropské rozvojové země [55] a bohužel též Česká republika a Slovensko. Tento přístup je jednoznačně v rozporu s doporučením SZO nerevakcinovat [56]. Je chybou, že toto nyní již 13 let staré doporučení SZO nebylo reflektováno v platné vyhlášce č. 537/2006 Sb., o očkování proti infekčním nemocem a revakcinace nebyla zrušena [52]. Nepočítáme-li Slovensko a Bulharsko, Česká republika je jedinou zemí Evropské unie, která ještě revakcinuje [12, 15, 21].
Čtvrtá skupina je tvořena zeměmi, které BCG vakcínu buď vůbec nepoužívají, případně její použití limitují na různým způsobem definované rizikové skupiny. Sem patří tradičně Spojené státy americké [80] a Nizozemsko. V současnosti tímto způsobem postupuje většina evropských zemí s nízkou náloží TBC, včetně výrobce v Evropě používané vakcíny BCG SSI Dánska a některé nejvyspělejší mimoevropské země (Kanada, Austrálie, Nový Zéland) [55]. Jedná se v každém případě o současný trend ve vyspělých státech Evropy, jen v posledních 3 letech přešly k selektivní vakcinaci Slovinsko, Finsko, Velká Británie a Francie [2, 12, 15]. Určité vodítko pro země uvažující o tomto kroku představují Mezinárodní kritéria pro zrušení neselektivní BCG vakcinace vypracované v roce 1993 Mezinárodní unií proti tuberkulóze a plicním nemocem (IUATLD):
- země má dobře fungující notifikační systém
A BUĎ
- průměrná roční notifikace mikroskopicky pozitivní plicní TBC je 5/100 000 nebo méně během posledních 3 let,
NEBO
- průměrná roční notifikace TBC meningitidy u dětí mladších 5 let je nižší než 1/10 000 000 během posledních 5 let,
NEBO
- průměrné roční riziko infekce TBC je 0,1 % nebo méně [10].
Česká republika uvedená kritéria splňuje. Připočteme-li k tomu skutečnost, že u nás v posledních letech došlo k nárůstu počtu komplikací po vakcinaci (viz výše), měli bychom i my o ukončení neselektivní BCG vakcinace přinejmenším uvažovat. Se stanoviskem České pneumologické a ftiseologické společnosti ČLS JEP k současné situaci BCG vakcinace v České republice, totiž: „Pokračovat v plošném očkování proti TBC v celé ČR, ale termín primovakcinace posunout z novorozeneckého období do 2. pololetí prvého roku života, kde by očkování zajišťovala kalmetizační oddělení. Zachovat revakcinaci ve věku 11 let.“ [23], lze jen těžko souhlasit. Zachování revakcinace je v jasném rozporu se stanoviskem Světové zdravotnické organizace (viz výše) a odporuje principům evidence based medicine a plošná primovakcinace ve 2. polovině prvního roku života by znamenala u každého dítěte 1 tuberkulinový test navíc a stejně by se musely očkovat po narození děti z rizikových skupin. Kromě toho se plošná kalmetizace v tomto období nikde v zahraničí neprovádí [55].
Za mnohem užitečnější než úvahy o posunu primovakcinace považuje autor článku zahájení seriózní debaty o vymezení rizikových skupin určených k vakcinaci a zajištění jejich vysoké proočkovanosti. Jistě zde bude nutné sledovat situaci v ostatních státech Evropské unie a vybrat to, co by mohlo fungovat i u nás. Vymezení rizikových skupin dětí se liší země od země, ale zpravidla se děje na základě původu (dítě, rodiče či rodina narozeni nebo pocházející ze země s vysokou incidencí TBC), kontaktu (kontakt s TBC nebo někdo z rodiny měl TBC) a cestování (cesta nebo plánovaný pobyt v zemi s vysokou incidencí TBC). Dále se liší země od země přesné vymezení výše uvedených důvodů a věkové rozpětí, kdy mají být děti očkovány [21].
Pozn.: Článek je aktualizovanou a zkrácenou podobou článku, který vyšel v časopisu Vakcinologie (Wallenfels J. Očkování proti tuberkulóze. Vakcinologie 2007;1(1): 28–47).
Došlo: 22. 10. 2008
Přijato: 22. 12. 2008
MUDr. Jiří Wallenfels
Národní jednotka dohledu nad tuberkulózou
FN Na Bulovce
Budínova 2
180 81 Praha 8
e-mail: jiri.wallenfels@fnb.cz
Zdroje
1. Al-Kassimi FA, Al-Hajjaj MS, Al-Orainey IO, et al. Does the protective effect of neonatal BCG correlate with vaccine-induced tuberculin reaction? Am. J. Resp. Crit. Care Med. 1995;152 : 1575–1578.
2. BCG vaccination. In Tuberculosis. Clinical Diagnosis and Management of Tuberculosis, and Measures for Its Prevention and Control. National Collaborating Centre for Chronic Conditions. London: Royal College of Physicians, 2006.
3. Bjartveit K, Waaler H. Some evidence of the efficacy of mass BCG vaccination. Bull. WHO 1965;33 : 289–319.
4. British Thoracic Association. Effectiveness of BCG vaccination in Great Britain in 1978. Br. J. Dis. Chest 1980;74 : 215–227.
5. Brosman SA. Carcinoma in Situ of the Urinary Bladder. http://www.emedicine.com/med/topic3022.htm.
6. CDC. Controlling Tuberculosis in the United States. Recommendations from the American Thoracic Society, CDC, and the Infectious Diseases Society of America. MMWR. Recommendations and Reports 2005;54(RR12): 1–81.
7. Colditz GA, Berkey CS, Mosteller F, et al. The efficacy of Bacillus Calmette Guerin vaccination of newborns and infants in the prevention of tuberculosis: meta-analysis of the published literature. Pediatrics 1995;96 : 29–35.
8. Comstock GW, Palmer CE. Long-term results of BCG vaccination in the southern United States. Am. Rev. Respir. Dis. 1966; 93(2): 171–183.
9. Connelly Smith K, Starke JR. Bacille Calmette-Guérin vaccine. In Plotkin SA, Orenstein WA (eds). Vaccines. 3rd ed. Philadelphia: WB Saunders Co., 1999 : 111–139.
10. Criteria for discontinuation of vaccination programmes using Bacille Calmette-Guerin (BCG) in countries with a low prevalence of tuberculosis: a statement of the International Union Against Tuberculosis and Lung Disease. Tubercle and Lung Disease 1994;75(3): 179–180.
11. Daňková D, Trnka L, Švandová E. Projekt přerušení BCG vakcinace novorozenců na vybraném území České republiky. Souhrnná zpráva za roky 1986–1993. Stud. Pneumol. Phtiseol. 1995;55(4): 281–292.
12. ECDC. Vaccines and immunization – V and I Newsletter. www.ecdc.eu.int.
13. Edwards LB, Palmer CE, Magnus K. BCG vaccination: Studies by the WHO Tuberculosis Research Office, Copenhagen. Geneva: WHO, 1953 : 1–307.
14. EuroTB and the national coordinators for tuberculosis surveillance in the WHO European Region. Surveillance of tuberculosis in Europe. Report on tuberculosis cases notified in 2006, Institut de veille sanitaire, Saint-Maurice, France. March 2008.
15. EUVAC.NET. A Surveillance Community Network for Vaccine Preventable Infectious Diseases. Vaccination schedules. www.euvac.net.
16. Fine P, Carneiro I, Milstien J, et al. Issues relating to the use of BCG in immunization programmes. A discussion document. Geneva: WHO. Department of Vaccines and Biologicals, 1999 (WHO/VB/99.23).
17. Global tuberculosis control: surveillance, planing, financing. WHO report 2008. Geneva: World Health Organization (WHO/HTM/TB/2008.393).
18. Hart PD, Surtherland I, Thomas J. The immunity conferred by effective BCG and vole bacillus vaccines, in relation to individual variations in induced tuberculin sensitivity and to technical variations in the vaccines. Tubercle 1967;48 : 201–210.
19. Hart PD, Sutherland I. BCG and vole bacillus vaccines in the prevention of tuberculosis in adolescence and adult life. Final report to the Medical Research council. BMJ 1977;2 : 293–295.
20. Homolka J, Votava V. Tuberkulóza. Praha: Karolinum, 2003 : 1–80.
21. Infuso A, Falzon D. European survey of BCG vaccination policies and surveillance in children, 2005. Euro Surveill. 2006;11(3): 6–11.
22. Karonga Prevention Trial Group. Randomised controlled trial of single BCG, repeated BCG, or combined BCG and killed Mycobacterium leprae vaccine for prevention of leprosy and tuberculosis in Malawi. Lancet 1996;348 : 17–24.
23. Kos S, Nykodýmová P, Balý J, výbor ČPFS. Stanovisko České pneumologické a ftizeologické společnosti ČLS JEP k současné situaci BCG vakcinace v České republice. www.pneumologie.cz.
24. Křepela K, Nykodýmová P, Kos S. Stanovisko k nárůstu komplikací po BCG vakcinaci v České republice. Neonatologické Listy 2005;11(2): 28-29.
25. Lugosi L. Theoretical and methodological aspects of BCG vaccine from the discovery of Calmette and Guerin to molecular biology: a review. Tuberc. Lung Dis. 1992;73 : 252–261.
26. Medical Research Council. BCG and vole bacillus vaccines in the prevention of tuberculosis in adolescence and early life. Bull. WHO 1972;46 : 371–385.
27. Menzies D. What does tuberculin reactivity after Bacille Calmette-Guérin vaccination tell us? Clin. Infect. Dis. 2000;31(Suppl 3): S71–74.
28. Mori T. The new Tuberculosis Control Program of Japan. Kansenshogaku Zasshi 2006;80(4): 345–352 (článek v japonštině).
29. Packe GE, Innes JA. Protective effect of BCG vaccination in infant Asians: a case control study. Arch. Dis. Child. 1988;63(3): 277–281.
30. Palmer CE, Shaw LW, Comstock GW. Community trials of BCG vaccination. American Review of Tuberculosis and Pulmonary Diseases 1958;77(6): 877–907.
31. Putrali J, Sutrisna B, Rahayoe N. A case-control study of the effectiveness of BCG vaccination in children in Jakarta, Indonesia. Proceeding I of the Eastern Regional Tuberculosis Conference of IUAT, 1983, Jakarta, Indonesia 1983;194–200.
32. Raška K, Radkovský J. Rozbor epidemiologické situace tuberkulosy. In Kolektiv autorů. Tuberkulosa. Současný stav a perspektivy boje proti tbc v ČSR. Praha: Státní zdravotnické nakladatelství, 1959 : 42–90.
33. Rodrigues LC, Diwan VK, Wheeler JG. Protective effect of BCG against tuberculous meningitis and miliary tuberculosis: a meta-analysis. Int. J. Epidemiol. 1993;22 : 1154–1158.
34. Romanus V, Hollander HO, Wahlen P, et al. Atypical mycobacteria in extrapulmonary disease among children. Incidence in Sweden from 1969 to 1990, related to changing BCG coverage. Tubercle and Lung Disease 1995;76 : 300–310.
35. Sepulveda RL, Parcha C, Sorensen RU. Case-control study of the efficacy of BCG immunization against pulmonary tuberculosis in young adults in Santiago, Chile. Tubercle and Lung Disease 1992;73 : 372–377.
36. Shapiro C, Cook N, Evans D, et al. A case control study of BCG and childhood tuberculosis in Cali, Columbia. Int. J. Epidemiol. 1985;14 : 441–446.
37. Smith PG, Revill WDL, Lukwago E, et al. The protective effect of BCG against Mycobacterium ulcerans disease: a controlled trial in an endemic area of Uganda. Trans. R. Soc. Trop. Med. Hyg. 1976;70 : 449–457.
38. Souhrn SPC: 58227 BCG VACCINE SSI INJ SIC 10X10DÁV+SO SST DK R.
39. Stanley SJ, Howland C, Stone MM, et al. BCG vaccination of children against leprosy in Uganda: final results. J. Hyg. (Camb). 1981;87 : 235–248.
40. Sutherland I, Lindgren I. The protective effect of BCG vaccination as indicated by autopsy studies. Tubercle 1979;60 : 225–231.
41. Sutherland I, Springett VH. Effectiveness of BCG vaccination in England and Wales in 1983. Tubercle 1987;68 : 81–92.
42. Tala-Heikkila MM, Tuominen JE, Tala EO. J. Bacillus Calmette-Guerin revaccination questionable with low tuberculosis incidence. Am. J. Respir. Crit. Care Med. 1998;157 : 1324–1327.
43. Temperature Sensitivity of Vaccines: Geneva: WHO. Department of Immunization, Vaccines and Biologicals, 2006 (WHO/IVB/06.10).
44. Trial of BCG vaccines in south India for tuberculosis prevention: first report – Tuberculosis Prevention Trial. Bulletin of the World Health Organization 1979;57(5): 819–827.
45. Tripathy SP. Fifteen-year follow-up of the Indian BCG prevention trial. Bull. Int. Union Tuberc. Lung Dis. 1987;62 : 69–72.
46. Trnka L, Daňková D. Kontrola a dohled nad tuberkulózou v České republice. Kodex TB kontroly pro praxi pro rok 2001. Bull. ČPFS 2001;11(1): 12–15.
47. Ústav zdravotnických informací a statistiky ČR. Zdravotnická statistika. Tuberkulóza a respirační nemoci 200x. Praha: ÚZIS ČR, 200x.
48. Vyhláška ministra zdravotnictví č. 390/1952 Ú. l., o očkování proti přenosným nemocem.
49. Vyhláška MZ ČR č. 48/1991 Sb., o očkování proti přenosným nemocem.
50. Vyhláška MZ ČR č. 19/1994 Sb., kterou se mění a doplňuje vyhláška MZ ČR č. 48/1991 Sb., o očkování proti přenosným nemocem, ve znění vyhlášky č. 527/1991 Sb.
51. Vyhláška MZ ČR č. 527/1991 Sb., kterou se mění vyhláška MZ ČR č. 48/1991 Sb., o očkování proti přenosným nemocem.
52. Vyhláška MZ ČR č. 537/2006 Sb., o očkování proti infekčním nemocem.
53. Výnos č. 1/1989 Věstníku Ministerstva zdravotnictví a sociálních věcí ČSR, o očkování proti přenosným nemocem.
54. Výnos č. 7/1986 Věstníku MZ ČSR, kterým se mění a doplňuje výnos č. 13/1984 Věstníku MZ ČSR, o očkování proti přenosným nemocem.
55. WHO Vaccine Preventable Diseases Monitoring System. Immunization schedules by antigen, selection centre. http://www.who.int/vaccines/globalsummary/immunization/scheduleselect.cfm.
56. World Health Organization. Global tuberculosis programme and global programme on vaccines: statement on BCG revaccination for the prevention of tuberculosis. Wkly Epidemiol. Rec. 1995;70 : 229–231.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek K očkování proti tuberkulózeČlánek Monogenní hypertenze
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2009 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- K očkování proti tuberkulóze
- Refluxní striktury jícnu u dětí – léčba a výsledky
- Mentální anorexie nebo nádor mozku?
- Očkování proti tuberkulóze
- Geneticky podmíněné formy nefrotického syndromu u dětí
- SMARCAL1 mutations: A cause of prepubertal idiopathic steroid-resistant nephrotic syndrome
- Flow-mediated dilation (FMD) – ultrazvukové hodnotenie funkcie cievneho endotelu v rizikových skupinách populácie
- Monogenní hypertenze
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Očkování proti tuberkulóze
- Geneticky podmíněné formy nefrotického syndromu u dětí
- Refluxní striktury jícnu u dětí – léčba a výsledky
- Monogenní hypertenze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



