-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy
Doporučení výboru ČDS ČLS JEP pro praxi
Review of Current Guidelines for Systemic „Non-biological“ Therapy of Psoriasis Clinical Practice
Guidelines of the Board of ČDS ČLS JEPPsoriasis is a chronic genetically determined immunologically mediated inflammatory condition with important systemic component (cardiovascular diseases, metabolic syndrome etc.). Local therapy and phototherapy is usually recommended for mild psoriasis. When this treatment is not effective, not tolerated or contraindicated, as well as in patients with severe disease or significantly decreased quality of life the systemic therapy is prescribed. Current range of systemic therapy in the Czech Republic includes non-biological agents (methotrexate, ciclosporin, acitretin), phototherapy and biological agents (adalimumab, etanercept, infliximab, ustekinumab, secukinumab). Presented recommendation for „non-biological“ systemic therapy of adult patients with moderate to severe psoriasis takes into account the European guidelines published in 2009 and their revised version from the year 2015 and international consensus adjusted upon clinical practice in the Czech Republic and current drug package inserts information (SPC).
Key words:
psoriasis – phototherapy – systemic treatment – methotrexate – ciclosporin – acitretin
Autoři: P. Cetkovská 1; M. Kojanová 2; P. Arenberger 3; J. Fabianová 4
Působiště autorů: Dermatovenerologická klinika FN a LF UK, Plzeň přednosta prof. MUDr. Karel Pizinger, CSc. 1; Dermatovenerologická klinika VFN a 1. LF UK, Praha přednosta prof. MUDr. Jiří Štork, CSc. 2; Dermatovenerologická klinika FNKV a 3. LF UK, Praha přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 3; Farmakoterapie, Praha 4
Vyšlo v časopise: Čes-slov Derm, 92, 2017, No. 1, p. 3-16
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Psoriáza je chronické geneticky podmíněné imunitně zprostředkované zánětlivé onemocnění kůže s prokazatelnou a významnou systémovou komponentou (kardiovaskulární onemocnění, metabolický syndrom aj.). Základem terapie pacientů s mírnějšími formami psoriázy je lokální léčba, popř. fototerapie. U nemocných, u kterých je tato léčba nedostatečně účinná, špatně snášená či kontraindikovaná, dále u pacientů s těžkou, rozsáhlou psoriázou či s psoriázou výrazně snižující kvalitu života, je indikována systémová farmakoterapie. Současné možnosti systémové léčby středně těžké až těžké psoriázy v České republice zahrnují nebiologické léky (metotrexát, cyklosporin, acitretin), fototerapii a biologické léky (adalimumab, etanercept, infliximab, ustekinumab, secukinumab). Prezentovaná doporučení pro nebiologickou systémovou léčbu dospělých pacientů se středně těžkou až těžkou psoriázou vychází z evropských doporučených postupů publikovaných v roce 2009 a jejich aktualizované verze z roku 2015, z konsenzuálních mezinárodních jednání upravených na základě klinické praxe v České republice a příslušných současně platných souhrnů údajů o léčivých přípravcích (SPC).
Klíčová slova:
psoriáza – fototerapie – systémová léčba – metotrexát – cyklosporin – acitretinÚVOD
Psoriáza je chronické geneticky podmíněné imunitně zprostředkované systémové onemocnění, projevující se především na kůži, nehtech, ve kštici a kloubech. Prevalence psoriázy se pohybuje okolo 2–3 %, frekvence psoriatické artritidy u pacientů s psoriázou dosahuje až 41 % [17]. Nejčastější formou je chronická ložisková psoriáza, k dalším formám patří gutátní psoriáza, inverzní psoriáza, nehtová psoriáza, palmoplantární psoriáza či pustulózní psoriáza. Závažnými formami jsou erytrodermická psoriáza a generalizovaná pustulózní psoriáza. Hlavními patofyziologickými rysy psoriázy jsou hyperproliferace epidermis s poruchou diferenciace keratinocytů, zvýšená angiogeneze a imunopatologický zánět, kdy významnou úlohu sehrávají Th1 - a Th17-lymfocyty, jejichž aktivita je provázena vysokou expresí prozánětlivých cytokinů jako TNF-α, IFN-γ, IL-12, IL-17 či IL-23 [13].
Psoriáza bývá doprovázena řadou souběžných onemocnění, která vznikají v důsledku chronických zánětlivých změn či na podkladě podobné patogeneze. Jedná se především o kardiovaskulární onemocnění, hypertenzi, obezitu, dyslipidémii, diabetes mellitus či nealkoholickou steatohepatitidu. U nemocných s psoriázou byl popsán i vyšší výskyt idiopatických střevních zánětů, malignit a psychiatrických poruch [2]. Výskyt komorbidit stoupá se závažností psoriázy a jejich přítomnost značně komplikuje výběr léčby, současně zhoršují prognózu pacientů a zvyšují náklady na terapii. Neadekvátně léčená psoriáza významně zhoršuje kvalitu života nemocných a často má negativní vliv na pracovní produktivitu. Závažná psoriáza prokazatelně zkracuje délku života až o 3,5 (muži), respektive 4,4 (ženy) roku [5].
Současná systémová léčba středně těžké až těžké psoriázy v České republice zahrnuje klasické nebiologické léky (metotrexát, cyklosporin, acitretin), fototerapii a biologické léky (adalimumab, etanercept, infliximab, ustekinumab, secukinumab). Před zahájením celkové terapie se nemocní obvykle ošetřují lokálními přípravky a docházejí na fototerapii. Pokud je tato terapie neúčinná, netolerovaná či kontraindikovaná, je indikována systémová terapie. Se zavedením biologické léčby se sice zvyšuje počet pacientů, kteří jsou spokojeni s výsledky své léčby, přesto stále až 90 % nemocných se středně těžkou až těžkou psoriázou, kteří by měli být léčeni celkovou terapií, je léčeno pouze lokálními přípravky nebo se vůbec neošetřuje [7]. Správný výběr systémové léčby závažnějších forem psoriázy přitom pomůže zabránit rozvoji nemoci i přidružených chorob, což přispívá ke zlepšení adherence a následné kvality života pacientů i jejich práceschopnosti.
Prezentovaná doporučení pro nebiologickou systémovou léčbu vychází z evropských guidelines publikovaných v roce 2009 [18] a jejich aktualizované verze z roku 2015 [14], z konsenzuálních mezinárodních jednání [10] upravených na základě klinické praxe v České republice a příslušných současně platných SPC [16, 21, 22].
HODNOCENÍ ZÁVAŽNOSTI PSORIÁZY
K hodnocení závažnosti psoriázy (a rovněž k hodnocení léčebné odpovědi při biologické terapii) je využíváno skóre PASI (Psoriasis Area and Severity Index), které umožňuje objektivní posouzení tíže (intenzita erytému, infiltrace a deskvamace) a rozsahu kožních projevů [11, 14]. Hodnota PASI se pohybuje od 0 do maxima 72 a skóre nad 10 značí středně těžkou až těžkou psoriázu. K určení rozsahu projevů je možno použít skóre BSA (Body Surface Area), které udává procentuální postižení povrchu těla. Měří se pomocí dlaně (plocha dlaně odpovídá 1 % tělesného povrchu) a hodnota nad 10 % ukazuje závažnou psoriázu. Ovlivnění kvality života lze vyjádřit pomocí skóre DLQI (Dermatology Life Quality Index), které nabývá hodnot 0–30. Skóre 0–5 znamená žádný či malý vliv na kvalitu života, skóre vyšší než 5 odráží střední vliv a hodnota nad 10 velký vliv onemocnění na kvalitu života. U pacientů s psoriázou nehtů či kštice jsou využívány škály NAPSI (Nail Psoriasis Severity Index) a PSSI (Psoriasis Scalp Severity Index) [23].
NEBIOLOGICKÁ SYSTÉMOVÁ LÉČBA PSORIÁZY
Léčba psoriázy by měla být vedena snahou o maximální snížení rozsahu a závažnosti projevů při minimálním výskytu nežádoucích účinků léčby (NÚ). Účinná terapie zlepšuje kvalitu života nemocných, výsledky některých studií kromě toho naznačují, že adekvátní a včasnou (systémovou) léčbou kožních projevů je možné příznivě ovlivnit i riziko vzniku komorbidit, především kardiovaskulárních či metabolických [19, 20]. Terapie musí být individuální a současně komplexní, její součástí by měla být také režimová opatření (eliminace provokačních faktorů, správná životospráva, vhodná pohybová aktivita). V některých případech může být přínosná i psychoterapie [13].
FOTOTERAPIE
Mezi formy systémové léčby psoriázy je tradičně řazena fototerapie, tj. léčebná aplikace neionizujícího elektromagnetického záření na kůži. Za nejúčinnější a nejbezpečnější lze považovat úzkopásmovou fototerapii UVB 311 nm (NBUVB), která je účinnější než fototerapie širokospektrým UVB či SUP (selektivní UV-fototerapie, dlouhovlnná část UVB) [3]. Fotochemoterapie PUVA (UVA + fotosenzibilizátor) se podle způsobu aplikace fotosenzibilizátoru rozděluje na systémovou PUVA (UVA + perorálně podaný psoralen) a lokální PUVA (UVA + psoralen podaný lokálně v koupeli, krému či roztoku). Použití této metody je v současné době v ČR velmi omezené vzhledem k výpadkům fotosenzibilizátoru (oxsoralen) jak v perorální, tak v lokální formě na trhu [3, 9]. Další možností fototerapie je kombinovaná fototerapie, především RePUVA či ReUVB (PUVA, resp. UVB + perorálně podaný retinoid), která umožňuje snížení kumulativní dávky UV záření, či balneofototerapie. Stále používanými postupy (většinou u hospitalizovaných pacientů) jsou Goeckermanova (aplikace dehtového externa + UVB) a Ingramova metoda (aplikace 0,5–3% cignolinu + UVB). Pro ambulantní ošetřování jsou tyto metody méně vhodné vzhledem k časové náročnosti, nepříznivým kosmetickým vlastnostem, případné intoleranci, iritaci, možné karcinogenitě dehtu a jeho nefrotoxickým účinkům. Dobře snášena je kombinace UVB a derivátů vitaminu D3. K novějším metodám patří excimerový laser emitující UVB o vlnové délce 308 nm, který umožňuje izolované ošetření psoriatických ložisek vysokými (supraerytémovými) dávkami záření při současném ošetření okolní zdravé kůže [3, 9].
Mechanismus účinku
Fototerapie má účinky imunomodulační až imunosupresivní, protizánětlivé a antiangiogenní. Inhibuje aktivaci T-lymfocytů, vede k indukci apoptózy keratinocytů a aktivovaných T-lymfocytů, ovlivňuje funkci dendritických buněk a makrofágů, inhibuje epidermální hyperproliferaci (interference s DNA keratinocytů), moduluje syntézu cytokinů a expresi membránových receptorů [3, 18].
Dávkování
Před zahájením fototerapie je zapotřebí určit fototyp pacienta a vyloučit případnou patologickou fotosenzitivitu. Při plánování léčebného schématu je možné vycházet z fototypu nebo lépe ze stanovení minimální erytémové dávky (MED), respektive minimální fototoxické dávky (MPD) – tabulka 1 [18].
Tab. 1. Fototerapie UVB – iniciální dávky 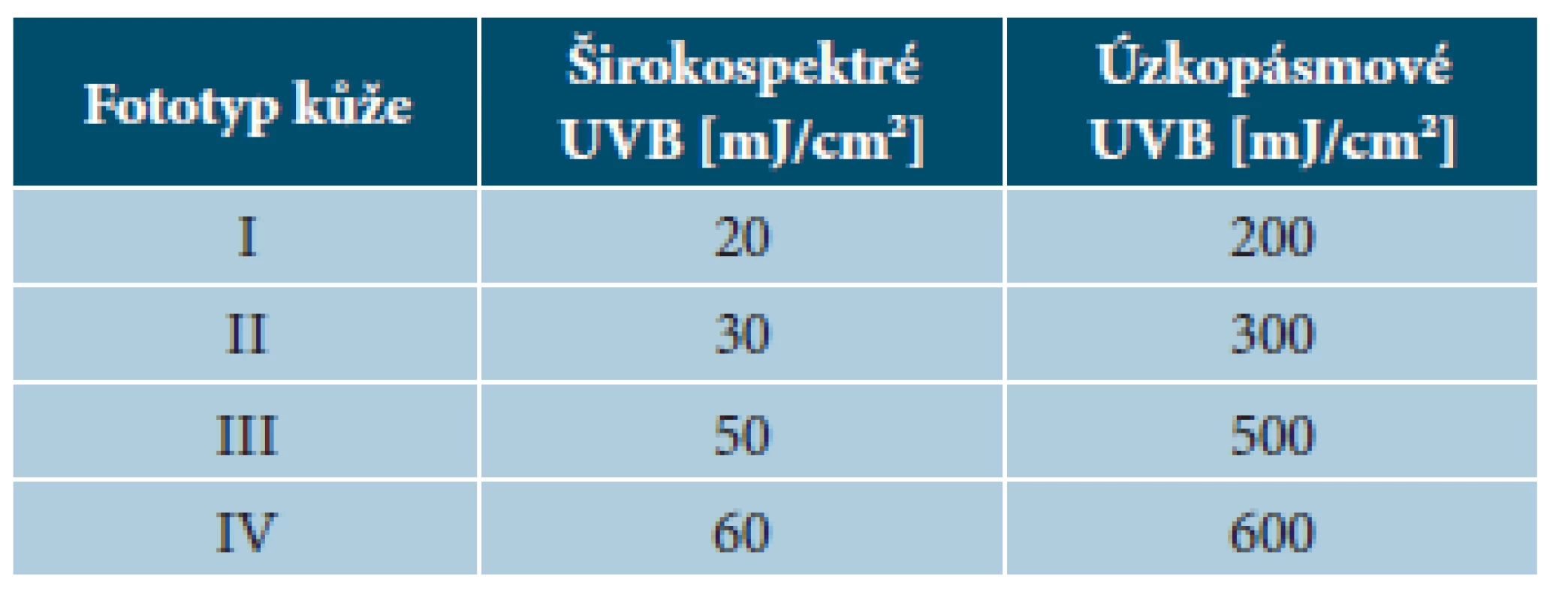
(podle [18]) Úvodní dávka fototerapie UVB pak bývá do 70 % stanovené MED. Frekvence ozařování je 2–5krát týdně a dávky se zvyšují o 20–30 % v porovnání s předchozí dávkou. Schéma se upravuje podle reakce kůže (tab. 2) [18]. Před aplikací fototerapie je vhodné odstranit nánosy šupin a během léčby kůži opakovaně promazávat emoliencii (vlivem fototerapie dochází k vysušení kůže a zesílení rohové vrstvy s olupováním).
Tab. 2. Fototerapie UVB – terapeutické režimy 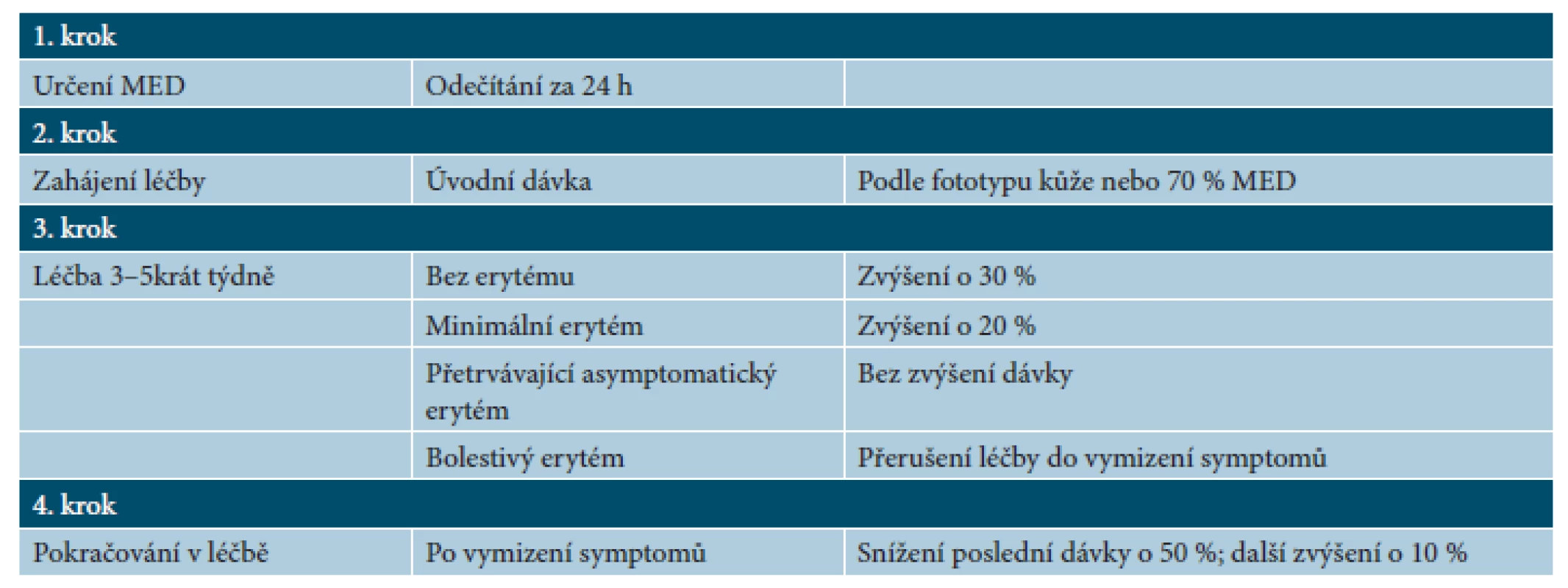
(podle [18]) Vedle celotělového ozařování je možné i lokální ošetření, umožňující cílenou fototerapii nejvíce postižených oblastí (tab. 3) [18].
Tab. 3. Lokální fototerapie UVB (excimerový laser nebo lampa) – terapeutické režimy 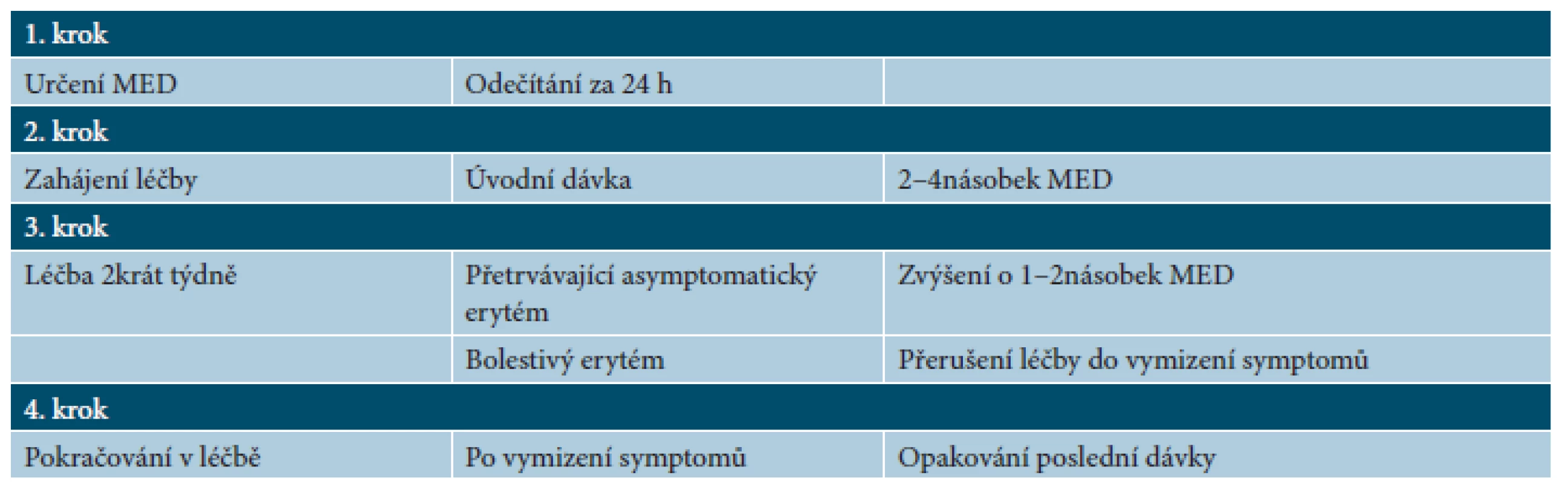
(podle [18]) Účinnost
Souhrnně lze u fototerapie klinicky významnou odpověď očekávat již po jednom až dvou týdnech, PASI 75 je dosahováno po 4–6 týdnech u více než 75 % nemocných. Za nejúčinnější se považuje excimerový laser (UVB 308 nm), který vzhledem k lokalizovanému působení umožňuje použití dávek několikanásobně převyšujících MED, a tím i významné zkrácení léčby, nicméně z praktických důvodů je vhodný u postižení menších ploch. Při fototerapii NBUVB je rychlost nástupu účinku přímo úměrná frekvenci ozařování, fototerapie širokospektrým UVB je relativně méně účinná, je proto vhodné ji kombinovat s lokální léčbou. Při fototerapii PUVA dosáhlo PASI 75 až 90 % pacientů, a to dokonce při aplikaci pouze 2krát týdně [18].
Nežádoucí účinky a lékové interakce
Nežádoucí účinky (NÚ) fototerapie mohou být akutní (erytém, puchýře, pocity pálení či svědění, reaktivace herpes simplex) nebo chronické (hyperpigmentace, aktinické stárnutí kůže, popřípadě karcinogenní působení) [18]. Při použití fototerapie v kombinaci s fototoxickými (např. tetracykliny, furosemid, amiodaron, piroxikam) či fotoalergizujícími léky (např. hydrochlorothiazid, chinin, kyselina tiaprofenová, některá opalovací mléka) může docházet k významným interakcím [18].
Kontraindikace
Absolutními kontraindikacemi fototerapie jsou genetická onemocnění provázená zvýšenou fotosenzitivitou či zvýšeným rizikem kožních malignit, lupus erythematosus, fotodermatózy a kožní malignity; absolutní kontraindikací léčby PUVA je rovněž současná léčba cyklosporinem a těhotenství či kojení. Relativními kontraindikacemi fototerapie pak jsou epilepsie, nutnost léčby fotosenzitizujícími léky, přítomnost dysplastického (atypického) melanocytového névu, anamnéza kožní malignity nebo špatná compliance; relativní kontraindikací PUVA je také závažné onemocnění jater, předchozí terapie arsenem či ionizujícím zářením a vysoký kumulativní počet předcházejících ošetření (více než 150–200) [9, 18].
Předávkování
Akutní předávkování při fototerapii se projevuje erytémem. V takových případech musí být léčba přerušena, vhodná je symptomatická topická terapie, popřípadě systémové podání nesteroidních antiflogistik či kortikosteroidů. Erytém při PUVA neodpovídá na podání kortikosteroidů a kinetika reakce je pomalejší, proto je při této léčbě zapotřebí zvýšené opatrnosti (výhodné jsou režimy s přestávkou uprostřed týdne) [18].
Monitorování před zahájením léčby a v jejím průběhu
Před zahájením fototerapie je zapotřebí důkladné zhodnocení osobní anamnézy a pečlivé vyšetření kůže, před terapií PUVA navíc oční a rutinní laboratorní vyšetření. V průběhu léčby sledujeme především stav kůže (na základě posouzení erytému se individuálně upravuje dávka fototerapie), je třeba zaznamenávat údaje o počtu cyklů a podaných dávkách. Po ukončení fototerapie se stanoví kumulativní dávka fototerapie; u nemocných, kteří prodělali 200–250 ošetření PUVA a více než 350 ošetření NBUVB, by měl být stav kůže pravidelně kontrolován po celý život (riziko malignit po terapii PUVA přetrvává i po ukončení léčby, u bazocelulárního karcinomu dokonce narůstá) [12, 18].
Zvláštní opatření
Vzhledem k riziku fotokarcinogeneze se doporučuje optimalizace účinnosti, zkrácení cyklů léčby a dodržování všeobecných opatření, jako je zakrytí obličeje a genitálu. Celková kumulativní dávka UVA by neměla přesáhnout 1 000 J/cm2. Při fotochemoterapii PUVA je nutná i důsledná ochrana očí, a to až do večera ve dny ošetření, pro zvýšené riziko vzniku katarakty.
Léčebná doporučení a kombinace se systémovou léčbou
Fototerapie je indikována především jako indukční léčba u pacientů se středně těžkou až těžkou psoriázou. První volbou by měla být fototerapie NBUVB, při její nedostatečné účinnosti se doporučuje PUVA, pokud je dostupná. Vzhledem k riziku chronických NÚ není fototerapie vhodná k dlouhodobé léčbě psoriázy.
Fototerapie může být kombinována s lokální léčbou (dehet, cignolin, analoga vitaminu D3) a rovněž se systémovou léčbou retinoidy – tato kombinace umožňuje snížení kumulativní dávky UVB, a tím i riziko NÚ (na druhou stranu může zvýšit i riziko fototoxicity) [12]. Kombinace s cyklosporinem (riziko kožních karcinomů) ani s metotrexátem se nedoporučuje [9, 18].
KLASICKÁ SYSTÉMOVÁ LÉČBA
Podle doporučení britské organizace NICE (National Institute of Clinical Excellence) je systémová terapie indikována u pacientů:
- S těžkou život ohrožující formou psoriázy (erytrodermická, generalizovaná pustulózní).
- S rozsáhlou ložiskovou psoriázou, u níž by lokální léčba nebyla účelná či bezpečná a kdy není vhodná či selhala fototerapie.
- S lokalizovanou ložiskovou psoriázou spojenou s významným funkčním postižením anebo psychickým stresem (např. postižení problematických míst jako jsou kštice, genitál, nehty, dlaně či plosky) [15].
Podle jiných doporučení je systémová léčba indikována u nemocných s ložiskovou psoriázou, u nichž nestačí lokální léčba či fototerapie (pacient nebyl v posledních 6 měsících nikdy zhojen), či s nestabilní psoriázou, kdy po ukončení léčby nastávají brzké exacerbace (remise kratší než 1 měsíc), a u kterých je výrazně snížena kvalita života [4].
Při výběru konkrétního léku je zapotřebí zohlednit fenotyp (forma, klinický obraz a lokalizace psoriázy) a závažnost onemocnění, věk a pohlaví pacienta, komorbidity a způsob jejich léčby, případné plánování početí, vhodné je přihlédnout i k preferencím pacienta. Vzhledem k možné toxicitě systémově podávaných antipsoriatik jsou v průběhu této léčby nutné pravidelné laboratorní i klinické kontroly [8].
METOTREXÁT
Metotrexát (MTX) je nejdéle používaný lék v systémové terapii psoriázy (schválen k léčbě v roce 1971). Indikován je u pacientů se středně těžkou až těžkou ložiskovou psoriázou (zejména při současném postižení kloubů), vhodný je i u nemocných s pustulózní či erytrodermickou psoriázou [18].
Mechanismus účinku
Metotrexát (kyselina 4-amino-10-methylfolová) je analogem kyseliny listové, který kompetitivně inhibuje dihydrofolátreduktázu a několik dalších folát-dependentních enzymů. Hlavním účinkem MTX je inhibice syntézy thymidinu, methioninu a purinů, což vede ke snížené syntéze DNA a RNA. Inhibice tvorby nukleových kyselin v aktivovaných T-lymfocytech a keratinocytech je podkladem antiproliferačního a imunosupresivního působení, tedy hlavních terapeutických účinků MTX [18].
Dávkování
Metotrexát se podává 1krát týdně perorálně nebo parenterálně (subkutánně či intramuskulárně). Obvyklá počáteční dávka MTX je 5–15 mg. Pokud je podána na začátku nízká dávka, může být navyšována poměrně rychle na 15 mg týdně do 3 týdnů, a není-li v 8. týdnu účinek uspokojivý, lze dávku zvýšit až na 20 mg týdně. Jestliže po 16–24 týdnech není reakce na tuto dávku dostatečná, smysl dalšího navyšování je sporný. Vyšší účinnosti a lepší snášenlivosti lze dosáhnout při injekční aplikaci [10].
Po dosažení léčebné odpovědi (za 4–8 týdnů) je vhodné snížení na nejnižší možnou účinnou dávku. Metotrexát se užívá nalačno nebo za 1–2 h po jídle buď jednorázově, nebo rozděleně do 3 dávek po 12 hodinách. Za účelem lepší snášenlivosti MTX se za 24 hodin po jeho užití doporučuje podat kyselinu listovou v dávce 5 mg (v České republice dostupné 10mg tablety). Při přetrvávajících gastrointestinálních potížích je možné podat kyselinu listovou i 24 h před užitím MTX [5]. U starších pacientů by iniciální dávka MTX měla být snížena na 2,5 mg [18].
Účinnost
Účinek MTX se projeví pomalu, až za 4–8 týdnů po zahájení léčby. Při iniciální dávce 5–7,5 mg MTX je průměrné PASI 50 pozorováno za 7–13 týdnů a PASI 75 je dosahováno do 14 týdnů, při vyšších zahajovacích dávkách (15–22,5 mg) do 4, respektive 7 týdnů. Maximální účinek se dostavuje během 12–20 týdnů [10]. Metotrexát je obecně považován za méně účinný v porovnání s cyklosporinem, ačkoliv dosud provedené klinické studie prokázaly vyšší účinnost cyklosporinu oproti MTX pouze při indukční léčbě, a to z hlediska hodnoty skóre PASI na konci sledování a relativního snížení skóre DLQI. Nástup účinku byl sice rychlejší u cyklosporinu, ale medián doby do relapsu po vysazení byl u obou léků srovnatelný. Metotrexát byl porovnáván rovněž s biologickými léky adalimumabem a infliximabem. Při porovnání s adalimumabem v indukční léčbě byla demonstrována nižší účinnost metotrexátu z hlediska dosahování PASI 75, PASI 90, skóre 0 nebo 1 dle PGA i absolutního snížení skóre PASI a DLQI. Metotrexát se vyznačoval opět pomalejším nástupem účinku. Podobně tomu bylo také při porovnání s infliximabem [14].
Nežádoucí účinky
Výskyt a závažnost NÚ jsou závislé na dávce a dávkovacím režimu, jejich incidence stoupá při hypalbuminémii a renální insuficienci. K nejčastějším NÚ MTX patří nauzea, únava, vypadávání vlasů, elevace transamináz, změny v krevním obraze či gastrointestinální vředy (tab. 4). Závažnými NÚ jsou hepatotoxicita, myelosuprese, popřípadě intersticiální pneumonie. Ta může postihnout až 8 % léčených a projeví se zejména akutním vznikem dyspnoe, suchým kašlem, horečkou a radiologickými nálezy intersticiálních či alveolárních infiltrátů [6]. Riziko hepatotoxicity (jaterní fibrózy či cirhózy) je zvýšené především u osob s anamnézou abúzu alkoholu, obezity, hepatitidy či diabetes mellitus. K detekci jaterní fibrózy a cirhózy se dříve doporučovalo provedení jaterní biopsie, ta však již běžně není indikována. K odhadu rizika poškození jater je v současné době doporučeno stanovení sérové koncentrace PIIINP (N-terminální propeptid prokolagenu III), které by mělo být provedeno před zahájením léčby MTX a dále každé 3 měsíce (v ČR zatím není běžně dostupné). U nemocných s dlouhodobě normálními hodnotami PIIINP je vznik jaterní fibrózy či cirhózy velmi nepravděpodobný. Při interpretaci výsledků však je třeba si uvědomit, že hodnoty PIIINP mohou být ovlivněny při aktivním onemocnění kloubů, plicní fibróze, kouřením či jinými faktory (rozdílné laboratoře). V současné době jsou intenzivně zkoumány další neinvazivní metody využitelné k odhadu rizika strukturálního poškození jater MTX. Obecně lze říci, že riziko závažného postižení jater u pečlivě sledovaných nemocných léčených nízkou dávkou MTX je malé [14].
Tab. 4. Přehled významných nežádoucích účinků metotrexátu 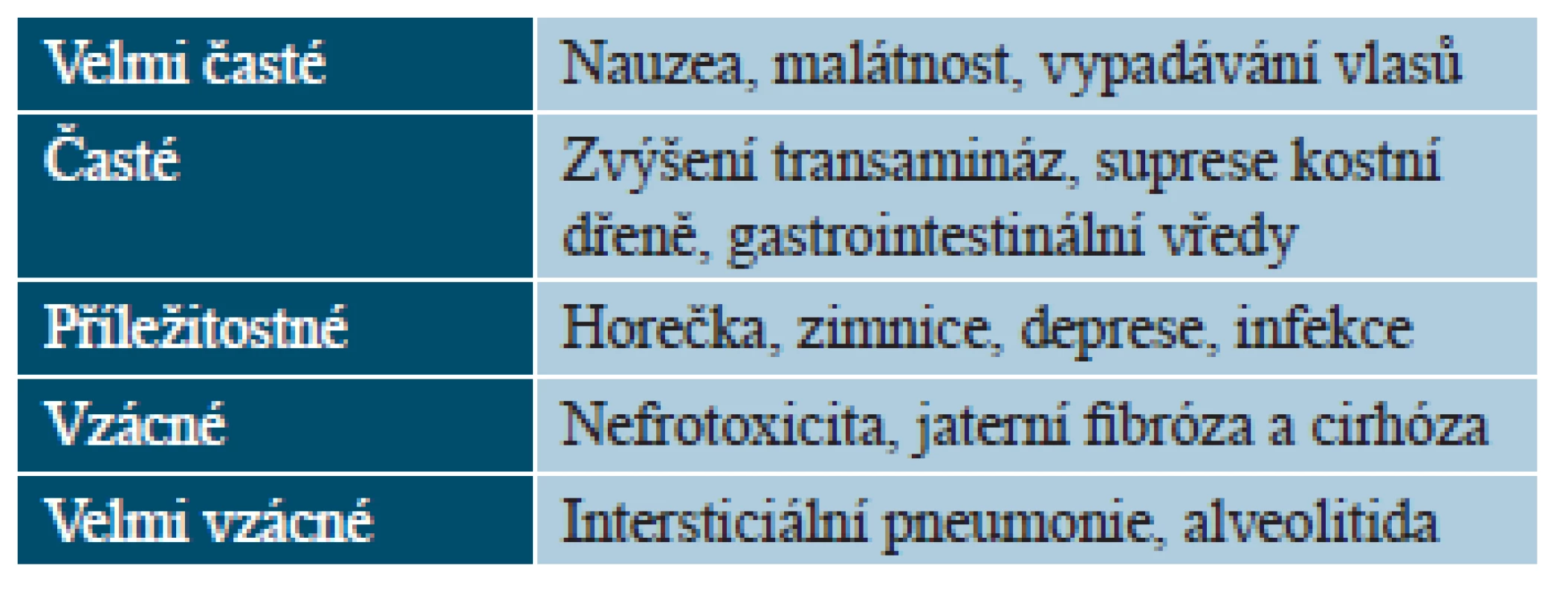
(podle [14]) Kontraindikace
Absolutními kontraindikacemi podání MTX jsou závažná onemocnění jater, renální selhání, závažné infekce, hematologické poruchy, imunodeficity, alkoholismus, akutní peptický vřed, významně snížená plicní funkce, těhotenství/aktivní snaha o koncepci a kojení.
Relativními kontraindikacemi jsou onemocnění jater nebo ledvin, vyšší věk, ulcerózní kolitida, gastritida, diabetes mellitus, městnavé srdeční selhání, anamnéza hepatitidy, anamnéza malignity, plánování těhotenství a špatná compliance [14, 18].
Lékové interakce
Metotrexát vykazuje významné lékové interakce, protože se po absorpci částečně váže na sérový albumin a léky, které tuto vazbu ovlivňují, mohou zvýšit jeho toxicitu. Podobně jsou nebezpečné léky, které zvyšují hepato-, hemato - či nefrotoxicitu. Lék by proto neměl být podáván současně s nesteroidními antiflogistiky, některými antibiotiky (penicilin, tetracyklin, kotrimoxazol), barbituráty, cyklosporinem, azathioprinem, retinoidy či leflunomidem (tab. 5) [14, 18].
Tab. 5. Lékové interakce metotrexátu 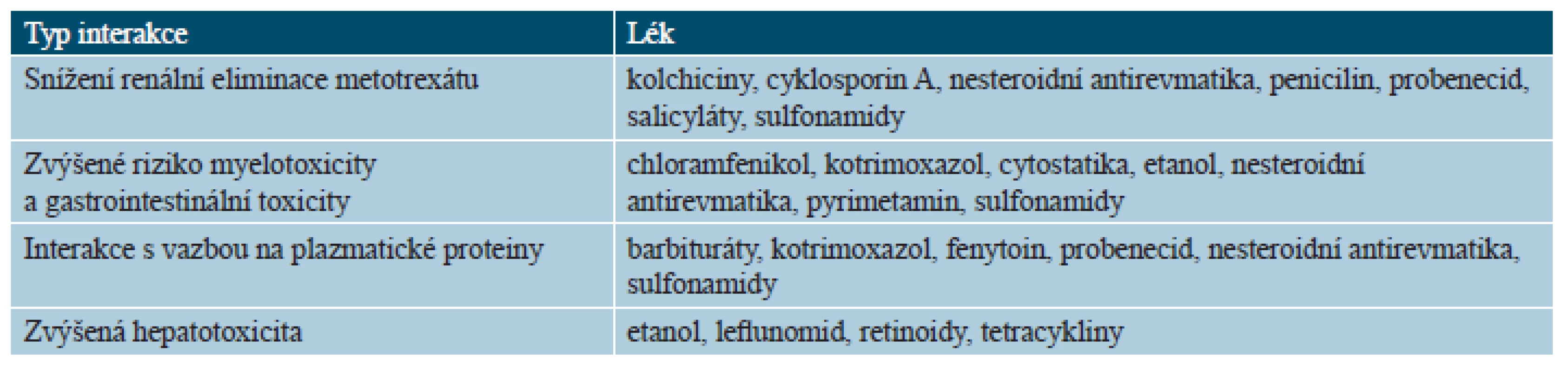
(podle [14]) Předávkování
K předávkování MTX může dojít na podkladě lékových interakcí a při narušení exkrece MTX ledvinami. Akutní toxicita se pak obvykle manifestuje v podobě myelosuprese či vzniku slizničních vředů (zejména v ústech), vzácně ve formě kožní nekrolýzy (ta může být pozorována u nemocných s velmi aktivní, extenzivní psoriázou, u nichž byla příliš rychle navýšena dávka MTX). Při předávkování MTX je třeba okamžitě aplikovat folinát vápenatý, jehož dávka musí být nejméně tak vysoká jako užitá dávka MTX [22].
Monitorování před zahájením léčby a v jejím průběhu
Vzhledem k bezpečnostnímu profilu MTX je před zahájením léčby a před druhou dávkou MTX nutné vyšetřit krevní obraz a diferenciální rozpočet leukocytů k odhalení možné hematotoxicity. Před zahájením se dále doporučují vyšetření jaterních testů, hodnot albuminu a kreatininu, močového sedimentu, RTG hrudníku, tam, kde je dostupné, vyšetření PIIINP, a u žen těhotenský test (tab. 6). Je zapotřebí vyloučit tuberkulózu, hepatitidy, popřípadě infekci HIV. V pravidelných 2–4měsíčních intervalech pak je nutné kontrolovat krevní obraz a diferenciál, jaterní testy a event. PIIINP, kreatinin, močový sediment (viz tab. 3). V průběhu léčby je nutné sledovat symptomy postižení plic (suchý kašel, dušnost, horečka), kontrolovat stav sliznice dutiny ústní a krku, sledovat ostatní užívané léky, vyhnout se hepatotoxickým lékům a alkoholu, nesmí být aplikovány živé vakcíny [14, 22]. U žen v reprodukčním věku se během léčby doporučuje kontracepce a koncepce (u žen i mužů) je možná nejdříve za 3 měsíce [14] (respektive za 6 měsíců [22]) od vysazení MTX.
Tab. 6. Doporučené kontroly před zahájením léčby metotrexátem a v jejím průběhu 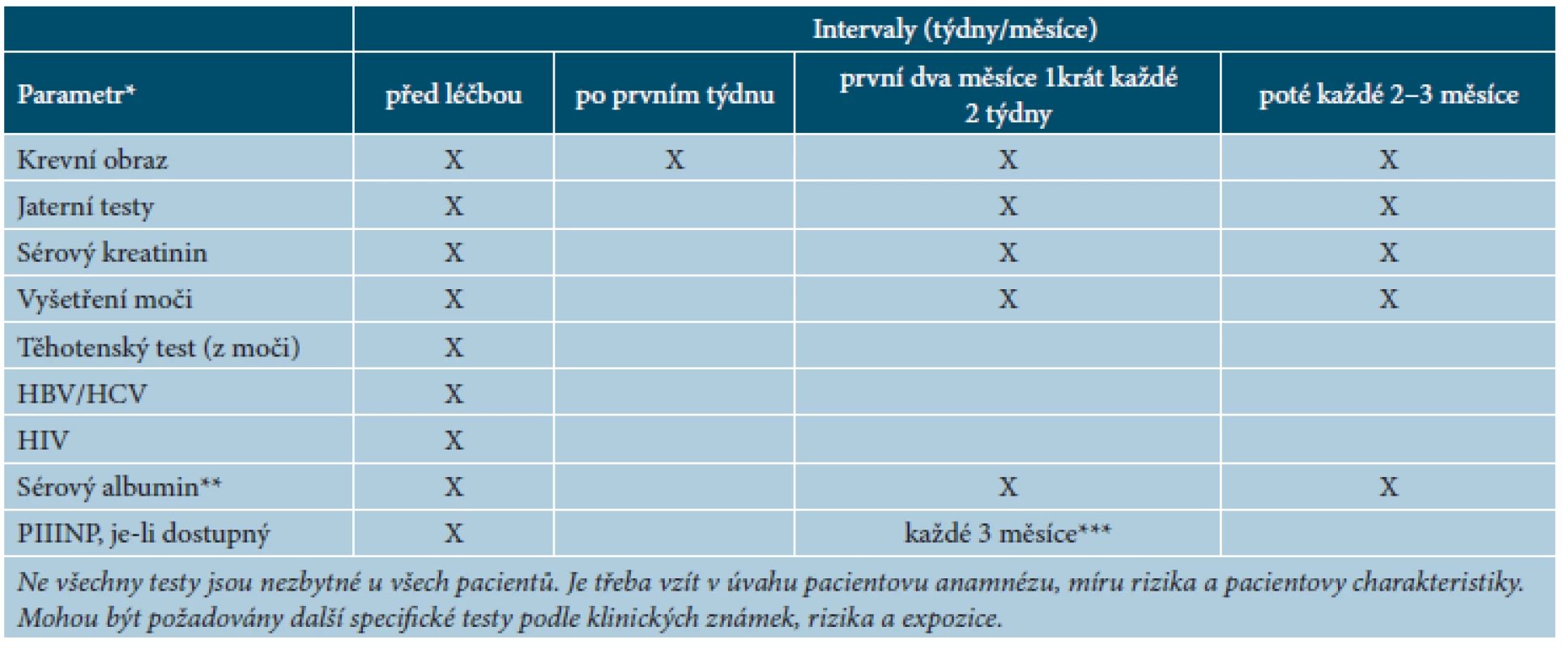
(podle [14]) *Jestliže jsou leukocyty < 3,0, neutrofily < 1,0, trombocyty < 100 nebo jaterní enzymy > dvojnásobek výchozí hodnoty, doporučuje se snížit dávku nebo ukončit medikaci. **Ve vybraných případech (např. při podezření na hypoalbuminémii nebo u pacientů, kteří užívají jiné léky s velkou vazebnou afinitou k sérovému albuminu). ***Ve vybraných případech biopsie jater, je-li to nezbytné; je třeba o ní uvažovat např. u pacientů s přetrvávající abnormální hodnotou PIIINP (> 4,2 μg/l v nejméně třech vzorcích v průběhu 12 měsíců) či u rizikových pacientů. Léčebná doporučení a zvláštní opatření
Metotrexát je indikován k indukční i dlouhodobé léčbě. Maximální opatrnosti je třeba u pacientů s infekcí, peptickým vředem či ulcerózní kolitidou a u pacientů vyššího věku. Při léčbě starších pacientů by měly být použity nižší dávky MTX za častějších kontrol renálních parametrů. Jedním z nejzávažnějších nežádoucích účinků MTX je pancytopenie, proto je nutné pátrat po jejích časných známkách (suchý kašel, nauzea, horečka, dyspnoe, cyanóza, stomatitida, krvácení) [14, 22].
Praktické aspekty v České republice
Kontraindikace MTX jsou lékaři a plátci zdravotní péče (pojišťovnami) chápány z hlediska úhrady ze zdravotního pojištění poněkud odlišně, což může být významné při rozhodování o zahájení biologické terapie (např. biologické léky z řad anti-TNF-α je možné podat pouze u pacientů, u nichž nelze použít dva ze způsobů klasické systémové léčby [metotrexát, cyklosporin, acitretin, fototerapie] vzhledem k jejich kontraindikaci, intoleranci či nedostatečné účinnosti): podle konsenzu s VZP přítomnost absolutní kontraindikace obecně skutečně vylučuje nasazení léku, přítomnost relativní kontraindikace však značí, že lék může být podán, jen je zapotřebí zvýšené opatrnosti (tj. pečlivějšího sledování a častějších kontrol). V případě metotrexátu může taková situace v praxi nastat často například u pacientů s abnormalitami jaterních testů – aby byla elevace jaterních testů akceptována jako kontraindikace metotrexátu, musí se jednat o opakovaně patologické hodnoty, a především je třeba pátrat po jejich příčině, prokázat poruchu jaterních funkcí, stanovit diagnózu. Optimální je připojit výsledek zobrazovacího vyšetření (UZ) a nejlépe vyjádření gastroenterologa. Možným postupem (za účelem urychlení řešení) je rovněž nasazení metotrexátu, přičemž dojde-li u pacienta k dalšímu zvýšení jaterních testů, je metotrexát již jednoznačně kontraindikován [1].
Možnosti kombinované léčby
Metotrexát může být kombinován s lokální terapií či biologickou léčbou (adalimumab, etanercept, infliximab), zkušenosti s kombinovanou léčbou jsou zejména v revmatologii. Při společném podávání s monoklonálními protilátkami dávky metotrexátu 7,5–10 mg týdně pravděpodobně snižují tvorbu protilékových protilátek a zvyšují prahové hodnoty biologického léčiva. Současné podání s cyklosporinem a leflunomidem (zvýšené riziko imunosuprese) se nedoporučuje, kombinace s acitretinem (zvýšené riziko hepatotoxicity) je kontraindikována [14, 22].
CYKLOSPORIN
Cyklosporin je nejmladší lék z klasických systémových antipsoriatik. Jedná se o neutrální, silně hydrofobní cyklický oligopeptid složený z 11 aminokyselin, který byl izolován ze spor houby Tolypocladium inflatum. K terapii psoriázy byl schválen v roce 1993. V současné době je užíván v mikroemulzní lékové formě, která se vyznačuje spolehlivější absorpcí, a dávka takto podaného cyklosporinu lépe koreluje s plazmatickou hladinou léku. Cyklosporin je indikován u pacientů s těžkou ložiskovou, ale i erytrodermickou a pustulózní psoriázou [6]. Využíván je zejména ke krátkodobé terapii (3–6 měsíců), jejíž cykly je možné zopakovat. Výjimečně je užíván k dlouhodobější léčbě po dobu jednoho, nejvýše však dvou let [10, 18, 21].
Mechanismus účinku
Mechanismus účinku cyklosporinu je dán především inhibicí kalcineurinového komplexu – lék brání defosforylaci transkripčních faktorů včetně nukleárních faktorů aktivovaných T-buněk (NFAT) a jejich translokaci do buněčného jádra, kde tyto faktory spouští transkripci genů kódujících různé prozánětlivé molekuly. Vzhledem k tomu, že cyklosporin inhibuje tvorbu významných imunologických mediátorů, a to především v T-lymfocytech, a neovlivňuje funkci fagocytů, je považován za selektivní imunosupresivum, takže léčení pacienti jsou méně náchylní k infekcím než při podávání jiných imunosupresiv. Cyklosporin nevykazuje myelotoxické ani mutagenní působení, jeho účinek je reverzibilní [18].
Dávkování
Počáteční dávka cyklosporinu je 2,5–3 mg/kg/den rozdělená do dvou denních dávek (ráno a večer). Tuto dávku lze při nedostatečné odpovědi za 4–6 týdnů zvýšit na max. 5 mg/kg/den, není-li ani tato dávka dostatečně účinná, má být lék vysazen. U pacientů s těžkým postižením lze začít i dávkou 5 mg/kg/den. Po stabilizaci stavu (většinou za 10–16 týdnů) je vhodné dávku postupně snižovat (o 1 mg/kg každé 4 týdny nebo o 0,5 mg/kg/den každé 2 týdny), až je lék vysazen. Při relapsu je možné opět podat dříve účinnou dávku (pomalé vysazování léku je spojeno s nižší četností relapsů a delší dobou do relapsu). Udržovací léčba po dobu jednoho až dvou let nejnižší účinnou dávkou je možná. Tato terapie však je spojena s nárůstem rizika NÚ (arteriální hypertenze, nefrotoxicita, kožní nemelanomové nádory, popřípadě lymfomy) [18, 21].
Účinnost
Účinek cyklosporinu je patrný již za 2–4 týdny, průměrné PASI 50 se dostavuje za 4 týdny v závislosti na výši použité iniciální dávky, maximální účinek bývá patrný za 5–12 týdnů [10]. V klinických studiích byla dávka 5 mg/kg účinnější než dávka 1,25–3 mg/kg. Výsledky studií porovnávajících účinnost cyklosporinu a MTX nejsou konzistentní, nástup účinku cyklosporinu však byl mírně rychlejší v porovnání s MTX (viz výše) [14].
Nežádoucí účinky
Výskyt NÚ je obecně závislý na dávce cyklosporinu a většina NÚ odpovídá na snížení dávky léku. V některých případech může být nutná specifická léčba (antihypertenziva, statiny), popřípadě až vysazení léku. K nejčastějším NÚ cyklosporinu patří porucha funkce ledvin, elevace bilirubinu a jaterních transamináz, hypertenze, únava, třes, bolesti hlavy, gastrointestinální příznaky, parestezie, gingivální hyperplazie či hypertrichóza (tab. 7). Co se týká nefrotoxicity, u 20–70 % nemocných léčených cyklosporinem po dobu dvou let bylo detekováno zvýšení sérového kreatininu o > 30 % (ireverzibilní zvýšení hodnoty kreatininu je přitom prediktorem strukturálního postižení ledvin), výskyt a závažnost strukturálních změn koreluje s délkou léčby cyklosporinem. Terapie cyklosporinem je provázena rovněž zvýšeným rizikem lymfoproliferativních onemocnění (T - a B-buněčné lymfomy) či jiných malignit, především kožních. Výskyt malignit je závislý zejména na trvání imunosupresivní léčby a rovněž na případné současně probíhající či předchozí léčbě (fotochemoterapie, léčba MTX). Zvýšené riziko kožních malignit (především spinocelulárních karcinomů) při terapii cyklosporinem mají pacienti dříve dlouhodobě léčení fotochemoterapií, zejména při vyšší kumulativní dávce PUVA (> 200 ošetření). Léčba cyklosporinem dále může zvyšovat riziko infekcí, včetně oportunních. Cyklosporin není teratogenní, může však mít nepříznivý vliv na výsledky těhotenství (viz dále) [14].
Tab. 7. Přehled významných nežádoucích účinků cyklosporinu 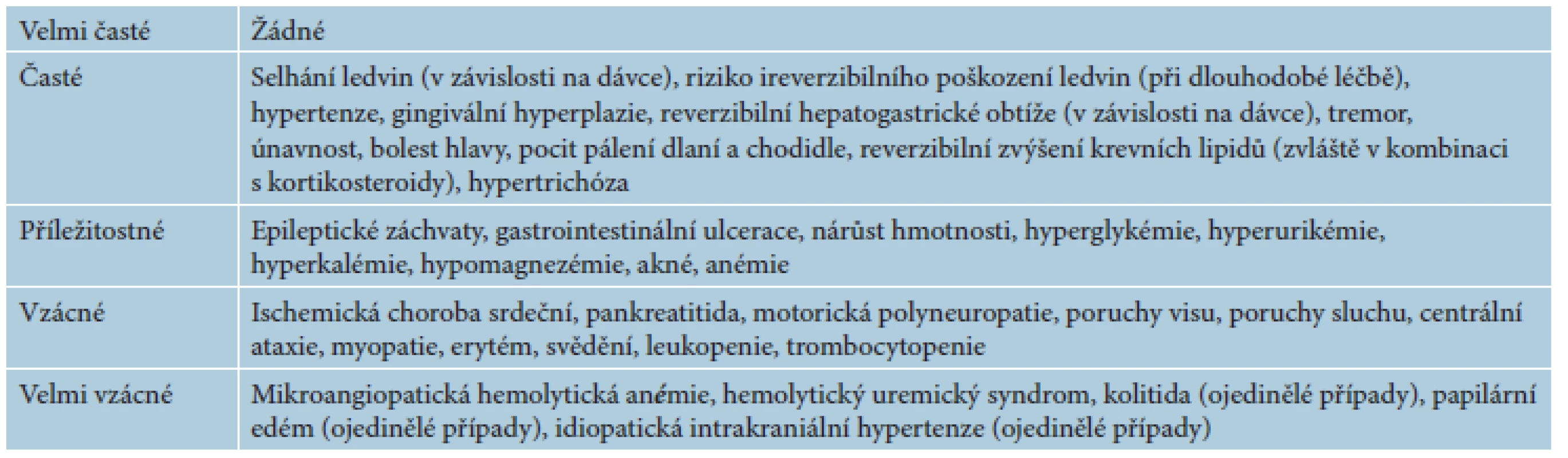
(podle [14, 18]) Kontraindikace
Absolutními kontraindikacemi podání cyklosporinu jsou porucha funkce ledvin, nekompenzovaná arteriální hypertenze, závažná infekce, přítomnost malignity či anamnéza malignity (s možnou výjimkou léčeného bazocelulárního karcinomu či anamnézy spinocelulárního karcinomu in situ) a současná léčba PUVA. K relativním kontraindikacím patří předchozí potenciálně karcinogenní léčba (např. PUVA > 1 000 J/cm2), psoriáza spuštěná závažnou infekcí či léky (betablokátory, lithium, antimalarika), závažné onemocnění jater, hypeurikémie, hyperkalémie, epilepsie, současná léčba nefrotoxickými léky, imunosupresivy, retinoidy, ricinovým olejem či fototerapií, předchozí dlouhodobá terapie MTX, onemocnění související s abúzem alkoholu či drog, těhotenství nebo kojení a očkování živými vakcínami [14, 18].
Lékové interakce
Cyklosporin, při jehož metabolismu a eliminaci se uplatňuje především CYP3A4 a P-glykoprotein, vykazuje mnohočetné lékové interakce (tab. 8). Silné inhibitory CYP3A4, jako jsou např. některé blokátory kalciových kanálů, makrolidová antibiotika, doxycyklin, gentamycin, tobramycin, ketokonazol, statiny, hormonální antikoncepce či grapefruitová šťáva, zvyšují riziko předávkování cyklosporinem, naopak silné induktory CYP3A4, jakým je karbamazepin, fenytoin, barbituráty, tiklopidin či třezalka tečkovaná, snižují plazmatickou hladinu cyklosporinu. Současné podání s MTX, aminoglykosidy, amfotericinem B, ciprofloxacinem, vankomycinem či nesteroidními antirevmatiky zvyšuje riziko nefrotoxicity, současné podávání se statiny zvyšuje riziko myopatií. Ve většině případů není současné podání zmíněných léků kontraindikováno, je však potřeba pečlivé sledování s případnou úpravou dávek cyklosporinu [18].
Tab. 8. Lékové interakce cyklosporinu 
(podle [18]) Předávkování
Při podezření na předávkování cyklosporinem je zapotřebí stanovit plazmatickou hladinu cyklosporinu, renální, jaterní parametry, hodnoty elektrolytů a přerušit léčbu cyklosporinem. Specifické antidotum cyklosporinu není k dispozici, léčba je tedy symptomatická [18].
Monitorování před zahájením léčby a v jejím průběhu
Před zahájením léčby cyklosporinem je nutné vyšetřit krevní obraz a diferenciální rozpočet leukocytů, jaterní testy, hodnoty elektrolytů (Na, K, Mg), kyseliny močové, kreatininu, cholesterolu a triglyceridů, močový sediment a krevní tlak. U žen je vhodný těhotenský test a gynekologické vyšetření. V pravidelných intervalech pak je zapotřebí kontrolovat krevní obraz a diferenciální rozpočet, jaterní testy, hodnoty elektrolytů, kreatininu, kyseliny močové a lipidů a krevní tlak (tab. 9). Dále se doporučuje kontrolovat stav kůže a sliznic (změny na dásních), pátrat po známkách infekce, gastrointestinálních nebo neurologických příznacích (třes, dysestezie) a po kloubních či muskuloskeletálních bolestech [14].
Tab. 9. Doporučené kontroly před zahájením léčby cyklosporinem a v jejím průběhu 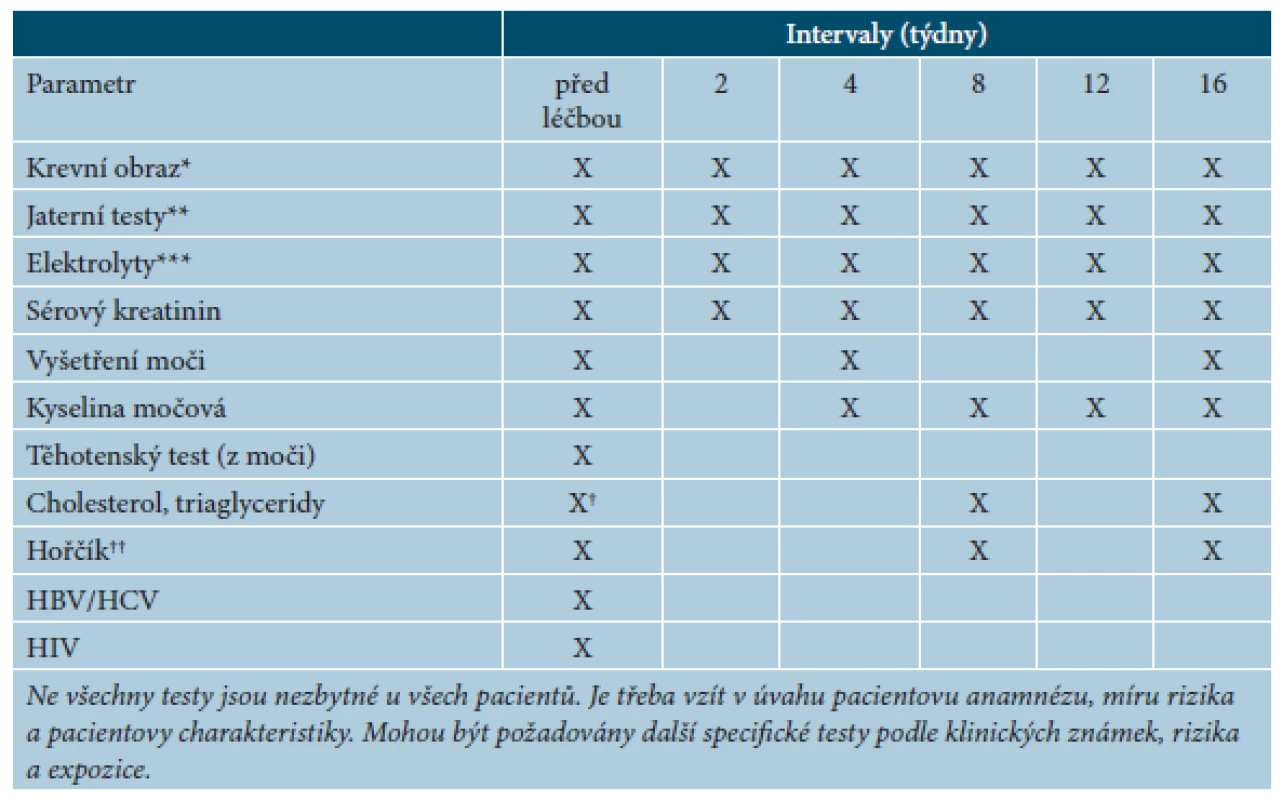
(podle [14]) *Včetně diferenciálního rozpočtu leukocytů. **Transaminázy, ALP, GGT, bilirubin. ***Sodík, draslík. †Doporučuje se dva týdny před léčbou a v den zahájení léčby (nalačno). ††Je-li indikováno (svalové křeče). Léčebná doporučení a zvláštní opatření
Cyklosporin je určen především ke krátkodobé indukční léčbě, jeho dlouhodobé podávání přichází v úvahu pouze u selektované skupiny pacientů a nemělo by přesáhnout dva roky. Je-li zapotřebí delší léčby, měl by být konzultován nefrolog a měla by být sledována clearance kreatininu.
Nemocní léčení cyklosporinem by měli být upozorněni na obsah alkoholu v kapslích (12,7 % obj. alkoholu). Vzhledem k významnému riziku lékových interakcí je při léčbě cyklosporinem nutné sledovat souběžnou medikaci (zejména léčbu statiny). U některých pacientů léčených cyklosporinem byl pozorován vznik idiopatické intrakraniální hypertenze, v takovém případě je nutné vysazení léku vzhledem k riziku trvalého poškození zraku [18].
S ohledem na potenciální riziko malignit kůže by se pacienti léčení cyklosporinem neměli vystavovat přímému slunečnímu záření a měli by používat vhodnou fotoprotekci, tato doporučení je třeba během léčby opakovat [14]. Cyklosporin by se neměl užívat v těhotenství (může vyvolávat např. preeklampsii nebo předčasný porod), během jeho podávání musí být zajištěna kontracepce (cyklosporin přitom snižuje účinnost gestagenní antikoncepce). Nedoporučuje se ani při kojení. Během léčby cyklosporinem může být méně účinná vakcinace; je nutné vyvarovat se očkování živými vakcínami [18, 21].
Zkušenosti s léčbou starších pacientů jsou omezené, u nemocných starších 50 let léčených cyklosporinem je vyšší riziko renální insuficience i výskytu kožních tumorů, měli by být proto pečlivěji sledováni [14, 18, 21].
Praktické aspekty v České republice
V praxi mohou být sporné kontraindikace cyklosporinu u pacientů s poruchou renálních funkcí, a především s hypertenzí. U nemocných s anamnézou onemocnění ledvin, elevací sérového kreatininu či poklesem glomerulární filtrace kontraindikaci cyklosporinu zdravotní pojišťovna obvykle akceptuje. Naproti tomu u pacientů s léčenou (i při použití kombinace antihypertenziv) a kompenzovanou hypertenzí lze dle stanoviska pojišťovny cyklosporin podat, ačkoliv je zapotřebí zvýšené opatrnosti. Aby byla přítomnost hypertenze (u pacienta na antihypertenzní léčbě) uznána jako kontraindikace zahájení terapie cyklosporinem, je třeba připojit vyjádření lékaře, který pacientovi předepsal antihypertenziva a sleduje ho (tj. praktický lékař či internista). Pokud je v průběhu léčby cyklosporinem zaznamenáno další zvýšení krevního tlaku, je nutné jej vysadit a je kontraindikován [1].
Možnosti kombinované léčby
Cyklosporin lze kombinovat s jakoukoliv topickou léčbou, naproti tomu podání současně s retinoidy (kompetitivní inaktivace cytochromu P450), s metotrexátem, biologiky ani fototerapií se nedoporučuje (zvýšené riziko imunosuprese) [14, 18].
ACITRETIN
Acitretin je syntetický aromatický analog kyseliny retinové. Spolu s isotretinoinem (schválen k terapii akné) a nejstarším etretinátem patří mezi retinoidy. Etretinát se již nepoužívá, byl účinnější, ale i více toxický než acitretin. Acitretin se vyznačuje kratším biologickým poločasem a nižší lipofilitou, a je proto dnes používán jako jediný systémový retinoid pro terapii psoriázy. Na rozdíl od ostatních systémových antipsoriatických léků nemá imunosupresivní účinky. Indikován je u pacientů s těžkou ložiskovou psoriázou, kde k jejímu zvládnutí nepostačuje fototerapie či lokální léčba, vhodný je i u erytrodermické či pustulózní formy [16].
Mechanismus účinku
Přesný mechanismus účinku retinoidů dosud nebyl zcela objasněn, vykazují však působení imunomodulační (inhibice IL-6-zprostředkované indukce Th17-lymfocytů, které hrají významnou úlohu v patogenezi psoriázy a podporují diferenciaci regulačních T-lymfocytů), antiproliferační (omezení proliferace epidermálních keratinocytů), prodiferenciační (normalizace keratinizace) a protizánětlivé (snížení intraepidermální migrace neutrofilů); inhibují rovněž uvolňování VEGF keratinocyty [18].
Dávkování
Léčba se obvykle zahajuje dávkou 25‒30 mg, kterou je při nedostatečné účinnosti po 3–4 týdnech možné zvýšit až na maximální dávku 75 mg. Na základě klinických zkušeností a vzhledem k optimálnímu individuálnímu účinku léčby se doporučují nižší dávky 20‒30 mg acitretinu denně, pokud má být zajištěna nejlepší snášenlivost, a více než 30 mg denně k zajištění nejvyšší účinnosti [16].
Kapsle se podávají s jídlem nebo se zapíjejí mlékem (nejlépe plnotučným). Při optimálním dávkování mají pacienti mírně suché, olupující se rty. Po dosažení remise lze léčbu přerušit, při dobré účinnosti i snášenlivosti je však možná i udržovací terapie za pravidelného klinického a laboratorního sledování (dlouhodobá léčba se však u psoriázy nedoporučuje, zkušenosti jsou jen po dobu 2 let) [16, 18].
Účinnost
Při dávce acitretinu 0,4 mg/kg zvyšované na max. 40 mg/den dosáhlo PASI 75 po 8–12 týdnech 23–30 % pacientů (13). Studie porovnávající různé dávky acitretinu (25 mg vs. 35 mg, 25 mg vs. 50 mg, 35 mg vs. 50 mg 1x denně) v indukční léčbě neprokázaly signifikantní rozdíly z hlediska dosahování PASI 75, skóre PASI na konci sledování ani skóre 0 dle PGA. Acitretin byl porovnáván rovněž s etanerceptem, přičemž byla prokázána nižší účinnost acitretinu z hlediska dosahování PASI 75 a hodnoty skóre PASI na konci sledování (indukční léčba). Při dlouhodobé terapii byla, co se týká dosahování PASI 75, zjištěna srovnatelná účinnost acitretinu i etanerceptu [14].
Nežádoucí účinky
Většina NÚ je závislá na dávce a reverzibilní (tab. 10). K nejčastějším NÚ acitretinu patří projevy hypervitaminózy A (xeróza kůže a sliznic, možná intolerance kontaktních čoček, cheilitida – nutné pravidelné promazávání kůže a používání očních kapek), vypadávání vlasů (reverzibilní), fotosenzitivita (pacienti léčení acitretinem by se neměli vystavovat přímému slunečnímu záření a měli by užívat dostatečně účinnou fotoprotekci), elevace jaterních testů či hyperlipidémie (především hypertriglyceridémie). Při hypertriglyceridémii se doporučují nejprve režimová opatření (dieta), při hodnotách triglyceridů > 5 mmol/l je indikována léčba hypolipidemiky a mělo by být zváženo vysazení acitretinu. Hyperlipidemii by měla být věnována pozornost již proto, že nemocní s psoriázou mají zvýšené kardiovaskulární riziko. Při hyperlipidémii lze v terapii acitretinem pokračovat v případě krátkodobé léčby a je-li individuální kardiovaskulární riziko nízké [14].
Tab. 10. Přehled významných nežádoucích účinků acitretinu 
(podle [14]) Při dlouhodobé terapii může docházet rovněž k poruchám osifikace skeletu. Při bolestech kostí a snížené mobilitě je indikováno RTG vyšetření, při svalových bolestech je nutné omezení nadměrné fyzické zátěže a podávají se nesteroidní antiflogistické léky. Acitretin je vysoce teratogenní [14, 16].
Kontraindikace
Absolutními kontraindikacemi podání acitretinu jsou závažná renální či hepatální insuficience a alkoholismus, u žen těhotenství, kojení, plánování početí nebo neschopnost zajistit účinnou kontracepci po dobu dvou let (podle FDA až po dobu 3 let) po ukončení léčby. Relativními kontraindikacemi jsou abúzus alkoholu, hepatitida, diabetes mellitus (léčba acitretinem může ovlivňovat metabolismus glukózy), anamnéza pankreatitidy, hyperlipidémie (především hypertriglyceridémie), popřípadě nošení kontaktních čoček [14].
Lékové interakce
Lékové interakce acitretinu jsou zcela minimální, kontraindikováno je zejména společné podávání s tetracyklinem (riziko vzniku intrakraniální hypertenze), metotrexátem či vitaminem A (tab. 11).
Tab. 11. Lékové interakce acitretinu 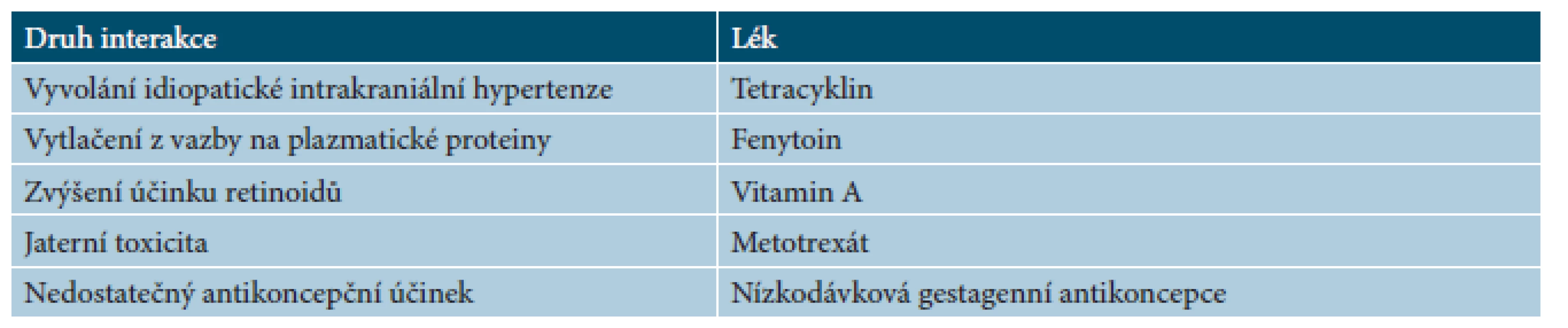
(podle [14]) Předávkování
Akutní toxicita acitretinu je nízká a její projevy po přerušení aplikace acitretinu většinou spontánně odezní. K projevům akutní intoxikace acitretinem patří bolest hlavy, nauzea a/nebo zvracení, únava, podrážděnost či svědění [14, 16].
Monitorování před zahájením léčby a v jejím průběhu
Před zahájením terapie acitretinem je nutné vyšetřit krevní obraz a diferenciální rozpočet leukocytů, jaterní testy, glykémii, hodnoty kreatininu, cholesterolu a triglyceridů. U žen je nezbytný těhotenský test. V průběhu léčby se provádí pravidelné kontroly jaterních testů, hodnot cholesterolu a triglyceridů (tab. 12). U pacientů s diabetem, obezitou, poruchami metabolismu lipidů a jinými kardiovaskulárními rizikovými faktory jsou nutné častější laboratorní kontroly. U žen ve fertilním věku by měly být 1krát měsíčně prováděny těhotenské testy. U starších nemocných jsou při dlouhodobé terapii acitretinem doporučena vyšetření zaměřená na detekci poruch osifikace skeletu [14, 16].
Tab. 12. Doporučené kontroly před zahájením léčby acitretinem a v jejím průběhu 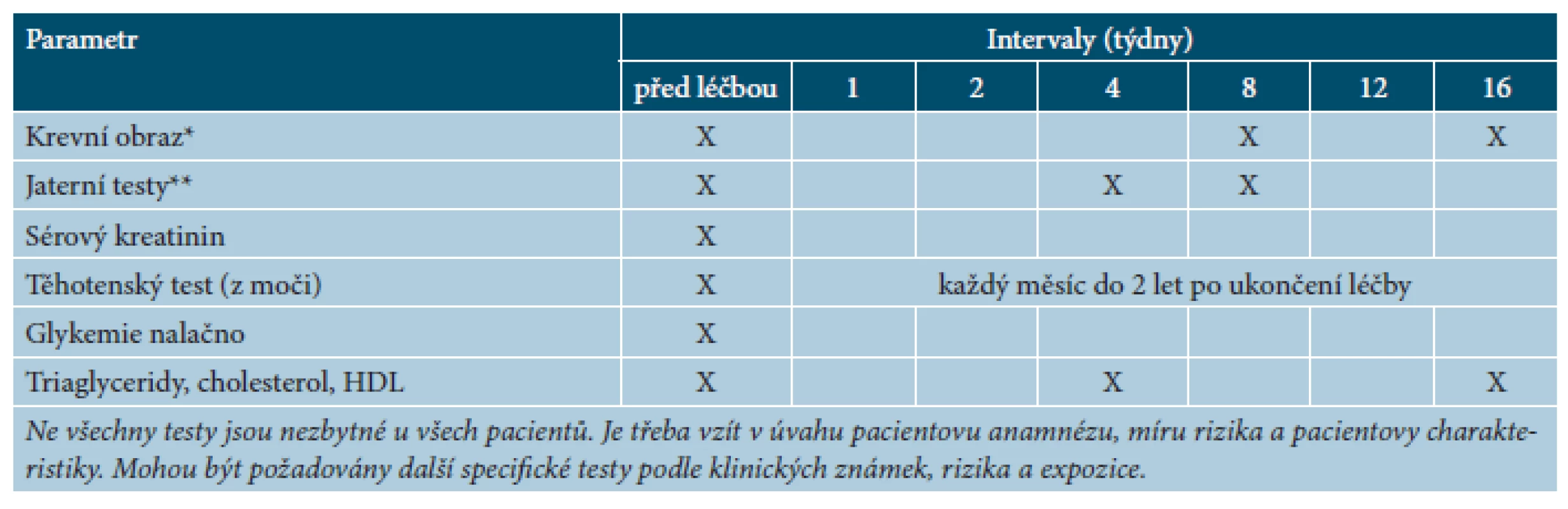
(podle [9]) *Hemoglobin, diferenciální rozpočet leukocytů **AST, ALT, ALP, GGT Léčebná doporučení a zvláštní opatření
Jak již bylo uvedeno, acitretin je vysoce teratogenní (riziko kraniofaciálních defektů, malformací srdce, cév a centrálního nervového systému, defektů kostry a thymu), během léčby a 2, respektive 3 roky po jejím ukončení je proto nutné zajištění účinné kontracepce, nejlépe dvěma metodami (acitretin snižuje účinnost nízkodávkové gestagenní antikoncepce, a proto je tento typ antikoncepce nevhodný). Léčba se zahajuje 2.–3. den menstruace a je třeba provést písemný zápis o poučení pacientky. Riziko teratogenních účinků pro ženu z ejakulátu či seminální tekutiny od muže léčeného acitretinem je minimální nebo žádné [14, 16].
V anamnéze a při klinickém vyšetřování je třeba se zaměřit na muskuloskeletální obtíže a při potížích provést příslušné zobrazovací vyšetření. Za účelem prevence elevace sérových lipidů a jaterních testů se doporučuje nízkotučná strava a abstinence alkoholu. Dárcovství krve je zakázáno v průběhu terapie a ještě rok [14] (respektive 2 roky [16]) po jejím ukončení.
Nemocní by měli být upozorněni na možné zhoršení nočního vidění zejména při obsluze vozidel v noci a na možné změny nálady včetně podrážděnosti, agresivity a deprese [16].
Praktické aspekty v České republice
V praxi může být problematická kontraindikace acitretinu u pacientů s dyslipidémií. Izolované, mírné zvýšení hodnot lipidů bez dalšího vyšetřování a interpretace zdravotní pojišťovna neakceptuje jako kontraindikaci podání acitretinu (pokud by pacient dodržoval dietu a režimová opatření, mohly by se hodnoty lipidů znormalizovat). K tomu je zapotřebí, aby měl pacient stanovenu diagnózu dyslipidémie a byl pro ni sledován. Možným postupem (za účelem urychlení řešení) je rovněž nasazení acitretinu, a dojde-li u pacienta k dalšímu zvýšení hodnot lipidů, je acitretin již jednoznačně kontraindikován [1].
Možnosti kombinované léčby
Acitretin lze kombinovat s topickou léčbou (především kalcipotriolem), vhodná je i kombinace s fototerapií, jejíž účinnost acitretin zvyšuje (RePUVA, ReUVB); kombinace zároveň umožňuje snížení dávky acitretinu, a tím i snížení rizika jeho NÚ [17]. Kombinace s etanerceptem může zvýšit účinnost léčby. Podání současně s metotrexátem (riziko hepatotoxicity) ani cyklosporinem se nedoporučuje [14].
UKONČENÍ KLASICKÉ SYSTÉMOVÉ LÉČBY A PŘECHOD Z NEBIOLOGICKÉ TERAPIE NA BIOLOGICKOU
U většiny pacientů se středně těžkou až těžkou psoriázou bývá k zajištění dlouhodobé kontroly onemocnění nutná kontinuální systémová terapie. Ukončení klasické systémové léčby po dosažení klinické odpovědi, bez výskytu kontraindikace nebo nežádoucích účinků, tedy obecně není doporučováno. Ukončení systémové terapie (náhlé či postupné) s následným pečlivým sledováním lze zvážit u nemocných s prolongovanou klinickou odpovědí a setrvalým zlepšením kvality života. U mnoha pacientů, u nichž je vysazena klasická systémová léčba, však dochází během 2–6 měsíců k opětovnému vzplanutí onemocnění [10].
Přechod na biologickou terapii je obecně indikován u pacientů, u nichž byly vyčerpány možnosti klasické systémové léčby včetně fototerapie vzhledem k nedostatečné účinnosti, nesnášenlivosti či kontraindikacím. Zahájení biologické léčby se řídí indikačními kritérii pro jednotlivé přípravky, jež lze nalézt na webových stránkách Státního ústavu pro kontrolu léčiv (www.sukl.cz).
Doporučení, jakým způsobem postupovat při převádění pacientů z nebiologické léčby na biologickou, se liší v závislosti na příčině změny terapie – u nemocných, u nichž se klasická systémová léčba ukončuje pro špatnou snášenlivost, může být nutná přestávka v terapii (dokud nedojde k normalizaci či stabilizaci patologického stavu), naproti tomu u pacientů, u kterých se klasická systémová léčba ukončuje pro nedostatečnou účinnost, je možné zahájit biologickou terapii hned po vysazení nebiologického léku nebo ještě před ním (překryv biologické a nebiologické terapie) [10]. Pokud se u pacienta manifestuje psoriatická artritida, je zapotřebí zvolit lék, který má prokázanou účinnost v terapii psoriázy i psoriatické artritidy. Nově nasazený biologický lék by měl být vždy (nehledě na příčinu změny terapie) aplikován v dávkování schváleném pro indukční terapii. Doporučený postup při přechodu z jednotlivých nebiologických léků na biologickou terapii shrnuje tabulka 13.
Tab. 13. Doporučený postup při přechodu z jednotlivých nebiologických léků na biologickou terapii 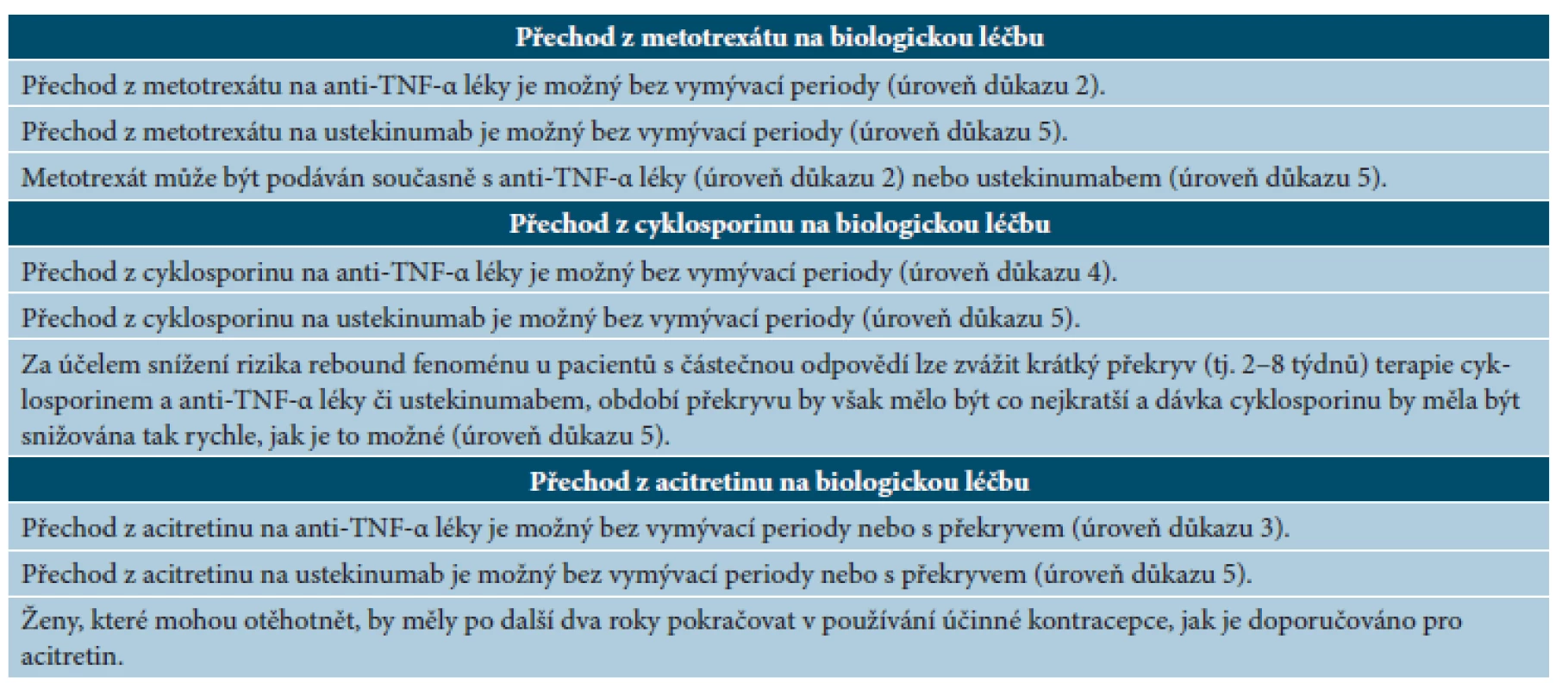
(podle [10]) Legenda k úrovni důkazů ve škále 1–5 podle Oxford Centre for Evidence-Based Medicine: úroveň 1 – nejvyšší úroveň důkazu založená na randomizovaných kontrolovaných studiích, úroveň 2 – úroveň důkazu založená na kohortových studiích vysoké kvality a randomizovaných kontrolovaných studiích nízké kvality, úroveň 3 – úroveň důkazu založená na studiích případů a kontrol vysoké kvality, úroveň 4 – úroveň důkazu založená na sérii kazuistik nebo kohortových studiích/studiích případů a kontrol nízké kvality, úroveň 5 – nejvyšší úroveň důkazu založená na názoru odborníků. ZÁVĚR
Psoriáza je poměrně časté systémové zánětlivé onemocnění, které má významný dopad na kvalitu života a psychický stav pacientů. Pojí se s četnými komorbiditami, z nichž nejvýznamnější jsou zřejmě kardiovaskulární onemocnění.
Léčba psoriázy má být komplexní a individualizovaná, měla by zahrnovat také režimová opatření, popřípadě psychoterapii. Cílem léčby je maximální snížení rozsahu a závažnosti postižení a zlepšení kvality života pacientů. Při výběru konkrétního léku je zapotřebí vzít v úvahu fenotyp a závažnost onemocnění, věk pacienta, komorbidity a souběžnou medikaci, případné plánování početí; vhodné je přihlédnout rovněž k preferencím nemocného. Systémová léčba včetně fototerapie je obecně indikována u středně těžké až těžké psoriázy, k jejímuž zvládnutí nedostačuje lokální léčba, dále u refrakterních případů a u nemocných se závažným dopadem onemocnění (postižení specifických oblastí, významné funkční omezení či psychický stres).
Fototerapie NBUVB je indikována především jako indukční léčba u pacientů se středně těžkou až těžkou psoriázou. Metotrexát je vhodný k indukční i dlouhodobé léčbě psoriázy, a to především při současném postižení kloubů; lze jej použít i u nemocných s erytrodermickou či pustulózní psoriázou. Cyklosporin se vyznačuje poměrně rychlým nástupem účinku a je určen především ke krátkodobé indukční léčbě. Jeho dlouhodobé podávání přichází v úvahu pouze u vybrané skupiny pacientů a nemělo by přesáhnout dva roky. Acitretin je indikován k indukční i dlouhodobé terapii psoriázy, účinný je i u nemocných s erytrodermickou či pustulózní formou. Vzhledem ke své teratogenitě je méně vhodný u žen fertilního věku. Kvůli možné toxicitě systémově podávaných klasických antipsoriatik jsou v průběhu této léčby nutné pravidelné laboratorní i klinické kontroly.
Do redakce došlo dne 24. 1. 2017.
Adresa pro korespondenci:
prof. MUDr. Petra Cetkovská, Ph.D.
Dermatovenerologická klinika LF UK a FN
Dr. E. Beneše 13
305 99 Plzeň
e-mail: cetkovska@fnplzen.cz
Zdroje
1. ARENBERGER, P. Setkání Center biologické léčby psoriázy. Čes-slov Derm, 2016, 91, p. 154–204.
2. BOEHNCKE, W. H., BOEHNCKE, S. More than skin-deep: the many dimensions of the psoriatic disease. Swiss Med Wkly, 2014, 144, p. 139–168.
3. ETTLER, K. Fototerapie psoriázy. Lékařské listy. 2013, http://zdravi.euro.cz/clanek/priloha-lekarske-listy/fototerapie-psoriazy-469159.
4. FELDMAN, S. R., KOO, J. Y., MENTER, A. et al. Decision points for the initiation of systemic treatment for psoriasis. J Am Acad Dermatol, 2005, 53, p. 101–107.
5. GELFAND, JM., TROXEL, AB., LEWIS, JD. et al. The risk of mortality in patients with psoriasis: results from a population based study. Arch Dermatol, 2007, 143, p. 1493–1499.
6. KOLIOS, A. G., YAWALKAR, N., ANLIKER, M. et al. Swiss S1 Guidelines on the Systemic Treatment of Psoriasis Vulgaris. Dermatology, 2016, 232, p. 385–406.
7. LEBWOHL, M. G., BACHELEZ, H., BARKER, J. et al. Patient perspectives in the management of psoriasis: results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis Survey. J Am Acad Dermatol, 2014, 70, p. 871–881.
8. MENTER, A., KORMAN, N. J., ELMETS, C. A. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents. J Am Acad Dermatol, 2009, 61, p. 451–485.
9. MENTER, A., KORMAN, N. J., ELMETS, C. A. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 5. Guidelines of care for the treatment of psoriasis with phototherapy and photochemotherapy. J Am Acad Dermatol, 2010, 62, p. 114–135.
10. MROWIETZ, U., DE JONG, E. M., KRAGBALLE, K. et al. A consensus report on appropriate treatment optimization and transitioning in the management of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol, 2014, 28, p. 438–453.
11. MROWIETZ, U., KRAGBALLE, K., REICH, K. et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res, 2011, 303, p. 1–10.
12. NALDI, L., GRIFFITHS, CEM. Traditional therapies in the management of moderate to severe chronic plaque psoriasis: an assessment of the benefits and risks. British J Dermatol, 2005, 152, p. 597–615.
13. NAST, A., BOEHNCKE, W. H., MROWIETZ, U. et al. Deutsche Dermatologische Gesellschaft (DDG); Berufsverband Deutscher Dermatologen (BVDD). S3 – Guidelines on the treatment of psoriasis vulgaris (English version). Update. J Dtsch Dermatol Ges, 2012, 10(Suppl 2), p. S1–S95.
14. NAST, A., GISONDI, P., ORMEROD, A. D. et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris – Update 2015 – Long version – EDF in cooperation with EADV and IPC. J Eur Acad Dermatol Venereol, 2015, 29, p. 2277–2294
15. National Clinical Guideline Centre. Psoriasis: Assessment and management of psoriasis. Clinical Guideline. Methods, evidence and recommendations. Issued: October 2012.
16. Neotigason 10 mg, 25 mg, Souhrn informací o přípravku, 2016.
17. OGDIE, A., WEISS, P. The Epidemiology of Psoriatic Arthritis. Rheum Dis Clin North Am, 2015, 41, p. 545–568.
18. PATHIRANA, D., ORMEROD, A. D., SAIAG, P. et al. European S3-guidelines on the systemic treatment of psoriasis vulgaris. J Eur Acad Dermatol Venereol, 2009, 23(Suppl 2), p. 1–70.
19. PRODANOVICH, S., MA, F., TAYLOR, J. R. et al. Methotrexate reduces incidence of vascular diseases in veterans with psoriasis or rheumatoid arthritis. J Am Acad Dermatol, 2005, 52, p. 262–267.
20. RAJAPPA, M., RATHIKA, S., MUNISAMY, M. et al. Effect of treatment with methotrexate and coal tar on adipokine levels and indices of insulin resistance and sensitivity in patients with psoriasis vulgaris. J Eur Acad Dermatol Venereol, 2015, 29, p. 69–76.
21. Sandimmun Neoral 25 mg, 50 mg, 100 mg, Souhrn informací o přípravku, 2015.
22. Trexan 2,5 mg, 10 mg tablety, Souhrn informací o přípravku, 2015.
23. www.dermakalk.cz
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2017 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Význam lokální oxygenoterapie a ozonoterapie pro léčbu nehojivých ran
-
Všechny články tohoto čísla
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Závažnost atopické dermatitidy podle indexu SCORAD a vztah k výskytu bronchiálního astmatu, alergické rýmy a dalším parametrům
- Panikulitida bérce jako první projev Crohnovy choroby – popis případu
-
Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy
Doporučení výboru ČDS ČLS JEP pro praxi - Klinický prípad: Diseminované červené makuly, tmavofialové papuly a nodulus s hyperkeratózou
- Kaposiho sarkom s dermatoskopickým obrazem fenoménu duhy – popis tří případů
- Odborné akce v roce 2017
-
Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti
Bratislava 12. 11. 2016 -
Zápis ze schůze výboru ČDS
Praha 8. 12. 2016 -
Doc. MUDr. Marie Nožičková, CSc.
(*7. 10. 1937 – †22. 12. 2016)
-
DOŠKOLOVÁNÍ LÉKAŘŮ
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy
Doporučení výboru ČDS ČLS JEP pro praxi - Kaposiho sarkom s dermatoskopickým obrazem fenoménu duhy – popis tří případů
- Panikulitida bérce jako první projev Crohnovy choroby – popis případu
- Závažnost atopické dermatitidy podle indexu SCORAD a vztah k výskytu bronchiálního astmatu, alergické rýmy a dalším parametrům
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



