-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
VYBRANÉ VLASTNOSTI SÚČASNÝCH ENDODONTICKÝCH SEALEROV: ČASŤ 1
SELECTED PROPERTIES OF CONTEMPORARY ENDODONTIC SEALERS: PART 1
Introduction and aims: Today's endodontics has at its disposal a myriad of materials intended for the definitive filling of root canals, which differ in their composition as well as in their physical, chemical and biological properties. The dental market strives for continuous innovation of some materials by modifying their composition, which results in a change in the properties of new preparations. The aim of this article is to compare selected properties of current endodontic sealers and thus make it clear to clinicians about the current situation on the market with these materials.
The first part of this article deals with materials based on calcium hydroxide, zinc oxide eugenol and finally, attention was paid to the gold standard in endodontics – polyepoxide material. When comparing the individual properties of these materials, their setting time, pH during solidification, radiopacity, solubility and susceptibility to root filling leaks over time, volume changes occurring during and after solidification of these materials, cytotoxicity, antibacterial properties and ability of these materials to color hard teeth were monitored tissues.
Methods, materials: By comparing the individual properties of these materials, it can be stated that each of the current endodontic sealers excels in properties that significantly differ from the others. Sealers based on calcium hydroxide thus excel mainly in strong antibacterial action and low susceptibility to discoloration of hard dental tissues and low or mild cytotoxicity due to their high pH, or other substances contained in the sealer composition, but their high solubility and susceptibility to leaks significantly deteriorates the quality of the root filling. Zinc oxide eugenol sealers have excellent antibacterial properties, but only in the first days of their action, but on the other hand they negatively affect the prognosis of endodontic treatment with their high susceptibility to leaks and cytotoxicity and also adversely affect the staining of remaining hard dental tissues. Polyepoxide sealers, due to their low solubility and low susceptibility to leakage, guarantee a quality root filling, but their antibacterial properties, however high, are only short-lived, their high cytotoxicity adversely affects periapical periodontal cells and high susceptibility to hard tooth discoloration. Excess of sealer worsens the aesthetics of an endodontically treated tooth.
Conclusion: The selection of a suitable material is therefore not easy and the clinician must consider which of the properties he will prefer in this selection and which he will instead attribute less importance to.
Keywords:
endodontic sealer – calcium hydroxide – zinc oxide eugenol – polyepoxide – properties
Autoři: M. Rosa; Y. Morozova; R. Moštěk; A. Jusku; Veronika Kováčová; L. Somolová; I. Voborná; T. Kovalský
Působiště autorů: Klinika zubního lékařství, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice, Olomouc
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 120, 2020, 4, s. 107-115
Kategorie: Přehledový článek
Souhrn
Úvod a ciel´: Súčasná endodoncia má k dispozícii nespočetné množstvo materiálov, určených k definitívnemu plneniu koreňových kanálikov, ktoré sa líšia svojím zložením a tiež aj svojimi fyzikálnymi, chemickými a biologickými vlastnosťami. Dentálny trh sa snaží o sústavnú inováciu niektorých materiálov úpravou ich zloženia, čo má za následok zmenu vlastností nových preparátov. Úlohou tohto článku je porovnať vybrané vlastnosti súčasných endodontických sealerov, a sprehľadniť tak klinickým pracovníkom situáciu, ktorá momentálne na trhu s týmito materiálmi panuje.
V prvej časti tohto článku sa pojednáva o materiáloch založených na hydroxide vápenatom, zinkoxid eugenole, a na záver je pozornosť venovaná zlatému štandardu v endodoncii – polyepoxidovým materiálom. Pri porovnávaní jednotlivých vlastností týchto materiálov bola sledovaná ich doba tuhnutia, pH pri tuhnutí, radioopacita, rozpustnosť a náchylnosť k vzniku netesností koreňovej výplne v čase, objemové zmeny prebiehajúce pri a po stuhnutí týchto materiálov, cytotoxicita, antibakteriálne vlastnosti a schopnosť týchto materiálov zafarbovať tvrdé zubné tkanivá.
Metódy, materiály: Porovnaním jednotlivých vlastností týchto materiálov možno konštatovať, že každý zo súčasných endodontických sealerov vyniká vlastnosťami, ktorými sa od ostatných výrazne odlišuje. Sealery na báze hydroxidu vápenatého vynikajú predovšetkým výrazným antibakteriálnym pôsobením a nízkou náchylnosťou k zafarbovaniu tvrdých zubných tkanív a nízkou, prípadne miernou cytotoxicitou, spôsobenou ich vysokým pH, prípadne ďalšími látkami obsiahnutými v zložení sealeru, naopak ale ich vysoká rozpustnosť a náchylnosť k vzniku netesností výrazne zhoršuje kvalitu koreňovej výplne. Zinkoxid eugenolové sealery majú výborné antibakteriálne vlastnosti, len v prvých dňoch svojho pôsobenia, ale negatívne ovplyvňujú prognózu endodontického ošetrenia svojou vysokou náchylnosťou k vzniku netesností a cytotoxicitou a taktiež nepriaznivo ovplyvňujú zafarbenie zvyšných tvrdých zubných tkanív. Polyepoxidové sealery svojou nízkou rozpustnosťou a nízkou náchylnosťou k vzniku netesností sú zárukou kvalitnej koreňovej výplne, avšak ich antibakteriálne vlastnosti sú len krátkodobé. Ich vysoká cytotoxicita nepriaznivo vplýva na bunky periapikálneho periodoncia a je vysoká náchylnosť k zafarbovaniu tvrdých zubných tkanív. Pri nedostatočnom odstránení prebytkov sealeru sa zhoršuje estetika endodonticky preliečeného zubu.
Záver: Výber vhodného materiálu nie je jednoduchý a klinický pracovník musí zvážiť, ktoré z vlastností bude pri tomto výbere preferovať a ktorým bude naopak pripisovať menšiu mieru dôležitosti.
Klíčová slova:
endodontický sealer – hydroxid vápenatý – zinkoxid eugenol – polyepoxid – vlastnosti
ÚVOD
Mikroorganizmy a ich produkty hrajú dôležitú úlohu pri rozvoji zápalových ochorení zubnej drene a periodoncia – pulpitídy a periodontitídy a taktiež úzko súvisia so zlyhaním endodontického ošetrenia [1, 2, 3]. Aj keď sa individuálne prípady líšia spektrom prítomných mikroorganizmov a taktiež sa prítomné spektrum líši v závislosti od toho, či je infekcia v periodonciu, alebo v koreňovom systéme, a tiež či ide o primárnu, alebo sekundárnu infekciu, jedná sa vždy o prevažne anaeróbnu mikroflóru [4]. Mechanické a chemické opracovanie koreňového systému má ako jeden z cieľov túto mikroflóru z koreňového systému odstrániť, čo však v skutočnosti nie je nikdy stopercentne možné a v opracovanom koreňovom systéme je vždy prítomné isté množstvo baktérií [5, 6]. Úlohou koreňovej výplne je uzavrieť rezíduum a antibakteriálnym pôsobením redukovať mikroflóru [7, 8, 9]. Vlastnosti ideálneho materiálu určeného k plneniu koreňového kanáliku sú pre väčšiu prehľadnosť uvedené v tabuľke 1 [10–12]. Žiaden z dostupných endodontických výplňových materiálov nespĺňa všetky tieto požiadavky a žiaden ideálny materiál určený k výplni koreňového systému neexistuje [13]. Najvhodnejším výplňovým materiálom je gutaperča, ktorá spĺňa najväčší počet kritérií, okrem adhézie k dentínu, a teda vzniku vrstvy nepriepustnej pre tekutiny. To musí zabezpečiť ďalší výplňový materiál, sealer, ktorý vypĺňa priestor medzi gutaperčou a stenou koreňového kanálika [14].
Na trhu existuje veľké množstvo endodontických sealerov, určených k rôznym metódam plnenia koreňových kanálikov, či už sa jedná o laterálnu, alebo vertikálnu kondenzáciu gutaperči, prípadne použitie techniky centrálneho kónusu. V závislosti od ich chemického zloženia, reakcií, ktoré prebiehajú pri tuhnutí, a finálnych produktov ich tuhnutia sa jednotlivé sealery líšia svojimi vlastnosťami.
ROZDELENIE JEDNOTLIVÝCH SEALEROV
Na základe zloženia možno súčasné endodontické sealery rozdeliť do jednotlivých kategórií, uvedených v tabuľke 2 [11, 13, 15–20]. Klasifikácia biokeramických materiálov je ale nejednotná a s neustále pribúdajúcimi materiálmi tejto kategórie je potrebné ich jasné roztriedenie. Biokeramické sealery sú rozdelené na základe najviac obsiahnutej zložky [15, 21]. Skloionomernim sealerom, ktoré sa kvôli ich pomerne krátkej dobe tuhnutia [22] v súčasnosti nepoužívajú, nie je v tomto článku venovaná pozornosť. Pre prehľadnosť boli vybrané vlastnosti jednotlivých materiálov určených k definitívnemu plneniu koreňového kanálika zosumarizované v tabuľke 3.
Sealery na báze hydroxidu vápenatého
Hydroxid vápenatý je biely prášok s nízkou rozpustnosťou vo vode a vysokým pH, okolo 12,5–12,8. Prvýkrát bol použitý v endodoncii ako prostriedok na priame prekrytie zubnej drene v dvadsiatych rokoch dvadsiateho storočia [23]. Antibakteriálne pôsobenie hydroxidu vápenatého je založené na pomalom uvoľňovaní hydroxylových aniónov vo vodnom prostredí vďaka nízkemu koeficientu rozpustnosti rovnému 0,17. Uvoľnené hydroxylové anióny sú veľmi reaktívne voľné radikály, ktorých antibakteriálny účinok je založený na poškodení cytoplazmatickej membrány bakteriálnych buniek, denaturácii proteínov a poškodení DNA baktérií. Vysoké pH hydroxidu vápenatého pri dlhodobom pôsobení taktiež nevratne deaktivuje bakteriálne enzýmy dôležité pre bakteriálny metabolizmus [24]. Práve pre tieto vlastnosti boli vyvinuté sealery na báze hydroxidu vápenatého, od ktorých sa taktiež sľubovala podpora osteogenézy a cementogenézy [25].
Chemická reakcia tuhnutia prebiehajúca medzi bázou a katalyzátorom, prípadne aktivátorom, kompletne prebehne a sealer stuhne približne za jednu až šesť hodín, v závislosti na zložení sealeru [25, 26]. V niektorých klinických štúdiách, pri ktorých boli nastavené podmienky podobné podmienkam vládnucim v ošetrovaných koreňových kanálikoch, však tieto sealery tuhli až štyri týždne [27]. Je to pravdepodobne spôsobené zložením týchto sealerov, kedy u niektorých prebieha chemická reakcia medzi vodou pochádzajúcou z dentínových tubulov a oxidom vápenatým týchto sealerov, za vzniku hydroxidu vápenatého, čo spomaľuje reakciu tuhnutia sealeru [26]. U iných sealerov je zas vlhkosť potrebná k priebehu chemickej reakcie. Voda sa však v dentínových tubuloch nachádza len v obmedzenej miere a po jej vyčerpaní prebieha chemická reakcia tuhnutia len veľmi pomaly [27]. Pri tuhnutí majú tieto sealery, podobne ako hydroxid vápenatý, vďaka uvoľňovaniu hydroxylových aniónov vysoké pH, ktoré si dokážu udržať v zásaditých hodnotách po dobu jedného a viac týždňov [26, 28]. Prídavok radioopáknych látok činí tieto sealery röntgen kontrastnými, s radioopacitou ekvivalentnou 3–6 mm hliníku, čo je v rámci noriem ISO, ako aj ANSI/ADA [28, 29].
Po stuhnutí dochádza u týchto sealerov k miernemu zväčšeniu objemu, podobnému ako u sealerov na báze polyepoxidových živíc [26]. To je pravdepodobne spôsobené absorpciou vody z dentínových tubulov, čo umožňuje ďalší priebeh chemickej reakcie s výsledným miernym nárastom objemu týchto sealerov [30]. Pri kontakte s vodou dochádza k stuhnutiu sealeru na jeho povrchu, avšak vo svojej hĺbke môže mať stále menej tuhú, cestovitú konzistenciu. To môže viesť k vzniku porozít, ktoré uľahčujú ďalšiu absorpciu vody, čo má za následok pokračovanie chemickej reakcie medzi jednotlivými zložkami sealeru. Dochádza k ďalšej objemovej expanzii, ale aj nepriaznivému ovplyvneniu rozpustnosti sealerov, ktorá je podstatne vyššia ako u sealerov polyepoxidových [31, 32].
Vysoká rozpustnosť je aj príčinou ich miernej až stredne vysokej cytotoxicity, ktorá je ale menšia v porovnaní s polyepoxidovými alebo zinkoxideugenolovými sealermi a ktorú tieto sealery vykazujú po dobu približne dvoch týždňov od aplikácie [33, 34, 35]. Vďaka vysokej rozpustnosti sa totiž výrazne zvyšuje disociácia hydroxidu vápenatého na hydroxylové anióny, čo signifikantne zvyšuje pH a zároveň aj zápalovú odpoveď periodoncia [34, 33]. Ďalšie látky obsiahnuté v týchto sealeroch, ako napríklad polymetylénmetylsalicylátová živica alebo isobutyl salicylát, taktiež pôsobia cytotoxicky na bunky periodontálnych ligament [34].
Existuje len málo štúdií zaoberajúcich sa schopnosťou týchto sealerov zafarbovať tvrdé zubné tkanivá, avšak táto nežiaduca vlastnosť bola potvrdená, aj keď nie v takej miere ako u polyepoxidových, prípadne zinkoxid-eugenolových sealerov [36].
Sealery na báze hydroxidu vápenatého vykazujú dobrý apikálny uzáver, a to hlavne v prvých dňoch po ich aplikácií [37]. Je to spôsobené pravdepodobne ich dobrou adaptáciou k dentínu, a to predovšetkým v apikálnej a strednej tretine koreňového kanálika [28]. Ich vysoká rozpustnosť ale zapríčiňuje veľkú náchylnosť k vzniku netesností koreňovej výplne, ktorá sa prejaví až s odstupom času [30, 37, 38].
Antibakteriálna aktivita týchto sealerov je založená práve na pôsobení hydroxidu vápenatého [25]. Enterococcus faecalis je však voči pôsobeniu hydroxidu vápenatého odolný, predovšetkým ak je organizovaný v biofilme [39]. Enterococcus faecalis dokáže vysoké pH pufrovať zapojením protónovej pumpy, avšak len do pH rovného 11,5 [40]. Taktiež je vplyvom rastu v alkalických podmienkach schopný silnejšie adherovať ku kolagénu, čo zvyšuje jeho infekčnosť a tiež zvyšuje pravdepodobnosť vzniku reziduálnej infekcie [41]. Ďalším mikroorganizmom spojeným s infekciami odolnými voči endodontickej liečbe je Candida albicans, ktorá je taktiež odolná voči pôsobeniu hydroxidu vápenatého, najmä ak je prítomná v podobe biofilmu [40]. Taktiež je vplyvom rastu v alkalických podmienkach schopná silnejšie adherovať ku kolagénu, čo zvyšuje jej infekčnosť a tiež zvyšuje pravdepodobnosť vzniku reziduálnej infekcie [41, 42]. Vápnik v hydroxide vápenatom podporuje adherenciu Candidy ku kolagénu, vysoké pH zas podporuje Candidu k tvorbe hýf, ktoré penetrujú hlboko do dentínových tubulov, čím zvyšujú infekčnosť tohto mikroorganizmu [41, 43]. Aj napriek týmto nepriaznivým skutočnostiam vykazujú tieto sealery vysokú antibakteriálnu aktivitu [44, 45], ktorá sa prejaví minimálne po 20 minútach kontaktu sealeru s bakteriálnou kultúrou, pričom túto si dokážu udržať tiež s odstupom času po stuhnutí, kedy aj sedem dní od ich namiešania stačí dvadsaťminútový kontakt stuhnutého sealeru s bakteriálnou kultúrou, aby sa ich antibakteriálne vlastnosti signifikantne prejavili [45, 46]. Ich výborné antibakteriálne vlastnosti potvrdili aj testy vykonávané na blokoch dentínu, v ktorých sa však ukázalo, že antibakte - riálne pôsobenie týchto sealerov je úzko späté s ich zložením. Vzostup pH niektorých sealerov založených na hydroxide vápenatom nemusí byť dostatočný na ovplyvnenie bakteriálnej kultúry nachádzajúcej sa v hĺbke dentínových tubulov [9].
Sealery na báze zinkoxid eugenolu
Prvé sealery na báze zinkoxid eugenolu vznikli v prvej polovici 20. storočia, na základe pôvodnej receptúry Dr. Louisa I. Grossmana. Tieto sealery tuhnú chelatačnou reakciou prebiehajúcou medzi oxidom zinočnatým a eugenolom, pričom táto reakcia prebieha v rozmedzí 10–26 hodín. Čas tuhnutia ovplyvňuje hlavne miera vlhkosti [13, 47]. Látky zaisťujúce týmto sealerom radioopacitu, ktorá je ekvivalentná 4 mm hliníku, sú totiž málo rozpustné vo vode, čím predlžujú ich čas tuhnutia [26]. Pri tuhnutí majú tieto sealery mierne kyslé pH, ktoré si dokážu udržať po dobu piatich týždňov [47].
U väčšiny týchto sealerov dochádza k ich miernej kontrakcii, porovnateľnej s niektorými kalciumsilikátovými sealermi, avšak u niektorých dochádza po stuhnutí ku zväčšeniu ich objemu, porovnateľnému so sealermi na báze hydroxidu vápenatého [26, 48]. Rozpustnosť týchto sealerov sa líši v závislosti od výrobcu. Rozpustnosť týchto sealerov je porovnateľná alebo vyššia ako u polyepoxidových sealerov a je pravdepodobne zapríčinená vylúhovaním nezreagovaného eugenolu zo stuhnutého sealeru a taktiež hydrolýzou vzniknutého eugenolátu zinočnatého na hydroxid zinočnatý a eugenol [47, 49, 50].
Jednou z nežiadúcich vlastností týchto sealerov je ich vysoká cytotoxicita, ktorá je hodinu po ich aplikácií porovnateľná s polyepoxidovými sealermi a ktorá sa pohybuje v stredných hodnotách aj po dvoch týždňoch, kedy už sealery založené na báze polyepoxidových živíc vykazujú len minimálne hodnoty cytotoxicity [33]. Je to pravdepodobne spôsobené uvoľňovaním nezreagovaného eugenolu ako aj uvoľnovaním formaldehydu z niektorých zinkoxideugenolových sealerov po ich stuhnutí [51]. Uvoľňovanie eugenolu z týchto sealerov má za následok aj ďalšiu ich nevítanú vlastnosť, a to zafarbovanie tvrdých zubných tkanív, ktoré sa prejaví už jeden týždeň od ich aplikácie (obr. 1). Dochádza k oxidácii uvoľneného eugenolu, čo spôsobí zníženie jasu a žltočervené sfarbenie tvrdých zubných tkanív [52].
Obr. 1. Zub zafarbený zinkoxideugenolovým sealerom
Fig. 1 Tooth discolored by zinc-oxide eugenol based sealer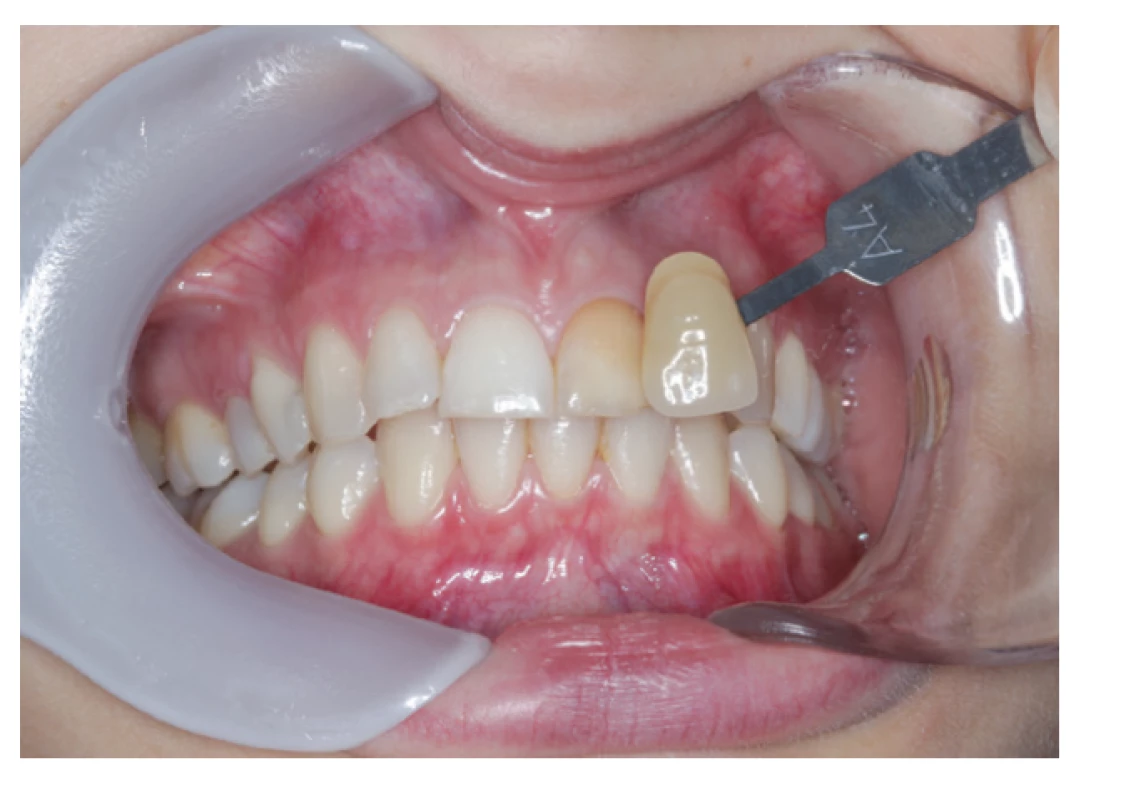
Vysoká náchylnosť k vzniku netesností koreňovej výplne je taktiež slabou stránkou týchto sealerov [38]. Medzi sealerom a dentínovou stenou koreňového kanálika sú prítomné časté medzery, spôsobené degradáciou eugenolátu zinočnatého oxidom uhličitým, ktorý je v periapikálnej oblasti prítomný vo forme bikarbonátových iónov, ako aj ich častou kontrakciou po stuhnutí [38, 53]. Túto nepriaznivú vlastnosť môže do istej miery vyvažovať fakt, že nezreagovaný eugenol podporuje expanziu gutaperči, čím je možné zlepšenie tesnosti koreňovej výplne [54], ako aj existencia chemickej väzby medzi gutaperčou a zinkoxideugenolovým sealerom zapríčinená chelatačnou reakciou medzi oxidom zinočnatým gutaperči a eugenolom sealeru [13, 54]. Táto väzba je však veľmi slabá, a to najviac vplyvom prítomnosti početných porozít [ 53].
Tieto sealery sa vyznačujú svojou vysokou antibakteriálnou aktivitou, a to hlavne voči fakultatívne anaeróbnym baktériám, ktorou sa približujú sealerom založeným na polyepoxidových živiciach. Ich antimikrobiálne vlastnosti však rýchlo klesajú a po 72 hodinách sú prakticky nulové [46, 55]. V prvých 24 hodinách si ale dokážu udržať svoje antibakteriálne vlastnosti konštantné [56]. Čerstvo namiešané zinkoxideugenolové sealery vykazujú vysokú antibakteriálnu aktivitu, ktorá sa prejaví už po 20 minútach kontaktu s kultúrou E. faecalis, avšak sedem dní starý sealer nedokáže ani po 60 minútach signifikantne znížiť koncentráciu baktérií, čo potvrdzuje ich krátkodobé antibakteriálne vlastnosti [45]. Eugenol uvoľňovaný z týchto sealerov dokáže penetrovať do podstatnej hĺbky dentínových tubulov, a ovplyvňovať tak aj bakteriálne kolónie vzdialené od koreňového kanálika, čo potvrdil Saleh a kol., ktorí vo svojich testoch zistili, že zinkoxideugenolový sealer dokáže výrazne ovplyvniť kolónie E. faecalis v dentínových tubuloch až do hĺbky 300 μm od steny koreňového kanálika [9].
Polyepoxidové sealery
Sealery na báze polyepoxidových živíc (obr. 2, 3) boli prvýkrát vyvinuté v polovici 20. storočia a tuhnú reakciou medzi bázou a katalyzátorom [57]. Sealer definitívne stuhne približne za 2,5–16 hodín, v závislosti od výrobcu [10, 26, 58, 59]. Táto relatívne dlhá doba tuhnutia je spôsobená pomalou polymeračnou reakciou epoxidových živíc a taktiež k tomu môže prispievať prídavok málo rozpustných radioopáknych látok [26, 58]. Urýchlenie tejto reakcie je možné vďaka prídavku katalyzátorov, ktoré sú súčasťou zloženia niektorých polyepoxidových sealerov [10]. Pri tuhnutí sú tieto sealery v závislosti od zloženia mierne kyslé, s postupným vzostupom pH k neutrálnym hodnotám, prípadne zásadité, čo môže prispievať k antibakteriálnym a osteogenickým vlastnostiam týchto sealerov, ako aj k ich biokompatibilite [10, 47, 60].
Obr. 2. Čerstvo namiešaný polyepoxidový sealer AH26® Silverfree
Fig. 2 Freshly mixed poly-epoxide sealer AH26® Silverfree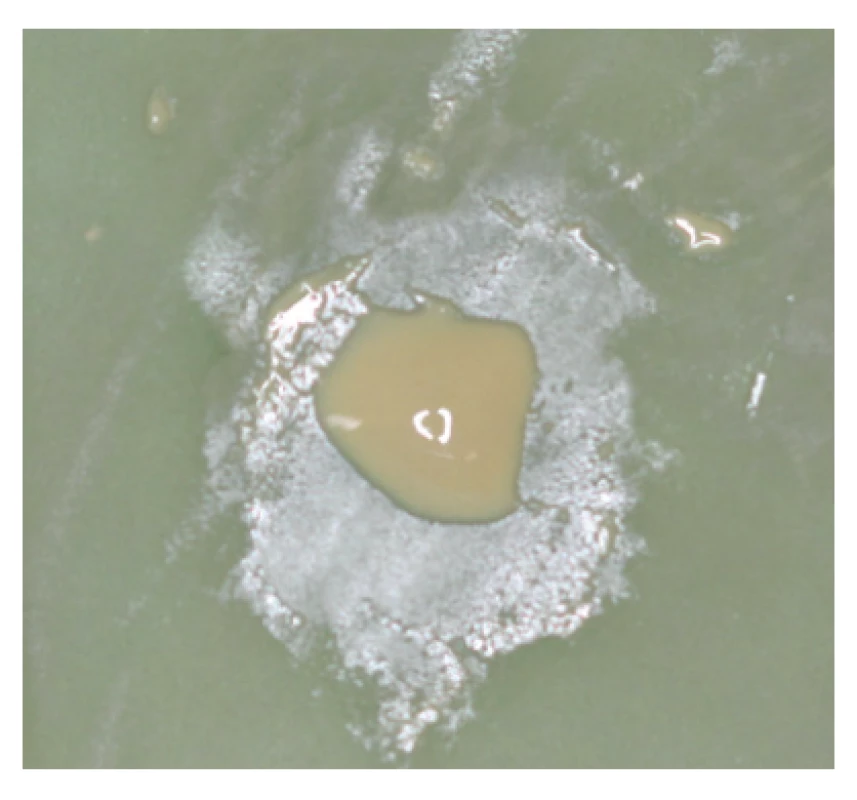
Obr. 3. Čerstvo namiešaný polyepoxidový sealer AD Seal™
Fig. 3 Freshly mixed poly-epoxide sealer AD Seal™
Za svoju radioopacitu, ktorá sa pohybuje v rozmedzí 6–14 mm Al [10, 58–61] vďačia tieto sealery obsahu látok, ako je napríklad oxid zirkoničitý alebo wolframan vápenatý [26] (obr. 4). Takýto veľký rozsah v hodnotách radioopacity môže byť zapríčinený skutočnosťou, že radioopákne látky sa ukladajú v hlbších vrstvách sealeru, zatiaľ čo vrchné vrstvy sealeru sú chudobnejšie na obsah týchto látok, čo mohlo spôsobiť rozdiely v nameraných hodnotách jednotlivých výskumov [10].
Obr. 4. koreňové kanáliky zaplnené polyepoxidovým sealerom AD Seal™ a gutaperčou
Fig. 4 Root canal obturated with poly-epoxide sealer AD Seal™ and gutta-percha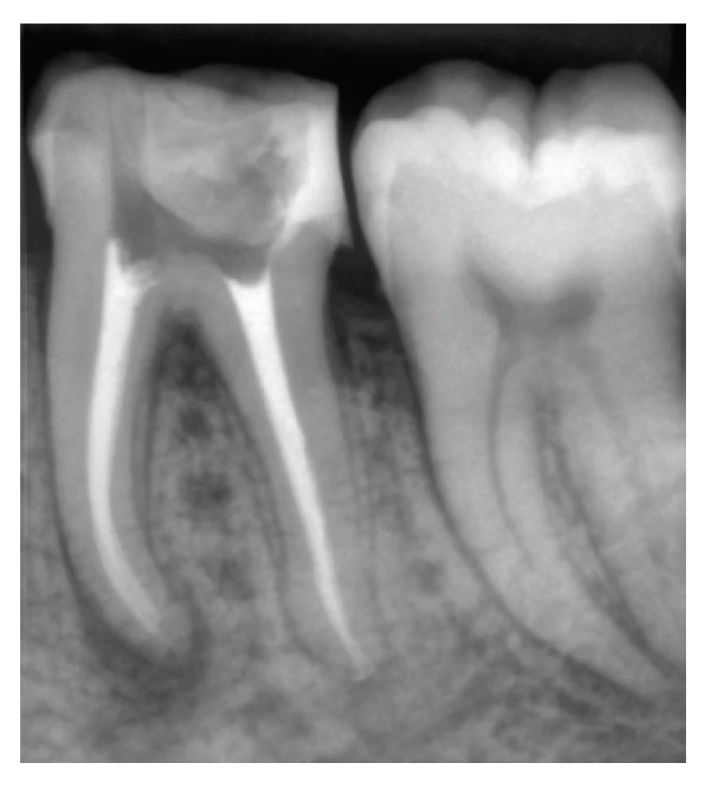
Po stuhnutí dochádza u týchto sealerov, v závislosti od ich zloženia, k miernemu, prípadne stredne veľkému zväčšeniu ich objemu, ktoré je pravdepodobne spôsobené absorpciou vody po ich polymerizácií [10, 60, 58–61]. Ide o proces, prebiehajúci na základe difúzie hlavne v matrix polyepoxidových sealerov, ktorý vychádza z polárnej povahy týchto materiálov [58].
Hexametylén tetraamín – pôvodné zloženie polyepoxidového sealeru, komerčne známeho pod názvom AH 26®, (DENTSPLY De Trey, GmbH, Konstanz, Nemecko), ktorý obsahoval hexametylén tetraamín ako jednu zo svojich základných zložiek, bolo príčinou vyššej rozpustnosti tohto materiálu, kedy dochádzalo k degradácií hexametylén tetraamínu na amoniak a formaldehyd. Novšia generácia, na trhu dostupná pod názvom AH Plus® (DENTSPLY DeTrey GmbH De-Trey, Konstanz, Nemecko), už však túto látku neobsahuje, z čoho vyplýva aj jej nižšia rozpustnosť [50]. Sealery založené na báze polyepoxidových živíc majú veľmi nízku rozpustnosť v tkanivových tekutinách [47, 58–60]. Tá je pravdepodobne dôsledkom reakcie amínových skupín so skupinami epoxidovými, výsledkom čoho je tvorba pevne zosieťovaného a málo rozpustného polyméru [62].
Nepriaznivou vlastnosťou týchto materiálov je ich stredne vysoká až vysoká cytotoxicita, prejavujúca sa už krátko po ich aplikácií a udržujúca si svoje vysoké hodnoty počas prvých troch dní od ich aplikácie [33]. S postupom času ich cytotoxicita pomaly klesá, avšak nulovú cytotoxicitu sa nepodarilo preukázať ani po piatich týždňoch od aplikácie [63]. Toxické pôsobenie týchto materiálov na bunky periodontálnych ligament je pravdepodobne spôsobené uvoľňovaním ich nezreagovaných zložiek, ako je napríklad Bisfenol-A diglycidyleter, ktorý má mutagénne účinky, ale aj uvoľnovaním amino - a epoxizlúčenín [64]. Ďalšou nežiadúcou vlastnosťou týchto sealerov je ich vysoký potenciál k zafarbovaniu tvrdých zubných tkanív [36]. U preparátu AH 26® dochádzalo vplyvom obsahu strieborných iónov k ich tmavému sfarbeniu, avšak sivé zafarbenie tvrdých zubných tkanív spôsobené sealerom AH Plus®, ktorý už vo svojom zložení strieborné ióny neobsahuje, naznačuje, že na zafarbení tvrdých zubných tkanív sa podieľajú aj ďalšie zložky týchto sealerov [52, 65].
Sealery na báze polyepoxidových živíc sa vyznačujú svojou malou náchylnosťou k vzniku netesností koreňovej výplne, prameniacej z ich expanzie pri tuhnutí, ako aj dobrej zatekavosti a relatívne dobrej adhézie k dentínu [10, 13, 30, 37, 58–61].
Čerstvo namiešané polyepoxidové sealery majú vysokú antibakteriálnu aktivitu, kedy dvojminútový kontakt sealeru s bakteriálnou kultúrou dokázal významnou mierou ovplyvniť počet žijúcich buniek tejto kultúry a po piatich minútach styku sealeru s kultúrou E. faecalis táto nevykazovala prítomnosť životaschopných baktérií [45]. Takto vysoká antibakteriálna aktivita je možná pravdepodobne práve kvôli obsahu Bisfenolu-A v základnom zložení sealeru ako aj uvoľňovaniu formaldehydu pri tuhnutí, pričom obe látky sú pre E. faecalis toxické [66]. Túto teóriu potvrdzuje aj fakt, že stuhnutý, jeden deň starý sealer potreboval až šesťdesiatminútový kontakt s bakteriálnou kultúrou, aby znížil množstvo žijúcich baktérií a sealer starší ako tri dni kultúru E. faecalis neovplyvnil vôbec [44, 45]. V testoch na blokoch dentinu, si však polyepoxidové sealery dokázali udržať svoju antibakteriálnu aktivitu približne konštantnú, a to minimálne po dobu jedného týždňa [67]. V týchto testoch sa taktiež ukázala ich schopnosť penetrovať do dentínových tubulov a ovplyvňovať tak kolónie E. faecalis v hĺbke 300 μm od steny koreňového kanálika [9].
ZÁVER
Výber vhodného materiálu určeného k definitívnemu plneniu koreňového kanáliku je vzhľadom na odlišnosť niektorých vlastností týchto materiálov mnohokrát neľahká úloha. Cieľom tohto článku bolo podať stručný a ucelený prehľad vlastností jednotlivých skupín týchto materiálov, pričom možno konštatovať, že žiaden z dostupných materiálov nespĺňa požiadavky kladené na ideálny výplňový materiál v endodoncii a je potrebné voliť určitý kompromis. Sealery na báze hydroxidu vápenatého vynikajú svojimi dlhodobými antibakteriálnymi vlastnosťami a minimálnou cytotoxicitou ako aj minimálnou náchylnosťou k zafarbovaniu tvrdých zubných tkanív. Zinkoxideugenolové sealery majú taktiež vynikajúce antibakteriálne vlastnosti, avšak len krátkodobé. Polyepoxidové sealery sa vyznačujú predovšetkým svojimi krátkodobými antibakteriálnymi vlastnosťami, ako aj nízkou rozpustnosťou a nízkou náchylnosťou k vzniku netesností.
MDDr. Matej Rosa
Klinika zubního lékařství LF UP a FN
Palackého 12
772 00 Olomouc
e-mail: matej.rosa@gmail.com
Zdroje
1. Sundqvist G. Bacteriological studies of necrotic dental pulps. Umae Univ Odontol, Dissertation. 1976; 94.
2. Rôças IN, Siqueira JF. Characterization of microbiota of root canal-treated teeth with posttreatment disease. J Clin Microbiol. 2012; 50(5): 1721–1724.
3. Tabassum S, Khan FR. Failure of endodontic treatment: The usual suspects. Eur J Dent. 2016; 10(1): 144–147.
4. Sakko M, Tjäderhane L, Rautemaa-Richardson R. Microbiology of root canal infections. Prim Dent J. 2016; 5(2): 84–89.
5. Waltimo T, Trope M, Haapasalo M, Ørstavik D. Clinical efficacy of treatment procedures in endodontic infection control and one year follow-up of periapical healing. J Endod. 2005; 31(12): 863–866.
6. Fabricius L, Dahlén G, Sundqvist G, Happonen RP, Möller AJR. Influence of residual bacteria on periapical tissue healing after chemomechanical treatment and root filling of experimentally infected monkey teeth. Eur J Oral Sci. 2006; 114(4): 278–285.
7. Özcan E, Eldeniz AU, Ari H. Bacterial killing by several root filling materials and methods in an ex vivo infected root canal model. Int Endod J. 2011; 44(12): 1102–1109.
8. Wu MK, Dummer PMH, Wesselink PR. Consequences of and strategies to deal with residual post-treatment root canal infection. Int Endod J. 2006; 39(5): 343–356.
9. Saleh IM, Ruyter IE, Haapasalo M, Ørstavik D. Survival of Enterococcus faecalis in infected dentinal tubules after root canal filling with different root canal sealers in vitro. Int Endod J. 2004; 37(3): 193–198.
10. Lee JK, Kwak SW, Ha JH, Lee WC, Kim HC. Physicochemical properties of epoxy resin-based and bioceramic-based root canal sealers. Bioinorg Chem Appl 2017. 2017; 2582849. doi: 10.1155/2017/2582849.
11. Torabinejad M, Fouad AF, Walton RE. Endodontics: principles and practice. 5. vydání. Philadelphia: Elsevier Saunders; 2014, 322–324.
12. Castellucci A. Endodontics. Volume II. 1. vydání. Florencie: Edizioni Odontoiatriche Il Tridente; 2005, 610.
13. Tyagi S, Tyagi P, Mishra P. Evolution of root canal sealers: An insight story. Eur J Gen Dent. 2013; 2(3): 199–218.
14. Li GH, Niu LN, Zhang W, Olsen M, De-Deus G, Eid AA. Ability of new obturation materials to improve the seal of the root canal system: A review. Acta Biomaterialia. 2014; 10(3): 1053–1063.
15. Al-Haddad A, Che Ab Aziz ZA. Bioceramic-based root canal sealers: A review. Int J Biomater. 2016; 9753210. doi:10.1155/2016/9753210.
16. Raghavendra SS, Jadhav GR, Gathani KM, Kotadia P. Bioceramics in endodontics – a review. J Istanbul Univ Fac Dent. 2017; 51(3 Suppl 1): S128–S137.
17. Singh H, Markan S, Kaur M, Gupta G. “Endodontic sealers”: Current concepts and comparative analysis. Dent Open J. 2015; 2(1): 32–37.
18. Siboni F, Taddei P, Zamparini F, Prati C, Gandolfi MG. Properties of bioroot RCS, a tricalcium silicate endodontic sealer modified with povidone and polycarboxylate. Int Endod J. 2017; 50(Suppl 2): e120–e136.
19. Jafari F, Jafari S. Composition and physicochemical properties of calcium silicate based sealers: A review article. J Clin Exp Dent. 2017; 9(10): e1249–e1255.
20. Žižka R, Šedý J, Škrdlant J, Kučera P, Čtvrtlík R, Tomaštík J. Kalciumsilikátové cementy. 1. část: Vlastnosti a rozdělení. LKS. 2018; 28(2): 37–43.
21. Munitić MS, Peričić TP, Utrobičić A, Bago I, Puljak L. Antimicrobial efficacy of commercially available endodontic bioceramic root canal sealers: A systematic review. PLoS One. 2019; 14(10): 0223575. doi: 10.1371/journal.pone.0223575.
22. Peřinka L, Bartůšková Š, Záhlavová E. Základy klinické endodoncie. Praha: Quintessenz; 2003, 288.
23. Mohammadi Z, Dummer PMH. Properties and applications of calcium hydroxide in endodontics and dental traumatology. Int Endod J. 2011; 44(8): 697–730.
24. Mohammadi Z, Shalavi S, Yazdizadeh M. Antimicrobial activity of calcium hydroxide in endodontics: a review. Chonnam Med J. 2012; 48(3): 133–140.
25. Komabayashi T, Colmenar D, Cvach N, Bhat A, Primus C, Imai Y. Comprehensive review of current endodontic sealers. Dent Mater J [Internet]. 2020 Mar 24; Available from: https://www.jstage.jst.go.jp/article/dmj/advpub/0/advpub_2019-288/_article.
26. Marín-Bauza GA, Silva-Sousa YTC, da Cunha SA, Rached FJA, Bonetti-Filho I, Sousa-Neto MD. Physicochemical properties of endodontic sealers of different bases. J Appl Oral Sci. 2012; 20(4): 455–461.
27. Allan NA, Walton RC, Schaeffer MA. Setting times for endodontic sealers under clinical usage and in vitro conditions. J Endod. 2001; 27(6): 421–423.
28. Cañadas PS, Berástegui E, Gaton-Hernández P, Silva LA, Leite GA, Silva RS. Physicochemical properties and interfacial adaptation of root canal sealers. Braz Dent J. 2014; 25(5): 435–441.
29. Tanomaru-Filho M, Jorge EG, Tanomaru JMG, Gonçalves M. Evaluation of the radiopacity of calcium hydroxide - and glass-ionomer-based root canal sealers. Int Endod J. 2008; 41(1): 50–53.
30. Ballullaya SV, Vinay V, Thumu J, Devalla S, Priyadarshini BI, Balla S. Stereomicroscopic dye leakage measurement of six different root canal sealers. J Clin Diagnostic Res. 2017; 11(6): ZC65–68.
31. Borges RP, Sousa-Neto MD, Versiani MA, Rached-Júnior FA, De-Deus G, Miranda CE, Pécora JD. Changes in the surface of four calcium silicate-containing endodontic materials and an epoxy resin-based sealer after a solubility test. Int Endod J. 2012; 45(5): 419–428.
32. Colombo M, Poggio C, Dagna A, Meravini MV, Riva P, Trovati F, Pietrocola G. Biological and physico-chemical properties of new root canal sealers. J Clin Exp Dent. 2018; 10(2): e120–e126.
33. Jagtap P, Shetty R, Agarwalla A, Wani P, Bhargava K, Martande S. Comparative evaluation of cytotoxicity of root canal sealers on cultured human periodontal fibroblasts: In vitro study. J Contemp Dent Pract. 2018; 19(7): 847–852.
34. Kaur A, Shah N, Logani A, Mishra N. Biotoxicity of commonly used root canal sealers: A meta-analysis. J Conservative Dent. 2015; 18(2): 83–88.
35. Scelza MZ, Coil J, Alves GG. Effect of time of extraction on the biocompatibility of endodontic sealers with primary human fibroblasts. Braz Oral Res. 2012; 26(5): 424–430.
36. Tour Savadkouhi S, Fazlyab M. Discoloration potential of endodontic sealers: A brief review. Iran Endod J. 2016; 11(4): 250–254.
37. Muneeb Lone M, Raza Khan F, Ahmed Lone M. Evaluation of microleakage in single-rooted teeth obturated with thermoplasticized gutta-percha using various endodontic sealers: an in-vitro study. J Coll Physicians Surg Pakistan. 2018; 28(5): 339–343.
38. Patni PM, Chandak M, Jain P, Patni MJ, Jain S, Mishra P, Jain V. Stereomicroscopic evaluation of sealing ability of four different root canal sealers – an invitro study. J Clin Diagnostic Res. 2016; 10(8): ZC37–39.
39. Zancan RF, Vivan RR, Milanda Lopes MR,Weckwerth PH, de Andrade FB, Ponce JB. Antimicrobial activity and physicochemical properties of calcium hydroxide pastes used as intracanal medication. J Endod. 2016; 42(12): 1822–1828.
40. Evans M, Davies JK, Sundqvist G, Figdor D.Mechanisms involved in the resistance of Enterococcus faecalis to calcium hydroxide. Int Endod J. 2002; 35(3): 221–228.
41. Zancan RF, Calefi PHS, Borges MMB, Lopes MRM, de Andrade FB, Vivan RR. Antimicrobial activity of intracanal medications against both Enterococcus faecalis and Candida albicans biofilm. Microsc Res Tech. 2019; 82(5): 494–500.
42. Paikkatt JV, Sreedharan S, Philomina B, Kannan V, Santhakumar M, Kumar TA. Efficacy of various intracanal medicaments in human primary teeth with necrotic pulp against Candida biofilms: An in vivo Study. Int J Clin Pediatr Dent. 2017; 10(1): 45–48.
43. Caplice N, Moran GP. Candida albicans exhibits enhanced alkaline and temperature induction of Efg1-regulated transcripts relative to Candida dubliniensis. Genom Data [Internet]. 2015; 6 : 130–135. http://dx.doi.org/10.1016/j.gdata.2015.08.026.
44. Shin JH, Lee DY, Lee SH. Comparison of antimicrobial activity of traditional and new developed root sealers against pathogens related root canal. J Dent Sci. 2018; 13(1): 54–59.
45. Zhang H, Shen Y, Ruse ND, Haapasalo M.Antibacterial activity of endodontic sealers by modified direct contact test against Enterococcus faecalis. J Endod. 2009; 35(7): 1051–1055.
46. Dalmia S, Gaikwad A, Samuel R, Aher G, Gulve M, Kolhe S. Antimicrobial efficacy of different endodontic sealers against Enterococcus faecalis: An in vitro study. J Int Soc Prev Community Dent. 2018; 8(2): 104–109.
47. Zhou HM, Shen Y, Zheng W, Li L, Zheng YF, Haapasalo M. Physical properties of 5 root canal sealers. J Endod. 2013; 39(10): 1281–1286.
48. Ørstavik D, Nordahl I, Tibballs JE. Dimensional change following setting of root canal sealer materials. Dent Mater. 2001; 17(6): 512–519.
49. Poggio C, Arciola CR, Dagna A, Colombo M, Bianchi S, Visai L. Solubility of root canal sealers: A comparative study. Int J Artif Organs. 2010; 33(9): 676–681.
50. Schäfer E, Zandbiglari T. Solubility of root-canal sealers in water and artificial saliva. Int Endod J. 2003; 36(10): 660–669.
51. Huang FM, Tai KW, Chou MY, Chang YC. Cytotoxicity of resin-, zinc oxide-eugenol-, and calcium hydroxide-based root canal sealers on human periodontal ligament cells and permanent V79 cells. Int Endod J. 2002; 35(2): 153–158.
52. Ioannidis K, Beltes P, Lambrianidis T, Kapagiannidis D, Karagiannis V. Crown discoloration induced by endodontic sealers: spectrophotometric measurement of Commission International de I’Eclairage’s L*, a*, b* chromatic parameters. Oper Dent. 2013; 38(3): 1–12.
53. Upadhyay V, Upadhyay M, Panday RK, Chturvedi TP, Bajpai U. A SEM evaluation of dentinal adaptation of root canal obturation with GuttaFlow and conventional obturating material. Indian J Dent Res. 2011; 22(6): 881.
54. Chandrasekhar V, Morishetty PK, Metla SL, Raju RVSC. Expansion of gutta-percha in contact with various concentrations of zinc oxide eugenol sealer: A three-dimensional volumetric study. J Endod. 2011; 37(5): 697–700.
55. Monajemzadeh A, Ahmadi S, Aslani S, Sadeghi-Nejad B. In vitro antimicrobial effect of different root canal sealers against oral pathogens. Curr Med Mycol. 2017; 3(2): 7–12.
56. Wainstein M, Morgental RD, Waltrick SBG, Oliveira SD, Vier-Pelisser FV, Figueiredo JAP. In vitro antibacterial activity of a silicone-based endodontic sealer and two conventional sealers. Braz Oral Res. 2016; 30 : 1–5.
57. Ørstavik D. Materials used for root canal obturation: technical, biological and clinical testing. Endod Top. 2005; 12(1): 25–38.
58. Marin-Bauza GA, Rached-Junior FJA, Souza-Gabriel AE, Sousa-Neto MD, Miranda CES, Silva-Sousa YTC. Physicochemical properties of methacrylate resin-based root canal sealers. J Endod. 2010; 36(9): 1531–1536.
59. Flores DSH, Rached-Júnior FJA, Versiani MA, Guedes DFC, Sousa-Neto MD, Pécora JD. Evaluation of physicochemical properties of four root canal sealers. Int Endod J. 2011; 44(2): 126–135.
60. Song Y-S, Choi Y, Lim M-J, Yu M-K, Hong C-U, Lee K-W, Min KS. In vitro evaluation of a newly produced resin-based endodontic sealer. Restor Dent Endod. 2016; 41(3): 189–195.
61. Resende LM, Rached-Junior FJA, Versiani MA, Souza-Gabriel AE, Miranda CES, Silva-Sousa YTC. A comparative study of physicochemical properties of AH plus, epiphany, and epiphany SE root canal sealers. Int Endod J. 2009; 42(9): 785–793.
62. Camargo RV de, Silva-Sousa YTC, Rosa RPF da, Mazzi-Chaves JF, Lopes FC, Steier L, Sousa-Neto MD. Evaluation of the physicochemical properties of silicone - and epoxy resin-based root canal sealers. Braz Oral Res. 2017; 31 : 72.
63. Garza EG, Wadajkar A, Ahn C, Zhu Q, Opperman LA, Bellinger LL, Nguyen KT, Komabayashi T. Cytotoxicity evaluation of methacrylate-based resins for clinical endodontics in vitro. J Oral Sci. 2012; 54(3): 213–217.
64. Al-Hiyasat AS, Tayyar M, Darmani H. Cytotoxicity evaluation of various resin based root canal sealers. Int Endod J. 2010; 43(2): 148–153.
65. El Sayed MAA, Etemadi H. Coronal discoloration effect of three endodontic sealers: An in vitro spectrophotometric analysis. J Conserv Dent. 2013; 16(4): 347–351.
66. Kapralos V, Koutroulis A, Ørstavik D, Sunde PT, Rukke HV. Antibacterial activity of endodontic sealers against planktonic bacteria and bacteria in biofilms. J Endod. 2018; 44(1): 149–154.
67. Prestegaard H, Portenier I, Ørstavik D, Kayaoglu G, Haapasalo M, Endal U. Antibacterial activity of various root canal sealers and root-end filling materials in dentin blocks infected ex vivo with Enterococcus faecalis. Acta Odontol Scand. 2014; 72(8): 970–976.
Štítky
Chirurgie maxilofaciální Ortodoncie Stomatologie
Článek vyšel v časopiseČeská stomatologie / Praktické zubní lékařství
Nejčtenější tento týden
2020 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Význam ústní sprchy pro čištění mezizubních prostor
- MIH – komplexní problém s nutností komplexního přístupu
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- STAV ORÁLNÍHO ZDRAVÍ U PACIENTŮ S KARDIOVASKULÁRNÍM ONEMOCNĚNÍM - Původní práce – klinická studie
- VYBRANÉ VLASTNOSTI SÚČASNÝCH ENDODONTICKÝCH SEALEROV: ČASŤ 1
- UVOLNĚNÍ ŠROUBKU V ABUTMENTU: PŘÍČINY, MECHANISMUS VZNIKU, KOMPLIKACE A MANAGEMENT
- PŘÍMÁ REKONSTRUKCE STÁLÉHO CHRUPU PACIENTKY S AMELOGENESIS IMPERFECTA
- DENS SANUS OLOMUCENSIS – PRVNÍ ROČNÍK KONFERENCE
- EDITORIAL
- DVĚ VÝZNAMNÁ STOLETÁ VÝROČÍ
- ONLINE PRAŽSKÝ DENTÁLNÍ DEN BYL ÚSPĚŠNÝ
- Česká stomatologie / Praktické zubní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- UVOLNĚNÍ ŠROUBKU V ABUTMENTU: PŘÍČINY, MECHANISMUS VZNIKU, KOMPLIKACE A MANAGEMENT
- PŘÍMÁ REKONSTRUKCE STÁLÉHO CHRUPU PACIENTKY S AMELOGENESIS IMPERFECTA
- STAV ORÁLNÍHO ZDRAVÍ U PACIENTŮ S KARDIOVASKULÁRNÍM ONEMOCNĚNÍM - Původní práce – klinická studie
- VYBRANÉ VLASTNOSTI SÚČASNÝCH ENDODONTICKÝCH SEALEROV: ČASŤ 1
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






