-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučené postupy diagnostiky a léčby diabetického makulárního edému
Autoři: J. Ernest 1,2,3; J. Němčanský 4,5; D. Vysloužilová 6; M. Veith 7; J. Studnička 8,9; P. Němec 3
Působiště autorů: Vitreoretinální centrum Neoris, s. r. o., Praha 1; Axon Clinical, s. r. o., Praha 2; Oční klinika ÚVN a 1. LF Univerzita Karlova v Praze 3; Oční klinika FN Ostrava 4; Katedra kraniofaciálních oborů, LF Ostravská univerzita 5; Oční klinika FN Brno Bohunice, LF Masarykovy univerzity 6; Oční klinika FN Královské Vinohrady a 3. LF, Univerzita Karlova 7; Oční klinika FN Hradec Králové a LF v Hradci Králové, Univerzita Karlova 8; VISUS, spol. s r. o., Police nad Metují 9
Vyšlo v časopise: Čes. a slov. Oftal., 79, 2023, No. 5, p. 225-235
Kategorie: Původní práce
doi: https://doi.org/10.31348/2023/27Souhrn
Diabetický makulární edém (DME) patří společně s diabetickou retinopatií mezi hlavní příčiny těžké ztráty zraku u produktivní populace. V nedávných letech byly zlepšeny diagnostické možnosti díky rozvoji zobrazovacích metod, což umožnilo vytvořit nová klasifikační schémata DME. Dále byly představeny nové možnosti léčby – jak nové léčivé přípravky podávané do sklivce, tak inovace v dávkovacích schématech jejich podání. Zároveň je stále dostupná laserová, chirurgická a také kombinovaná léčba.
V práci jsou vyhodnoceny a shrnuty současné poznatky o dostupných diagnostických a léčebných metodách DME a na jejich základě jsou formulovány doporučené postupy diagnostiky, klasifikace a léčby DME.Klíčová slova:
doporučené postupy – léčba – diabetický makulární edém
1. ÚVOD A EPIDEMIOLOGIE
Diabetická retinopatie (DR) je nejčastější orgánovou komplikací diabetu mellitu (DM) a společně s diabetickým makulárním edémem (DME) je hlavní příčinou slepoty u populace v produktivním věku [1–4]. Diabetický makulární edém (DME) vznikající v rámci diabetické retinopatie způsobuje zhoršení zrakových funkcí, především centrální zrakové ostrosti (ZO). Postihuje asi 7 % diabetiků [5–9]. Pokud není zahájena léčba DME, dochází přibližně u 50 % pacientů během dvou let ke zhoršení zrakové ostrosti o 2 a více řádků [2,10].
Léčba DME byla v minulých letech ovlivňovaná výsledky a doporučeními ETDRS studií (Early Treatment Diabetic Retinopathy Study) pro klinicky signifikatní makulární edém [11]. Spočívala v laserové fotokoagulaci (LFK) sítnice, v tzv. mřížkové (grid) nebo fokální LFK. Po dlouhá desetiletí byla tato technika jedinou možností léčby DME.
Přesto, že mřížková LFK makuly významně snížila riziko střední ztráty ZO o 50 % a měla i protektivní efekt, neměla významnější vliv na zlepšení zrakových funkcí [12]. Také z tohoto důvodu je v současné době laserová fotokoagulace DME omezena pouze pro úzkou skupinu makulárních edémů, které nezasahují centrum makulární oblasti (non-central involved DME – non-CIDME) a/nebo jsou přítomné u nemocných s velmi dobrou vstupní ZO.
Vzhledem k pokrokům ve farmakologii dnes spočívá těžiště léčby DME v nitroočním podání různých typů léčiv, které prokázaly velmi dobrou účinnost nejen na stabilizaci choroby, ale u významné části nemocných také na zlepšení zrakových funkcí [12–15].
Současně s rozvojem nových léčebných technik došlo v uplynulé dekádě k výraznému pokroku v diagnostice – především v zobrazovacích metodách. Jsme proto schopni lépe pochopit a klasifikovat chorobu u konkrétního pacienta a následně z široké palety možností zvolit léčebný postup na míru – mnohdy spočívající v kombinaci léčiv nebo léčebných metod.
Tab. 1. Základní klasifikace DME 
DME – diabetický makulární edém 2. PATOFYZIOLOGIE DME
DME má multifaktoriální patofyziologii, která zahrnuje angiogenezi, zvýšenou cévní permeabilitu a lokální zánětlivé procesy [16]. Na jeho vzniku a rozvoji se podílí celá řada mechanismů, jejichž poměry a vztahy nejsou dosud zcela detailně objasněny. Obecně se předpokládá, že trvalá hyperglykémie vede k mikrovaskulárním změnám, k narušení hematookulární bariéry, k hypoxii a k následně kaskádě patologických metabolických pochodů. V průběhu těchto dějů má zásadní vliv zvýšení produkce vaskulárního endoteliálního růstového faktoru (VEGF) a zánětlivých mediátorů (např. interleukinů (IL-6, IL-10), intercellular adhesion molecule 1 (ICAM-1), tumor nekrotizujícího faktoru α (TNF-α), angiopoetinu 2 (Ang2), monocyte chemoattractant protein 1 (MCP-1), P-selektinu aj. [17–20]. Narušená hematookulární bariéra je příčinou hromadění intracelulární a extracelulární tekutiny a ukládání lipidových exsudátů v sítnici, což vede k morfologickým i funkčním změnám.
Patologické morfologické projevy jsou dobře detekovatelné pomocí fluorescenční angiografie (FAG), optické koherenční tomografie (OCT) a OCT angiografie (OCT-A) [9]. Multifaktoriální patofyziologii respektuje i současný přístup k léčbě DME, cílený na ovlivnění procesů vazogenní a zánětlivé aktivity a k regulaci jednotlivých jejích mediátorů.
Ke vzniku DME mohou přispívat i nežádoucí účinky některých perorálních antidiabetik – inzulínových senzitizérů, které mají schopnost zadržovat tekutinu, především u pokročilých forem DR. Jedná se např. o thiazolidindiony (pioglitazon) nebo GLP 1 inkretinová mimetika liraglutid a semaglutid [21]. Proto je před jejich plánovaným nasazením vhodné vyšetření očního pozadí.
3. KLASIFIKACE DME
Historický systém hodnocení DME dle ETDRS (a termín klinicky signifikantní makulární edém) je v dnešní době již nevyhovující. Nerespektuje totiž dosažené pokroky v diagnostických zobrazovacích metodách: FAG, OCT a OCT angiografii včetně jejich širokoúhlých (wide-field) modalit. Především rozvoj OCT diagnostiky umožňuje odhalit časné morfologické změny a přesně definovat nové znaky (markery) vzniku a průběhu DME. Použití nejnovějších technologií (např. neuronové sítě) navíc umožňuje detailní analýzu a predikci přirozeného vývoje choroby i efektu různých léčebných technik [22]. Všechny tyto faktory přispěly k revizi klasifikace DME a k návrhům celé řady nových klasifikačních systémů [2,5,23,24]. Mezi nejkomplexnější patří klasifikace navržená mezinárodním panelem předních evropských sítnicových odborníků, která byla publikována v roce 2020 v European Journal of Ophthalmology [2] a která je založena právě na celé řadě markerů (viz níže).
Současný základní systém klasifikace DME vychází z OCT diagnostiky a z lokalizace edému vzhledem k centru makuly (Tabulka 1) [25].
CIDME dále dělíme na:
- s poklesem ZO (horší než 20/32 – Snellen horší než 6/9)
- bez poklesu ZO (20/32 a lepší – Snellen 6/9 a lepší)
V podrobnější diagnostice a klasifikaci DME je klíčová analýza morfologických sítnicových změn, detekce přesně definovaných znaků (biomarkerů) a hodnocení tloušťky subfoveolární zóny o průměru 1 mm kolem centra (CST, central subfield thickness). Používáme OCT skeny o vysokém rozlišení (high definition, HD skeny) v paralelním, rastrovém a radiálním uspořádání a posuzujeme 7 základních OCT parametrů [2]. Někteří autoři nepovažují samotnou hodnotu CST za významnou, protože nemusí vždy korelovat s funkčními výsledky [5,26,27]. Pro účely našich doporučení, pro návaznost na dosavadní zkušenosti, posudkovou činnost, hodnocení a vykazování péče však považujeme tento parametr a jeho hodnocení za přínosné a důležité.
Klasifikační parametry a hlavní markery DME hodnocené v centrální zóně 1 mm (CST) [2]:
- retinální tloušťka (T) – subfoveální tloušťka sítnice
- intraretinální cysty (IC) – okrouhlé, minimálně reflektivní prostory zevní/vnitřní nukleární vrstvy nebo vrstvy gangliových buněk
- stav elipsoidní zóny (EZ) a/nebo zevní limitující membrány (ELM) - dezorganizace zevních retinálních vrstev v oblasti spojení vnitřních/zevních segmentů fotoreceptorů a linie ELM – známka zánětu
- dezorganizace vnitřních retinálních vrstev (DRIL) ve foveální oblasti – ztráta stratifikace mezi vrstev mezi gangliovými buňkami a vnitřní plexiformní vrstvy – známka zánětu
- hyperreflektivní ložiska – focci (H) – známka zánětu
- subretinální tekutina (F) – přítomnost tekutiny mezi retinálním pigmentovým epitelem (RPE) a neurosenzorickou sítnicí – známka zánětu
- vitreoretinální status (VS) – zjednodušená verze dle International Vitreomacular Traction Group [28]
- absence jakékoliv viditelné adheze nebo trakce mezi sklivcem a sítnicí
- nekompletní odloučení sklivce (PVD, posterior vitreous detachment)
- kompletní odloučení sklivce
- vitreomakulární trakce (VMT)
- epiretinální membrána (ERM)
Všechny tyto parametry se mohou vzájemně kombinovat a jejich přítomnost je určující pro volbu léčby.
Komplexní posouzení jednotlivých OCT parametrů je základem podrobné klasifikace DME (a diabetické makulopatie v širším významu) dle Panozza a kol. [2] Ta je určena především sítnicovým specialistům a centrům, kde je poskytována specializovaná léčba DME. Nejprve je provedeno hodnocení (grading) 7 základních parametrů a vypočítáno tzv. TCED-HFV skóre, následně je stanoveno stadium DME (staging) – časný, střední, závažný, atrofická makulopatie [2].
Hodnocení (grading) TCED-HFV skóre včetně obrazové dokumentace je znázorněno v oddíle 6 a 7 tohoto článku.
Obr. 1. Schéma diagnostiky a léčby DME 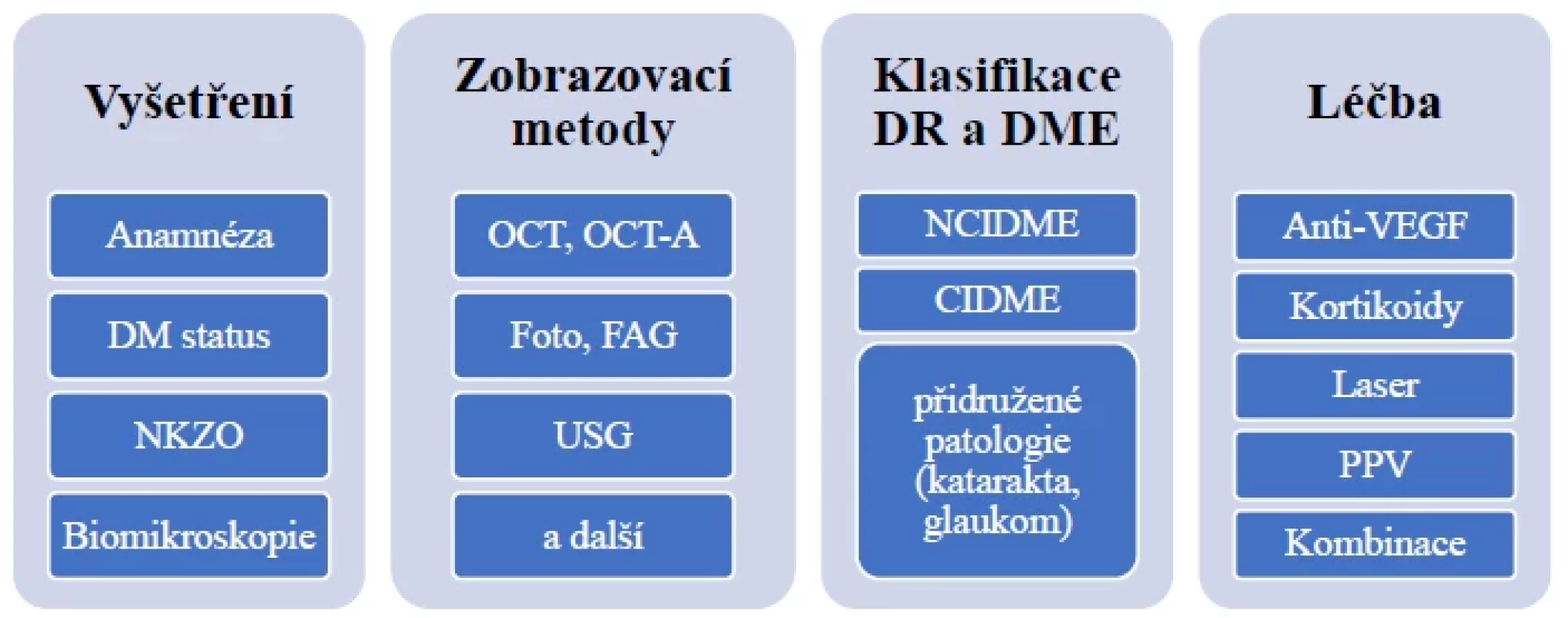
DM – diabetes mellitus, DME – diabetický makulární edém, NKZO – nejlépe korigovaná zraková ostrost, OCT – optická koherenční
tomografie, OCT-A – OCT angiografie, FAG – fluorescenční angiografie, USG – ultrazvuk, NCIDME – DME bez postižení centra,
CIDME – DME v centru, VEGF – vaskulární endoteliální růstový faktor, PPV – pars plana vitrektomieObr. 2. Schéma rozhodovacího postupu léčby DME 
DME – diabetický makulární edém, NCIDME – DME bez postižení centra, CIDME – DME v centru, ZO – zraková ostrost, OCT –
optická koherenční tomografie, PPV – pars plana vitrektomie, VEGF – vaskulární endoteliální růstový faktor, V - vitreoretinální
statusTab. 2. TCED-HFV skóre/grading DME. Upraveno dle Panozza a kol [2] ![TCED-HFV skóre/grading DME. Upraveno dle Panozza a kol [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/800ea1d81aca1c31ffd511d081f6928f.png)
DME – diabetický makulární edém, ELM – zevní limitující membrána, DRIL – dezorganizace vnitřních sítnicových vrstev, PVD – odloučení
sklivce, VMT – vitreomakulární trakce, ERM – epiretinální membránaTab. 3. Stadia DME – staging. Upraveno dle Panozza a kol [2] ![Stadia DME – staging. Upraveno dle Panozza a kol [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/098e39b8d2d496ad982b84c070212ab5.png)
DME – diabetický makulární edém Obr. 3. Časný DME 
Edém temporálně od fovey, drobné intraretinální cysty ve vnitřních i zevních vrstvách sítnice, hyperreflektivní focci
(méně než 30). Grading T-1, C-2, E-0, D-0, H-0, F-0, V-0. Upraveno dle Panozza a kol [2]
DME – diabetický makulární edémObr. 4. Časný DME 
Minimální edém temporálně, zachovaný reliéf sítnice, drobné intraretinální cysty, zachované zevní i vnitřní vrstvy
sítnice, hyperreflektivní focci (více než 30), subretinální tekutina, bez patologie vitreoretinálního rozhraní. Grading
T-1, C-1, E-0, D-0, H-1, F-1, V-0. Upraveno dle Panozza a kol [2]
DME – diabetický makulární edém4. LÉČBA DME
4.1 Kompenzace diabetu a konkomitujících onemocnění
Zásadním předpokladem úspěšné léčby komplikací diabetu (včetně léčby DR a DME) je léčba základního onemocnění a přidružených onemocnění (hypertenze, poruchy metabolismu lipidů atd.). Současně je nutná spolupráce pacienta včetně dodržování obecných doporučení v rámci životosprávy a pohybového režimu. Tato problematika je zpracována v Doporučených postupech diagnostiky a léčby DR a je vedena ošetřujícím specialistou – praktickým lékařem, internistou nebo diabetologem.
4.2 Laserová fotokoagulace
LFK dnes využíváme v přísně indikovaných případech – u očí s non-CIDME nebo u očí s CIDME a zároveň velmi dobrou ZO (lepší než 20/32). Cílem je přímá fokální fotokoagulace jednotlivých prosakujících mikroaneuryzmat (případně ztluštění sítnice) dle modifikovaného ETDRS protokolu [29, 30]. Předpokladem úspěšné léčby je předchozí provedení FAG, detekce jednotlivých prosakujících aneuryzmat a následně jejich cílené ošetření, optimálně navigovaným automatickým laserem. Tímto postupem lze docílit následné regrese DME [31–34].
U očí s non-CIDME provádíme fokální ošetření, pokud edém ohrožuje foveu [25,35].
U očí s CIDME a ZO lepší než 20/32 provádíme fokální ošetření mikroaneuryzmat pokud se nacházejí alespoň 300–500 µm od centra makuly. Dříve často používaná mřížková fotokoagulace makuly má jen minimální efekt na zlepšení zrakových funkcí [11,13,14] a v současné době je již nahrazena intravitreálním podáním přípravků, které působí proti vaskulárnímu endoteliálnímu růstovému faktoru (anti-VEGF) nebo kortikoidů.
Srovnatelné i lepší výsledky s klasickou fotokoagulací sítnice nabízí mikropulzní laser, který je šetrnější – působí fotostimulačně na chromofory v RPE, nezpůsobuje kolaterální poškození tkáně, atrofii a jizvení [36–40]. S úspěchem se využívá v kombinaci s farmakoterapií a méně efektivní je u očí s CST >400 µm [36–39]. Technika se liší od klasické fotokoagulace; používáme splývavé podprahové stopy na oblast fovey (alespoň 500 µm od centra) a do oblastí ztluštění sítnice [39].
U nemocných s výskytem DME a současně přítomné neproliferativní nebo mírné proliferativní diabetické retinopatie zvažujeme indikaci tzv. “scatter” laserové fotokoagulace ischemických zón periferní sítnice. LFK v těchto případech redukuje produkci VEGF a následně i omezuje riziko vzniku DME snížením produkce VEGF faktorů. LFK je účinná v monoterapii i v kombinaci s nitroočním podáním anti-VEGF přípravků [26,41].
4.3 Farmakologická nitrooční intravitreální léčba
4.3.1. Anti-VEGF preparáty
Anti-VEGF léčba dnes představuje základní léčebný postup v léčbě CIDME.
U očí s CIDME se ZO horší než 20/32 prokázaly četné klinické randomizované studie statisticky signifikantní efekt a zlepšení ZO ve srovnání s observací nebo laserovou léčbou [13,14,26,42]. Jednalo se o protokol T studie DRCR.net, který současně hodnotil různé anti-VEGF preparáty a porovnával jejich účinnost a vedlejší účinky. Hodnocenými preparáty byly aflibercept, bevacizumab a ranibizumab [15]. Ranibizumab i aflibercept prokázaly svou účinnost také v běžné klinické praxi.
Dalšími účinnými novými anti-VEGF přípravky jsou brolucizumab a faricimab. Tyto léky prokázaly v prospektivních randomizovaných studiích účinnost srovnatelnou s afliberceptem, zároveň léčebného účinku dosahují s nízkou frekvencí podání léku během sledovacího období [43,44].
U očí s CIDME s velmi dobrou ZO, tzn. 20/32 a lepší existuje v klinických studiích pouze omezené množství dat. Přesto se ukazuje, že i u těchto pacientů má podání anti-VEGF přípravků pozitivní vliv na zlepšení anatomického i funkčního nálezu. Zároveň je k dosažení léčebného efektu potřeba menší počet injekcí [26].
Cílem anti-VEGF léčby je dosáhnout optimální léčebné odpovědi s minimálním počtem injekcí vzhledem k zátěži nemocných, poskytovatelů i plátců zdravotní péče. Z tohoto důvodu je velmi důležitým aspektem léčby také dávkování léku a volba léčebných intervalů. Léčbu zahajujeme tzv. nasycovací fází (loading) s pevně danými léčebnými intervaly a následně pokračujeme tzv. udržovací fází léčby. Dávkování i léčebné intervaly jsou individuální podle typu jednotlivých preparátů. Klinické studie zároveň jednoznačně prokázaly potřebu úvodní intenzivní léčby v prvním roce léčby, v druhém roce je možné dle reakce na léčbu a vývoje nálezu určité rozvolnění [15,35,45].
V zásadě se aktuálně ustálily tyto možnosti aplikačních režimů:
- fixní režim s pevnými intervaly mezi jednotlivými podáními léku
- léčba s postupnými prodlužováním léčebných intervalů – treat and extend režim (T&E)
Fixní režim aplikací v pevných intervalech dle jednotlivých přípravků (1–3 měsíce mezi dávkami) a také důsledné monitorování léčby umožňuje dosáhnout nejlepšího anatomického i funkčního výsledku [15,46]. Z tohoto důvodu je tento režim zpravidla volen v iniciální nasycovací fázi u všech pacientů.
Řada studií však podporuje svými závěry také fakt, že je optimálního léčebného výsledku možné dosáhnout v udržovací fázi s menším počtem injekcí. Proto je po nasycovací fázi výhodné pokračovat léčebným režimem T&E [15,46–49].
Volba léčebného intervalu v udržovací fázi vyplývá především z léčebné reakce a dynamiky nálezu pacienta v prvním roce léčby. V případě dobré terapeutické odpovědi na úvodní dávky anti-VEGF preparátu v prvním roce léčby lze očekávat v druhém roce v režimu T&E prodloužení intervalu mezi aplikacemi až na 12–20 týdnů.
Dříve často používaný režim pro re nata (PRN) může dosahovat (zejména v prvním roce léčby) podobných výsledků jako fixní a T&E režim, ale za cenu intenzivního monitorování nemocných – vyššího počtu kontrolních návštěv – z tohoto důvodu se dnes používá minimálně [50,51].
Přibližně 20–42 % léčených pacientů vykazuje bez ohledu na zvolený anti-VEGF přípravek nedostatečnou (suboptimální) nebo žádnou terapeutickou odpověď – tzv. nonresponzi [14,16, 47,52–55].
Známkami suboptimální odpovědi nebo nonresponze jsou:
- trvale zhoršená ZO i přes intenzivní léčbu
- zhoršení ZO
- perzistence edému
- známky aktivity (markery) na OCT vyšetření – jejich kvantitativní zhodnocení v průběhu léčby, především DRIL, EZ, H, F.
Za suboptimální odpověď považujeme také zisk méně než 5 písmen ZO na konci nasycovací fáze. Zároveň je prokázáno, že takové oči mají špatné dlouhodobé výsledky [54].
Pacienty, kteří vykazují známky suboptimální odpovědi nebo nonresponzi, doporučujeme po vyhodnocení morfologických znaků (biomarkerů) převést na jiný druh léčby.
4.3.2. Kortikoidy
Anti-VEGF léčba byla u DME po řadu let léčbou první volby a depotní kortikoidy byly považovány za lék druhé volby. Byly používány až po selhání anti-VEGF léčby nebo při jejích kontraindikacích, při omezené spolupráci pacienta a při nemožnosti frekventních kontrol. S neustále se zvyšujícím počtem pacientů a s tím spojeným záchytem vyššího počtu suboptimální terapeutické odpovědi nebo non-responze na anti-VEGF léky narůstá i potřeba použití kortikoidní léčby.
V případě detekce zánětlivých markerů na OCT (DRIL, EZ, HF) nebo při známkách chronicity nálezu může být použití intravitreálních depotních kortikoidů dokonce primární volbou.
Intravitreální depotní kortikoidy působí odlišným mechanismem než anti-VEGF preparáty. Blokují široké spektrum cytokinů, inhibují leukostázu a snižují vaskulární permeabilitu [42,56–58]. V současné době je možno použít k intravitreální aplikaci dexamethazon nebo fluocinolon acetonid. Oba preparáty jsou ve formě depotních rezervoárů s postupným uvolňováním léčiva do sklivcového prostoru.
4.3.2.1. Depotní dexamethazon
U depotního dexamethazonu byl prokázán významný anatomický i funkční efekt ve srovnání s observací, zároveň však bylo pozorováno vysoké procento (68 %) rozvoje komplikované katarakty [42]. U více než 28 % pacientů také bylo nutno nasadit lokální léčbu antiglaukomatiky a u 0,3 % pacientů byla nutná antiglaukomová operace [59]. Opakované intravitreální aplikace nevedly k dalšímu zvyšování nitroočního tlaku (NT) a proto je možno depotní dexamethazon aplikovat častěji než
1 x za 6 měsíců. Depotní dexamethazon doporučujeme u následujících stavů:- nedostatečná léčebná odpověď na anti-VEGF
- kontraindikace anti-VEGF
- známky chronicity onemocnění (dlouhotrvající edém)
- pokročilé morfologické změny na OCT: DRIL, EZ, HF
U všech nemocných je třeba zohlednit riziko elevace NT, u fakických nemocných také riziko rozvoje nebo progrese katarakty.
Dávkování depotního dexamethazonu je individuální dle reakce na předchozí aplikaci, interval následné aplikace je obvykle mezi 4–6 měsíci a před každou další aplikací je nutno přihlédnout k TCED-HFV klasifikaci.
Depotní dexamethazon lze kombinovat s jinými léčebnými postupy, především s LFK nebo anti-VEGF léčbou. Pacienti léčení kombinací depotního dexamethazonu a anti-VEGF léky vykázali v klinických studiích větší zlepšení zrakových funkcí a větší redukci CST proti pacientům s anti-VEGF monoterapií [60].
Obr. 5. Středně pokročilý DME 
Edém sítnice, intraretinální cysty v zevních i vnitřních vrstvách, zachované zevní retinální vrsty, dezorganizace vnitřních
retinálních vrstev, hyperreflektivní focci (více než 30), bez subretinální tekutiny, bez patologie vitreoretinálního
rozhraní. Grading T-1, C-2, E-0, D-1, H-1, F-0, V-0. Upraveno dle Panozza a kol [2]
DME – diabetický makulární edémObr. 6. Středně pokročilý DME 
Edém sítnice, intraretinální cysty, v centru makrocysty s hyperdenzním obsahem, narušení elipsoidní zóny v subfoveální
oblasti, narušení vnitřních retinálních vrstev, hustě hyperreflektivní focci, bez subretinální tekutiny, adherentní
kortikální sklivec. Grading T-2, C-3, E-1, D-1, H-1,F-0, V-1. Upraveno dle Panozza a kol [2]
DME – diabetický makulární edémObr. 7. Závažný DME 
Edém sítnice, intraretinální cysty v zevních i vnitřních vrstvách, v centru makrocysta, dezorganizace vnitřních retinálních
vrstev, nepřítomná elipsoidní zóna, mnohočetné hyperrefletivní focci, subretinální tekutina, adhezivní
kortikální sklivec. Grading T-2, C-3, E-2, D-1, H-1, F-1, V-1. Upraveno dle Panozza a kol [2]
DME – diabetický makulární edémObr. 8. Závažný DME 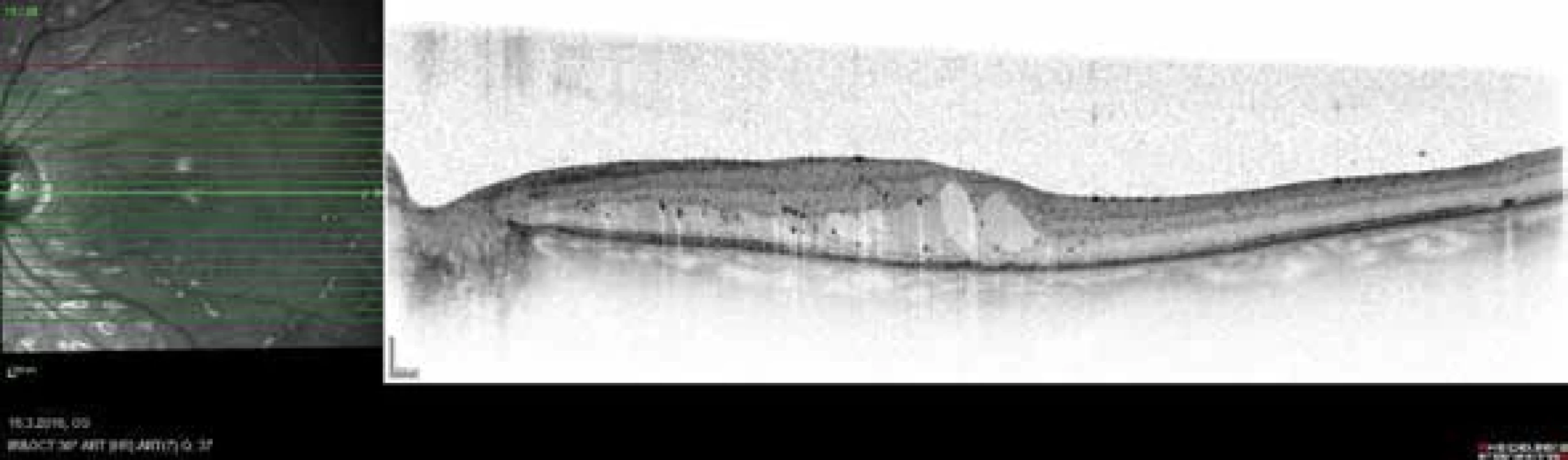
Edém sítnice, intraretinální cysty v zevních vrstvách, v centru větší cysty, minimální dezorganizace vnitřních retinálních
vrstev, nepřítomná elipsoidní zóna, mnohočetné hyperrefletivní focci, bez subretinální tekutiny, bez poruch
vitreoretinálního rozhraní. Grading T-1, C-2, E-2, D-0, H-1, F-0, V-0. Upraveno dle Panozza a kol [2]
DME – diabetický makulární edémObr. 9. Atrofická diabetická makulopatie 
Centrální tloušťka sítnice zvětšena do 10 % (303 μm), drobné intraretinální cysty, dezorganizace vnitřních retinálních
vrstev, disrupce elipsoidní zóny, hyperreflektivní focci, atrofie RPE, epiretinální membrána s tangenciální trakcí.
Grading T-0, C-1, E-1, D-1, H-1, F-0, V-1. Upraveno dle Panozza a kol [2]4.3.2.2. Depotní fluocinolon acetát
Dalším druhem depotního intravitreálního kortikoidu k léčbě DME je flucinolon acetát. Studie FAME prokázala jeho významný pozitivní efekt na snížení CST a zlepšení zrakových funkcí u pacientů s DME [61]. Během tříletého sledování bylo ve studii pacientům nutno aplikovat v průměru pouze 1,3 injekce. Obdobně jako u dexametazonu je aplikace flucinolonu spojena s vyšším rizikem rozvoje katarakty (82 %) a elevací NT (37 %) [57]. Většina pacientů s elevací NT dobře reagovala na lokální antiglaukomatika a pouze u 4,8 % byla nutná chirurgická intervence [57]. Terapeutický efekt kortikoidní léčby přetrvával během 3 let i při minimálním počtu injekcí (průměrně 1,3 injekce). Téměř 28 % pacientů mělo zisk > než 15 písmen ETDRS.
Pacienti s DME vhodní k léčbě fluocinolon acetátem:
- předchozí léčba anti-VEGF nebyla úspěšná
- byla zaznamenána dobrá léčebná odpověď na podání jiného kortikoidu
4.4 Chirurgická léčba – pars plana vitrektomie
Role vitreoretinálního rozhraní a adherentního zadního kortikálního sklivce je dlouhodobě považovaná za významný faktor v patofyziologii DME. Současně hraje roli i v ovlivnění reakce na konzervativní léčbu [62,63]. V rámci TCED-HFV klasifikace by měl být proto vždy zhodnocen vitreoretinální status a podle stanovené klasifikace zvolena individuálně léčba. Významnou roli v diagnostice stavu vitreoretinálního (VR) rozhraní hraje kromě klinického vyšetření a OCT také sonografické vyšetření B scanem a jeho kinetický záznam. Odstranění adherentního kortikálního sklivce ze zadního pólu a eliminace patologie VR rozhraní zlepšuje oxygenaci sklivce i sítnice [63,64].
Indikací k provedení pars plana vitrektomie (PPV) je DME rezistentní na konzervativní léčbu (anti-VEGF nebo kortikoidy) u pacientů:
- s adherentním kortikálním sklivcem
- s manifestní ERM
- s vitreomakulárním trakčním syndromem
- s jinou patologií VR rozhraní
V současné době neexistuje klinická randomizovaná studie, která by porovnala efekt PPV a PPV s farmakologickou léčbou, existuje však řada publikací, které prokazují pozitivní efekt aditivní anti-VEGF léčby před, během nebo po provedené PPV [45,64].
5. SCHÉMA DIAGNOSTIKY A LÉČBY DME
Schémata diagnostiky a léčby DME a rozhodovacího postupu léčby DME jsou zobrazena na Obrázcích 1, 2.
6. KLASIFIKACE, GRADING A STAGING DME DLE OCT ZNAKŮ [2]
Klasifikace DME dle OCT znaků – TCED-HFV skóre/grading – je uvedena v Tabulce 2. Stadia DME/staging jsou určena dle vyhodnocení gradingu TCED-HFV a jsou zobrazena v Tabulce 3.
7. OBRAZOVÁ DOKUMENTACE
Obrázky zobrazují příklady časného DME (Obrázky 3, 4), středně pokročilého DME (Obrázky 5, 6), závažného DME (Obrázky 7, 8) a atrofické diabetické makulopatie (Obrázek 9).
Zdroje
1. Ehlers JP, Yeh S, Maguire MG, et al. Intravitreal Pharmacotherapies for Diabetic Macular Edema: A Report by the American Academy of Ophthalmology. Ophthalmology. 2022;129(1):88-99.
2. Panozzo G, Cicinelli MV, Augustin AJ, et al. An optical coherence tomography-based grading of diabetic maculopathy proposed by an international expert panel: The European School for Advanced Studies in Ophthalmology classification. Eur J Ophthalmol. 2020;30(1):8-18.
3. Rowley WR, Bezold C, Arikan Y, Byrne E, Krohe S. Diabetes 2030: Insights from Yesterday, Today, and Future Trends. Popul Health Manag. 2017;20(1):6-12.
4. Zhang X, Saaddine JB, Chou CF, et al. Prevalence of diabetic retinopathy in the United States, 2005-2008. Jama. 2010;304(6):649-656.
5. Huang YT, Chang YC, Meng PP, et al. Optical Coherence Tomography Biomarkers in Predicting Treatment Outcomes of Diabetic Macular Edema After Dexamethasone Implants. Front Med (Lausanne). 2022;9 : 852022.
6. Lian JX, Gangwani RA, McGhee SM, Chan CK, Lam CL, Wong DS. Systematic screening for diabetic retinopathy (DR) in Hong Kong: prevalence of DR and visual impairment among diabetic population. Br J Ophthalmol. 2016;100(2):151-155.
7. Tan GS, Cheung N, Simó R, Cheung GC, Wong TY. Diabetic macular oedema. Lancet Diabetes Endocrinol. 2017;5(2):143-155.
8. Wong TY, Cheung CM, Larsen M, Sharma S, Simó R. Diabetic retinopathy. Nat Rev Dis Primers. 2016;2 : 16012.
9. Yang Y, Bailey C, Loewenstein A, Massin P. Intravitreal corticosteroids in diabetic macular edema: pharmacokinetic considerations. Retina. 2015;35(12):2440-2449.
10. Sabanayagam C, Yip W, Ting DS, Tan G, Wong TY. Ten Emerging Trends in the Epidemiology of Diabetic Retinopathy. Ophthalmic Epidemiol. 2016;23(4):209-222.
11. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol. 1985;103(12):1796-1806.
12. Bakri SJ, Wolfe JD, Regillo CD, Flynn HW, Wykoff CC. Evidence-Based Guidelines for Management of Diabetic Macular Edema. Journal of VitreoRetinal Diseases. 2019;3(3):145-152.
13. Korobelnik JF, Do DV, Schmidt-Erfurth U, et al. Intravitreal aflibercept for diabetic macular edema. Ophthalmology. 2014;121(11):2247-2254.
14. Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: results from 2 phase III randomized trials: RISE and RIDE. Ophthalmology. 2012;119(4):789-801.
15. Wells JA, Glassman AR, Ayala AR, et al. Aflibercept, Bevacizumab, or Ranibizumab for Diabetic Macular Edema: Two-Year Results from a Comparative Effectiveness Randomized Clinical Trial. Ophthalmology. 2016;123(6):1351-1359.
16. Downey L, Acharya N, Devonport H, et al. Treatment choices for diabetic macular oedema: a guideline for when to consider an intravitreal corticosteroid, including adaptations for the COVID-19 era. BMJ Open Ophthalmol. 2021;6(1):e000696.
17. Funatsu H, Noma H, Mimura T, Eguchi S, Hori S. Association of vitreous inflammatory factors with diabetic macular edema. Ophthalmology. 2009;116(1):73-79.
18. Funk M, Schmidinger G, Maar N, et al. Angiogenic and inflammatory markers in the intraocular fluid of eyes with diabetic macular edema and influence of therapy with bevacizumab. Retina. 2010;30(9):1412-1419.
19. Lupo G, Motta C, Giurdanella G, et al. Role of phospholipases A2 in diabetic retinopathy: in vitro and in vivo studies. Biochem Pharmacol. 2013;86(11):1603-1613.
20. Sonoda S, Sakamoto T, Yamashita T, Shirasawa M, Otsuka H, Sonoda Y. Retinal morphologic changes and concentrations of cytokines in eyes with diabetic macular edema. Retina. 2014;34(4):741-748.
21. Sharma A, Parachuri N, Kumar N, et al. Semaglutide and the risk of diabetic retinopathy-current perspective. Eye (Lond). 2022;36(1):10-11.
22. Gallardo M, Munk MR, Kurmann T, et al. Machine Learning Can Predict Anti-VEGF Treatment Demand in a Treat-and-Extend Regimen for Patients with Neovascular AMD, DME, and RVO Associated Macular Edema. Ophthalmol Retina. 2021;5(7):604-624.
23. Szeto SK, Hui VWK, Tang FY, et al. OCT-based biomarkers for predicting treatment response in eyes with centre-involved diabetic macular oedema treated with anti-VEGF injections: a real-life retina clinic-based study. Br J Ophthalmol. 2023;107(4):525-533.
24. Tang F, Wang X, Ran AR, et al. A Multitask Deep-Learning System to Classify Diabetic Macular Edema for Different Optical Coherence Tomography Devices: A Multicenter Analysis. Diabetes Care. 2021;44(9):2078-2088.
25. Wong TY, Sun J, Kawasaki R, et al. Guidelines on Diabetic Eye Care: The International Council of Ophthalmology Recommendations for Screening, Follow-up, Referral, and Treatment Based on Resource Settings. Ophthalmology. 2018;125(10):1608-1622.
26. Bressler SB, Qin H, Beck RW, et al. Factors associated with changes in visual acuity and central subfield thickness at 1 year after treatment for diabetic macular edema with ranibizumab. Arch Ophthalmol. 2012;130(9):1153-1161.
27. Szeto SK, Hui VWK, Tang FY, et al. OCT-based biomarkers for predicting treatment response in eyes with centre-involved diabetic macular oedema treated with anti-VEGF injections: a real-life retina clinic-based study. Br J Ophthalmol. 2021;107(4):525-533.
28. Duker JS, Kaiser PK, Binder S, et al. The International Vitreomacular Traction Study Group classification of vitreomacular adhesion, traction, and macular hole. Ophthalmology. 2013;120(12):2611-2619.
29. Fong DS, Strauber SF, Aiello LP, et al. Comparison of the modified Early Treatment Diabetic Retinopathy Study and mild macular grid laser photocoagulation strategies for diabetic macular edema. Arch Ophthalmol. 2007;125(4):469-480.
30. Treatment Techniques and Clinical Guidelines for Photocoagulation of Diabetic Macular Edema: Early Treatment Diabetic Retinopathy Study Report Number 2. Ophthalmology. 1987;94(7):761-774.
31. Everett LA, Paulus YM. Laser Therapy in the Treatment of Diabetic Retinopathy and Diabetic Macular Edema. Curr Diab Rep. 2021;21(9):35.
32. Kernt M, Cheuteu R, Vounotrypidis E, et al. Focal and panretinal photocoagulation with a navigated laser (NAVILAS®). Acta Ophthalmol. 2011;89(8):e662-664.
33. Kozak I, Oster SF, Cortes MA, et al. Clinical evaluation and treatment accuracy in diabetic macular edema using navigated laser photocoagulator NAVILAS. Ophthalmology. 2011;118(6):1119-1124.
34. Sosna T. Diabetická retinopatie: diagnostika, prevence, léčba. 2 ed. Sosna T, editor. Praha: Axonite CZ; 2016.
35. Flaxel CJ, Adelman RA, Bailey ST, et al. Diabetic Retinopathy Preferred Practice Pattern®. Ophthalmology. 2020;127(1):P66-p145.
36. Sivaprasad S, Elagouz M, McHugh D, Shona O, Dorin G. Micropulsed diode laser therapy: evolution and clinical applications. Surv Ophthalmol. 2010;55(6):516-530.
37. Stanga PE, Reck AC, Hamilton AM. Micropulse laser in the treatment of diabetic macular edema. Semin Ophthalmol. 1999;14(4):210-213.
38. Scholz P, Altay L, Fauser S. A Review of Subthreshold Micropulse Laser for Treatment of Macular Disorders. Adv Ther. 2017;34(7):1528-1555.
39. Lois N, Campbell C, Waugh N, et al. Diabetic Macular Edema and Diode Subthreshold Micropulse Laser: A Randomized Double-Masked Noninferiority Clinical Trial. Ophthalmology. 2023;130(1):14-27.
40. Zavorkova M, Nekolova J, Prochazkova L, Cermakova E, Jiraskova N. Diabetic macular edema treatment with subthreshold micropulse laser - five-year long monitoring. Biomedical papers. 2023;167(1):74-79.
41. Vujosevic S, Toma C, Villani E, et al. Diabetic macular edema with neuroretinal detachment: OCT and OCT-angiography biomarkers of treatment response to anti-VEGF and steroids. Acta Diabetol. 2020;57(3):287-296.
42. Boyer DS, Yoon YH, Belfort R, Jr., et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology. 2014;121(10):1904-1914.
43. Brown DM, Emanuelli A, Bandello F, et al. KESTREL and KITE: 52-Week Results From Two Phase III Pivotal Trials of Brolucizumab for Diabetic Macular Edema. Am J Ophthalmol. 2022;238 : 157-172.
44. Wykoff CC, Abreu F, Adamis AP, et al. Efficacy, durability, and safety of intravitreal faricimab with extended dosing up to every 16 weeks in patients with diabetic macular oedema (YOSEMITE and RHINE): two randomised, double-masked, phase 3 trials. Lancet. 2022;399(10326):741-755.
45. Amoaku WM, Ghanchi F, Bailey C, et al. Diabetic retinopathy and diabetic macular oedema pathways and management: UK Consensus Working Group. Eye (Lond). 2020;34(Suppl 1):1-51.
46. Baker CW, Glassman AR, Beaulieu WT, et al. Effect of Initial Management With Aflibercept vs Laser Photocoagulation vs Observation on Vision Loss Among Patients With Diabetic Macular Edema Involving the Center of the Macula and Good Visual Acuity: A Randomized Clinical Trial. Jama. 2019;321(19):1880-1894.
47. Dugel PU, Campbell JH, Kiss S, et al. Association between early anatomic response to anti-vascular endothelial growth factor therapy and long-term outcome in diabetic macular edema: An Independent Analysis of Protocol I Study Data. Retina. 2019;39(1):88-97.
48. Payne JF, Wykoff CC, Clark WL, Bruce BB, Boyer DS, Brown DM. Long-term outcomes of treat-and-extend ranibizumab with and without navigated laser for diabetic macular oedema: TREX-DME 3-year results. Br J Ophthalmol. 2021;105(2):253-257.
49. Kim YC, Shin JP, Pak KY, et al. Two-year outcomes of the treat-and-extend regimen using aflibercept for treating diabetic macular oedema. Sci Rep. 2020;10(1):22030.
50. Lim SY, Wong WM, Seah I, et al. Treat and extend regimen for diabetic macular oedema-a systematic review and meta-analysis. Graefes Arch Clin Exp Ophthalmol. 2023;261(2):303-315.
51. Sarohia GS, Nanji K, Khan M, et al. Treat-and-extend versus alternate dosing strategies with anti-vascular endothelial growth factor agents to treat center involving diabetic macular edema: A systematic review and meta-analysis of 2,346 eyes. Surv Ophthalmol. 2022;67(5):1346-1363.
52. Bressler NM, Beaulieu WT, Maguire MG, et al. Early Response to Anti-Vascular Endothelial Growth Factor and Two-Year Outcomes Among Eyes With Diabetic Macular Edema in Protocol T. Am J Ophthalmol. 2018;195 : 93-100.
53. Bressler NM, Beaulieu WT, Glassman AR, et al. Persistent Macular Thickening Following Intravitreous Aflibercept, Bevacizumab, or Ranibizumab for Central-Involved Diabetic Macular Edema With Vision Impairment: A Secondary Analysis of a Randomized Clinical Trial. JAMA Ophthalmol. 2018;136(3):257-269.
54. Gonzalez VH, Campbell J, Holekamp NM, et al. Early and Long-Term Responses to Anti-Vascular Endothelial Growth Factor Therapy in Diabetic Macular Edema: Analysis of Protocol I Data. Am J Ophthalmol. 2016;172 : 72-79.
55. Pieramici D, Singh RP, Gibson A, et al. Outcomes of Diabetic Macular Edema Eyes with Limited Early Response in the VISTA and VIVID Studies. Ophthalmol Retina. 2018;2(6):558-566.
56. Augustin AJ, Kuppermann BD, Lanzetta P, et al. Dexamethasone intravitreal implant in previously treated patients with diabetic macular edema: subgroup analysis of the MEAD study. BMC Ophthalmol. 2015;15 : 150.
57. Campochiaro PA, Brown DM, Pearson A, et al. Long-term benefit of sustained-delivery fluocinolone acetonide vitreous inserts for diabetic macular edema. Ophthalmology. 2011;118(4):626-635.e622.
58. Danis RP, Sadda S, Li XY, Cui H, Hashad Y, Whitcup SM. Anatomical effects of dexamethasone intravitreal implant in diabetic macular oedema: a pooled analysis of 3-year phase III trials. Br J Ophthalmol. 2016;100(6):796-801.
59. Maturi RK, Pollack A, Uy HS, et al. Intraocular pressure in patients with diabetic macular edema treated with dexamethasone intravitreal implant in the 3-year MEAD study. Retina. 2016;36(6):1143-1152.
60. Maturi RK, Glassman AR, Liu D, et al. Effect of Adding Dexamethasone to Continued Ranibizumab Treatment in Patients With Persistent Diabetic Macular Edema: A DRCR Network Phase 2 Randomized Clinical Trial. JAMA Ophthalmol. 2018;136(1):29-38.
61. Campochiaro PA, Brown DM, Pearson A, et al. Sustained delivery fluocinolone acetonide vitreous inserts provide benefit for at least 3 years in patients with diabetic macular edema. Ophthalmology. 2012;119(10):2125-2132.
62. Nasrallah FP, Jalkh AE, Van Coppenolle F, et al. The role of the vitreous in diabetic macular edema. Ophthalmology. 1988;95(10):1335-1339.
63. Stefansson E, Landers MB, 3rd, Wolbarsht ML. Increased retinal oxygen supply following pan-retinal photocoagulation and vitrectomy and lensectomy. Trans Am Ophthalmol Soc. 1981;79 : 307-334.
64. Haller JA, Qin H, Apte RS, et al. Vitrectomy outcomes in eyes with diabetic macular edema and vitreomacular traction. Ophthalmology. 2010;117(6):1087-1093.e1083.Štítky
Oftalmologie
Článek Úvod do Doporučených postupů
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2023 Číslo 5- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Konjunktivitida a původce Corynebacterium macginleyi – kazuistika
-
Všechny články tohoto čísla
- XXXI. Výroční sjezd ČOS. Anonce
- Vzpomínka na doc. Hejcmanovou. Nekrolog
- Determination of Corneal Power after Refractive Surgery with Excimer Laser: A Concise Review
- Úvod do Doporučených postupů
- Doporučené postupy diagnostiky a léčby diabetického makulárního edému
- Doporučené postupy diagnostiky a léčby diabetické retinopatie
- Screening diabetické retinopatie a diabetického makulárního edému
- Využitie rohovkovej topografie v detskej oftalmológii
- Torpédo makulopatia. Kazuistika
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučené postupy diagnostiky a léčby diabetického makulárního edému
- Doporučené postupy diagnostiky a léčby diabetické retinopatie
- Screening diabetické retinopatie a diabetického makulárního edému
- Torpédo makulopatia. Kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



