-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ZMENY CHIRURGICKY INDUKOVANÉHO ASTIGMATIZMU ROHOVKY A POLOHY UMELEJ VNÚTROOCNEJ ŠOŠOVKY V CASE
Autoři: I. Popov; J. Juhas; K. Kopálová; V. Krásnik
Působiště autorů: Klinika oftalmológie LF UK a UN Bratislava
Vyšlo v časopise: Čes. a slov. Oftal., 79, 2023, No. 2, p. 88-93
Kategorie: Původní práce
doi: https://doi.org/10.31348/2023/14Souhrn
Ciele: Sledovat zmeny chirurgicky indukovaného astigmatizmu rohovky a stability umelej vnútroocnej šošovky (IOL) v case po operácii katarakty. Porovnat zamenitelnost meraní medzi automatickým keratorefraktometrom (AKRM) a biometrom.
Materiál a metodika: Prospektívna observacná štúdia, v ktorej sme sledovali dané parametre na 25 ociach (25 pacientov) v prvom dni, prvom týždni, prvom a v tretom mesiaci po nekomplikovanej operácii katarakty. Ako nepriamy ukazovatel zmeny stability IOL sme použili astigmatizmus indukovaný IOL (rozdiel medzi refraktometriou a keratometriou). Na analýzu zhody medzi prístrojmi sme použili Blant-Altmanovú metódu.
Výsledky: V horeuvedených casových bodoch klesal chirurgicky indukovaný astigmatizmus nasledovne: 0,65 D; 0,62 D; 0,60 D a 0,41 D (v prvom dni, týždni, mesiaci a tretom mesiaci). Astigmatizmus indukovaný zmenou polohy umelej vnútroocnej šošovky sa menil nasledovne: 0,88 D; 0,59 D; 0,44 D a 0,49 D. Zmeny v oboch parametroch boli štatisticky signikantné (p<0,05). Merania hodnoty astigmatizmu aj uhla astigmatizmu nevykazovali štatisticky signikantný rozdiel medzi prístrojmi (p>0,05).
Záver: Chirurgicky indukovaný astigmatizmus aj astigmatizmu indukovaný IOL signikantne klesal v case (p < 0,05). Pokles chirurgicky indukovaného astigmatizmu rohovky bol najvýraznejší medzi prvým a tretím mesiacom po operácii. U astigmatizmu indukovaného IOL bol najväcší pokles do prvého mesiaca po operácii. Rozdiely v meraní medzi biometrom a AKRM boli štatisticky nesignikantné, avšak klinická zamenitelnost medzi danými metódami je otázna, obzvlášt u merania uhlu astigmatizmu.
Klíčová slova:
chirurgicky indukovaný astigmatizmus – poloha umelej vnútroocnej šošovky – zmena astigmatizmu v case
ÚVOD
Rohovka tvorí približne dve tretiny [1] z celkovej optickej mohutnosti oka a má u kaukazskej populácie horizontálny priemer 11,96 mm („white to white“), pricom vertikálne je tento rozmer menší. Jej priemerná dioptrická sila je 44,3 D a priemerný astigmatizmus je 0,91 D [2].
Tieto parametre však môžu byt ovplyvnené zásahom do integrity rohovky, napríklad rezom pri operácii katarakty, ktorý môže spôsobit zmeny v zakrivení rohovky. Kvantifikácia týchto zmien je vyjadrená pod názvom chirugicky indukovaný astigmatizmus (SIA, z anglictiny Surgical induced astigmatism). Je definovaný ako rozdiel medzi pooperacným a predoperacným astigmatizmom a možno ho merat bud pomocou manifestnej refrakcie alebo analýzou zakrivenia rohovky [1]. Operácia katarakty je najcastejšie vykonávanou operáciou v oftalmológii [3]. Chirurgicky indukovaný astigmatizmus spôsobený rohovkovými incíziami je velmi dôležitý faktor vplývajúci na pooperacný výsledok a spokojnost pacienta. Predpokladá sa, že temporálne incízie spôsobujú menší SIA ako superiórne incízie a na velkost SIA môže vplývat aj dlžka, tvar a šírka rezu [4]. S velkostou SIA je nutné rátat už pri biometrii a výpocte umelej vnútroocnej šošovky (IOL, z ang. Intraocular lens) pri biometrii. Hojenie rohovky je dynamický proces [5]. S tým súvisí aj zmena SIA v case. Vediet stabilizáciu pooperacného astigmatizmu je dôležité, ci už pre správne nacasovanie finálnej pooperacnej korekcie alebo aj pri dalšom plánovaní liecby a diagnostiky ochorení oka. Na pooperacný astigmatizmus okrem rohovky vplýva aj astigmatizmus indukovaný umelou vnútroocnou šošovkou. Aj monofokálne netorické šošovky môžu indukovat astigmatizmus ich naklonením (takzvaný „tilt“) alebo decentráciou. Tilt sa najviac prejavuje pri nestabilite IOL v puzdre, co môže nastat v skorom pooperacnom období, dokial nie je IOL stabilizovaná adhéziou puzdra. V našej práci sme sa preto rozhodli sledovat zmenu SIA a astigmatizmu indukovaného IOL v case po štandardnej operácii katarakty s implantáciou monofokálnej IOL. V pooperacnom období je casto pri pooperacných kontrolách používaný automatický keratorefraktometer (AKRM) na meranie refrakcie a rohovkového astigmatizmu. Obcas sa tiež vyskytnú situácie (napríklad nepriehladnost optických médií), ked sa biometrom nedarí zmerat rohovkový astigmatizmus a je nutné údaje doplnit z AKRM. Preto sme sa rozhodli porovnat aj presnost zhody keratometrie medzi biometrom a automatickým keratometrom.
MATERIÁL A METODIKA
V našej prospektívnej štúdii sme sledovali vývoj astigmatizmu vo forme SIA a astigmatizmu indukovaného IOL v case u pacientov, ktorí boli plánovaný na štandardnú operáciu katarakty s implatáciou IOL do puzdra. Pred operáciou bola vykonaná biometria u každého pacienta pomocou optického biometra Lenstar LS900 (Haag-Streit AG, Koeniz, Switzerland). Do súboru boli zaradení iba pacienti bez nepravidelného astigmatizmu, bez predošlých ocných operácii a bez známeho alebo zisteného ochorenia rohovky, akým je napríklad keratokonus, jazvy rohovky, syndróm suchého oka a iné. Ako bezpecnú hranicu na vylúcenie ektatických ochorení rohovky sme zvolili hodnotu astigmatizmu pod 2,0 D a najstrmšiu hodnotu keratometrie (Steep K) pod 47,0 D. Pacienti s náznakmi pterýgia boli tiež vylúcení zo sledovania. Pacienti boli operovaní tým istým chirurgom uniformnou technikou. Hlavný 2-stupnový rohovkový rez o šírky 2,75 mm bol umiestnený na c.12. Dve paracentézy o šírky 1 mm boli umiestnené na císle 10 a 2. Umelá vnútroocná šošovka bola umiestnená do puzdra po nekomplikovanej operácii katarakty pomocou fakoemulzifikácie a bimanuálnej irigácie a aspirácie. Implantovaná bola jednokusová IOL MD Tech I-stream hybrid, ktorá je štvorcového tvaru („quadrilateral“) z hybridného (hydrofóbny a hydrofilný) akrylového materiálu. Na konci operácie boli paracentézy utesnené hydratáciou. Hlavný rez nebolo nutné hydratovat ani u jedného pacienta. Na další pooperacný den boli pacienti vyšetrení za štrbinovou lampou aj mydriáze. Decentrácia IOL sa hodnotila vizuálne. U žiadneho pacienta sme nepozorovali výraznú decentráciu IOL a všetci mali cirkulárne prekrytý okraj optickej casti IOL kapsulorexou. Ak bola rohovka bez viditelných známok edému, pacienti boli zaradený do dalších analýz. Do analýzy bolo zaradené iba pravé oko pacienta ak boli operované obidve oci a ak splnalo inklúzne kritéria. Všetci pacienti boli vyšetrovaní prvý den, prvý týžden, prvý mesiac a tretí mesiac po operácii. Na co najpresnejšiu analýzu bola zmena astigmatizmu sledovaná pomocou toho istého optického biometra Lenstar LS900 aj v pooperacnom období. Pacienti pocas kontrol absolvovali aj vyšetrenie AKRM (Nidek AKR-1a). Chirurgicky indukovaný astigmatizmu sme vypocítali pomocou vektorovej analýzy podla vzorca spomenutého v clánku Sáncheza-Tabernera [6]. Na kvantifikáciu vplyvu astigmatizmu indukovaného IOL sme použili absolútne hodnoty rozdielu refraktometrie a keratometrie z AKRM. Výsledky sme zobrazili ako priemery sledovaných velicín, s minimálnymi a maximálnymi hodnotami. Dáta v hodnotách SIA aj šošovkou indukovaného astigmatizmu vykazovali odchýlky od normálnej distribúcie, preto sme na porovnanie priemerov z opakovaných meraní použili Friedmanov neparametrický test. Na Post-hoc analýzu sme použili Bonferroniho korekciu. Na hodnotenie zhody výsledkov keratometrie medzi biometrom a AKRM z tretieho mesiaca po operácii sme použili Blant-Altmanovú metódu [7]. Hladinu významnosti alfa sme stanovili na 0,05. Astigmatizmy z keratometrie sme prekonvertovali na hodnoty kompatibilné so zobrazením astigmatizmu v biometri a pri kalkulácii sme hodnoty zobrazili v rozpätí od 270° do 90°, pricom sme dané hodnoty oznacili od -90°po +90° (Obrázok 1). Na vylúcenie metodickej chyby sme rozdiely väcšie ako 90° manuálne skontrolovali a opravili adekvátne. Napríklad, pri uhle 80°a100°, sme po konverzii dostali 80° a -80°, co robí rozdiel 160° pricom reálny rozdiel je iba 20°.V našom výskume sa držali princípov Helsinskej deklarácie.
Obr. 1. Príklad konverzie hodnôt astigmatizmu pri kalkulácii 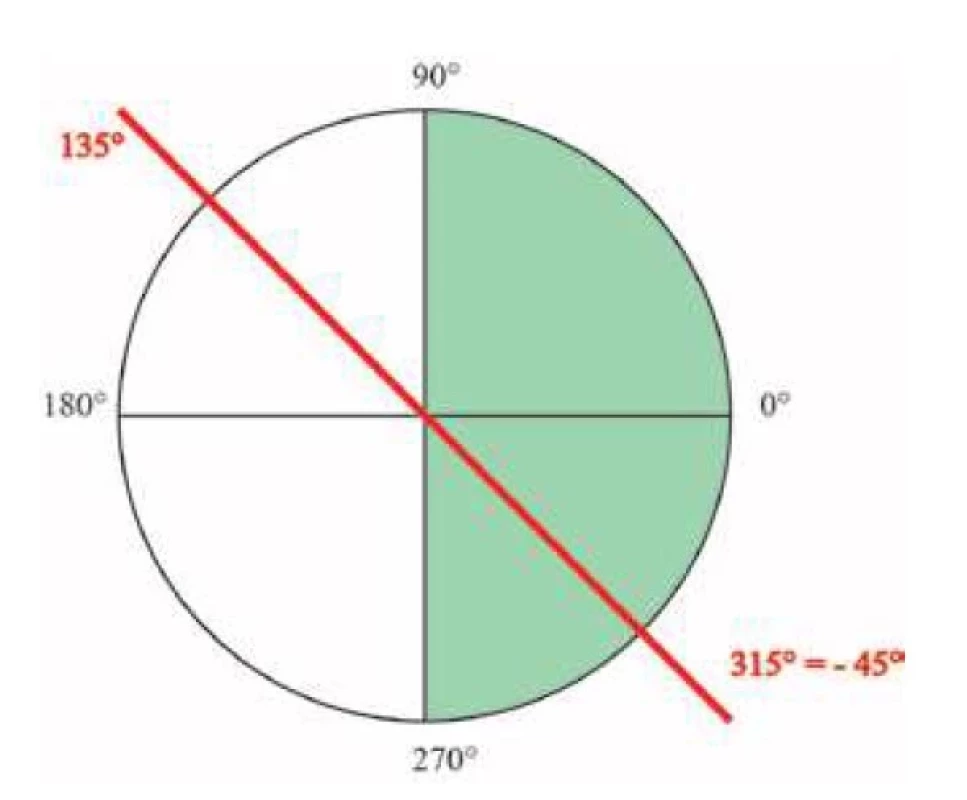
VÝSLEDKY
Analyzované boli dáta 25 z celkovo 30 pacientov. Piati pacient nedokoncili sledovanie pre ochorenie COVID-19, alebo z iných zdravotných dôvodov. V analyzovanom súbore bolo 6 mužov a 19 žien. Popisná štatistika súboru a vývoj SIA v case je zobrazená vTabulke 1.
Tab. 1. Popisná štatistika súboru a vývoj SIA 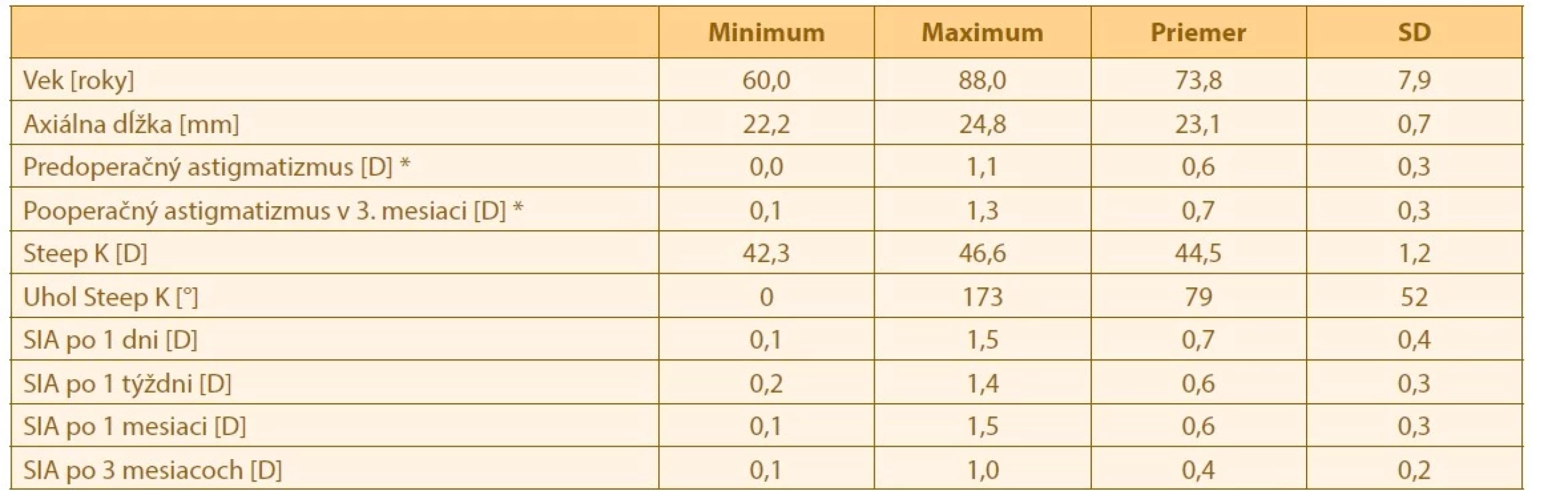
Steep K– najstrmšie zakrivenie rohovky
SIA – chirurgicky indukovaný astigmatizmus
SD – smerodajná odchýlka
* rohovkový astigmatizmus meraný pomocou Lenstar LS900SIA v jednotlivých casových obdobiach medzi sebou. Rozdiely medzi jednotlivými casovými bodmi boli štatisticky signifikantné (p < 0,05). Bol pozorovaný finálny pokles o 0,23 D, ktorý môže byt v niektorých prípadoch klinický signifikantný. Chirurgicky indukovaný astigmatizmus klesal v case, pricom najvýraznejší pokles nastal medzi prvým a tretím mesiacom. Zmenu SIA v case je zobrazená v Grafe 1.
Graf 1. Krabicový graf zobrazujúci zmenu hodnoty SIA v čase s oznacením kvartilov 
SIA – chirurgicky indukovaný astigmatizmus Realizovali sme aj post hoc analýzu Wilcoxonovým testom s Bonferroniho korekciou. Štatisticky signifikantný rozdiel v SIA bol v post hoc analýze medzi prvým dnom a tretím mesiacom (p<0,05) a medzi prvým a tretím mesiacom (p<0,05). Hodnoty významnosti sú uvedené po aplikácii Bonferroniho korekcie. Ostatné rozdiely boli štatisticky nesignifikantné.
Vývoj hodnoty pooperacnej refraktometrie uvedenej v sférickom ekvivalente je zobrazený v Tabulke 2.
Tab. 2. Vývoj hodnoty refraktometrie v čase 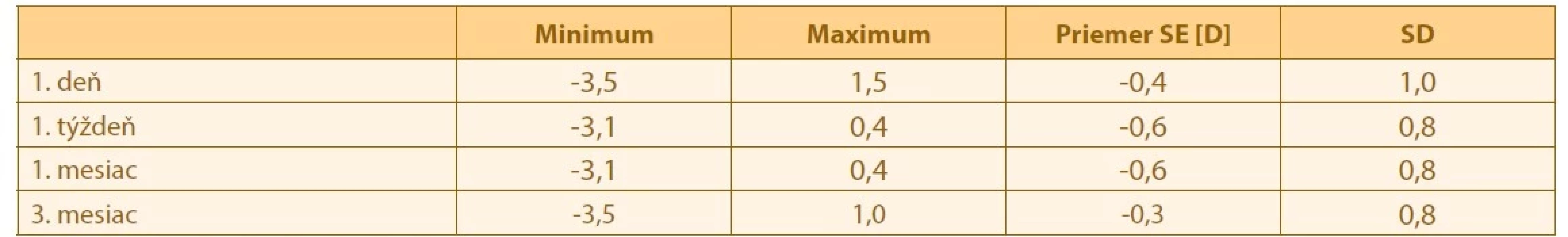
SE – sférický ekvivalent
SD – smerodajná odchýlkaRefraktometria spociatku vykazovala mierny myopický posun do prvého pooperacného týždna, až medzi prvým a tretím pooperacným mesiacom sa objavuje opacný trend. Tieto zmeny súvisia so zmenou v SIA aj so zmenou v polohe IOL, pricom efekt oboch javov nemožno iba na základe týchto hodnôt odlíšit. Vývoj zmeny refraktometrie nebol štatisticky signifikantný (Friedmanov test, p>0,05).
Vplyv IOL na celkovú hodnotu astigmatizmu sme zobrazili ako rozdiel celkového a rohovkového astigmatizmu. Vývoj jeho hodnoty je zobrazený v Tabulke 3. Rozdiel vo vývoji astigmatizmu bol štatisticky signifikantný (Friedmanov test, p < 0,05), konkrétne medzi prvým dnom a prvým mesiacom (p = 0,018, post hoc analýza s Bonferroniho korekciou).
Tab. 3. Vývoj astigmatizmu indukovaného IOL v čase 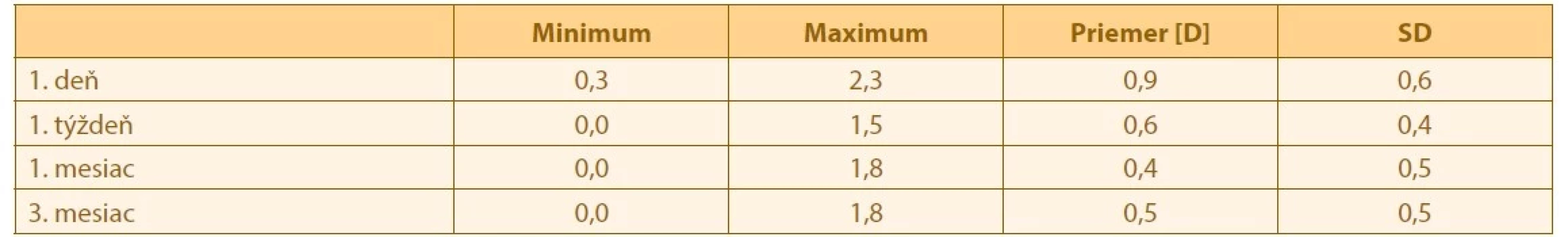
SD – smerodajná odchýlka Zamenitelnost hodnôt z keratometrie z biometru a AKRM sme analyzovali pomocou Blant-Altmanovej metódy. Analyzovali sme zvlášt hodnoty výšky astigmatizmu a jeho uhol. Priemery rozdielov v meraniach a limity zhody medzi nimi sú zobrazené v Tabulke 4.
Tab. 4. Rozdiely v meraniach medzi jednotlivými prístrojmi a ich limity zhody 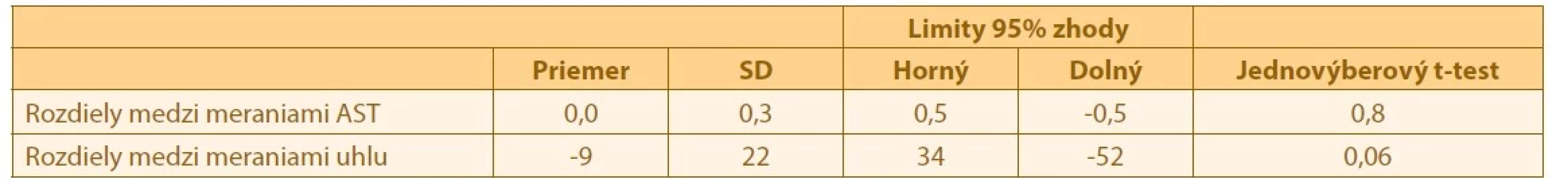
AST – astigmatizmus
SD – smerodajná odchýlkaHodnoty výšky astigmatizmu vykazovali štatisticky nesignifikantný rozdiel medzi meraniami (p = 0,80). Priemerný rozdiel hodnôt astigmatizmu medzi prístrojmi bol velmi malý (0,0 ±0,3 D). Lenstar nadhodnocoval hodnotu uhla o 9 ±22°. Zamenitelnost meraní je znázornená v Grafe 2, kde vidíme že dve hodnoty sa nachádzajú mimo 95% interval zhody. Pri uhle astigmatizmu bol rozdiel medzi meraniami tiež štatisticky nesignifikantný (p=0,06). Koreláciu meraní vidíme v Grafe 3. Rozsah limitu zhody medzi meraniami uhlu astigmatizmu (86°) sme považovali za velmi široký, preto sme analyzovali, ci nedochádza u vyšších astigmatizmov k väcším nepresnostiam v meraniach. Nenašli sme signifikantnú koreláciu medzi velkostou astigmatizmu a rozdielom v meraniach jeho uhlu ( p=0,43; Pearsonov korelacný koeficient r=0,16).
Graf 2. Blant-Altmanov graf zhody pri meraní hodnoty astigmatizmu 
AST – astigmatizmus Graf 3. Blant-Altmanov graf zhody pri meraní hodnoty uhla astigmatizmu 
AST – astigmatizmus DISKUSIA
V našej práci sme sledovali niekolko velicín súvisiacich anatomickou prestavbou operacných rán a iných ocných štruktúr po nekomplikovanej operácii katarakty. Hlavné zameranie bolo na sledovanie zmien v zakrivení rohovky po operacných rezoch v case vo forme SIA. Z výsledkov vyplýva, že proces hojenia z refrakcného hladiska nemôžme považovat za ukoncený ani mesiac po operácii. Qin He v svojej štúdii pozoroval štatisticky nesignifikantný pokles SIA medzi prvým a šiestym mesiacom o 0,1 D [8]. V našej štúdií sme pozorovali signifikantný pokles SIA, a aj velkost poklesu bola u nás medzi prvým a tretím mesiacom väcšia (0,2 D). Aj ked v Qinovej štúdii bol použitý 2,2 mm rez, co mohlo spôsobit celkovo nižší SIA a aj jeho nižší pokles. Na základe Qin Heho štúdie možno predpokladat, že pokles SIA medzi 3. a 6. mesiacom je zanedbatelný a neocakávali by sme další významný pokles ani v našom súbore. V Theodoulidouovej štúdii pozorovali pokles v SIA medzi 1. a 6. mesiacom od 0,3 do 0,12 D [9]. Podobný casový horizont sledovania zvolil Rainer vo svojej štúdii [10], kde však sledovali temporálny a supero-temporálny rez so šírkou 3 mm. Pri temporálnom reze pozorovali pokles SIA medzi 1. týždnom a 3. mesiacom o 0,3 D, co je viac ako v našom pozorovaní (my sme zaznamenali pokles o 0,21 D). Avšak pri supero-temporálnom reze dokonca zaznamenali nárast o 0,1 v danom casovom období. V našej štúdii sme pozorovali najväcší pokles medzi 1. a 3. mesiacom. Do prvého mesiaca bol vývoj astigmatizmu takmer bez zmeny. Podobný jav odsledoval Liang pri 2,2 aj pri 3,0 mm reze, kde tiež došlo k tretiemu mesiacu k výraznejšiemu poklesu SIA, a to o 0,08 D pri 2,2 mm reze a o 0,2 D pri 3,0 mm reze [11].
Zmena polohy IOL môže spôsobovat rôzne aberácie ako defokus, astigmatizmus, komu a iné aberácie vyššieho rádu. Tilt do 2–3° a decentrácia do 0,2–0,3 mm sú klinicky nesignifikantné takmer u všetkých typov IOL [12]. Menší vplyv na tieto aberácie pri zmene polohy IOL majú monofokálne sférické IOL v porovnaní s asférickými, torickými alebo multifokálnymi IOL [13]. Tilt a decentrácia IOL vznikajú na podklade rôznych faktorov. Patrí sem napríklad prirodzený tilt vlastnej pôvodnej šošovky [14], asymetrická fixácia IOL v puzdre (cast v puzdre, cast v sulkuse) a trhlina kapsuly [12]. Zatial co velká axiálna dlžka, hrubá šošovka a velká alebo decentrovaná kapsulorexa spôsobujú hlavne decentráciu, predošlá pars plana vitrektómia, krátka axiálna dlžka, nekompletné prekrytie optiky IOL kapsulou a kapsulárna fibrotizácia spôsobujú hlavne tilt [15-17]. Napríklad u asférickej monofokálnej IOL, horizontálny tilt spôsobuje astigmatizmus proti pravidlu. Pri 5° tilte spôsobuje 0,14 D a pri 10° je to 0,56 D u 28 D IOL [18]. V našej štúdií sme sa snažili faktory súvisiace s kapsulorexou eliminovat výberom pacientov, kde sme vylúcili decentrované kapsulorexy a kapsulorexy bez kompletného prekrytia optiky. Kedže sme vplyv šošovky pocítali iba na základe rozdielu medzi celkovou refrakciou a keratometriou, nemožno odlíšit vplyv tiltu od decentrácie a taktiež sme iba posudzovali vplyv na astigmatizmus, kedže aberácie vyššieho rádu neboli analyzované. Z výsledkov vidno (Tabulka 3), že najväcší pokles astigmatizmu indukovaného IOL nastáva medzi prvým dnom a týždnom, a následný pokles do tretieho mesiace je pozvolný. Tento výraznejší pokles je signifikantný medzi prvým nom a prvým mesiacom (p=0,018). Pravdepodobne to súvisí s vytvorením adhézií IOL s puzdrom v skorom pooperacnom období, co je súlade s teóriou, že kompletná kapsulárna adhézia nastáva u akrylických IOL už v 11. pooperacnom dni [19]. U vysoko myopických ocí je tento cas predlžený [20], avšak v našom súbore sa nenachádzal takýto typ ocí.
Pri porovnaní zhody v meraniach velkosti astigmatizmu pomocou AKM a biometra sme pozorovali štatisticky nesignifikatné rozdiely (p=0,8). Medzi prístrojmi pri meraní uhla astigmatizmu boli rozdiely tiež štatisticky nesignifikantné, ak ked iba naznacene (p=0,06). Hashemi v svojom sledovaní pozorovali pomerne dobrú zhodu v meraní velkosti astigmatizmu AKM s Lenstarom, co je v súlade s našimi pozorovaniami. Zhoda medzi prístrojmi sa však v ich štúdií zlepšila až pri aplikácii korekcie z regresného vzorca z ich analýzy [21]. Naše výsledky sa však nezhodujú s Altınelovou štúdiou aj s druhou Hashemiho štúdiou, ktorá však bola realizovaná na detoch [22,23]. Napriek nášmu pozorovaniu štatisticky nesignifikantého rozdielu medzi prístrojmi pri meraní velkosti astigmatizmu, je otázne, ci je rozsah zhody (1,0 D) klinicky akceptovatelný. Akceptovatelnost môže byt posudzovaná iba individuálne. Ani v jednej z uvedených štúdií neporovnávali zhodu v uhle astigmatizmu, aj ked v Hashemiho štúdií na detoch bola analýza robená na vektorovom zápise astigmatizmu, ktorý už v sebe zahrna informácie o sile aj uhle astigmatizmu. Tým pádom sú obe veliciny tažko oddelitelné pri analýze. V našej štúdii sme pozorovali z klinického hladiska široký interval limitov zhody pri porovnaní meraní uhlu astigmatizmu (86°). Tu je tiež otázne, ci takto široký interval zhody je klinicky akceptovatelný, kedže sa už blíži 90°, co kompletne mení astigmatizmus. Velkost rozdielov v meraniach uhlu nekorelovali a výškou astigmatizmu (p = 0,43; r=0,16).
Naša štúdia poukázala na vývoj rohovkového astigmatizmu pri hojení rezov po operácii katarakty v case. Taktiež sledovala nepriamo stabilizáciu IOL v puzdre šošovky. Výhodou je homogénny súbor pacientov, operovaných jedným operatérom s jedným typom IOL a rovnakou technikou. Možnými nedostatkami štúdie je, že pri hodnotení vývoja astigmatizmu nebola meraná dlžka rezu, ktorá môže ovplyvnovat hojenie a SIA. Taktiež pri zmenách polohy IOL neboli merané aberácia vyššieho rádu a reálna zmena polohy IOL.
Práca nebola zadaná inému casopisu ani inde publikovaná. Autori práce prehlasujú, že vznik aj téma odbornej práce a jej zverejnenie nie je v strete záujmov a nie je podporené žiadnou farmaceutickou firmou.
Do redakce doruceno dne: 8. 11. 2022
Prijato k publikaci dne: 23. 1. 2023
MUDr. Mgr. Ivajlo Popov Ph.D, MPH, FEBO
Klinika oftalmológie LF UK a UN Bratislava
Ružinovská 6
82101 Bratislava
E-mail: ivajlo.popov@gmail.com
Zdroje
1. Azar D. Refractive Surgery. Elsevier, 2019.
2. Popov I, Waczulikova I, Stefanickova J, et al. Analysis of biometric parameters of 2340 eyes measured with optical biometer Lenstar LS900 in a Caucasian population. Eur J Ophthalmol. 2021; 1120672121998920.
3. Acosta R, Hoffmeister L, Román R, Comas M, Castilla M, Castells X. Systematic review of population-based studies of the prevalence of cataracts. Arch Soc Espanola Oftalmol. 2006;81 : 509-516.
4. Marek R, Klus A, Pawlik R. Comparison of surgically induced astigmatism of temporal versus superior clear corneal incisions. Klin Oczna. 2006;108 : 392-396.
5. Kamil S, Mohan RR. Corneal stromal wound healing: Major regulators and therapeutic targets. Ocul Surf. 2021;19 : 290-306.
6. Sánchez-Tabernero S. SIA-formula: an easy way to calculate surgically induced astigmatism. Eye. 2018;32 : 659-660.
7. Bland JM, Altman DG. Measuring agreement in method comparison studies. Stat Methods Med Res. 1999;8 : 135-160.
8. He Q, Huang J, He X, Yu W, Yap M, Han W. Eect of corneal incision features on anterior and posterior corneal astigmatism and higher-order aberrations after cataract surgery. Acta Ophthalmol (Copenh). 2021;99:e1027-e1040.
9. Theodoulidou S, Asproudis I, Kalogeropoulos C, Athanasiadis A, Aspiotis M. The role of sideport incision in astigmatism change after cataract surgery. Clin Ophthalmol Auckl NZ. 2015;9 : 1421-1428.
10. Rainer G, Menapace R, Vass C, Annen D, Findl O, Schmetterer K. Corneal shape changes after temporal and superolateral 3.0 mm clear corneal incisions. J Cataract Refract Surg. 1999;25 : 1121-1126.
11. Liang JL, Xing XL, Yang XT, Jiang YF, Zhang H. [Clinical comparison analysis in surgically induced astigmatism of the total, anterior and posterior cornea after 2.2-mm versus 3.0-mm clear corneal incision cataract surgery]. Zhonghua Yan Ke Za Zhi Chin J Ophthalmol. 2019;55 : 495-501.
12. Ale JB. Intraocular lens tilt and decentration: a concern for contemporary IOL designs. Nepal J Ophthalmol Biannu Peer-Rev Acad J Nepal Ophthalmic Soc NEPJOPH. 2011;3 : 68-77.
13. Ashena Z, Maqsood S, Ahmed SN, Nanavaty MA. Effect of Intraocular Lens Tilt and Decentration on Visual Acuity, Dysphotopsia and Wavefront Aberrations. Vision. 2020;4 : 41.
14. Kimura S, Morizane Y, Shiode Y, et al. Assessment of tilt and decentration of crystalline lens and intraocular lens relative to the corneal topographic axis using anterior segment optical coherence tomography. PloS One. 2017;12:e0184066.
15. Chen X, Gu X, Wang W, et al. Characteristics and factors associated with intraocular lens tilt and decentration after cataract surgery. J Cataract Refract Surg. 2020;46 : 1126-1131.
16. Uzel MM, Ozates S, Koc M, Taslipinar Uzel AG, Yılmazbas P. Decentration and Tilt of Intraocular Lens after Posterior Capsulotomy. Semin Ophthalmol. 2018;33 : 766-771.
17. Ding X, Wang Q, Xiang L, Chang P, Huang S, Zhao Y-E. Three-Dimensional Assessments of Intraocular Lens Stability With High-Speed Swept-Source Optical Coherence Tomography. J Refract Surg Thorofare NJ. 1995 2020;36 : 388-394.
18. Weikert MP, Golla A, Wang L. Astigmatism induced by intraocular lens tilt evaluated via ray tracing. J Cataract Refract Surg 2018;44 : 745-749.
19. Hayashi H, Hayashi K, Nakao F, Hayashi F. Elapsed time for capsular apposition to intraocular lens after cataract surgery. Ophthalmology. 2002;109 : 1427-1431.
20. Zhao Y, Li J, Lu W, et al. Capsular adhesion to intraocular lens in highly myopic eyes evaluated in vivo using ultralong-scan-depth optical coherence tomography. Am J Ophthalmol. 2013;155 : 484 - 491.e1.
21. Hashemi H, Asgari S, Miraftab M, Emamian MH, Shariati M, Fotouhi A. Agreement study of keratometric values measured by Biograph/ LENSTAR, auto-kerato-refractometer and Pentacam: decision for IOL calculation. Clin Exp Optom. 2014; 97 : 450-455.
22. Altınel MG, Uslu H. Agreement of keratometric readings measured using rotating Scheimpflug imaging, auto-refractokeratometer, and biograph in eyes with keratoconus. Int Ophthalmol. 2021;41 : 1659-1669.
23. Hashemi H, Heydarian S, Khabazkhoob M, Yekta A, Emamian MH, Fotouhi A. Keratometry in children: Comparison between auto-refractokeratometer, rotating scheimpflug imaging, and biograph. J Optom. 2019;12 : 99-110.
Štítky
Oftalmologie
Článek Zprávy
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2023 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
-
Všechny články tohoto čísla
- TRAUMA-RELATED ACUTE MACULAR NEURORETINOPATHY. A CASE REPORT
- Zprávy
- FORMY OČNÍ LARVÁLNÍ TOXOKARÓZY V DĚTSTVÍ. PŘEHLED
- CENTRAL CORNEAL THICKNESS AND INTRAOCULAR PRESSURE CHANGES POST- PHACOEMULSIFICATION SURGERY IN GLAUCOMA PATIENTS WITH CATARACT
- VISUAL OUTCOMES, CONTRAST SENSITIVITY, AND SATISFACTION WITH MULTIFOCAL INTRAOCULAR LENS BLENDED TECHNIQUE: LATE MID-TERM RESULTS
- ZMENY CHIRURGICKY INDUKOVANÉHO ASTIGMATIZMU ROHOVKY A POLOHY UMELEJ VNÚTROOCNEJ ŠOŠOVKY V CASE
- SEVERE NEAR REFLEX SPASM IN A HEALTHY TEENAGER. A CASE REPORT
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- FORMY OČNÍ LARVÁLNÍ TOXOKARÓZY V DĚTSTVÍ. PŘEHLED
- ZMENY CHIRURGICKY INDUKOVANÉHO ASTIGMATIZMU ROHOVKY A POLOHY UMELEJ VNÚTROOCNEJ ŠOŠOVKY V CASE
- VISUAL OUTCOMES, CONTRAST SENSITIVITY, AND SATISFACTION WITH MULTIFOCAL INTRAOCULAR LENS BLENDED TECHNIQUE: LATE MID-TERM RESULTS
- CENTRAL CORNEAL THICKNESS AND INTRAOCULAR PRESSURE CHANGES POST- PHACOEMULSIFICATION SURGERY IN GLAUCOMA PATIENTS WITH CATARACT
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



