-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
PRIMÁRNÍ GLAUKOM OTEVŘENÉHO ÚHLU NA PODKLADĚ MUTACÍ V GENU MYOC
PRIMARY OPEN-ANGLE GLAUCOMA DUE TO MUTATIONS IN THE MYOC GENE
Aim: Mutations in the myocilin gene (MYOC) cause trabecular dysfunction and thus are involved in the pathogenesis of primary open-angle glaucoma (POAG). The aim of this study was to characterize and describe the clinical findings in two Czech families with POAG due to pathogenic variants in the MYOC gene.
Material and methods: Members of the two families affected by POAG underwent complete ophthalmological examination. In the proband from the first family, a direct sequencing of the three most frequent mutations in the MYOC gene was performed, and in the proband from the second family, an exome sequencing was performed. Other family members underwent targeted tests using direct sequencing.
Results: In total, 10 individuals diagnosed with POAG aged 20–70 years (mean 32.2 years, SD ±10,9 years) were examined. Eight of them showed advanced glaucomatous neuropathy with severe changes in the retinal nerve fiber layer. Clinical signs of POAG were present in six individuals in the third decade of life already; another four developed POAG during the fourth decade of life. Eight out of 10 patients had to undergo filtration surgery. Surgery was performed within 1 to 7 years of diagnosis, but mostly was performed within 2 years of glaucoma diagnosis. In the first family, MYOC variant c.1099G>A p.(Gly367Arg) was shown in the affected family members; in the second family MYOC variant c.1440C>A p.(Asn480Lys), both in heterozygous state. The changes were assessed as pathogenic.
Conclusion: Our study is the first to describe mutations in the MYOC gene causing POAG in Czech patients. Genetic testing may be recommended for this diagnosis, especially in individuals with early presentation and a positive family history. Carriers of pathogenic variants of the MYOC gene have a lifetime risk of developing POAG of more than 50% and the course of their disease is often more aggressive, requiring surgical intervention to permanently control the intraocular pressure.
Keywords:
Mutation – Myocilin – primary open angle glaucoma – juvenile glaucoma
Autoři: A. Vergaro 1,2; L. Rezková 1; M. Fichtl 1; J. Jedličková 2; Ľ. Ďuďáková 2; E. Růžičková 1; P. Lišková 1,2
Působiště autorů: Oční klinika, 1. lékařská fakulta, Univerzita Karlova a Všeobecná fakultní nemocnice v Praze 1; Laboratoř pro studium vzácných nemocí, Klinika pediatrie a dědičných poruch metabolismu, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze 2
Vyšlo v časopise: Čes. a slov. Oftal., 78, 2022, No. 5, p. 242-248
Kategorie: Původní práce
doi: https://doi.org/10.31348/2022/25Souhrn
Cíle: Mutace v genu myocilin (MYOC) vedou k dysfunkci trámčiny a mají tak vliv na etiopatogenezi primárního glaukomu s otevřeným úhlem (PGOÚ). Cílem práce bylo charakterizovat a popsat klinické nálezy ve dvou českých rodinách s PGOÚ vzniklým na podkladě patogenních variant v tomto genu.
Materiál a metody: Příslušníci dvou rodin s výskytem PGOÚ podstoupili komplexní oftalmologické vyšetření. U probanda z první rodiny jsme provedli přímé sekvenování tří nejčastějších mutací v genu MYOC a u probanda z druhé rodiny pak exomové sekvenování. Ostatní rodinní příslušníci byli cíleně testováni pomocí přímého sekvenování.
Výsledky: Celkem jsme vyšetřili 10 jedinců s diagnózou PGOÚ ve věku 20–70 let (průměr 32,2 let, SD ±10,9 let). Osm z nich vykazovalo obraz pokročilé glaukomové neuropatie se závažnými změnami vrstvy nervových vláken. K manifestaci PGOÚ došlo u šesti jedinců již ve třetí dekádě života, u ostatních čtyř pak v průběhu čtvrté dekády života. U osmi z 10 pacientů bylo nutné přikročit k provedení filtrační operace. Operace proběhla v rozmezí 1–7 let od stanovení diagnózy, u většiny však byla provedena do dvou let od stanovení diagnózy. V první rodině byla u postižených členů nalezena v MYOC varianta c.1099G>A p.(Gly367Arg), ve druhé rodině pak c.1440C>A p.(Asn480Lys), obě v heterozygotním stavu. Změny byly vyhodnoceny jako patogenní.
Závěr: Naše studie jako první popisuje u českých pacientů mutace v genu MYOC způsobující PGOÚ. Genetické testování lze u této diagnózy doporučit především u jedinců s časnou manifestací a pozitivní rodinnou anamnézou. Nositelé patogenních variant genu MYOC mají celoživotní riziko vzniku PGOÚ více než 50% a průběh jejich onemocnění je často agresivnější, vyžadující chirurgickou intervenci k trvalé kompenzaci nitroočního tlaku.
Klíčová slova:
mutace – Myocilin – primární glaukom s otevřeným úhlem – juvenilní glaukom
ÚVOD
Glaukom je neurodegenerativní onemocnění, které patří celosvětově mezi hlavní příčiny závažné nevratné ztráty zraku [1]. Nejčastější formu představuje primární glaukom s otevřeným úhlem (PGOÚ). Etiopatogeneze PGOÚ nebyla dosud zcela objasněna, nicméně byl prokázán významný vliv genetických faktorů [2]. U pacientů s časnou manifestací do 40 let věku je třeba uvažovat o Mendelovském typu přenosu, tedy zásadnímu vlivu variant v jednom genu pro vznik onemocnění, zatímco u jedinců s pozdější manifestací se nejčastěji jedná o dědičnost polygenní [3].
Mutace v genu MYOC jsou nejčastější příčinou monogenně podmíněného glaukomu, dle literatury tvoří 10 % všech juvenilních glaukomů s otevřeným úhlem a 2–4 % PGOÚ s manifestací v dospělosti [4]. Doposud bylo v tomto genu identifikováno více než 70 patogenních variant [5].MYOC kóduje protein myocilin, jehož fyziologická funkce nebyla doposud zcela objasněna. Myocilin je intracelulárně proteolyticky degradován a jeho fragmenty jsou pak uvolněny do extracelulárního prostoru. Interakcí s proteiny mezibuněčné hmoty se pak podílejí na homeostáze trámčiny. Přestože myocilin nacházíme v mnoha tkáních, mutace v MYOC způsobují pouze onemocnění oka [4]. Hlavní hypotéza patofyziologického mechanismu zahrnuje apoptotickou ztrátu buněk v trámčině, která vede k její dysfunkci a následně k elevaci nitroočního tlaku (NOT) [5].
Cílem práce bylo popsat klinické projevy PGOÚ asociovaným s mutacemi v genu MYOC ve dvou rodinách českého původu.
MATERIÁL A METODY
Výzkum popsaný v této práci byl schválen Etickou komisí VFN v Praze a všichni účastníci nebo jejich zákonní zástupci podepsali informovaný souhlas.
Probandi ze dvou vzájemně nepříbuzných rodin s výskytem PGOÚ byli odesláni na konziliární vyšetření na naše pracoviště. Primárním důvodem byla dekompenzace NOT při maximální farmakologické léčbě. Komplexní oční vyšetření zahrnovalo stanovení nejlepší korigované zrakové ostrosti na Snellenových optotypech s hodnotami převedenými do decimální podoby, měření NOT Goldmanovým aplanačním tonometrem, vyšetření zorného pole pomocí statického perimetru na přístroji Medmont M700 (Medmont International, Nunawading, Austrálie) a optickou koherenční tomografii se spektrální doménou (SD‐OCT) na přístroji Spectralis (Heidelberg Engineering GmbH, Heidelberg, Německo). Kromě řezu makul jsme měřili i tloušťku peripapilární vrstvy nervových vláken (RNFL) pomocí cirkulárních skenů ve vzdálenosti 3,5–3,6 mm od centra terče zrakového nervu. Jako fyziologické rozmezí celkové tloušťky RNFL byl považován interval 97,41 ±11,73 μm u dětí a 97,52 ±9,83 μm u dospělých [6]. Stejným způsobem byli vyšetřeni i další rodinní příslušníci.
Dále byla provedena podrobná genealogická analýza včetně zakreslení rodokmenu obou rodin a molekulárně genetické vyšetření. DNA byla extrahována ze vzorku venózní krve pomocí kitu Gentra Puregene Blood Kit (Qiagen GmbH, Hilden, Německo) nebo ze vzorku slin pomocí kitu Oragene (Oragene OG-300, DNA Genotek, Kanada). U probanda z rodiny č. 1 bylo dále provedeno Sangerovo sekvenování tří PCR produktů genu MYOC (referenční sekvence NM_000261.2) pokrývající jeho 3. exon, ve kterém se dle literatury nachází většina patogenních mutací [4]. DNA byla amplifikována pomocí námi navržených primerů (sekvence jsou dostupné na vyžádání v laboratoři) a sekvenována na kapilárním sekvenátoru ABI PRISM 3100 Genetic Analyzer (Applied Biosystems, Foster City, Kalifornie, USA). U probanda z rodiny č. 2 bylo provedeno exomové sekvenování. Sekvenační knihovny byly generovány kitem SureSelect Human All Exome V6 capture kit (Agilent, Santa Clara, Kalifornie, USA). Knihovny byly sekvenovány přístrojem Novaseq6000 (Illumina, San Diego, Kalifornie, USA). Sangerovo sekvenování bylo použito i pro cílené testování přítomnosti zjištěných mutací u dalších příbuzných. Efekt detekovaných variant byl stanoven na základě kritérií Americké vysoké školy lékařské genetiky a genomiky a Společností pro molekulární patologii [7].
VÝSLEDKY
Probandovi z rodiny č. 1 byla stanovena diagnóza PGOÚ ve 42 letech a na naše pracoviště byl odeslán ve věku 49 let pro elevaci NOT nereagující na trojkombinaci lokálních antiglaukomatik. Jeho klinické vyšetření prokázalo glaukomovou neuropatii s asymetrickou vertikální exkavací terče zrakového nervu (Obrázek 1A, C). Při SD-OCT vyšetření bylo přítomno významné snížení tloušťky RNFL s celkovou hodnotou 57 μm vpravo a 42 μm vlevo (Obrázek 1B, D). Pomocí automatické perimetrie byly oboustranně identifikovány absolutní skotomy odpovídající segmentům se sníženou tloušťkou RNFL. Maximum změn zorného pole bylo v dolní Bjerrumově oblasti (Obrázek 1E, F). Gonioskopické vyšetření prokázalo otevřený komorový úhel.
Obr. 1. Klinické nálezy u probanda z rodiny č.1 v době první návštěvy na našem pracovišti. SD-OCT MultiColor fotografie očního pozadí oka pravého (A) a levého (C) ukazující glaukomovou exkavaci na obou očích, měření peripapilární tloušťky RNFL pravého oka (B) a levého oka (D) dokumentující významné snížení na hodnoty pod 5 (žluté sektory) a 1 (červené sektory) percentilem normativní databáze, statická automatická perimetrie (glaukomový program) pravého oka s absolutními skotomy v dolní Bjerrumově oblasti (E) a levého oka (F) kde jsou patrné ne zcela typické skotomy pouze částečně odpovídající Bjerrumově oblasti avšak vysoce korelující s hodnotami RNFL 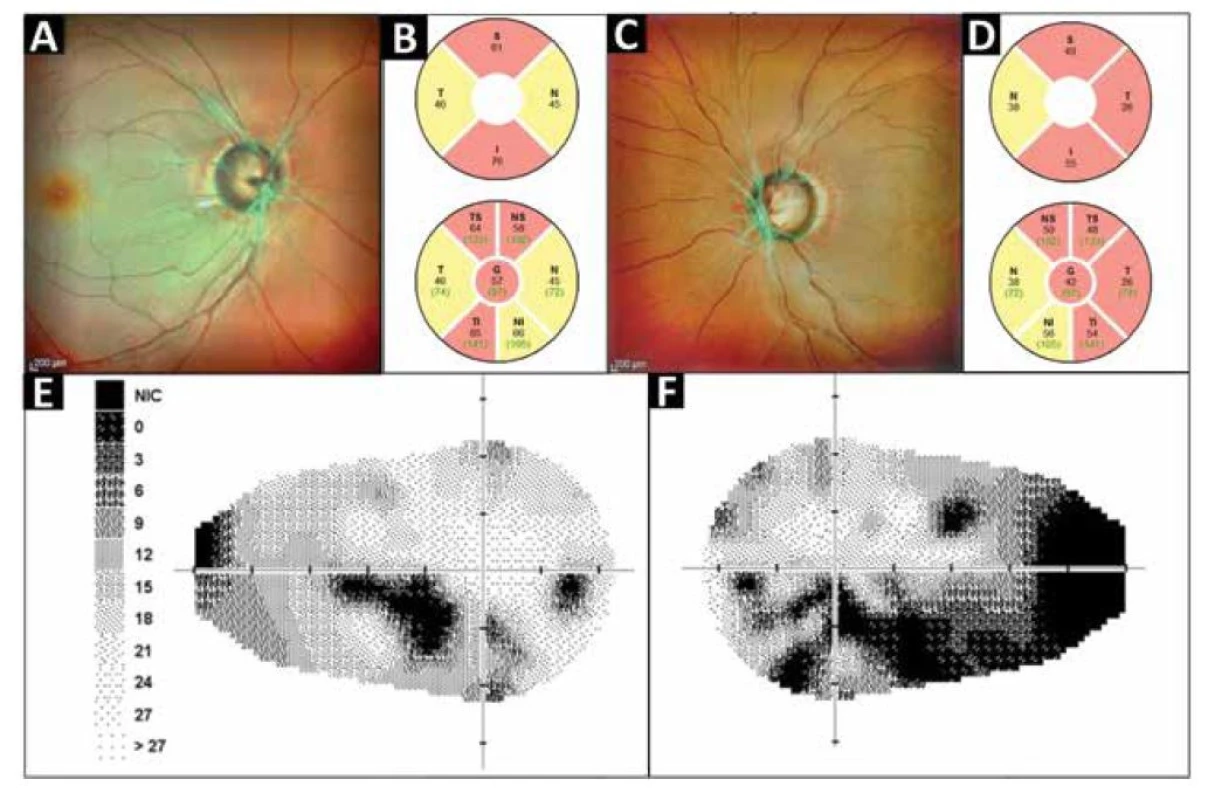
RNFL – peripapilární vrstva nervových vláken Na našem pracovišti byla následně provedena trabekulektomie s implantátem Ologen (Aeon Astron Europe BV, Leiden, Nizozemsko) oboustranně. Po operaci zůstal NOT pravého oka v rozmezí 8–16 mmHg bez terapie v průběhu sledovacího období šesti měsíců po výkonu. Na levém oku došlo rok po provedení filtrační operace k dekompenzaci NOT k 24 mmHg, ke kompenzaci NOT došlo až po nasazení fixní kombinované terapie brinzolamidem a brimonidinem.
Z rodiny č. 1 jsme dále vyšetřili tři muže. Diagnóza PGOÚ u nich byla stanovena v průměrném věku 39,25 let (rozmezí 22–47). U tří ze čtyř rodinných příslušníků byl tedy PGOÚ diagnostikován v průběhu čtvrté dekády života a u jednoho v dekádě třetí a v souladu s touto diagnózou jsme zaznamenali oboustrannou výraznou atrofii RNFL u všech jedinců (Tabulka 1). V době prvního vyšetření na našem pracovišti dva z nich (Obrázek 2A, I:1, II:1) měli zvýšený NOT i přes terapii třemi nebo více antiglaukomatiky. Filtrační operace byla nakonec nutná ke kompenzaci NOT u všech čtyř postižených rodinných příslušníků. Základní klinické údaje a provedené operace u vyšetřených jedinců z rodiny č. 1 jsou shrnuty v Tabulce 1.
Tab. 1. Souhrn klinických nálezů vyšetřených pacientů, prokázaných heterozygotních nositelů patogenních variant v genu MYOC z obou rodin. Označení pacientů je dle zaznamenaných rodokmenů (Obrázek 2). Věk je udáván v letech, hodnota RNFL představuje celkovou tloušťku, pokud bylo měření provedeno jindy než při prvním vyšetření, je věk udán v závorce 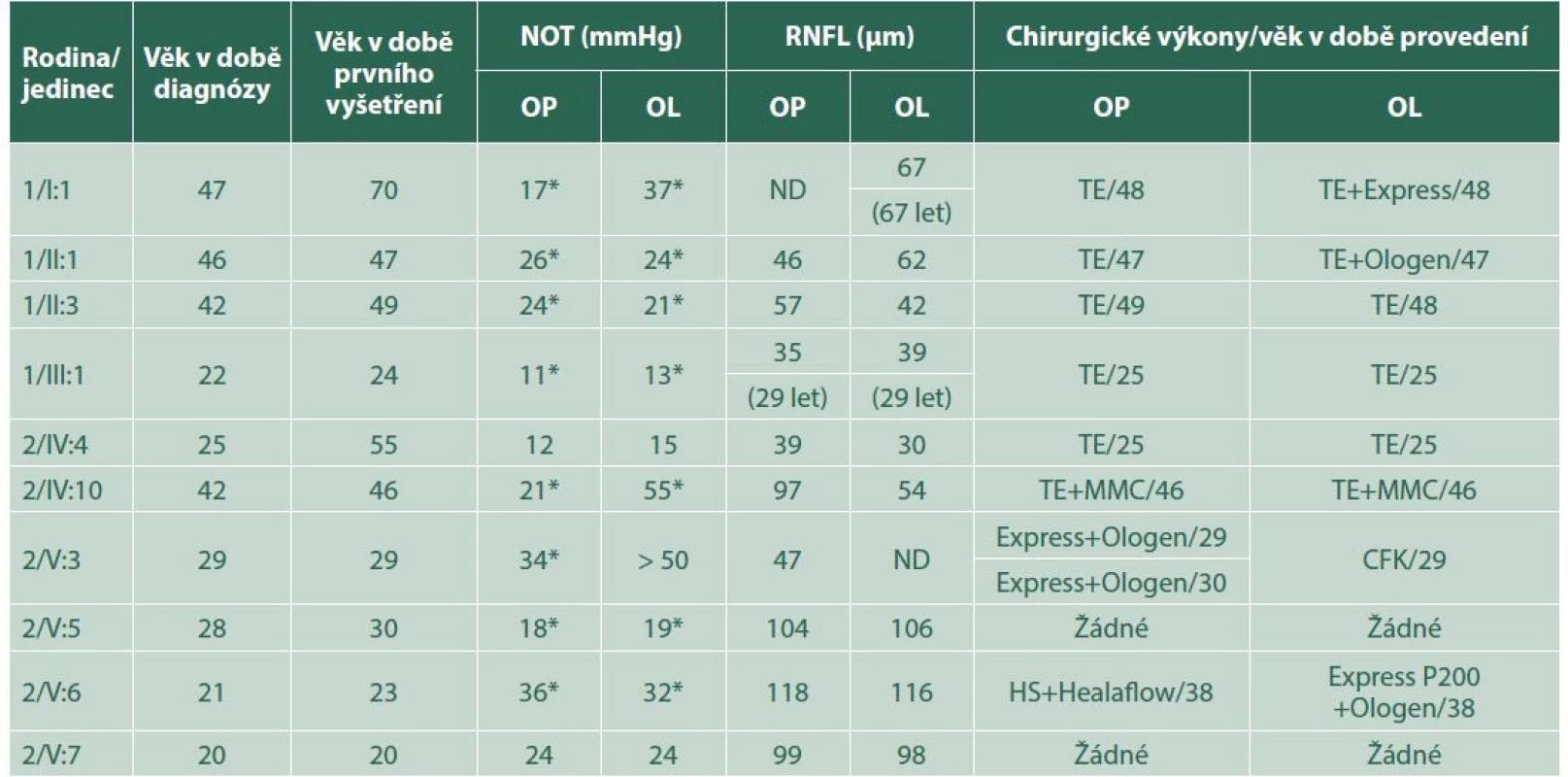
*zkratka NOT znamená nitrooční tlak při použití kombinace tří a více antiglaukomatik
CFK – cyklofotokoagulace, MMC – 0,04% mitomycin, OP – oko pravé, OL – oko levé, RNFL – peripapilární vrstva nervových vláken, TE – trabekulektomie, HS – hluboká sklerektomie, ND – údaj není k dispoziciU probanda z rodiny č. 1 (II:3, Obrázek 2A) byla v genu MYOC zjištěna v heterozygotním stavu mutace c.1099G>A p.(Gly367Arg), která byla v souvislosti s PGOÚ opakovaně popsána [8–12]. Varianta byla klasifikována jako patogenní, což bylo v souladu s databází Clinvar (https://www.ncbi.nlm.nih.gov/clinvar/), kde je také interpretována jako kauzální pod identifikátorem VCV000007952.2. Tato mutace byla zjištěna u všech rodinných příslušníků s diagnózou PGOÚ, tedy u mužů: I:1, II:1, II:3, III:1, a naopak nebyla nalezena u ženy III:2, která byla bez známek glaukomového onemocnění (Obrázek 2A).
Obr. 2. Rodokmeny dvou rodin s PGOÚ na podkladě patogenních variant v genu MYOC. Rodina č. 1 s mutací M1 c.1099G>A v heterozygotním stavu, která byla detekována u čtyř postižených jedinců (A). Rodina č. 2 s mutací M2 c.1440C>A v heterozygotním stavu, která byla prokázána u devíti postižených jedinců (B). Probandi jsou označeni černou šipkou, jedinci klinicky vyšetřeni alespoň jedním z autorů hvězdičkou, černé kolečko označuje ženu s PGOÚ, černý čtvereček muže s PGOÚ. Výsledky genetického testování genu MYOC jsou ukázány pouze u molekulárně geneticky vyšetřených jedinců. Všichni prokázaní nositelé patogenních variant vykazovali známky PGOÚ (diagnóza PGOÚ u jedinců, kteří nebyli vyšetřeni na našem pracovišti [tj. IV:2, IV:7, IV:9] byla stanovena na jiném pracovišti, což bylo ověřeno na základě dostupných lékařských zpráv). WT označuje referenční sekvenci (anglicky „wild type“) ![Rodokmeny dvou rodin s PGOÚ na podkladě patogenních variant v genu MYOC. Rodina č. 1 s mutací M1
c.1099G>A v heterozygotním stavu, která byla detekována u čtyř postižených jedinců (A). Rodina č. 2 s mutací M2
c.1440C>A v heterozygotním stavu, která byla prokázána u devíti postižených jedinců (B). Probandi jsou označeni černou
šipkou, jedinci klinicky vyšetřeni alespoň jedním z autorů hvězdičkou, černé kolečko označuje ženu s PGOÚ, černý
čtvereček muže s PGOÚ. Výsledky genetického testování genu MYOC jsou ukázány pouze u molekulárně geneticky
vyšetřených jedinců. Všichni prokázaní nositelé patogenních variant vykazovali známky PGOÚ (diagnóza PGOÚ u jedinců,
kteří nebyli vyšetřeni na našem pracovišti [tj. IV:2, IV:7, IV:9] byla stanovena na jiném pracovišti, což bylo ověřeno na
základě dostupných lékařských zpráv). WT označuje referenční sekvenci (anglicky „wild type“)](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/38602e09b216e08d6670997d50656921.jpg)
PGOÚ – primární glaukom s otevřeným úhlem Probandovi z rodiny č. 2 (IV:10, Obrázek 2B) bylo v době našeho prvního vyšetření 46 let. Odeslán byl pro oboustrannou asymetrickou elevaci NOT refrakterní na maximální antiglaukomovou terapii: trojkombinaci lokálních antiglaukomatik a celkově podávaný acetazolamid 250 mg třikrát denně. Diagnóza PGOÚ mu byla stanovena ve věku 42 let. Paralelně s hodnotami NOT prokázala i ostatní klinická vyšetření značnou asymetrii mezi oběma očima s koncentrickým zúžením zorného pole k 10 stupňům a významným snížením tloušťky RNFL na horším levém oku oproti normálnímu rozsahu zorného pole, absenci významné exkavace a fyziologické křivce RNFL na pravém oku (Obrázek 3). U tohoto pacienta byla bezprostředně oboustranně provedena trabekulektomie s aplikací 0,04 % mitomycinu. V průběhu sledovacího období jednoho roku nedošlo k elevaci NOT ani k progresi perimetrického nálezu ani na jednom oku. Vyšetření RNFL na pravém oku nevykazovalo progresi, na levém oku bylo identifikováno další významné snížení tloušťky ve všech kvadrantech, což lze vysvětlit pokročilostí nálezu v době operace a velmi vysokým předoperačním NOT.
Obr. 3. Oční vyšetření probanda z rodiny č. 2 v době první návštěvy na našem pracovišti. Barevná fotografie fundu pravého (A) a levého oka (C) zobrazuje výraznou asymetrii mezi exkavacemi papil zrakového nervu. Statická automatická perimetrie (glaukomový program) dokumentující markantní asymetrii mezi rozsahem zorného pole pravého (E) a levého oka (F), odpovídající měření peripapilární tloušťky RNFL pravého (B) a levého oka (D) 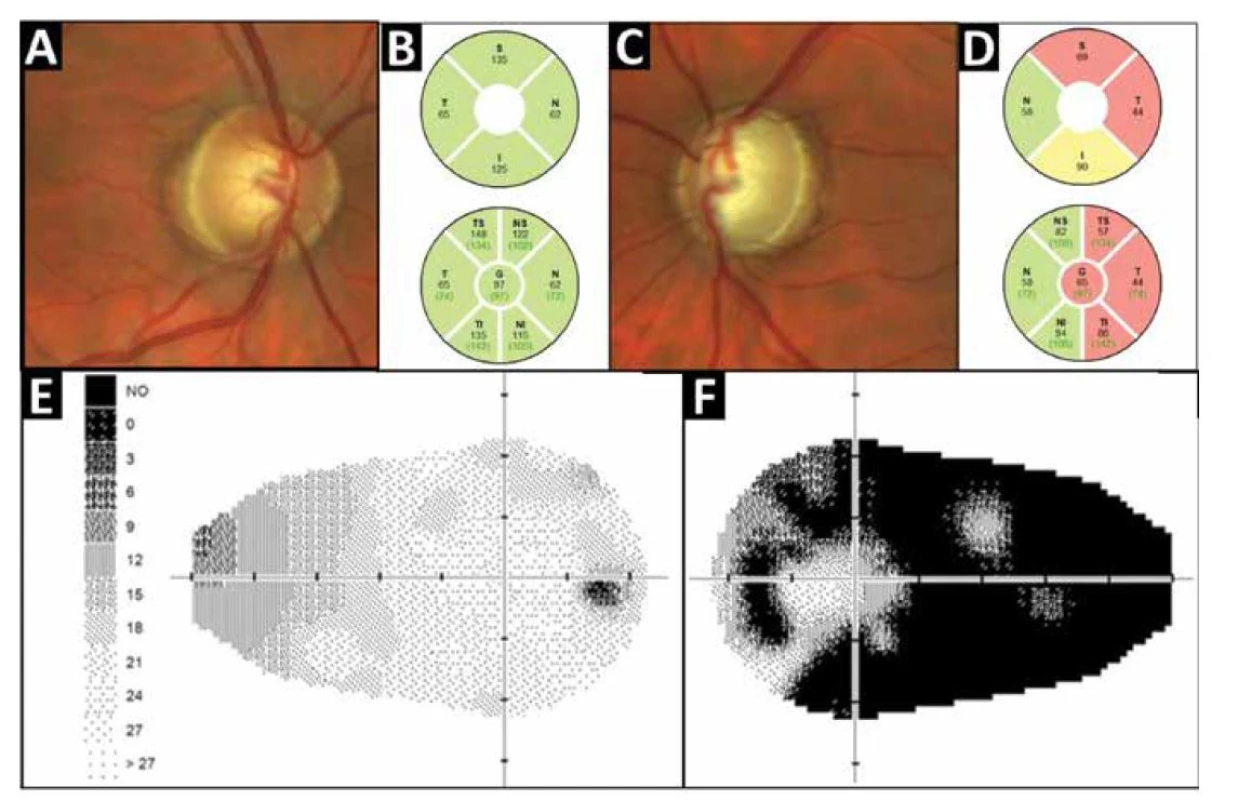
RNFL – peripapilární vrstva nervových vláken Celkem byla filtrační operace nutná ke kompenzaci NOT u čtyř ze šesti rodinných příslušníků vyšetřených na našem pracovišti (Tabulka 1). Důvodem pro odeslání byla u čtyř jedinců elevace NOT neodpovídající na tři a více lokálních antiglaukomatik a přítomnost onemocnění v rodině u dvou jedinců. U čtyř ze šesti pacientů byla diagnóza PGOÚ stanovena v průběhu třetí dekády života a nejmladšímu jedinci ve 21 letech. U tohoto pacienta byla po dvou letech sledování provedena filtrační operace oboustranně. Pacientce V:7 (Obrázek 2B) byla ve 20 letech stanovena diagnóza oční hypertenze a při opakované elevaci NOT nad 30 mmHg a pozitivní rodinné anamnéze byla nasazena monoterapie prostaglandinem.
U probanda z rodiny č. 2 byla v genu MYOC nalezena v heterozygotním stavu patogenní varianta c.1440C>A; p.(Asn - 480Lys). Tato mutace byla zjištěna i u dalších rodinných příslušníků IV:2, IV:4, IV:7, IV:9, V:3, V:5, V:6 a V:7 (Obrázek 2B). Také varianta c.1440C>A byla v souvislosti s výskytem PGOÚ opakovaně popsána [13–16]. Variantu jsme klasifikovali jako patogenní, stejně jako databáze Clinvar, kde je interpretována jako kauzální pod identifikátorem VCV000007951.1.
DISKUZE
V rámci této práce popisujeme u pacientů českého původu poprvé kauzální mutace v genu MYOC a související klinické nálezy.
Pacienti s PGOÚ na podkladě mutací v genu MYOC mívají zpravidla elevaci NOT, kterou nelze kompenzovat pouze farmakologickou či laserovou léčbou, a ve většině případů je nutné přistupovat k řešení chirurgicky, nejčastěji provedením trabekulektomie.
PGOÚ způsobený mutacemi genu MYOC vykazuje inkompletní penetranci, což znamená, že klinicky detekovatelné glaukomové onemocnění se v průběhu života rozvine pouze u některých nositelů patogenních mutací. Pravděpodobnost vzniku PGOÚ se liší dle konkrétní varianty a dále se zvyšuje s věkem, přičemž závažnější mutace vedou ke vzniku PGOÚ častěji a dříve, např. p.(Thr - 377Met), která způsobuje onemocnění u 88 % nositelů do věku 30 let [17]. Je třeba zdůraznit, že není známá žádná patogenní varianta v genu MYOC, která by byla ve věku 30 let kompletně penetrantní.
Mutace p.(Gly367Arg) zjištěná u členů rodiny č. 1 byla opakovaně popsána u pacientů s PGOÚ v různých populacích a odhaduje se, že její nositelé mají více než 90 % riziko vzniku glaukomu do 50 let [8–11,18]. Diagnóza PGOÚ byla u nositelů této patogenní varianty stanovena většinou v průběhu čtvrté dekády života, nicméně nejnižší zaznamenaný věk v době manifestace byl 12 let [9]. Více než 50 % pacientů s PGOÚ na podkladě p.(Gly367Arg) musí podstoupit trabekulektomii ke kompenzaci NOT [8–11,18]. Údajům v literatuře odpovídají i naše pozorování. Průměrný věk diagnózy v rodině č. 1 byl 39,25 let (SD ±10,13 let) s průměrným NOT při prvním vyšetření 21,63 mmHg (SD ±7,71 mmHg), a to i přes užívání kombinace tří a více antiglaukomatik u všech čtyř vyšetřených pacientů. Nejvyšší zaznamenaný NOT byl 37 mmHg. U všech postižených rodinných příslušníků bylo nutno provést trabekulektomii ke kompenzaci NOT a všichni měli v době prvního vyšetření významné glaukomové změny na zorném poli a výrazný pokles RNFL.
Patogenní varianta p.(Asn480Lys) zjištěná ve druhé rodině je vzácnější; byla dosud nalezena pouze v několika rodinách ve Francii, Nizozemsku, Malajsii, Indii a Peru [13,15,16,19,20]. Průměrný věk diagnózy byl v publikovaných článcích nižší než 40 let a nejnižší věk, ve kterém byla stanovena diagnóza, činil 10 let [19]. Procento pacientů vyžadujících filtrační operaci ke kompenzaci NOT bylo v rozmezí 28–70 % [13,15,16]. V souladu s údaji z literatury činil v rodině č. 2 průměrný věk diagnózy PGOÚ 27,5 let (SD ±7,97 let), u 66 % pacientů bylo nutno provést filtrační operaci ke kompenzaci NOT, u všech oboustranně do dvou let od diagnózy PGOÚ. U jedné pacientky bylo nutno provést i cyklodestruktivní zákrok. S ohledem na velmi vysoký nitrooční tlak nereagující na tři a více antiglaukomatik a rodinnou anamnézu, byla provedena filtrační operace u dvou jedinců mladších 30 let, i když nevykazovali známky glaukomové neuropatie.
ZÁVĚR
Tato studie poprvé demonstruje roli mutací genu MYOC u glaukomového onemocnění v české populaci. Výsledky naší práce prokázaly, že příčinou PGOÚ v námi studovaných rodinách jsou MYOC mutace c. 1099G>A a c.1440C>A v heterozygotním stavu. PGOÚ na podkladě mutací v genu MYOC je autozomálně dominantní onemocnění s 50% rizikem přenosu na další generaci. V souladu s publikovanou literaturou potvrzujeme závažnost klinického průběhu PGOÚ na podkladě MYOC mutací včetně vysoké pravděpodobnosti nutnosti provedení filtrační operaci ke kompenzaci NOT. Identifikace nositelů mutací v rodinách umožňuje individuálně nastavit pravidelnost preventivního sledování za účelem včasného rozpoznání vzniku a progrese glaukomového onemocnění, ke zvážení je provedení filtrační operace při časných známkách PGOÚ ještě před vznikem neuropatie.
Poděkování
Práce byla podpořena granty UNCE/MED/007, SVV 2016/260148 a výzkumným grantem České glaukomové společnosti z roku 2019. Tento výstup vznikl v rámci programu Cooperatio, vědní oblasti Lékařská diagnostika a základní lékařské vědy.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Dále prohlašujeme, že práce nebyla zadána jinému časopisu ani jinde otištěna.
Do redakce doručeno dne: 6. 5. 2022
Přijato k publikaci dne: 27. 7. 2022
MUDr. Andrea Vergaro
Oční klinika 1. LF UK a VFN v Praze
U Nemocnice 2
12808 Praha 2
E-mail: andrea.vergaro@vfn.cz
Zdroje
1. Takamoto M, Araie M. Genetics of primary open angle glaucoma. Japanese Journal of Ophthalmology. 2014;58(1):1-15.
2. Khawaja AP, Viswanathan AC. Are we ready for genetic testing for primary open-angle glaucoma? Eye. 2018;32(5):877-883.
3. Wiggs JL, Pasquale LR. Genetics of glaucoma. Hum Mol Genet. 2017;26(R1):R21-R7.
4. Wang HW, Li MZ, Zhang ZZ, Xue HF, Chen X, Ji Y. Physiological function of myocilin and its role in the pathogenesis of glaucoma in the trabecular meshwork (Review). Int J Mol Med. 2019;43(2):671-681.
5. Resch ZT, Fautsch MP. Glaucoma-associated myocilin: A better understanding but much more to learn. Experimental Eye Research. 2009;88(4):704-712.
6. Chung HK, Han YK, Oh S, Kim SH. Comparison of Optical Coherence Tomography Measurement Reproducibility between Children and Adults. PLoS One. 2016;11(1):e0147448.
7. Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-424.
8. Iliev ME, Bodmer S, Gallati S, et al. Glaucoma phenotype in a large Swiss pedigree with the myocilin Gly367Arg mutation. Eye. 2008;22(7):880-888.
9. Gupta V, Somarajan BI, Gupta S, et al. The mutational spectrum of Myocilin gene among familial versus sporadic cases of Juvenile onset open angle glaucoma. Eye. 2021;35(2):400-408.
10. Faucher M, Anctil JL, Rodrigue MA, et al. Founder TIGR/myocilin mutations for glaucoma in the Quebec population. Hum Mol Genet. 2002;11(18):2077-2090.
11. Mansergh FC, Kenna PF, Ayuso C, Kiang AS, Humphries P, Farrar GJ. Novel mutations in the TIGR gene in early and late onset open angle glaucoma. Hum Mutat. 1998;11(3):244-251.
12. Chen J, Cai SP, Yu W, et al. Sequence analysis of MYOC and CYP1B1 in a Chinese pedigree of primary open-angle glaucoma. Mol Vis. 2011;17 : 1431-1435.
13. Mimivati Z, Nurliza K, Marini M, Liza-Sharmini A. Identification of MYOC gene mutation and polymorphism in a large Malay family with juvenile-onset open angle glaucoma. Mol Vis. 2014;20 : 714-723.
14. Rose R, Balakrishnan A, Muthusamy K, Arumugam P, Shanmugam S, Gopalswamy J. Myocilin mutations among POAG patients from two populations of Tamil Nadu, South India, a comparative analysis. Mol Vis. 2011;17(349-53):3243-3253.
15. Guevara-Fujita ML, Perez-Grossmann RA, Estrada-Cuzcano A, et al. Recurrent Myocilin Asn480Lys glaucoma causative mutation arises de novo in a family of Andean descent. J Glaucoma. 2008;17(1):67-72.
16. Hulsman CA, De Jong PT, Lettink M, Van Duijn CM, Hofman A, Bergen AA. Myocilin mutations in a population-based sample of cases with open-angle glaucoma: the Rotterdam Study. Graefe’s Archive for Clinical and Experimental Ophthalmology. 2002;240(6):468-474.
17. Mackey DA, Healey DL, Fingert JH, et al. Glaucoma phenotype in pedigrees with the myocilin Thr377Met mutation. Arch Ophthalmol. 2003;121(8):1172-1180.
18. Taniguchi F, Suzuki Y, Shirato S, Araie M. The Gly367Arg mutation in the myocilin gene causes adult-onset primary open-angle glaucoma. Jpn J Ophthalmol. 2000;44(4):445-8.
19. Adam MF, Belmouden A, Binisti P, et al. Recurrent Mutations in a Single Exon Encoding the Evolutionarily Conserved Olfactomedin - Homology Domain of TIGR in Familial Open-Angle Glaucoma. Hum Mol Genet. 1997;6(12):2091-2097.
20. Rose R, Balakrishnan A, Muthusamy K, Arumugam P, Shanmugam S, Gopalswamy J. Myocilin mutations among POAG patients from two populations of Tamil Nadu, South India, a comparative analysis. Mol Vis. 2011;17 : 3243-3253.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2022 Číslo 5- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Konjunktivitida a původce Corynebacterium macginleyi – kazuistika
-
Všechny články tohoto čísla
- PANDÉMIA SARS-COV-2 Z POHĽADU OFTALMOLÓGA. PREHĽAD
- ANALÝZA PŘEDOZADNÍHO POMĚRU OPTICKÉ MOHUTNOSTI ROHOVKY POMOCÍ OCT
- THE EXACTNESS OF INTRAOCULAR LENS POWER CALCULATION FORMULAS FOR SHORT EYES AND CORRELATION BETWEEN METHOD ACCURACY AND EYEBALL AXIAL LENGTH
- PRIMÁRNÍ GLAUKOM OTEVŘENÉHO ÚHLU NA PODKLADĚ MUTACÍ V GENU MYOC
- CHELACE ZONULÁRNÍ KERATOPATIE V DLOUHODOBÉM SLEDOVÁNÍ
- ATYPICKÉ FORMY OČNÍ TOXOPLAZMÓZY V DĚTSTVÍ. KAZUISTIKY
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- CHELACE ZONULÁRNÍ KERATOPATIE V DLOUHODOBÉM SLEDOVÁNÍ
- PANDÉMIA SARS-COV-2 Z POHĽADU OFTALMOLÓGA. PREHĽAD
- ATYPICKÉ FORMY OČNÍ TOXOPLAZMÓZY V DĚTSTVÍ. KAZUISTIKY
- PRIMÁRNÍ GLAUKOM OTEVŘENÉHO ÚHLU NA PODKLADĚ MUTACÍ V GENU MYOC
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




