-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
SCREENING, LÉČBA A DLOUHODOBÉ SLEDOVÁNÍ RETINOPATIE PŘEDČASNĚ NAROZENÝCH DĚTÍ V ČR
Autoři: A. Zobanová 1; P. Brychcínová 1; R. Autrata 2; K. Šenková 2
Působiště autorů: Soukromá oční ordinace, Kršková 807, Praha 5, 152 00 1; Dětská oční klinika, LF MU a FN Brno, Černopolní 9, 613 00 Brno, Přednosta: prof. MUDr. Rudolf Autrata, CSc., MBA 2
Vyšlo v časopise: Čes. a slov. Oftal., 74, 2018, No. 6, p. 253-264
Kategorie: Doporučené postupy
doi: https://doi.org/10.31348/2018/6/7Závazná pravidla léčby ROP – Doporučený postup České společnosti pro dětskou oftalmologii a strabologii (ČSDOS) pod záštitou České oftalmologické společnosti (ČOS)
ÚVOD
Retinopatie nedonošených dětí (Retinopathy of Prematurity – ROP) je vazoproliferativní onemocnění postihující vývoj vaskularizace sítnice nedonošených dětí. Její výskyt úzce koreluje s nízkým gestačním věkem a porodní váhou [19,22]. Přes veškerý pokrok v diagnostice a léčbě zůstává ROP jednou z hlavních příčin slepoty u dětí [5].
V zemích s vysokým standardem perinatální a neonatologické péče, mezi něž Česká republika patří, se onemocnění ROP vyskytuje téměř výhradně u kategorií velmi nedonošených novorozenců (porod mezi 28. – 32. týdnem těhotenství, nejčastěji s porodní váhou 1000-1500 g) a extrémně nedonošených novorozenců (porod před 28. týdnem gravidity, většinou s porodní váhou pod 1000 g). Za poslední dvě desetiletí se kvalita péče o těhotnou, plod a novorozence v ČR významně zvýšila. Následkem toho signifikantně klesla celková i specifická novorozenecká úmrtnost, změnilo se spektrum a letalita neonatální morbidity, zvýšila se kvalita života zachráněných nedonošených dětí [51].
VÝVOJ VASKULARIZACE SÍTNICE
U plodu je do 4. měsíce nezralá sítnice bezcévná a je vyživovaná difuzí z choriokapilaris. Cévní systém sítnice se začíná vyvíjet až od 16. týdne těhotenství. Rostoucí cévy vycházejí z hyaloidní arterie v místech zrakového nervu a postupují centrifugálně směrem do periferie k ora serrata. V období porodu je za fyziologických podmínek vaskularizace sítnice ukončena. Na zdravém oku zůstává i u dospělých osob za ora serrata 1-3 mm široký bezcévný pás. Rostoucí céva je tvořena proliferujícími mezenchymálními vřetenovitými buňkami, tj. prekurzory endoteliálních buněk. Ty rostou po vnitřní vrstvě sítnice směrem do periferie a formují se do sloupců, které se luminizují a postupně se diferencují na zmíněné endoteliální buňky. Vzniká tak primární sítnicová kapilární síť. Zbylé mesenchymální buňky zanikají.
PATOGENEZE ROP
Základní poznatky o ROP a jejím vývoji pocházející z padesátých let minulého století vycházejí z histologických nálezů na vzorcích tkáně postižené sítnice. V rámci vývoje ROP byly popsány dvě na sebe navazující fáze. Klasická teorie [4,37] zdůrazňuje iniciální arteriolární vazokonstrikci, zpočátku reverzibilní, po níž následuje ireverzibilní vazoobliterace, kdy přežívají pouze hlavní cévní kmeny. Po narušení endotelu primitivních kapilár přežívající zralé cévy a doprovodná mezenchymální tkáň vytvářejí patologické mezenchymální A-V zkraty a nahrazují tak destruovanou kapilární síť. Zkraty jsou lokalizovány na přechodu vaskulární a avaskulární části sítnice. Hyperoxie vazokonstrikci prodlužuje. Ve druhé fázi vzniká vazoproliferativní odpověď na retinální ischemii, vedoucí k neovaskularizaci [6,38]. Druhá, tzv. teorie „gap junctions“ [23] akcentuje roli hyperoxie, resp. oxidačního stresu se vznikem abnormálních spojů, tzv. „gap junctions“ (patologické spoje mezi sousedícími vřetenovitými buňkami), které narušují normální buněčnou migraci a tvorbu cév.
Rozšiřující se poznatky o patogeneze ROP postupně odhalily další mechanizmy, související se vznikem a progresí změn, vedoucích po předčasném porodu k patologické vaskularizaci nezralé sítnice. Již dlouho je známo, že kyslík hraje v etiopatogeneze ROP klíčovou roli. Nízké nebo vysoké hladiny PaO2 regulují normální nebo abnormální produkci hypoxií indukovatelného faktoru 1 (hypoxia-inducible factor 1 – HIF-1) a vaskulárních endoteliálních růstových faktorů (vascular endothelial growth factors – VEGF), rozhodujících regulátorů angiogeneze sítnice [36,49]. Přestože se ukazuje, že pečlivě monitorovaná nízká saturace kyslíkem snižuje riziko vzniku závažné ROP, její optimální hladina zůstává nejistá. Vlastní vývoj onemocnění, jak bylo řečeno, probíhá ve dvou fázích – iniciální tzv. „avaskulární“, vedoucí ke chronické hypoxii sítnice a sekundární, „proliferativní“, navozující vazodilataci a angiogenezi. Hlavními modulátory progrese ROP během obou fází jsou „insulin-like growth factor 1” (IGF-1) a erytropoetin (EPO) [26,42]. Kromě toho se na etiopatogenezi ROP podílí celá kaskáda dalších faktorů jako oxid dusnatý, adenosin, noradrenalin, β-adrenergní receptory, genetické faktory a další [9]. Všechny tyto faktory vesměs fungují jako mediátory progrese z avaskulární do proliferativní fáze a hlubší poznání jejich role při vzniku a vývoji ROP může pomoci ke zdokonalení její účinné a bezpečné léčby
POPIS KLINICKÉHO NÁLEZU A KLASIFIKACE ROP
ROP byla poprvé popsána Terrym v roce 1942 jako retrolentární fibroplázie (RLF), která představuje až její nejtěžší 5. stádium [46]. V padesátých letech minulého století vznikla dvoufázová klasifikace ROP, rozlišující fázi aktivní a cikatrikózní. U nás se problematice ROP celoživotně věnovala prof. Lomíčková [28,29], jejíž publikace předběhly svou dobu téměř o 30 let. V současnosti je používána mezinárodní klasifikace ROP z roku 1984 (ICROP – International Classification of Retinopathy of Prematurity) [12], revidovaná a doplněna v roce 2005 s upřesněním hodnocení vaskulárních změn [45].
Klasifikace ICROP hodnotí:
- a) lokalizaci změn na sítnici podle definovaných zón I-III
- b) rozsah postižení sítnice podle 30 stupňových sektorů odpovídajících hodinovému číselníku
- c) stadium závažnosti onemocnění podle strukturálních sítnicových změn na hranici vaskularizované a avaskulární části sítnice
- d) přítomnost nebo absenci abnormálně rozšířených a vinutých cév na zadním pólu oka, tzv. plus známky onemocnění
Dále definuje tzv. agresivní posteriorní formu ROP (APROP) postihující zejména extrémně nezralé novorozence s extrémně nízkou porodní hmotnosti [45].
Lokalizace změn
Lokalizace změn na sítnici (obrázek 1) má zásadní význam z hlediska klinického hodnocení prognózy a rozdílnosti načasování terapeutické intervence u jednotlivých forem ROP. Obecně platí, že čím blíže jsou změny k zadnímu pólu oka, tím horší je prognóza a včasnější potřeba léčby.
Obr. 1. Klasifikace retinopatie nedonošených (ROP) podle lokalizace 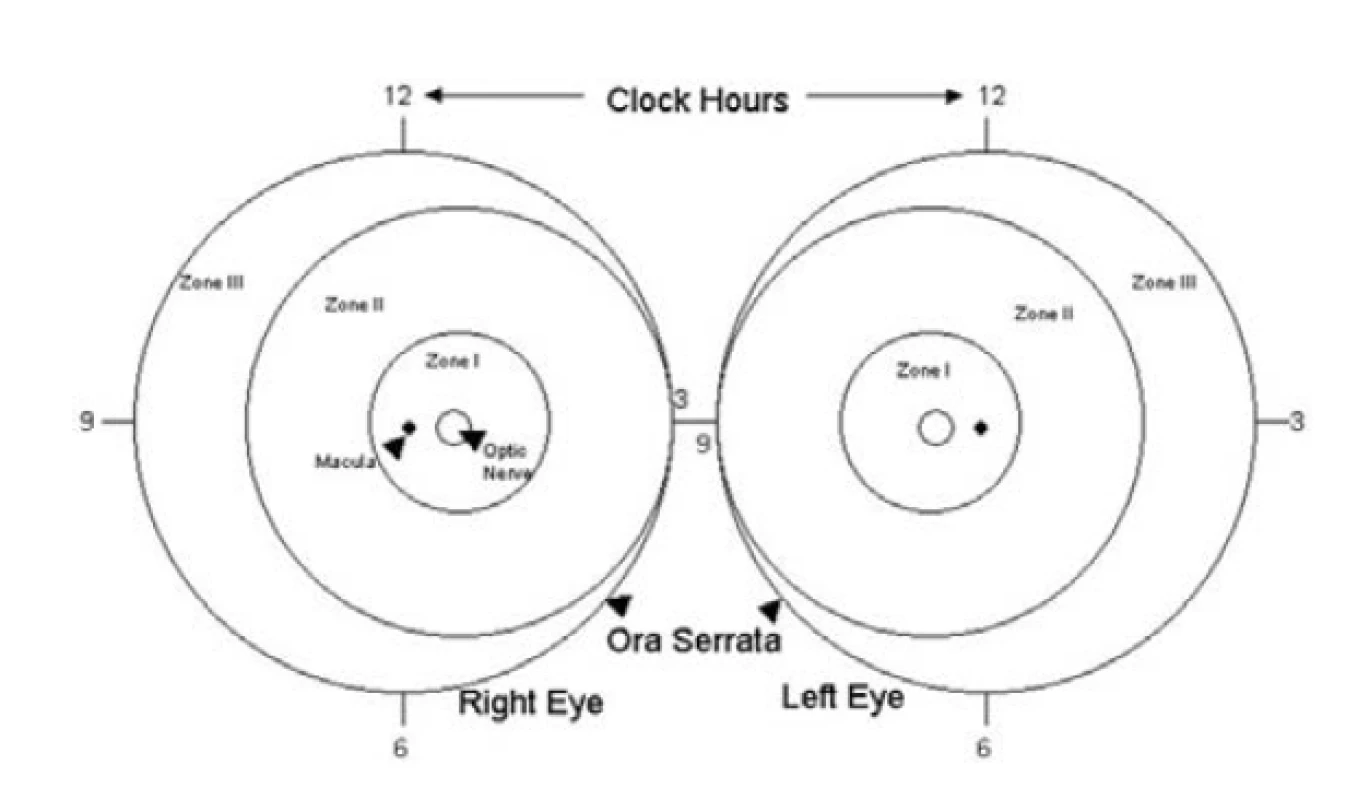
Zóna I – kruhová zóna zadního pólu s centrem ve středu terče zrakového nervu, poloměr kružnice určující hranici zóny je dvojnásobek vzdálenosti mezi zrakovým nervem a makulou (obrázek 1). Z praktického hlediska lze rozsah první zóny orientačně hodnotit pomocí nepřímého oftalmoskopu při použití 28 D čočky, jejíž nasální okraj zorného pole centrujeme ke středu terče zrakového nervu. Temporální okraj zorného pole čočky pak vyjadřuje zevní hranici zóny I.
Zóna II - cirkulární pás se středem v terči zrakového nervu. Navazuje na zónu I, zevní hranicí je nazálně okraj ora serrata, temporálně odpovídá anatomicky přibližně ekvátoru oka (obrázek 1). Klinickou pomůckou k hodnocení temporální hranice zóny II může být v některých případech výstup vortikózních žil z očního bulbu. Je-li patrný, vytváří na očním pozadí charakteristický vzhled růžice.
Zóna III - zbývající výseč srpkovitého tvaru navazující temporálně na zónu II (obrázek 1). Je to nejvzdálenější část sítnice, kde pro nasální posun optického nervu trvá vývoj vaskularizace déle a bývá ukončen nejpozději.
Zóna s nejpokročilejšími změnami na daném oku určuje zařazení ROP do indikačních kritérií pro terapii tohoto oka.
Rozsah postižení sítnice
Rozsah změn na sítnici se tradičně hodnotí pomocí 30 stupňových sektorových výsečí podle hodinového číselníku 1-12. V klasické podobě vývoje ROP se patologické změny na rozhraní vaskularizované a avaskulární části sítnice objevují nejdříve v temporální části sítnice. V současné době se ale setkáváme i s méně typickými formami ROP, u kterých bývají změny lokalizovány nejprve nasálně. ROP se změnami v této lokalizaci velmi často rychle progreduje.
Stádia ROP
Retinopatie nedonošených probíhá v pěti vývojových stádiích, která jsou charakterizována strukturálními změnami vyvíjejícími se na hranici již vaskularizované a avaskulární části sítnice.
Stádium 1 – demarkace: Stav, kdy rostoucí cévy náhle končí v linii oddělující cévnatou a bezcévnou zónu. Je to poměrně pomíjivé stádium s možností progrese stejně jako regrese a normalizace dalšího vývoje během několika týdnů. Morfologicky se jedná o hyperplastickou mezenchymální tkáň vřetenovitých buněk, která se svým rozšiřováním a narůstáním tloušťky stává viditelnou. Při progresi do vyšších stádií vytváří tato tkáň širokou průsvitnou plochu před valem, případně až k ora serrata.
Stádium 2 – intraretinální prstenec – val – hřeben: Demarkační linie roste do šířky i tloušťky a jako hřeben pak prominuje nad úroveň sítnice. Může být barvy bílé nebo růžové. Morfologicky se jedná vedle hyperplázie mezenchymu o diferenciaci a organizaci endotelových buněk, proto má val jasné dvě kontury s relativně hypocelulární zónou uprostřed. Nepřítomnost fibrovaskulární proliferace odlišuje 2. stádium od 3. stádia. V tomto stádiu se mohou objevit v oblasti zadní hrany valu malé izolované trsy fibrovaskulární tkáně ležící na povrchu sítnice, nazývané „popcorn“. Nepředstavují ještě vznik 3. stupně ROP, ale jejich přítomnost poukazuje na výrazně vyšší riziko další progrese onemocnění [48].
Stádium 3 – extraretinální fibrovaskulární proliferace: V této fázi z přední i zadní kontury valu vychází extraretinální fibrovaskulární proliferace, šířící se z povrchu sítnice do sklivce. Později nastává kontrakce a jizvení těchto doprovodných vazivových změn, které tahem způsobují trakční odchlípení sítnice a tím přechod do dalších závažnějších stádií ROP.
Stádium 4 – parciální amoce: Jedná se o částečné trakční odchlípení sítnice (4a - bez postižení makuly, 4b - včetně s postižením makuly). Trakční odchlípení sítnice může být později komplikováno subretinální exsudací, která stav ještě více zhoršuje.
Stádium 5 - totální amoce: Úplné odchlípení sítnice, dříve retrolentární fibroplazie (RLF)/ retrolentární fibrovaskulární membrána.
Stádium ROP daného oka je určeno místem s nejpokročilejšími změnami na tomto oku.
Plus známky ROP
Podle revidované klasifikace z roku 2005 [45] je stav cév součástí hodnocení ROP a jsou uváděny tzv. „Plus“ známky či „Pre-plus“ známky, tj. ke stadiu ROP se přidává přípona Plus či Pre-Plus. Jsou definovány jako zvýšená dilatace a tortuozita cév zadního pólu oka. Doprovodnými projevy Plus formy onemocnění může být rigidita zornice, dilatace duhovkových cév či sklivcové opacity (vitreal haze) a sítnicová krvácení. Důležité je i rozlišování tzv. „pre-plus“ a „plus“ známek, které charakterizují aktivitu a progresi onemocnění.
„Plus“ známky se dělí na tři stupně pokročilosti: mírné, středně těžké a těžké.
„Pre-plus“ známky jsou známky onemocnění definované jako cévní abnormality zadního pólu, které jsou nedostatečné pro diagnózu „plus známek“ ROP, ale dokládají větší arteriální vinutost a venózní dilataci, než je obvyklý fyziologický nález.
„Plus“ přestavuje floridní aktivnější formu ROP, kde možnost spontánní regrese je zanedbatelná a takový nález je signálem významně horší prognózy.
Agresivní posteriorní forma ROP (APROP)
Termín je vyhrazený pro nález strukturálních změn na sítnici, které nelze jednoznačně zařadit do některého z výše uvedených stádií ROP a dříve byl označován jako tzv. „rush form“. Postihuje posteriorní část sítnice, tj. zónu I až ev. zónu II posterior. Je považován za nejtěžší a rychle progredující formu ROP. Neprochází klasickými stádii, často ani není přítomná linie demarkace, pouze diskrétní snadno přehlédnutelné známky v oblasti přechodu vaskulární a avaskulární části sítnice. Dominují rychle se rozvíjející „Plus“ známky ve všech čtyřech kvadrantech, u těžkých známek „Plus“ nelze rozlišit artérii od vény vlivem výrazné vazodilatace a tortuozity. Mohou vznikat arteriovenózní zkraty nejen na pomezí vaskularizované a avaskulární části sítnice, ale i mezi cévami ve vaskularizované části. Zde mohou být přítomné i hemorhagie. U ROP zóny I se rozvíjí často plochá nenápadná extraretinální proliferace bez patrné propagace do sklivce, takže nevzniká konvenční val. APROP tak může postupovat během několika dnů skokově ze stádia 1 do stádia 3, bez rozpoznání typického 2. stádia ROP. Obraz časné fáze 3. stádia ROP v posteriorní zóně II může být tak decentní, že se nezkušený lékař může nechat ukolébat a přehlédnout rozvoj 3. stádia ROP se současně vznikající trakční amocí.
Neléčená APROP vždy progreduje do finálního stádia ROP. Po prvním laserovém ošetření může ustoupit, ale obvykle se znovu aktivuje. Reaktivace je charakterizována návratem „Plus“ formy onemocnění, progresivní kontrakcí zadní sklivcové membrány a počínajícím posteriorním trakčním odchlípením sítnice. Důvodem je, že v ploše nezřetelného přechodu vaskularizované a avaskulární sítnice je nedostatek orientačních bodů k přesnému laserovému ošetření. Ačkoliv ROP zdánlivě ustupuje, neošetřené části avaskulární sítnice přetrvávají jako zdroj VEGF a dále ovlivňují průběh ROP. Navíc laserová fotokoagulace sítnice sice destruuje buňky produkující VEGF, avšak neovlivní už stávající hladinu VEGF ve sklivci. VEGF tak nadále působí navzdory včasnému a téměř úplnému zničení jeho zdroje. To vysvětluje obvyklé selhání transpupilární laserové léčby u APROP. Z tohoto pohledu se jeví logické použití anti-VEGF preparátů jako první volby v léčbě těchto refrakterních a fulminantních forem ROP [15,35]. Dalším důvodem pro podání anti-VEGF u APROP v zóně 1 je čas, který získáme do případné další reaktivace ROP. Během této doby pokračuje vývoj vaskularizace směrem do zóny II a plocha sítnice nutná k destrukci fotokoagulací při dalším léčebném zákroku, je-li nutný, je pak výrazně menší.
SCREENING ROP
Screening provádí zkušený, v problematice zaškolený oftalmolog s užitím nepřímé oftalmoskopie. Vyšetření lze doplnit fotodokumentací pomocí přenosné širokoúhlé digitální fundus kamery RetCam.
Doporučené vybavení: Nepřímý binokulární oftalmoskop, spojná čočka, širokoúhlá digitální fundus kamera RetCam, víčkový rozvěrač, sklerální depresor nebo svalový háček (běžně používaný pro operace strabismu) k případné indentaci.
Základním předpokladem ke screeningovému vyšetření je dokonalá arteficiální mydriáza zornice. Mydriatické oční kapky jsou buď parasympatické blokátory (např. homatropin, tropicamid, cyklopentolát), které mají vliv na svaly pupilárního svěrače, nebo sympatické stimulanty (např. phenylephrin hydrochloridum), které ovlivňují svaly dilatátoru zornice. Proto pro kvalitní mydriázu používáme kombinaci obou typů mydriatik. Nebyly hlášeny žádné závažné nežádoucí systémové účinky. S vedlejšími účinky mydriatik nelze zaměňovat výkyvy srdečního rytmu z tlaku rozvěrače a háčku během protrahovaného a nešetrného vyšetřování.
Lokální znecitlivění pomocí lokálních anestetických očních kapek (oxybuprocain hydrochlorid, 1 nebo 2 kapky, 30-60 sekund před vyšetřením) nabývá na významu zejména v situacích, kdy zvažujeme nutnost použití rozvěrače nebo předpokládáme během vyšetření využití sklerální indentace a též před použitím fundus kamery RetCam.
Screening ROP se provádí u všech novorozenců narozených do 31. gestačního týdne včetně, nebo s porodní váhou do 1500 g včetně. Pro zařazení stačí aspoň jedno z uvedených kritérií. Do screeningu se dále zařazují novorozenci s porodní váhou 1500-2000 g nebo porození po 31. týdnu těhotenství, kteří pro poporodní instabilitu vyžadovali kardiorespirační podporu [3]. Všechny děti narozené před 32. týdnem gestace nebo s porodní hmotností 1 500 g a nižší by měly mít před propuštěním alespoň jedno screeningové vyšetření pro ROP [52]. Nástup příznaků ROP koreluje lépe s postkoncepčním věkem (tj. gestační věk při porodu + chronologický věk po narození dítěte). Proto by se mělo zahájení screeningu ROP řídit podle postkoncepčního věku [3]. Načasování („timing”) prvního screeningu ROP ukazuje tabulka 1.
Tab. 1. Určení prvního screeningového vyšetření pro ROP 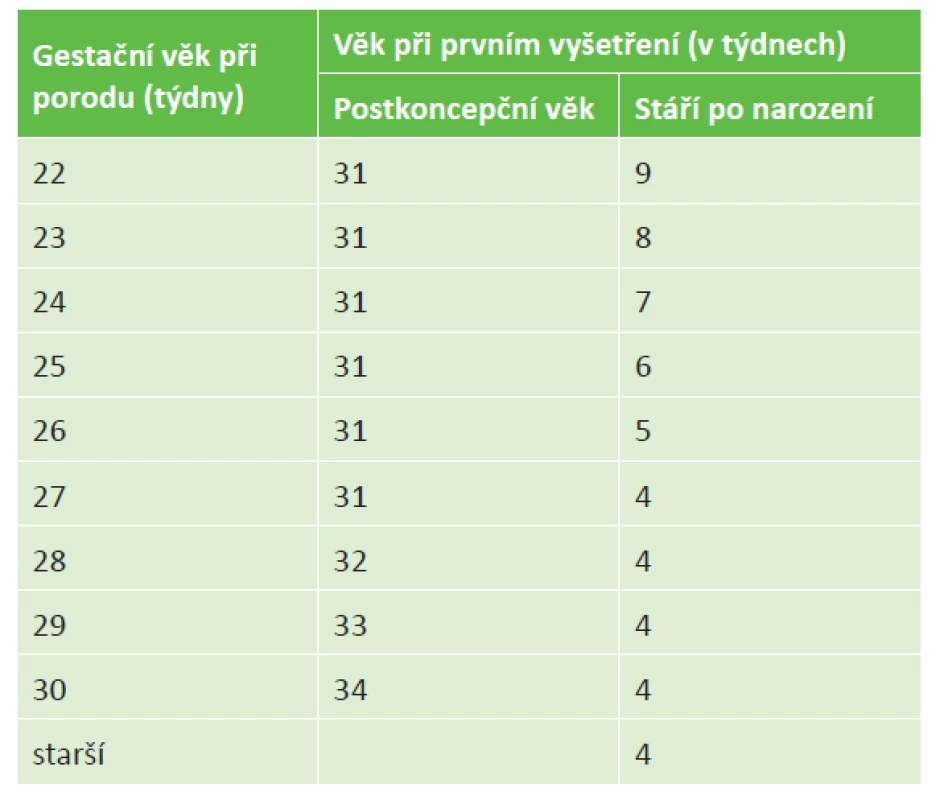
Screeningové vyšetření provádíme v intervalu 1-2 týdnů podle nálezu na sítnici a stáří dítěte. Je stanovena minimální frekvence screeningu 1x týdně v případě, že cévy končí v zóně I nebo posteriorně v zóně II nebo jsou patrny jakékoliv známky „Pre-plus“ či „Plus“ formy onemocnění nebo je přítomno jakéhokoliv 3. stádium ROP, a to v kterékoliv zóně. Od okamžiku vzniku známek ROP určuje frekvenci kontrol oftalmolog individuálně podle aktuálního nálezu.
Screening ROP se provádí do ukončení vaskularizace zóny III sítnice, obvykle do 40. postkoncepčního týdne věku dítěte, tedy do původního termínu porodu. Screening může být ukončen i dříve, když je dítě již mimo riziko rozvoje ROP. To nastává, když vývoj vaskularizace postoupí do zóny III, u dětí bez rozvoje ROP obvykle po ukončení 36. gestačního týdne.
Děti s ROP sledujeme až do úplné regrese nálezu na sítnici, ať již spontánní či po léčebném zákroku (pokles „stagingu“ a pokračování vaskularizace dále do periferie), často už v ambulantních podmínkách, ale vždy na pracovištích zabývajících se léčbou ROP.
Po propuštění do domácí péče dítě přechází do systému dlouhodobého sledování [40]. Neonatologické pracoviště, po dohodě s konziliárním oftalmologem, je povinno zajistit následnou péči jmenovitě u erudovaného oftalmologa. V případě reaktivace ROP či pochybností o probíhající regresi, spadá dítě zpět do péče konziliárního oftalmologa původního mateřského pracoviště. Interval kontrol v dlouhodobém sledování je dán závažností průběhu onemocnění, jeho vznikem, rozsahem léčby a regresí změn.
INVOLUČNÍ NÁSLEDKY ROP DLE ICROP 2005 [45]
ROP stádium 1 a 2 regreduje bez strukturálních následků, ROP stádium 3 z 50% regreduje spontánně, avšak může zanechat některý z následků:
Změny na zadním pólu
A. Cévní
- Přetrvávající tortuozita
- Napřímení temporálních arkád
- Ostrý úhel při odstupu temporálních arkád
B. Retinální
- Pigmentové změny
- Distorze a dislokace makuly
- Tah a nařasená makulární oblasti směrem do periferie
- Změny vitreoretinálního rozhraní
- Sklivcové fibrózní změny
- Sítnicová trakce jdoucí přes papilu či deformující papilu
- Trakčně-rhegmatogenní amoce
Změny v periferii sítnice
A. Cévní
- Selhání vývoje periferní vaskularizace a její předčasné ukončení zanechá široký avaskulární pás před ora serrata
- Abnormální, nedichotomické větvení retinálních cév
- Abnormální spojky mezi cévními arkádamí
- Teleangiektazie
B. Retinální
- Pigmentové změny
- Změny na vitreoretinálním rozhraní
- Sklivcové fíbrózní změny s adhezí či bez adheze k sítnici
- Periferní nařasení sítnice
- Lattice-like degenerace
- Ztenčení sítnice
- Retinální trhliny
- Trakčně-rhegmatogenní amoce
SOUHRN DOPORUČENÍ
K dosažení dostatečné mydriázy zornice aplikujeme 3x postupně vždy s odstupem cca 5-10 minut, 1 hodinu před vyšetřením phenylephrin 2,5% (Neosynephrin 10% ředěný Aqua pro inj. 1 : 3) a homatropin 2,0% (magistraliter).
Lokální anestezie před použitím rozvěrače a fundus kamery – oxybuprocain hydrochlorid 0,4% (Benoxi gtt, 1 nebo 2 kapky, 30-60 sekund před vyšetřením).
Záznam nálezu je nutné učinit po každém screeningovém vyšetření. V případě suspektního či pozitivního nálezu rozvíjející se ROP musí být definována postižená zóna, rozsah a stupeň změn a stav cév. Závěr musí obsahovat zhodnocení nálezu ve smyslu fyziologického nálezu, suspektních změn nebo jasné diagnózy ROP. Dále načasování dalšího očního vyšetření či indikaci k operačnímu řešení anebo informaci o ukončení screeningu. Následuje podpis lékaře, který vyšetření provedl.
Zóna s nejpokročilejšími změnami na daném oku určuje jeho zařazení do indikačních kritérií pro terapii tohoto oka.
Stádium ROP daného oka je určeno místem s nejpokročilejšími změnami na tomto oku.
Pokud je RetCam součástí vybavení oftalmologického nebo neonatologického pracoviště, je pořízení fotodokumentace u ROP stadia 2 a vyšším nutné nejméně jednou před propuštěním nebo překladem na jiné pracoviště.
Každé dítě z rizikové skupiny musí mít alespoň jedno oční screeningové vyšetření na mateřském perinatálním centru a případný překlad na jiné, intermediární, pracoviště je možný pouze po zajištění pravidelných očních kontrol zkušeným oftalmologem. V případě objevení známek progredující ROP je toto dítě nutno přeložit zpět na pracoviště, které je schopno zajistit vhodnou terapii.
INDIKACE K LÉČBĚ ROP
V roce 2003 studie Early Treatment for Retinopathy of Prematurity (ETROP) ukázala, že časná koagulační terapie je spojena s lepšími strukturálními i funkčními výsledky po 9 měsících od léčby, ve srovnání se zahájením terapie v pozdějších stádiích ROP [17]. Tato studie nově definuje Typ 1 ROP s vysokým rizikem rozvoje odchlípení sítnice a následné slepoty, který vyžaduje okamžitý léčebný zákrok, a naopak Typ 2 ROP s reálnou možností spontánní regrese. Tato druhá skupina ROP sice není indikována k urgentnímu operačnímu zákroku, ale vyžaduje další pečlivé sledování, a to buď k pozdější terapii, nebo až do známek regrese nálezu. Revidované výsledky studie ETROP jsou dnes celosvětově podkladem pro doporučené postupy léčby retinopatie předčasně narozených dětí (tabulka 2).
Tab. 2. Indikační kritéria pro léčbu ROP 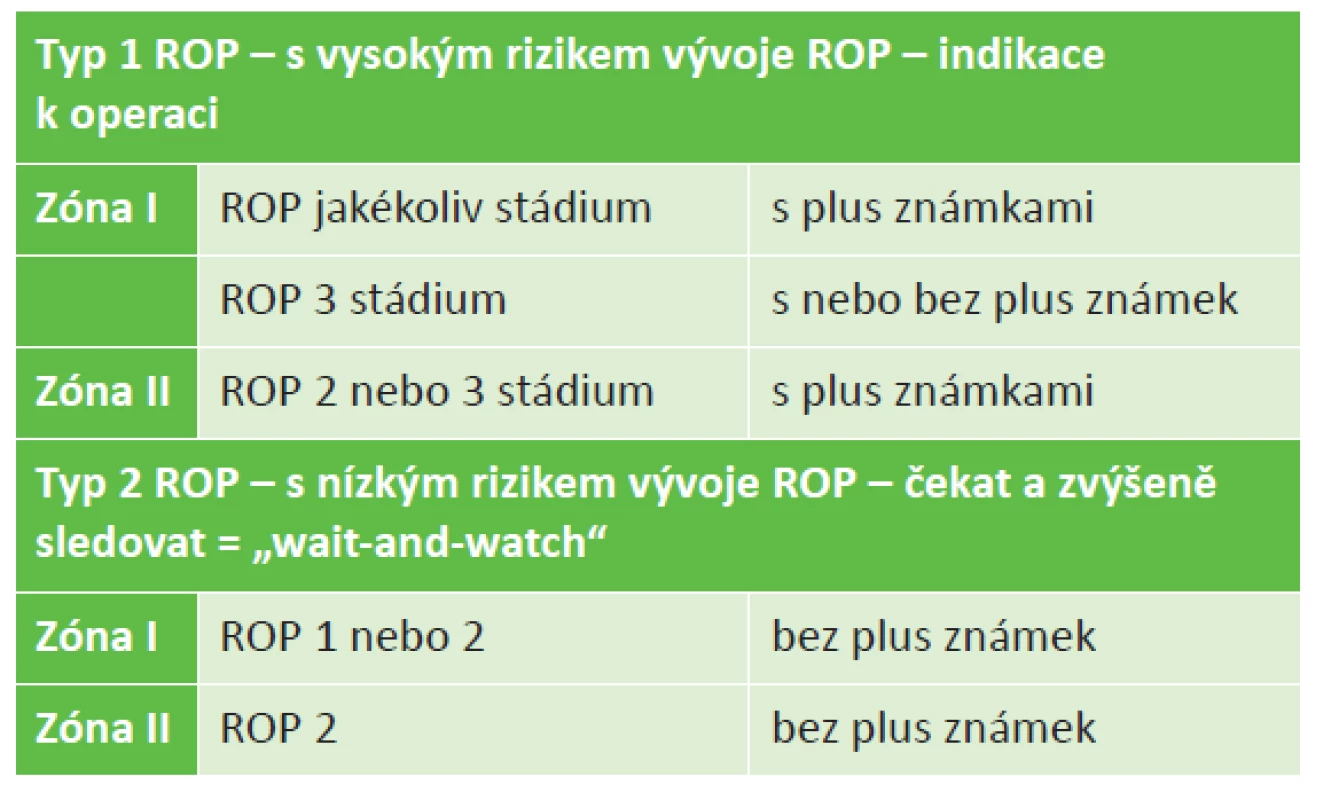
Revidovaná studie ETROP z roku 2003 [16] nahrazuje původní závěry multicentrické CRYO-ROP studie z roku 1988 [34], která indikuje léčbu na základě tzv. „treshold“ stádia, tj. rozsah změn 3+ stadia ROP v pěti na sebe navazujících sektorech hodinového číselníku nebo v celkovém součtu osmi sektorů na hodinovém číselníku. Za „pretreshold“ stádium se považuje rozsah změn 3. stádia, které nedosahuje prahového stádia. Studie ETROP [16] zvažuje, zda jde o typ 1 ROP s vysokým rizikem progrese ROP, který je okamžitou indikací k operaci nebo zda se jedná o typ 2 ROP s nízkým rizikem progrese, který je nutno pozorně sledovat (tabulka 2). V případě hraničního nálezu mezi oběma typy je indikace a rozhodnutí o způsobu léčby na oftalmologovi.
LÉČBA ROP
Princip dosud jediné úspěšné léčby ROP spočívá ve snížení hladiny VEGF v oku. Poklesu VEGF dosáhneme buď redukcí plochy avaskulární sítnice, která VEGF produkuje, tj. termokoagulací (fotokoagulace či kryokoagulace) a/nebo vyvázáním již vytvořeného VEGF pomocí intravitreální aplikace příslušných protilátek, tzv. „anti-VEGF“ preparátů.
Léčba retinopatie nedonošených se podle zvyklostí různých pracovišť provádí v řádné analgosedaci a v lokálním znecitlivění nebo v celkové anestezii nezralého novorozence pod dohledem zkušeného neonatologa nebo anesteziologa. V ideálním případě se jedná o úzkou vzájemnou spolupráci obou specialistů. Pro možnost správného provedení léčebného výkonu je nutná maximální arteficiální mydriáza, kterou dosáhneme kombinací kapek phenylephrin hydrochloridum (2,5%) a homatropin (2%) eventuálně tropicamid (0,5%). K zajištění otevření očí se používají víčkové rozvěrače.
TERMOKOAGULACE SÍTNICE
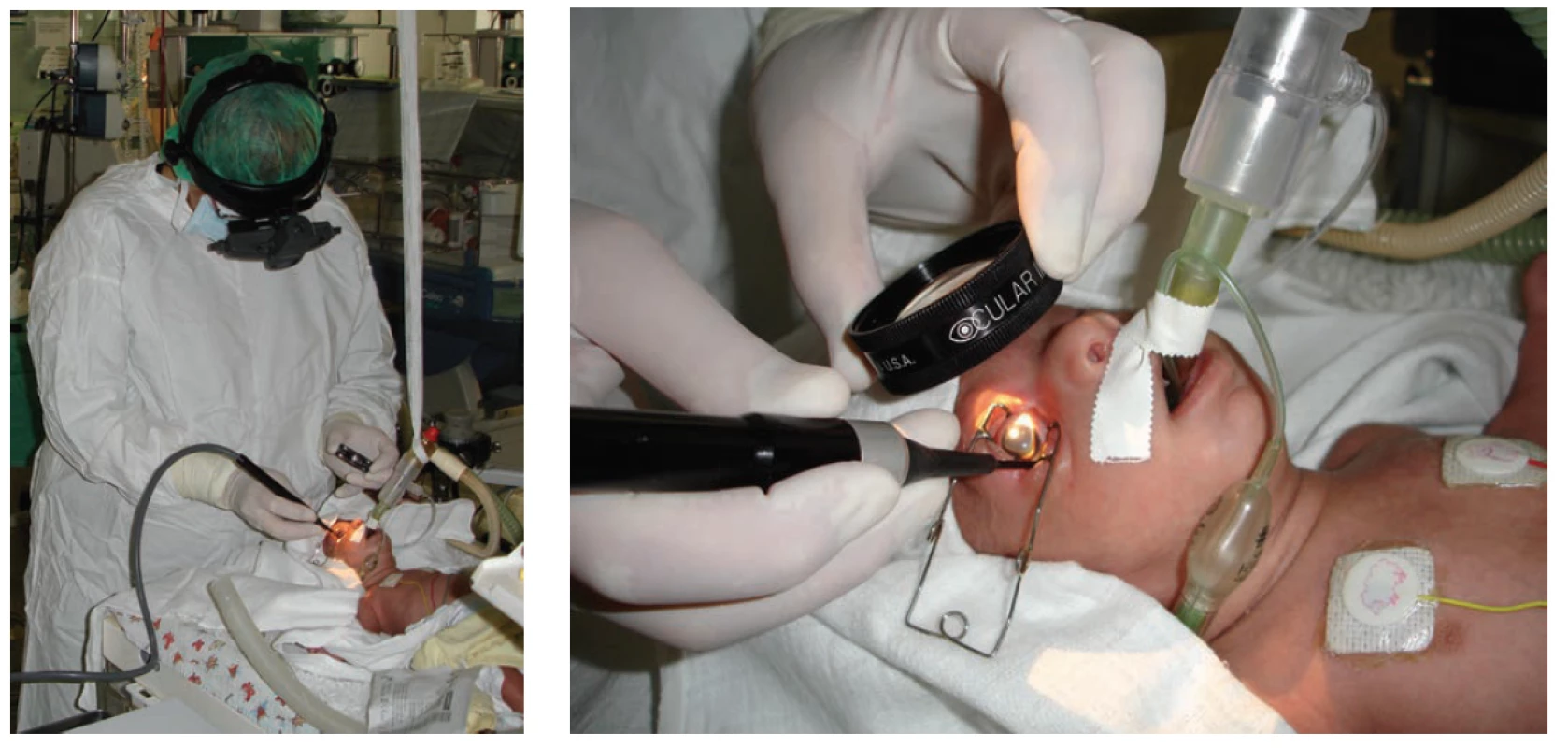
Transpupilární laserová fotokoagulace sítnice (obrázek 2) je považována za „zlatý standard” léčby. Proti kryoterapii je spojena s lepšími dlouhodobými výsledky, jak strukturálními, tak funkčními [13]. Provádí se diodovým laserem, umístěným na hlavě operatéra, v celkové anestézii nebo řádné analgosedaci doplněné o lokální anestesii pod oftalmoskopickou kontrolou. Na každém oku se aplikuje skrze zornici do avaskulární oblasti sítnice 400-1000 bodů. Účinnost správného zacílení laserového paprsku potvrzuje vznik bílého bodu na sítnici. Výhodou transpupilární fotokoagulace je možnost dokonalého ošetření celého pásu avaskulární sítnice na rozhraní vaskularizované a avaskulární části. Operaci není možné účinně provést při úzké rigidní zornici, při naplnění cév pupilární membrány, při větším ztluštění avaskulární části nebo při větším zkalení optických médií. Proto s indikací metody nelze čekat tak dlouho jako u kryoterapie. Po výkonu se zahajuje lokální aplikace kombinovaným preparáty antiobiotika s kortikoidy 4x denně po dobu 3-4 dnů jako prevence vzniku postoperačních uveálních reakcí.
Obr. 2. Transpupilární operace sítnice diodovým laserem s nepřímou oftalmoskopií 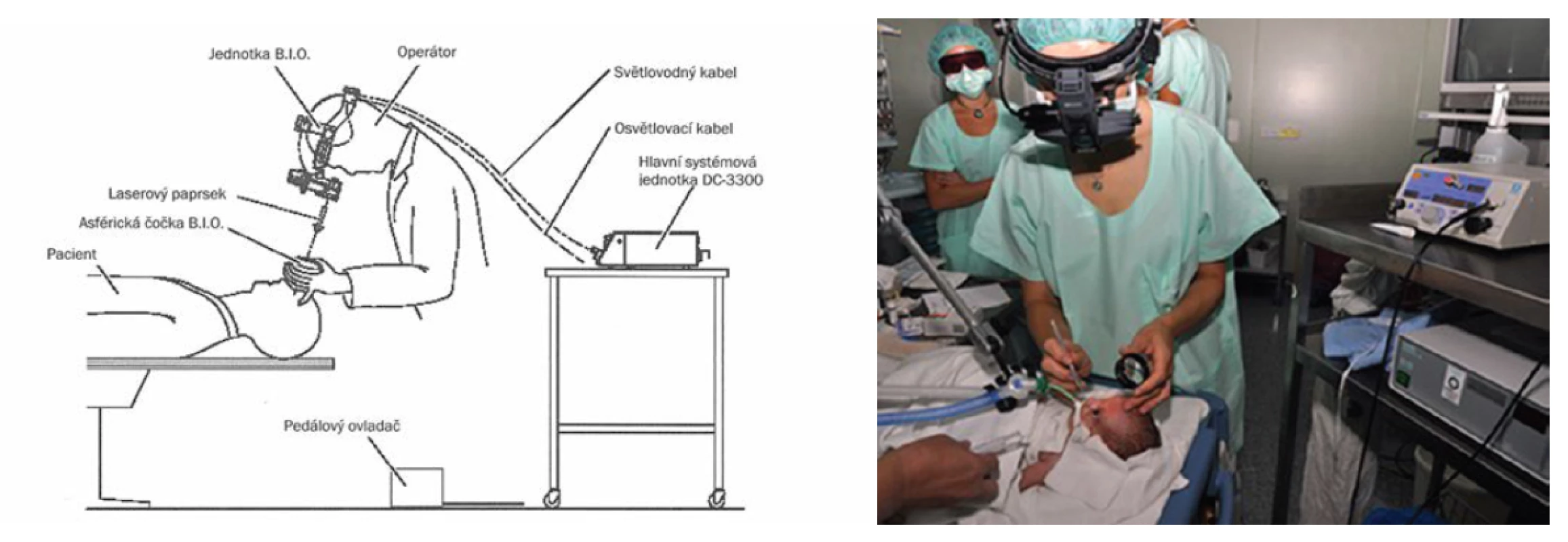
Transsklerální laserová fotokoagulace diodovým laserem je výkon časově kratší, než je transpupilární fotokoagulace. K ošetření avaskulární části sítnice je obvykle nutno aplikovat řádově kolem 300-500 laserových bodů. Také ji lze provést při relativně horší transparentnosti optických medii a je šetrnější k očním tkáním než kryoterapie. Přesto je provedení transsklerální laserové fotokoagulace sítnice zatíženo stejným rizikem nedokonalého ošetření změn ROP v posteriorní zóně II.
Hlavní rozdíl mezi oběma základními technikami laserové léčby (transpupilární a transsklerální fotokoagulace sítnice) je daný energií a dobou působení laserového paprsku na oční tkáň. V případě transpupilární laserové fotokoagulace se jedná o energii řádově v rozmezí 200-500 mW při časech kolem 200 ms ve srovnání s transsklerální laserovou fotokoagulací, u které pracujeme s vyšší energií, obvykle v intervalu 500-1500 mW při časech 400-800 ms.
Kryoterapie sítnice (obrázek 3) dosud patří mezi standardní léčebné postupy u progredující ROP. Provádí se pomocí speciálně upravené dětské retinální sondy s teplotou -80 °C na konci hrotu, přes spojivku transsklerálně v celkové anestézii nebo řádné analgosedaci doplněné o lokální anestesii pod oftalmoskopickou kontrolou. Doba expozice zásahu je do náznaku zbělění sítnice. Je možné ji provést i při částečném zkalení optických médií i při vyšších stupních ROP s větším edémem periferie sítnice. Aplikuje se 20-50 bodů (dle velikosti použité sondy) na každém oku cirkulárně do avaskulární oblasti sítnice, kopírujeme linii valu. Kryoterapie je metodou technicky jednodušší a rychlejší. Více však destruuje sítnici a nedokáže správně ošetřit oblasti blíže zadnímu pólu oka. K častým pooperačním relativním komplikacím této techniky léčby patří hematomy a otoky víček, chemóza a podspojivkové sufuze, lacerace spojivky, sklivcové nebo sítnicové krvácení a především pak nadměrné či nežádoucí jizvení sítnice v pooperačním období. Z dlouhodobého hlediska je další komplikací kryoterapie vyšší výskyt krátkozrakosti u předčasně narozených dětí léčených touto technikou. Proto se dnes doporučuje jen ojediněle. Po výkonu se zahajuje lokální aplikace antiobiotika s kortikoidy 4x denně po dobu 3-4 dnů jako prevence vzniku postoperačních uveálních reakcí a infekce.
Obě metody transsklerální termokoagulace sítnice mají své přednosti i nedostatky. Při léčbě prahového stadia ROP v zóně II-III jsou obě metody prakticky stejně účinné. Obě metody lze použít v kombinaci s transpupilární laserovou fotokoagulací k dosažení optimálního léčebného ošetření sítnice při lokalizaci ROP na rozhraní zóny I a II, je-li zapotřebí zkrátit dobu výkonu v celkové anestézii.
Správně načasovaná a provedená termokoagulace sítnice je pro zachování dosud nezměněné, ležící sítnice nezastupitelná. Další chirurgické intervence již jen reparují anatomicky i funkčně závažně postižené nitrooční struktury.
Výjimku a samostatnou kapitolu v indikacích léčby tvoří výše popsaná APROP (agresivní posteriorní forma ROP) a ROP v zóně I, které jsou primárně indikovány k intravitreální aplikaci anti-VEGF preparátů.
Před výkonem se vždy pořizuje fotodokumentace nálezu pomocí fundus kamery RetCam (pokud je součástí vybavení oftalmologického nebo neonatologického pracoviště).
LÉČBA INTRAVITREÁLNÍ APLIKACÍ ANTI-VEGF PREPARÁTŮ
Z výsledků výzkumů vyplývá, že vaskulární endoteliální růstový faktor (VEGF), produkovaný retinálními buňkami avaskulární sítnice, hraje důležitou roli v patogenezi ROP [43]. Dosavadní léčebné postupy, tj. laserová fotokoagulace a kryoterapie, svým účinkem přímo destruují tyto buňky. V posledních letech je stále více důkazů podporujících použití cílené farmakologické inhibice již vytvořeného VEGF v léčbě ROP [1,2,10,11,14,18,20,21,24,25,27,31-33,38,41,44,47,50]. Ukazuje se, že léčba anti-VEGF preparáty umožňuje přiměřený vývoj vaskularizace sítnice a je spojena s nižším výskytem refrakčních vad a lepší výslednou zrakovou ostrostí.
Intravitreální aplikace anti-VEGF (obrázek 4) je jednoznačně indikovaná při APROP a ROP typu 1 (tabulka 2) v zóně I a často je zvažována jako metoda první volby v případě rychle progredující ROP v posteriorní zóně II s vyjádřenými známkami „Plus“ formy onemocnění. Před intravitreální aplikací musí rodiče podepsat informovaný souhlas, neboť se t. č. jedná o „off label“ léčbu. K intravitreální aplikaci anti-VEGF lze použít pouze buď originálně plněné stříkačky anebo lékárnou sterilně připravené stříkačky užívané pro aplikaci inzulínu. Dávkování závisí na typu použitého preparátu. Před výkonem se pořizuje fotodokumentace nálezu na sítnici pomocí přenosné širokouhlé fundus kamery RetCam. Anti-VEGF preparát se aplikuje v celkové anestezii intravitreálně za přísně sterilních podmínek s výplachem spojivkového vaku Betadine (ředění 1 : 10) po dobu 90 s, jehlou 30 G ½ 0,3x13 mm. Vpich provedeme ve vzdálenosti 1,0 až 2,0 mm od limbu (s přihlédnutím k věku a velikosti dítěte, resp. velikosti bulbu) nejčastěji u č. 6 hodinového číselníku. Po aplikaci se zahajuje lokální antibiotická profylaxe fluorochinolony (ofloxacin, ciprofloxacin) 4x denně po dobu 3-4 dnů. Výhody intravitreální léčby spočívají v rychlé aplikaci a tím snížení zátěže dlouhou celkovou anestezií. Po aplikaci protilátky sledujeme v následujících dnech nejen ústup závažnosti ROP, ale často i obnovení přirozeného vývoje vaskularizace až do periferie sítnice. Zásadním přínosem je, že léčbou nevznikají sekundární strukturální změny v zadním pólu oka, zejména v makulární oblasti (deformace papily, dislokace či degenerativní změny makuly). Eventuální doplňující laserová terapie destruuje již menší plochu periferní části sítnice [6-8,31].
Obr. 4. Intravitreální aplikace anti-VEGF 
Vylučovací kritéria pro intravitreální léčbu anti-VEGF jsou oční infekce v průběhu 5 dní před aplikací [39].
FOTODOKUMENTACE NÁLEZŮ NA OČNÍM POZADÍ NOVOROZENCŮ
Fotodokumentace abnormálních nálezů na nezralé sítnici (obrázek 5) by v současnosti měla být standardní součástí zdravotnické dokumentace dítěte. Digitální fotodokumentace přenosnou širokoúhlou fundus kamerou RetCam začíná být dostupná ve všech regionálních centrech perinatální a neonatální péče. Fotodokumentace umožňuje nejen archivaci nálezů, ale především dává možnost posoudit větší úseky sítnice kontinuálně, přesně změřit a porovnat rozsah patologických nálezů a jejich změn v čase, umožňuje konzultaci nálezu na dálku. V neposlední řadě slouží jako doklad správné indikace léčby ROP.
Obr. 5. Fotodokumentace pomocí Retcam 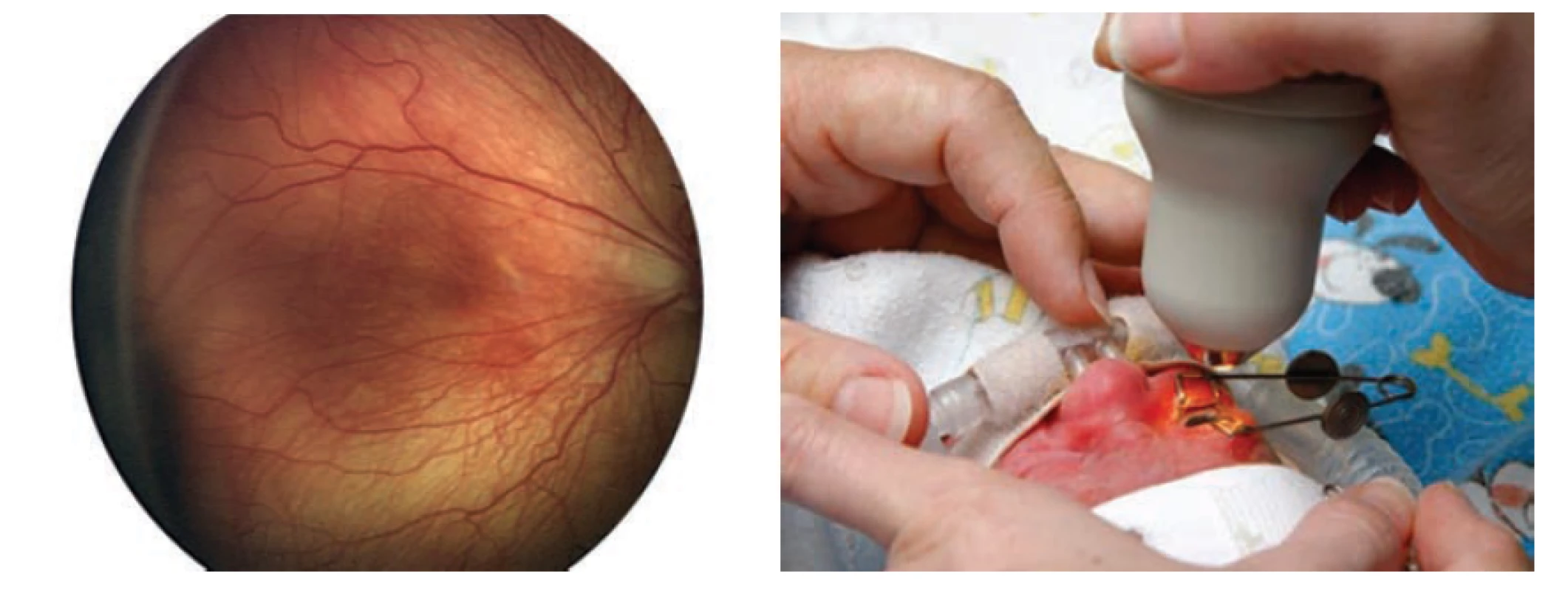
Kvalita pořízené fotodokumentace je silně závislá na senzitivitě digitálních zobrazovacích systémů. Z tohoto pohledu tedy digitální zobrazovací systémy nenahrazují konvenční metody vyšetřování nepřímým oftalmoskopem, ale lze je chápat jako vhodný doplněk ke konvenčnímu způsobu vyšetřování.
SOUHRN DOPORUČENÍ:
Je nutné jasně definovat, o jaký typ ROP se jedná (typ 1 nebo 2).
V případě nutnosti léčebného zákroku je doporučená doba k jeho provedení 24-72 hodin od stanovení diagnózy splňující indikační kritéria, ale je na oftalmologově posouzení, zda se jedná o urgentní operační zákrok nebo je možná určitá prodleva. Zahájení léčby v případě APROP je nutné co nejdříve, nejpozději do 48 hodin, stejně tak jako u ROP typu 1.
Volba prvního léčebného ošetření ROP je dána zónou ROP. Při léčbě ROP v zóně II-III je transpupilární laserová fotokoagulace sítnice první metodou volby (pokud je hlavový laser součástí vybavení oftalmologického nebo neonatologického pracoviště). Fotokoagulace je také preferovaná při lokalizaci ROP v posteriorní části zóny II. Výjimku tvoří nález APROP, ROP v zóně I a nálezy na rozhraní zóny I a posterior zóny II, které jsou primárně indikovány k intravitreální léčbě anti-VEGF.
Kryoterapie je metodou technicky jednodušší a rychlejší. Více však destruuje sítnici a nedokáže správně ošetřit oblasti blíže zadnímu pólu, proto ji použijeme jen v případě, kdy nelze provést transpupilární laserovou fotokoagulaci jako metodu první volby. Alternativní léčebnou volbou je transsklerální laserová fotokoagulace.
Před každým operačním výkonem rodiče podepisují informovaný souhlas a pořizuje se fotodokumentace nálezu na sítnici pomocí přenosné širokoúhlé fundus kamery RetCam (pokud je součástí vybavení oftalmologického nebo neonatologického pracoviště). Pořízení fotodokumentace ROP je nutné pro dokumentaci správné indikace operačního zákroku. Další fotodokumentaci pořizuje oftalmolog dle vlastního uvážení, ale vždy při zhoršení nálezu a před propuštěním dítěte.
Vylučovací kritéria pro intravitreální léčbu anti-VEGF jsou oční infekce v průběhu 5 dní před aplikací.
Kontroly po operačním výkonu (den provedení výkonu je definován jako 0. den):
- a) Po transpupilární laserové fotokoagulaci: 5. - 7. den po výkonu a dále dle nálezu a uvážení oftalmologa až do regrese nálezu
- b) Po transsklerální laserové fotokoagulaci / kryoterapii sítnice: 5. - 7. den po výkonu a dále dle nálezu a uvážení oftalmologa až do regrese nálezu
- c) Po intravitreální léčbě anti-VEGF: 1., 3. - 4. den, 7. den a dále dle nálezu a uvážení oftalmologa až do regrese nálezu.
DOPLŇUJÍCÍ LÉČBA
Při neuspokojivé odpovědi na léčbu první volby je třeba provést další léčebný zákrok, tj. „retreatment“. Lze doplnit první typ použité léčby nebo převést pacienta na druhý typ zákroku. Při nedostatečné nebo nulové regresi je výběr doplňující terapie zcela v rukou oftalmologa. Pacienti po anti-VEGF se mohou převést na laserovou fotokoagulaci a naopak po laserové fotokoagulaci na anti-VEGF terapii (může se to týkat obou očí nebo pouze jednoho oka) [39].
Za známky regrese je považován ústup změny na cévách, tj. zúžení nebo normalizace šířky cév, zmírnění nebo vymizení jejich tortuosity a viditelná nebo plná resorbce hemoragií. Pro regresi v periferii svědčí snížení, zúžení nebo vymizení valu, ústup nebo vymizení preretinálních fibrotických změn.
Volba terapie po léčbě anti-VEGF se řídí typem regrese
Pokud nedojde k žádné regresi nebo je regrese nálezu na cévách minimální proti nálezu v periferii, svědčí to pro trvající vysokou agresivitu onemocnění a je vhodné použít druhou aplikaci anti-VEGF. Tato léčba bude výhodou i pro rychlejší odezvu ve srovnání s fotokoagulací. Při aplikaci injekce zvolíme jiný kvadrant. V případě alespoň částečné regrese vyvolané snížením aktivity ROP a přetrvávajících změnách v periferii je vhodnou doplňující terapií fotokoagulace, kdy dosáhneme kombinovaného efektu léčby ROP.
Pacienti po léčbě anti-VEGF (převedení na laserovou fotokoagulaci nebo možnost 2. aplikace anti-VEGF)
- a) nález je beze změny nebo zhoršen při kontrolním vyšetření 4. den (srovnání s nálezem před léčbou)
- b) nález minimálně zlepšen, beze změny nebo zhoršen při kontrolním vyšetření 7. den (srovnání s nálezem před léčbou)
- c) nález zhoršen kdykoliv mezi 7. a 28. dnem (srovnání s předchozím nálezem).
- d) zhoršení ROP ve srovnání s předchozím vyšetřením kdykoliv po 28. dni.
Po první i druhé opakované injekci je možné převést na laserovou fotokoagulaci sítnice podle zvážení oftalmologa.
Pacienti po léčbě transpupilární laserovou fotokoagulací (převedení na anti-VEGF terapii)
- a) nález beze změny nebo zhoršen při kontrolním vyšetření 5. - 7. den (srovnání s nálezem před léčbou)
- b) nález minimálně zlepšen, beze změny nebo zhoršen při vyšetření 14. den (srovnání s nálezem před léčbou)
- c) nález zhoršen kdykoliv po 14. dni (srovnání s předchozím nálezem).
Injekci možno aplikovat do jednoho nebo do obou očí v závislosti na aktuálním klinickém nálezu na sítnici.
Pacienti po léčbě transsklerální termokoagulací (laserovou fotokoagulací/ kryokoagulací) (převedení na anti-VEGF terapii)
- a) nález beze změny nebo zhoršen při kontrolním vyšetření v 5. - 7. den (srovnání s nálezem před léčbou)
- b) nález minimálně zlepšen, beze změny nebo zhoršen při vyš. v 14. den (srovnání s nálezem před léčbou)
- c) nález zhoršen kdykoliv po 14. dni (srovnání s předchozím nálezem).
Injekci možno aplikovat do jednoho nebo do obou očí v závislosti na aktuálním klinickém nálezu na sítnici.
Doplnění laserové terapie přichází v úvahu jen při nedostatečném primárním ošetření avaskulární plochy sítnice koagulací.
PARS PLANA VITREKTOMIE
Přechodem onemocnění do dalších závažnějších stádií ROP (stádia 4 a 5) už není nález vhodný k primární léčbě nebo k doplňující léčbě dle doporučených postupů.
Vitreoretinální výkony jsou v současné době vyhrazené jen pro řešení těchto terminálních stádií ROP a jejích komplikací, které jsou charakterizovány jizevnatými a trakčními změnami na sítnici se všemi jejich negativními důsledky ve smyslu částečného nebo úplného odchlípení sítnice.
Doporučovanou technikou léčby ROP čtvrtého a pátého stádia je tzv. čočku šetřící pars plana vitrektomie s následnou tamponádou oka silikonovým olejem nebo expanzivním plynem. Indikace k provedení tohoto typu operací jsou přísně individuální s přihlédnutím na lokální sítnicový nález, celkový stav dítěte a zkušenosti vitreoretinálního chirurga, který danou operaci provádí. Obvykle se jedná o déle trvající operaci s velkou zátěží na organismus nezralého novorozence.
Na tomto místě je však nutno zdůraznit, že anatomické úspěchy tohoto typu léčby jsou obvykle ve velkém kontrastu s minimálními funkčními výsledky.
DLOUHODOBÉ SLEDOVÁNÍ TĚŽCE NEDONOŠENÝCH DĚTÍ
Programy dlouhodobého sledování předčasně narozených dětí, nejen s ROP, existují v ČR od roku 1997, tedy téměř 20 let. Mají jednotný odborný obsah, formu a pravidla. Jde o kvalitní mezioborovou spolupráci.
Těžce nedonošené děti bez ROP mají vysoké riziko vzniku refrakčních vad a šilhání. I mírný a střední stupeň ROP se spontánní regresí má nepříznivý vliv na vývoj sítnice a prakticky nikdy neproběhne bez následků pro vidění.
Faktory omezující výslednou zrakovou ostrost
Nezralost může mít vliv na vývoj normální foveolární buněčné a cévní architektury. Studie s využitím optické koherentní tomografie (OCT) ukazují, že foveolární deprese může být u dětí předčasně narozených vejcovitá a mělká a fovea bývá ztluštělá [30]. Tato abnormalita v hloubce foveolární deprese vzniká v důsledku snížení migrace buněk z foveální oblasti, způsobené nerovnováhou hladin VEGF a jejich vlivu na cévní remodelaci. Limitovaná foveolární diferenciace snižuje kvalitu vznikajících vizuálních potenciálů. Pokud dojde k foveálnímu posunu distorzí nebo dislokací (dezorganizace sítnicových elementů fovey trakcí) jako následků ROP, kvalita vidění klesá až pod hranici slabozrakosti, přestože sítnice není odchlípená. Situaci navíc zhoršuje chybějící či pozdní nasazení správné brýlové korekce. Správný vývoj nezralého mozku je narušen v důsledku neošetřené anisometropie nebo strabismu a vede ke vzniku amblyopie.
AMBULANTNÍ DLOUHODOBÉ SLEDOVÁNÍ OFTALMOLOGEM
V rámci dlouhodobého sledování je důležité stanovit včas kvalitu zrakové ostrosti, zjistit objektivně velikost refrakce a posoudit schopnost a sílu akomodace [54]. Pokud je to možné, snažíme se zmapovat poruchy v zorném poli dítěte a zjistit kvalitu kontrastní citlivosti (tabulka 3).
Tab. 3. Dlouhodobé oftalmologické sledování rizikových dětí v ČR 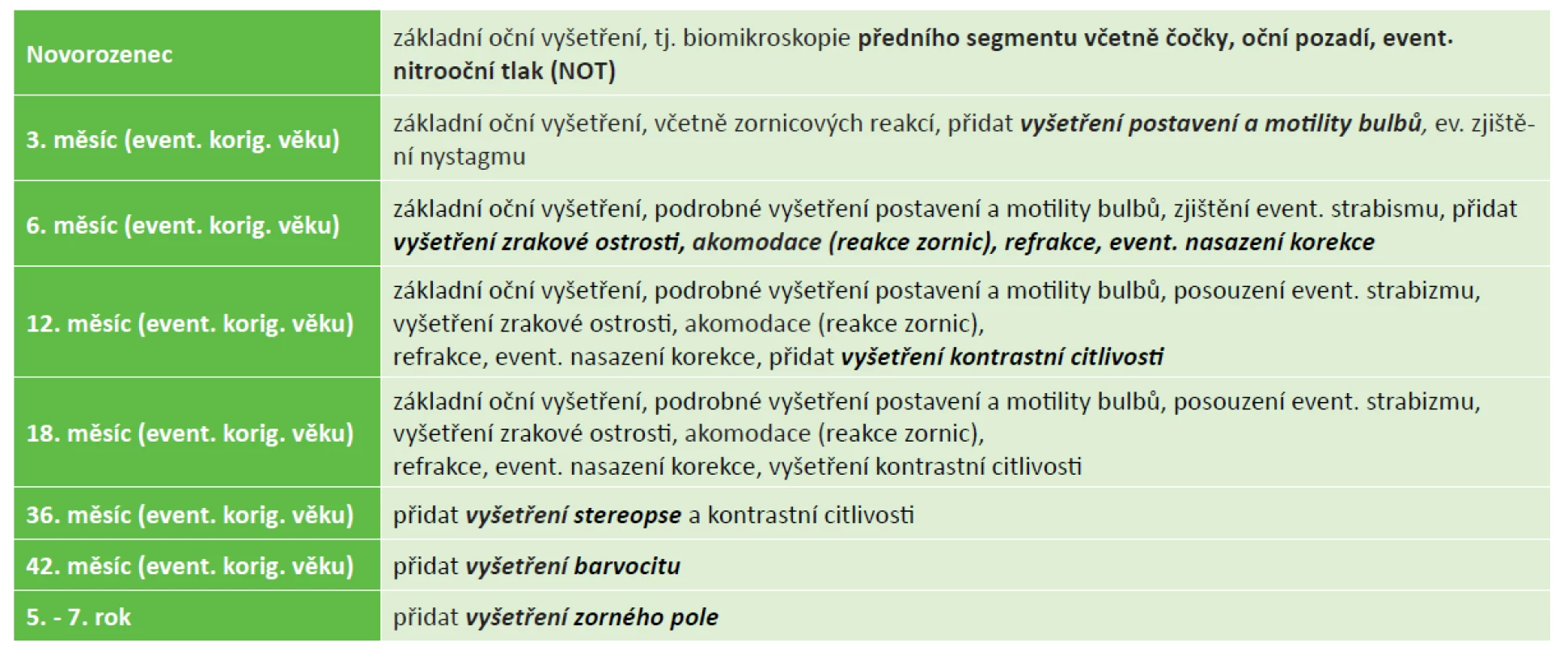
(jedná se o standardní rozsah oftalmologického vyšetření prováděného erudovaným dětským oftalmologem) Na základě získaných údajů máme možnost navrhnout léčebný a zrakově rehabilitační plán pro rozvoj zrakových funkcí, někdy ještě dlouho před ukončením regrese ROP a definitivním stanovením stupně zrakového postižení. Včasné odeslání dítěte k očnímu vyšetření je podmínkou úspěšnosti možné léčby.
Nejčastější komplikace po mírných nebo středních formách ROP jsou refrakční vady (myopie, astigmatismus, anisometropie) s výskytem 32-74%, strabismus s incidencí 30 % (nejčastěji esotropie v 13-21 %). Dále často vzniká pseudostrabismus pro stažení až nařasení sítnice s posunem nebo bez posunu makuly (pseudoexotropie) a amblyopie na základě včas nerozpoznané a neošetřené refrakční vady [53].
Mezi pozdní následky patří rozvoj komplikované katarakty nebo sekundárního glaukomu, který může být komplikací u jizvících se ROP. Ke zpomalení průběhu jizvení jsou v léčbě kombinovány lokální kortikoidy s antiglaukomatiky. V pozdějším období, dokonce mnoho let po prodělané ROP, jsou tito pacienti ohrožení rozvojem ciliárního bloku a akutním glaukomovým záchvatem. Často vyžadují až chirurgické řešení pomocí laserové iridotomie. V případě konečného 5. stádia ROP dochází postupně k atrofizaci bulbu, která je provázena výrazným poklesem nitroočního tlaku, iritací a bolestivostí bulbu a vyžaduje lokální aplikaci kortikoidů. V případě vzniku zonulární keratopatie chráníme povrch rohovky dlouhodobě umělými slzami.
S ohledem na kritické periody vývoje zraku, trváme na precizním ošetření, tj. adekvátní korekce refrakční vady a vždy plná korekce astigmatismu, dále addice nebo hyperkorekce u postižení spojených s poruchou akomodace. Důležitá je i správná indikace a režim okluzní terapie v případě strabismu, amblyopie či výrazné asymetrie zjištěné zrakové ostrosti. Celá léčba je vedena s ohledem na oftalmologický nález. Citlivě zvolené chirurgické řešení strabismu má významný vliv na rozvoj motorických funkcí nejen u dětí s motorickým handicapem. Jakékoliv těžké zrakové postižení (včetně následků ROP) vždy negativně ovlivní rozvoj motorických, poznávacích i komunikačních schopností dítěte, zejména v předškolním věku. Některá perinatální poškození mozku mohou vést k tzv. CVI (Cerebral Visual Impairment), což jest centrální zraková porucha. Ke kompletní dlouhodobé péči o tyto děti patří i trpělivá, pečlivá zraková stimulace a rehabilitace ve spolupráci se zrakovým terapeutem, případně podpora rozvoje binokulárního vidění pomocí ortoptického cvičení. Výsledky práce s postiženými dětmi můžeme posoudit až s časovým odstupem, často několikaletým. Jsou natolik povzbudivé, že se vyplatí takovým dětem věnovat maximální úsilí.
Do redakce doručeno dne: 30. 11. 2018
Do tisku přijato dne: 17. 12. 2018
Korespondující autor:
MUDr. Anna Zobanová
Soukromá oční ordinace, Kršková 807, Praha 5, 152 00
Zdroje
1. Ahmed, AE., Channa, R., Durrani, J. et al.: Early experience with intravitreal bevacizumab combined with laser treatment for retinopathy of prematurity. Middle East Afr J Ophthalmol, 17; 2010 : 264-247.
2. Altinsoy, HI., Mutlu, FM., Gungor, R. et al.: Combination of laser photocoagulation and intravitreal bevacizumab in aggressive posterior retinopathy of prematurity. Ophthalmic Surg Lasers Imaging, 42; 2010: E1-E5.
3. American Academy of Pediatrics. Section on Ophthalmology: Screening examination of premature infants for retinopathy of prematurity. Pediatrics, 131; 2013 : 189-195.
4. Ashton, N., Ward, B., Serpell, G.: Role of oxygen in the genesis of retrolental fibroplasia; a preliminary report. Br J Ophthalmol, 37; 1953 : 513-520.
5. Augestad, LB., Klingenberg, O., Fosse, P.: Braile use among Norwegian children from 1967 to 2007: trends in the underlying causes. Acta Ophthalmol, 90; 2012 : 428-434.
6. Autrata, R., Šenková, K., Holoušová, M. et al.: Combined treatment with laser photocoagulation and cryotherapy for threshold retinopathy of prematurity. Eur J Ophthalmol, 18; 2008 : 112-117.
7. Autrata, R., Šenková, K., Holoušová, M. et al.: Effects of intravitreal pegaptanib or bevacizumab and laser in treatment of threshold retinopathy of prematurity in zone I and posterior zone II-four years results. Cesk Slov Oftalmol, 68; 2012 : 29-36.
8. Autrata, R., Krejčířová, I., Šenková, K. et al.: Intravitreal pegaptanib combined with diode laser therapy for stage 3+ retinopathy of prematurity in zone I and posterior zone II. Eur J Ophthalmol, 22; 2012 : 687-694.
9. Carvallaro, G., Filippi, L., Bagnoli, P. et al.: The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmol, 92; 2014 : 2-20.
10. Castellanos, MA., Schwartz, S., García-Aguirre G. et al.: Short-term outcome after intravitreal ranibizumab injections for the treatment of retinopathy of prematurity. Br J Ophthalmol, 97; 2013 : 816-819.
11. Chung, EJ., Kim, JH., Ahn, HS. et al.: Combination of laser photocoagulation and intravitreal bevacizumab (Avastin) for aggressive zone I retinopathy of prematurity. Graefes Arch Clin Exp Ophthalmol, 245; 2007 : 1727-1730.
12. Committee for the Classification of Retinopathy of Prematurity: an international classification of retinopathy of prematurity. Arch Ophthalmol, 102; 1984 : 1130-1134.
13. Connolly, BP., Ng, EY., McNamara, JA. et al.: A comparison of laser photocoagulation with cryotherapy for threshold retinopathy of prematurity at 10 years. Part 2. Refractive outcome. Ophthalmology, 109; 2002 : 936-941.
14. Dorta, P., Kychenthal, A.: Treatment of type 1 retinopathy of prematurity with intravitreal bevacizumab (Avastin). Retina, 30 (4 Suppl); 2010: S24-S31.
15. Drenser, KA., Trese, MT., Capone, A., Jr.: Aggressive posterior retinopathy of prematurity. Retina, 30 (4 Suppl); 2010: S37-S40.
16. Early Treatment for Retinopathy of Prematurity Cooperative Group: Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial. Arch Ophthalmol, 121; 2003 : 1684-1694.
17. Good, WV., Early Treatment for Retinopathy of Prematurity Cooperative Group: Final results of the Early Treatment for Retinopathy of Prematurity (ETROP) randomized trial. Trans Am Ophthalmol Soc, 102; 2004 : 233-248.
18. Harder, BC., von Baltz S., Jonas, JB., et al.: Intravitreal bevacizumab for retinopathy of prematurity. J Ocul Pharmacol Ther, 27; 2011 : 623-627.
19. Hartnett, ME., Penn, JS.: Mechanisms and management of retinopathy of prematurity. N Engl J Med, 367; 2012 : 2515-2526.
20. Honda, S., Hirabayashi, H., Tsukahara, Y. et al.: Acute contraction of the proliferative membrane after an intravitreal injection of bevacizumab for advanced retinopathy of prematurity. Graefes Arch Clin Exp Ophthalmol, 246; 2008 : 1061-1063
21. Kim, J., Kim,SJ., Chang, YS. et al.: Combined intravitreal bevacizumab injection and zone I sparing laser photocoagulation in patients with zone I retinopathy of prematurity. Retina, 34; 2014 : 77-82.
22. Koo, KY., Kim, JE., Lee, SM. et al.: Effect of severe neonatal morbidities on long term outcome in extremely low birth-weight infants. Korean J Pediatr, 53; 2010 : 694-700.
23. Kretzer, FL., Hittner, HM.: Human retinal development: relationship to the pathogenesis of retinopathy of prematurity. In: McPherson, AR., Hittner, HM., Kretzer, FL. (Eds), Retinopathy of prematurity: current concepts and controversies. Toronto, Decker, 1986, 27-52.
24. Kusaka, S., Shima, C., Wada, K. et al.: Efficacy of intravitreal injection of bevacizumab for severe retinopathy of prematurity: a pilot study. Br J Ophthalmol, 92; 2008 : 1450-1455.
25. Lalwani, GA., Berrocal, AM., Murray, TG. et al.: Off-label use of intravitreal bevacizumab (Avastin) for salvage treatment in progressive threshold retinopathy of prematurity. Retina, 28(3 Suppl); 2008: S13-S18.
26. Langford, K., Nicolaides, K., Miell, JP.: Maternal and fetal insulin-like growth factor and their binding proteins in the second and third trimesters of human pregnancy. Hum Reprod, 13; 1998 : 1389-1393.
27. Lin, CJ., Chen, SN., Hwang, JF.: Intravitreal ranibizumab as salvage therapy in an extremely low-birth-weight infant with rush type retinopathy of prematurity. Oman J Ophthalmol, 5; 2012 : 184-186.
28. Lomíčková, H.: Léčení retrolentální fibroplasie kyslíkem. Čs Oftalmol, 14; 1958 : 138-146.
29. Lomíčková, H., Odehnal, M., Zobanová, A. et al.: Kryokoagulace v léčbě retinopatie nedonošených. Čs Oftalmol, 46; 1990 : 1-8.
30. Miki, A., Honda, S., Inoue, Y.,Yamada,Y. et al.: Foveal depression and related factors in patients with a history of retinopathy of prematurity. Ophthalmologica, 240; 2018 : 106-110.
31. Mintz-Hittner, HA., Kennedy, KA., Chuang, AZ., BEAT-ROP Cooperative Group: Efficacy of intravitreal bevacizumab for stage 3+ retinopathy of prematurity. N Engl J Med, 364; 2011 : 603-615.
32. Mintz-Hittner, HA., Kuffel, RR., Jr.: Intravitreal injection of bevacizumab (Avastin) for treatment of stage 3 retinopathy of prematurity in zone I or posterior zone II. Retina, 28; 2008 : 831-838.
33. Mota, A., Carneiro, A., Breda, J. et al.: Combination of intravitreal ranibizumab and laser photocoagulation for aggressive posterior retinopathy of prematurity. Case Rep Ophthalmol, 3; 2012 : 136-141.
34. Multicenter trial of cryotherapy for retinopathy of prematurity: Preliminary results. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Arch Ophthalmol, 106; 1988 : 471-479.
35. Nicoară, SD., Stefanut AC., Nascutzy C. et al.: Regression rates following the treatment of aggressive posterior retinopathy of prematurity with bevacizumab versus laser: 8-year retrospective analysis. Med Sci Monit, 22; 2016 : 1192-1209.
36. Olofsson, B., Korpelainen, E., Pepper, MS. et al.: Vascular endothelial growth factor B (VEGF-B) binds to VEGF receptor-1 and regulates plasminogen activator activity in endothelial cells. Proc Natl Acad Sci USA, 95; 1998 : 11709-11714.
37. Patz, A., Hoeck, LE., De LaCruz, E.: Studies on the effect of high oxygen administration in retrolental fibroplasia. I. Nursery observations. Am J Ophthalmol, 35; 1952 : 1248-1253.
38. Quiroz-Mercado, H., Martinez-Castellanos, MA., Hernandez-Rojas, ML. et al.: Antiangiogenic therapy with intravitreal bevacizumab for retinopathy of prematurity. Retina, 28(3 Suppl); 2008: S19-S25.
39. RAINBOW study: A randomized, controlled study evaluating the efficacy and safety of Ranibizumab compared with laser therapy for the treatment of infants born prematurely with retinopathy of prematurity – Protocol.
40. Royal College of Ophthalmologists, Royal College of Paediatrics and Child Health, British Association of Perinatal Medicine & BLISS: Guidelines for the Screening and Treatment of Retinopathy of Prematurity, UK Retinopathy of Prematurity Guideline. Royal College of Paediatrics and Child Health, 2008.
41. Sato, T., Kusaka, S., Shimojo, H. et al.: Vitreous levels of erythropoietin and vascular endothelial growth factor in eyes with retinopathy of prematurity. Ophthalmology, 116; 2009 : 1599-1603.
42. Sautina, L., Sautin, Y., Beem, E. et al.: Induction of nitric oxide by erythropoetin is mediated by the β common receptor and requires interaction with VEGF receptor 2. Blood, 115; 2010 : 896-905.
43. Smith, LE.: Through the eyes of a child: understanding retinopathy through ROP. The Friedenwald lecture. Invest Ophthalmol Vis Sci, 49; 2008 : 5177-5182.
44. Sonmez, K., Drenser, KA., Capone, A., Jr. et al.: Vitreous levels of stromal cell-derived factor 1 and vascular endothelial growth factor in patients with retinopathy of prematurity. Ophthalmology, 115; 2008 : 1065-1070.
45. The International Committee for the Classification of Retinopathy of Prematurity: The international classification of retinopathy of prematurity revised. Arch Ophthalmol, 123; 2005 : 991-999.
46. Terry, TL.: Extreme prematurity and fibroplastic overgrowth of persistent vascular sheath behind each crystaline lens. I. Preliminary report, Am J Ophthalmol, 25; 1942 : 203-204.
47. Travassos, A., Teixeira, S., Ferreira, P. et al.: Intravitreal bevacizumab in aggressive posterior retinopathy of prematurity. Ophthalmic Surg Lasers Imaging, 38; 2007 : 233-237.
48. Wallace, DK., Kylstra, JA., Greenman, DB. et al.: Significance of isolated neovascular tufts (“popcorn”) in retinopathy of prematurity. J AAPOS, 2; 1998 : 52-56.
49. Wood, SM., Gleadle, JM., Pugh, CW. et al.: The role of the aryl hydrocarbon receptor nuclear translocator (ARNT) in hypoxic induction of gene expression. Studies in ARNT-deficient cells. J Biol Chem, 271; 1996 : 15117-15123.
50. Wu, WC., Yeh, PT., Chen, SN. et al.: Effects and complications of bevacizumab use in patients with retinopathy of prematurity: a multicenter study in Taiwan. Ophthalmology, 2011; 118(1): 176-83.
51. Zoban, P.: Výskyt dlouhodobé morbidity u rizikových skupin dětské populace. In Štembera, Z., Dittrichová, J., Sobotková, D. et al. (Eds), Perinatální neuropsychická morbidita dítěte, Praha, Nakladatelství Karolinum, 2014, 518-529.
52. Zobanova, A.: Koordinace péče o poruchy vidění ve spolupráci dětský lékař a oftalmolog. Pediatrie pro praxi, 5; 2004 : 236-237.
53. Zobanová, A.: Současný pohled na retinopatii předčasně narozených dětí. Pediatrie pro praxi, 17; 2016 : 279-284.
Štítky
Oftalmologie
Článek SILENT SINUS SYNDROM
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2018 Číslo 6- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
-
Všechny články tohoto čísla
- VIRTIOL – SIMULACE KVALITY VIDĚNÍ S MULTIFOKÁLNÍMI A EDOF INTRAOKULÁRNÍMI ČOČKAMI
- KORTIKOSTEROIDY INDUKOVANÁ ZADNÍ SUBKAPSULÁRNÍ KATARAKTA
- OČNÍ PROJEVY U PACIENTŮ S HIV INFEKCÍ
- VÝZNAM ZHODNOCENÍ VÝVOJE OCT OBRAZU PŘI KONZERVATIVNÍM ŘEŠENÍ VITREOMAKULÁRNÍ TRAKCE KOMPLIKOVANÉ MAKULÁRNÍ DÍROU
- SILENT SINUS SYNDROM
- IDIOPATICKÁ CHOROIDÁLNÍ NEOVASKULÁRNÍ MEMBRÁNA U 12LETÉ DÍVKY
- SCREENING, LÉČBA A DLOUHODOBÉ SLEDOVÁNÍ RETINOPATIE PŘEDČASNĚ NAROZENÝCH DĚTÍ V ČR
- OČNÍ KLINIKA 1. LÉKAŘSKÉ FAKULTY UNIVERZITY KARLOVY A VŠEOBECNÉ FAKULTNÍ NEMOCNICE V PRAZE SLAVÍ 200 LET OD SVÉHO ZALOŽENÍ
- Vážený a milý pán doc. MUDr. Tomáš Mazalán, CSc.
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- OČNÍ PROJEVY U PACIENTŮ S HIV INFEKCÍ
- SILENT SINUS SYNDROM
- VIRTIOL – SIMULACE KVALITY VIDĚNÍ S MULTIFOKÁLNÍMI A EDOF INTRAOKULÁRNÍMI ČOČKAMI
- KORTIKOSTEROIDY INDUKOVANÁ ZADNÍ SUBKAPSULÁRNÍ KATARAKTA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání