-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přínos a kontraproduktivita terapie kortikosteroidy u afekcí rohovky
Autoři: M. Zemanová; V. Matušková
Působiště autorů: Oční klinika FN a LF MU, Brno, přednosta prof. MUDr. Eva Vlková, CSc.
Vyšlo v časopise: Čes. a slov. Oftal., 73, 2017, No. 2, p. 69-77
Kategorie: Původní práce
Souhrn
Úvod:
Terapie kortikosteroidy je velkým přínosem u mnoha typů očních onemocnění. Kortikosteroidy se používají se v léčbě zánětlivých a imunologických onemocnění oka.Cíl:
Cílem práce je prezentovat základní informace o působení steroidů v tkáních, jejich nežádoucích účincích a strategii léčby.Metodika a výsledky:
Autorky zpracovávají přehled lokálních a celkových steroidů a jejich aplikační formy. Poukazují na nejčastější problémy spojené s léčbou kortikosteroidy.Závěr:
Ač kortikosteroidy patří napříč medicínou k jedněm z nejčastěji předepisovaným lékům vůbec, vždy je třeba velmi obezřetně indikovat léčbu jakýmkoliv kortikosteroidním preparátem a před jeho podáním vyloučit všechny infekční choroby, odebrat důkladnou anamnézu a pečlivě vyšetřit pacienta.Klíčová slova:
rohovka, hojení rohovky, zánětlivá kaskáda, kortikosteroidyÚVOD
Rohovka (cornea) je avaskulární tkáň, přičemž nepřítomnost cév v rohovce je základní podmínkou její transparentnosti. Rohovka má pomalý metabolismus i hojení, nemá žádnou lymfatickou drenáž. Výživa rohovky není zajišťována krevní cestou (rohovka je avaskulární, bradytrofická tkáň, stejně jako skléra, čočka a sklivec), ale třemi rozdílnými systémy: difuzí živin z kapilár limbu, difuzí a aktivním transportem z komorové tekutiny (především glukóza), a difuzí z prekorneálního slzného filmu (především kyslík) [7].
Histologicky se rohovka skládá ze šesti vrstev: epitel, Bowmanova membrána, stroma, Duova vrstva, Descemetova membrána a endotel (obr. 1). Epitel rohovky tvoří 10 % její tloušťky a skládá se z 5–6 vrstev nekeratinizujících nesekrečních buněk – bazální vrstva kubických až nízce cylindrických buněk, jež jsou schopny dělení a postupně migrují k povrchu epitelu, dvě vrstvy polyedrických (polygonálních, křídlových) buněk, které jsou též schopny dělení a kde končí nervová zakončení, a na povrchu 2–3 vrstvy plochých (squamózních) buněk, které mají na apikální straně mikroklky, díky nimž je umožněno přilnutí mucinu slzného filmu. Buňky epitelu programově umírají, odumírající buňky se šupinovitě odlučují do slzného filmu. Epitel rohovky je permeabilní bariéra pro malé molekuly, vodu a ionty, a je bariérou proti vstupu patogenů. Epitel neustále regeneruje každých 7–10 dní (díky limbálním buňkám). Slzný film (7 µm) na povrchu rohovky tvoří důležité refrakční prostředí a chrání povrch epitelu (mechanická a imunologická ochrana). Bowmannova membrána (= lamina limitans anterior) má tloušťku 8–12 µm, jedná se o homogenní, acelulární, ostře ohraničenou vrstvu. Je tvořena z tenkých a náhodně se křížících kolagenních fibril a kondenzované interfibrilání hmoty. Bowmanova membrána se podílí na pevnosti rohovky a při poranění nemá schopnost regenerace, po jejím narušení dochází k tvorbě jizvy, pokud je poškozena infekcí, vždy vzniká vřed. Stroma (= substantia propria) představuje 90 % tloušťky rohovky. Je složeno z pravidelně uspořádaných kolagenních fibril, z extracelulární matrix (amorfní hmota z proteoglykanů, glykosaminoglykanů a kyseliny hyaluronové) a z buněk – tzv. keratocytů (modifikované fibroblasty uložené mezi fibrilami a produkující kolagenní fibrily a extracelulární matrix). Příležitostně jsou ve stromatu zachyceny lymfocyty, makrofágy a polymorfonukleární leukocyty. Průhlednost rohovky je dána pravidelnou vzdáleností fibril a jejich stejnou tloušťkou. Hydratace stromatu musí být konstantní, pokud se zvýší obsahu vody, jednotlivé fibrily se zbobtnáním mukopolysacharidů roztlačí, vzniká edém a rohovka se kalí. Stroma má velmi malou schopnost regenerace. Duova vrstva je nově objevená vrstva mezi stromatem a Descemetovou membránou, tloušťky 15 µm, velmi pevná, acelulární. V poslední době bylo zjištěno, že hraje roli v etiopatogenezi ektatických onemocnění, rohovkových dystrofií, při descemetokéle či akutnímu hydropsu rohovky. Byla objevena britským lékařem Harmindeem Duem, který potvrdil její existenci mezi Descemetovou membránou a stromatem pomocí pokusů se vzduchovými bublinami při pečlivém pozorování rohovky elektronovým mikroskopem. Její objevení umožňuje očním chirurgům postupovat při transplantacích rohovky dokonaleji [3]. Descemetova membrána (= lamina limitans posterior) je bazální membránou endotelu, produkována endotelovými buňkami a je relativně pevná. S narůstajícím věkem dochází k jejímu ztlušťování (po narození se vyvíjí zadní 2/3 membrány). Je tvořena svazky kolagenních (kolagen typu IV) a elastických fibril. Descemetova membrána je bohatá na glykoproteiny (laminin), díky nim pevně přilne k endotelu, brání průniku leukocytů do stromatu rohovky, v periferii přechází do trabekula duhovko-rohovkového úhlu a končí ve Schwalbeho prstenci. Je velmi odolná vůči poranění a infekcím a má schopnost regenerace (díky funkčním endotelovým buňkám). Endotel je tvořen jednou řadou plochých a pravidelně šestibokých (hexagonálních) buněk, jeho tloušťka je 4–6 µm. Endotel vystýlá zadní plochu rohovky a duhovko-rohovkový úhel odkud přechází na přední plochu duhovky. Normální počet endotelových buněk je při narození 4000–5000 buněk/mm², v dospělosti průměrná hustota 2700 buněk/mm², při poklesu počtu buněk pod 500/mm² dojde k poruše hydratace rohovky, vzniká edém a snížení transparentnosti rohovky. Endotel neregeneruje (buňky mají omezenou schopnost mitózy), reparace endotelu probíhá zvětšováním (= hypertrofií) a migrací stávajících buněk. Endotel zodpovídá za konstantní hydrataci a transparenci rohovky a tím udržuje konstantní optickou mohutnost, má bariérovou funkci (zabraňuje průniku komorové tekutiny do stromatu) a funkci metabolické pumpy (aktivní transport díky Na/K ATPáze) [6, 7].
Obr. 1. Rohovka – histologie 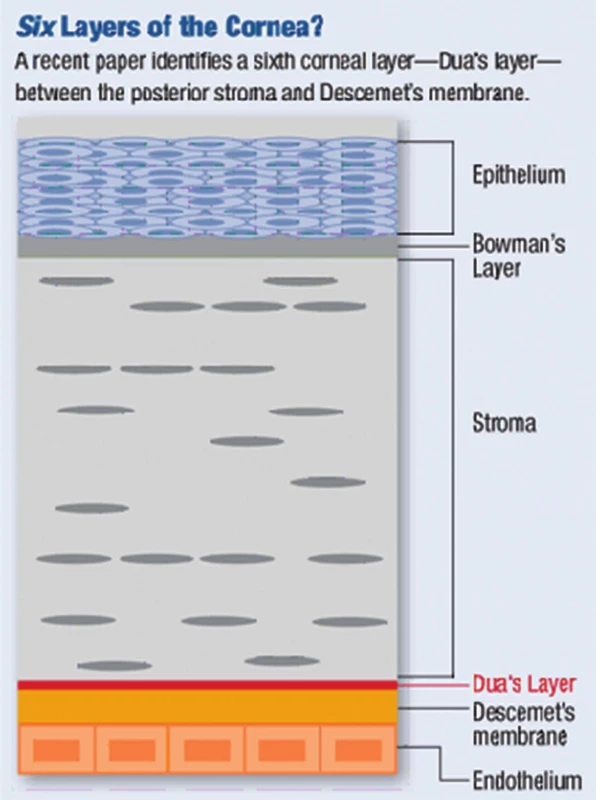
Zdroj: www.google.com Rohovka je velmi bohatě inervovaná, má největší počet senzitivních nervových zakončení na mm² ze všech tkání v těle. Senzitivní inervace je zajišťována první větví trojklanného nervu (n. trigeminus) cestou n. ophthalmicus, n. nasociliaris a nn. ciliares breves. Tyto nervy vstupují cirkulárně v počtu 12–16 do oblasti korneo-sklerálního limbu, při průchodu od limbu ztrácí nervy myelinovou pochvu. V rohovce je pak konečná větev rozvětvena na dva plexy: subepiteliální a subbazální plexus (nejsilnější jsou stromální vlákna). Spolu se senzitivní inervací vstupuje do rohovky sympatická (autonomní) inervace cestou ganglion cervicale superior [7].
Rohovka je imunologicky privilegovaná tkáň díky avaskularitě, chybějící lymfatické drenáži a nízkému obsahu antigen prezentujících buněk. Imunitní odpověď rohovky se dělí na dvě složky. Nespecifická se skládá z humorální složky (tzv. komplementový systém), a složky buněčné – buňky schopné fagocytózy (leukocyty a dendritické buňky). Specifická imunitní odpověď se opět skládá z humorální složky (B-lymfocyty, cytokiny) a z buněčné složky (T-lymfocyty, Langerhansovy buňky, stromální keratocyty, epiteliální a endoteliální buňky) [11].
Hojení rohovky: Obnova epitelu vyžaduje součinnost mnoha faktorů a je charakterizována třemi fázemi. První fází je fáze migrace, která vzniká za 4–5 hodin po poranění a probíhá při ní interakce mezi buňkami. Za 24–30 hodin pak následuje fáze proliferace a jako poslední je fáze diferenciace – adheze. Při postižení rohovky se buňky pohybují po obvodu. Limbální epitelové kmenové buňky sídlí v bazálních vrstvách epitelu v přechodové zóně rohovky a spojivky (tzv. Vogtovy palisády) a jejich dceřiné buňky putují do centrálních oblastí rohovky, aby zacelily defekt. Vždy se nejdříve zacelí defekt na limbu před centrálním defektem rohovky. Během poškození epitelu (zánětem, infekcí, traumatem) dojde k proliferaci a diferenciaci bazálních buněk. Z porušeného epitelu je do stromatu přímo pod epitelový defekt uvolňován IL-1α. Ten u některých keratocytů, které leží pod místem rány, indukuje apoptózu, u jiných způsobí proliferaci a přechod z klidového do aktivovaného stadia. Aktivované keratocyty dále samostatně produkují IL-1α a remodelují extracelulární matrix. Poškozené epiteliální buňky produkují do přiléhajícího stromatu též TGF-β2 (transforming growth factor), který indukuje subpopulaci keratocytů k přeměně na myofibroblasty. Myofibroblasty produkují komponenty extracelulární matrix. Zdravý epitel rohovky pomáhají udržovat i rohovkové nervy díky uvolnění rozpustných trofických faktorů. Důležitý je především neurotransmiter Substance P (SP), který působí synergicky s jinými růstovými faktory (včetně nervového růstového faktoru NGF) na urychlení hojení rohovkového epitelu, migraci keratocytů do porušeného místa a jejich proliferaci v průběhu hojení a regenerace. Dle klinických studií je prokázáno, že exprese a sekrece SP se v lidských keratocytech zvýší jako odpověď na poranění in vitro [5, 8].
Kortikosteroidy (KS) se dělí na endogenní a syntetické. Endogenní KS jsou steroidní hormony syntetizované z cholesterolu, produkované kůrou nadledvin, jejichž sekrece je řízena adrenokortikotropním hormonem (ACTH) produkovaným adenohypofýzou. Dělí se na glukokortikoidy (kortisol, kortikosteron), které regulují metabolismus cukrů a bílkovin, na mineralokortikoidy (aldosteron), které ovlivňují metabolismus vody a minerálů v těle, řídí především udržování normální hladiny sodíku (Na) a draslíku (K) v krevní plazmě a objem extracelulární tekutiny, a androgeny (testosteron), které řídí vývoj a udržení maskulinních znaků a jsou prekurzory pro estrogeny. Endogenní kortikosteroidy ovlivňují většinu fyziologických funkcí organismu, umožňují překonání stresových reakcí, regulují imunitní systém, navozují přirozenou imunosupresi, kontrolují zánětlivou reakci a brání jejímu patologickému rozvinutí. Syntetické KS vznikají uměle na základě strukturní analogie, mají vekou šíři terapeutického použití, rozlišujeme čtyři generace. Dle chemické struktury se glukokortikoidy dělí na fluorované a nefluorované. Mezi nefluorované = nehalogenované (1. generace) patří cortison, hydrocortison acetat a prednisolon. Ke fluorovaným = halogenovým (2. a 3. generace) patří dexamethason, fluorometholon a betamethason. Fluorované KS obsahují ve své chemické struktuře molekulu halogenu (Fˉ, Clˉ), vykazují mnohonásobně vyšší terapeutickou účinnost, mají vystupňovaný protizánětlivý účinek, vysoký antiproliferační účinek a tím i větší výskyt nežádoucích účinků. Do 4. generace patří hydrocortison 17-butyrat, methylprednisolon acetonat, prednicarbat. Tyto steroidy neobsahují halogeny, ale na základě určité substituce na molekule uhlíku (C-17 a C-21 pozici) mají vysokou protizánětlivou aktivitu, ale jen slabší antiproliferativní účinek než 2. a 3. generace, z čehož plyne snížení rizika nežádoucích účinků. V praxi se používá velmi široká řada léčiv ze skupiny kortikosteroidů, jejichž použití je závislé na převažujícím mechanismu účinku jednotlivých látek. Mezi možné formy aplikace kortikosteroidů patří lokální aplikace ve formě očních kapek či mastí. Oční lékové formy vykazují rychlý, vysoký protizánětlivý účinek a dobrý průnik do předního segmentu oka. Přes rohovku lépe pronikají roztoky než suspenze či masti. Další možností podání je periokulární aplikace ve formě subkonjunktivální, subtenonské či parabulbární injekce. Jinou aplikační formou je intraokulární aplikace ve formě depotních nitroočních implantátů (Dexamethasone – Ozurdex, Fluocinolone acetonide – Iluvien, Retisert) a intravitreální injekce (Triamcinolone acetonide 4 mg v 0,1 ml). Častou formou aplikace je systémové podání cestou perorální (Prednison tbl., Medrol tbl.), inhalační či parenterální (methylprednisolon – Solu-Medrol). Systémové podání může být provázeno celou řadou nežádoucích účinků (viz dále), jejichž incidence roste v závislosti na trvání, frekvenci a intenzitě léčby. Nesmí se aplikovat u aktivní systémové infekce [2, 4, 9].
Kortikosteroidy mají protizánětlivé, antialergické, imunosupresivní a antiedematózní účinky. Protizánětlivý a imunosupresivní účinek kortikosteroidů je nespecifický. Ovlivňují všechny typy zánětlivých reakcí bez ohledu na příčinu, působí v akutní i chronické fázi zánětu. Kortikosteroidy vykazují silné protizánětlivé účinky, protože přímo zasahují do zánětlivé a koagulační kaskády (obr. 2). Zánět je obrannou reakcí organismu, jehož cílem je zničit či vyřadit podnět vedoucí k zánětlivé reakci. Při zánětu se z poškozených tkáňových buněk do cirkulace uvolňuje řada chemických látek jako histamin, bradykinin, proteolytické enzymy, prostaglandiny a leukotrieny s řadou zánětlivých mediátorů (TNFα, IFNγ, IL-1, PAF, LTB4) a také složky komplementu (C3a, C5a), které iniciují zánětlivou reakci, vzniká bolest (dolor) a zvýšená teplota (calor). Mediátory zánětu zvyšují průtok krve v důsledku vazodilatace za vzniku erytému (rubor), dále zvyšují únik plazmy do poškozené oblasti zvýšením kapilární permeability za vzniku edému (tumor). Zánětlivé mediátory zvyšují expresi adhezivních molekul na povrchu fagocytů a cévních endoteliálních buněk, vzniká zpomalení toku krve a funkce tkáně se poškodí (functio laesa). Poškozenou oblast pak infiltrují leukocyty, které vycestovávají z mirkocirkulace a kumulují se v místě zánětu. Po několika dnech vrůstá fibrózní tkáň a poškozená tkáň se tak hojí. Kortikosteroidy inhibicí fosfolipázy A2 (PL A2) brání biosyntéze kyseliny arachidonové a následně tvorbě prostacyklinu, prostaglandinů a leukotrienů. Brání tvorbě prozánětlivých transkripčních faktorů a tento účinek je nazýván negenomový trans-represivní. Protizánětlivé účinky jsou nespecifické (nezáleží na tom, zda je etiologie alergická, traumatická či infekční). Kortikosteroidy dále snižují proliferaci fibroblastů a množství ukládání kolagenu, a tím ovlivňují regeneraci a opravu tkání. Snižují kapilární propustnost, a tak působí antiedematózně. Antialergický účinek je dán sníženým uvolňováním histaminu z basofilů, které je indukované protilátkami třídy IgE závislé na vyvolávajícím podnětu. Imunosupresivní účinky jsou rovněž nespecifické. Cytoplazmatický receptor pro kortikosteroidy (KSR) je totiž univerzální pro všechny typy buněk v organismu, proto se při všech aplikačních cestách uplatňuje stejný mechanismus účinku. Kortikosteroid pronikne přes cytoplazmatickou membránu buňky, naváže se na cytoplazmatický kortikosteroidní receptor (KSR) a vytvoří komplex KS-KSR. Obsazený receptor je transportován přímo do jádra buňky, kde působí. Takovéto účinky nazýváme genomové trans-aktivační. U cílových buněk (lymfocytů) navodí řízenou smrt buňky (tzv. apoptózu) přímým účinkem komplexu KS-KSR v jádře buňky díky aktivaci proapoptotických genů (tzv. lymfolytický účinek). V makrofázích blokují produkci prozánětlivých interleukinů 1 a 6 (IL-1 a IL-6). Zastavují migraci antigen-prezentujících buněk a buněk fagocytózy do místa zánětu [9, 10, 11].
Obr. 2. Zánětlivá kaskáda 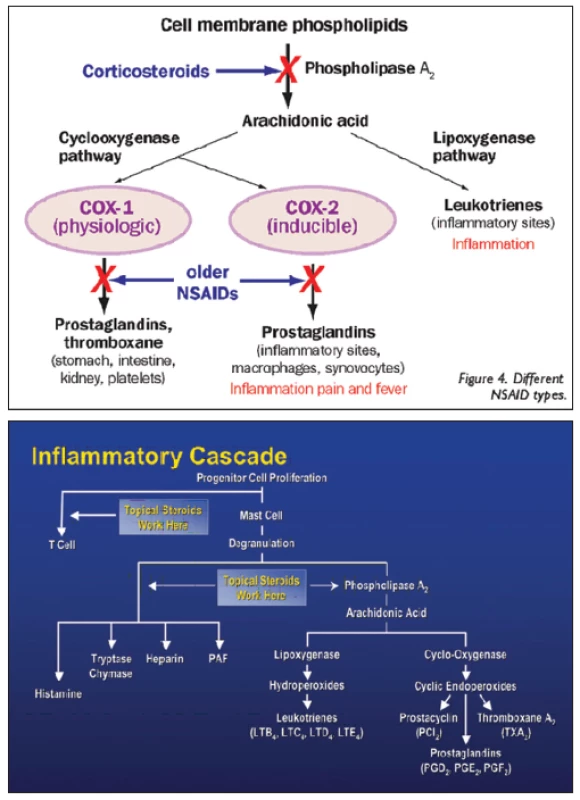
Zdroj: www.google.com Typ a závažnost nežádoucích účinků kortikosteroidů závisí na léčivé látce, na délce a frekvenci jejího podávání, na dávce a lékové formě, ve které je upravena. Nežádoucí účinky souvisí s metabolickými a endokrinními účinky kortikosteroidů. I krátkodobá aplikace velmi vysokých dávek kortikosteroidů může vyvolat vážné, až život ohrožující nežádoucí účinky. K systémovým nežádoucím účinkům patří účinky mineralokortikoidní jako je zvýšení krevního tlaku, retence tekutin a sodíku, deplece kalia, hypokalemická acidóza, negativní dusíková bilance, smrtelné srdeční komorové arytmie. K systémovým účinkům řadíme dále účinky glukokortikoidní (metabolické), kam spadá stimulace glukoneogeneze, snížení využití glukózy buňkami, zvýšená koncentrace glukózy v krvi (porucha glukózové tolerance až manifestace diabetu mellitu), osteoporóza, myopatie, Cushingův syndrom, centripetální obezita, hyperlipidémie, redukce buněčných proteinů (mimo jaterní tkáň), vředová choroba gastroduodena, podpora růstu kosterních svalů (anabolický efekt), zvýšené riziko infekce, reaktivace latentní infekce až vznik sepse, zpomalené hojení ran, ztenčení až atrofie a fragilita kůže, vyrážka (flash), psychiatrické poruchy (třes, deprese, euforie, hyperaktivita), poruchy menstruace, inhibice růstu u dětí, akutní pankreatitida. Kortikosteroidy snižují aktivaci a migraci leukocytů, blokují migraci neutrofilů do extracelulárního prostoru, mají lymfolytický efekt, lehce zvyšují počet červených krvinek, zvyšují srážlivost krve, podávání velkých dávek způsobuje významnou atrofii veškeré lymfoidní tkáně v organismu. K častým lokálním nežádoucím účinkům patří katarakta (nejčastěji zadní subkapsulární) a steroidní glaukom. Steroidní glaukom je formou sekundárního glaukomu otevřeného úhlu. Je způsoben akumulací glykosaminoglykanů v trabekulární trámčině. U geneticky predisponovaných lidí dochází při opakovaném použití lokálních kortikosteroidů k elevaci nitroočního tlaku (tzv. steroid responder). Roli přitom hraje individuální vnímavost pacienta, trvání, síla, frekvence léčby a vlastnosti použitého preparátu (tab. 1, obr. 3). Téměř nikdy sekundární glaukom nenastane za dobu trvání kortikosteroidní terapie kratší než 5 dní, zřídkakdy nastane za méně než 2 týdny. Je obvykle reverzibilní po přerušení léčby, pokud nebyl lék používán déle než jeden rok. K dalším lokálním nežádoucím účinkům patří exacerbace bakteriálních a virových infekcí, méně často přechodný oční diskomfort, atrofie víček, blefaroptóza (způsobena inhibicí sympatické inervace), ztenčení skléry, depozita kalcia v rohovce, zpomalené hojení epitelu rohovky, protenčení až lýza („melting“) rohovky, mydriáza (zvětšení pupilárního diametru přibližně o 1 mm), vzácně výskyt centrální serózní chorioretinopatie (CSCHR). Kortikosteroidy maskují typické klinické známky plísňových a virových nemocí [4, 10].
Tab. 1. Sekundární glaukom – vliv jednotlivých lokálních preparátů na zvýšení nitroočního tlaku 
Zdroj: www.google.com Obr. 3. Lokální kortikosteroidy – srovnání účinku 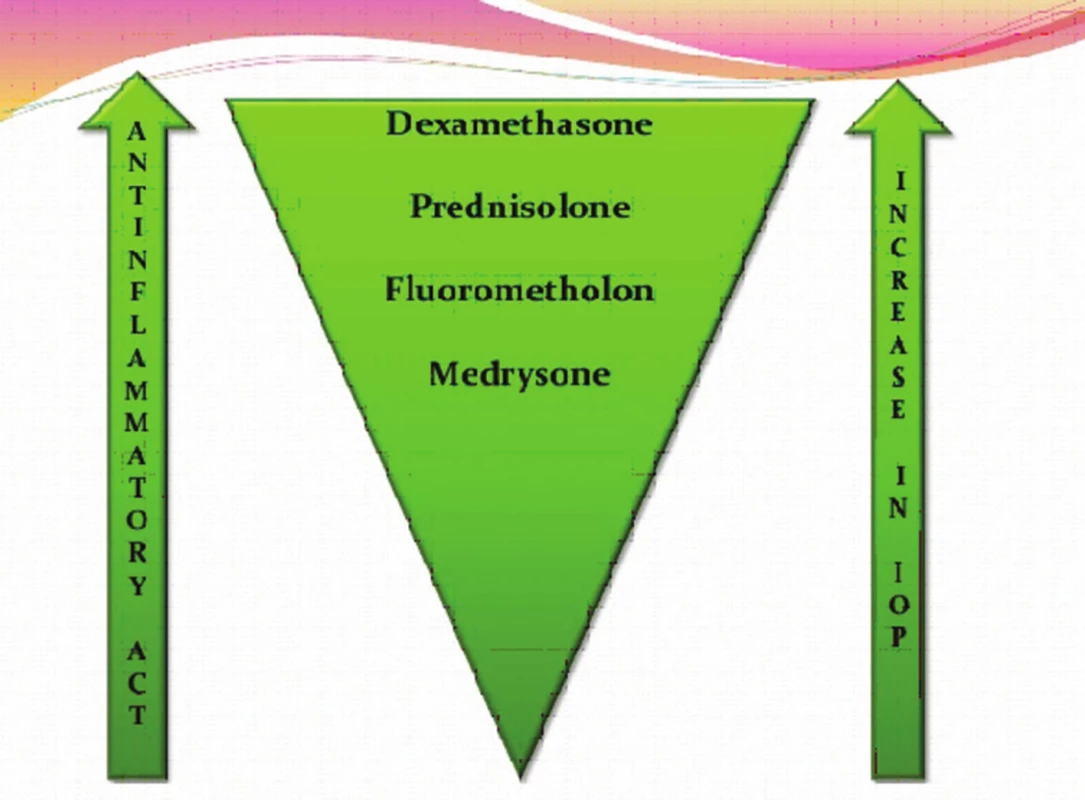
Zdroj: [9] Při dlouhodobém systémovém podání vysokých dávek kortikosteroidů dojde k supresi kůry nadledvinek pro potlačení sekrece adrenokortikotropního hormonu (ACTH). Mechanismem negativní zpětné vazby na osu hypothalamus – adenohypofýza – nadledvinky dojde k utlumení její funkce, a to jak při použití velké dávky na několik dní, tak menší dávky po více než 2 týdny. Dávky glukokortikoidů se musí proto snižovat vždy plynule a opatrně, rychlost ukončení terapie závisí na délce předchozí terapie a na použité dávce. Nikdy nesmí dojít k rychlému vysazení léčby pro nebezpečí vzniku adrenokortikální nedostatečnosti. Při léčbě musíme vždy začít velkou dávkou, kterou poté postupně redukujeme, přičemž dávka má být tak nízká, jak jen to je možné, aby se zabránilo závažným celkovým vedlejším účinkům. Při celkové perorální terapii musí být největší část denní dávky užita ráno, zbytek v poledne a večer se neužívá nic. Vysoké dávky je nutno ponechat tak dlouho, dokud je vidět efekt léčby, poté několik týdnů pomalu vysazovat, aby se zabránilo reaktivaci či recidivě onemocnění, a abychom dali nadledvinkám čas k zotavení k návratu své obvyklé sekrece. Obvyklý případ selhání léčby je z důvodu neoptimálního dávkování [4, 9, 10].
Celkové kortikosteroidy. V praxi se používá velmi široká řada léčiv ze skupiny kortikosteroidů, jejichž použití je závislé na převažujícím mechanismu účinku jednotlivých látek. Přehled celkových kortikosteroidů je uveden v tabulce (tab. 2).
Tab. 2. Celkové kortikosteroidy – přehled 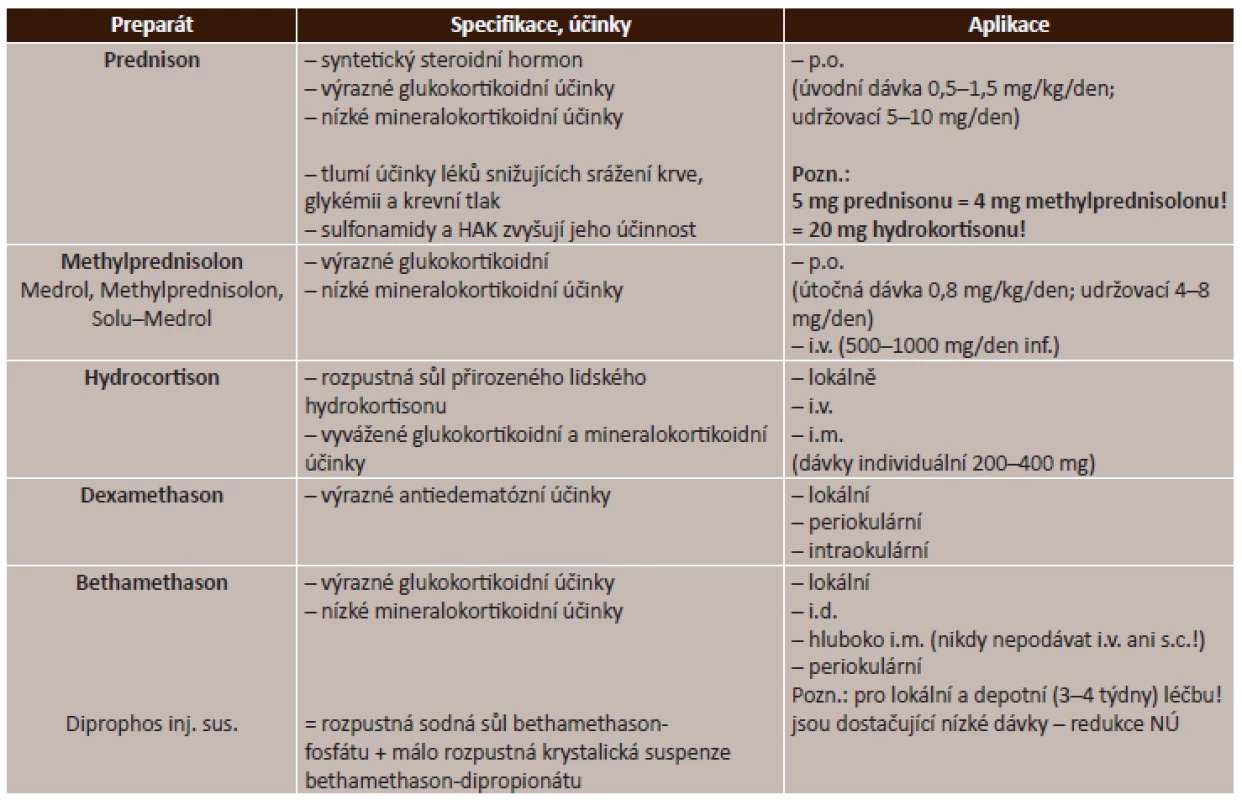
Zdroj: www.aislp.cz (AISPL – automatizovaný informační systém léčivých přípravků) Lokální kortikosteroidy. Lokální aplikace kortikosteroidů je účinná u zánětů předního segmentu, nedosáhne však dostatečných terapeutických hladin u zánětů sklivce, sítnice či cévnatky, proto je u zánětů zadního segmentu potencován účinek podáváním periokulárně a celkově. Podrobný přehled lokálních kortikosteroidů uvádí tabulka (tab. 3).
Tab. 3. Lokální kortikosteroidy – přehled 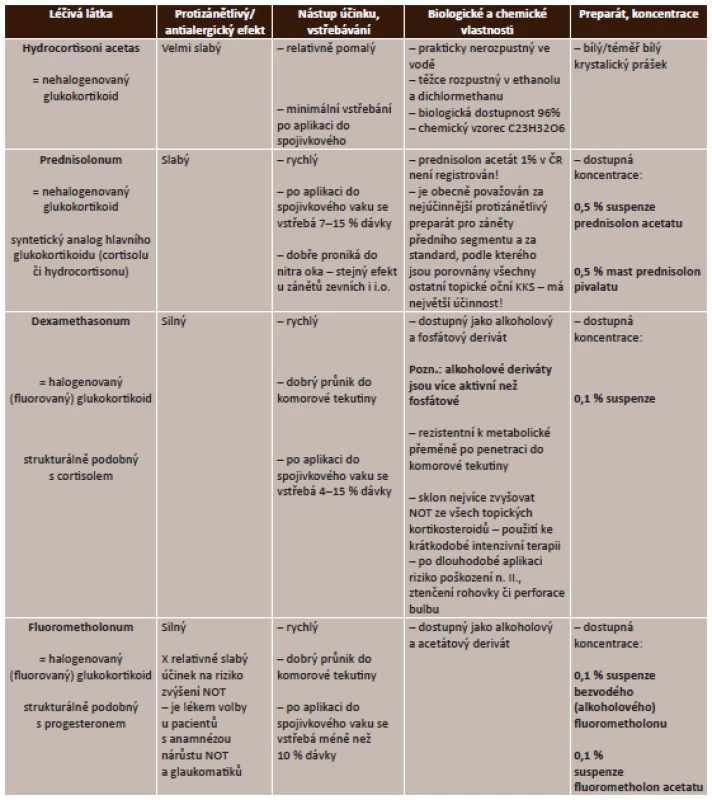
Zdroj: www.aislp.cz (AISPL – automatizovaný informační systém léčivých přípravků) Účinek lokálních kortikosteroidů se v magistraliter léčivých přípravcích kombinují s antibiotickým účinkem, a to jak bakteriostatickým, který zastavuje množení bakterií, tak baktericidním účinkem, který bakterie usmrcuje. Tyto lokální kombinované přípravky jsou ve formě mastí, suspenzí či roztoků. Přehled kombinovaných korkosteroidů uvádí tabulka (tab. 4).
Tab. 4. Lokální kombinované kortikosteroidy s antibiotikem – přehled 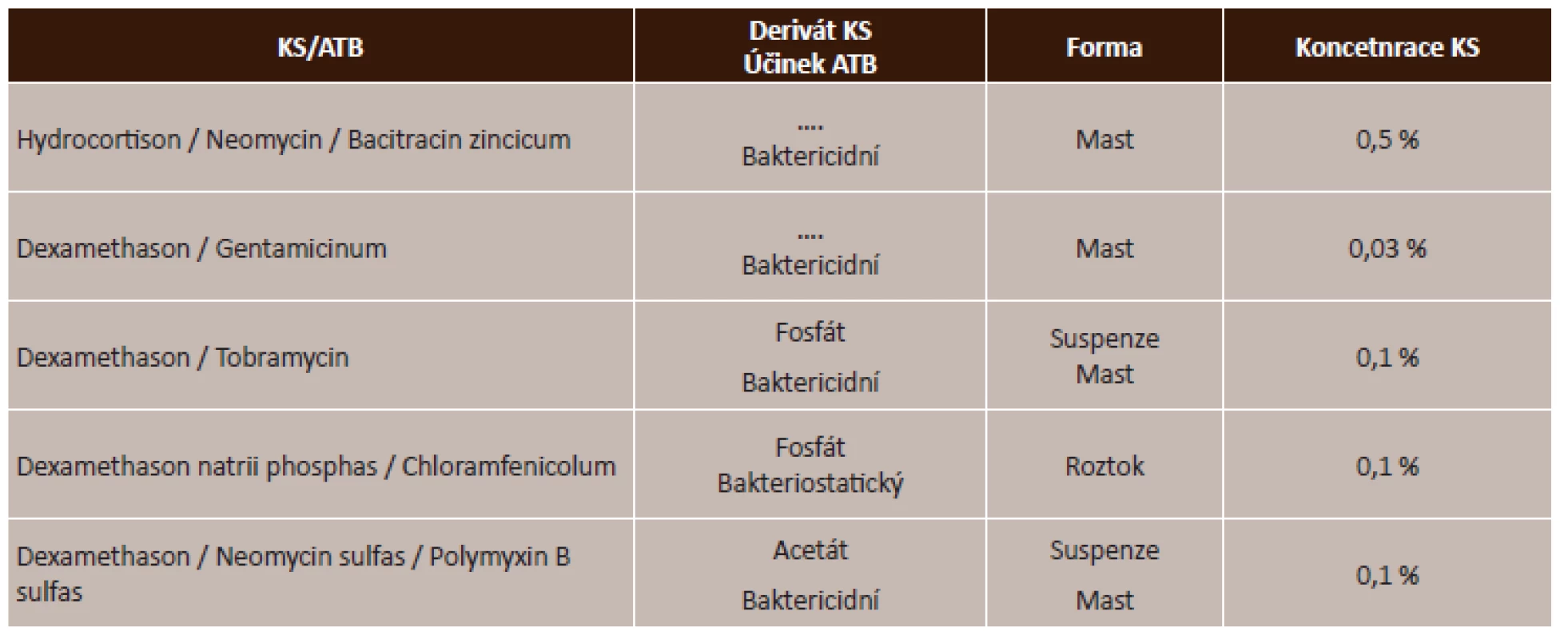
Zdroj: www.aislp.cz (AISPL – automatizovaný informační systém léčivých přípravků) Biologická dostupnost topických kortikosteroidů: Biologická dostupnost je definována jako podíl nezměněného léku, který dosáhne systémové cirkulace. Závisí na schopnosti pronikat rohovkou. Penetrace závisí na typu léčiva a způsobu podání. Znalosti penetrace jsou získané z pokusů na zdravých tkání a data jsou dohledatelné v literatuře [9].
Ideální steroid v oftalmologii by měl mít tzv. dvoufázovou rozpustnost:
- rozpustný v lipidových (hydrofobních) vrstvách epitelu a endotelu.
- rozpustný ve vodných (hydrofilních) vrstvách stromatu.
Deriváty acetátu a alkoholu jsou více lipofilní neboli rozpustné v tucích. Naopak deriváty fosforečnanu sodného a hydrochloridu jsou více hydrofilní neboli lépe rozpustné ve vodě.
V neporušeném epitelu je větší penetrace lipofilních molekul (deriváty acetátu a alkoholu). Na druhé straně v porušeném epitelu je větší penetrace fosfátů (hydrofilních derivátů). Z toho plyne, že v potlačování zánětu rohovky jsou efektivnější deriváty alkoholu a acetátu nežli fosfátové deriváty, a to jak v přítomnosti, tak i nepřítomnosti epitelu rohovky [9].
Při indikaci topických kortikosteroidů je důležitá skutečnost, zda je epitel rohovky intaktní či nikoliv. Při intaktní epitelu aplikujeme kortikosteroidy ve formě očních kapek či mastí, při narušeném epitelu je nutná aplikace periokulární (parabulbární injekce), vzhledem k jejich schopnosti inhibice reepitelizace rohovky.
Management použití kortikosteroidů je uveden v tabulce (tab. 5).
Tab. 5. Kortikosteroidy – management použití 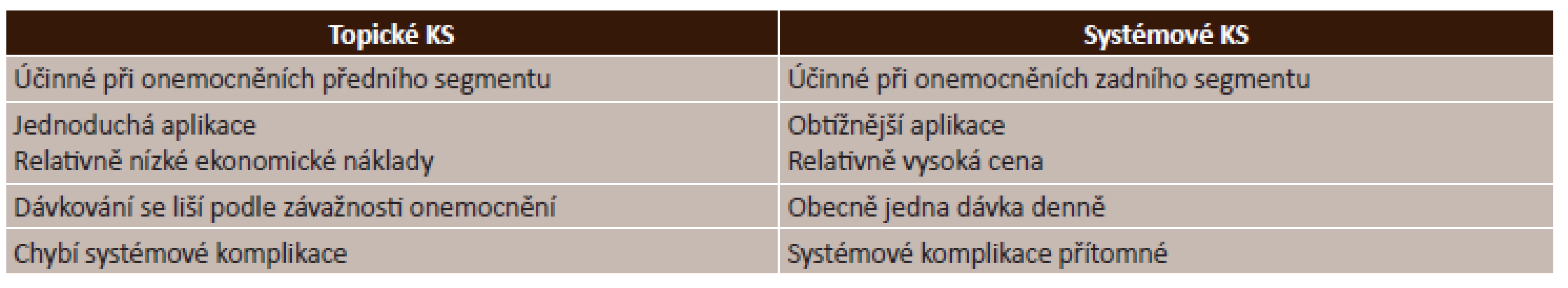
Zdroj: [9] Kortikosteroidy jsou velkým přínosem v léčbě mnoha typů očních onemocnění. Detailní přehled indikací lokálních i systémových kortikosteroidů v léčbě očních onemocnění nám uvádí tabulka (tab. 6).
Tab. 6. Kortikosteroidy – indikace 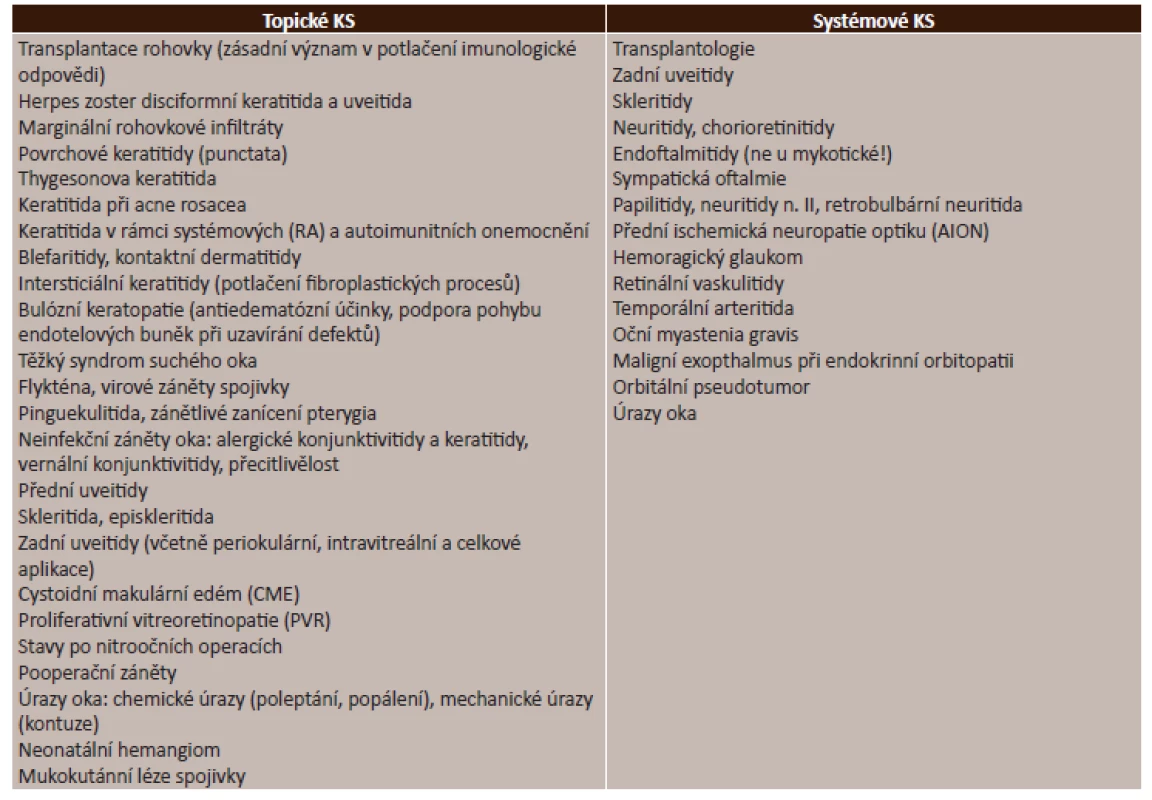
Zdroj: [2, 9] K očním kontraindikacím (dále jen KI) řadíme bakteriální konjunktivitidy, bakteriální keratitidy a rohovkové vředy (v iniciální fázi onemocnění, naopak v procesu hojení mají kortikosteroidy nepostradatelný vliv), herpetické keratitidy (při užití kortikosteroidů hrozí perforace rohovky). Mezi relativní oční KI patří glaukom. Mezi celkové KI řadíme chronické renální selhání, městnavé srdeční selhání, systémovou hypertenzi, infekční onemocnění, diabetes mellitus, peptický vřed, osteoporózu a psychózy [2, 9].
DISKUSE
Přínos
Díky nespecifickým imunosupresivním účinkům mají kortikosteroidy významné a nezastupitelné postavení v transplantologii rohovky. Vzhledem k nespecifickému protizánětlivému účinku, a tedy potlačení komplexní zánětlivé kaskády zaujímají významné místo v terapii chemických poraněních, neinfekčních a alergických zánětů, celé řady autoimunitních a systémových chorob.
Topické steroidy redukují počet zánětlivých buněk (leukocytů) v infiltrovaném stromatu rohovky, a tak napomáhají procesu reepitelizace. Pokud se předčasně a nevhodně ukončí terapie kortikosteroidy, buňky imunitního systému proliferují, nezralé buňky produkují velké množství protilátek proti reziduálním antigenům v oční tkáni a na výslednou reakci antigenu-protilátky (Ag-PL) navazuje masivní polymorfonukleární leukocytární reakce. Pokud není tento sled událostí okamžitě přerušen, může vést k opakujícím se a vážným nekrotizujícím zánětům. Proto by i topická terapie kortikosteroidy v závislosti na odpovědi a použitých dávkách měla být pomalu snižována v průběhu několika dnů až týdnů. Kortikosteroidy hrají důležitou úlohu při chemickém poranění rohovky proto, že inhibují produkci kolagenázy a snižují tak syntézu kolagenu, což vede ke zpomalení rozvoje nekontrolovatelného a často velmi závažného jizvení. Zabraňují vzniku trvalých jizev. Kortikosteroidy zpomalují hojení ran zpomalením migrace buněk a přestavbou cytoskeletu epiteliálních buněk [9].
Léčba glukokortikoidy zlepšuje organizaci těsných spojů (tigh-junctions) proteinů epitelu a zvyšuje epiteliální bariérovou funkci rohovky. Studiemi je dokázáno, že buňky rohovkového epitelu exprimují funkční glukokortikoidní receptor (GR), který je po lokální aplikaci dexamethasonu významně regulován již po 6 hodinách léčby. Dochází k remodelaci cystoskeletu, snížení propustnosti epitelu, zvýšené proliferaci buněk, ale i k indukované apoptóze u kultivovaných rohovkových epiteliálních buněk v jakékoliv použité koncentraci. Buňky epitelu rohovky proliferují v reakci na stimulaci dexamethasonem. Glukokortikoidy mění expresi genů rohovkového epitelu a ovlivňují tak hojení ran a bariérové funkce buněk epitelu [1].
V dalším experimentu, o kterém se můžeme dočíst v literatuře [2] je prokázáno, že při in vitro poranění rohovky kortizon inhibuje formování fibrózních sraženin, buněčnou infiltraci a regeneraci endotelu. Ashton a Cook (1951) dokázali zabránit hojení rohovky dosti velkými dávkami kortikosteroidů. Cook a Mac-Donald (1951) ukázali, že kortizon snižuje zvýšenou propustnost očních kapilár při zánětu, a potvrdili, že kortizon nemá vliv na permeabilitu zdravých cév. Po vysazení léčby se propustnost opět zvyšuje [2].
Nesmíme zapomínat na fakt, že kortikosteroidy můžeme používat lokálně při intaktním epitelu, naopak při narušeném epitelu vhodné nejsou (výjimka je u těžkých poleptání a traumat).
Při neúspěchu terapie je lepší zvyšovat koncentrace léku nežli zvyšovat počet dávek.
Kontraproduktivita
Kortikosteroidy inhibují reepitelizaci rohovky, proto se nesmí lokálně podat při lézích epitelu. Dále, jak již bylo zmíněno, inhibují syntézu kolagenu, což může způsobit při nekontrolovatelné a neuvážené aplikaci lýzu rohovky (u perforující keratoplastiky až tzv. „odplavání“ transplantátu). Kortikosteroidy maskují klinické známky nemoci z důvodu potlačení projevů zánětu, proto je nutná velká obezřetnost jejich použití v iniciálních fázích zánětu, nevíme-li etiologické agens. Kortikosteroidy podporují invazi saprofytických organismů. Inhibují chemotaxi a funkce fagocytů, blokují degranulaci a snižují produkci fagocytů. Potencují plísňová onemocnění a fungální vředy. Herpes virům usnadňují průnik rohovkou a podporují jejich replikaci. U adenovirových zánětů prodlužují infekciozitu pacienta, přičemž délku trvání zánětu nezkracují. Tam, kde neočekáváme, že terapeutický přínos léčby významně nepřevýší rizika podávání, bychom kortikosteroidy podávat neměli.
ZÁVĚR
Terapie kortikosteroidy je velkým přínosem u mnoha typů očních onemocnění, používají se v léčbě zánětlivých a imunologických onemocnění oka. Vykazují silné protizánětlivé účinky, neboť přímo zasahují do zánětlivé a koagulační kaskády. Protizánětlivý a imunosupresivní účinek kortikosteroidů je nespecifický a je dán lymfolytickým působením, inhibicí tvorby prostaglandinů a leukotrienů a útlumem produkce interleukinu 2 a dalších cytokinů.
Nebezpečí steroidů jsou široce uznávána, ať už se jedná o oční nežádoucí účinky ve formě katarakty či steroidního glaukomu, tak i o celkové nežádoucí účinky léčby. Ač kortikosteroidy patří napříč medicínou k jedněm z nejčastěji předepisovaným lékům vůbec, vždy je třeba velmi obezřetně indikovat léčbu jakýmkoliv kortikosteroidním preparátem a před jeho podáním vyloučit všechny infekční choroby, odebrat důkladnou anamnézu a pečlivě vyšetřit pacienta. Neuvážlivá preskripce kortikosteroidů může pozměnit klinický obraz, zkomplikovat diagnosticko-terapeutickou rozvahu a často prodloužit či zkomplikovat léčbu pacienta. Obecně by se kortikosteroidy neměly používat tam, kde terapeutický přínos významně nepřevýší rizika podávání. Naopak správně a včas indikovaná terapie kortikosteroidy, správná léková forma, dávka, frekvence, síla a typ preparátu, zabraňuje ztrátě zrakových funkcí a pacienta navrací do plnohodnotného života.
Kortikosteroidy hrají nezastupitelnou úlohu v celé řadě rohovkových afekcí a v transplantologii.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Do redakce doručeno dne 16. 2. 2017
Do tisku přijato dne 6. 6. 2017
MUDr. Markéta Zemanová
Oční klinika FN a LF MU Brno
Jihlavská 20
625 00 Brno
e-mail: marketa.zemanova@fnbrno.cz
Zdroje
1. Bourcier, T., Forgez, P., Borderie, V. et al.: Regulation of Human Corneal Epithelial Cell Proliferation and Apoptosis by Dexamethasone. Invest. Ophthalmol Vis Sci, 2000, 41(13): 4133–4141.
2. Dinning, W. J.: Steroids and the eye – indications and complications. Postgrad Med J 1976 Oct; 52(612): 634–638.
3. Dua, H. S., Faraj, L. A., Said, D. G. et al.: Human corneal anatomy redefined: a novel pre-Descemet’s layer (Dua’s layer). Ophthalmology, 2013, 120(9): 1778–1785.
4. Jirásková, N.: Přehled léčby zánětů oka. In Rozsíval, P. (Ed), Infekce oka, Praha: Grada Publishing a.s., 2003, s. 65–67.
5. Kadmiel, M., Janoshazi, A., Xu, X. et al.: Glucocorticoid action in human corneal epithelial cells establishes roles for corticosteroids in wound healing and barrier function of the eye. Exp Eye Res. 2016 Nov, 152 : 10–33. doi: 10.1016/j.exer.2016.08.020.
6. Kanski, J.J.: Clinical Ophthalmology: A systematic Approach / Edition 6. Edinburgh: Butterworth-Heinemann/Elsevier, 2007, p. 250
7. Kuchynka, P. a kol.: Oční lékařství. 2. doplněné a přepracované vydání. Praha: Grada Publishing a.s., 2016. s. 283–285.
8. Słoniecka, M., Le Roux, S., Zhou, Q. et al.: Substance P enhances keratocyte migration and neutrophil recruitment through interleukin-8. Mol Pharmacol. 2016 Feb, 89(2): 215-225. doi: 10.1124/mol.115.101014.
9. Suraj, Ch.: Ocular steroid. 16th batch [online]. 2015. [cit. 2016-11-7]. Dostupné na: http://www.slideshare.net/surajkc5832/steroid-suraj.
10. Toušková, M., Jirásková, N.: Imunosuprese v oftalmologii. In Rozsíval, P. (Ed), Infekce oka, Praha: Grada Publishing a.s., 2003, s. 39–40.
11. Vlková, E., Hlinomazová, Z.: Riziková keratoplastika. Sborník prací lékařské fakulty 118. Masarykova Univerzita Brno, 1999, s. 18–20.
Štítky
Chirurgie maxilofaciální Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2017 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
-
Všechny články tohoto čísla
- Dvouleté zkušenosti s intravitreální léčbou makulárního edému ranibizumabem u pacientů s okluzí retinální vény
- Translaminárny gradient a glaukóm
- Hodnotenie intrakraniálneho tlaku oftalmológom
- Selektivní laserová trabekuloplastika – význam pro přerušení medikamentózní léčby glaukomu u těhotných a kojících žen
- Steroidní glaukom jako komplikace lokální léčby atopického ekzému
- Přínos a kontraproduktivita terapie kortikosteroidy u afekcí rohovky
- ŽIVOTNÍ JUBILEUM PROF. MUDr. ANTONA GERINCE, CSc.
-
Klinický konsensus pro refrakční chirurgii
Vypracovala Česká společnost refrakční a kataraktové chirurgie
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přínos a kontraproduktivita terapie kortikosteroidy u afekcí rohovky
- Steroidní glaukom jako komplikace lokální léčby atopického ekzému
- Hodnotenie intrakraniálneho tlaku oftalmológom
- Dvouleté zkušenosti s intravitreální léčbou makulárního edému ranibizumabem u pacientů s okluzí retinální vény
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




