-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Charakteristika souboru chlapců s Duchennovou a Beckerovou svalovou dystrofií – studie z jednoho nervosvalového centra
Characteristics of a cohort of boys with Duchenne and Becker muscular dystrophies – a study from a single neuromuscular centre
Aim: Description of natural course and variety of complications in Duchenne (DMD) and Becker (BMD) muscular dystrophies in childhood.
Patients and methods: Retrospective analysis of clinical and laboratory data with focus on muscular and extramuscular complications in 78 boys with dystrophinopathy (65 with DMD and 13 with BMD) followed up in our neuromuscular centre between 2004 and 2018.
Results: The incidence of secondary complications was negligible in boys with BMD. On the other hand, boys with DMD suffered from severe complications from their second decade of age. Overall 43 (66%) of the boys with DMD were treated with glucocorticoids. Glucocorticoid-treated boys lost ability to walk on average 1.3 years later than glucocorticoid-naive boys (P < 0.001). Moderate restrictive lung disease was diagnosed in 54% of boys with DMD older than 12 years of age, and loss of ability to walk was the most significant risk factor (P < 0.001). Decreased ejection fraction or myocardial fibrosis was found in 45% of boys older than 10 years of age. Boys with DMD had short stature in 40%, the incidence of which increased with age (P < 0.0001). Osteoporosis was diagnosed in 22% of boys with DMD, more often in the glucocorticoid-treated group than in glucocorticoid-naive group (P = 0.024). Transient proteinuria was described in 48% of boys with DMD. Psychological aberrations were described in 68% of boys with DMD.
Conclusion: This study describes the most extensive cohort of pediatric patients with dystrophinopathy in the Czech Republic and highlights the need of multidisciplinary care.
Keywords:
complications – osteoporosis – cardiomyopathy – Duchenne – Becker – multidisciplinary care – Proteinuria – muscular dystrophy – respiratory insufficiency
Autoři: M. Rohlenová 1; K. Machová 2; V. Stará 3; P. Hedvičáková 4; J. Zieg 3; T. Doušová 3; L. Fajkusová 5; J. Venclová-Žáčková 1; O. Souček 3
; J. Haberlová 1
Působiště autorů: Klinika dětské neurologie, 2. LF UK a FN Motol, Praha 1; UAM Czech Republic s. r. o., Praha 2; Pediatrická klinika, 2. LF UK a FN Motol, Praha 3; Ústav biologie a lékařské genetiky, 2. LF UK a FN Motol, Praha 4; Centrum molekulární biologie, a genové terapie, LF MU a FN Brno 5
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(3): 305-314
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2020305Souhrn
Cíl: Popis průběhu a komplikací Duchennovy (DMD) a Beckerovy (BMD) svalové dystrofie v dětském věku.
Soubor a metodika: Restrospektivní analýza klinických a laboratorních dat se zaměřením na svalové a mimosvalové komplikace 78 chlapců s dystrofinopatií (65 DMD a 13 BMD) sledovaných v našem nervosvalovém centru v letech 2004–2018.
Výsledky: Zatímco chlapci s BMD měli zanedbatelný výskyt sekundárních komplikací, chlapci s DMD byli ohroženi závažnými komplikacemi již od druhé dekády života. Celkem 43 (66 %) chlapců s DMD bylo léčeno kortikoidy. Chlapci léčení kortikoidy v průměru ztratili schopnost chůze o 1,3 roku později než chlapci neléčení (p < 0,001). U 54 % chlapců s DMD starších 12 let byla diagnostikována středně těžká restriktivní plicní porucha, nejvýznamnějším rizikovým faktorem byla ztráta schopnosti chůze (p < 0,001). Sníženou ejekční frakci či fibrózu myokardu mělo 45 % chlapců starších 10 let. Chlapci s DMD měli ve 40 % malý vzrůst, jehož výskyt stoupal s věkem (p < 0,0001). Osteoporóza byla diagnostikována u 22 % chlapců s DMD, častěji u léčených kortikoidy než u neléčených (p = 0,024). Tranzientní proteinurie v biochemickém vyšetření moči byla u 48 % chlapců s DMD. Psychologické odchylky mělo 68 % chlapců s DMD.
Závěr: Tato studie vychází z dosud nejrozsáhlejšího souboru dětských pacientů s dystrofinopatií v ČR a zdůrazňuje potřebu multioborového přístupu v péči o ně.
Klíčová slova:
Duchenne – Becker – komplikace – multioborový přístup – osteoporóza – kardiomyopatie – proteinurie – svalová dystrofie – respirační insuficience
Úvod
Dystrofinopatie typu Duchenne/Becker (DMD/BMD) jsou nejčastější vrozená onemocnění svalů v dětském věku postihující zhruba 1 : 3 000–5 000 živě rozených chlapců u DMD a 1 : 18 000 chlapců u mírnější formy BMD. Jsou způsobeny mutacemi v genu pro strukturální protein dystrofin lokalizovaném na krátkém raménku X chromozomu, proto onemocnění typicky postihuje mužské pohlaví. Kromě svalové slabosti se u vrozených dystrofinopatií vyskytuje také řada komplikací [1–3]. U DMD je nejzávažnější rozvoj respirační insuficience a dilatační kardiomyopatie, které bývají nejčastějšími příčinami úmrtí (u 40, resp. 30 % jedinců) [4]. Postižen je i skelet, kde vídáme komplikace ortopedické (tj. kontraktury, skolióza) [2] a endokrinologické (tj. porucha růstu, opoždění puberty, sekundární osteoporóza) [1,2], na nichž se vedle vlastního onemocnění podílejí i vedlejší účinky jinak prospěšné terapie kortikoidy [5,6]. Časté jsou též nefrologické odchylky (v dětském věku především asymptomatická proteinurie často popisovaná v klinických studiích testujících terapii exon skippingem či myoglobinurie/hemoglobinurie) [7] a poruchy kognice a chování [3].
U BMD jsou v dětském věku komplikace spíše vzácné, nejzávažnější je riziko srdečního postižení, které se může rozvinout i při zachované svalové síle [8]. Proto je důležitá multioborová péče zahrnující časnou prevenci a léčbu komplikací, a to jak v dětském, tak i v dospělém věku.
Typ DMD se dnes standardně léčí glukokortikoidy, které prokazatelně zpomalují degeneraci a fibrotizaci svalů a oddalují ztrátu schopnosti chůze v průměru o 1–3 roky [1–3], stabilizují plicní funkce [9] a pravděpodobně oddalují i projevy kardiomyopatie [10]. Přesto má terapie i významné nežádoucí účinky. V roce 2018 byla revidována a rozšířena doporučení pro péči o pacienty s DMD (prvně publikovaná v roce 2010), která kladou důraz zejména na multioborovou péči ve specializovaných centrech [1–3]. Cílem této práce je, i s ohledem na tato nová doporučení, popsat současný průběh onemocnění a výskyt jeho komplikací u chlapců s dystrofinopatií sledovaných v našem centru.
Soubor a metodika
Zařazeni byli všichni chlapci s dystrofinopatií pravidelně sledovaní v našem centru. Dle klinického průběhu byli chlapci rozděleni na BMD či DMD. U všech byla diagnóza dystrofinopatie potvrzena geneticky, patologické varianty byly rozděleny dle typu (delece či duplikace celých exonů, mutace malého rozsahu, bodové mutace) a dle jejich efektu při translaci (nonsense mutace, mutace s posunem či bez posunu čtecího rámce a intronové mutace ovlivňující sestřih).
Ze zdravotnické dokumentace z let 2004–2018 byly retrospektivně zaznamenány a analyzovány údaje o věku ztráty schopnosti chůze, výskytu a léčbě komplikací kardiologických, pneumologických, endokrinologických, psychologických a nefrologických, které byly vyhledávány pravidelným vyšetřením dle platných doporučení v dané době [1–3,11]. Údaje nebyly vždy kompletní, systematický skríning byl postupně zaváděn zhruba od roku 2012 a ke konci sledovaného období zahrnoval:
- Vyšetření kardiologem u všech pacientů (BMD i DMD) po 1 roce vč. elektrokardiografie (EKG), echokardiografie (ECHO) a nad 10 let MR myokardu. Případná kardiologická léčba (inhibitory angiotensin konvertujícího enzymu [angiotensin-converting enzyme inhibitors; ACEI]) byla indikována při poklesu ejekční frakce (EF) pod 55 %, při záchytu fibrózy na MR či v posledních letech byla dle závěrů nových studií [12,13] rodinám nabízena i preventivně u chlapců starších 10 let. Další vyšetření či léčba byly indikovány eventuálně dle potřeby kardiologem (vyšetření holterovskou EKG, nasazení beta blokátorů či antiarytmik).
- Spirometrické vyšetření v intervalech dle stadia nemoci a platných doporučení [1–3]. Při poklesu funkční vitální kapacity (forced vital capacity; FVC) pod 60 % náležité hodnoty či při subjektivně udávané ranní únavě, nočním buzení či dušnosti nebo při častých respiračních infektech bylo indikováno komplexní vyšetření pneumologem ke zvážení zahájení mechanické insuflace/exsuflace (asistent kašle) či neinvazivní dechové podpory.
- Pravidelné měření tělesné výšky a hmotnosti, u chlapců na kortikoterapii či starších 12 let 1× ročně a u ostatních dle klinického uvážení 1× za 2 roky krevní odběry, boční RTG snímek hrudní a bederní páteře a duální rentgenová absorbometrie (dualenergy X-ray absorptiometry; DXA) pro stanovení Z-skóre kostní denzity bederní páteře (areal bone density; aBMD) a případná další vyšetření indikovaná endokrinologem.
- Po stanovení diagnózy bylo všem pacientům alespoň jedenkrát doporučeno vyšetření klinickým psychologem. Z uvedených bylo do studie zavzato u každého chlapce poslední dostupné vyšetření (FVC, psychologické, endokrinologické vyšetření), popřípadě věk objevení komplikace (pokles EF, záchyt fibrózy myokardu, nasazení léčby). Dále ze všech dostupných laboratorních vyšetření indikovaných během sledovaného období z různých příčin jsme analyzovali údaje o výši sérového myoglobinu a z biochemického vyšetření moči a vyšetření močového sedimentu jsme zaznamenali údaje o pozitivní peroxidázové reakci a o výskytu proteinurie.
Zaznamenali jsme také léčbu glukokortikoidy, vč. typu užívaného léku, důvodu případné změny, věku nasazení či případného vysazení. Do skupiny „léčených“ byli zařazeni všichni chlapci, kteří užívali glukokortikoidy minimálně po dobu 6 měsíců, ostatní tvořili skupinu „neléčení“. Standardní terapie kortikoidy u DMD byla během sledovaného období taktéž teprve postupně zaváděna, v současné době již je nabízena všem chlapcům v předškolním věku a po ztrátě chůze se nevysazuje. V indikovaných případech byla rodinám nabízena možnost účasti v klinických studiích experimentální léčby – exon skipping 45, 53 a 51.
Statistika
U spojitých proměnných byly pro popis souboru použity průměr a směrodatná odchylka, u kategoriálních kontingenční tabulka. Pro porovnání dvou skupin byl použit Welchův dvouvýběrový t test v případě spojitých proměnných a chí kvadrát test v případě kategoriálních proměnných. Fisherův test byl použit pro hodnoty menší než pět v kontingenční tabulce, logistická regrese byla použita pro vyhodnocení závislosti binární proměnné na jednom či více faktorech (statistická významnost hodnocena pomocí testu poměrem věrohodností), lineární regrese (s testem statistické významnosti F testem) pro spojité proměnné závislé na jednom či více faktorech a log-rankový test pro rozdíl rizik mezi dvěma skupinami. Testy byly provedeny na 5% hladině významnosti. Všechny analýzy byly provedeny v programu R, verze 3.4.3 (Microsoft, Redmont, WA, USA).
Výsledky
Klinická a genetická charakteristika souboru
V době analýzy bylo v našem centru sledováno celkem 78 chlapců s dystrofinopatií, z toho 13 s BMD a 65 s DMD. Popis souboru a nalezené patologické varianty detailněji shrnuje tab. 1.
Tab. 1. Stručná charakteristika našeho souboru – vidíme věkové rozložení, přehled terapie kortikoidy u DMD a přehled nejčastějších genetických patologických variant.
Věk pacientů počítán k 1. 10. 2018. U věku je uveden aritmetický průměr a směrodatná odchylka v letech. V závorce procentuální zastoupení pacientů z relevantní skupiny. U DMD v relevantních případech pacienti rozděleni na léčené a neléčené kortikoidy.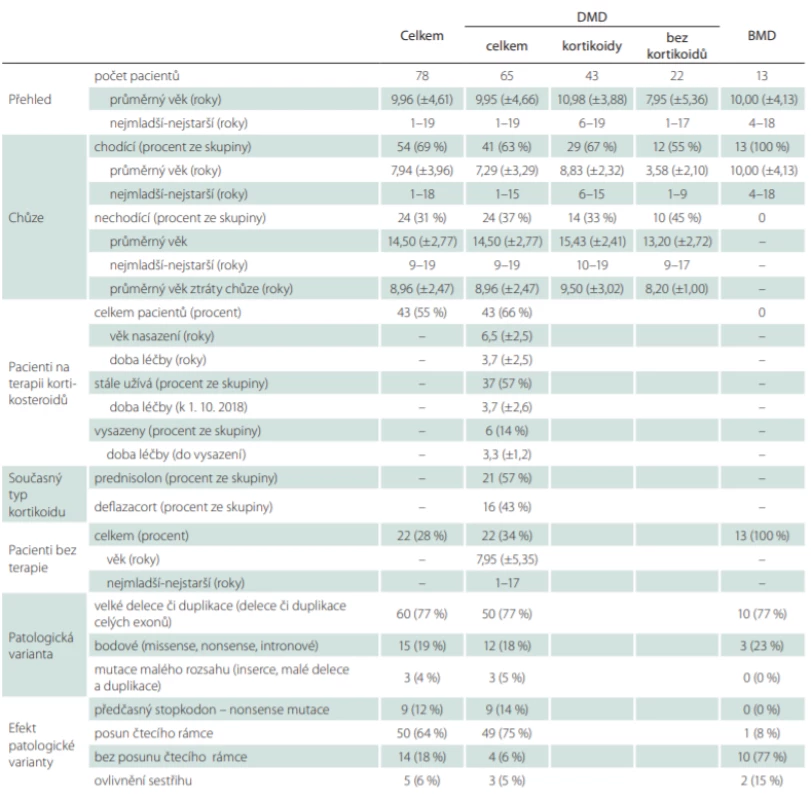
BMD – Beckerova muskulární dystrofi e; DMD – Duchennova muskulární dystrofie Všichni chlapci s BMD byli v době analýzy chodící a bez kortikoterapie. Celkem 43 (66 %) chlapců s DMD bylo léčeno kortikoidy, z toho 6 byla léčba vysazena na přání rodiny po ztrátě schopnosti chůze, v průměru po 3,3 ± 1,0 letech (tab. 1). Deflazakortem bylo léčeno celkem 16 chlapců s DMD, u 14 z nich byl indikován jako druhá volba pro nadměrný přírůstek hmotnosti na předchozí léčbě prednizolonem, u dalších 2 chlapců byl deflazakort nasazen jako první volba (u obou až po ztrátě schopnosti chůze). Ostatních 27 chlapců s DMD bylo léčeno prednizolonem. Experimentální léčba exon skipping byla podána celkem 5 chlapcům.
Celkem 24 (40 %) chlapců s DMD již v době analýzy ztratilo schopnost samostatné chůze, průměrný věk ztráty samostatné chůze byl 9 roků. Chlapci na kortikoterapii v průměru ztratili schopnost chůze o 1,3 roku později než chlapci bez kortikoterapie (p < 0,001) (obr. 1).
Obr. 1. Kaplan-Meierova křivka ukazuje závislost věku ztráty schopnosti chůze na léčbě kortikoidy. Chlapci léčení (žlutě) jsou v průměru schopni samostatné chůze déle než chlapci neléčení (modře); (log-rank test; p < 0,001). Cenzorovaní byli pacienti, kteří schopnost chůze v době analýzy neztratili.
Fig. 1. Kaplan-Meier curve showing the dependency of loss of ability to walk on the therapy with of glucocorticoids. On average, the glucocorticoid-treated boys (yellow) were capable of independent walk longer then glucocorticoid-naive boys (blue); (log-rank test; P < 0.001). The patients who had not lost ability to walk by the time of the analysis were censored.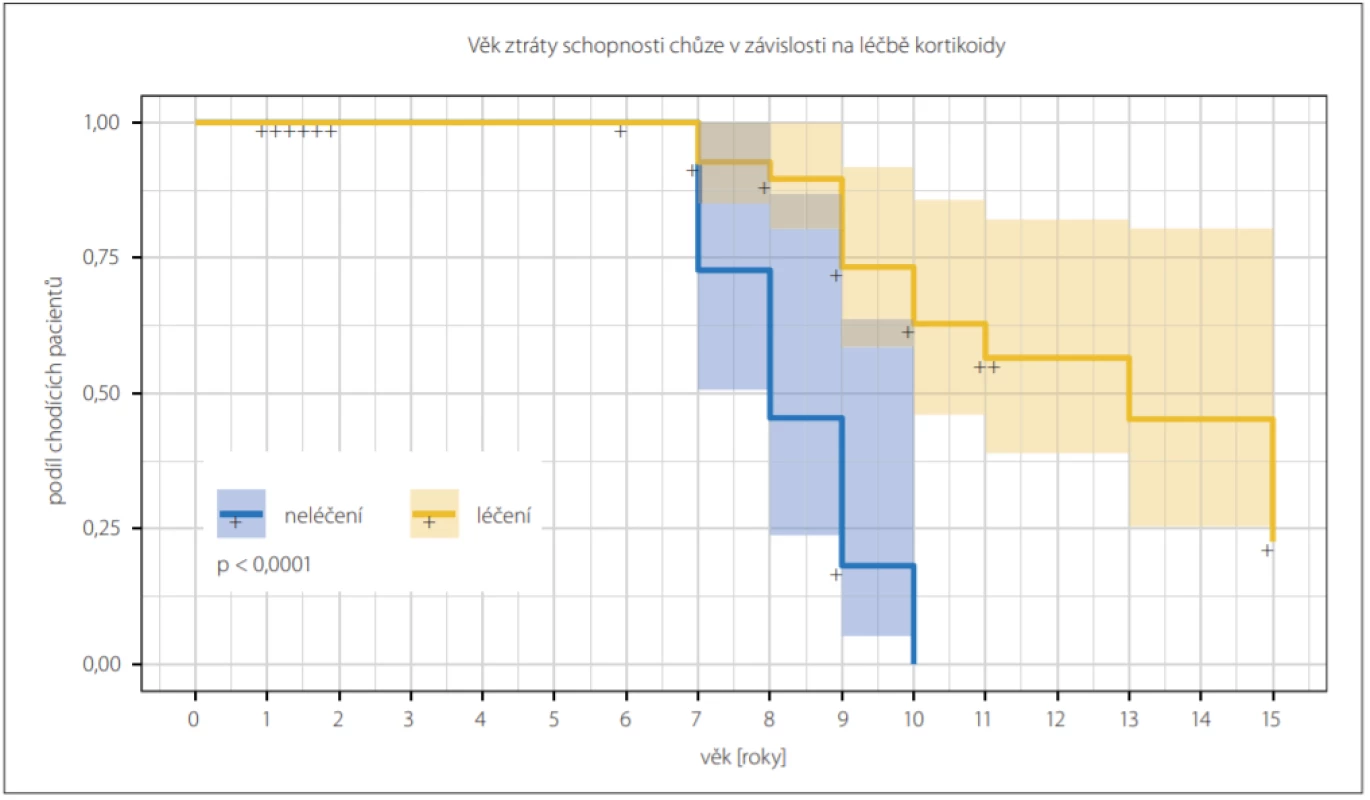
Pneumologické komplikace
Průměrný pokles náležité hodnoty FVC byl 4,3 % za rok (p < 0,001) (obr. 2A). Chlapci na kortikoterapii měli náležitou hodnotu FVC v průměru o 32,6 ± 11,5 % vyšší než chlapci bez kortikoterapie (léčení 76,8 ± 26,7 % vs. neléčení 44,2 ± 17,9 %; p = 0,008). Ztráta schopnosti chůze byla nejvýznamnějším rizikovým faktorem restriktivní plicní poruchy v porovnání s věkem i užíváním kortikoidů (mnohočetná lineární regrese, F test; p = 0,96, resp. 0,18) (tab. 2B, obr. 2B). Středně těžkou restriktivní poruchu plic (FVC < 60 %) mělo 54 % všech DMD chlapců starších 12 let. Neinvazivní dechovou podporu vyžadovali dva chlapci (oba od 14 let věku), kašlací asistent mělo pět chlapců (v průměru od 16,0 ± 0,9 let věku).
Obr. 2. (A) Závislost náležité hodnoty FVC na věku u chlapců s Duchennovou muskulární dystrofií. Přerušovaná čára značí dolní referenční mez FVC (80 % náležité hodnoty). Modře je znázorněn výsledek lineární regrese (střední hodnota a 95% konfidenční interval). Průměrná hodnota FVC je 70,4 (±29,5) %. Odhadovaný pokles FVC v souboru je 4,3 (±1,2) % za rok věku (lineární regrese, F test; p < 0,01). (B) Po rozdělení chlapců podle schopnosti chůze zmizela závislost FVC na věku (lineární regrese, F test; p = 0,96) a nechodící chlapci (n = 16, žlutě) měli FVC signifi kantně nižší než chlapci chodící (n = 20, modře), tj. 53,0 ± 0,2 %, resp. 94,0 ± 0,1 %; p < 0,001.
Fig. 2. (A) The dependency of the percent predicted value of FVC on age in Duchenne muscular dystrophy boys. The dashed line shows the lower reference value of the norm of FVC (80% of predicted value). Blue curve shows the result of linear regression (mean value and 95% confi dence interval). The mean value of FVC was 70.4 (±29.5) %. The estimated decrease of FVC in the cohort was 4.3 (±1.2) % per year of age (linear regression, F test; P < 0.01).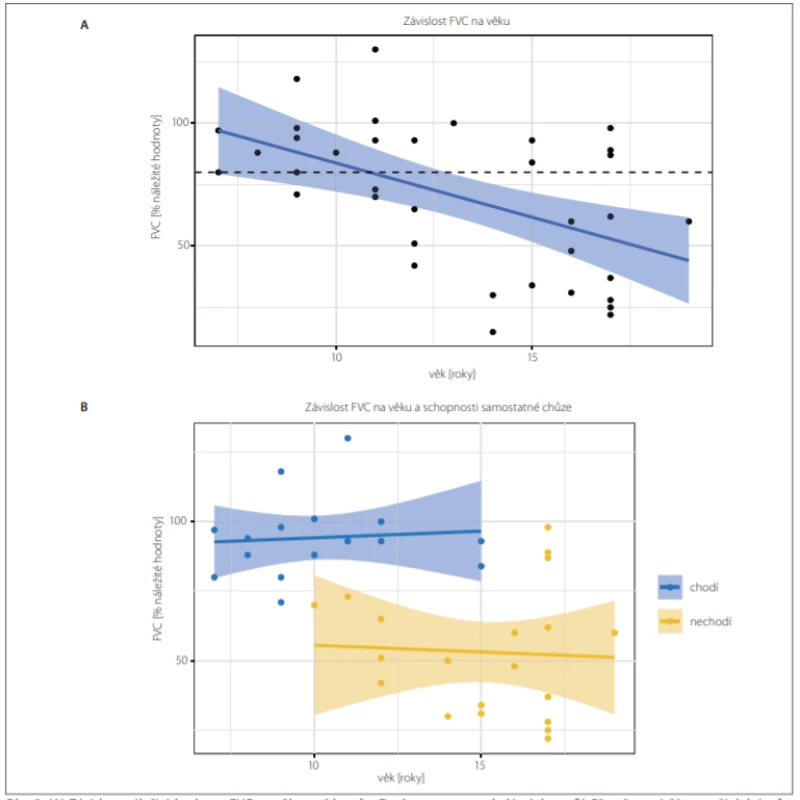
FVC – funkční vitální kapacita; n – počet
FVC – forced vital capacity; N – numberObr. 3. (A) Závislost Z-skóre výšky na věku u chlapců s DMD. Z-skóre klesá s věkem v průměru o 0,1 za rok (F test; p = 0,005). Přerušovaná čára znázorňuje dolní referenční mez. Modře je znázorněn výsledek lineární regrese (střední hodnota a 95% konfidenční interval). (B) Kaplan-Meierova křivka ukazuje podíl chlapců s malou výškou (Z-skóre < –2,0) vzhledem k věku. Chodící chlapci s DMD (modře) mají výskyt malé výšky časněji než chlapci nechodící (žlutě); (log-rank test; p < 0,001).
Fig. 3. (A) The dependency of Z-score of height on age in boys with DMD. Z-score is reduced by 0.1 per year of age on average (F test; P = 0.005). The dashed line shows the lower reference value for normal height. The result of linear regression is shown in blue (mean value and 95% confi dence interval). (B) Kaplan-Meier curve showing the occurence of small height (Z-score < –2.0) in dependancy on age. Small height occures sooner in walking boys with DMD (blue curve) than in non-walking boys with DMD (yellow curve); (log-rank test; P < 0.001).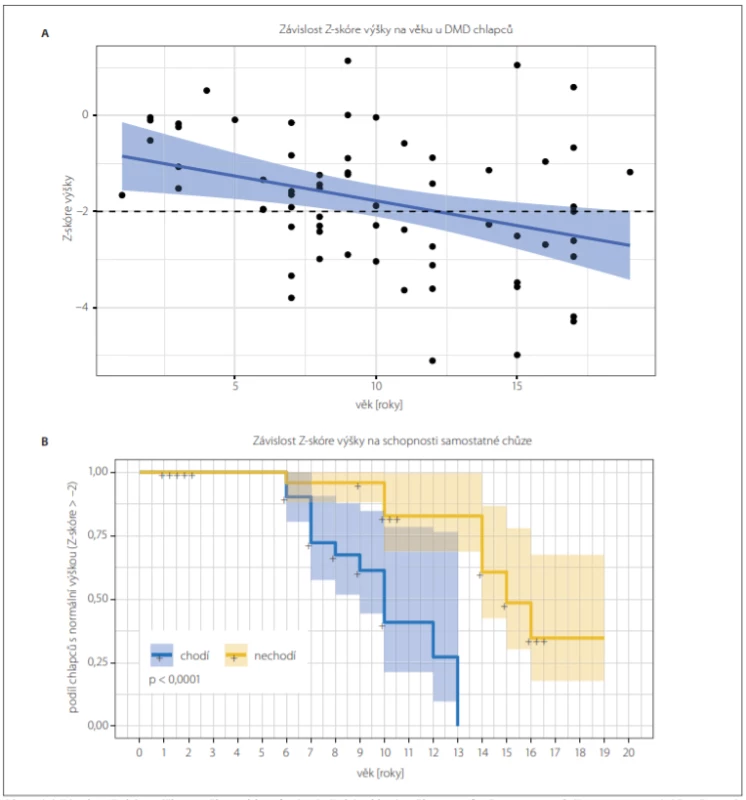
DMD – Duchennova muskulární dystrofie
DMD – Duchenne muscular dystrophyTab. 2. A. Počty vyšetřených jedinců a důvod chybějících dat v jednotlivých kategoriích skríningového protokolu pro záchyt komplikací.
Jako 100 % je brán počet 78 u vyšetření, která byla sledována u všech pacientů (BMD i DMD) či 65 u těch vyšetření, která byla hodnocena jen u DMD.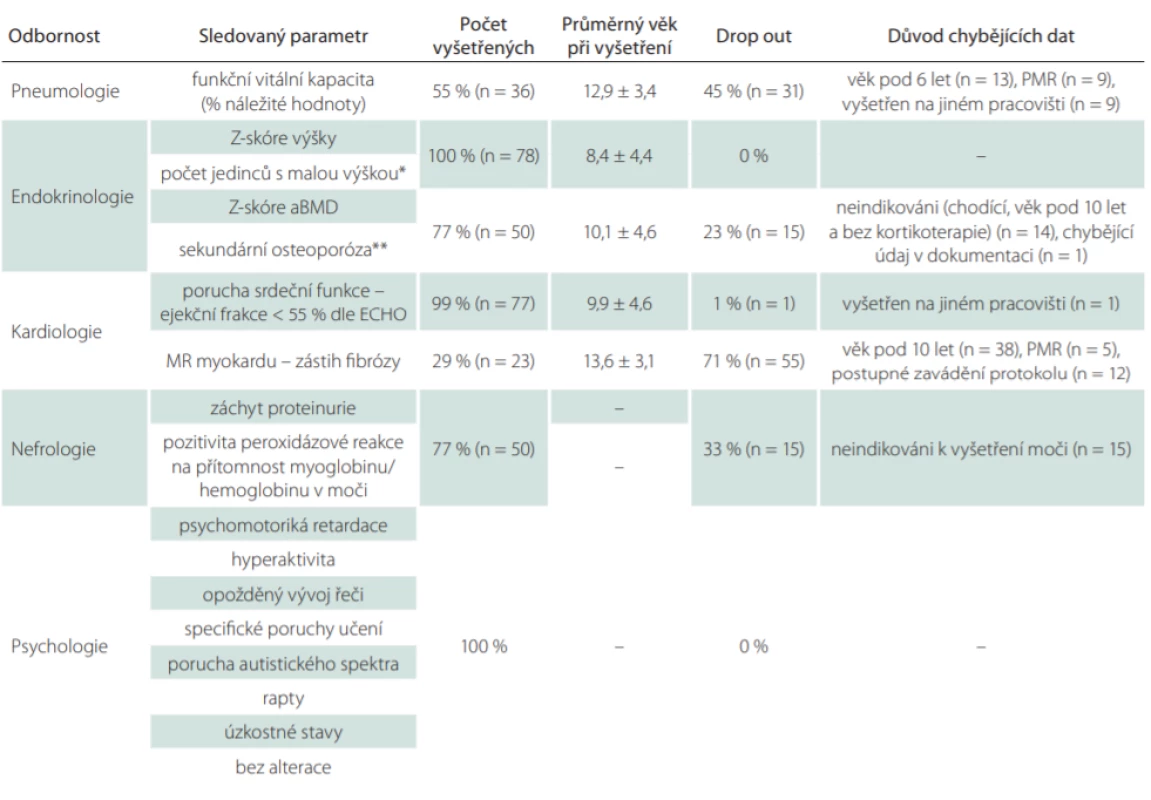
*definována jako Z-skóre výšky < –2,0; **defi nována jako Z-skóre aBMD < –2,0 a zároveň výskyt patologické fraktury
aBMD – kostní denzita bederní páteře; BMD – Beckerova muskulární dystrofi e; DMD – Duchennova muskulární dystrofie; ECHO – echokardiografi e; n – počet; PMR – psychomotorická retardaceKardiologické komplikace
Vzhledem k tomu, že i chlapci s BMD mají riziko srdečního postižení, byly kardiologické komplikace hodnoceny v celém našem souboru (BMD i DMD). Porucha srdeční funkce (definovaná jako EF < 55 %) byla zastižena u sedmi (9 %) pacientů, všichni měli diagnózu DMD a byli starší 10 let, průměrný věk při prvním záchytu byl 14,2 ± 3,0 let, fibróza myokardu dle MR byla zjistěna u 10 chlapců (tab. 2B). U 70 % (n = 7) chlapců se záchytem fibrózy myokardu na ECHO ještě nebyla patrná porucha srdeční funkce. Z chlapců starších 10 let jich mělo patologický kardiologický nález celkem 45 %. Terapie ACEI byla nasazena u 23 (29 %) chlapců, u devíti z nich preventivně. Průměrný věk zahájení léčby byl 15,0 ± 1,0 let, pouze jeden z těchto pacientů měl diagnózu BMD.
Tab. 2B. Výskyt komplikací dle jednotlivých odborností. Včetně statistického srovnání jednotlivých skupin (dle diagnózy a u DMD srovnání skupiny léčených a neléčených kortikosteroidy a chodící a nechodící). Výsledné p-hodnoty dvouvýběrového t-testu u spojitých proměnných a chí-kvadrát testu (pro více než 5 jedinců v jednotlivých kategoriích) či Fisherova exaktního testu (5 a méně jedinců v některé z kategorií) u kategoriálních proměnných. Tučně jsou zvýrazněny skupiny se signifi kantním rozdílem (p < 0,05). Uvedeny jsou průměrné hodnoty se směrodatnou odchylkou u vyšetření či počty jedinců v dané skupině vyjádřené jako procento z vyšetřených danou metodou. Skupiny „léčení“ a „neléčení“ rozděleni dle terapie kortikoidy. 
*defi nována jako Z-skóre výšky < –2,0; **definována jako Z-skóre aBMD < –2,0 a zároveń výskyt patologické fraktury
aBMD – kostní denzita bederní páteře; BMD – Beckerova muskulární dystrofi e; DMD – Duchennova muskulární dystrofi e; ECHO – echokardiografi e; n – početEndokrinologické komplikace
Zatímco chlapci s BMD měli normální výšku (průměrné Z-skóre výšky –0,1 ± 1,1), chlapci s DMD byli významně nižší v porovnání s populační normou (Z-skóre –1,8 ± 1,4; p < 0,0001). Kortikoidy léčení chlapci měli výskyt malé výšky 4,7× vyšší než chlapci neléčení (p = 0,02) (tab. 2B). Výskyt nízkého vzrůstu stoupal s věkem (pokles Z-skóre o 0,1 za rok; p = 0,005) (obr. 3A), a to více u chodících chlapců než u chlapců nechodících (beta koeficient –2,26 ± 0,10, log-rankový test; p < 0,001) (obr. 3B).
Průměrná kostní denzita (aBMD) bederní páteře vyšetřená pomocí DXA byla u chlapců s DMD významně snížená oproti normě (Z-skóre –1,4 ± 0.9; p < 0,0001). Klinicky významnou anamnézu zlomenin (definovanou podle Mezinárodní společnosti klinické denzitometrie [14]) mělo 15 chlapců (23 %), z nichž 11 mělo zlomeniny obratlů a čtyři měli opakované zlomeniny dlouhých kostí končetin. Sekundární osteoporóza (definovaná jako aBMD Z-skóre ≤ –2,0 a současně klinicky významná anamnéza fraktur [14]) byla diagnostikována u 14 (22 %) chlapců, výskyt byl 9× vyšší u chlapců léčených kortikoidy než u chlapců neléčených (p = 0,024). Bisfosfonáty bylo v době analýzy léčeno 11 chlapců, v průměru od 11,7 ± 3,0 let.
Pubertální zrání bylo vyšetřeno u 11 chlapců s DMD, z nichž pouze dva byli v době hodnocení starší 15 let. U jednoho z nich byla diagnostikována opožděná puberta a nasazena terapie testosteronem.
Nefrologické nálezy
Alespoň jedno vyšetření močového sedimentu bylo k dispozici u 50 (77 %) chlapců s DMD. Z toho u 24 (48 %) chlapců s DMD byla zachycena proteinurie. Užívání terapie exon skipping nemělo na tento nález vliv (Fisherův exaktní test; p = 0,13). U 10 (20 %) jedinců byla zjištěna pozitivní peroxidázová reakce na přítomnost hemoglobinu/myoglobinu v moči. Myoglobinémie v době odběru moči byla naměřena u 42 (84 %) chlapců, průměrně 1 235 ± 810 mg/l, maximální hodnota byla 3 527 mg/l. Její absolutní hodnota neměla vliv na nález pozitivní peroxidázové reakce (p = 0,16). Nálezy v močovém sedimentu byly u všech chlapců tranzientní se spontánní úpravou do normy při kontrolním vyšetření.
Psychologické symptomy
Psychologické odchylky byly častější u chlapců s DMD než s BMD (67, resp. 31%; p = 0,01). Nejčastěji se jednalo o lehkou až středně těžkou psychomotorickou retardaci (27 % chlapců), hyperaktivitu či opožděný vývoj řeči. Psychomotorická retardace byla častější u kortikoidy neléčených DMD chlapců (p < 0,01), u ostatních odchylek neměla terapie vliv (tab. 2B).
Diskuze
Naše práce popisuje v ČR dosud nejrozsáhlejší soubor chlapců s dystrofinopatií vč. efektu terapie a výskytu interních komplikací, které se objevují již ve druhé dekádě. Tím potvrzuje i nutnost multioborového přístupu. Zachycuje soubor pacientů s dystrofinopatií v době, kdy vznikala úzká spolupráce mezi odbornostmi v rámci nervosvalového centra a byla zaváděna i rutinní terapie kortikoidy. Dává tak možnost analyzovat jejich vliv na průběh nemoci a na základě těchto dat umožňuje stanovit klinická doporučení pro další sledování těchto chlapců.
Práce potvrzuje u DMD příznivý efekt kortikoterapie na prodloužení schopnosti samostatné chůze, zároveň však také dokládá její závažné nežádoucí účinky.
Z interních komplikací porucha srdeční funkce či fibróza myokardu dle ECHO a MR byla v souboru zjištěna téměř u poloviny chlapců starších 10 let. Detekce fibrózy myokardu pomocí MR byla častá a předcházela v některých případech poruchu srdeční funkce, což v souladu s publikovanými daty [15,16] podporuje zahrnutí vyšetření MR myokardu do rutinní péče o pacienty s dystrofinopatií. Toto vyšetření doporučujeme provádět 1× za rok u chlapců starších 10 let věku, pokud jsou již schopni vyšetření podstoupit bez celkové anestezie. Tento nález dále podporuje preventivní nasazení léčby u DMD chlapců nad 10 let v případě nedostupnosti MR srdce.
Restriktivní plicní choroba je u DMD častá od 2. dekády věku. V souladu se zahraničními studiemi je patrnou pokles FVC s věkem [17,18]. Chlapci léčení kortikoidy měli průměrné FVC signifikantně vyšší než chlapci neléčení, což opět odpovídá v zahraničí publikovaným datům [19] a souvisí s delším zachováním svalové síly na terapii. V našem souboru byla nejvýznamnějším rizikovým faktorem ztráta schopnosti chůze. Vysvětlením může být se ztrátou schopnosti chůze (a imobilizací ve vozíku) spojená zhoršená ventilační schopnost, výraznější svalová slabost anebo progrese skoliózy a deformity hrudníku. Tato pozorování zdůrazňují potřebu pravidelné monitorace dechových funkcí, zejména po ztrátě schopnosti chůze, kdy je doporučeno provádět spirometrické vyšetření 1× za 6 měsíců.
Téměř polovina chlapců s DMD měla výšku pod 3. percentilem pro daný věk, přičemž chlapci léčení kortikoidy měli významně vyšší výskyt malé výšky než chlapci neléčení. Malý vzrůst je známým a pacienty nepříznivě vnímaným nežádoucím účinkem dlouhodobé kortikoterapie [20–22]. Nicméně malý vzrůst u DMD může být mechanickou výhodou pro udržení schopnosti samostatné chůze [23]. Ač v našem souboru dosahovali chodící chlapci malé výšky vzhledem k věku dříve než chlapci nechodící, pro nedostatek jedinců v jednotlivých skupinách nebylo možné testovat možný zavádějící vliv kortikoterapie. Další častou skeletální komplikací u DMD byla sekundární osteoporóza, jejímž klinickým projevem jsou fraktury (téměř u čtvrtiny chlapců). Léčba kortikoidy dle očekávání výskyt osteoporózy zvyšovala. V zahraničních centrech byl výskyt fraktur značně variabilní (9–76 %) [24–26], pravděpodobně vzhledem k odlišnému věkovému složení a způsobu diagnostikování fraktur. Výskyt fraktur v našem souboru mohl být podhodnocen, jelikož protokol s cíleným dotazováním na výskyt fraktur dlouhých kostí v anamnéze a s pravidelným prováděním bočního RTG snímku páteře byl teprve postupně zaváděn. Naše pozorování spolu s daty z literatury [24–26] podporují potřebu cíleného vyhledávání skeletálních komplikací za účelem včasné diagnostiky osteoporózy a zahájení specifické antiresorpční terapie bisfosfonáty. Na základě našich dat proto doporučujeme provádět vyšetření DXA, bočního RTG snímku bederní a hrudní páteře a krevní odběry zaměřené na kostní metabolizmus (hladina kalcia, parathormonu) 1× za rok u všech chlapců na kortikoterapii či po ztrátě schopnosti chůze.
V našem souboru mělo 48 % chlapců s DMD asymptomatickou proteinurii. Dosud bylo publikováno velmi málo dat ohledně nálezů v moči u jedinců s DMD, proteinurie však bývá považována za nežádoucí událost v klinických studiích testujících exon skipping [27]. V našem souboru její výskyt ve skupině léčených touto terapií nebyl signifikantně vyšší než u ostatních chlapců s DMD. V našem centru jsme se zaměřovali pouze na nálezy proteinurie či pozitivní peroxidázové reakce při biochemickém vyšetření moči, cystatin C k analýze glomerulární filtrace nebyl rutinně vyšetřován. Vymizení pozitivních nálezů při kontrolním vyšetření a normální hodnota urey naznačují, že významné či trvalé poškození ledvin je u DMD v dětském věku vzácné. Důsledek intermitentní proteinurie u chlapců s DMD není jasný. Byla však popsána porucha glomerulární filtrace, zejména v pokročilejších fázích onemocnění a u pacientů se srdečním selháváním [28,29]. Pro zařazení vyšetření ledvinných funkcí do standardů péče je zatím nedostatek dat.
Alterace psychiky, zejména lehká psychomotorická retardace, ale i poruchy autistického spektra či úzkostné stavy byly v souboru velmi časté, a to více u chlapců s DMD. Ač kortikosteroidy mohou mít na psychiku nežádoucí účinky (zvýšená úzkost, deprese, psychózy a jiné) [30], v našem souboru kortikoterapie výskyt těchto komplikací nezvyšovala. Psychomotorická retardace byla naopak častější ve skupině neléčených chlapců s DMD. Tento nález byl nejspíše dán tím, že rodiče více postižených chlapců v minulosti častěji terapii odmítali. Nedostatečná spolupráce na vrub psychologických odchylek byla také v našem souboru častým důvodem neprovedení některých vyšetření (tab. 2A). Data potvrzují potřebu diagnostiky vývojových poruch mozku, a to zejména před zahájením školní docházky.
Limitací této studie je i přes dosud největší soubor v ČR malý počet jedinců v jednotlivých podskupinách dílčích analýz. Nebyli jsme tak schopni prokázat závislost sledovaných komplikací např. na genotypu nebo typu léčby (neporovnávali jsme chlapce dle délky kortikoterapie, věku nasazení, typu užívaného kortikoidu, ani jsme do analýzy nezahrnuli údaje o případných terapiích nové generace). Multisystémový skríningový a vyšetřovací protokol byl aplikován pouze u jedinců dlouhodobě sledovaných na našem pracovišti. Někteří chlapci tak neabsolvovali všechna odborná vyšetření a data mohou být zkreslena nedostatečnou motivací rodin relativně náročný protokol podstoupit. I přes tyto limitace přináší studie ucelený obraz průběhu a komplikací dystrofinopatií v dětském věku v ČR a potvrzuje význam implementace doporučených multioborových standardů v péči o tyto pacienty.
Etické principy
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Studie nepodléhá schválení etickou komisí. Pacienti podepsali souhlas s diagnostickým a léčebným procesem.
Grantová podpora
Podpořeno grantem MH CR AZV 16-30206 Fakultní nemocnice v Motole, Česká republika a grantem MZ ČR (RVO 64203), nadací Pohyb bez pomoci.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Marie Rohlenová
Klinika dětské neurologie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: marie.rohlenova@fnmotol.cz
Přijato k recenzi: 2. 12. 2019
Přijato do tisku: 23. 4. 2020
Zdroje
1. Birnkrant DJ, Bushby K, Bann CM et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet 2018; 17 (3): 251–267. doi: 10.1016/S1474-4422 (18) 30024-3.
2. Birnkrant DJ, Bushby K, Bann CM et al. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet 2018, 17 (4): 347–361. doi: 10.1016/S1474-4422 (18) 30025-5.
3. Birnkrant DJ, Bushby K, Bann CM et al. Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. Lancet 2018; 17 (5): 445–455. doi: 10.1016/S1474-4422 (18) 30026-7.
4. Kieny P, Chollet S, Delalande P et al. Evolution of life expectancy of patients with Duchenne muscular dystrophy at AFM Yolaine de Kepper centre between 1981 and 2011. Ann Phys Rehabil Med 2013; 56 (6): 443–454. doi: 10.1016/j.rehab.2013.06.002.
5. Wood CL, Straub V, Guglieri M et al. Short stature and pubertal delay in Duchenne muscular dystrophy. Arch Dis Child 2015; 101 (1): 101–106. doi: 10.1136/archdischild-2015-308654.
6. Bianchi, ML, Morandi L, Andreucci E et al. Low bone density and bone metabolism alterations in Duchenne muscular dystrophy: response to calcium and vitamin D treatment. Osteoporos Int 2011; 22 (2): 529–539. doi: 10.1007/s00198-010-1275-5.
7. Braat E, Hoste L, De Waele L et al. Renal function in children and adolescents with Duchenne muscular dystrophy. Neuromuscul Disord 2015; 25 (5): 381–387. doi: 10.1016/j.nmd.2015.01.005.
8. Ho R, Nguyen ML a Paul Mather P. Cardiomyopathy in becker muscular dystrophy: overview. World J Cardiol 2016; 8 (6): 356–361. doi: 10.4330/wjc.v8.i6.356.
9. Lomauro A, Romei M, Gandossini S et al. Evolution of respiratory function in Duchenne muscular dystrophy from childhood to adulthood. Eur Respir J 2018; 51 (2). pii: 1701418. doi: 10.1183/13993003.01418-2017.
10. Gloss D, Moxley RT, Ashwal S et al. Practice guideline update summary: corticosteroid treatment of Duchenne muscular dystrophy. Neurology 2016; 86 (5): 465–472. doi: 10.1212/WNL.0000000000002337.
11. Bushby K, Finkel R, Birnkrant DJ et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. Lancet 2010; 9 (1): 77. doi: 10.1016/S1474-4422 (09) 70271-6.
12. Duboc D, Meune C, Lerebours G et al. Effect of perindopril on the onset and progression of left ventricular dysfunction in Duchenne muscular dystrophy. J Am Coll Cardiol 2005; 45 (6): 855–857. doi: 10.1016/j.jacc.2004.09.078.
13. Duboc D, Meune C, Pierre B et al. Perindopril preventive treatment on mortality in Duchenne muscular dystrophy: 10 years’ follow-up. Am Heart J 2007; 154 (3): 596–602. doi: 10.1016/j.ahj.2007.05.014.
14. Bishop N, Arundel P, Clark E et al. Fracture prediction and the definition of osteoporosis in children and adolescents: the ISCD 2013 Pediatric Official Positions. J Clin Densitom 2014; 17 (2): 275–280. doi: 10.1016/j.jocd.2014.01.004.
15. Annexstad EJ, Fagerheim T, Holm I et al. Molecular and clinical characteristics of a national cohort of paediatric Duchenne muscular dystrophy patients in Norway. J Neuromuscul Dis 2019; 6 (3): 349–359. doi: 10.3233/JND-190402.
16. Markham LW, Spicer RL, Khoury PR et al. Steroid therapy and cardiac function in duchenne muscular dystrophy. Pediatr Cardiol 2005; 26 (6): 768–771. doi: 10.1007/s00246-005-0909-4.
17. Lomauro A, Romei M, Gandossini S et al. Evolution of respiratory function in Duchenne muscular dystrophy from childhood to adulthood. Eur Respir J 2018; 51 (2). pii: 1701418doi: 10.1183/13993003.01418-2017.
18. Liang WC, Wang CH, Chou PC et al. The natural history of the patients with Duchenne muscular dystrophy in Taiwan: a medical center experience. Pediatr Neonatol 2018; 59 (2): 176–183. doi: 10.1016/j.pedneo.2017.02.004.
19. Biggar WD, Harris VA, Eliasoph L et al. Long-term benefits of deflazacort treatment for boys with Duchenne muscular dystrophy in their second decade. Neuromuscul Disord 2006; 16 (4): 249–255. doi: 10.1016/j.nmd.2006.01.010.
20. Lamb M, West NA, Ouyang L et al. Corticosteroid Treatment and growth patterns in ambulatory males with Duchenne muscular dystrophy. J Pediatr 2016; 173 : 207–213. doi: 10.1016/j.jpeds.2016.02.067.
21. Crabtree NJ, Adams JE, Padidela R et al. Growth, bone health & ambulatory status of boys with DMD treated with daily vs. intermittent oral glucocorticoid regimen. Bone 2018; 116 : 181–186. doi: 10.1016/j.bone.2018.07.019.
22. Skoner DP, Rachelefsky GS, Meltzer EO et al. Detection of Growth suppression in children during treatment with intranasal beclomethasone dipropionate. Pediatrics 2000; 105 (2): e23–e23. doi: 10.1542/peds.105.2.e23.
23. Bodor M, McDonald CM. Why short stature is beneficial in duchenne muscular dystrophy. Muscle Nerve 2013; 48 (3): 336–342. doi: 10.1002/mus.23793.
24. Joseph S, Wang C, Di Marco M et al. Fractures and bone health monitoring in boys with Duchenne muscular dystrophy managed within the Scottish Muscle Network. Neuromuscul Disord 2019; 29 (1): 59–66. doi: 10.1016/j.nmd.2018.09.005.
25. Mayo AL, Craven BC, McAdam LC et al. Bone health in boys with Duchenne muscular dystrophy on long-term daily deflazacort therapy. Neuromuscul Disord 2012; 22 (12): 1040–1045. doi: 10.1016/j.nmd.2012.06.354.
26. Bothwell JE, Gordon KE, Dooley JM et al. Vertebral fractures in boys with Duchenne muscular dystrophy. Clin Pediatr 2016; 42 (4): 353–356. doi: 10.1177/000 992280304200408.
27. Goemans NM, Tulinius M, Van Der Akker JT et al. Systemic Administration of PRO051 in Duchenne‘s Muscular Dystrophy. N Engl J Med 2011; 364 (16): 1513–1522. doi: 10.1056/NEJMoa1011367.
28. Braat E, Hoste L, Liesbeth De Waele et al. Renal function in children and adolescents with Duchenne muscular dystrophy. Neuromuscul Disord 2015; 25 (5): 381–387. doi: 10.1016/j.nmd.2015.01.005.
29. Villa CR, Kaddourah A, Mathew J et al. Identifying evidence of cardio-renal syndrome in patients with Duchenne muscular dystrophy using cystatin C. Neuromuscul Disord 2016; 26 (10): 637–642. doi: 10.1016/j.nmd.2016.07.010.
30. Judd LL, Schettler PJ, Brown ES et al. Adverse consequences of glucocorticoid medication: psychological, cognitive, and behavioral effects. Am J Psychiatry 2014; 171 (10): 1045–1051. doi: 10.1176/appi.ajp.2014.13091264.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 3- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Primární progresivní afázie
- Jsme na dosah cílené terapie Huntingtonovy nemoci? ANO
- Jsme na dosah cílené terapie Huntingtonovy nemoci? NE
- Je cielená terapia Huntingtonovej choroby na dosah?
- Kognitivní poruchy u dětí s epilepsií
- Autoimunitní encefalitidy s negativitou neurálních protilátek – klinické charakteristiky a možnosti detekce protilátek
- APOE a BDNF jako rizikové genetické markery pro predikci nástupu a rozvoje kognitivního deficitu při Alzheimerově nemoci
- Význam nových laboratorních technik v diagnostice Niemann-Pickovy choroby typu C
- Bolesti hlavy v graviditě
- Výskyt a rizikové faktory neprovokovaných epileptických záchvatů u pacientů po ischemické cévní mozkové příhodě
- Validace dotazníku pro hodnocení dysfagie u pacientů s roztroušenou sklerózou – česká verze DYMUS
- Význam neuropaliativní péče pro zlepšení kvality života pacientů s progresivním neurologickým onemocněním – intervenční studie
- Vliv demence na trajektorie kvality života seniorů
- Charakteristika souboru chlapců s Duchennovou a Beckerovou svalovou dystrofií – studie z jednoho nervosvalového centra
- Metabolomika cerebrospinálneho likvoru pomocou magnetickej rezonančnej spektroskopie u pacientov so sclerosis multiplex, s klinicky izolovaným syndrómom, inými zápalovými ochoreniami mozgu a u zdravých kontrol
- Epidurální aplikace kortikoidů 2. část – Kvalita života pacientů před aplikací
- Fokální epileptický záchvat u mladé ženy z Jižní Korey
- Glioblastom grade IV – dlouhodobé přežití
- Stanovisko redakční rady k diskuzi o úrovni a směřování Cesk Slov Neurol N
- Erratum
- Informace vedoucího redaktora
- Recenze
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Glioblastom grade IV – dlouhodobé přežití
- Primární progresivní afázie
- Bolesti hlavy v graviditě
- Kognitivní poruchy u dětí s epilepsií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



