-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
Neuropsychiatric symptoms as early manifestation of Alzheimer’s disease
Aim: Neuropsychiatric symptoms (NPS) are a heterogeneous group of changes in personality and behavior that can be observed already in early stages of Alzheimer’s disease (AD). Mild behavioral impairment (MBI) is a newly developed diagnostic category describing persistent changes in personality and behavior starting later in life. Based on these criteria, a new measure, the Mild Behavioral Impairment Checklist (MBI-C) has been developed, aimed at detecting NPS in early stages of AD. The aim of this study is to present the newly adapted Czech version of the MBI-C and to explore the presence of NPS in a pilot group of patients.
Patients and methods: The original MBI-C has been adapted to Czech and administered to close informants of 188 patients. The patients were divided according to the results of a complex neuropsychological, neurological examination and brain imaging into 3 groups: cognitively normal (N = 69), amnestic mild cognitive impairment (aMCI; N = 87) and dementia due to AD (N = 32).
Results: Patients with aMCI expressed in the MBI-C significantly more severe score compared to cognitively normal subjects and less severe compared to dementia patients. The differences were observed mainly in affective, motivation and impulse control domains.
Conclusion: The Czech version of the MBI-C detects the presence of NPS even before the onset of dementia syndrome and is useful in clinical practice.
Keywords:
mild cognitive impairment – neuropsychiatric symptoms – Alzheimer´s disease – mild behavioral impairment
Autoři: V. Matušková; T. Nikolai; H. Marková; K. Čechová; J. Laczó; J. Hort; M. Vyhnálek
Působiště autorů: Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně ; Neurologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83(1): 64-72
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn202064Neuropsychiatrické symptomy (NPS) jsou heterogenní skupina změn v osobnosti a chování, které lze pozorovat již v časných stadiích Alzheimerovy nemoci (AN). Mírná behaviorální porucha (mild behavioral impairment; MBI) je nová diagnostická kategorie popisující trvalé změny v osobnosti a chování s počátkem v pozdější fázi života. Na podkladě těchto kritérií byl vytvořen nový Dotazník mírné poruchy chování (Mild Behavioral Impairment Checklist; MBI-C) zaměřený na detekci NPS v časných stadiích AN. Cílem studie je představit námi adaptovanou českou verzi dotazníku MBI-C a studovat přítomnost a závažnost NPS na pilotním souboru pacientů.
Souhrn
Cíl: Neuropsychiatrické symptomy (NPS) jsou heterogenní skupina změn v osobnosti a chování, které lze pozorovat již v časných stadiích Alzheimerovy nemoci (AN). Mírná behaviorální porucha (mild behavioral impairment; MBI) je nová diagnostická kategorie popisující trvalé změny v osobnosti a chování s počátkem v pozdější fázi života. Na podkladě těchto kritérií byl vytvořen nový Dotazník mírné poruchy chování (Mild Behavioral Impairment Checklist; MBI-C) zaměřený na detekci NPS v časných stadiích AN. Cílem studie je představit námi adaptovanou českou verzi dotazníku MBI-C a studovat přítomnost a závažnost NPS na pilotním souboru pacientů.
Soubor a metodika: Originální verze MBI-C byla adaptována do češtiny a administrována blízkým osobám 188 pacientů. Pacienti podstoupili komplexní neuropsychologické, neurologické vyšetření a zobrazení mozku a dle výsledků byli rozděleni do tří skupin: kognitivně zdraví (n = 69), amnestická mírná kognitivní porucha (amnestic mild cognitive impairment; aMCI) (n = 87) a demence při AN (n = 32).
Výsledky: Pacienti s aMCI vykazovali v dotazníku MBI-C signifikantně vyšší skóre ve srovnání s kognitivně zdravými a zároveň nižší skóre než pacienti s demencí. Rozdíly byly patrné zejména v doménách nálady, motivace a kontroly impulzů.
Závěr: Česká verze dotazníku MBI-C detekuje přítomnost NPS ještě před rozvojem syndromu demence a je dobře využitelná v klinické praxi.
Klíčová slova:
neuropsychiatrické symptomy – Alzheimerova nemoc – mírná behaviorální porucha – mírná kognitivní porucha
Úvod
V souvislosti se stárnutím populace stoupá incidence Alzheimerovy nemoci (AN). V minulosti bylo pravidlem diagnostikovat toto onemocnění ve stadiu demence. S vývojem nové medikace přímo zasahující do patofyziologie AN, u níž se předpokládá účinek zejména v časných stadiích tohoto onemocnění, se současná diagnostika zaměřuje na časná stadia. Demenci předchází prodromální stadium zvané mírná kognitivní porucha (mild cognitive impairment; MCI), která je definována existencí objektivizovatelného kognitivního deficitu u ještě soběstačného pacienta [1]. MCI je heterogenní koncept zahrnující postižení nervového systému různé etiologie. Ve stáří je MCI u většiny pacientů v příčinné souvislosti s časnými alzheimerovskými změnami – tzv. MCI při AN [2]. Stadiu MCI předchází stadium preklinické. V preklinickém stadiu jsou u pacienta již přítomny patologické změny v mozku detekovatelné pomocí biomarkerů, ale výkony při standardním neuropsychologickém vyšetření jsou ještě v normě [3]. U části osob jsou však již přítomny subjektivní stížnosti na pokles v kognici, přičemž specifické stížnosti byly asociovány s vyšším rizikem rozvoje kognitivního deficitu [4]. Tato část osob v preklinickém stadiu AN je definována jako subjektivní kognitivní pokles (subjective cognitive decline; SCD) [5].
Kromě kognitivního deficitu lze však u AN pozorovat i změny v osobnosti a chování. Tato heterogenní skupina změn byla nazvána neuropsychiatrické symptomy (NPS) neboli behaviorální a psychologické symptomy. Zahrnuje např. poruchy nálady, motivace, vnímání a obsahu myšlení, změny chování, příjmu potravy a poruchy spánku. Ve stadiu demence jsou NPS častým příznakem a s postupnou progresí nemoci se obvykle zvýrazňují. Uvádí se, že u 70 – 90 % pacientů s demencí se vyskytuje alespoň jeden NPS, přičemž časté jsou jejich kombinace. Proto byly zařazeny i do nových konsenzuálních diagnostických kritérií demencí různé etiologie [6 – 8] a jsou také součástí českých doporučených postupů pro diagnostiku demence u AN a jiných demencí [9]. Tyto symptomy mohou způsobit nejen zhoršení soběstačnosti a kvality života pacientů, ale i zátěž pečovatelů, komplikace a nákladnost léčby a jsou nejčastějším důvodem institucionalizace [10].
V prodromálních a preklinických stadiích se NPS začaly zkoumat teprve nedávno a přítomnost alespoň jednoho příznaku byla pozorována u 35 – 75 % pacientů s MCI a u 18 – 30 % kognitivně zdravých starších osob v populaci [11 – 13]. Mezi nejčastější NPS v časných stadiích AN patří deprese, úzkost, apatie, iritabilita, agitace a poruchy spánku. Naopak bludy a halucinace jsou poměrně vzácné a vyskytují se až ve stadiu demence [14 – 19]. Nově vzniklé NPS prokazatelně zvyšují riziko rozvoje a progrese kognitivního deficitu u pacientů s MCI i u kognitivně zdravých starších osob [20 – 22]. Na rozsáhlé kohortě dobrovolníků studie Národního koordinačního centra pro Alzheimerovu nemoc (NACC) bylo recentně publikováno několik zajímavých zjištění:
- Celkem 55 % kognitivně zdravých jedinců nad 60 let, kteří progredovali do MCI, vykazovalo NPS ještě před rozvojem kognitivního deficitu a dalších 24 % MCI rozvinulo NPS před rozvojem demence [23];
- roční konverze pacientů s MCI a přítomností NPS do demence je 25 %, ve srovnání s 15 % pacientů s MCI dle populačních studií [24];
- nižší přítomnost poruch nálady a jejich zlepšování v čase zvýšilo pravděpodobnost zpětného návratu z MCI do skupiny bez kognitivního deficitu [25].
Dlouho se uvažovalo, že změny v chování a osobnosti jsou u neurodegenerativních onemocnění důsledkem kognitivního postižení. Výzkumy se ale v poslední době spíše přiklánějí k hypotéze, že nově vzniklé a přetrvávající NPS jsou, podobně jako kognitivní postižení, přímým důsledkem neuropatologických změn v mozku. Zatímco nově vzniklé NPS jsou asociovány s vyšším rizikem progrese kognitivního deficitu, přítomnost izolovaných depresivních příznaků [26,27] či jiné psychiatrické poruchy [28] v mládí nebyla asociována s vyšším rizikem rozvoje demence. Poruchy nálady se také s vyšší pravděpodobností vyskytují u osob s rizikovým genotypem ApoE4 [29]. U MCI navíc současná přítomnost ApoE4 a deprese či apatie zvyšuje riziko progrese do demence výrazněji, než by odpovídalo prostému aditivnímu efektu [22].
I když se výzkum v této oblasti rychle rozvíjí, v praxi jsou NPS identifikovány často nepřesně nebo pozdě. MCI jako prodromální stadium se zaměřuje pouze na poruchy kognice a existenci NPS opomíjí. V praxi tak bývají nově vzniklé NPS ve stáří často považovány za počátek psychiatrického onemocnění, zejména depresivní poruchy [30]. To může vést k nesprávně stanovené diagnóze a oddalování správně cílené intervence. Analogický koncept, který by popisoval NPS ve stadiích předcházejících demenci, donedávna chyběl a v revidované formě byl publikován až v roce 2016 jako tzv. mírná behaviorální porucha (mild behavioral impairment; MBI) [31].
Mírná behaviorální porucha
Mírná behaviorální porucha je syndrom označující nově vzniklé změny v chování nebo osobnosti u starší populace s předpokladem neurodegenerativní etiologie. Iniciální pojetí mělo za cíl identifikovat časná stadia frontotemporální demence [32]. Avšak každá z demencí neurodegenerativní etiologie se může v časném stadiu manifestovat NPS. Proto byla kritéria rozšířena a v současnosti je MBI definována jako změny v chování nebo osobnosti udávané pacientem nebo jeho okolím s počátkem v pozdější fázi života (věk ≥ 50 let) trvající po dobu alespoň 6 měsíců a nezpůsobené jinou současnou psychiatrickou poruchou, traumatickým poškozením mozku ani užíváním psychotropních látek nebo medikace (viz diagnostická kritéria v tab. 1). Změny by měly způsobovat alespoň minimální postižení v oblasti interpersonálních vztahů nebo podávání výkonu na pracovišti. Pacient je ale plně soběstačný, nesplňuje tedy kritéria demence. MBI může být diagnostikována současně s MCI, avšak může kognitivní deficit i předcházet (obr. 1) [31].
Tab. 1. Kompletní diagnostická kritéria mírné behaviorální poruchy. 
Obr. 1. Diagnostická kategorie mírné behaviorální poruchy.
Fig. 1. Diagnostic category of mild behavioral impairment.
Diagnostické nástroje měření neuropsychiatrických symptomů
Diagnostická kategorie MBI se snaží postihnout změny v chování a osobnosti ve stáří co nejčasněji a má potenciál přispět k zpřesnění diagnostického procesu neurodegenerativních onemocnění. Pro sledování NPS však existuje množství různých škál, což přispívá k výrazným rozdílům v udávaných prevalencích napříč studiemi.
Neuropsychiatrické symptomy lze v klinické praxi hodnotit několika způsoby – pozorováním a strukturovaným rozhovorem s pečovatelem a pacientem či za použití standardizovaných dotazníků a škál. Za zlatý standard mezi škálami NPS je obecně považován Neuropsychiatrický inventář (Neuropsychiatric Inventory; NPI), který má formu strukturovaného rozhovoru s pečovatelem [33]. Jeho zkrácená verze NPI-Q (Neuropsychiatric Inventory – Questionnaire) ve formě dotazníku pro pečovatele patří v zahraničí k výzkumně i klinicky nejužívanějším nástrojům [34]. Naopak rozšířením původního NPI vznikla verze pro expertního klinika – NPI-C [35]. V praxi se také setkáme s doménově specifickými nástroji určenými k hodnocení vlastního prožívání samotným pacientem, přičemž nejčastěji se hodnotí depresivní (Beckova škála deprese [BDI-II] [36], Geriatrická škála deprese [GDS-15] [37]) nebo úzkostná symptomatika (Beckova škála úzkosti [BAI] [38], Dotazník úzkosti a úzkostlivosti [STAI] [39]).
I když jsou výše zmíněné dotazníky validní a v praxi dobře etablované, většinou byly konstruovány a validovány na kohortě pacientů ve stadiu demence nebo u pacientů s psychiatrickým onemocněním. Nemusí tak být dostatečně senzitivní pro spektrum NPS obvyklé v časném stadiu neurodegenerace. Navíc posuzovaná doba trvání 1 – 4 týdny, která je u stávajících dotazníků obvyklá, může být příliš krátká na odlišení neurodegenerativní etiologie od přechodných narušení (např. poruchy přizpůsobení, vliv medikace či nedostatku spánku). Pro praxi je také důležitá časová úspornost administrace. Autoři konceptu MBI reflektovali tyto potřeby a na podkladě kritérií MBI vytvořili nástroj zaměřený přímo na detekci NPS ve stadiích předcházejících demenci – Dotazník mírné poruchy chování (Mild Behavioral Impairment – Checklist; MBI-C) [40].
Dotazník mírné poruchy chování
Dotazník mírné poruchy chování MBI-C byl publikován v roce 2017 pod záštitou neuropsychiatrické sekce mezinárodní Alzheimerovské společnosti. Jeho cílem je zachytit širší spektrum NPS v časovém horizontu 6 měsíců u pacientů v predementních stadiích (podrobný popis viz Metody).
Pouze dvě publikované studie se zabývaly prevalencí neuropsychiatrických příznaků a MBI u preklinických a prodromálních stadií za použití dotazníku MBI-C. U obou skupin zaznamenaly vysokou prevalenci NPS, alespoň 1 bod v dotazníku skórovalo 76 % pacientů s MCI a 55 % osob s SCD. Kompletní kritéria MBI však splňovalo pouze 14,2 % MCI [41] a 5,8 % SCD [42], protože NPS musí být dostatečně závažné, aby ovlivňovaly fungování v každodenních aktivitách. Design studií však neumožňuje zjistit, zda existují rozdíly ve skóre MBI-C mezi těmito diagnostickými skupinami.
Cíle této studie jsou: 1. představit námi nově přeloženou a adaptovanou oficiální českou verzi dotazníku MBI-C; 2. za pomoci dotazníku MBI-C sledovat přítomnost a závažnost NPS u klinicky a neuropsychologicky podrobně definovaného souboru osob bez kognitivního deficitu, s amnestickou formou MCI (aMCI) a demencí; 3. zjistit, zda je MBI-C schopen zachytit rozdíly v NPS v predementních stadiích; a 4. zjistit souvislost domény poruchy nálady v dotazníku MBI-C se sebeposuzujícími standardními dotazníky deprese a úzkosti.
Na základě znalostí o stoupající prevalenci a závažnosti NPS v závislosti na míře kognitivního deficitu předpokládáme, že dotazník MBI-C, který byl vyvinut k záchytu časných změn, zachytí rozdíly již v predementních stadiích (mezi kognitivně zdravými osobami a aMCI). Na základě předchozích výzkumů NPS očekáváme nejvýraznější rozdíly v doméně motivace a poruchy nálady.
Metody
Účastníci
Do studie bylo zahrnuto 188 osob starších 50 let (průměrný věk 71,33 let; směrodatná odchylka [standard deviation; SD] = 8,04) vyšetřených v rámci Czech Brain Aging Study (CBAS). CBAS je longitudinálně probíhající studie Kognitivního centra Neurologické kliniky 2. LF UK a FN Motol a programu Demence FNUSA – ICRC, jejímž hlavním cílem je identifikovat časné markery patologického stárnutí. Do studie CBAS jsou zahrnuty osoby odeslané praktickým lékařem nebo jiným specialistou pro stížnosti na kognici referované buďto samotným pacientem, jeho blízkou osobou nebo klinikem. Účastníci byli podrobně vyšetřeni (viz dále) a na základě neuropsychologického vyšetření klasifikováni do 3 skupin:
Skupina s pravděpodobnou či možnou demencí při AN (smíšená prezentace s podílem vaskulárních změn) (AD; 32 osob) byla definována dle publikovaných kritérií [6].
Skupina s MCI byla definována dle publikovaných kritérií [1] a zahrnovala osoby se subjektivními stížnostmi na kognici referovanými pacientem, blízkou osobou nebo klinikem, které měly objektivní postižení kognice ve standardním neuropsychologickém vyšetření, avšak v aktivitách denního života byly soběstačné. Postižení kognitivní domény znamenalo výkon v daném testu více než 1,5 SD pod věkově a vzdělanostně vázanou normou, zahrnuti byli pouze pacienti s postižením paměti, a to výlučně nebo v kombinaci s postižením jiné kognitivní domény (aMCI; 87 osob).
Skupina s SCD (45 osob) na základě publikovaných kritérií [5] zahrnovala osoby se subjektivními stížnostmi na kognici, které v neuropsychologickém vyšetření skórovaly v rámci normy.
Dále bylo do studie zahrnuto 24 kognitivně zdravých dobrovolníků z Univerzity třetího věku nebo blízkých osob sledovaných pacientů neudávajících významnější subjektivní stížnosti na kognici, pro které by někdy vyhledali lékařskou pomoc, a jejichž výkon v neuropsychologickém vyšetření byl v rámci normy. Pro účely statistického vyhodnocení byly skupiny kognitivně zdravých dobrovolníků a SCD sloučeny do jedné skupiny „kognitivně zdraví“ (KZ; 69 osob).
Do studie nebyly zahrnuty osoby s přítomností jiného psychiatrického či neurologického onemocnění (Parkinsonova nemoc, traumatické poškození mozku, CMP, dlouhodobé psychiatrické onemocnění [≥ 5 let], abúzus alkoholu), které by mohlo způsobit poruchy kognice či NPS.
Protokol vyšetření
Každý účastník absolvoval komplexní neurologické, neuropsychologické vyšetření a zobrazení mozku MR. Neuropsychologická baterie obsahovala skríningový test Mini Mental State Examination (MMSE) [43] a českou verzi testové baterie Uniform Data Set (UDS) [44] sestávající z následujících testů: Logická paměť WMS-R – oddálené vybavení příběhu A (LP), Opakování čísel WAIS-III (Wechslerova inteligenční škála pro dospělé), Test cesty A (Trail Making Test; TMT A) a Test cesty B (TMT B), Bostonský test pojmenování (zkrácená 30položková verze), sémantická verbální fluence (SVF; zvířata). Baterie UDS byla doplněna testy: fonemická verbální fluence (FVF s využitím písmen N, K, P) [45], Paměťový test učení (Auditory Verbal Learning Test; AVLT) [46] a Rey-Osterriethova komplexní figura (kopie a reprodukce po 3 min) [47]. Všichni účastníci dále vyplnili 2 sebeposuzovací škály ke zhodnocení depresivní a úzkostné symptomatologie: Geriatric Depression Scale (GDS-15) [37] a Beck Anxiety Inventory (BAI) [38]. Všechny diagnózy byly stanoveny na konsenzuálním diagnostickém sezení týmu neurologů a neuropsychologů.
Dotazník mírné poruchy chování MBI-C byl administrován blízkým osobám všech účastníků výzkumu. Dotazník obsahuje celkem 34 otázek, u kterých se hodnotí přítomnost symptomů jednoduchou formou ano/ ne a jejich závažnost na třístupňové škále (1 – mírná změna, 2 – střední změna a 3 – výrazná změna). V souladu s kritérii MBI sleduje projevy pěti domén NPS – poruchy motivace (6 otázek zjišťujících zájem a motivaci), poruchy nálady (6 otázek zaměřených na úzkostné a depresivní příznaky), poruchy kontroly impulzů (12 otázek zjišťujících kontrolu chování či impulzů, schopnost odložit uspokojení), nevhodné sociální chování (5 otázek zaměřených na dodržování sociálních norem, takt a empatii) a poruchy percepce a obsahu myšlení (5 otázek zaměřených na bludy a halucinace). Hodnotící osobou je primárně blízká osoba pacienta, přičemž přítomnost klinika není nutná.
Výstupem dotazníku je celkové skóre v rozsahu 0 – 102 bodů, které získáme prostým součtem všech odpovědí. Dále dotazník poskytuje 5 samostatných skórů dle jednotlivých hodnocených domén: poruchy motivace (0 – 18 bodů), poruchy nálady (0 – 18 bodů), poruchy kontroly impulzů (0 – 36 bodů), nevhodné sociální chování (0 – 15 bodů) a poruchy percepce a obsahu myšlení (0 – 15 bodů). Česká verze MBI-C byla přeložena z anglického originálu zkušeným klinikem a revidována kognitivními neurology a neuropsychology (MV, TN, HM, KČ). Zpětný překlad byl proveden nezávislým překladatelem, konzultován a schválen původním autorem dotazníku.
Do studie nebyly zahrnuty osoby, u nichž chyběly 4 a více z 34 položek v dotazníku (celkem 6 osob). Maximální odstup mezi jednotlivými vyšetřeními vč. vyplnění dotazníku byl 4 měsíce. NPS jsme považovali za přítomné, pokud osoba dosáhla alespoň 1 bod v jakékoliv doméně dotazníku.
Statistické zpracování dat
Meziskupinové rozdíly v demografických údajích jsme porovnali pomocí analýzy kovariance (analysis of covariance; ANCOVA), zastoupení pohlaví pomocí χ2. Pro analýzu rozdílů v celkovém skóre MBI-C napříč jednotlivými skupinami jsme pro nesplnění předpokladu normálního rozložení použili logaritmované celkové skóre MBI-C a dále postupovali parametricky pomocí analýzy variance (analysis of variance; ANOVA) kontrolované pro věk a pohlaví účastníků. Pro analýzu rozdílů v jednotlivých doménových skórech MBI-C jsme použili neparametrický Kruskal-Wallisův test, post-hoc analýzy byly provedeny za použití Mann-Whitneyho U testu. Hladiny signifikance byly upraveny Holm-Bonferroniho korekcí pro vícenásobná porovnání. Spearmanovy korelace byly použity pro zjištění asociace mezi MBI-C doménou poruchy nálady a sebeposuzovacími škálami GDS-15 a BAI (rovněž s úpravou hladin signifikance Holm-Bonferroniho korekcí pro vícenásobná porovnání). Velikosti efektu jsou uvedeny jako η2 (eta-squared) nebo korelační koeficient r, přičemž za malý efekt považujeme η2 = 0,02 – 0,13 nebo r = 0,1 – 0,3; za středně velký efekt považujeme η2 = 0,13 – 0,26 nebo r = 0,3 – 0,5 a za velký efekt považujeme η2 > 0,26 nebo r > 0,5. Všechny analýzy byly provedeny v programu SPSS (verze 20) (IBM, Armonk, NY, USA).
Výsledky
Demografická a neuropsychologická charakteristika souboru
Celkem bylo do studie zařazeno 188 osob, z toho 87 osob s aMCI, 32 osob s AD a 69 osob KZ. Jednotlivé diagnostické skupiny se významně lišily v zastoupení pohlaví (nižší zastoupení žen ve skupině aMCI oproti KZ a AD; p < 0,01), ve věku (skupina AD byla nejstarší; p < 0,05) a vzdělání (skupina AD měla oproti KZ průměrně nižší vzdělání; p < 0,05). Dle očekávání se skupiny dále vzájemně lišily ve skóre MMSE a ve výkonech napříč všemi neuropsychologickými testy. Osoby ve skupině KZ vykazovaly dle sebeposouzení nižší úroveň depresivní symptomatiky (GDS-15) než aMCI a AD. Naopak v sebeposouzení úzkostné symptomatiky (BAI) jsme nezjistili žádné rozdíly mezi diagnostickými skupinami. Blízkou osobou vyplňující dotazník MBI-C byli nejčastěji partneři/ partnerky (69 %) nebo děti účastníků (23 %) a v 79% uváděli každodenní kontakt s účastníkem. Vztah ani intenzita kontaktu se napříč skupinami nelišily. Detailní charakteristika souboru je uvedena v tab. 2.
Tab. 2. Demografická a neuropsychologická charakteristika souboru. 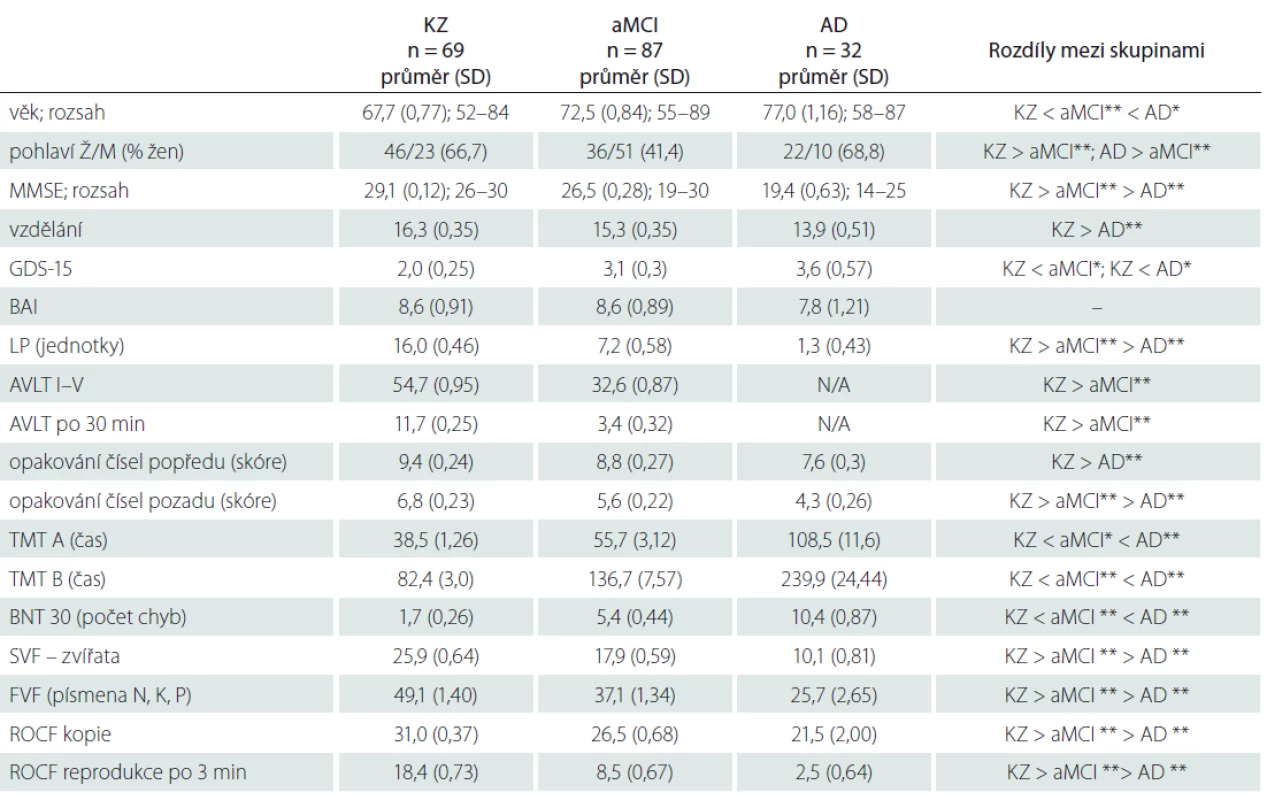
*p < 0,05; **p < 0,01
AD – demence při Alzheimerově nemoci s možným podílem vaskulárních změn; aMCI – amnestická mírná kognitivní porucha; AVLT – Paměťový test učení; BAI – Beckova škála úzkosti; BNT – Bostonský test pojmenování; FVF – fonemická verbální fl uence; GDS – Geriatrická škála deprese; KZ – kognitivně zdravé osoby; LP – logická paměť; M – muži; MMSE – Mini Mental State Examination; N/A – neměřeno; ROCF – Rey-Osterriethova komplexní fi gura; SD – standardní odchylka; SVF – sémantická verbální fl uence; TMT – Test cesty; Ž – ženyVýskyt neuropsychiatrických příznaků dle MBI-C
Administrace dotazníku trvala méně než 5 min, více než 95 % dotazníků bylo vyplněno správně bez přítomnosti administrátora. Alespoň 1 NPS (tj. alespoň 1 bod v dotazníku MBI-C) jsme pozorovali u 50,7 % KZ osob, u 78,2 % osob s aMCI a u 97 % osob s AD. Nejčastějšími doménami MBI u skupiny KZ byly poruchy nálady (37,7 %) a kontroly impulzů (37,7 %). U skupiny aMCI byly nejčastější poruchy kontroly impulzů (61,4 %), nálady (60,7 %) a motivace (51,2 %). U skupiny AD byly rovněž nejčastěji uváděny poruchy kontroly impulzů (89,3 %), nálady (71,9 %) a motivace (71,9 %). Poruchy sociálního chování a percepce a obsahu myšlení byly u KZ vzácné (13 a 6 %) a objevovaly se častěji u aMCI (24 a 16 %)a AD (29 a 30 %).
Rozdíly v MBI-C mezi diagnostickými skupinami
V analýze ANCOVA kontrolované pro věk a pohlaví se skupiny výrazně lišily v celkovém skóre MBI-C (F [2,181] = 23,85; p < 0,001; partial η2 = 0,21), bez významného ovlivnění této variability věkem (F [1,181] = 1,69; p = 0,20) nebo pohlavím účastníků (F [1,181] = 1,02; p = 0,31). V souladu s naším očekáváním dosahovala skupina KZ průměrného nejnižšího skóre MBI-C, skupina AD nejvyššího skóre a skupina aMCI skórovala mezi těmito dvěma skupinami. V jednotlivých doménách jsme napříč diagnostickými skupinami našli statisticky významné rozdíly v poruchách motivace (χ2 [2] = 33,59; p < 0,001) nálady (χ2 [2] = 19,98; p < 0,001), kontroly impulzů (χ2 [2] = 32,14; p < 0,001) a percepce a obsahu myšlení (χ2 [2] = 11,39; p < 0,01). KZ a aMCI se lišily v poruchách motivace (U = 1912,5; p < 0,001), nálady (U = 2076; p = 0,001) a kontroly impulzů (U = 1946,5; p = 0,001). U skupiny aMCI bylo oproti KZ naznačeno vyšší skóre i v poruchách percepce a obsahu myšlení (p = 0,046), po úpravě Holm-Bonferroniho korekcí ale tento rozdíl zanikl. Skupiny aMCI a AD se rovněž signifikantně lišily v poruchách motivace (U = 1004,5; p = 0,019), nálady (U = 1030,5; p = 0,046) a kontroly impulzů (U = 677,5; p = 0,001). Skupiny KZ a AD se signifikantně lišily v poruchách motivace (U = 453; p < 0,001), nálady (U = 579; p < 0,001), kontroly impulzů (U = 308,5; p < 0,001) a také percepce a obsahu myšlení (U = 774,5; p = 0,001). V doméně nevhodného sociálního chování jsme nenašli žádné významné rozdíly, což je důsledkem nízkého skóre ve všech skupinách. Celkové i doménové skóre v dotazníku MBI-C napříč diagnostickými skupinami jsou shrnuty v tab. 3. Jednotlivé rozdíly celkového skóre ilustruje obr. 2, rozdíly doménových skórů obr. 3.
Tab. 3. Rozdíly ve skórech MBI-C mezi diagnostickými skupinami. 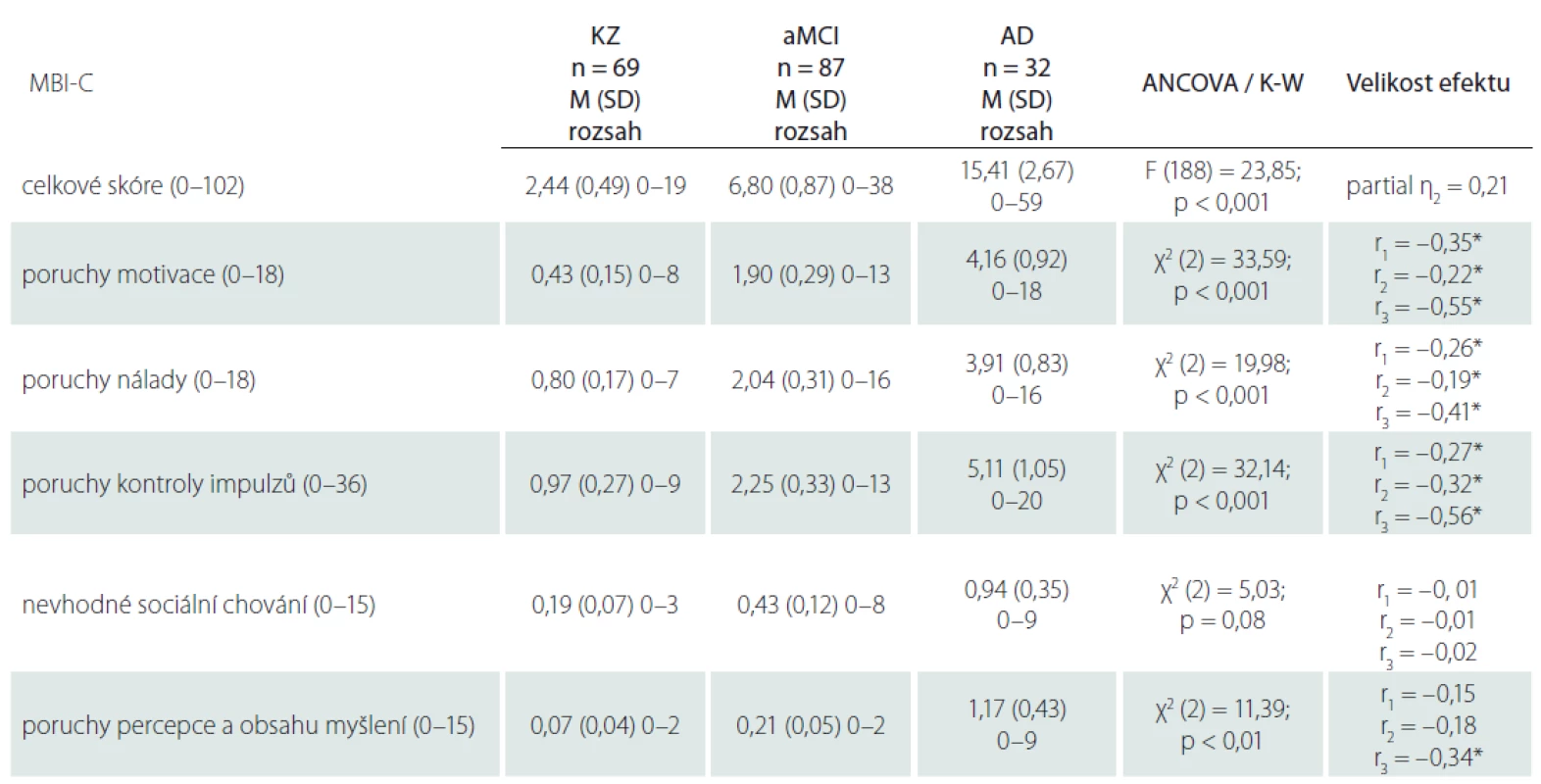
*velikost efektu při výsledku signifi kantním na úrovni p upravené Holm-Bonferroniho korekcí η2 – velikost efektu pouze příslušnosti ke skupině na variabilitu celkového skóre MBI-C, vyjádřena jako eta squared; AD – demence při Alzheimerově nemoci s možným podílem vaskulárních změn; aMCI – amnestická mírná kognitivní porucha; ANCOVA – analýza kovariance; K-W – Kruskal- Wallisův test; KZ – kognitivně zdraví; M – průměr; MBI-C – dotazník mírné behaviorální poruchy; n – počet; r1 – velikost efektu pro data KZ vs. aMCI; r2 – velikost efektu pro data aMCI vs. AD; r3 – velikost efektu pro data KZ vs. AD; SD – standardní odchylka Obr. 2. Celkové skóre MBI-C.
AD – pravděpodobná či možná demence při Alzheimerově nemoci; aMCI – amnestická mírná kognitivní porucha; KZ – kognitivně zdravé osoby; MBI-C – Dotazník mírné behaviorální poruchy
Fig. 2. MBI-C total score.
AD – probable or possible dementia due to Alzheimer‘s disease; aMCI – amnestic mild cognitive impairment; KZ – cognitively healthy persons; MBI-C – Mild Behavioral Impairment Checklist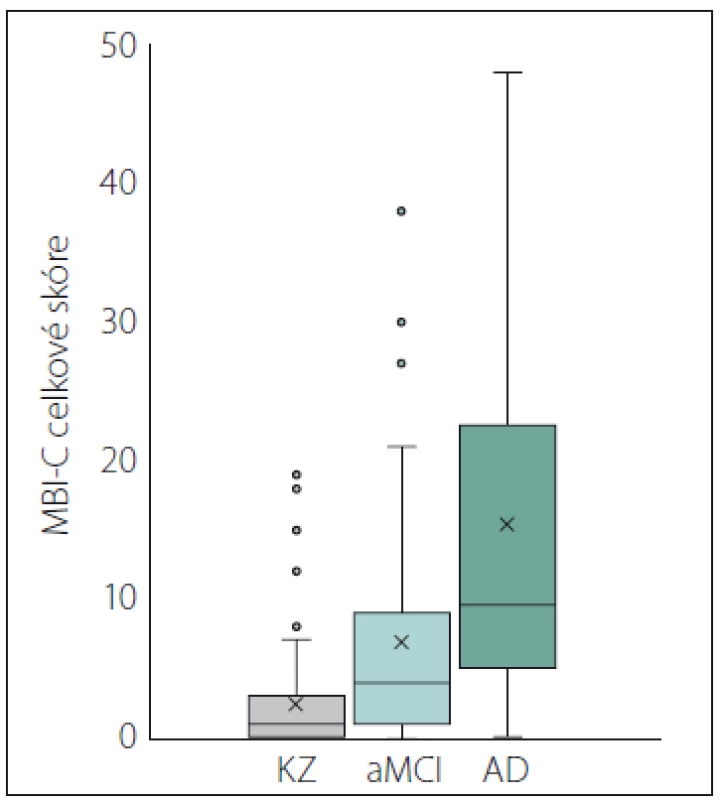
Obr. 3. Relativní doménová skóre MBI-C (v procentech z maximálního počtu bodů).
AD – pravděpodobná či možná demence při Alzheimerově nemoci; aMCI – amnestická mírná kognitivní porucha; KZ – kognitivně zdravé osoby; MBI-C – Dotazník mírné behaviorální poruchy
Fig. 3. MBI-C relative domain scores (percentage of the maximum domain score).
AD – probable or possible dementia due to Alzheimer´s disease; aMCI – amnestic mild cognitive impairment; KZ – cognitively healthy persons; MBI-C – Mild Behavioral Impairment Checklist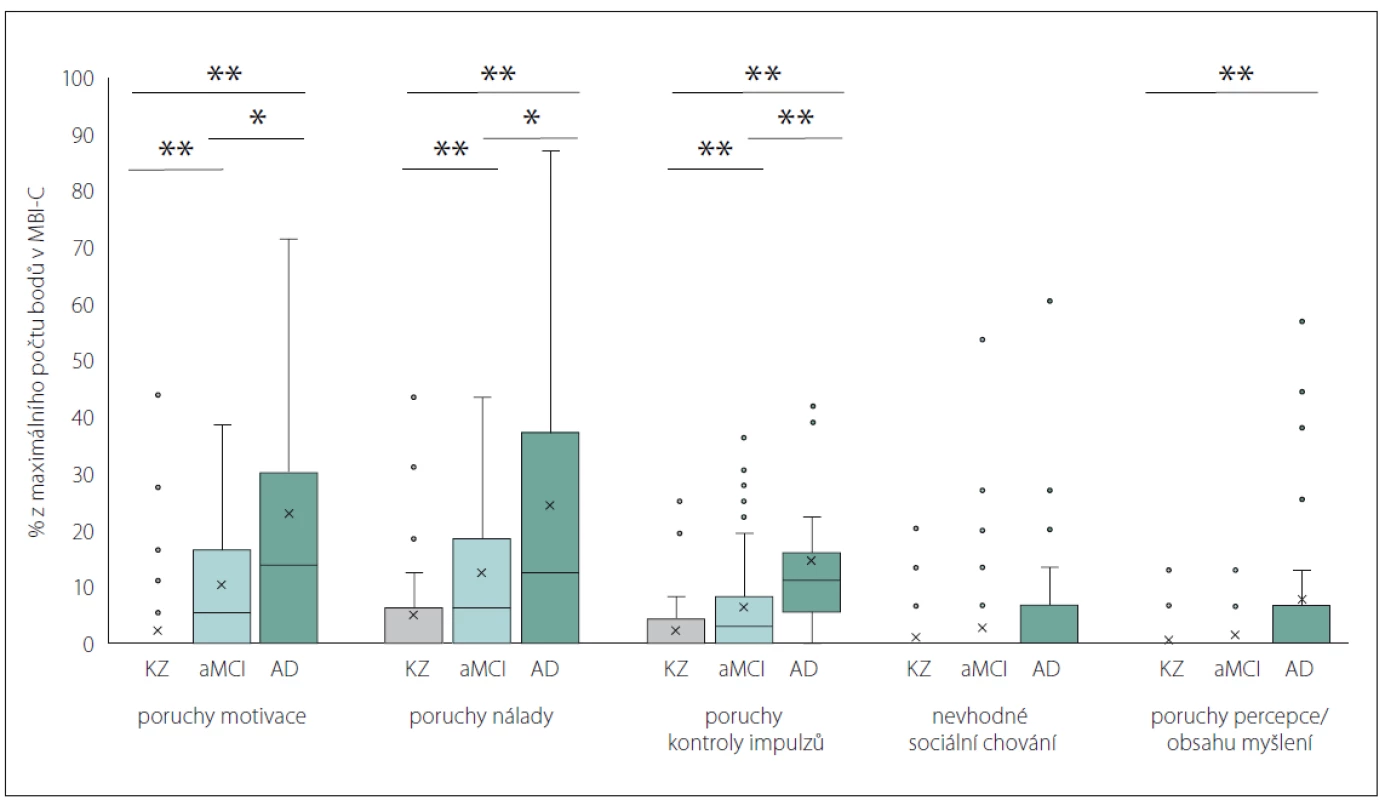
Korelace s dotazníky depresivní a úzkostné symptomatiky
Skóre v doméně poruch nálady pozitivně korelovalo se sebeposuzujícím dotazníkem depresivní symptomatologie GDS-15ve skupině KZ (Rho = 0,41; p = 0,001), aMCI (Rho = 0,41; p < 0,001) i ve skupině AD (Rho = 0,36; p = 0,047). Pozitivní korelace MBI-C s dotazníkem úzkosti BAI jsme rovněž pozorovali ve skupině KZ (Rho = 0,32; p = 0,007) a aMCI (Rho = 0,44; p < 0,001), ale ne ve skupině AD (Rho = 0,27; p = 0,17).
Diskuze
Představili jsme diagnostická kritéria MBI a námi adaptovanou českou verzi dotazníku MBI-C jako nový nástroj pro zachycení NPS v predementních stadiích. Dotazník vyplnily blízké osoby našich účastníků, především jejich partneři. Zjistili jsme, že MBI-C je schopen dobře detekovat přítomnost NPS v predementích stadiích. Rozdíly byly patrné nejenom v doméně poruch motivace a nálady, ale i v doméně kontroly impulzů.
Dle našeho očekávání se celkové skóre v dotazníku zvyšovalo napříč skupinami se vzrůstajícím kognitivním deficitem. Tyto výsledky jsou konzistentní se zjištěním klinických [48] i populačních studií [12,49], i když ty používaly ke zkoumání prevalence zejména Neuropsychiatrický inventář (NPI) jako zlatý standard měření NPS.
Námi zjištěná přítomnost a závažnost NPS hodnocena MBI-C u aMCI je ve shodě s nedávným zjištěním [41]. Ve skupině KZ jsme však pozorovali značně velký rozsah celkových skórů MBI-C, který může být způsoben sloučením zdravých dobrovolníků a osob s SCD. I když u SCD není přítomen objektivní kognitivní deficit, příznaky úzkosti a deprese jsou u nich častější než u kognitivně zdravých osob bez stížností [50]. Je ale důležité poznamenat, že NPS se vyskytují i u zdravého stárnutí a jejich prevalence a závažnost nejsou doposud dobře prozkoumány.
Rozdíly mezi KZ a aMCI byly nejvíce patrné v doménách poruch motivace, nálady a kontroly impulzů. Obdobné výsledky byly publikovány v běžné populaci při použití NPI [49]. U klinické populace se nálezy různí, dle NPI se objevily rozdíly mezi SCD a MCI pouze v poruchách motivace a nálady [48]. V poslední době se ukazuje, že nově vzniklé poruchy nálady jako deprese či úzkost a poruchy motivace zvyšují riziko rozvoje kognitivního deficitu a progrese do demence [17,19,26,27]. Naproti tomu doména kontroly impulzů je poměrně heterogenní doménou a napříč studiemi je zkoumána nejednotně. Symptomy agitovanosti či impulzivity, které jsou její součástí, jsou však také častou nekognitivní prezentací v časných stadiích AN [14,48], přítomnost agitovanosti zvyšuje riziko progrese z MCI do demence [22]. V naší studii se u aMCI nejčastěji vyskytovaly podrážděnost (33 %), netrpělivost (31 %), tvrdohlavost/ rigidita myšlení (32 %) a hádavost (26 %). Naproti tomu u KZ jsme pozorovali hlavně symptomy podrážděnosti a netrpělivosti, oproti aMCI však v mnohem menším zastoupení (13 a 17 %).
V doménách nevhodného sociálního chování a poruchách percepce a obsahu myšlení se skóre KZ a aMCI nelišilo. Nejedná se o překvapivý výsledek, protože poruchy sociálního chování jsou časným příznakem zejména frontotemporální demence [7,15], která byla vylučujícím kritériem v naší studii. U časných stadií AN je toto chování vzácné [11,15]. Rovněž bludy a halucinace bývají častěji spojovány s prodromálními stadii onemocnění s Lewyho tělísky [16]. U AN se obvykle vyskytují zejména v pozdějších stadiích demence, přičemž bludy často předchází halucinace [10,14]. Poruchy percepce a obsahu myšlení byly u naší skupiny AD častější než u KZ, a to zejména v položkách popisujících bludy; mezi skupinami aMCI a AD jsme naopak rozdíly nezaznamenali. Nutno však zmínit, že naše studie zahrnovala pouze pacienty ve stadiu lehké demence. Pacienti ve stadiu středně těžké a těžké demence nebyli do této studie zařazeni.
Doména poruch nálady v MBI-C středně silně korelovala se sebeposuzujícími škálami depresivní (GDS-15) a úzkostné symptomatiky (BAI) u KZ a aMCI, což podporuje její validitu u těchto skupin.
Výsledky této studie je nutné interpretovat v kontextu jejích silných stránek i limitací. Silnou stránkou studie je podrobně vyšetřený soubor pacientů i kognitivně zdravých osob. Vyšetření zahrnovalo komplexní neuropsychologické, neurologické vyšetření i neurozobrazovací metody. Jedná se o jednu z prvních studií srovnávající pomocí MBI-C úroveň NPS mezi osobami s demencí, aMCI a normální kognicí. Za limit studie považujeme nerovnoměrný počet osob napříč skupinami. I navzdory nižšímu počtu jsme však byli schopni najít statisticky významné rozdíly srovnatelné s podobnými studiemi. Nutno také uvést, že pouhé hodnocení přítomnosti počtu a závažnosti NPS pomocí MBI-C neumožňuje stanovit, kolik lidí ze souboru osob bez demence splnilo kritéria MBI.
Co se týče samotného dotazníku, jeho výhodou oproti nejpoužívanějšímu NPI je delší posuzovaný časový úsek trvání symptomů (6 vs. 1 měsíc), což umožňuje vyloučit přechodná narušení, a tedy s větší pravděpodobností detekovat prodromální stadium demence [31].
Závěr
Námi adaptovaná česká verze dotazníku MBI-C detekuje přítomnost změn v chování a osobnosti ještě před rozvojem syndromu demence. Dotazník je zároveň krátký a jednoduše administrovatelný i bez přítomnosti klinika. Z těchto důvodů se ukazuje jako slibný nástroj pro použití při podezření na přítomnost NPS u pacientů v preklinických a prodromálních stadiích AN. Jeho validace vůči zlatému standardu je cílem budoucích studií.
Pro klinickou praxi je dotazník MBI-C aktuálně volně dostupný ke stažení na oficiální stránce www.mbitest.org [51].
Etické principy
Studie byla provedena v souladu s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008) a etickými standardy Etické komise 2. LF UK a FN Motol. Všichni účastníci podepsali informovaný souhlas schválený Etickou komisí 2. LF UK a FN Motol č. rozhodnutí: EK-701/16.
Grantová podpora
Výzkum byl podpořen projektem č. LQ1605 z Národního programu udržitelnosti II (MŠMT), MZ ČR – RVO, FN v Motole 00064203, IPE 2. LF UK No. 699012, projektem GA UK No. 692818 a projektem AZV – 16-27611A.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 31. 7. 2019
Přijato do tisku: 4. 12. 2019
MUDr. Martin Vyhnálek, Ph.D.
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: martin.vyhnalek@fnmotol.cz
Zdroje
1. Petersen RC. Mild cognitive impairment as a diagnostic entity. J Intern Med 2004; 256(3): 183 – 194. doi: 10.1111/ j.1365-2796.2004.01388.x.
2. Albert MS, DeKosky ST, Dickson D et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7(3): 270 – 279. doi: 10.1016/ j.jalz.2011.03.008.
3. Dubois B, Hampel H, Feldman HH et al. Preclinical Alzheimer’s disease: definition, natural history, and diagnostic criteria. Alzheimers Dement 2016; 12(3): 292 – 323. doi: 10.1016/ j.jalz.2016.02.002.
4. Markova H, Andel R, Stepankova H et al. Subjective Cognitive complaints in cognitively healthy older adults and their relationship to cognitive performance and depressive symptoms. J Alzheimers Dis 2017; 59(3): 871 – 881. doi: 10.3233/ JAD-160970.
5. Jessen F, Amariglio RE, van Boxtel M et al. A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer’s disease. Alzheimers Dement 2014; 10(6): 844 – 852. doi: 10.1016/ j.jalz.2014.01.001.
6. McKhann GM, Knopman DS, Chertkow H et al. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diag-nostic guidelines for Alzheimer’s disease. Alzheimers Dement J Alzheimers Assoc 2011; 7(3): 263 – 269. doi: 10.1016/ j.jalz.2011.03.005.
7. Rascovsky K, Hodges JR, Knopman D et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain J Neurol 2011; 134(Pt 9): 2456 – 2477. doi: 10.1093/ brain/ awr179.
8. McKeith IG, Boeve BF, Dickson DW et al. Diagnosis and management of dementia with Lewy bodies: fourth consensus report of the DLB Consortium. Neurology 2017; 89(1): 88 – 100. doi: 10.1212/ WNL.0000000000004058.
9. Ressner P, Hort J, Rektorová I et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/ 104(4): 494 – 501.
10. Cerejeira J, Lagarto L, Mukaetova-Ladinska EB. Behavioral and psychological symptoms of dementia. Front Neurol 2012; 3 : 73. doi: 10.3389/ fneur.2012.00073.
11. Apostolova LG, Cummings JL. Neuropsychiatric manifestations in mild cognitive impairment: a systematic review of the literature. Dement Geriatr Cogn Disord 2008; 25(2): 115 – 126. doi: 10.1159/ 000112509.
12. Geda YE, Roberts RO, Knopman DS et al. Prevalence of neuropsychiatric symptoms in mild cognitive impairment and normal cognitive aging: population-based study. Arch Gen Psychiatry 2008; 65(10): 1193 – 1198. doi: 10.1001/ archpsyc.65.10.1193.
13. Okura T, Plassman BL, Steffens DC et al. Prevalence of neuropsychiatric symptoms and their association with functional limitations in older adults in the United States: the aging, demographics, and memory study. J Am Geriatr Soc 2010; 58(2): 330 – 337. doi: 10.1111/ j.1532-5415.2009.02680.x.
14. Gallagher D, Fischer CE, Iaboni A. Neuropsychiatric symptoms in mild cognitive impairment. Can J Psychiatry Rev Can Psychiatr 2017; 62(3): 161 – 169. doi: 10.1177/ 0706743716648296.
15. Desmarais P, Lanctôt KL, Masellis M et al. Social inappropriateness in neurodegenerative disorders. Int Psychogeriatr 2018; 30(2): 197 – 207. doi: 10.1017/ S10416102 17001260.
16. Fischer CE, Agüera-Ortiz L. Psychosis and dementia: risk factor, prodrome, or cause? Int Psychogeriatr 2018; 30(2): 209 – 219. doi: 10.1017/ S1041610217000874.
17. Ismail Z, Gatchel J, Bateman DR et al. Affective and emotional dysregulation as pre-dementia risk markers: exploring the mild behavioral impairment symptoms of depression, anxiety, irritability, and euphoria. Int Psychogeriatr 2018; 30(2): 185 – 196. doi: 10.1017/ S1041610217001880
18. Krell-Roesch J, Lowe VJ, Neureiter J et al. Depressive and anxiety symptoms and cortical amyloid deposition among cognitively normal elderly persons: the Mayo Clinic Study of Aging. Int Psychogeriatr 2018; 30(2): 245 – 251. doi: 10.1017/ S1041610217002368.
19. Sherman C, Liu CS, Herrmann N et al. Prevalence, neurobiology, and treatments for apathy in prodromal dementia. Int Psychogeriatr 2018; 30(2): 177 – 184. doi: 10.1017/ S1041610217000527.
20. Geda YE, Roberts RO, Mielke MM et al. Baseline neuropsychiatric symptoms and the risk of incident mild cognitive impairment: a population-based study. Am J Psychiatry 2014; 171(5): 572 – 581. doi: 10.1176/ appi.ajp.2014.13060821.
21. Donovan NJ, Amariglio RE, Zoller AS et al. Subjective cognitive concerns and neuropsychiatric predictors of progression to the early clinical stages of Alzheimer disease. Am J Geriatr Psychiatry 2014; 22(12): 1642 – 1651. doi: 10.1016/ j.jagp.2014.02.007.
22. Pink A, Stokin GB, Bartley MM et al. Neuropsychiatric symptoms, APOE ε4, and the risk of incident dementia: a population-based study. Neurology 2015; 84(9): 935 – 943. doi: 10.1212/ WNL.0000000000001307.
23. Wise EA, Rosenberg PB, Lyketsos CG et al. Time course of neuropsychiatric symptoms and cognitive diag-nosis in National Alzheimer’s Coordinating Centers volunteers. Alzheimers Dement (Amst) 2019; 11 : 333 – 339. doi: 10.1016/ j.dadm.2019.02.006.
24. Rosenberg PB, Mielke MM, Appleby BS et al. The association of neuropsychiatric symptoms in MCI with incident dementia and Alzheimer disease. Am J Geriatr Psychiatry Off J Am Assoc Geriatr Psychiatry 2013; 21(7): 685 – 695. doi: 10.1016/ j.jagp.2013.01.006.
25. Sugarman MA, Alosco ML, Tripodis Y et al. Neuropsychiatric symptoms and the diagnostic stability of mild cognitive impairment. J Alzheimers Dis 2018; 62(4): 1841 – 1855. doi: 10.3233/ JAD-170527.
26. Singh-Manoux A, Dugravot A, Fournier A et al. Trajectories of depressive symptoms before diagnosis of dementia. JAMA Psychiatry 2017; 74(7): 712 – 718. doi: 10.1001/ jamapsychiatry.2017.0660.
27. Steenland K, Karnes C, Seals R et al. Late-life depression as a risk factor for mild cognitive impairment or Alzheimer’s disease in 30 US Alzheimer’s disease centers. J Alzheimers Dis 2012; 31(2): 265 – 275. doi: 10.3233/ JAD-2012-111922.
28. Tapiainen V, Hartikainen S, Taipale H et al. Hospital-treated mental and behavioral disorders and risk of Alzheimer’s disease: a nationwide nested case-control study. Eur Psychiatry 2017; 43 : 92 – 98. doi: 10.1016/ j.eurpsy.2017.02.486.
29. Andrews SJ, Ismail Z, Anstey KJ et al. Association of Alzheimer’s genetic loci with mild behavioral impairment. Am J Med Genet Part B Neuropsychiatr Genet 2018; 177(8): 727 – 735. doi: 10.1002/ ajmg.b.32684.
30. Woolley JD, Khan BK, Murthy NK et al. The diagnostic challenge of psychiatric symptoms in neurodegenerative disease: rates of and risk factors for prior psychiatric diagnosis in patients with early neurodegenerative disease. J Clin Psychiatry 2011; 72(2): 126 – 133. doi: 10.4088/ JCP.10m06382oli.
31. Ismail Z, Smith EE, Geda Y et al. Neuropsychiatric symptoms as early manifestations of emergent dementia: Provisional diagnostic criteria for mild behavioral impairment. Alzheimers Dement J Alzheimers Assoc 2016; 12(2): 195 – 202. doi: 10.1016/ j.jalz.2015.05.017.
32. Taragano F, Allegri R, Krupitzki H et al. Mild behavioral impairment and risk of dementia. J Clin Psychiatry 2009; 70(4): 584 – 592. doi: 10.4088/ jcp.08m04181.
33. Cummings JL. The Neuropsychiatric Inventory: assessing psychopathology in dementia patients. Neurology 1997; 48 (5 Suppl 6): S10 – S16. doi: 10.1212/ wnl.48.5_suppl_6.10s.
34. Kaufer DI, Cummings JL, Ketchel P et al. Validation of the NPI-Q, a brief clinical form of the Neuropsychiatric Inventory. J Neuropsychiatry Clin Neurosci 2000; 12(2): 233 – 239. doi: 10.1176/ jnp.12.2.233.
35. de Medeiros K, Robert P, Gauthier S et al. The Neuropsychiatric Inventory-Clinician rating scale (NPI-C): reliability and validity of a revised assessment of neuropsychiatric symptoms in dementia. Int Psychogeriatr 2010; 22(6): 984 – 994. doi: 10.1017/ S1041610210000876.
36. Beck AT, Steer RA, Ball R et al. Comparison of Beck Depression Inventories -IA and -II in psychiatric outpatients. J Pers Assess 1996; 67(3): 588 – 597. doi: 10.1207/ s15327752jpa6703_13.
37. Sheikh JI, Yesavage JA. Geriatric Depression Scale (GDS): recent evidence and development of a shorter version. Clin Gerontol J Aging Ment Health 1986; 5(1 – 2): 165 – 173. doi: 10.1300/ J018v05n01_09.
38. Beck AT, Epstein N, Brown G et al. An inventory for measuring clinical anxiety: psychometric properties. J Consult Clin Psychol 1988; 56(6): 893 – 897. doi: 10.1037/ / 0022-006x.56.6.893.
39. The State-Trait Anxiety Inventory (STAI). [online]. Available from URL: https:/ / www.apa.org/ pi/ about/ publications/ caregivers/ practice-settings/ assessment/ tools/ trait-state.
40. Ismail Z, Agüera-Ortiz L, Brodaty H et al. The Mild Behavioral Impairment Checklist (MBI-C): a rating scale for neuropsychiatric symptoms in pre-dementia populations. J Alzheimers Dis 2017; 56(3): 929 – 938. doi: 10.3233/ JAD-160979.
41. Mallo SC, Ismail Z, Pereiro AX et al. Assessing mild behavioral impairment with the mild behavioral impairment-checklist in people with mild cognitive impairment. J Alzheimers Dis 2018; 66(1): 83 – 95. doi: 10.3233/ JAD-180131.
42. Mallo SC, Ismail Z, Pereiro AX et al. Assessing mild behavioral impairment with the mild behavioral impairment checklist in people with subjective cognitive decline. Int Psychogeriatr 2019; 31(2): 231 – 239. doi: 10.1017/ S1041610218000698.
43. Štěpánková H, Nikolai T, Lukavský J et al. Mini‑Mental State Examination – česká normativní studie. Cesk Slov Neurol N 2015; 78/ 111(1): 57 – 63.
44. Nikolai T, Stepankova H, Kopecek M et al. The uniform data set, Czech version: normative data in older adults from an international perspective. J Alzheimers Dis 2018; 61(3): 1233 – 1240. doi: 10.3233/ JAD-170595.
45. Nikolai T, Štěpánková H, Michalec J et al. Testy verbální fluence, česká normativní studie pro osoby vyššího věku. Cesk Slov Neurol N 2015; 78/ 111(3): 292 – 299. doi: 10.14735/ amcsnn2015292.
46. Bezdicek O, Stepankova H, Moták L et al. Czech version of Rey Auditory Verbal Learning test: normative data. Neuropsychol Dev Cogn B Aging Neuropsychol Cogn 2014; 21(6): 693 – 721. doi: 10.1080/ 13825585.2013.865699.
47. Drozdová K, Štěpánková H, Lukavský J et al. Normativní studie testu Reyovy-Osterriethovy komplexní figury v populaci českých seniorů. Cesk Slov Neurol N 2015; 78/ 111(5): 542 – 549.
48. Sheikh F, Ismail Z, Mortby ME et al. Prevalence of mild behavioral impairment in mild cognitive impairment and subjective cognitive decline, and its association with caregiver burden. Int Psychogeriatr 2018; 30(2): 233 – 244. doi: 10.1017/ S104161021700151X.
49. Mortby ME, Ismail Z, Anstey KJ. Prevalence estimates of mild behavioral impairment in a population-based sample of pre-dementia states and cognitively healthy older adults. Int Psychogeriatr 2018; 30(2): 221 – 232. doi: 10.1017/ S1041610217001909.
50. Hill NL, Mogle J, Wion R et al. Subjective cognitive impairment and affective symptoms: a systematic review. Gerontologist 2016; 56(6): e109 – e127. doi: 10.1093/ geront/ gnw091
51. MBItest. [online]. Available from URL: https:/ / mbitest.org/ .
Štítky
Dětská neurologie Neurochirurgie Neurologie Psychiatrie
Článek EditorialČlánek Poděkování recenzentůmČlánek Analýza dat v neurologiiČlánek Recenze monografieČlánek Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Randomizovaná kontrolovaná studie efektu terapie poruch rovnováhy s využitím audiovizuální zpětné vazby u seniorů
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Analýza dat v neurologii
- Vzpomínka na prof. Pavla Petrovického
- Prof. MUDr. Rudolf Malec, CSc. (1924–2019)
- Recenze monografie
- Kognitivní rehabilitace pacientů s Parkinsonovou nemocí
- Homeostáza mědi jako terapeutický cíl u amyotrofické laterální sklerózy s mutací superoxiddismutázy 1 a sloučenina CuATSM
- Možnosti prevence Alzheimerovy choroby
- Editorial
- Dominantní (Kjerova) atrofie optiku asociovaná s mutacemi v OPA1 genu
- Metodologie měření kognitivního deficitu u depresivní poruchy
- Novorozenecké záchvaty – současný pohled na problematiku
- Polysomnografické nálezy u osob nad 50 let bez subjektivních příznaků poruch spánku
- Poděkování recenzentům
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
- Choroidální tloušťka u asymptomatických pacientů se stenózou karotidy
- Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
- Role zánětu v etiopatogenezi farmakorezistentní epilepsie a refrakterního status epilepticus
- Charakteristika aterosklerotického plátu a riziko mozkové ischemie při stentování vnitřní karotidy
- Komorbidity Alzheimerovej choroby – výsledky multicentrickej prierezovej observačnej štúdie COSMOS v Slovenskej republike
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Novorozenecké záchvaty – současný pohled na problematiku
- Možnosti prevence Alzheimerovy choroby
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



