-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti prevence Alzheimerovy choroby
Possible prevention of Alzheimer’s disease
The 21st century is referred to as a century of degenerative diseases, particularly neurodegeneration. Alzheimer’s disease (AD), as the most common form of dementia, accounts for as many as 75% of cases, and represents a serious public health issue. Since AD is a multifactorial disease of unknown etiology, it is essential to focus on possible risk factors and their prevention. This paper provides a comprehensive overview of different ways of preventing AD. Knowing the preventive measures may aid in controlling the development and progression of AD.
Keywords:
dementia – Epidemiology – risk factors – prevention – Alzheimer´s disease
Autoři: J. Janoutová 1,2; M. Kovalová 1; P. Ambroz 1; O. Machaczka 1; A. Zatloukalová 1; K. Němček 1; E. Mrázková 1; O. Košta 1; D. Školoudík 2; V. Janout 1,2
Působiště autorů: Ústav epidemiologie a ochrany veřejného zdraví, LF OU, Ostrava 1; Centrum vědy a výzkumu, Fakulta zdravotnických věd, UP v Olomouci 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83(1): 28-32
Kategorie: Přehledný referát
doi: https://doi.org/10.14735/amcsnn202028Dvacáté první století je označováno jako století degenerativních onemocnění, zejména neurodegenerace. Alzheimerova choroba (ACH) jako nejčastější forma demence, s podílem až 75 %, představuje závažný problém veřejného zdravotnictví. Vzhledem k tomu, že ACH je multifaktoriální onemocnění, jehož etiologie je stále neznámá, je potřeba zaměřit se na možné rizikové faktory a jejich prevenci. Práce předkládá v uceleném přehledu možnosti prevence ACH dle jednotlivých druhů prevence. Znalost preventivních opatření může pomoci nástup a průběh ACH ovlivnit.
Souhrn
Dvacáté první století je označováno jako století degenerativních onemocnění, zejména neurodegenerace. Alzheimerova choroba (ACH) jako nejčastější forma demence, s podílem až 75 %, představuje závažný problém veřejného zdravotnictví. Vzhledem k tomu, že ACH je multifaktoriální onemocnění, jehož etiologie je stále neznámá, je potřeba zaměřit se na možné rizikové faktory a jejich prevenci. Práce předkládá v uceleném přehledu možnosti prevence ACH dle jednotlivých druhů prevence. Znalost preventivních opatření může pomoci nástup a průběh ACH ovlivnit.
Klíčová slova:
demence – Alzheimerova choroba – rizikové faktory – epidemiologie – prevence
Úvod
Současný demografický vývoj světové populace charakterizovaný prodlužováním věku dožití a stárnutím populace je doprovázen problémy v oblasti veřejného zdravotnictví. Dvacáté první století je označováno jako století degenerativních onemocnění, zejména neurodegenerace, vč. výskytu demence. Nejčastější formu demence, uvádí se až 75 %, představuje Alzheimerova choroba (ACH). Toto onemocnění má již dnes značný veřejně zdravotnický dopad. Očekává se, že se tato situace bude zhoršovat s dalším stárnutím populace na celém světě. World Alzheimer Association ve své zprávě z roku 2015 na základě systematických přehledových studií uvádí, že v roce 2015 žilo na světě 46,8 milionů lidí s demencí. Je předpoklad, že se tento počet každých příštích 20 let téměř zdvojnásobí. Očekává se, že v roce 2050 to bude 131,5 milionu osob [1].
I přes intenzivní výzkum stále není zcela objasněn primární impulz, který tuto patologii způsobuje, což výrazně snižuje šanci na vývoj účinné terapie. Navíc první klinické příznaky se objevují u pacientů až po mnoha letech neurodegenerace. Proto je celosvětově stále více patrná významná snaha vyvinout efektivní preventivní opatření, která by snížila riziko vzniku ACH [2 – 4].
Základními neuropatologickými nálezy u ACH jsou atrofie mozku (nejvýraznější mediální temporální struktury), zánik především hipokampálních a cerebrokortikálních neuronů, ztráta synapsí, tvorba beta amyloidu, formace amyloidových plaků, amyloidová angiopatie, degenerace tau-proteinu, tvorba tzv. tangles (neurofibrilární klubka), neuronální zánětlivé změny v mozku a nadměrná neuronální apoptóza [5,6].
Protože vztah mezi patogenezí ACH a kognicí není stále úplně jasný, je klíčovou otázkou, zda zaměřit primárně preventivní úsilí na prevenci změn v mozku nebo na prevenci kognitivní poruchy. Mnoho starších osob totiž zemře s intaktní kognicí, ale s patologickými známkami ACH v jejich mozku, nebo naopak [7,8].
Existují však důkazy o vztahu mezi numerickou atrofií neuronů, specifickými inkluzemi, postižením různých oblastí mozkové kůry a podkorových struktur a klinickými manifestacemi [9].
Nejčastější kognitivní poruchy ve starším věku mají pravděpodobně smíšenou etiologii. Způsobují je různé patologické procesy a jsou ovlivňovány různými rizikovými faktory, např. vaskulární demence (multiinfarktová a mikroangiopatická), demence při nádorech mozku, demence prionové etiologie (Creutzfeldt-Jakobova nemoc), traumatická demence, demence vznikající při infekcích, metabolické demence, toxické demence, demence při kolagenózách [10]. Smíšená etiologie demencí je na podkladě aterosklerózy. Neurodegenerativní a vaskulární léze mají synergní úlohu v rozvoji kognitivní poruchy a demence. Ateroskleróza signifikantně ovlivňuje pokles kognitivních funkcí a výrazně zvyšuje riziko rozvoje demence [11,12]. Z těchto důvodů se zdá, že kombinovaná multidoménová preventivní intervence cílená na více rizikových faktorů by mohla mít největší efekt [7].
Zaměření prevence se u ACH řídí předpokládanými rizikovými faktory, které je možno rozdělit do několika skupin. První skupinu tvoří neovlivnitelné rizikové faktory, kterými jsou především vyšší věk, ženské pohlaví a genetická predispozice jedince. Druhou skupinu tvoří vaskulární rizikové faktory [13 – 15], a to především obezita, hypercholesterolemie, hyperhomocysteinemie, diabetes mellitus (DM), kardiovaskulární (KVN) a cerebrovaskulární onemocnění, arteriální hypertenze (AH) a faktory životního stylu, jako jsou kouření, nadměrná konzumace alkoholu, nízká pohybová aktivita nebo výživa. Psychosociální rizikové faktory tvoří další skupinu [16,17]. Zde se jedná např. o nižší vzdělání a socioekonomickou úroveň, slabou sociální síť a sociální angažovanost nebo nízkou tělesnou a duševní aktivitu.
Čtvrtou skupinu tvoří genetické faktory [18], kde se prokázalo spojení zvýšeného rizika vzniku ACH s přítomností genů pro amyloidní proteinový prekurzor, PSEN1, PSEN2 u časné formy ACH nebo genu ApoE4 a dalších kandidátních genů u pozdní formy ACH.
Poslední skupinu pak tvoří vývojové faktory, stresové zážitky v časné fázi života, deprese, psychické strádání, poranění mozku, nedostatek spánku a infekce – herpetické viry, chlamydie, spirochety [19 – 24].
Prevence ACH zahrnuje všechny přístupy prevence. Úkolem primární prevence je zabránit vzniku onemocnění, a proto bude primární prevence ACH cílit především na vaskulární, psychosociální a genetické faktory, které jsou nebo budou známy. Úkolem sekundární prevence je včasná diagnostika nemoci a zabránění jejího dalšího rozvoje. Proto je důležitá včasná diagnostika demence a rozlišení jejích druhů. Úkolem terciární prevence je zabránit komplikacím nemoci, imobilitě pacienta a jeho invalidizaci. To souvisí s rodinnou i institucionální péčí o nemocného s ACH.
Primární prevence
Alzheimerova choroba je multifaktoriální onemocnění, jehož etiopatogeneze není stále zcela vyjasněna. Většina vaskulárních a psychosociálních faktorů, vč. faktorů životního stylu, je velmi dobře známá. Tyto faktory jsou modifikovatelné a velmi často dobře preventabilní. V tab. 1 je uveden orientační přehled rizikových faktorů u ACH.
Tab. 1. Rizikové faktory Alzheimerovy choroby – orientační hodnocení jejich závažnosti a možnosti ovlivnění. 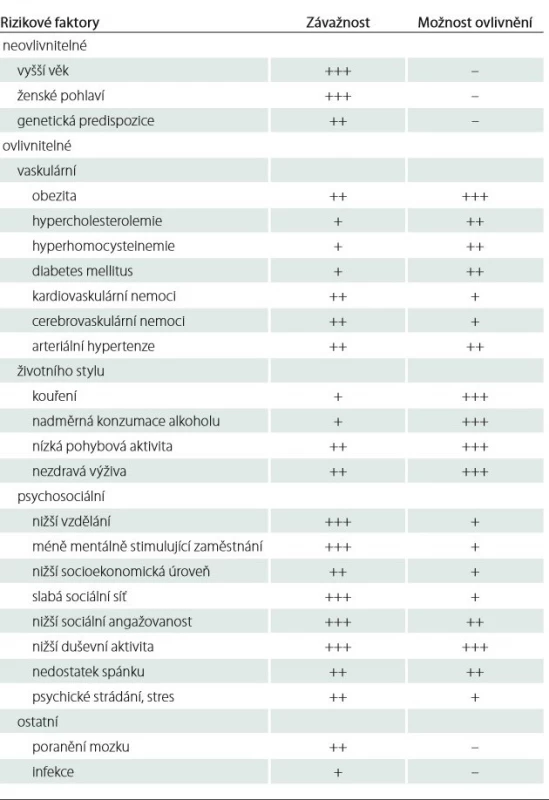
V rámci primární prevence lze uplatnit širokou škálu opatření, která mohou nástup a průběh nemoci ovlivnit. V oblasti vaskulárních rizikových faktorů by měla být prevence zaměřena především na hlavní rizika, jako jsou AH, DM, a to zejména ve středním věku, KVN a cerebrovaskulární onemocnění. Hlavním nástrojem je úprava životosprávy. V úpravě stravovacích návyků se doporučuje tzv. středozemní dieta, která zahrnuje vysoký příjem cereálií, ovoce, ryb, luštěnin a zeleniny a je spojena se snížením rizika výše uvedených chorob a celkové mortality [14,25,26]. Diskutabilní je vliv mírné konzumace alkoholu, který je obecně považován za rizikový faktor a toxický pro mozek. Na druhé straně u mírných konzumentů zejména vína (přítomnost resveratrolu) může mít alkohol spíše protektivní efekt na rozdíl od abstinentů nebo výrazných konzumentů [27]. Se správnou životosprávou úzce souvisí také dostatečná a vhodná pohybová aktivita. V řadě studií byl prokázán úbytek kognice v souvislosti s nízkou pohybovou aktivitou [28]. Některé studie však nebyly tak průkazné [29]. Dále by měla být součástí preventivních opatření snaha o nekuřáctví a omezení užívání jiných návykových látek.
Primární prevence v oblasti psychosociálních faktorů je zaměřena na individuální vzdělávání, udržování kondice paměti četbou, hrami, luštěním křížovek, kulturními aktivitami apod. Důležité jsou také aktivní pobyt mezi lidmi, udržování kontaktů a sociálních vazeb s přáteli, rodinou [16,17]. Prevence zaměřená na extenzivní sociální síť by měla zahrnovat kvalitní služby, kvalitní a dostupnou zdravotní a sociální péči, kvalitní a dostupné pečovatelské služby.
K nezbytným předpokladům účinné prevence ACH patří vzdělávání a informovanost veřejnosti o této problematice a podpora kvalitního výzkum v této oblasti. Také včasná diagnóza demence ve stadiu mírného kognitivního deficitu či počínající demence je základním předpokladem pro včasné zahájení léčby a uplatňování některých preventivních opatření s cílem udržení co nejlepší kvality života nemocného a jeho rodiny [2,26,30].
Vakcinace
Nedílnou součástí primární prevence u řady především infekčních chorob je očkování. Už více než 10 let se v odborném světě diskutuje o možnosti vakcinace i u ACH, i když se v tomto případě jedná spíše o imunoterapii [31], protože při klasické vakcinaci je aplikován antigen a v odpovědi na něj organizmus tvoří protilátky. Imunoterapie nebo biologická léčba využívá imunitu organizmu a její oslabení nebo posílení k léčbě nemocí. Např. při genové terapii jsou do mozku pacientů vpraveny geneticky upravené buňky vlastních tkání, které produkují tzv. nervový růstový faktor. Díky tomu rychlost rozvoje demence u pacientů klesá o polovinu, zatímco současné léky dovedou zpomalit postup demence jen o 5 %. Do pojmu imunoterapie spadají i klasické humánní imunologické léčivé přípravky, jako jsou vakcíny, toxiny nebo séra.
Cílem vakcinace u ACH je ovlivnění patologických depozit vznikajících z přirozených proteinů. Informace o očkování proti beta amyloidu je k dispozici řadu let. Již ve studii z roku 2001 autoři prokázali, že imunizace myší vakcínou Abeta42 omezila hromadění senilních plak v CNS [32]. Stejný účinek měla i protilátka proti Abeta42 aplikovaná intravenózně. Nicméně řada dalších pokusů s očkováním proti beta amyloidu sice odstranila patologické plaky této bílkoviny, ale neměla léčebný účinek [33]. Navíc Cribbs et al informovali o zastavení prvního klinického pokusu s vakcínou AN1792 u pacientů s ACH pro rozvoj aseptické meningoencefalitidy u části pacientů (6 %) [34].
Proto se zájem výzkumu přesunul na tau protein. První pokusy na myších proběhly v roce 2007 a v letech 2013 – 2015 bylo v Rakousku na čtyřech klinických pracovištích vakcínou firmy AXON Neuroscience (Bratislava, Slovensko) AADvac1 ve studii 1. fáze očkováno 30 osob s ACH. Vakcína se ukázala jako bezpečná a u 29 osob vyvolala mohutnou imunitní odpověď s geometrickým průměrem titrů imunoglobulinů 1 : 31 415 [35]. Geometrické titry protilátek jsou počítány jako „n“tá odmocnina součinu „n“ hodnot vyšetření a udávají typickou hodnotu souboru čísel (vyšetření). Tato vakcína indukuje imunitní odpověď proti tau proteinu, který aglomerací tvoří neurofibrilární klubka v mozkových buňkách a narušuje tak normální funkci neuronů [35]. Tento fakt je považován za jeden z hlavních mechanizmů poruchy kognice u ACH. Na tento první klinický pokus navázala studie, ve které pacienti dostali dvě další booster dávky vakcíny AADvac1 a která ukázala schopnost vakcinace udržet imunitní odpověď po delší dobu. Současně bylo prokázáno, že tato vakcína je schopna cílit na společného jmenovatele, kterým je tau protein, i u jiných onemocnění než je ACH. Použití této vakcíny je v pilotní studii testováno také u primární progresivní afázie. Výsledky studie jsou očekávány v polovině roku 2020 [36].
Klinický pokus s vakcínou AADvac1 je ve 2. fázi realizován na 208 pacientech s počáteční fází ACH v 8 evropských zemích a na 44 klinických pracovištích od března 2016 do června 2019 pod názvem „ADAMANT“. Pacienti ve věku 50 – 85 let dostávají celkem 11 dávek vakcíny, 6 dávek ve 4týdenních intervalech a dále 5 jednotlivých booster dávek v 3měsíčních intervalech [37]. Primárním cílem studie je potvrzení bezpečnosti a tolerance dlouhodobého podávání vakcíny. Sekundárním výstupem je posouzení schopnosti vakcíny zastavit nebo zpomalit progresi kognitivního poklesu [36].
Perspektivou vakcinace u ACH v prevenci nebo inhibici progrese nemoci a kognitivního poklesu je zacílení jak na beta amyloid, tak i na tau protein. Tedy vytvořit dvě vakcíny, jednu proti beta amyloidu a druhou proti tau proteinu, nebo vyvinout duální vakcínu, která by cílila na oba patologické proteiny simultánně [38].
Sekundární prevence
Alzheimerova choroba je charakterizována dlouhou preklinickou fází, která probíhá řadu let. Uvádí se, že doba dožití od prvních příznaků choroby je až 20 let, doba dožití po stanovení diagnózy 4 – 6 let [39]. Prostor na prevenci je tedy dostatečně dlouhý, nicméně předpokladem je včasná identifikace rizikových faktorů a časná diagnostika odhalující preklinickou fázi onemocnění. Rozlišení prostého stárnutí, mírné kognitivní poruchy, která je často považována za prodromální stadium ACH, a ACH však není snadné.
Neurodegenerativní změny v mozku se obvykle postupně objevují ještě před počátkem typických klinických příznaků. Zde by bylo možné využít zobrazovací metody, např. MR nebo amyloidovou PET. Je možno také detekovat přítomnost biochemických markerů (např. beta amyloidu a tau proteinu v séru a mozkomíšním moku) a sledovat jejich dynamiku [40 – 43]. Biomarkery jsou součástí nových diagnostických kritérií National Institute on Aging – Alzheimer‘s Association (NIA-AA) pro ACH a likvorové biomarkery i amyloidová PET jsou dostupné v ČR ve vybraných centrech pro klinické užití a je stanovena jejich úhrada z veřejného zdravotního pojištění. Tyto metody jsou však pro svou náročnost a nákladnost využívány především pro výzkumné účely.
První informace o porušení kognitivních funkcí lze obvykle získat z pohovoru s pacientem, případně pohovorem s jeho blízkými. Při rozhovoru či odebírání anamnézy je možno si všimnout nepřesných či nelogických odpovědí, horší výbavnosti údajů, složitého popisování, chybění správných výrazů a dalších změn. Zde by měli svou roli plnit praktičtí lékaři. Další z možností diagnostiky časných příznaků ACH je skríningové použití neuropsychologických testů [44 – 49].
Genetické vyšetření, které by prokázalo přítomnost některého genu, který je významně asociován s ACH, je v současné době k dispozici na vybraných pracovištích a je věcí klinika nebo genetika, zda bude toto vyšetření indikovat [50]. V literatuře existuje řada dokladů z výzkumných studií o takové asociaci [51 – 54].
Terciární prevence
Terciární prevence u pacientů s ACH by se měla zabývat především zlepšením kvality života nemocného a jeho okolí. Jedná se o podporu soběstačnosti seniorů, poskytování služeb zajišťujících chod domácnosti, zprostředkování kontaktu se společenským životem, prosazování zájmů a práv seniorů [55].
Součástí terciární prevence může být i trénink kognitivních funkcí, jako jsou luštění křížovek, hraní společenských her, četba novin, časopisů a knížek, popřípadě využití speciálních počítačových programů. Celkově je důležité udržení aktivního životního stylu a sociálních aktivit jak v domácnosti, tak v zařízeních pro seniory [16,17,56].
Závěr
Na základě epidemiologických studií, genetických studií, zobrazovacích metod a neuropatologického výzkumu byly definovány tři skupiny rizikových faktorů pro vznik ACH:
vaskulární – rizikové faktory, jako jsou kouření, obezita a vysoké hodnoty celkového cholesterolu, spolu s nemocemi na vaskulárním podkladu, jako jsou AH, DM a asymptomatické mozkové infarkty, jsou spojeny s vyšším rizikem vzniku demence vč. ACH;
psychosociální – psychosociální faktory a pasivní životní styl, nižší úroveň vzdělání, horší socioekonomické podmínky, nízká pohybová a duševní aktivita mohou zvýšit riziko vzniku ACH;
genetické – genetické rizikové faktory jsou v poslední době intenzivně studovány a jejich přítomnost by v budoucnu mohla být využita k vyhledávání rizikových osob před rozvojem nebo v časné fázi rozvoje ACH.
Přestože etiologické faktory vzniku ACH nejsou ještě známy, je již dnes možná primární prevence tohoto onemocnění, jelikož většina výše uvedených vaskulárních a psychosociálních rizikových faktorů, vč. faktorů životního stylu, je modifikovatelná. Proto jsou tyto metody prevence, vč. pokroku u vakcinace, jedním z nástrojů, kterými lze nastávající celosvětovou pandemii neurodegenerativních onemocnění, vč. ACH, výrazně zpomalit.
Grantová podpora
Podpořeno z programového projektu MZ ČR s reg. č. 16 – 31207A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 9. 1. 2019
Přijato do tisku: 10. 12. 2019
doc. MUDr. Jana Janoutová, Ph.D.
Ústav zdravotnického managementu
Fakulta zdravotnických věd
UP Olomouc
Hněvotínská 976/3, Nová Ulice
775 15 Olomouc
e-mail: jana.janoutova@upol.cz
Zdroje
1. Alzheimer’s disease International. World Alzheimer Report 2015. [online]. Available from URL: http:/ / www.alz.co.uk/ sites/ default/ files/ pdfs/ World-Report-2015.
2. Koncepce Alzheimer. Ministerstvo zdravotnictví. [online]. Dostupné z URL: https:/ / www.mzcr.cz/ dokumenty/ definitivni-navrh-koncepce-alzheimer_12998_3216_1.html.
3. Höschl C et al. Alzheimerova choroba. Praha: Galén 1999 : 96.
4. Scheltens P, Blennow K, Breteler MM et al. Alzheimer‘s disease. Lancet 2016; 388(10043): 505 – 517. doi: 10.1016/ S0140-6736(15)01124-1.
5. Smith GE, Bondi MW. Mild cognitive impairment and dementia. Definition, diagnosis and treatment. American Academy of Clinical Neuropsychology. Oxford University Press 2013.
6. Kalvach P, Kupka K, Vogner M, Je amyloid podstatný pro senilní demenci? Cesk Slov Neurol N 2018; 81/ 114(2): 164 – 170. doi: 10.14735/ amcsnn2018csnn.eu1.
7. Solomon A, Mangialasche F, Richard E et al. Advances in the prevention of Alzheimer‘s disease and dementia. J Intern Med 2014; 275(3): 229 – 250. doi: 10.1111/ joim.12178.
8. Šilhán D, Ibrahim I, Tintěra J et al. Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem. Cesk Slov Neurol N 2019; 82/ 115(1): 91 – 95. doi: 10.14735/ amcsnn201991.
9. Elahi FM, Miller BL. A clinicopathological approach to the diagnosis of dementia. Nat Rev Neurol 2017; 13(8): 457 – 476. doi: 10.1038/ nrneurol.2017.96.
10. Jirák R, Holmerová I, Borzová C et al. Demence a jiné poruchy paměti: komunikace a každodenní péče. Praha: Grada Publishing 2009.
11. Wendell CR, Waldstein SR, Ferrucci L et al. Carotid atherosclerosis and prospective risk of dementia. Stroke 2012; 43(12): 3319 – 3324. doi: 10.1161/ STROKEAHA.112.672527.
12. Iadecola C. The overlap between neurodegenerative and vascular factors in the pathogenesis of dementia. Acta Neuropathol 2010; 120(3): 287 – 296. doi: 10.1007/ s00401-010-0718-6.
13. Kloppenborg RP, van den Berg E, Kappelle LJ et al. Diabetes and other vascular risk factors for dementia: which factor matters most? A systematic review. Eur J Pharmacol 2008; 585(1): 97 – 108. doi: 10.1016/ j.ejphar.2008.02.049.
14. Sheardová K, Hudeček D. Prevence demence a životní styl. Neurol praxi 2011; 12(6): 418 – 421.
15. Janoutová J, Ambroz P, Kovalová M et al. Epidemiologie mírné kognitivní poruchy. Cesk Slov Neurol N 2018; 81/ 114(3): 284 – 289. doi: 10.14735/ amcsnn2018284.
16. Fratiglioni L, Paillard-Borg S, Winblad B. An active and socially inte-grated lifestyle in late life might protect against dementia. Lancet Neurol 2004; 3(6): 343 – 353. doi: 10.1016/ S1474-4422(04)00767-7.
17. Lužný J. Gerontopsychiatrie. Praha: Triton 2012 : 139 – 144.
18. Alonso Vilatela ME, López-López M, Yescas-Gómez P. et al. Genetics of Alzheimer‘s disease. Arch Med Res 2012; 43(8): 622 – 631. doi: 10.1016/ j.arcmed.2012.10.017.
19. Prince M, Acosta D, Dangour AD et al. Leg length, skull circumference, and the prevalence of dementia in low and middle income countries: a 10/ 66 population--based cross sectional survey. Int Psychogeriatr 2011; 23(2): 202 – 213. doi: 10.1017/ S1041610210001274.
20. Norton MC, Østbye T, Smith KR et al. Early parental death and late-life dementia risk: findings from the Cache County Study. Age Ageing 2009; 38(3): 340 – 343. doi: 10.1093/ ageing/ afp023.
21. Meng X, D’Arcy C. Education and dementia in the context of the cognitive reserve hypothesis: a systematic review with metaanalyses and qualitative analyses. PLoS One 2012; 7(6): e38268. doi: 10.1371/ journal.pone.0038268.
22. Alam MZ, Alam Q, Kamal MA et al. Infectious agents and neurodegenerative diseases: exploring the links. Curr Top Med Chem 2017; 17(12): 1390 – 1399. doi: 10.2174/ 1568026617666170103164040.
23. Piacentini R, Li Puma DD, Ripoli C et al. Herpes Simplex Virus type-1 infection induces synaptic dysfunction in cultured cortical neurons via GSK-3 activation and intraneuronal amyloid-β protein accumulation. Sci Rep 2015; 5 : 15444. doi: 10.1038/ srep15444.
24. Corroboration of a major role for Herpes Simplex Virus type 1 in Alzheimer’s disease. Front Aging Neurosci 2018; 10 : 324. doi: 10.3389/ fnagi.2018.00324.
25. Sofi F, Cesari F, Abbate R et al. Adherence to Mediterranean diet and health status: meta-analysis. BMJ 2008; 337: a1344. doi: 10.1136/ bmj.a1344.
26. Prevention and risk of Alzheimer’s disease and dementia. [online]. Available from URL: http:/ / www.alz.org/ research/ science/ alzheimers_prevention_and_risk. asp#exercise.
27. Brust JC. Ethanol and cognition: indirect effects, neurotoxicity and neuroprotection: a review. Int J Environ Res Public Health 2010; 7(4): 1540 – 1557. doi: 10.3390/ ijerph7041540.
28. Yang M, Guo Y, Gong J et al. Relationships between functional fitness and cognitive impairment in Chinese community-dwelling older adults: a cross-sectional study. BMJ Open 2018; 8(5): e020695. doi: 10.1136/ bmjopen-2017-020695.
29. Kivimäki M, Singh-Manoux A, Pentti J et al. Physical inactivity, cardiometabolic disease, and risk of dementia: an individual-participant meta-analysis. BMJ 2019; 365: l1495. doi: 10.1136/ bmj.l1495.
30. Cornutiu G. The epidemiological scale of Alzheimer‘s disease. J Clin Med Res 2015; 7(9): 657 – 666. doi: 10.14740/ jocmr2106w.
31. Pohanka M. Vaccination to Alzheimer disease. Is it a promising tool or a blind way? Curr Med Chem 2016; 23(14): 1432 – 1441. doi: 10.2174/ 0929867323666160418114733.
32. Arendash GW, Gordon MN, Diamond DM et al. Behavioral assessment of Alzheimer‘s transgenic mice following long-term Abeta vaccination: task specificity and correlations between Abeta deposition and spatial memory. Nature 2000; 408(6815): 982 – 985. doi: 10.1038/ 35050116.
33. Schenk D, Seubert P, Ciccarelli RB. Immunotherapy with beta-amyloid for Alzheimer‘s disease: a new frontier. DNA Cell Biol 2001; 20(11): 679 – 681. doi: 10.1089/ 10445490152717532.
34. Cribbs DH. Abeta DNA vaccination for Alzheimer‘s disease: focus on disease prevention. CNS Neurol Disord Drug Targets 2010; 9(2): 207 – 216. doi: 10.2174/ 18715 2710791012080.
35. Novak P, Schmidt R, Kontsekova E et al. Safety and immunogenicity of the tau vaccine AADvac1 in patients with Alzheimer‘s disease: a randomised, double-blind, placebo-controlled, phase 1 trial. Lancet Neurol 2017; 16(2): 123 – 134. doi: 10.1016/ S1474-4422(16)30331-3.
36. Axon Neuroscience. [online]. Available from URL: http:/ / www.axon-neuroscience.eu/ .
37. ClinicalTrials.gov. [online]. Available from URL: https:/ / www.clinicaltrials.gov/ .
38. Agadjanyan MG, Petrovsky N, Ghochikyan A. A fresh perspective from immunologists and vaccine researchers: Active vaccination strategies to prevent and reverse Alzheimer ’s disease. Alzheimers Dement 2015; 11(10): 1246 – 1259. doi: 10.1016/ j.jalz.2015.06.1884.
39. Murray F. Can Alzheimer‘s disease be prevented? Intractable Rare Dis Res 2013; 2(4): 136 – 138. doi: 10.5582/ irdr.2013.v2.4.136.
40. Bäckman L, Small BJ, Fratiglioni L. Stability of the preclinical episodic memory deficit in Alzheimer’s disease. Brain 2001; 124(Pt 1): 96 – 102. doi: 10.1093/ brain/ 124.1.96.
41. DeKosky ST, Marek K. Looking backward to move forward: early detection of neurodegenerative disorders. Science 2003; 302(5646): 830 – 834. doi: 10.1126/ science.1090349.
42. Korcyzn AD. Is dementia preventable? Dialogues Clin Neurosci 2009; 11(2): 213 – 216.
43. Bartoš A. Kdy vlastně začíná Alzheimerova nemoc – nová kritéria mírné kognitivní poruchy a Alzheimerovy nemoci. Cesk Slov Neurol N 2012; 75/ 108(1): 108 – 109.
44. Bartoš A, Raisová M. Testy a dotazníky pro vyšetřování kognitivních funkcí, nálady a soběstačnosti. Praha: Mladá fronta a.s. 2015.
45. Věchetová G, Bolceková E, Jarošová Z et al. Měření kognitivních funkcí pomocí krátkých opakovatelných neuropsychologických baterií. Cesk Slov Neurol N 2018; 81/ 114(1): 29 – 36. doi: 10.14735/ amcsnn201829.
46. Bartoš A. Test gest (TEGEST) k rychlému vyšetření epizodické paměti u mírné kognitivní poruchy. Cesk Slov Neurol N 2018; 81/ 114(1): 37 – 44. doi: 10.14735/ amcsnn201837.
47. Bartoš A, Raisová M. Test mince v ruce k detekci předstírání oslabeného paměťového výkonu ve srovnání s mírnou kognitivní poruchou a s mírnou demencí u Alzheimerovy nemoci. Cesk Slov Neurol N 2019; 85/ 115(3): 316 – 321. doi: 10.14735/ amcsnn2019316.
48. Bezdíček O, Georgi H, Panenková E et al. Ekvivalence alternativních verzí Montrealského kognitivního testu. Cesk Slov Neurol N 2019; 82/ 115(3): 332 – 340. doi: 10.14735/ amcsnn2019332.
49. Bartoš A. Dvě původní české zkoušky k vyšetřenípaměti za tři minuty – Amnesia Light and Brief Asses-sment (ALBA). Cesk Slov Neurol N 2019; 82/ 115(4): 420 – 429. doi: 10.14735/ amcsnn2019420.
50. Parobková E, Rusina R, Matějčková M et al. Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika? Cesk Slov Neurol N 2019; 82/ 115(1): 100 – 105. doi: 10.14735/ amcsnn2019100.
51. Maowen Ba, Min Kong, Xiaofeng Li et al. Is ApoE a good biomarker for amyloid pathology in late onset Alzheimer’s disease? Transl Neurodegener 2016; 5 : 20. doi: 10.1186/ s40035-016-0067-z.
52. Šerý O, Hlinecká L, Povová J et al. Arachidonate 5 – lipoxygenase (ALOX5) gene polymorphism is associated with Alzheimer‘s disease and body mass index. J Neurol Sci 2016; 362 : 27 – 32. doi: 10.1016/ j.jns.2016.01.022.
53. Hálová A, Janoutová J, Ewerlingová L et al. CHAT gene polymorphism rs3810950 is associated with the risk of Alzheimer‘s disease in the Czech population. J Biomed Sci 2018; 25(1): 41. doi: 10.1186/ s12929-018-0444-2.
54. Šerý O, Janoutová J, Ewerlingová L et al. CD36 gene polymorphism is associated with Alzheimer‘s disease. Biochimie 2017; 135 : 46 – 53. doi: 10.1016/ j.biochi.2017. 01.009.
55. Národní akční plán podporující pozitivní stárnutí pro období let 2013 až 2017. [online]. Dostupné z URL: http:/ / www.mpsv.cz/ files/ clanky/ 21726/ NAP_CZ_web.pdf.
56. Povová J. Epidemiologie a genetika Alzheime-rovy choroby [disertační práce]. Olomouc: Univerzita Palackého v Olomouci, Lékařská fakulta 2013.
Štítky
Dětská neurologie Neurochirurgie Neurologie Psychiatrie Praktické lékařství pro dospělé
Článek EditorialČlánek Poděkování recenzentůmČlánek Analýza dat v neurologiiČlánek Recenze monografieČlánek Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Randomizovaná kontrolovaná studie efektu terapie poruch rovnováhy s využitím audiovizuální zpětné vazby u seniorů
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Analýza dat v neurologii
- Vzpomínka na prof. Pavla Petrovického
- Prof. MUDr. Rudolf Malec, CSc. (1924–2019)
- Recenze monografie
- Kognitivní rehabilitace pacientů s Parkinsonovou nemocí
- Homeostáza mědi jako terapeutický cíl u amyotrofické laterální sklerózy s mutací superoxiddismutázy 1 a sloučenina CuATSM
- Možnosti prevence Alzheimerovy choroby
- Editorial
- Dominantní (Kjerova) atrofie optiku asociovaná s mutacemi v OPA1 genu
- Metodologie měření kognitivního deficitu u depresivní poruchy
- Novorozenecké záchvaty – současný pohled na problematiku
- Polysomnografické nálezy u osob nad 50 let bez subjektivních příznaků poruch spánku
- Poděkování recenzentům
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
- Choroidální tloušťka u asymptomatických pacientů se stenózou karotidy
- Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
- Role zánětu v etiopatogenezi farmakorezistentní epilepsie a refrakterního status epilepticus
- Charakteristika aterosklerotického plátu a riziko mozkové ischemie při stentování vnitřní karotidy
- Komorbidity Alzheimerovej choroby – výsledky multicentrickej prierezovej observačnej štúdie COSMOS v Slovenskej republike
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Novorozenecké záchvaty – současný pohled na problematiku
- Možnosti prevence Alzheimerovy choroby
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



