-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaImunomodulační léčba roztroušené sklerózy mozkomíšní v klinických a zobrazovacích parametrech
Clinical and Imaging Parameters of Immunomodulating Therapy in Multiple Sclerosis
Multiple sclerosis is an inflammatory autoimmune disorder of the central nervous system. Immunomodulating and immunosuppressive drugs have been shown to have partial efficacy but also, sometimes life-threatening, adverse effects. New agents continue to be introduced into the clinical practice and, therefore, treatment algorithm should be regularly updated, to reflect their efficacy, safety profile and evidence-based medicine.
Key words:
multiple sclerosis treatment – treatment algorithm – interferon β – glatiramer acetate –
fingolimod – natalizumab – mitoxantrone
Autoři: P. Štourač1 ,2
Působiště autorů: Neurologická klinika LF MU a F N Brno 1; CEITEC – Středoevropský technologický institut MU, Brno 2
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(4): 404-410
Kategorie: Minimonografie
Souhrn
Roztroušená skléróza mozkomíšní je zánětlivé autoimunitní onemocnění centrálního nervového systému. Imunomodulační a imunosupresivní léky vykazují částečnou účinnost a rovněž mají vedlejší účinky, z nichž některé mohou být i život ohrožující. S příchodem stále nových léků vzniká potřeba průběžně aktualizovat algoritmus léčby se zohledněním účinnosti, bezpečnosti na podkladě medicíny založené na důkazech pro potřeby klinické praxe.
Klíčová slova:
léčba roztroušené sklerózy – léčebný algoritmus – interferon beta – glatiramer acetát – fingolimod – natalizumab – mitoxantronÚvod
V posledních dvou desetiletích došlo k výraznému pokroku v léčbě roztroušené sklerózy mozkomíšní (RS), jehož počátek můžeme datovat do roku 1993, kdy Food and Drug Administration schválila k léčbě atakovitě remitentního průběhu (RR -RS) interferon beta-1b (Betaseron v USA, Betaferon v E U). V průběhu následujících let se postupně objevily v léčbě další imunomodulační preparáty ze skupiny interferonu beta, dále glatiramer acetát, mitoxantron a zatím jediná monoklonální protilátka natalizumab. V současnosti se dostal na trh nejnovější preparát – fingolimod, zaváděný do klinické praxe v ČR jako perorální léčivo Gilenya® (fingolimod). Velmi rychlý nástup těchto preparátů do léčby roztroušené sklerózy vyžaduje nejen průběžné hodnocení jejich účinnosti v klinických a zobrazovacích parametrech, ale současně potřebu zvážit i jejich bezpečností profil, ekonomickou náročnost, tolerabilitu a adherenci při dlouhodobé léčbě. Takováto komplexnost požadavků vede k vytváření léčebných algoritmů a jejich průběžné aktualizaci s příchodem dalších nových léků do klinické praxe. Následující sdělení si klade právě tento cíl, tj. popsat aktuální léčebný algoritmus imunomodulačních léků u roztroušené sklerózy, který je založen na mezinárodním konsenzu odborníků a vyplývá z dat získaných v klinických studiích s odpovídající metodikou.
Indikace imunomodulační léčby a klinicky izolovaný syndrom (tab. 1)
Z hlediska klinické praxe jsou v současnosti v popředí dva aspekty, které do značné míry určují pozici jednotlivých přípravků v léčbě: jednak je to rozhodnutí, kdy zahájit léčbu pacienta na základě vědeckých poznatků, a dále jakým způsobem eskalovat léčbu v případě, kdy léky první linie nevykazují dostatečný klinický účinek. Důvody pro časné zahájení léčby jsou stále průkaznější a je zřejmé, že již v nejčasnějších fázích onemocnění, v období klinicky izolovaného syndromu (Clinically Isolated Syndrome, CIS), je přítomno rozsáhlé a ireverzibilní poškození axonů, které je podkladem trvalého neurologického deficitu. Toto axonální postižení je úzce spjato s přítomností zánětu v centrálním nervovém systému [1,2]. Jako CIS jsou označovány objektivní neurologické příznaky suspektní z demyelinizačního onemocnění, kdy byly vyloučeny v rámci diferenciální diagnostiky ostatní možné příčiny. Z klinického hlediska se CIS nejčastěji manifestuje optickou neuritidou, akutním kmenovým syndromem a parciální transverzální myelitidou. V současnosti mají léky první linie léčby interferony beta a glatiramer acetát schválenou indikaci k léčbě klinicky izolovaného syndromu, kdy vykazují signifikantní zpomalení konverze do klinicky definitivní roztroušené sklerózy (Clinically Definite Multiple Sclerosis, CDMS) ve srovnání s placebem [3–6]. Ve snaze poskytnout včasnou léčbu zejména nejrizikovějším pacientům s CIS byly určeny některé další prediktivní parametry určující podskupinu nejvíce ohroženou přechodem do CDMS. Nejvýraznější prediktivní sílu má pozitivní nález na magnetické rezonanci (MR) a rovněž přítomnost oligoklonálních IgG pásů v mozkomíšním moku [7]. U pacientů s CIS byly hodnoceny léky, které měly za cíl oddálit či zabránit přechodu do CDMS.
Tab. 1. Klinické studie provedené u CIS s evidencí stupně A. 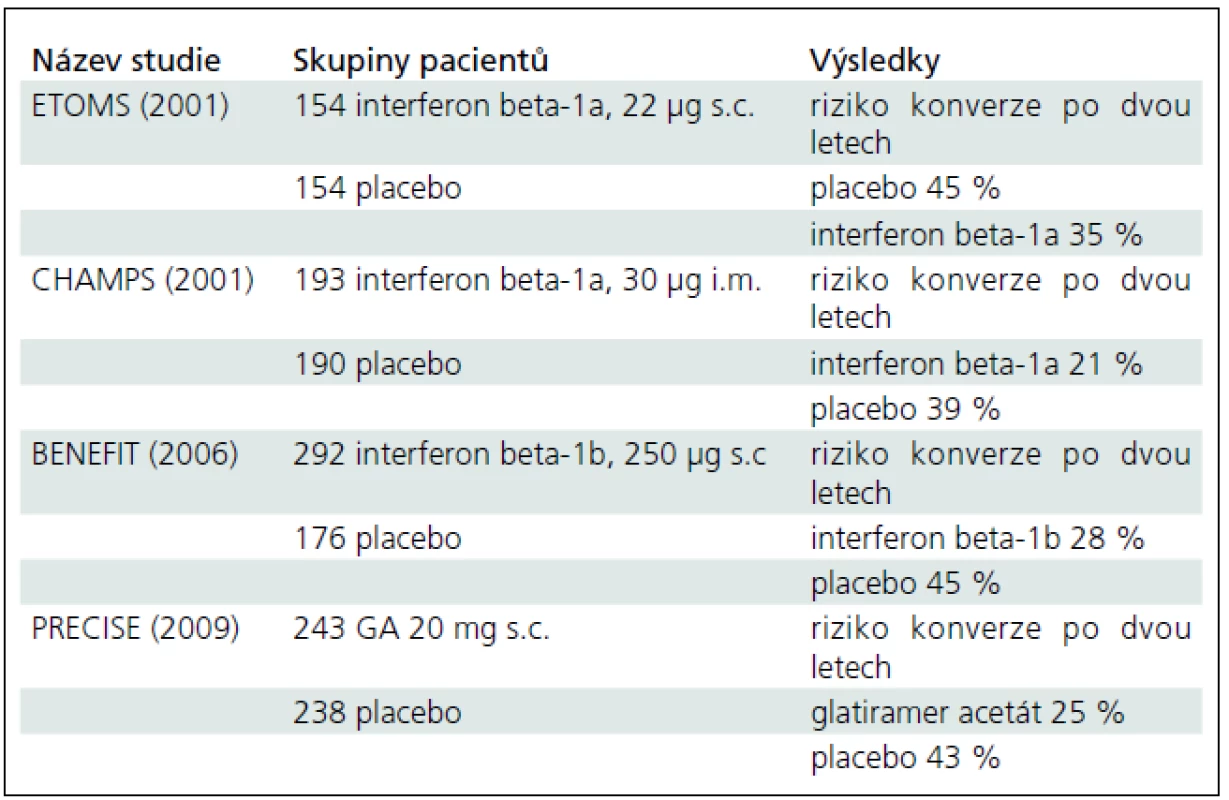
CIS – klinicky izolovaný syndrom Souhrnně ve třech studiích s interferonem beta u CIS s MR nálezem podezřelým na RS byl u pacientů léčených po dobu dvou let rozdíl v konverzi do CDMS v rozmezí 10–19 % oproti pacientům léčeným placebem [3,5]. V těchto studiích bylo rovněž prokázáno, že došlo ke snížení počtu, resp. objemu zánětlivých ložisek v MR [8]. Obdobné výsledky byly ve studii s glatiramer acetátem (PRECISE) [4].
Imunomodulační léčba u klinicky definitivní roztroušené sklerózy
U pacientů s klinicky definitivní roztroušenou sklerózou začíná onemocnění nejčastěji atakovitě remitentní formou, a to přibližně u 85 % případů, a významná část přechází do sekundárně chronickoprogresivního průběhu po 10–15 letech od počátku onemocnění. Klinické studie evidence třídy A testující účinnost u atakovité formy RS byly provedeny u interferonu beta, glatiramer acetátu, natalizumabu, mitoxantronu a fingolimodu, tj. léků, které jsou k dispozici pro klinickou léčbu v zemích EU včetně ČR . Všechny tyto preparáty vykázaly statisticky signifikantní účinnost v redukci počtu atak, snížení objemu ložisek a počtu aktivních ložisek na MR a ve snížení rizika progrese disability [9–13]. V roce 2010 byly publikovány výsledky studie FREE DOMS s fingolimodem, které prokázaly redukci v počtu atak, v progresi disability a objemu ložisek detekovaných na MR [14]. Rovněž byl fingolimod testován ve studii TRA NSFOR MS souběžně s interferonem beta-1a (Avonex) (tab. 2) [15].
Tab. 2. Klinické studie u RR-RS s evidencí stupně A. 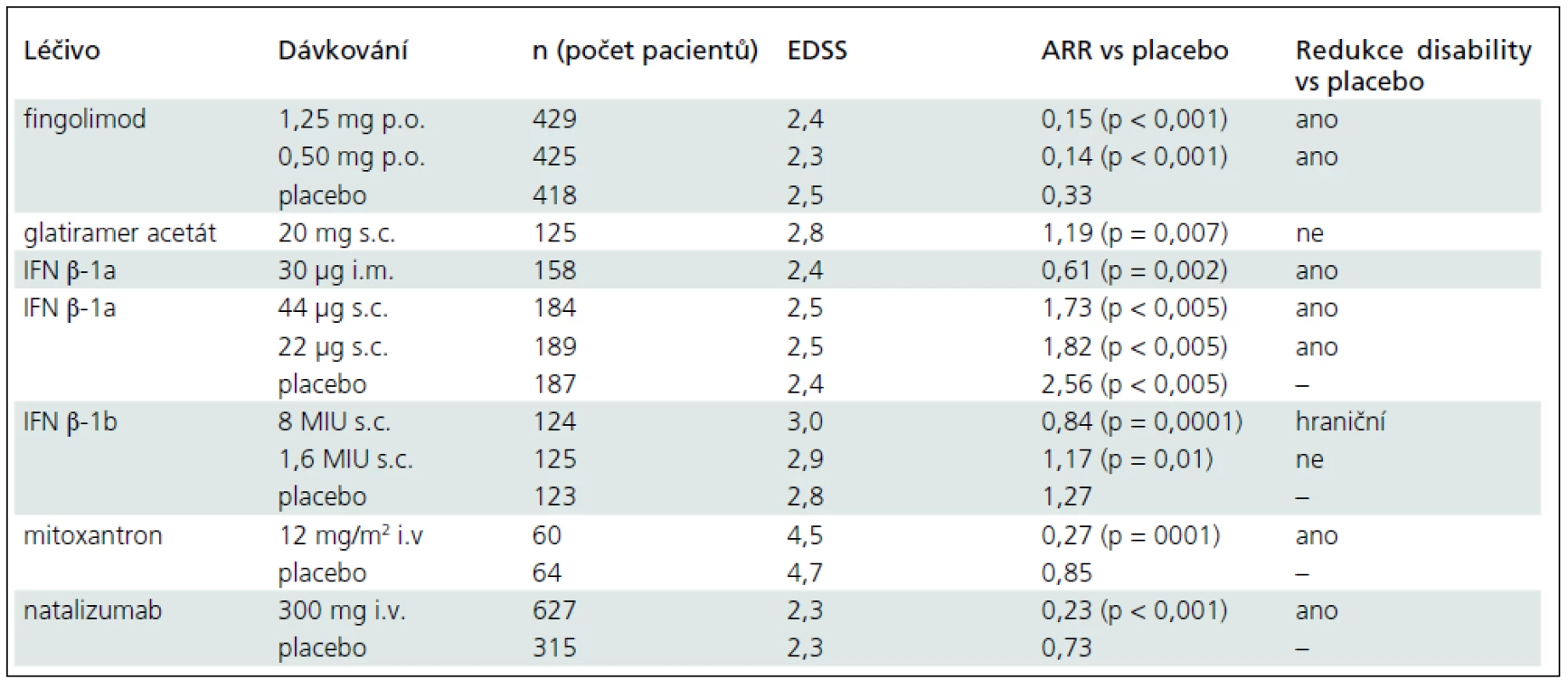
RR-RS – relaps-remitentní roztroušené skleróza, IFN β-1a – interferon beta-1a, IFN β-1b – interferon beta-1b, GA – glatiramer acetát, EDSS – Expanded Disability Status Scale, ARR – Annualized Relapse Rate (roční četnost relapsů) V této skupině léků označovaných jako léky první volby byly provedeny srovnávací studie, tzv. head to head study (tab. 3), které měly za cíl zjistit eventuální superioritu jednotlivých léčiv v dané skupině vůči ostatním srovnávaným. Nebyl zjištěn rozdíl v účinnosti mezi subkutánně podávaným interferonem beta a glatiramer acetátem a subkutánně podávanými interferony beta. Výsledky studie INCOMIN a E VIDENCE prokázaly vyšší účinnost v redukci četnosti relapsů a v redukci aktivity na MR při vyšší frekvenci a dávce subkutánně podávaného interferonu beta-1a ve srovnání s interferonem beta-1a podávaným intramuskulárně [16,17]. Uvedené studie byly kritizovány pro některé metodické nedostatky a léčebný efekt nepřetrvával po celou dobu studie [18]. Další aspektem, který je nutno zvážit, je potenciální vyšší výskyt nežádoucích účinků při frekventnějším podávání a vyšší dávce interferonu beta s vyšším podílem tvorby neutralizačních protilátek, které mohou snižovat dlouhodobou účinnost léčby. Při vyšší frekvenci podávání klesá adherence k léčbě.
Tab. 3. Srovnávací klinické studie u RR-RS s evidencí stupně A. 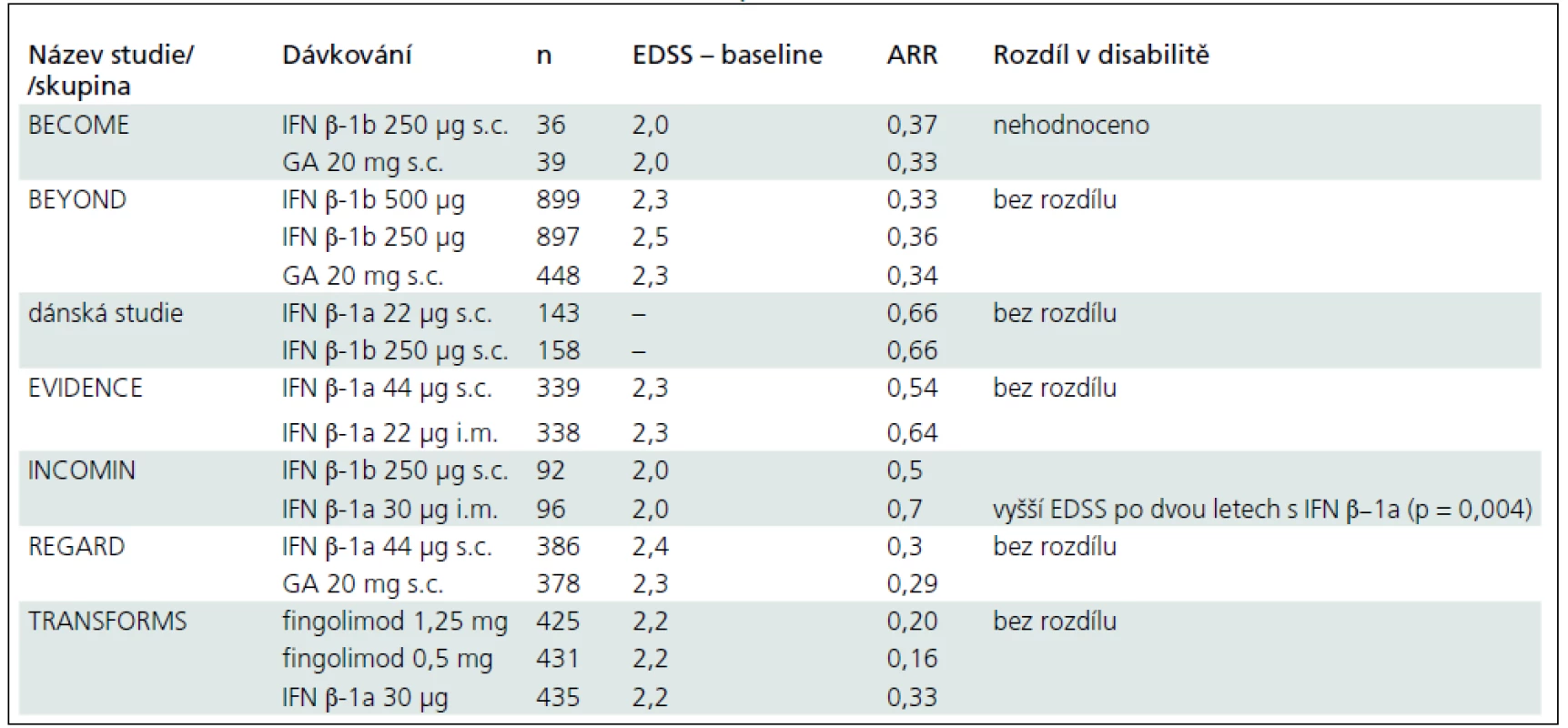
RR-RS – relaps-remitentní roztroušené skleróza, IFN β-1a – interferon beta-1a, IFN β-1b – interferon beta-1b, GA – glatiramer acetát, EDSS – Expanded Disability Status Scale, ARR – Annualized Relapse Rate (roční četnost relapsů) Obdobná srovnávací „head to head“ hodnocení nejsou provedena s interferonem beta-1a podávaným jedenkrát týdně intramuskulárně vůči glatiramer acetátu, natalizumabu, fingolimodu a mitoxantronu. V případě natalizumabu a fingolimodu výsledky získané ze základních studií (affirMS a freeDoMS) předpokládají vyšší účinnost v redukci počtu atak a progresi onemocnění ve srovnání s léky první volby interferonem beta a glatiramer acetatem. Rovněž nejsou obdobná srovnání provedena pro natalizumab a mitoxantron, tudíž nepřímé srovnání výsledků ze základních studií má pouze nižší stupeň evidence D.
Do kategorie léků první volby pro atakovitou formu roztroušené sklerózy lze zahrnout i natalizumab v případě velmi těžkého průběhu RS od počátku onemocnění. Jedná se o monoklonální protilátku vážící se na α4 podjednotku integrinů na povrchu leukocytů s výjimkou neutrofilních granulocytů. Výrazná klinická účinnost natalizumabu byla prokázána ve dvou velkých klinických studiích, jednak v monoterapii, a též v kombinaci s interferonem beta-1a podávaným jedenkrát týdně intramuskulárně [12,19]. Zde je indikace v první linii vymezena pro těžkou atakovitou formu s rychle narůstajícím neurologickým deficitem nebo pro pacienty, kteří jinou léčbu netolerují. V ostatních případech se jedná v ČR o pacienty, u nichž léčba interferonem beta nebo glatiramer acetátem nevedla k redukci počtu atak pod dvě ataky za dva roky nebo tři ataky za tři roky léčby a kteří vykazují přítomnost enhancujících lézí či zvýšení počtu ložisek a jejich objemu na MR. Léčba natalizumabem přináší riziko progresivní multifokální leukoencefalopatie (PML), jejíž incidence narůstá v souvislosti se třemi známými faktory. Prvním faktorem je délka léčby natalizumabem, zejména období delší než dva roky. U pacientů, kteří jsou léčeni více než čtyři roky, nejsou k dispozici dostatečně průkazná data týkající se míry rizika. Druhým známým rizikovým faktorem je předchozí léčba imunosupresivy – azatioprinem, cyklofosfamidem, mitoxantronem. Třetím známým rizikovým faktorem je přítomnost protilátek proti JC viru detekovaných metodou ELISA (Enzyme-Linked ImmunoSorbent Assay). Pacienti, kteří mají současně přítomny všechny tři rizikové faktory, mají riziko vzniku PML při léčbě natalizumabem přibližně 9 : 1 000. U 21 % pacientů s výskytem PML během léčby došlo k úmrtí, ostatní pacienti vykazovali různý stupeň postižení od těžkého až po lehký neurologický deficit s procentuálním rozložením cca 10 % lehké postižení, 50 % středně těžké postižení a 40 % těžký neurologický deficit s možností dalšího mírného zlepšování v uvedených skupinách v následujících měsících [20]. Jinými potenciálními riziky léčby jsou alergické reakce vyskytující se nejčastěji v prvních fázích léčby zpravidla mezi 3.–6. podáním a zvýšená incidence infekčních onemocnění. Z hlediska zvažované strategie dočasného přerušení léčby je otázkou známý rebound fenomén neboli rychlý návrat onemocnění k původní aktivitě před léčbou. Samotná léčba PML se provádí plazmaferézou s cílem odstranit natalizumab z cirkulace. Průběh léčby je však komplikován výskytem syndromu IRI S (Immune Reconstitution Inflammatory Syndrome), kde obnova imunitního systému vede k dalšímu poškození nervového systému. Ke zvládnutí této komplikace se podávají kortikoidy.
Mitoxantron není primárně lékem první volby z důvodu řady nežádoucích i potenciálně fatálních důsledků. Při léčbě mitoxantronem dochází k výrazné lymfopenii, zvýšenému riziku vzniku infekcí a případně k závažné kardiotoxicitě. Nelze jej podat pacientům s ejekční frakcí levé komory menší než 50 %, což vyžaduje provést transtorakální sonografické vyšetření srdce a během léčby jej opakovat. Celková kumulativní dávka nesmí překročit 140 mg/m2. K závažným vedlejším účinkům lze řadit i vznik akutní leukemie [21]. V současné době natalizumab a mitoxantron představují v ČR léky druhé volby při nedostatečné účinnosti interferonu beta a glatiramer acetátu, pouze ve výjimečných případech výše uvedených mohou být použity v léčbě primárně.
Od roku 2011 je v E U schválen k léčbě atakovité formy roztroušené sklerózy nový lék fingolimod, který však nemá v současnosti indikaci pro CIS. Tento lék působí na sfingosin-1 fosfátový receptor v centrálním nervovém a imunitním systému. Způsobuje reverzibilní zadržení části CD4+ a CD 8+ T lymfocytů v lymfatických uzlinách. Tímto mechanizmem autoagresivní T lymfocyty zůstávají sekvestrovány v lymfatických uzlinách a např. u experimentální autoimunitní encefalomyelitidy dochází k potlačení zánětu v centrálním nervovém systému. Významnou klinickou účinnost prokázal fingolimod ve srovnání s placebem ve studii FREEDOMS [14] a ve srovnávací studii s interferonem beta-1a jedenkrát týdně intramuskulárně TRANSFORMS [15]. Ve studii TRANSFORMS prokázal fingolimod výraznější účinnost v redukci atak než interferon beta-1a, progrese disability však byla obdobná. Určité úskalí v interpretaci výsledků však představuje skutečnost, že cca 50 % pacientů v uvedené studii bylo před vstupem do studie léčeno interferonem beta, a mohlo se tudíž jednat o nedostatečné respondenty k této léčbě. Závažnější však byly nežádoucí reakce ve skupině léčené fingolimodem. Nejzávažnější nežádoucí účinky představovala dvě úmrtí v důsledku infekčních onemocnění ve skupině léčené vyšší dávkou fingolimodu 1,25 mg perorálně denně. Do klinické praxe byla schválena dávka nižší, obdobně účinná, a to 0,5 mg denně perorálně. Jedna fatální komplikace byla zaznamenána v důsledku diseminace viru varicella zoster a druhá v případě herpes simplex encefalitidy. Ovlivnění převodního srdečního systému po první dávce léčiva ve smyslu bradykardie eventuálně až atrioventrikulárních (A-V) blokád představuje významné riziko a současně nutnost EKG monitorování pacientů po dobu nejméně šest hodin po podání první dávky. Před zahájením léčby je vhodné kardiologické vyšetření. Toto ovlivnění převodního systému při pokračující léčbě vymizí. Kardiolog by měl být členem terapeutického týmu. Rovněž byly registrovány infekce dýchacích cest. Další nežádoucími účinky byly makulární edém, hepatopatie, snížení výdechového objemu a v menší míře zvýšení krevního tlaku. V ČR je fingolimod (Gilenya) řazen mezi léky druhé volby, zatímco ve Švýcarsku a Spojených státech je možné fingolimod využít i jako lék první volby. Do doby, než budou k dispozici dlouhodobá data o bezpečnosti fingolimodu a do určité míry i natalizumabu s ohledem na narůstající incidencí PML, zůstávají interferon beta a glatiramer acetát s velmi dobrým dlouhodobým bezpečnostním profilem základními léky první volby v léčbě roztroušené sklerózy.
Eskalační léčba
Skutečností však je, že poměrně velká část pacientů léčená léky první volby vykazuje nedostatečnou nebo žádnou terapeutickou odpověď (až 30 % léčených pacientů) a do popředí se dostává otázka změny preparátu v rámci léků první linie nebo eskalace na léky druhé linie, v ČR v současnosti na natalizumab, mitoxantron nebo fingolimod [22]. V klinické praxi dochází nejčastěji ke změně z interferonu beta na glatiramer acetát nebo obráceně. Pro tento postup však není k dispozici podpora na základě klinických studií úrovně A, ani jednoznačné výsledky z nerandomizovaných studií [23–25]. Druhou možností je změna na lék s vyšší dávkou a frekvencí podávání s evidencí úrovně B [9,17], ale v případě zvýšení dávky u interferonu beta-1b ze standardní dávky 250 µg na 500 µ g nebyl pozorován rozdíl v účinnosti [26]. Třetí možností, jak postupovat u selhání léků první linie, je kombinovaná terapie. Z dosavadních klinických studií pouze u léčby interferonem beta kombinace s perorálním metylprednizonem vedla k pozitivnímu efektu v podobě redukce relapsů a snížení objemu a počtu ložisek na MR [27,28].
Uvedené strategie týkající se změny nebo eskalace v rámci uvedených dostupných léčiv jsou nutně spojeny s kritérii neúčinnosti terapie první volby dle příslušných národních standardů nebo mezinárodního konsenzu zohledňujícího tři aspekty léčby, kdy při splnění nejméně dvou požadavků lze uvažovat o změně léčby vzhledem k určité prognostické hodnotě těchto kritérií. Pokud má pacient při léčbě relaps nebo zhoršení disability o jeden stupeň v E DSS škále a nová T2 vážená ložiska v MR obraze, lze očekávat v následujících dvou letech nedostatečnou odpověď k léčbě [29–31].
V případě nutnosti eskalace léčby je navrženo následují schéma [32]:
1. Léky první volby:
- a) interferon beta
- b) glatiramer acetát
- c) fingolimod (USA)
- d) natalizumab nebo fingolimod v případě agresivního průběhu onemocnění
2. Přetrvávání relapsů a MR aktivity:
- a) interferon beta: zvýšit frekvenci/dávku
- b) vysokodávkovaný interferon beta: zvážit převedení na glatiramer acetát
- c) glatiramer acetát: zvážit převedení na interferon beta
- d) pokud je fingolimod lékem první volby, zvážit převedení na interferon beta nebo glatiramer acetát
- e) natalizumab (primárně agresivní průběh onemocnění)
- f) fingolimod (primárně agresivní průběh onemocnění)
3. Pacienti s intolerancí vůči natalizumabu nebo fingolimodu či non-respondéři:
- a) mitoxantron
4. V případě neúčinnosti předchozích registrovaných léčiv:
- a) rituximab
- b) alemtuzumab
- c) daclizumab
- d) cyklofosfamid
Závěr
V uvedeném sdělení jsou shrnuty současné možnosti v léčbě atakovitého průběhu roztroušené sklerózy imunomodulačními a imunosupresivnímí léky. Snahou lékařů pečujících o tyto pacienty je dosáhnout klinického stavu bez příznaků klinické a rezonanční aktivity v podobě relapsů, progrese disability a nových lézí na MR. Vzhledem k tomu, že všechny výše uvedené postupy jsou v současnosti pouze částečně účinné s významným podílem non-respondérů, je nezbytný monitoring pacientů a případně včasná změna léčby. S příchodem dalších léčiv u RS a při narůstajících zkušenostech se stávajícími léky bude algoritmus léčby dále podléhat průběžným změnám.
doc. MUDr. Pavel Štourač, Ph.D.
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: pstourac@fnbrno.cz
Recenzenti:
doc. MUDr. Jan Mareš, Ph.D.
doc. MUDr. Martin Vališ, Ph.D.
MUDr. Jiří Berger, CSc.
Přijato k recenzi: 30. 5. 2012
Přijato do tisku: 11. 7. 2012
doc. MUDr. Pavel Štourač, Ph.D. (1959)
Docent Pavel Štourač se narodil 24. 1. 1959 v Novém Městě na Moravě. Promoval na LF J. E. Purkyně v Brně v roce 1984. Od roku 1996 působil jako odborný asistent na Neurologické klinice FN Brno – pracoviště Bohunice. Postgraduální studium s tématem paraneoplastických neurologických syndromů ukončil v r. 2001 a habilitoval v r. 2007. Hlavním předmětem jeho zájmu je neuroimunologie a likvorologie. V r. 1995 absolvoval odbornou stáž v neuroimunologické laboratoři na Mayo Clinic v R ochesteru a v r.1998 v Memorial Sloan-Kettering Center v New Yorku, kde se věnoval problematice paraneoplastických neurologických syndromů z hlediska laboratorní a klinické diagnostiky. Byl hlavním řešitelem grantu IGA s touto tematikou a v letech 2002–2009 byl členem mezinárodního výzkumného projektu v rámci 6RP EU nazvaného PNS EURONETWORK, který vytvořil evropskou databázi. V r. 1999 byl spoluautorem publikace oceněné Hennerovou cenou pro mladé autory. V r. 2010 byl oceněn cenou „Investigator Award 2010 Neuro-oncology in 14th Congress of the European Federation of Neurological Societies“ v Ženevě. V oblasti roztroušené sklerózy pracuje jako vedoucí MS centra ve FN Brno a věnuje se problematice neuroimunologie a likvorologie u roztroušené sklerózy. Výsledky projektů u roztroušené sklerózy mozkomíšní prezentuje pravidelně na domácích i mezinárodních sympoziích. Je členem výboru mezinárodních odborných společností EFNS a E SNI, členem výboru Sekce pro neuroimunologii, likvorologii a roztroušenou sklerózu ČLS a oborové rady pro neurologii LF MU. Na svoje publikace má aktuálně 87 citací dle CSI a h-index 6.
Zdroje
1. Trapp BD, Peterson J, Ransonhoff RM, Rudick R, Mörk S, Bö L. Axonal transection in the lesions of multiple sclerosis. N Eng J Med 1998; 338(5): 278–285.
2. Kuhlmann T, Lingfeld G, Bitsch A, Schuchardt J, Brück W. Acute axonal damage in multiple sclerosis is most extensive in early disease stages and decreases over time. Brain 2002; 125(Pt 10): 2202–2012.
3. Jacobs LD, Beck RW, Simon JH, Kinkel RP, Brownscheidle CM, Murray TJ et al. Intramuscular interferon beta-1a therapy initiated during a first demyelinating event in multiple sclerosis. CHA MPS Study Group. N Eng J Med 2000; 343(13): 898–904.
4. Comi G, Martinelli V, Rodegher M, Moiola L, Bajenaru O, Carra A et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe): a randomised, double-blind, placebo-controlled trial. Lancet 2009; 374(9700): 1503–1511.
5. Kappos L, Freedman MS, Polman CH , Edan G, Hartung HP, Miller DH et al. Effects of early versus delayed interferon beta-1b treatment on disability after a first clinical event suggestive of multiple sclerosis: a 3-year follow-up analysis of the BENEFIT study. Lancet 2007; 370(9585): 389–397.
6. Comi G, Filippi M, Barkhof F, Durelli L, Edan G, Fernández O et al. Effects of early interferon treatment on conversion to definite multiple sclerosis: a randomised study. Lancet 2001; 357(9268): 1576–1582.
7. Tintoré M, Rovira A, Río J, Nos C, Grivé E, Téllez N et al. Baseline MRI predicts future attacks and disability in clinically isolated syndromes. Neurology 2006; 67(6): 968–972.
8. Clerico M, Faggiano F, Palace J, Rice G, Tintore M, Durelli L. Recombinant interferon beta or glatiramer acetate for delaying conversion of the first demyelinating event to multiple sclerosis. Cochrane Database Syst Rev 2008; 2: CD005278.
9. PRISMS (Prevention of Relapses and Disability by Interferon ß-1a Subcutaneously in Multiple Sclerosis) Study Group. Randomised double-blind placebocontrolled study of interferon beta-1a in relapsing-remitting multiple sclerosis. Lancet 1998; 352(9139): 1498–1504.
10. IFNß Multiple Sclerosis Study Group. Interferon beta-1b is effective in relapsing-remitting multiple sclerosis. I. Clinical results of a multicenter, randomized, double-blind, placebo-controlled trial. Neurology 1993; 43(4): 655–661.
11. Hartung H, Gonsette R, König N, Kwiecinski H, Guseo A, Morrissey SP et al. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. Lancet 2002; 360(9350): 2018–2025.
12. Polman CH, O’Connor PW, Havrdova E, Hutchinson M, Kappos L, Miller DH et al. A randomized, placebo-controlled trial of natalizumab for relaspsing multiple sclerosis. N Engl J Med 2006; 354(9): 899–910.
13. Johnson KP, Brooks BR, Cohen JA, Ford CC, Goldstein J, Lisak RP et al. Copolymer 1 reduces relapse rate and improves disability in relapsing-remitting multiple sclerosis: results of a Phase III multicenter, double-blind placebo-controlled trial. The Copolymer 1 Multiple Sclerosis Study Group. Neurology 1995; 45(7): 1268–1276.
14. Kappos L, Radue EW, O’Connor P, Polman CH, Hohlfeld R, Calabresi P et al. FREEDOMS Study Group. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362(5): 387–401.
15. Cohen JA, Barkhof M, Comi G, Hartung HP, Khatri BO, Montalban X et al. TRA NSFOR MS Study Group. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med; 362(5): 402–415.
16. Panitch H, Goodin DS, Francis G, Chang P, Coyle PK, O’Connor P et al. Randomized, comparative study of interferon beta-1a treatment regiment in MS: the EVIDENCE trial. Neurology 2002; 59(10): 1496–1506.
17. Durelli L, Verdun E, Barbero P, Bergui M, Versino E, Ghezzi A et al. Every-other-day interferon
beta-1b versus once-weekly interferon beta-1a for multiple sclerosis: results of a 2-year prospective randomised multicentre study (INCOMIN). Lancet 2002; 359(9316): 1453–1460.
18. Vartanian T. An examination of the results of the EVIDENCE, INCOMIN, and phase III studies of interferon beta products in the treatment of multiple sclerosis. Clin Ther 2003; 25(1): 105–118.
19. Rudick RA , Stuart WH, Calabresi PA, Confavreux CH, Galetta SL, Radue EW et al. SENTINEL Investigators. Natalizumab plus interferon beta-1a for relapsing multiple sclerosis. N Engl J Med 2006; 354(9): 911–923.
20. Warnke C, Menge T, Hartung HP, Racke MK, Cravens PD, Bennett JL et al. Natalizumab and progressive multifocal leukoencephalopathy: what are the casual factors and can it be avoided? Arch Neurol 2009; 67(8): 923–930.
21. Neuhaus O, Kieseier BC, Hartung HP. Therapeutic role of mitoxantrone in multiple sclerosis. Pharmacol Ther 2006; 109(1–2): 198–209.
22. Mikol DD, Barkhof F, Chang P , Coyle PK, Jeffery DR, Schwid SR et al. Comparison of subcutaneous interferon betta-1a with glatiramer acetate in patients with relapsing multiple sclerosis (the REbif vs Glatiramer acetate in Relapsing MS Disease (REGARD) study: a multicentre, randomised, parallel, open-label trial. Lancet Neurol 2008; 7(10): 903–914.
23. Gajofatto A, Bacchetti P, Grimes B, High A, Waubant E. Switching first line disease-modifying therapy after failure: impact on the course of relapsing remitting mutliple sclerosis. Mult Scler 2009; 15(1): 50–58.
24. Carrá A, Onaha P, Luetic G, Burgos M, Crespo E, Deri N et al. Therapeutic outcome 3 years after switching of immunomodulatory therapies in patients with relapsing-remitting multiple sclerosis in Argentina. Eur J Neurol 2008; 15(4): 386–393.
25. Limmroth V, Malessa R, Zettl UK, Koehler J, Japp G, Haller P et al. Quality Assessment in Multiple Sclerosis Therapy (QUASIMS): a comparison of interferon beta therapies for relapsing-remitting multiple sclerosis. J Neurol 2007; 254(1): 67–77.
26. O’Connor P, Filippi M, Arnason B, Comi G, Cook S, Goodin D et al. BEYO ND Study Group.
250 μg or 500 μg interferon beta-1b versus 20 mg glatiramer acetate in relapsing-remitting multiple sclerosis: a prospective, randomised, multicentre study. Lancet Neurol 2009; 8(10): 889–897.
27. Sorensen PS, Mellgren SI, Svenningsson A, Elovaara I, Frederiksen JL, Beiske AG et al. NOR dic trial of oral Methylprednisolone as add-on therapy to Interferon beta-1a for treatment of relapsing-remitting Multiple Sclerosis (NOR MIMS study): a randomised placebo-controlled trial. Lancet Neurol 2009; 8(6): 519–529.
28. Ravnborg M, Sorensen PS, Andersson M, Celius EG , Jongen PJ, Elovaara I.et al. Methylprednisolone in combination with interferon beta-1a for relapsing-remitting multiple sclerosis (MECOMBIN study): a multicentre, double-blind, randomised, placebo-controlled, parallel-group trial. Lancet Neurol 2010; 9(7): 672–680.
29. Rio J, Castillo J, Rovira A, Tintore M, Sastre-Garriga J, Horga A.et al. Measures in the first year of the rapy predict the response to interferon beta in MS. Mult Scler 2009; 15(7): 848–853.
30. Vaněčková M, Seidl Z, Krásenský J, Horáková D, Havrdová E, Němcová J et al. Naše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010; 73/106(6): 716–720.
31. Obhlídalová I, Keřkovský M, Štourač P, Bednařík P, Vlčková E. Diagnostické možnosti zobrazovacích metod v hodnocení morfologického korelátu kognitivních změn u pacientů s roztroušenou sklerózou. Cesk Slov Neurol N 2012; 75/108(2): 170–178.
32. Rio J, Comabella M, Montalban X. Multiple sclerosis: current treatment algorithms. Curr Opin Neurol 2011; 24(3): 230–237.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2012 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Komentář k minimonografii P. Štourače
- Imunomodulační léčba roztroušené sklerózy mozkomíšní v klinických a zobrazovacích parametrech
- Prostorová orientace při fyziologickém a patologickém stárnutí
- Porucha spánku s rytmickými pohyby
- Meningeomy pochev zrakového nervu – přehled současných léčebných možností
- Stanovení prognostických faktorů trombolytické léčby u pacientů s akutním mozkovým infarktem – analýza registru SITS
- Koagulopatia pri kraniocerebrálnom poranení u detí a mladistvých
- Léčba obstrukční spánkové apnoe pomocí CPAP snižuje nezávisle hladinu A-FABP a CRP
- Přístrojově asistované kvantitativní testování senzitivity – normativní data
- Vyšetření hustoty intraepidermálních nervových vláken z kožní biopsie – normativní data
- Oswestry dotazník, verze 2.1a – výsledky u pacientů s lumbální spinální stenózou, srovnání se starší verzí dotazníku
- Peroperační elektromyografie svěračového komplexu anorekta dětí s anorektálními malformacemi
- Vliv novorozenecké žloutenky na vznik autizmu
- Izolovaná sfenoidální sinusitida – možná příčina bolestí hlavy a závažných komplikací
- Mozkové arachnoidální cysty u dospělých – retrospektivní analýza výsledků chirurgické terapie
- Hyperbarická oxygenační terapie závažných kraniocerebrálních poranění u dětí a adolescentů
- Primárně extradurální meningeom prezentující se Garcinovým syndromem – kazuistika
- Austrianův syndrom: pneumokoková meningitida, pneumonie a endokarditida – kazuistika
- Lewisův- Sumnerův syndrom – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXIV. Bayesovské sítě - V. neuromuskulární kongres, 3.–4. května 2012 v Brně
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mozkové arachnoidální cysty u dospělých – retrospektivní analýza výsledků chirurgické terapie
- Porucha spánku s rytmickými pohyby
- Izolovaná sfenoidální sinusitida – možná příčina bolestí hlavy a závažných komplikací
- Oswestry dotazník, verze 2.1a – výsledky u pacientů s lumbální spinální stenózou, srovnání se starší verzí dotazníku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




