-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sonotrombolýza – mechanizmus účinku a její využití v léčbě ischemické cévní mozkové příhody
Sonothrombolysis – Mechanisms of Action and its Use in the Treatment of Stroke
Sonothrombolysis is one of the novel therapeutic methods in acute stroke patients. It is based on acceleration of clot lysis by ultrasound. Mechanisms of therapeutic ultrasound effect include heating, cavitation and micromotion of sonificated medium. In particular, cavitation and micromotion of sonificated medium are responsible for acceleration of clot lysis. Experiments with sonothrombolysis have been performed since 1950s, especially during the last 20 years. Many in vitro and in vivo studies demonstrated efficacy of sonothrombolysis in clot lysis. Sonothrombolysis can be used in combination with thrombolytic agents, echocontrast agents or even separately for activation of fibrinolytic system. Apart from the external application of ultrasound through the temporal bone window, endovascular application can also be used.
Key words:
ischemia – thrombus – arterial occlusion – thrombolysis – sonothrombolysis
Autoři: M. Kuliha 1; M. Roubec 1; D. Školoudík1 ,2
Působiště autorů: Neurologická klinika LF OU a FN Ostrava 1; Neurologická klinika LF UP a FN Olomouc 2
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(1): 23-29
Kategorie: Přehledný referát
Souhrn
Sonotrombolýza je jednou z nových terapeutických možností, využitelných u pacientů s akutní cévní mozkovou příhodou. Jedná se o potenciaci procesu trombolýzy ultrazvukem. Mechanizmy účinků ultrazvuku, které lze využít terapeuticky, jsou především produkce tepla, tvorba kavitací a mikropohyb sonifikovaného média. Za potenciaci trombolýzy je odpovědna zejména tvorba kavitací a mikropohyb sonifikovaného média. Zkoumání sonotrombolýzy probíhá od 50. let minulého století, zejména však v posledních 20 letech. Velké množství experimentů in vitro a in vivo prokázalo efektivnost sonotrombolýzy v procesu lýzy trombu. Sonotrombolýzu lze použít v kombinaci s trombolytickými látkami, echokontrastními látkami, ale i samostatně k aktivaci fibrinolytického systému. Aplikace ultrazvuku je možná jak externě přes temporální kostní okno, tak endovaskulárně.
Klíčová slova:
ischemie – trombus – uzávěr tepny – trombolýza – sonotrombolýzaÚvod
Cévní mozkové příhody (CMP) patří k nejčastějším příčinám mortality a morbidity ve vyspělých zemích [1,2]. Ischemické CMP, které tvoří okolo 80 % všech mozkových příhod, jsou nejčastěji způsobené akutní okluzí mozkové tepny. Třicetidenní mortalita ischemické CMP se pohybuje mezi 10 a 17 %, přičemž u pacientů s rozsáhlou ischemickou lézí dosahuje až 75 % [3]. Navíc 20 % přeživších pacientů má těžké následky vyžadující dlouhodobou ošetřovatelskou péči. Pouze 30 % pacientů je po třech měsících plně soběstačných s minimálním nebo žádným neurologickým deficitem [2].
Výsledný zdravotní stav pacienta po ischemické CMP je závislý kromě komorbidit a komplikací především na místě okluze tepny a rychlosti její rekanalizace. Časná rekanalizace (do 6 hod od začátku příznaků) je spojena s výrazně vyšší šancí na dobrý výsledný klinický stav po 90 dnech s výraznou redukcí mortality [4].
Teprve zavedení intravenózní trombolýzy (IVT), jako první specifické léčby ischemické CMP zvyšující procento časné rekanalizace tepny, do rutinní praxe změnilo signifikantně prognózu pacientů [5,6]. Podání IVT ve 4,5hodinovém časovém okně zvýšilo počet soběstačných pacientů v prvních třech měsících o 30 % [7]. Nicméně IVT je dle odhadů léčeno jen kolem 0,4–8,0 % pacientů s akutní ischemickou CMP, a to pro četné kontraindikace této léčby a riziko symptomatického intrakraniálního krvácení [7]. Navíc procento úspěšnosti časné rekanalizace u okluze hlavní tepny Willisova okruhu, vnitřní karotidy nebo vertebrální tepny je relativně nízké.
Z těchto důvodů jsou testovány další rekanalizační metody, jako intraarteriální a kombinovaná trombolýza nebo neurointervenční techniky (Merci, Penumbra, Solitaire, EPAR, LaTIS, Amplaplatz Goose-Neck snare, Attractor-18, Neuronet), které však lze provádět jen na specializovaných pracovištích [8–12].
Z metaanalýzy 53 klinických studií (2 066 pacientů) vyplývá, že časná rekanalizace je přítomna jen u 24,1 % pacientů bez specifické léčby (spontánní rekanalizace), 46,2 % pacientů léčených IVT, 63,2 % pacientů léčených intraarteriální trombolýzou, 67,5 % pacientů léčených kombinovanou intravenózní-intraarteriální trombolýzou a až 83,6 % pacientů léčených mechanickými metodami [13].
Další možností léčby ischemické CMP je ultrazvukem potencovaná rekanalizace okludované tepny zvaná sonotrombolýza (obr. 1, 2).
Obr. 1. TCD monitorovací přístroj s monitorovací 2MHz sondou upevněnou v monitorovací čepici. Na monitoru TCD křivka z a. cerebri media vpravo. 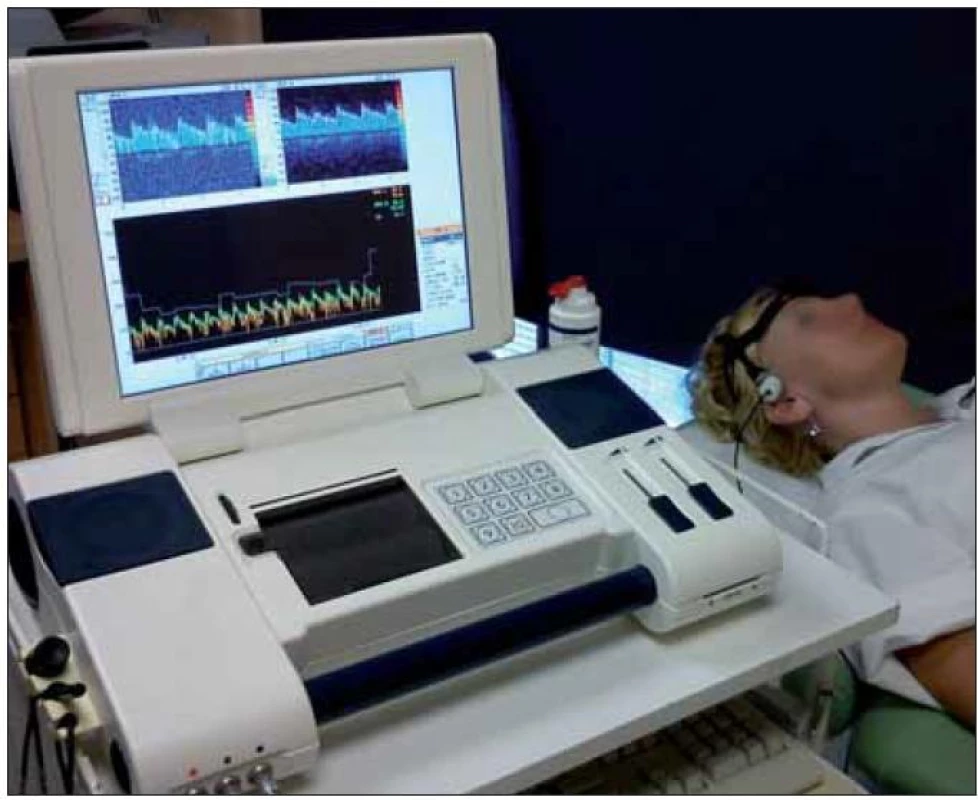
Obr. 2. Detail monitorovací čepice s 2MHz TCD sondou. 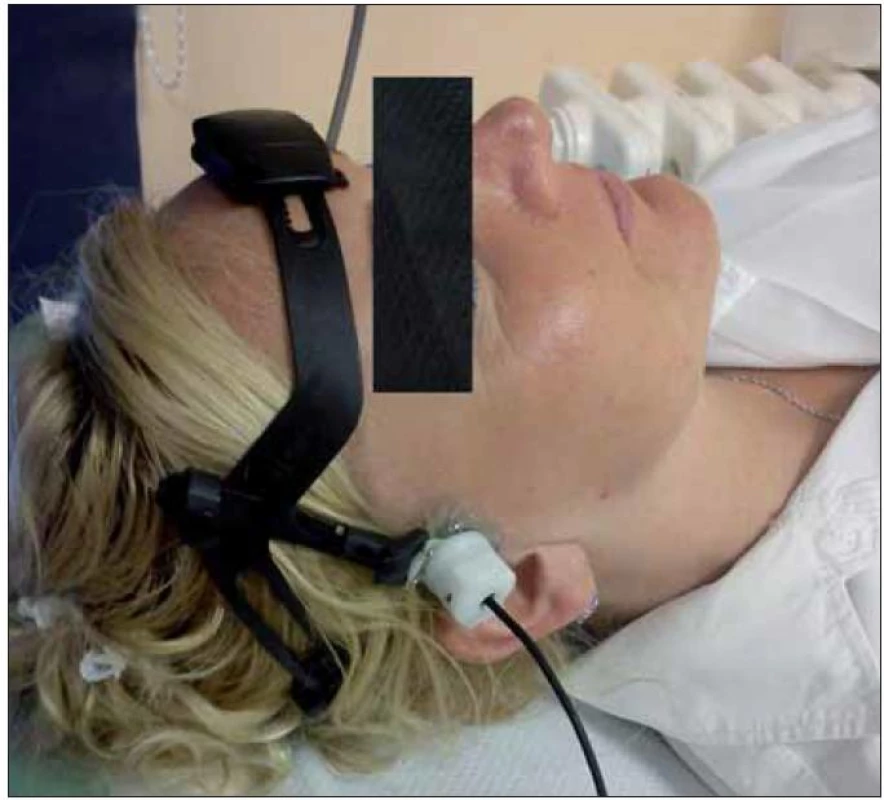
Mechanizmy účinků ultrazvuku
K základním biologickým efektům ultrazvuku, které lze využít terapeuticky patří:
- a) produkce tepla,
- b) tvorba kavitací a
- c) mikropohyb sonifikovaného média [14].
Při průchodu ultrazvukového vlnění biologickým materiálem (tkání) se ztrácí akustická energie, a to absorpcí, kdy dochází ke konverzi akustické energie na tepelnou třením částic v nosném médiu, a rozptylem. Absorpce je závislá hlavně na intenzitě ultrazvukového vlnění (čím větší intenzita, tím větší generace tepla), na frekvenci (čím vyšší frekvence, tím větší tepelný efekt) a na povaze média, kterým ultrazvuk prochází. Tepelný efekt je považován za hlavní příčinu fokálních lézí (koagulační nekrózy), které může ultrazvuk (HIFU) způsobit [15,16].
Při tvorbě kavitací se mění objem submikroskopických částic plynu, které jsou vystaveny ultrazvukovému vlnění. Existují dva typy kavitací – tranzientní a stabilní kavitace. Tranzientní kavitace vznikají působením nízkofrekvenčního ultrazvukového vlnění (20–100 kHz) s vyššími intenzitami (2–15 W/cm2). Dochází k rychlým změnám velikosti mikrobublin, jejich nestabilitě, kolapsům a vzniku tzv. šokových vln, čímž se vytvářejí síly odpovědné za mechanickou složku sonotrombolýzy. Tento efekt způsobuje mechanické rozrušení trombů a aterosklerotických plátů, a to i bez přítomnosti trombolytik [17,18].
Působením ultrazvuku s nižšími intenzitami (do 1 W/cm2) vznikají stabilní kavitace. Dochází k periodické změně (oscilaci) objemu bublin způsobené procházející tlakovou vlnou. Tento typ kavitací nemá mechanické účinky na trombus či aterosklerotické pláty [19]. Při oscilaci objemu bublin v oblasti trombu vzniká mikropohyb tekutiny a reverzibilní disagregace fibrinových vláken, což vede k lepšímu průniku trombolytika do trombu. Zároveň s těmito strukturálními změnami dochází k odkrývání receptorů pro t-PA, což jsou hlavní mechanizmy odpovědné za potenciaci systémové trombolýzy ultrazvukem při použití diagnostických frekvencí okolo 2 MHz [20–26].
In vitro studie
Použitím nízkofrekvenčního ultrazvuku (okolo 20 kHz) s vysokou intenzitou, zavedeného endovaskulárně se v in vitro modelech zabývalo několik prací [24,27–31]. Byla prokázána rychlá a účinná lýza trombů na mikroskopické fragmenty a také schopnost ultrazvuku rozrušit aterosklerotické pláty, a to jak fibrózní, tak i kalcifikované. Nežádoucím efektem této nízké frekvence však bylo termální postižení cévní stěny, které v některých případech vedlo až k její perforaci. Dalším rizikem této léčby je potenciální distální embolizace fragmentů vzniklých při mechanickém rozrušení trombu nebo aterosklerotického plátu.
Kromě endovaskulární aplikace bylo v dalších studiích testováno použití ultrazvuku externě k akceleraci enzymatické fibrinolýzy, přičemž byly použity různé frekvence ultrazvuku s nízkou intenzitou.
Otázkou zůstává efekt ultrazvuku při použití různých frekvencí. Bylo zkoumáno široké rozpětí ultrazvukových frekvencí od 50 kHz po 2 MHz [32,33].
Výzkumy s použitím vysokofrekvenčního ultrazvuku (0,5–3,4 MHz) ukázaly signifikantní zvýšení fibrinolytikem indukované fibrinolýzy při intenzitách ultrazvuku vyšších než 1 W/cm2 [26,34–39]. Stupeň ultrazvukové potenciace fibrinolýzy byl závislý na intenzitě a na koncentraci fibrinolytika; zvýšení fibrinolýzy nebylo pozorováno bez přítomnosti fibrinolytika ani nebyla zjištěna mechanická fragmentace trombů. Při použití nízkofrekvenčního ultrazvuku (20–170 kHz) byla také prokázána akcentace fibrinolýzy, a to vyšší než při použití ultrazvuku s vyššími frekvencemi [39–42].
Výsledky in vitro studií ukazují, že ultrazvuk s nízkými intenzitami akceleruje fibrinolýzu při použití trombů z čistého fibrinu, plazmy anebo celé krve při použití různých fibrinolytik (t-PA, urokinázy i streptokinázy). Rychlost fibrinolýzy je závislá na intenzitě a frekvenci ultrazvukového vlnění. Při vyšších frekvencích nedochází k mechanické lýze trombu, ale akcentaci enzymatického procesu fibrinolýzy.
Studie in vivo se zvířecími modely
Ve studiích in vivo byl na zvířecích modelech zkoumán efekt ultrazvuku s vysokou intenzitou a nízkou frekvencí již od 80. let minulého století. V několika pracích byl u psích modelů femorální a koronární trombózy aplikován ultrazvuk endovaskulárně, a to bez použití fibrinolytika [30,31,43,44]. Rekanalizace byla pozorována u většiny zvířat; nedošlo k žádné perforaci tepny v místě insonace, přesto však byly nalezeny histologické známky poškození cévní stěny.
Další studie testovaly na zvířecích modelech efekt ultrazvuku s nízkou intenzitou k augmentaci enzymatické fibrinolýzy za použití systémového fibrinolytika (t-PA, urokináza, streptokináza). Tachibana [45] v modelech s krysí femorální trombózou léčených intravenózní urokinázou a aplikací ultrazvuku o frekvenci 48 kHz dosáhl signifikantní snížení procenta ztráty končetiny u kombinované skupiny. Riggs et al [46] zkoumali efekt externě aplikovaného ultrazvuku u králičí arteriální trombózy. V terapeutické skupině s kombinací streptokinázy a ultrazvuku o frekvenci 1 MHz a intenzitě 2 W/cm2 dosáhl rekanalizace v 53 %, oproti 13 % ve skupině pouze se streptokinázou. Kornowski et al [47] studovali efekt ultrazvuku o frekvenci 1 MHz a intenzitě 6,3 W/cm2 v kombinaci s t-PA u králičích modelů femorální trombózy. Po iniciálním urychlení rekanalizace v kombinované skupině následovaly častější reokluze než při použití t-PA samostatně, takže ve výsledku bylo rekanalizací v kombinované skupině méně než u samotné t-PA. Vysvětlením nárůstu reokluze může být aktivace destiček ultrazvukem, což bylo v minulosti popsáno v studiích in vitro. Ishibashi et al [48] použili králičí model femorální trombózy s frekvencí 490 kHz a nízkou intenzitou 0,13 W/cm2 k testování kombinované aplikace ultrazvuku externě přes kousek temporální kosti s monteplázou. Procento rekanalizace bylo jen 16,7 % při použití samotné monteplázy, ale 66,7 % při kombinaci monteplázy s ultrazvukem.
Luo et al [35] použili ultrazvuk o nízké frekvenci 26 kHz a intenzitě 18 W/cm2 u králičích modelů femorální trombózy v kombinaci se streptokinázou. K rekanalizaci došlo u 59 % zvířat ve skupině kombinované terapie oproti 8 % a 7 % ve skupinách se samotnou streptokinázou a samotným ultrazvukem. Nežádoucím efektem zde byly kožní popáleniny a nekrózy tkáně. Nishioka et al [49] použili také ultrazvuk o nízké frekvenci 20 kHz a nízké intenzitě 1,5 W/cm2 v kombinaci s echokontrastní látkou dodecafluoropentanem. Rekanalizace dosáhli u 82 % modelů při kombinovaném použití v porovnání s 0 % a 9 % ve skupinách s použitím jen echokontrastní látky nebo jen ultrazvukem samotným. Při použití ultrazvuku však byly také nalezeny kožní nekrózy a těžké histopatologické změny v cévní stěně.
Výsledky z in vivo zvířecích studií poukazují na potenciál ultrazvuku v léčbě arteriálních a pravděpodobně i žilních trombóz, a to s použitím endovaskulárně aplikovaného ultrazvuku s vyššími intenzitami, kde však hrozí vyšší riziko poškození cévní stěny a možnost distální embolizace, nebo akcentací enzymatické fibrinolýzy ultrazvukem s nízkými intenzitami aplikovaným transkutánně s minimální evidencí poškození cévní stěny. Při použití nižších frekvencí a vyšších intenzit ultrazvuku však může dojít k postižení kůže i podkožních tkání.
Klinické studie s diagnostickými frekvencemi
Cílem studie ACUTE (Analysis of Coronary Ultrasound Thrombolysis Endpoints in Acute Myocardial Infarction) bylo prokázat trombolytický efekt nízkofrekvenčního ultrazvuku s frekvencí 45 kHz a vysokou intenzitou (18 W/cm2) použitého endovaskulárně u akutní okluze koronární tepny [50]. Kompletní rekanalizace bylo dosaženo u 87 % pacientů. Během terapie nebyly zaznamenány žádné nežádoucí účinky a u 80 % pacientů došlo ke klinickému zlepšení.
První randomizovanou studií testující terapeutický efekt ultrazvuku u pacientů s ischemickou CMP byla studie CLOTBUST (Combined Lysis of Thrombus in Brain ischemia using Transcranial Ultrasound and Systemic TPA) [51]. Tato studie prokázala, že použití sonotrombolýzy při systémové trombolýze t-PA může až ztrojnásobit šanci na plnou a trvající rekanalizaci okludované tepny než při samotné systémové trombolýze s t-PA, a to bez zvýšení rizika vzniku symptomatických intracerebrálních hemoragií (ICH).
Eggers et al [52] v roce 2008 publikovali výsledky studie, ve které použili u pacientů léčených IVT sonotrombolýzu prováděnou transkraniální duplexní sondou s frekvencí 1,8 (–4) MHz. V terapeutické skupině popsali vyšší procento kompletních rekanalizací a lepší časný výsledný stav i lepší klinický stav po třech měsících (mRS 0–1 : 21 vs 0 %), avšak také vyšší výskyt symptomatických ICH (15,7 vs 5,6 %).
Školoudík et al [53] publikovali v roce 2008 výsledky multicentrické studie případů a kontrol, ve které byla prováděna sonotrombolýza u pacientů s akutní okluzí a. cerebri media (ACM) pomocí transkraniální duplexní sondy s frekvencí 2 MHz po dobu 20–45 min. Procento rekanalizace tepny 6. a 24. hodinu od začátku příznaků bylo signifikantně vyšší ve skupině sonotrombolýzy oproti kontrolní skupině. Také dobrý výsledný klinický stav po 90 dnech (mRS 0–2) byl ve skupině se sonotrombolýzou výrazně častější (61,5 % pacientů) než v kontrolní skupině (32,7 % pacientů). Procento symptomatických ICH bylo v obou skupinách stejné (3,8 %). Tato studie potvrdila jak bezpečnost, tak efektivnost sonotrombolýzy s použitím diagnostické 2MHz transkraniální duplexní sondy v terapii akutní okluze ACM.
Další autoři [53–55] popsali efekt sonotrombolýzy také u pacientů s ischemickou CMP kontraindikovaných k IVT. Cintas et al [55] publikovali již v roce 2002 kazuistiky pacientů s akutní okluzí kmene ACM léčených pouze sonotrombolýzou s transkraniálním dopplerovským (TCD) monitoringem pomocí diagnostické 2MHz sondy. Parciální rekanalizace během monitorování nastala v 83 % případů. Zlepšení v NIHSS během 24 hod bylo o 21,7 %.
Eggers et al [54] popisují soubor pacientů s akutní ischemickou CMP a okluzí ACM léčených sonotrombolýzou při použití duplexní transkraniální sondy s frekvencí 2 MHz. V terapeutické skupině došlo častěji jak k parciální rekanalizaci, tak zlepšení NIHSS o více než čtyři body. Výsledný klinický stav po třech měsících se však v obou skupinách signifikantně nelišil.
Vysvětlení terapeutického principu sonotrombolýzy se věnovali Školoudík et al [56,57]. Prokázali přímé ovlivnění fibrinolytického systému pomocí transkraniální duplexní sondy s diagnostickou frekvencí 2 MHz u zdravých dobrovolníků. Při hodinovém ultrazvukovém monitorování a. cerebri media i a. radialis došlo k snížení hladiny inhibitorů fibrinolýzy (PAI-1 antigenu, aktivity plazminogenu a alfa-2 antiplazminu) [57]. Změnu aktivity fibrinolytického systému zkoumali také u pacientů s akutní okluzí ACM léčených 60minutovou sonotrombolýzou, při níž použili transkraniální duplexní sondu s diagnostickou frekvencí 2 MHz. Ve skupině pacientů léčených sonotrombolýzou bylo prokázáno signifikantní snížení hladiny PAI-1 antigenu, α-2-antiplazminu a plazminogenu a zvýšení hladiny t-PA oproti kontrolní skupině. Tyto nálezy byly mnohem výraznější u pacientů léčených kombinací t-PA se sonotrombolýzou než u samotné sonotrombolýzy. Nebyly zaznamenány signifikantní rozdíly v počtu symptomatických ICH mezi jednotlivými skupinami. Tato studie prokázala, že aktivace fibrinolytického systému je jedním z vysvětlení terapeutického účinku ultrazvuku u pacientů s akutní okluzí ACM léčených sonotrombolýzou [57].
První studii testující přídatný efekt echokontrastní látky u pacientů léčených sonotrombolýzou provedli Rubiera et al v roce 2008 [58]. Ve studii testoval kombinaci IVT, sonotrombolýzy s 2MHz TCD sondou s podáním echokontrastní látky. Cílem studie bylo porovnat efektivitu dvou typů echokontrastních látek: vzduchové mikrobubliny na bázi galaktózy (LevovistTM) a sulfurhexafluoridové mikrobubliny (SonovueTM).
Procento rekanalizace, zlepšení klinického stavu (hodnoceného v škále NIHSS) i procento soběstačných pacientů po třech měsících (mRS 0–2) se v obou skupinách signifikantně nelišilo. Symptomatické ICH se vyskytly celkem u čtyř pacientů, z toho u tří (3,3 %) ve skupině s LevovistemTM a jednoho (2,1 %) ve skupině se SonovueTM. Tato studie prokázala bezpečnost použití echokontrastních látek v potenciaci sonotrombolýzy, neprokázala však rozdíl při použití LevovistuTM a SonovueTM.
Alexandrov et al [59] publikovali v roce 2008 výsledky pilotní randomizované klinické studie s použitím sonotrombolýzy potencované echokontrastní látkou nové generace (perfluten-lipid microspheres) v terapii akutní ischemické CMP zaměřené na bezpečnost a účinnost této terapie. Asymptomatická ICH byla zjištěna u 25 % pacientů v terapeutické skupině a u 33 % v kontrolní skupině. Symptomatická ICH nebyla detekována. Procento kompletní rekanalizace do 2 hod od začátku terapie bylo ve skupině pacientů léčených kombinací IVT, sonotrombolýzy a echokontrastní látky 50 % ve srovnání s 18 % v kontrolní skupině vybrané ze studie CLOTBUST (pouze IVT léčba). Tato studie prokázala bezpečnost kombinovaného podání IVT, sonotrombolýzy a echokontrastní látky. Větší procento asymptomatických hemoragických transformací v této studii oproti dřívějším studiím bylo zároveň spojeno s vyšším procentem rekanalizace i lepším výsledným klinickým stavem.
Také Perren et al [60] prokázali výraznější úpravu neurologického deficitu hodnoceného v škále NIHSS a zlepšení v průtokovém signálu okludované tepny při použití sonotrombolýzy (2MHz duplexní transkraniální sonda) v kombinaci s echokontrastní látkou (SonovueTM) u pacientů s akutní okluzí ACM léčených pomocí IVT.
Dinia et al [61] v roce 2009 publikovali studii zaměřenou na riziko vzniku hemoragické transformace ischemie při terapii IVT v kombinaci se sonotrombolýzou potencovanou echokontrastní látkou. Studie prokázala efektivnost této kombinované terapie s častější rekanalizací okludované tepny, vyšším procentem dobrého výsledného stavu, ale také vyšší pravděpodobností vzniku asymptomatické hemoragické transformace. Tento nález potvrdil hypotézu, že nález asymptomatické hemoragické transformace ischemie je známkou časné reperfuze a následkem dobrého výsledného klinického stavu.
Další klinickou studií sledující efekt echokontrastní látkou potencované sonotrombolýzy byla studie TUCSON (Transcranial Ultrasound in Clinical Sonothrombolysis) [62], ve které byla použita sonotrombolýza pomocí 2MHz TCD sondy jako přídatná terapie k IVT zároveň s použitím echokontrastní látky MRX-801 (perfluten-lipid uS). Primárním end-pointem byl výskyt symptomatických ICH v závislosti na dávce echokontrastu.
Studie TUCSON ukázala, že podání echokontrastní látky (MRX-801) v dávce 1,4 ml kontinuální 90minutovou infuzí během systémové trombolýzy kombinované se sonotrombolýzou pomocí 2MHz TCD sondy je bezpečné a efektivní z pohledu jak urychlení rekanalizace, tak výsledného klinického stavu i výskytu symtomatických ICH. Vyšší dávky echokontrastní látky (MRX-801) jsou však potenciálně nebezpečné pro výskyt závažných hemoragických komplikací.
Šaňák et al [63] publikovali studii, ve které randomizovali 40 pacientů s akutní okluzí ACM do tří terapeutických skupin. Dvacet pacientů bylo léčeno IVT do 3 hod od vzniku iktu, 10 intraarteriální trombolýzou (IAT) a 10 pacientů 60minutovou sonotrombolýzou s 2MHz duplexní transkraniální sondou v časovém okně do 6 hod od vzniku iktu. Incidence symptomatických ICH byla ve skupině léčených IVT 5 %, ve skupině se sonotrombolýzou 0 % a ve skupině s IAT 20 %. Během prvních 24 hod došlo ke zlepšení klinického stavu u 45 % pacientů s IVT, 70 % pacientů léčených sonotrombolýzou a 70 % ve skupině s IAT. Dobrý výsledný klinický stav (mRS 0–2) po 90 dnech se však v jednotlivých terapeutických skupinách signifikantně nelišil.
Klinické studie s nediagnostickými frekvencemi
Studie TRUMBI (TRanscranial low-frequency Ultrasound Mediated Thrombolysis in Brain Ischemia) [64] byla první klinickou studií, v níž bylo použito nízkofrekvenčního ultrazvuku (300 kHz, intenzita 700 mW/cm2) aplikovaného transkraniálně po dobu 90 min pro potenciaci rekanalizace okludované mozkové tepny u pacientů léčených IVT. V plánu bylo zařazení celkově 48 pacientů, ale studie byla předčasně ukončena po zařazení 26 pacientů, a to pro vysoký výskyt symptomatických ICH. Tato studie poukázala na závažné nežádoucí účinky nízkofrekvenčního ultrazvuku aplikovaného transkraniálně u člověka, což bylo v rozporu se studiemi na zvířecích modelech. Výskyt symptomatických ICH v oblasti postižené ischemií, ale i ve vzdálených oblastech, byl větší než ve studiích pouze s IVT. Jedna z hypotéz vysvětlující souvislost vzniklých hemoragií ve studii TRUMBI je abnormní permeabilita hemato-encefalické bariéry u člověka, vzniklá působením nízkofrekvenčního ultrazvuku. Další možností je mnohočetné odražení ultrazvukové vlny (použité ve studii) uvnitř lebky, čímž se může výrazně zvýšit intenzita aplikovaného ultrazvuku v některých lokalitách mozku.
Reinhard et al [65] zkoumali efekt ultrazvuku s nízkou frekvencí na hemato-encefalickou bariéru. Čtyři pacienti s těžkou mozkovou mikroangiopatií byli transkraniálně insonováni pomocí ultrazvuku s frekvencí 300 kHz. Vyšetření pomocí TCD po 30 a 60 min neprokázalo žádné změny v průtocích v mozkových tepnách. Jeden pacient byl vyšetřen perfuzí váženou magnetickou rezonancí, kde byly zjištěny známky subarachnoidálního krvácení frontoparietálně po 60 min ultrazvukové intervence. Pacient byl asymptomatický, vyšetření likvoru pouze prokázalo vysokou koncentraci Gd-DTPA a žádné erytrocyty. Z bezpečnostních důvodů bylo rozhodnuto studii předčasně ukončit. Nález v této studii poukazuje na abnormní permeabilitu hemato-encefalické bariéry po insonaci nízkofrekvenčním ultrazvukem.
Klinické studie s endovaskulárním ultrazvukem
Prvním systémem umožňujícím endovaskulární aplikaci ultrazvuku je systém EKOS. Tento systém umožňuje lokální (endovaskulární) aplikaci ultrazvuku o frekvenci 1,7–2,35 MHz s emitovanou intenzitou 400 mW/cm2, a to i v kombinaci s intraarteriální aplikací trombolytika.
Efekt samotného endovaskulárně aplikovaného ultrazvuku s vyšší intenzitou bez použití trombolytika byl poprvé klinicky zkoumán na koronárních tepnách. Výsledky pilotních studií ukázaly potenciální efekt a bezpečnost této metody [66,67].
Mahon et al [66] publikovali jako první zkušenosti s intraarteriální sonotrombolýzou pomocí systému EKOS u pacientů s akutní ischemickou CMP. Použili kombinaci intraarteriální trombolýzy s použitím t-PA s intraarteriální aplikací ultrazvuku kontinuálně po dobu 60 minut. V souboru bylo 10 pacientů s okluzí ACM a čtyři pacienti s okluzí a. basilaris. Parciální nebo kompletní rekanalizace byla detekována u 57 % pacientů a nebyly pozorovány žádné nežádoucí účinky během terapie. Medián mRS po třech měsících u přeživších pacientů byl 2 u pacientů s ischemií v povodí ACM a 3 u pacientů s ischemií ve vertebrobazilárním povodí.
Naše pilotní výsledky také ukazují, že léčba pacientů s akutní okluzí mozkové tepny léčených systémem EKOS je bezpečná a pravděpodobně účinná [67]. Do prospektivní monocentrické studie bylo zařazeno 11 pacientů s akutní ischemickou CMP. Šest pacientů mělo okluzi ACM, pět pacientů okluzi a. basilaris. Kompletní rekanalizace na konci sonotrombolýzy systémem EKOS bylo dosaženo u 73 % pacientů. 54,5 % pacientů bylo soběstačných (mRS 0–3) po 90 dnech; medián mRS byl 4. Nebylo zaznamenáno žádné symptomatické intracerebrální krvácení.
Závěr
Sonotrombolýza je nadějná metoda léčby akutní ischemické CMP, a to pro možnost urychlení rekanalizace tepny, dobrou dostupnost, nízkou cenu a bezpečnost. I přes velký počet studií zatím není prokázáno, jaké frekvence, intenzita a charakter ultrazvukového vlnění jsou v procesu sonotrombolýzy nejúčinnější a nejbezpečnější. Základními limity této léčby jsou v současnosti kvalita temporálního kostního okna a částečně ovlivnitelná použitím echokontrastní látky.
MUDr. Martin Kuliha
Neurologická klinika LF OU a FN
17. listopadu 1790
70 852 Ostrava-Poruba
e-mail: martin.kuliha@email.cz
Přijato k recenzi: 24. 5. 2011
Přijato do tisku: 1. 8. 2011
Podpořeno grantem IGA MZ ČR NT/11386-5/2010.
Zdroje
1. Feigin VL, Lawes CM, Bennett DA, Anderson CS. Stroke epidemiology: a review of population-based studies of incidence, prevalence, and case-fatality in the late 20th century. Lancet Neurol 2003; 2(1): 43–53.
2. Rosamond W, Flegal K, Furie K, Go A, Greenlund K, Haase N et al. Heart disease and stroke statistics – 2008 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2008; 117(4): e25–e146.
3. van der Worp HB, van Gijn J. Clinical practice. Acute ischemic stroke. N Engl J Med 2007; 357(6): 572–579.
4. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke 2007; 38(3): 967–973.
5. Blakeley JO, Llinas RH. Thrombolytic therapy for acute ischemic stroke. J Neurol Sci 2007; 261(1–2): 55–62.
6. Brott T, Bogousslavsky J. Treatment of acute ischemic stroke. N Engl J Med 2000; 343(10): 710–722.
7. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333(24): 1581–1587.
8. Smith WS, Sung G, Starkman S, Saver JL, Kidwell CS, Gobin YP et al, for MERCI Trial Investigators. Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial. Stroke 2005; 36(7): 1432–1438.
9. Chopko BW, Kerber C, Wong W, Georgy B. Transcatheter snare removal of acute middle cerebral artery thromboembolism: technical case report. Neurosurgery 2000; 46(6): 1529–1531.
10. Kerber CW, Barr JD, Berger RM, Chopko BW. Snare retrieval of intracranial thrombus in patients with acute stroke. J Vasc Interv Radiol 2002; 13(12): 1269–1274.
11. Fourie P, Duncan IC. Microsnare-assisted mechanical removal of intraprocedural distal middle cerebral arterial thromboembolism. AJNR Am J Neuroradiol 2003; 24(4): 630–632.
12. Schumacher HC, Meyers PM, Yavagal DR, Harel NY, Elkind MS, Mohr JP et al. Endovascular mechanical thrombectomy of an occluded superior division branch of the left MCA for acute cardioembolic stroke. Cardiovasc Intervent Radiol 2003; 26(3): 305–308.
13. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke 2007; 38(3): 967–973.
14. Harvey EN. Biological aspects of ultrasonic waves, a general survey. Biol Bull 1930; 59(3): 306–325.
15. Haar GT, Coussios C. High intensity focused ultrasound: physical principles and devices. Int J Hyperthermia 2007; 23(2): 89–104.
16. Khokhlova VA, Bailey MR, Reed JA, Cunitz BW, Kaczkowski PJ, Crum LA. Effects of nonlinear propagation, cavitation, and boiling in lesion formation by high intensity focused ultrasound in a gel phantom. J Acoust Soc Am 2006; 119(3): 1834–1848.
17. Spengos K, Behrens S, Daffertshofer M, Dempfle CE, Hennerici M. Acceleration of thrombolysis with ultrasound through the cranium in a flow model. Ultrasound Med Biol 2000; 26(5): 889–895.
18. Dijkmans PA, Juffermans LJ, Musters RJ, van Wamel A, ten Cate FJ, van Gilst W et al. Microbubbles and ultrasound: from diagnosis to therapy. Eur J Echocardiogr 2004; 5(4): 245–256.
19. Prokop AF, Soltani A, Roy RA. Cavitational mechanisms in ultrasound-accelerated fibrinolysis. Ultrasound Med Biol 2007; 33(6): 924–933.
20. Braaten JV, Goss RA, Francis CW. Ultrasound reversibly disaggregates fibrin fibers. Thromb Haemost 1997; 78(3): 1063–1068.
21. Coussios CC, Farny CH, Haar GT, Roy RA. Role of acoustic cavitation in the delivery and monitoring of cancer treatment by high-intensity focused ultrasound (HIFU). Int J Hyperthermia 2007; 23(3): 105–120.
22. Nyborg WL. Biological effects of ultrasound: development of safety guidelines. Part II: general review. Ultrasound Med Biol 2001; 27(3): 301–333.
23. Diamond SL, Anand S. Inner clot diffusion and permeation during fibrinolysis. Biophys J 1993; 65(6): 2622–2643.
24. Francis CW, Blinc A, Lee S, Cox C. Ultrasound accelerates transport of recombinant tissue plasminogen activator into clots. Ultrasound Med Biol 1995; 21(3): 419–424.
25. Sakharov DV, Hekkenberg RT, Rijken DC. Acceleration of fibrinolysis by high-frequency ultrasound: the contribution of acoustic streaming and temperature rise. Thromb Res 2000; 100(4): 333–340.
26. Francis CW, Onundarson PT, Carstensen EL, Blinc A, Meltzer RS, Schwarz K et al. Enhancement of fibrinolysis in vitro by ultrasound. J Clin Invest 1992; 90(5): 2063–2068.
27. Siegel RJ, Fishbein MC, Forrester J, Moore K, DeCastro E, Daykhovsky L et al. Ultrasonic plaque ablation. A new method for recanalization of partially or totally occluded arteries. Circulation 1988; 78(6): 1443–1448.
28. Rosenschein U, Bernstein JJ, DiSegni E, Kaplinsky E, Bernheim J, Rozenzsajn LA. Experimental ultrasonic angioplasty: disruption of atherosclerotic plaques and thrombi in vitro and arterial recanalization in vivo. J Am Coll Cardiol 1990; 15(3): 711–717.
29. Hong AS, Chae JS, Dubin SB, Lee S, Fishbein MC, Siegel RJ. Ultrasonic clot disruption: an in vitro study. Am Heart J 1990; 120(2): 418–422.
30. Ariani M, Fishbein MC, Chae JS, Sadeghi H, Michael AD, Dubin SB et al. Dissolution of peripheral arterial thrombi by ultrasound. Circulation 1991; 84(4): 1680–1688.
31. Steffen W, Fishbein MC, Luo H, Lee DY, Nita H, Cumberland DC et al. High intensity, low frequency catheter-delivered ultrasound dissolution of occlusive coronary artery thrombi: an in vitro and in vivo study. J Am Coll Cardiol 1994; 24(6): 1571–1579.
32. Siddiqi F, Blinc A, Braaten J, Francis CW. Ultrasound increases flow through fibrin gels. Thromb Haemost 1995; 73(3): 495–498.
33. Braaten JV, Goss RA, Francis CW. Ultrasound reversibly disaggregates fibrin fibers. Thromb Haemost 1997; 78(3): 1063–1068.
34. Lauer CG, Burge R, Tang DB, Bass BG, Gomez ER, Alving BM. Effect of ultrasound on tissue-type plasminogen activator-induced thrombolysis. Circulation 1992; 86(4): 1257–1264.
35. Luo H, Nishioka T, Fishbein MC, Cercek B, Forrester JS, Kim CJ et al. Transcutaneous ultrasound augments lysis of arterial thrombi in vivo. Circulation 1996; 94(4): 775–778.
36. Harpaz D, Chen X, Francis CW, Meltzer RS. Ultrasound accelerates urokinase-induced thrombolysis and reperfusion. Am Heart J 1994; 127(5): 1211–1219.
37. Harpaz D, Chen X, Francis CW, Marder VJ, Meltzer RS. Ultrasound enhancement of thrombolysis and reperfusion in vitro. J Am Coll Cardiol 1993; 21(6): 1507–1511.
38. Devcic-Kuhar B, Pfaffenberger S, Gherardini L, Mayer C, Gröschl M, Kaun C et al. Ultrasound affects distribution of plasminogen and tissue-type plasminogen activator in whole blood clots in vitro. Thromb Haemost 2004; 92(5): 980–985.
39. Olsson SB, Johansson B, Nilsson AM, Olsson C, Roijer A. Enhancement of thrombolysis by ultrasound. Ultrasound Med Biol 1994; 20(4): 375–382.
40. Tachibana K. Enhancement of fibrinolysis with ultrasound energy. J Vasc Interv Radiol 1992; 3(2): 299–303.
41. Sehgal CM, Leveen RF, Shlansky-Goldberg RD. Ultrasound-assisted thrombolysis. Invest Radiol 1993; 28(10): 939–943.
42. Suchkova V, Siddiqi FN, Carstensen EL, Dalecki D, Child S, Francis CW. Enhancement of fibrinolysis with 40-kHz ultrasound. Circulation 1998; 98(10): 1030–1035
43. Trübestein G, Engel C, Etzel F, Sobbe A, Cremer H, Stumpff U. Thrombolysis by ultrasound. Clin Sci Mol Med 1976; 3 (Suppl): 697s–698s.
44. Rosenschein U, Frimerman A, Laniado S, Miller HI. Study of the mechanism of ultrasound angioplasty from human thrombi and bovine aorta. Am J Cardiol 1994; 74(12): 1263–1266.
45. Tachibana S. Application of ultrasonic vibration for boosting fibrinolytic effect of urokinase in rats. Blood Vessel 1985; 16 : 46–49.
46. Riggs PN, Francis CW, Bartos SR, Penney DP. Ultrasound enhancement of rabbit femoral artery thrombolysis. Cardiovasc Surg 1997; 5(2): 201–207.
47. Kornowski R, Meltzer RS, Chernine A, Vered Z, Battler A. Does external ultrasound accelerate thrombolysis? Results from a rabbit model. Circulation 1994; 89(1): 339–344.
48. Ishibashi T, Akiyama M, Onoue H, Abe T, Furuhata H. Can transcranial ultrasonication increase recanalization flow with tissue plasminogen activator? Stroke 2002; 33(5): 1399–1404.
49. Nishioka T, Luo H, Fishbein MC, Cercek B, Forrester JS, Kim CJ et al. Dissolution of thrombotic arterial occlusion by high intensity, low frequency ultrasound and dodecafluoropentane emulsion: an in vitro and in vivo study. J Am Coll Cardiol 1997; 30(2): 561–568.
50. Rosenschein U, Roth A, Rassin T, Basan S, Laniado S, Miller HI. Analysis of coronary ultrasound thrombolysis endpoints in acute myocardial infarction (ACUTE trial). Results of the feasibility phase. Circulation 1997; 95(6): 1411–1416.
51. Alexandrov AV, Molina CA, Grotta JC, Garami Z, Ford SR, Alvarez-Sabin J et al. Ultrasound-enhanced systemic thrombolysis for acute ischemic stroke. N Engl J Med 2004; 351(21): 2170–2178.
52. Eggers J, Koch B, Meyer K, König I, Seidel G. Effect of ultrasound on thrombolysis of middle cerebral artery occlusion. Ann Neurol 2003; 53(6): 797–800.
53. Skoloudik D, Bar M, Skoda O, Vaclavik D, Hradilek P, Allendoerfer J et al. Safety and efficacy of the sonographic acceleration of the middle cerebral artery recanalization: results of the pilot thrombotripsy study. Ultrasound Med Biol 2008; 34(11): 1775–1782.
54. Eggers J, Seidel G, Koch B, König IR. Sonothrombolysis in acute ischemic stroke for patients ineligible for rt-PA. Neurology 2005; 64(6): 1052–1054.
55. Cintas P, Le Traon AP, Larrue V. High rate of recanalization of middle cerebral artery occlusion during 2-MHz transcranial color-coded Doppler continuous monitoring without thrombolytic drug. Stroke 2002; 33(2): 626–628.
56. Školoudík D, Fadrná T, Bar M, Zapletalová O, Zapletal O, Blatný J et al. Ovlivnění fibrinolytického systému pomocí kontinuálního dopplerovského monitoringu u zdravých dobrovolníků. Cesk Slov Neurol N 2009; 72/105(5): 446–452.
57. Skoloudík D, Fadrná T, Roubec M, Bar M, Zapletal O, Blatný J et al. Changes in hemocoagulation in acute stroke patients after one-hour sono-thrombolysis using a diagnostic probe. Ultrasound Med Biol 2010; 36(7): 1052–1059.
58. Rubiera M, Ribo M, Delgado-Mederos R, Santamarina E, Maisterra O, Delgado P et al. Do bubble characteristics affect recanalization in stroke patients treated with microbubble-enhanced sonothrombolysis? Ultrasound Med Biol 2008; 34(10) 1573–1577.
59. Alexandrov AV, Mikulik R, Ribo M, Sharma VK, Lao AY, Tsivgoulis G et al. A pilot randomized clinical safety study of sonothrombolysis augmentation with ultrasound-activated perflutren-lipid microspheres for acute ischemic stroke. Stroke 2008; 39(5): 1464–1469.
60. Perren F, Loulidi J, Poglia D, Landis T, Sztajzel R. Microbubble potentiated transcranial duplex ultrasound enhances IV thrombolysis in acute stroke. J Thromb Thrombolysis 2008; 25(2): 219–223.
61. Dinia L, Rubiera M, Ribo M, Maisterra O, Ortega G, del Sette M et al. Reperfusion after stroke sonothrombolysis with microbubbles may predict intracranial bleeding. Neurology 2009; 73(10): 775–780.
62. Molina CA, Barreto AD, Tsivgoulis G, Sierzenski P, Malkoff MD, Rubiera M et al. Transcranial ultrasound in clinical sonothrombolysis (TUCSON) trial. Ann Neurol 2009; 66(1): 28–38.
63. Sanák D, Herzig R, Skoloudik D, Horák D, Zapletalova J, Köcher M et al. The safety and efficacy of continuous transcranial duplex Doppler monitoring of middle cerebral artery occlusion in acute stroke patients: comparison of TCDD and thrombolysis in MCA recanalization. J Neuroimaging 2010; 20(1): 58–63.
64. Daffertshofer M, Gass A, Ringleb P, Sitzer M, Sliwka U, Els T et al. Transcranial low-frequency ultrasound-mediated thrombolysis in brain ischemia: increased risk of hemorrhage with combined ultrasound and tissue plasminogen activator: results of a phase II clinical trial. Stroke 2005; 36(7): 1441–1446.
65. Reinhard M, Hetzel A, Krüger S, Kretzer S, Talazko J, Ziyeh S et al. Blood-brain barrier disruption by low-frequency ultrasound. Stroke 2006; 37(3): 1546–1548.
66. Mahon BR, Nesbit GM, Barnwell SL, Clark W, Marotta TR, Weill A et al. North American clinical experience with the EKOS MicroLysUS infusion catheter for the treatment of embolic stroke. AJNR Am J Neuroradiol 2003; 24(3): 534–538.
67. Skoloudik D, Fadrna T, Prochazka V, Jonszta T, Herzig R, Roubec M. Safety and efficacy of EKOS system and Solitaire stent device in major cerebral artery occlusion: a randomized pilot study. Neurology 2011; 76 (9 Suppl 4): A91.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2012 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Webové okénko
-
Analýza dat v neurologii
XXXI. Bayesovská vs klasická statistika v medicínských aplikacích - Kdy vlastně začíná Alzheimerova nemoc – nová kritéria mírné kognitivní poruchy a Alzheimerovy nemoci
- Diabetes a schizofrenie
- Prof. MUDr. Stanislav Němeček, DrSc., osmdesátníkem
- IX. medzinárodné afaziologické sympózium, Bratislava
- Mezinárodní sympozium Dystonie a dystonické syndromy
- Multimodální neurozobrazování pomocí simultánního EEG-fMR
- Sonotrombolýza – mechanizmus účinku a její využití v léčbě ischemické cévní mozkové příhody
- Úvodník
- Laboratorní disekce drah laterálního aspektu mozkové hemisféry
- XIV. European Congress of Neurosurgery – Řím
- Variabilita genu pro angiotenzinogen a vnímavost k roztroušené skleróze
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Dětská intrakraniální aneuryzmata
- Zrakové funkce nedonošených dětí s perinatálním mozkovým postižením
- Správnost přednemocniční diagnózy cévní mozkové příhody
- Neurologická profesionální onemocnění v České republice v letech 1994–2009
- Rekanalizace akutních uzávěrů mozkových tepen pomocí retrahovatelného stentu
- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Paraneoplastická polymyozitida u karcinomu prostaty – kazuistika
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Diagnosticky specifické nálezy při posturografickém vyšetření – dvě kazuistiky
- Klinický standard pro farmakoterapii neuropatické bolesti
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Klinický standard pro farmakoterapii neuropatické bolesti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



