-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVícečetné nádory gastrointestinálního traktu v České republice v letech 1976–2005
Multiple Gastrointestinal Cancers in the Czech Republic 1976–2005
The aim of the study:
To describe multiple gastrointestinal cancers during 1976–2005.Material and methods:
Czech Cancer Registry recorded 355,624 of gastrointestinal (GI) cancers, of which there were analysed primary and subsequent neoplasms by sites ICD-10: C15-C25 and C00-D48 in men and women.Results:
Total of 41,534 multiple cancers (56.6 % men, 43.4 % women) represented 12.1 % of all registered GI cancers in men and 11.1 % in women. The primary 14,744 (35.5 %) GI cancers followed 16,362 neoplasms, the subsequent 26,790 (64.5 %) GI cancers preceded 31,519 neoplasms. The most frequent were multiple cancers of colon, rectosigmoideum and stomach, the higher were the subsequent cancers of pancreas. The number of primary GI cancers increased till 1997, then decreased, of subsequent ones increased permanently. The most percentage cancers contributed the age groups 50-69 years in men and the age up to 49 years and more than 80 years in women. The average lenght between the primary and subsequent diseases was 6.1 years. The proportion of 31.2 % synchronous and 68.8 % metachronous cancers was 1 : 3.6 in men and 1 : 5 in women. The most frequent of 5,101 synchronous were cancers of other GI 43.6 %, urinary tract 13.7 %, male genital organs 11.8 % and respiratory tract 10.8 % in men and cancers of other GI 44.2 %, female genital organs 13.8 %, urinary tract 9.8 % and breast 8.1 % in women. GI cancers of the second diagnose sequence preceded the most frequent cancers of skin 38.1 %, cancers of other GI 20.3 %, male genital organs 9.7 %, urinary 9.4 % and respiratory tract 8.2 % in men and cancers of skin 31.9 %, female genital organs 18.5 %, cancers of other GI 15.7 % and breast 15.4 % in women. From 14,744 primary GI cancers died 11,433 (77.5 %) and survived 3,311 (22.5 %) cases, from 26,790 subsequent GI cancers died 23,098 (86.2 %) and survived 3,692 (13.8 %) cases up to October 2007.Conclusions:
From nearly 1.5 million of all neoplasm sites in the Czech registry there were every the fifth GI cancer associated with multiple neoplasm during 1976–2005.Key words:
prevalence – primary and subsequent diseases – synchronous and metachronous occurrence – multiple cancers
Autoři: E. Geryk 1; Petr Dítě 1
; J. Kozel 2; R. Štampach 2; P. Kubíček 2
Působiště autorů: Fakultní nemocnice, Brno 1; Geografický ústav Přírodovědecké fakulty MU, Brno 2
Vyšlo v časopise: Gastroent Hepatol 2010; 64(1): 12-21
Kategorie: Původní práce
Souhrn
Cíl studie:
Popsat vícečetné nádory gastrointestinálního traktu v letech 1976–2005.Materiál a metodika:
Národní onkologický registr ČR evidoval 355 624 nádorů gastrointestinálního traktu (GIT), ze kterých byly u mužů a žen analyzovány primární a následné novotvary podle dg. C15-C25 a C00-D48.Výsledky:
Celkem 41 534 vícečetných nádorů (56,6 % mužů, 43,4 % žen) představovalo 12,1% všech evidovaných nádorů GIT u mužů a 11,1 % u žen. Po 14 744 (35,5 %) primárních GI nádorech se vyskytlo 16 362 novotvarů, 26 790 (64,5 %) následným GI nádorům předcházelo 31 519 novotvarů. Nejpočetnější byly vícečetné nádory tlustého střeva, rektosigmoidea a žaludku, vyšší byly následné karcinomy pankreatu. Počet primárních nádorů GIT rostl do roku 1997, pak klesal, následných trvale rostl. Procentně vyšší byly nádory u mužů ve věku 50-69 let, u žen do 49 let a nad 80 let. Průměrná doba mezi primárním a následným onemocněním byla 6,1 roku. Poměr mezi 31,2 % synchronními a 68,8 % metachronními nádory byl 1 : 3,6 u mužů a 1 : 5 u žen. Nejpočetnější z 5 101 synchronních byly u mužů jiné nádory GIT 43,6 %, vylučovacích cest 13,7 %, pohlavních orgánů 11,8 % a dýchacích cest 10,8 %, u žen jiné nádory GIT 44,2 %, rodidel 13,8 %, vylučovacích cest 9,8 % a prsů 8,1 %. Nádorům GIT jako druhé diagnóze nejvíce předcházely u mužů nádory kůže 38,1 %, jiné nádory GIT 20,3 %, pohlavních orgánů 9,7 %, vylučovacích 9,4 % a dýchacích cest 8,2 %, u žen nádory kůže 31,9 %, rodidel 18,5 %, jiné nádory GIT 15,7 % a prsů 15,4 %. K říjnu 2007 zemřelo z 14 744 primárních nádorů GIT 11 433 (77,5 %) a přežívalo 3 311 (22,5 %) případů, z 26 790 následných nádorů GIT zemřelo 23 098 (86,2 %) a přežívalo 3 692 (13,8 %) případů.Závěr:
Z téměř 1,5 milionu všech novotvarů v registru ČR byl za období 1976–2005 každý pátý nádor GIT spojen s vícečetným novotvarem.Klíčová slova:
prevalence – primární a následná onemocnění – synchronní a metachronní výskyt – vícečetné nádory„Bez ohledu na pokroky lékařských technologií, jakékoliv výrazné snížení úmrtnosti nebo zdravotních důsledků z nádorů vyplyne především z prevence a nikoli z léčby.“
Atlas nádorů, 2006 [1]Věnováno památce doc. MUDr. T. Hildebranda, CSc.
Úvod
Nové léčebné postupy a diagnostika v gastroonkologii přináší významné prodloužení délky života onkologicky nemocných. Jedním z přesvědčivých důkazů je vývoj počtu nádorů dokumentovaný trendy jejich okamžikové (point) prevalence jako ukazatel průřezové nemocnosti, která se u dg. C15-C25 zvýšila mezi roky 1989 a 2005 [2]:
- z 10 425 na 27 204 případů u mužů tj. o 161 %
- z 9 530 na 22 562 případů u žen tj. o 136,7 %
Při nárůstu absolutních počtů se procentní zastoupení zhoubných novotvarů gastrointestinálního traktu (ZN GIT) v prevalenci všech dg. C00-D09 za toto období mírně snížilo u mužů ze 14,7 % na 14,4 %, u žen z 9,2 % na 8,3 % při podstatně rychlejším nárůstu počtu žijících s nádory prostaty, varlat, ledvin, močového měchýře, štítné žlázy a melanomu kůže. Po nemocných, žijících s 147 137 nádory kůže a 51 205 nádory prsu v roce 2005 byl kolorektální karcinom (KRK) v prevalenci třetím nejpočetnějším u 22 618 mužů 18 443 žen, což bylo 10,4 % z evidovaných počtů. Rozdíl 65 998 onemocnění mezi počty případů a osob (cases/persons) u všech dg. C00-D09 v roce 2005 byl orientačním pohledem na vícečetné zhoubné novotvary (VZN), k jejichž výskytu v GIT přinášíme po úvodním sdělení [3] podrobnější přehled.
Z programu National Cancer Institute v datech SEER (Surveillance Epidemiology and End Results) byl u jednotlivých diagnóz analyzován poměr počtu zjištěných a předpokládaných onemocnění (O/E), očekávané atributivní riziko (EAR) a příčinné faktory. V letech 1973–2000 bylo u 261 711 nemocných s KRK (68,5 % colon, 29,6 % rektum, 1,9 % anus) popsáno zvýšené celkové riziko následných nádorů po ZN tlustého střeva (O/E = 1,07, O = 20,847, EAR = 13) a análního kanálu (O/E = 1,24, O = 509, EAR = 36), nikoli rekta. Další následné ZN GIT byly dávané do souvislosti se složením stravy a obezitou, ZN dělohy, vaječníků, ledvin a mozku, s familiární adenomatózní polypózou (FAP), s dědičným nepolypózním nádorem tlustého střeva (HNPCC) a Turcotovým syndromem. Vyšší riziko ZN bronchů po ZN rekta souviselo s kuřáctvím, zatímco ZN dělohy a močového měchýře byly spojovány s předcházející dlouhodobou radioterapií. U osob s análním karcinomem bylo vyšší riziko ZN jazyka a tonzil, plic, Kaposiho sarkomu, vulvy a vagíny jako asociace s rizikem lidského papilomaviru a HIV [4].
Z 18 402 ZN jícnu, 39 998 ZN žaludku, 5 432 ZN tenkého střeva, 11 500 ZN jater, 10 841 ZN žlučníku a žlučových cest, 38 351 ZN pankreatu popsala analýza SEER programu signifikantní zvýšení následných nádorů jen po ZN jícnu (O/E = 1,38, O = 635, EAR = 70) a tenkého střeva (O/E = 1,11, O = 422, EAR = 18). Zvýšené riziko ZN dutiny úst a dýchacích cest po ZN jícnu jako následek abusu alkoholu a tabáku se týkalo víc spinocelulárního (SCE) než adenokarcinomu (ACE). Nemocní se sarkomy tenkého střeva byli víc postiženi ZN ledvin, měkkých tkání a melanomu, u mladší populace byla uvedena asociace s HNPCC. Ke zvýšení rizika ZN ovaria a pankreatu po ZN žlučníku a následných ZN ovaria, úst, ledvin a štítné žlázy po ZN jater přispěl abusus alkoholu, zlepšená surveillance a bioptické rozlišení primárních a metastatických tumorů [5].
Podobným způsobem, i když za odlišná období, byly popsány trendy primárních a následných ZN GIT ve spektru ostatních novotvarů z údajů šesti onkologických registrů, jejichž systém evidence a kontrola údajů umožnily rozlišení vícečetných novotvarů podle mezinárodně přijatých kritérií [6–11].
Protože v přehledech a zpracováních dat české statistiky nebyl kromě sporadického sdělení [12] dosud přehledně zpracován vývoj vícečetných novotvarů u orgánů GIT, uvádíme jejich úvodní epidemiologickou charakteristiku vycházející z evidovaných počtů aktualizovaných metodickými pokyny ÚZIS ČR k obsahu datové struktury hlášení nádorů [13].
Metodika
Zpracování vícečetných nádorů vycházelo z počtu novotvarů nahlášených do registru nádorů ČR od května 1976 do prosince 2005, které byly verifikovány ÚZIS ČR k 17. 10. 2007. K prvním (primárním) onemocněním s dg. C15-C25 byly přiřazeny následné nádory s dg. C00-C96 a nejisté novotvary s dg. D00-D48 podle rodných čísel nemocných, která byla po kontrole údajů z důvodu ochrany dat odstraněna. Anonymizované sestavy byly převedeny ke zpracování do podoby kontingenčních tabulek. Procentní zastoupení primárních a následných onemocní GIT u mužů a žen bylo za uvedené období porovnáno s počty nově diagnostikových. U nemocných s primárními nádory GIT byly posouzeny následné novotvary podle synchronního a metachronního výskytu, tj. do prvního roku a v dalších letech po primárním onemocnění. Stejně byly posouzeny histologicky odlišné novotvary předcházející u nemocných následným karcinomům GIT.
Průměrná délka intervalu mezi primárním a následným onemocněním byla stanovena z násobku počtu případů a středu jejich intervalů. Pro úplnost jsou v přehledu uvedeny také údaje za rok 1976, i když počty nových onemocnění byly hlášeny do registru podle kritérií Mezinárodní agentury pro výzkum rakoviny (IARC) až od května. Mapy uvádí počty primárních ZN GIT na ploše jednotlivých krajů se sloupcovým grafem počtu primárních a následných multiplicit za celé období.
Výsledky
Za uvedené období bylo v registru evidováno 355 624 nových onemocnění nádory GIT, z toho 193 547 (54,4 %) u mužů a 162 077 (45,6 %) u žen. Z těchto počtů se mezi vícečetnými nádory vyskytlo 41 534 případů, z toho 23 488 (56,6 %) u mužů a 18 046 (43,4 %) u žen. Podle pořadí se tyto multiplicity týkaly:
- 8 862 (37,7 %) primárních a 14 626 (62,3 %) následných onemocnění u mužů
- 5 882 (32,6 %) primárních a 12 164 (67,4 %) následných onemocnění u žen
Jako druhá diagnóza se vyskytly nádory GIT u 23 462 nemocných, jako třetí u 2 571, jako čtvrtá u 477, jako pátá u 147 a jako šestá a další diagnóza u 133 osob. Na druhém pořadí se nádory GIT vyskytly u 53,9% mužů a 59,9 % žen (tab. 1).
Tab. 1. Pořadí vícečetných nádorů GIT. Tab. 1. Sequence of multiple GI cancers. 
U 14 744 nemocných s primárním nádorem GIT bylo následně diagnostikováno 16 362 novotvarů s dg. C00-D48 s převahou mužů nad ženami. Naopak 26 790 nemocným s následným nádorem GIT předcházelo 31 519 histologicky odlišných novotvarů s dg. C00-D48 (tab. 2).
Tab. 2. struktura nemocných s multiplicitami GIT 1976–2005. Tab. 2. Structure of patients with gastrointestinal multiplicities 1976–2005. 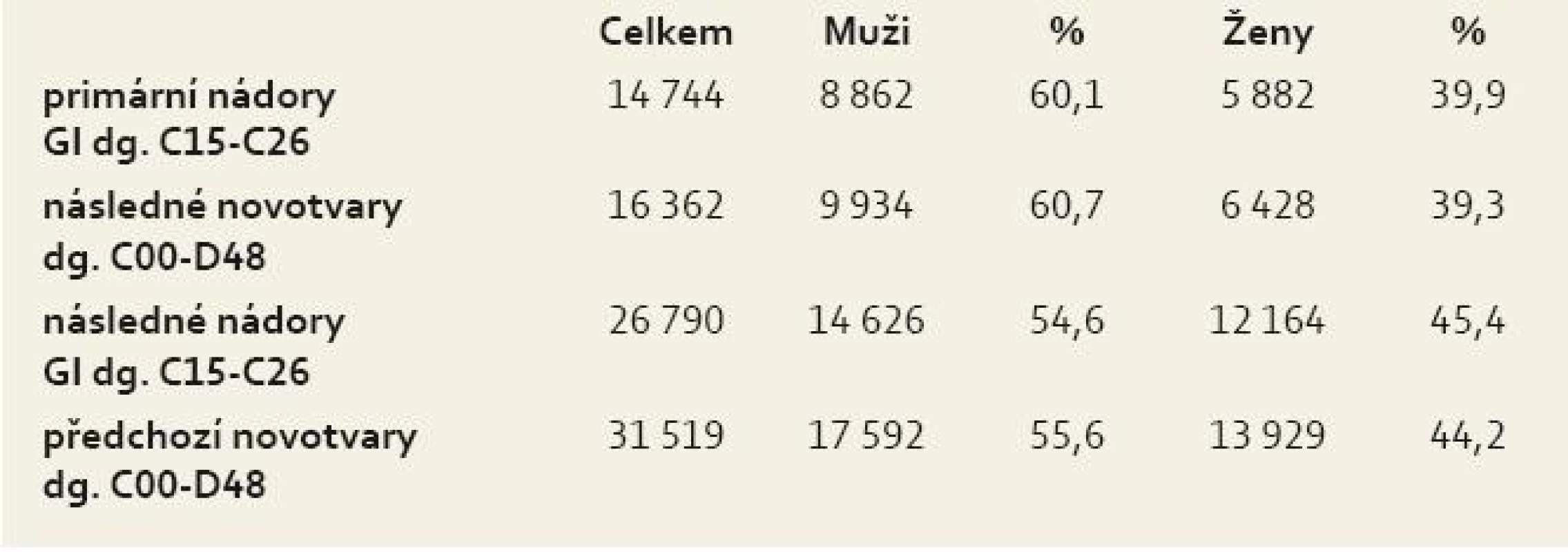
U primárních i následných diagnóz GIT byly nejpočetnější nádory tlustého střeva, rektosigmoidea a žaludku, muži i ženy byli postiženi vyšším výskytem následných karcinomů pankreatu (graf 1).
Graf 1. Zastoupení nemocných s 14 744 primárními a 26 790 následnými karcinomy gastrointenstinálního traktu. Graph 1. Representation of patients with 14,744 primary and 26,790 subsequent gastrointestinal cancers. 
Porovnání multiplicit s počty nově diagnostikovaných onemocnění za uvedené období ukázalo zastoupení 11,7 % (41 534 VZN) u obou pohlaví za všechny diagnózy GIT, 12,1 % (23 488 VZN) u mužů, 11,1 % (18 046 VZN) u žen. U primárních i následných onemocnění dohromady byly procentně početnější karcinomy tenkého střeva, tlustého střeva, rektosigmoidea, konečníku a analáního kanálu s menšími rozdíly mezi muži a ženami v zastoupení primárních a následných diagnóz u nových onemocnění (tab. 3). Z nich nejpočetnější multiplicity nádorů kolorekta se vyskytly v letech 1976–2005 u:
- 14 860 (15 %) mužů z 99 378 nově zjištěných onemocnění KRK
- 11 142 (14,1 %) žen z 78 977 nově zjištěných onemocnění KRK
Tab. 3. Zastoupení multiplicit u 355 624 nových nádorů GIT v letech 1976–2005. Tab. 3. Representation of multiplicities in 355,624 new gastrointestinal cancers in the period 1976–2005. 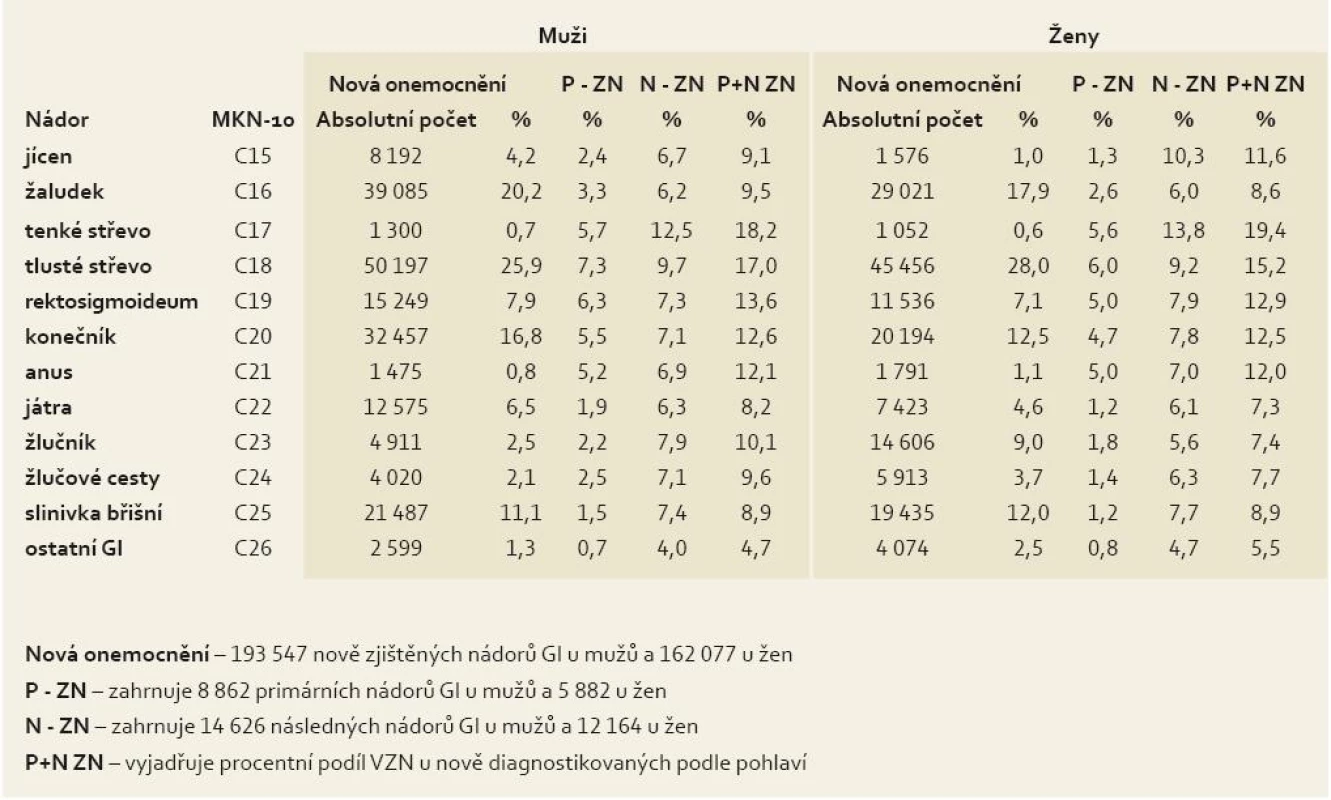
V časovém vývoji se počet primárních nádorů GIT zvyšoval do roku 1997 a pak klesal, počet následných nádorů GIT trvale rostl (graf 2). Procentní zastoupení primárních i následných ZN GIT bylo u mužů vyšší ve věku 50–69 let oproti ženám, u žen naopak ve věku do 49 let a nad 80 let ve srovnání s muži (graf 3).
Graf 2. Vývoj počtu vícečetných nádorů gastrointestinálního traktu 1976–2005. Hlášené nádory za rok 1976 od května. Graph 2. Development of the number of multiple gastrointestinal cancers 1976–2005. Registered cancers in 1976 since May. 
Graf 3. Věkové zastoupení primárních nádorů gastrointestinálního traktu. Graph 3. Age representation of primary gastrointestinal cancers. 
Ze 14 744 nemocných s primárními nádory GIT se nejvíc vyskytlo v kraji Moravskoslezském 13,7 %, Jihomoravském 10,8 % a v Praze 10,6 %. Z 26 790 nemocných s následnými nádory GIT bylo nejvíc v kraji Moravskoslezském 13,5 %, Jihomoravském 11,4 %, v Praze 11,3 % a Středočeském 8,4 % (mapa 1).
Obr.1. Zastoupení nemocných s primárními a následnými nádory GIT v krajích ČR 1976–2005. Fig. 1. Representation of patients with primary and subsequent GI cancers in individual regions of the Czech Republic 1976–2005. 
Průměrná doba mezi primárními karcinomy GIT a následnými novotvary s dg. C00-D48 byla 6,1 roku s rozmezím od 5 let u nádorů tenkého střeva po 6,6 roku u nádorů žlučových cest. Poměr mezi počty synchronních a metachronních novotvarů po primárních nádorech GIT byl u mužů 1 : 3,6 jako méně příznivý ve srovnání s 1 : 5 u žen a byl s výjimkou nádorů tenkého střeva u všech diagnóz GIT nižší u mužů než u žen (tab. 4). Po prvním nádoru GIT se během prvního roku synchronně vyskytlo 5 101 (31,2 %) novotvarů, v dalších 1–29 letech v pětiletých intervalech 6 451 (39,4 %) – 2 590 (15,8 %) – 1 286 (7,9 %) – 625 (3,8 %) – 259 (1,6 %) a 50 (0,3 %) metachronních novotvarů (graf 4).
Tab. 4. Průměrný interval a poměr následných novotvarů u nemocných s 14 744 primárními nádory Gi. Tab. 4. Average interval and proportion of subsequent neoplasms in patients with 14,744 primary GI cancers. 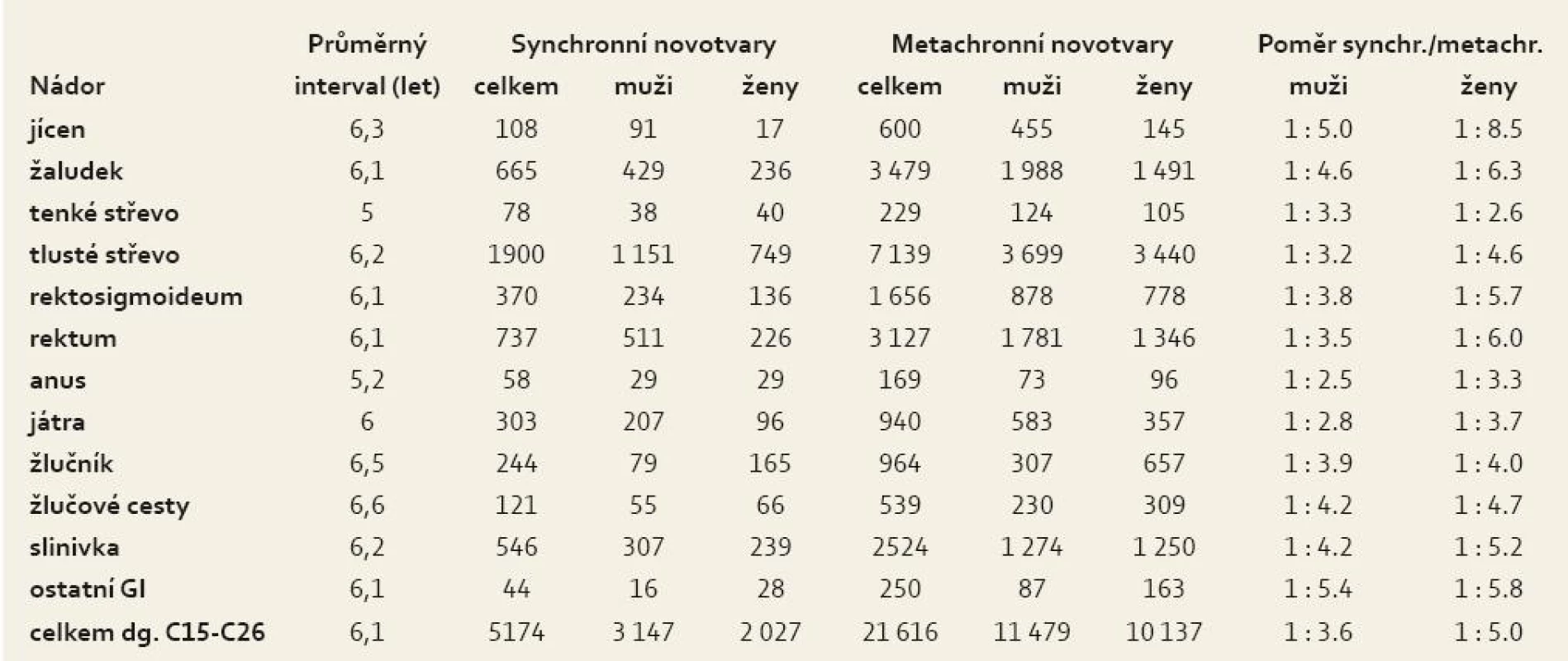
Graf 4. Výskyt 16 362 následných novotvarů (dg. C00-d48) u 14 744 pacientů s primárními nádory GI (dg. C15-C26). Graph 4. Occurrence of 16,362 subsequent neoplasms (ICD-10: C00-D48) in 14,744 patients with primary GI cancers (ICD-10: C15-C26). 
Mezi synchronními diagnózami převažovaly u mužů jiné nádory GIT 43,6 %, vylučovacích cest 13,7 %, pohlavních orgánů 11,8 % a dýchacích cest 10,8 %, u žen jiné nádory GIT 44,2 %, rodidel 13,8 %, vylučovacích cest 9,8 % a prsů 8,1 %.
U nemocných s nádory GIT jako druhou a další diagnózou se vyskytlo 31 519 předchozích novotvarů s dg. C00-D48, z toho 17 592 (55,8 %) u mužů a 13 927 (44,2 %) u žen. Druhé diagnóze nádoru GIT předcházelo 23 462 (74,4 %) novotvarů, třetí diagnóze 5 142 (16,3 %), čtvrté diagnóze 1 431 (4,5 %), páté a další diagnóze 1 484 (4,7 %) novotvarů. Nejčastěji předcházely nádorům GIT u mužů karcinomy kůže 38,1 %, jiné nádory GIT 20,3 %, pohlavních orgánů 9,7 %, vylučovacích 9,4 % a dýchacích cest 8,2 % (graf 5), u žen karcinomy kůže 31,9 %, rodidel 18,5 %, jiné nádory GIT 15,7 % a prsů 15,4 % (graf 6).
Graf 5. Zastoupení 17 592 novotvarů předcházejících u mužů následným nádorům GIT. Graph 5. Representation of 17,592 neoplasms preceding subsequent GI cancers in men. 
Graf 6. Zastoupení 13 927 novotvarů předcházejících u žen následným nádorům GIT. Graph 6. Representation of 13,927 neoplasms preceding subsequent GI cancers in women. 
Podle údajů registru zemřelo k 17. 10. 2007 z 8 862 mužů s primárními nádory GIT 6 930 (78,2 %) a přežívalo 1 932 (21,8 %) nemocných, z 5 882 žen zemřelo 4 503 (76,6 %) a přežívalo 1 379 (23,4 %) pacientek. Ze 14 626 mužů s následnými karcinomy GIT zemřelo 12 675 (86,7 %) a přežívalo 1 951 (13,3 %) nemocných, z 12 164 žen zemřelo 10 423 (85,7 %) a přežívalo 1 741 (14,3 %) pacientek.
Diskuze
Výskyt následných duplicit a multiplicit v dalších orgánech s odlišnou histologickou povahou představuje vážnější komplikaci léčby primárního novotvaru než jeho metastatický rozsev. Svým biologickým chováním a agresivitou podstatně zasahuje u léčeného do nastaveného diagnostického a terapeutického schématu a zkracuje délku přežití. Ve spektru ostatních nádorových diagnóz zaujímají VZN GIT zvláštní postavení. Uvedli jsme již [14], že v porovnání s ostatními nádory byly karcinomy GIT zastoupením 11,8 % primárních a 16,2 % následných nádorů z 290 312 analyzovaných multiplicit druhými nejpočetnějšími po nádorech kůže (42,8 % a 42,5 %), následovány nádory prsu (8,4 % a 5,7 %), rodidel (7 % a 4,1 %), vylučovacích (6,8 % a 6,5 %) a dýchacích cest (4,8 % a 7,8 %), pohlaví mužů (4,2 % a 4,2 %).
Jestliže zpracovatele statistických dat může omezovat problém malých čísel, platí to také při posuzování vícečetných nádorů GIT. Jejich oddělené diagnózy jsme zachovali vzhledem k předpokládané komparaci s počty VZN v jiných zemích. Abychom předešli nepřesné interpretaci, dodrželi jsme podle referencí terminologii pro karcinomy s dg. C15-C26 a novotvary s dg. C00-D48 v komentáři jejich primárních (prvních) a následných (dalších) onemocnění. Je nutné připomenout, že evidence novotvarů in situ s dg. D00-D09 byla zahájena rokem 1979 a novotvarů nejisté povahy s dg. D37-D48 rokem 1987. Rozložení následných novotvarů podle intervalu bylo silně zešikmené. K výpočtu průměrné doby jsme místo krajních hodnot použili střed intervalu. Jeho mírně vyšší hodnoty jsou orientační a budou upřesněny exponenciálním modelem pro jednotlivé diagnózy s testem dobré shody a odhadem jeho charakteristik. Stanovení variability doby mezi onemocněními a příslušného intervalu spolehlivosti pro průměr by tak ukázalo míru asymetrie.
Standardy dispenzární péče by měly zabránit, aby část nemocných podstupovala nadměrný počet nákladných vyšetření, stejně jako jiná část má dispenzární dohled minimální nebo žádný.
Jeho individuální algoritmus by měl respektovat klinické stadium a prognostické ukazatele primárního karcinomu včetně dědičné predispozice. Pokud při dispenzarizaci chybí obligatorní vyšetření parenchymových orgánů, scintigrafie skeletu a další laboratorní diagnostika také u nemocných s dalšími nádory (prsů, rodidel aj.), nelze očekávat zpomalení nepříznivého trendu incidence včetně zastoupení vícečetných novotvarů jako limitující příčiny ekonomické udržitelnosti systému zdravotní péče v onkologii. I když se politické představy o dosažení ekonomické stability zdravotnictví liší, panuje relativní shoda na nutnosti široké a účinné primární a sekundární prevence, která i přes dílčí snahy nenašla v gastroonkologii zatím dostatečné uplatnění. Zahraniční zkušenosti varují před růstem výdajů ve zdravotnictví, jejichž vynakládanému objemu v USA neodpovídá očekávané zlepšení zdraví a včasná léčba nádorů, diabetu a dalších civilizačních nemocí [15]. Charakteristice karcinomů, následujících po jednotlivých diagnózách GIT, bude věnováno další sdělení [16] a po metodickém upřesnění kartografické vizualizace [17] také jejich geografické rozložení [18].
Příčiny VZN u jednotlivých lokalizací GIT jsou posuzovány v kontextu poznatků o etiologii primárních onemocnění. U ZN jícnu se uvádí kouření, alkohol, špatné sociální poměry a nízká spotřeba ovoce a zeleniny jako příčina u 98 % SCE [19], navíc obezita a refluxní nemoc u 80 % ACE [20] a tylosa jako raritní autozomální dominantní syndrom u SCE [21]. K rizikovým faktorům ZN žaludku, podobajícím se ZN jícnu, se připojuje vliv Helicobacter pylori, přesolených, uzených a špatně zmrazených potravin na vznik metaplazií častěji kardie žaludku než nekardiálního ACE [20]. Nedoceněnou z hlediska VZN je genetická predispozice spojená s familiární adenomatózní polypózou (FAP), nepolypózním tumorem tlustého střeva (HNPCC), mutací genu CDH1 [22] a polymorfismem cytokinů [23]. I když etiologie ZN tenkého střeva je méně známá, zahrnuje vliv coeliakie a Crohnovy nemoci [24–25], obezity [26], alkoholu a kouření [27], asociaci s FAP, HNPCC a Peutz-Jeghersovým syndromem [25]. Vzhledem k dvacetinásobnému kolísání incidence a mortality ZN tlustého střeva ve světových přehledech je sledován jejich nárůst u populace migrující do oblastí s vysokým výskytem ostatních nádorů, rizikovou životosprávou a stravováním [28]. Kromě obezity se uvažuje vliv velké spotřeby červeného masa, nízké spotřeby zeleniny a ovoce, nepřímý vztah u příjmu hrubé vlákniny ve stravě, od mládí vysoká spotřeba alkoholu, cigaret a deplece kyseliny listové a stopových prvků [29–31]. Riziko zvyšuje ulcerózní kolitis [32] a Crohnova nemoc [33]. Asi 10–20 % ZN tlustého střeva je spojeno s výskytem u příbuzných prvního stupně [34] a část má asociaci s FAP, HNPCC [35], přičemž oba syndromy vykazují časný výskyt vícečetných ZN kolorekta, kte-ré zahrnují jen 3 % z této skupiny malignit [36]. Některé studie uvádí dominantní riziko alkoholu a kouření pro ZN rekta [31,37]. Kauzálním faktorem u ZN análního kanálu je papilomavirus typ HPV 16 a 18 jako příčina většiny ZN anogenitálního traktu [38] a oslabení buněčné imunity po infekci HIV [39] nebo po transplantační imunosupresi [40]. Zvýšené riziko ZN jater se uvádí po hepatitidě B, alkoholizmu, cirhóze, účinku plísňového aflatoxinu B, metabolických chorobách (tyrosinémie, hemochromatózy) [41] a steatohepatitidy po obezitě a diabetu [42]. U ZN žlučníku a žlučových cest převažuje nejasný vliv cholesterolových kamenů [43] a ulcerózní kolitis [44] s chronickými záněty, obezita, fyzická nečinnost [45] a FAP s predispozicí ZN Vaterské papily [46].
Výskyt následných novotvarů u onkologicky léčených není stejný u všech diagnóz. Existují specifické vzorce pro jejich jednotlivé lokalizace a vztahy. Jejich analýza může významně podpořit prevenci, dlouhodobější dispenzarizaci a včasné zjištění následných novotvarů. Sledování předchozích rizik a přínosu léčby ve výzkumných a experimentálních projektech může shromáždit údaje o následných efektech léčebných schémat pro aktualizaci chemopreventivní strategie a screening nejzávažnějších nádorových lokalizací včetně podpory klinického rozhodování v úsilí o delší přežívání léčených bez výskytu následných novotvarů [47].
Závěr
Během 29 let bylo téměř každé páté evidované onkologické onemocnění v ČR spojeno s výskytem jiného novotvaru zejména s kožními multiplicitami [48]. Z 355 624 nových karcinomů GIT bylo s následnými novotvary spojeno 41 534 (11,7 %) vícečetných nádorů GIT. Jestliže za všechny nádory každých osm minut přibýval další onkologicky nemocný a 80 z přežívajících denně umíralo [49], pak podle počtu hlášených [50] byl nový nádor GIT diagnostikován každých 40 min a umíralo na něj denně 27 nemocných. Při tomto trendu se evidovaný počet 49 766 žijících s nádory GIT v roce 2005 zvýší na konci roku 2009 o dalších 9 900 pacientů na téměř 60 tisíc. Při zvýšení prevalence nádorů GIT na 78 tisíc v roce 2015 [2] je vývoj multiplicit obtížně předvídatelný a bude spojen s požadavky na odpovídající personální zajištění oboru gastroonkologie. Perspektivou zdravotní péče a nemocných je komplexní diagnostika a terapie, doplněná účinnou prevencí ve smyslu úvodního stanoviska čtyř renomovaných autorů Atlasu nádorů [1].
Seznam zkratek
- C15 jícen
- C16 žaludek
- C17 tenké střevo
- C18 tlusté střevo
- C19 rektosigmoideum
- C20 konečník
- C21 anus
- C22 játra
- C23 žlučník
- C24 žlučové cesty
- C25 slinivka břišní
- C26 ostatní GI
- SCE spinocelulární karcinom
- ACE adenokarcinom
Zpracování přehledu bylo podpořeno grantem GA ČR 205/07/1278.
Za přípravu podkladů a metodické připomínky děkujeme paní Elišce Vankové z ÚZIS ČR.
MUDr. Edvard Geryk
FN Brno
Jihlavská 20, 625 00
e-mail: egeryk@fnbrno.cz
Zdroje
1. Mackay J, Jemal A, Lee NC et al. The Cancer Atlas. Amer Cancer Society; 2006 : 82, ISBN: 0-944235-62-X.
2. Konečný K, Geryk E, Kubíček P et al. Prevalence nádorů v ČR 1989-2005-2015. PřF
MU Brno 2008; 69.
3. Geryk E, Bendová M, Kubíček P et al. Vícečetné zhoubné novotvary – ukazatel zdraví a nákladů péče v onkologii. Zdravotnictví v ČR 2008; 2(11):50–55.
4. Mysliwiec PA, Cronin KA, Schatzkin A. New malignancies following cancer of the colon, rectum and anus. In: Curtis, R.E. et al. New malignancies among cancer survivors: SEER cancer registries, 1973-2000. NCI, NIH Publ. No.05-5302, Bethesda 2006 : 3.
5. Stolzenberg-Solomon RZ, Fraumeni JF jr., Wideroff L et al. New malignancies following cancer of the digestive tract, excluding colorectal cancer. In: Curtis, R.E. et al.: New malignancies among cancer survivors: SEER cancer registries 1973-2000. NCI, NIH Publ. No.05-5302, Bethesda, 2006; p. 59.
6. Hoar SK, Wilson J, Blot WJ et al. Second cancer following cancer of the digestive system in Connecticut, 1935-82. Natl Cancer Inst Monogr 1985; 68 : 49–82.
7. Lynge E, Jensen OM, Carstensen B. Second cancer following cancer of the digestive system in Denmark 1943-80. Natl Cancer Inst Monogr 1985; 68 : 277–308.
8. Teppo L, Pukkala E, Saxen E. Multiple cancer – an epidemiologic exercise in Finland. J Natl Canc Inst 1985; 75(2): 207–217.
9. Levi F, Randimbison L, Te VC et al. Multiple primary cancers in the Vaud Cancer Registry, Switzerland 1974-89. Br J Cancer 1993; 67(2): 391–395.
10. McCredie M, Macfarlane GJ, Bell J et al. Second primary cancers after cancers of the colon and rectum in New South Wales, Australia 1972-91. Canc Epidemiol Biomarkers Prev 1997; 6(3): 155–160.
11. Evans HS, Moller H, Robinson D et al. The risk of subsequent primary cancers after colorectal cancer in southeast England. Gut 2002; 50(5): 647–652.
12. Vítová V, Pecen L. Kolorektální karcinomu jako nádorová duplicita. In: Vyzula R et al. Rakovina tlustého střeva a konečníku-vybrané kapitoly. 2008 : 55–61. ISBN 978-86-7345-140-0.
13. ÚZIS: Národní onkologický registr – pokyny k obsahu datové struktury. Závazné pokyny NZIS, verze 051-20060101/2, ÚZIS ČR, 2005 : 46.
14. Geryk E, Dítě P, Pešek M et al. Následné primární novotvary u 125 262 onkologicky nemocných v ČR 1976-2005. Onkologie 2009; 3(3): 181–189.
15. Barták M, Horáková P. K současným reformám zdravotnictví v USA. Zdravotnictví v České Republice 2009; 2(12): 60–62.
16. Geryk E, Dítě P, Kozel J et al. Vícečetné novotvary u nemocných s karcinomy žaludku v ČR 1976–2005. Gastroenterologie 2010, v tisku.
17. Stampach R, Konecny M, Kubicek P et al. Dynamic cartographic methods for visualisation of health statistics. Proceedings ICA Symposium on Cartography for Central and Eastern Europe,Vinna, Vienna Univ of Technology 2009; 867–878.
18. Kubíček P, Geryk E, Štampach R et al. Geografické rozložení vícečetných novotvarů v České republice 1976-2005. 2010, ISBN 978-80-903255-3-1, v tisku.
19. Brown LM, Devesa SS. Epidemiologic trends in esophageal and gastric cancer in the United States. Surg Oncol Clin N Am 2002;11(2): 235–256.
20. Engel LS, Chow WH, Vaughan TL et al. Population attributable risks of esophageal and gastric cancers. J Natl Cancer Inst 2003; 95(18): 1404–1413.
21. Enzinger PC, Mayer RJ. Esophageal cancer. N Engl J Med 2003;349(23): 2241–2252.
22. Graziano F, Humar B, Guilford P. The role of the E-cadherin gene (CDH1) in diffuse gastric cancer susceptibility: from the laboratory to clinical practice. Ann Oncol 2003; 14(12): 1705–1713.
23. El-Omar EM, Rabkin CS, Gammond MD et al. Increased risk of noncardia gastric cancer associated with proinflamatory cytokine gene polymorphisms. Gastroenterology 2003; 124(5): 1193–1201.
24. Neugut AI, Jacobson JS, Suh S et al. The epidemiology of cancer of the small bowel. Canc Epidem Biomarkers Prev 1998; 7(3): 243–251.
25. Delaunoit T, Neczyporenko F, Limburg PJ et al. Pathogenesis and risk factors of small bowel adenocarcinoma: a colorectal cancer sibling? Am J Gastroenterol 2005; 100(3): 703–710.
26. Samanic C, Gridley G, Chow WH et al. Obesity and cancer risk among white and black United States veterans. Canc Causes Control 2004; 15(1): 35–43.
27. Kaerlev L, Teglbjaerg PS, Sabroe S et al. Is there an association between alcohol intake or smoking and small bowel adenocarcinoma? Results from European multi-center case-control study. Canc Causes Control 2000; 11(9): 791–797.
28. Martinez ME. Primary prevention of colorectal cancer: lifestyle, nutrition, exercise. Recent Results Canc Res 2005; 166 : 177–211.
29. Cho E, Smith-Warner SA, Ritz J et al. Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studies. Ann Intern Med 2004; 140(8): 603–613.
30. Corrao G, Bagnardi V, Zambon A et al. A meta-analysis of alcohol consumption and the risk of 15 diseases. Prev Med 2004; 38(5): 613–619.
31. Giovannucci E. An updated review of the epidemiological evidence that cigarette smoking increases risk of colorectal cancer. Canc Epidem Biomarkers Prev 2001; 10(7): 725-731.
32. Ekbom A, Helmick C, Zack M et al. Ulcerative colitis and colorectal cancer. A population-based study. N Engl J Med 1990; 323(18): 1228–1233.
33. Ekbom A, Helmick C, Zack M et al. Increased risk of large-bowel cancer in Crohn´s disease with colonic involvement. Lancet 1990; 336(8711): 357–359.
34. Burt RW, DiSario JA, Cannon-Albright L. Genetics of colon cancer: impact of inheritance on colon cancer risk. Ann Rev Med 1995; 46 : 371–379.
35. Lynch HT, de la Chapelle A. Genetic susceptibility to non-polyposis colorectal cancer. J Med Genet 1999; 36(11): 801–818.
36. Burt RW. Colon cancer screening. Gastroenterology 2000; 119(3): 837–853.
37. Potter JD. Colorectal cancer: molecules and populations. J Natl Canc Inst 1999; 91(11): 916–932.
38. Schiffman M, Kjaer SK. Natural history of anogenital human papillomavirus infection and neoplasia. J Natl Canc Inst Monogr 2003; 31 : 14–19.
39. Palefsky JM, Holly EA. Immunosuppression and co-infection with HIV. J Natl Canc Inst Monogr 2003; 31 : 41–46.
40. Birkeland SA, Storm HH, Lamm LU et al. Cancer risk after renal transplantation in the Nordic countries, 1964-1986. Int J Canc 1995; 60(2): 183–189.
41. Valea FA. Liver and hepatic duct cancer. Clin Obstet Gynecol 2002; 45(3): 939-951.
42. El-Serag HB. Hepatocelular carcinoma: recent trends in the United States. Gastroenterology 2004; 127(5 Suppl 1): S27–S34.
43. Misra S, Chaturvedi A, Misra NC et al. Carcinoma of the gallbladder. Lancet Oncol 2003; 4(3): 167–176.
44. Cullen S, Chapman R. Primary sclerosing cholangitis. Autoimun Rev 2003; 2(6): 305–312.
45. Lazcano-Ponce EC, Miquel JF, Munoz N et al. Epidemiology and molecular pathology of gallbladder cancer. CA Cancer J Clin 2001; 51(6): 349–364.
46. Lillemoe KD. Tumors of the gallbladder, bile ducts and ampulla. Semin Gastrointest Dis 2003; 14(4): 208–221.
47. van Leeuwen FE, Travis LB. Second cancers. In: DeVita, V.T. jr. et al. Cancer: Principles and practice of oncology. 7th ed. Philadelphia, Lippincott Williams-Wilkins, 2005 : 2575–2602.
48. Geryk E, Dítě P, Sedláková L et al. Trend vícečetných nemelanomových nádorů kůž z pohledu jejich epidemiologie. Dermatologie pro praxi, 2010; 1(4), v tisku.
49. Petruželka L. Od onkologického nihilismu k aktivní léčbě pokročilých nádorových onemocnění. Sborník XIII. dny prof. V.Staška, Praha 2009;4–5, ISBN 978-80-254-1284-8.
50. ÚZIS: Novotvary ČR 2005. ÚZIS ČR, 2008 : 254, ISBN 978-80-7280-723-9.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Proč sekce IBD
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2010 Číslo 1- S doc. Janou Hirmerovou o tromboprofylaxi v břišní či onkologické chirurgii a jak k ní správně přistupovat
- INTERAKTIVNÍ KAZUISTIKA: Žilní trombóza v graviditě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Open abdomen
-
Všechny články tohoto čísla
- Vícečetné nádory gastrointestinálního traktu v České republice v letech 1976–2005
- Neuroendokrinní nádory tlustého střeva
- Diagnostika a léčba globus faryngeus
- Komentáře k některým abstraktům posterů prezentovaných na UEGW 2009 v Londýně na téma Idiopatické střevní záněty
- Výroční zpráva vedoucího redaktora časopisu Česká a slovenská gastroenterologie a hepatologie za rok 2009
- Doporučení pro vakcinaci nemocných s Crohnovou chorobou a ulcerózní kolitidou na imunosupresivní a biologické léčbě
- Čestný doktorát Karlovy Univerzity profesoru Meinhardovi Classenovi
-
Zdeněk Mařatka. Zamyšlení nad medicínou, životem a světem.
Praha: Galén 2009. 396 stran. -
Jiří Černoch. Transkutánní cholangioskopie. Od perkutánní transhepatální cholangiografie a perkutánní transhepatální drenáže k transkutánní cholangioskopii.
Praha: Nakladatelství Karolinum 2008. Univerzita Karlova v Praze. 291 stran. - Nevyšetřená dyspepsie – nový pojem, užitečný termín?
- Proč sekce IBD
- Non-Hodgkinov T-lymfóm asociovaný s enteropatiou ako komplikácia neskoro diagnostikovanej celiakie u geriatrickej pacientky
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika a léčba globus faryngeus
- Doporučení pro vakcinaci nemocných s Crohnovou chorobou a ulcerózní kolitidou na imunosupresivní a biologické léčbě
- Neuroendokrinní nádory tlustého střeva
- Non-Hodgkinov T-lymfóm asociovaný s enteropatiou ako komplikácia neskoro diagnostikovanej celiakie u geriatrickej pacientky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání


